ELAVL1在肝癌预后预测模型及抗肿瘤转移中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及ELAVL1在肝癌预后预测模型及抗肿瘤转移中的应用,属于生物医药技术领域。
背景技术
最新研究报道,肝细胞癌(肝癌)的发病率位居全球恶性肿瘤中的第六位,死亡率位居恶性肿瘤中的第三位。肝癌的发病率和死亡率之所以居高不下,这与其早期诊断困难、高转移率、高复发率高度有关。虽然近年来基础科研和临床技术不断进步,但目前尚无十分有效的指标和模型来协助早期诊断,或精确预测肝癌患者转移和预后情况。因此,目前亟需开发灵敏度和特异度高的诊断及预后指标和模型,这将对攻克肝癌难题具有重要意义。
随着科学技术和临床技术的不断发展,肝癌的治疗手段越来越多样化。手术治疗主要用于早期肝癌患者,但大部分肝癌患者确诊时已处于中晚期,丧失了手术机会。肝癌高度异质性,对放射治疗和化学治疗并不敏感,对介入治疗的反应也不理想。近年来,新兴的治疗手段包括以索拉菲尼/仑伐替尼为代表的靶向治疗和以PD-1/PD-L1免疫抑制剂为代表的免疫治疗陆续用于中晚期患者。靶向治疗和免疫治疗,虽然有一定的抗肿瘤作用,但其耐药率居高不下,而且所带来的毒副作用也影响着患者的预后和生活质量。所以,目前肝癌的治疗手段亟需得到改善。
ELAVL1是胚胎致死性异常视力(embryonic lethal abnormal vision,ELAV)家族的成员,是一种RNA结合蛋白。ELAVL1在多种恶性肿瘤中表达升高,如肝癌、胰腺癌、乳腺癌、周围神经鞘瘤等,参与了这些肿瘤的发生发展。在正常细胞中,ELAVL1主要位于细胞核,而在肿瘤细胞中,其在细胞浆中的表达水平上升。异常增高的ELAVL1可以促进许多炎症基因和癌基因的表达,而且与许多恶性肿瘤的病理分型和患者预后相关。侵袭转移是肿瘤的重要特征之一,而上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤发生侵袭转移的重要机制,已有研究报道ELAVL1参与了EMT。ELAVL1作为一个重要的癌基因,目前尚无研究报道基于ELAVL1构建的肝癌预后模型,亦无研究发现ELAVL1在抗肝癌侵袭转移中的作用。
发明内容
本发明的目的是:针对现有技术的不足,本发明提供了ELAVL1在肝癌预后预测模型和抗肝癌转移中的应用,并提供了基于ELAVL1表达水平的预测模型,为一种能够定量精准预测肝癌患者术后总生存率和无病生存率的可视化Nomogram模型,可用于预测高危患者,对其进行重点随访和及时干预治疗,从而改善患者预后。
为了实现上述目的,本发明提供了用于检测ELAVL1基因或蛋白表达水平的试剂在制备肝癌预后预测的试剂或试剂盒中的应用。
本发明还提供了用于检测ELAVL1基因或蛋白表达水平的试剂在肝癌预后预测模型中的应用,所述预后预测模型为基于多因素COX比例风险模型绘制的可视化Nomogram模型,包括OS(总生存期)Nomogram模型和DFS(无病生存期)nomogram模型,所述OS Nomogram模型的特征变量包括ELAVL1的表达水平、TNM分期、肿瘤分化和肿瘤大小;所述DFSnomogram模型的特征变量包括TNM分期、ELAVL1的表达水平和脉管侵袭。
本发明还提供了一种用于肝癌预后预测的系统,所述系统包括:
数据收集模块:用于获取肝癌患者特征数据,所述特征数据为ELAVL1的表达水平、TNM分期、肿瘤分化和肿瘤大小的数据,或为TNM分期、ELAVL1的表达水平和脉管侵袭的数据;
预测模块:利用已经建立的肝癌预后预测模型,对所述特征数据的每一项进行赋分,计算总得分,根据所述总得分计算得到相应的预后生存率;所述预测模型为可视化Nomogram模型,包括OS(总生存期)Nomogram模型和DFS(无病生存期)nomogram模型;
其中,所述OS Nomogram模型中,ELAVL1高表达水平得分为100,低表达水平得分为0;TNM分期III-IV得分为92,I-II的得分为0;肿瘤分化(differentiation)III-IV得分为54,I-II的得分为0;肿瘤直径(tumor size)>5cm得分为47,肿瘤直径≤5cm得分为0;
所述DFS nomogram模型中,ELAVL1高表达水平得分为51.25,低表达水平得分为0;TNM分期III-IV得分为100,I-II的得分为0;有脉管侵袭(vessel invasion)得分为38,无脉管侵袭得分为0;
所述ELAVL1表达水平的划分标准为:以ELAVL1在癌组织中的IHC评分的中位数6为界,将患者癌组织ELAVL1蛋白IHC评分≥6分划分为ELAVL1高表达水平,将患者癌组织ELAVL1蛋白IHC评分<6分划分为ELAVL1低表达水平。
本发明还提供了一种肝癌预后预测的方法,所述方法基于上述系统,包括如下步骤:
步骤1:数据采集步骤
获取肝癌患者特征数据,所述特征数据为ELAVL1的表达水平、TNM分期、肿瘤分化和肿瘤大小的数据,或为TNM分期、ELAVL1的表达水平和脉管侵袭的数据;
步骤2:数据输入步骤
将步骤1采集的所述数据输入所述数据收集模块;
步骤3:预测步骤
利用已经建立的肝癌预后预测模型,对所述特征数据的每一项进行赋分,计算总得分,根据所述总得分计算得到相应的预后生存率;所述预测模型为可视化Nomogram模型,包括OS(总生存期)Nomogram模型和DFS(无病生存期)nomogram模型。
本发明还提供了抑制ELAVL1基因或蛋白的表达或活性的试剂在制备抗肝癌转移的药物中的应用。
优选地,所述试剂包括特异性抑制ELAVL1基因表达的siRNA,所述siRNA的序列如SEQ ID NO:1或SEQ ID NO:2所示。
与现有技术相比,本发明的有益效果在于:
(1)本发明通过检测肝细胞癌术后肿瘤组织中ELAVL1蛋白的表达水平,能够初步对患者的预后不良风险进行有效评估,从而在临床实践中能及时对术后的治疗策略提供有价值的参考;本发明所提供的基于ELAVL1蛋白的Nomogram预后预测模型能够综合利用各个独立预后因素的互补作用,定量准确地评估肝细胞癌患者术后无复发生存和总生存时间概率,其预测准确性明显优于已有的肿瘤分期系统,能够提高对患者术后生存情况的预测效果,对高风险患者及时给予额外的治疗干预和密切的监测,改善患者的不良预后,因此,其具有更好的预测效能和准确度,能够使肝癌患者获得更多的临床净收益。
(2)本发明通过构建ELAVL1上调剂和下调剂,采用功能学实验发现,ELAVL1能促进肿瘤细胞发生EMT,参与肝癌的侵袭转移;本发明的实验结果表明,ELAVL1基因或蛋白或它们的下调剂可用于制备抗肝癌转移的药物,以及研究肝癌发生发展机制的实验试剂。
附图说明
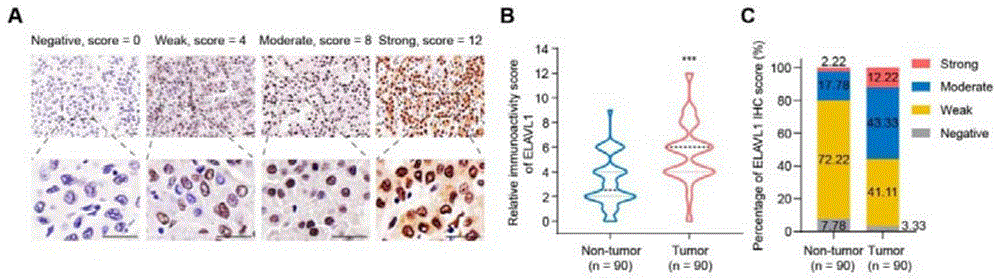
图1.ELAVL1在肝癌中高表达;A.ELAVL1在肝癌中的IHC结果(上图比例尺100μm,下图比例尺25μm);从左往右依次为阴性、弱阳性、阳性和强阳性;B.ELAVL1在HCC癌和癌旁组织中的IHC评分(n=90);C.ELAVL1在HCC癌和癌旁组织中的阴性、弱阳性、阳性和强阳性比例;***P<0.001;
图2.ELAVL1与肝癌患者的不良预后相关;A.ELAVL1对患者OS的影响;B.ELAVL1对患者DFS的影响;***P<0.001;
图3.基于ELAVL1蛋白Nomogram预后预测模型的构建和评价;A.患者OS多因素COX比例风险模型结果;B.患者DFS多因素COX比例风险模型结果;ELAVL1 OS(C,D)和DFS(E,F)nomogram模型和其校正曲线(3年和5年);ELAVL1 OS(G)和DFS(H)nomogram模型C-index比较;
图4.ELAVL1对肝癌细胞的迁移和侵袭能力的影响;A.细胞划痕实验探究ELAVL1对肝癌细胞迁移能力的影响,比例尺=200μm;B.transwell实验探究ELAVL1对肝癌细胞侵袭能力的影响,比例尺=100μm;**P<0.01.***P<0.001.
图5.ELAVL1对EMT相关指标表达水平的影响。
具体实施方式
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。
下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著的《分子克隆实验指南》(科学出版社,2002)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1
一、材料和方法
1.肝癌组织芯片和IHC实验
(1)收集确诊为肝癌患者的手术切除标本,采用多聚甲醛固定,并用石蜡包埋构建组织微阵列芯片。
(2)收集肝细胞癌患者的临床病理信息和术后随访数据
常规的临床病理信息包括年龄、性别、有无肝硬化,乙型肝炎病毒表面抗原(HBsAg)、甲胎蛋白(AFP)、肿瘤数量、大小、分级、脉管侵袭、淋巴结转移、TNM分期。随访第1年每3个月进行1次,随后第2年每3-6个月进行1次,然后每年1次。OS和DFS分别定义为从手术日期到死亡或复发日期(或最后一次随访)的时间间隔。
(3)肿瘤组织ELAVL1蛋白IHC(Immunohistochemistry,免疫组织化学)染色
将石蜡标本放入二甲苯中脱蜡,不同梯度的乙醇溶液中水化,然后使用Tris/EDTA抗原修复液(PH=9.0)抗原修复,3%的H
本发明根据如下标准对IHC结果进行评分,染色强度:无着色0分,浅黄色1分,棕黄色2分,棕褐色3分;染色面积:0%-25%1分,26%-50%2分,51%-75%3分,76%-100%4分。将染色强度得分与染色面积得分相乘即为最终得分。0分为阴性,1-4分为弱阳性,5-8分为阳性,9-12分为强阳性。最终得分 2.ELAVL1蛋白表达水平与临床病理参数的关系,以及基于ELAVL1蛋白Nomogram预后预测模型的构建和评价 (1)采用卡方检验,分析ELAVL1的表达水平与临床病理参数(年龄、性别、肝硬化、HBsAg、AFP、肿瘤数量、大小、分级、脉管侵袭、淋巴结转移、TNM分期)的关系; (2)采用Kaplan-Meier法、单因素和多因素COX回归分析探讨ELAVL1的表达水平在预测肝癌患者OS和DFS中的应用;通过多因素COX比例风险回归分析鉴定出肝细胞癌患者术后OS和DFS独立的预测因子,并纳入预测模型中进行COX回归以计算每个变量的偏回归系数,使用R语言软件中的rms包建立图形化的Nomogram。相应的生存概率=相应Nomogram模型中每个变量point值的总和在Total points轴中所在位置所对应的概率尺度轴数值。通过C指数、校准曲线分析对Nomogram模型的预测效能和准确性进行评价。 二、实验结果 1.ELAVL1在肝癌和癌旁组织中的表达情况 采用免疫组化的方法对90对肝癌和癌旁标本中的ELAVL1表达水平进行了检测,IHC评分结果表明ELAVL1在癌组织中的表达水平显著高于癌旁组织(P<0.001,图1A和1B)。在癌组织中,ELAVL1阴性率为3.33%,弱阳性率为44.44%,阳性率为43.33%,强阳性率为12.22%;而在癌旁组织中,ELAVL1阴性率为7.78%,弱阳性率为80.00%,阳性率为17.78%,强阳性率为2.22%(图1C)。结果表明,ELAVL1在肝癌组织中的表达明显增高。 2.ELAVL1的表达水平与肝癌患者临床参数之间的关系 通过以ELAVL1在癌组织中的IHC评分的中位数(6)为界,将患者分为ELAVL1高表达组(癌组织IHC评分≥6分)和ELAVL1低表达组(癌组织IHC评分<6分)。接着运用卡方检验的方法,研究ELAVL1患者临床参数之间的关系。研究结果显示,ELAVL1的表达水平与脉管侵袭有关(P=0.033),如表1所示: 表1 /> 表1中,上标a表示卡方检验,上标b表示连续校正。 3.基于ELAVL1蛋白Nomogram预后预测模型的构建和评价 采用Kaplan-Meier方法研究了ELAVL1的表达水平对患者OS(Overall survival,总生存期)和DFS(Disease-free survival,无病生存期)的影响。高表达组的5年OS为35.50%,而低表达组的5年OS为72.20%。高表达组病人的OS明显低于低表达组的OS(P<0.001,图2A)。高表达组的5年DFS为30.30%,而低表达组的5年DFS为55.40%。高表达组病人的DFS明显低于低表达组的DFS(P<0.001,图2B)。 单因素COX比例风险模型显示影响患者OS的预后因素有ELAVL1的表达水平、TNM分期、脉管侵袭、AFP、肿瘤大小、肿瘤分化、淋巴结转移。将这些因素纳入多因素COX比例风险模型,结果显示ELAVL1的表达水平(hazard ratio,4.525;95%CI 2.052-9.982;P<0.001)、TNM分期(hazard ratio,3.527;95%CI 1.449-8.588;P=0.005)、肿瘤分化(hazardratio,2.216;95%CI 1.063-4.621;P=0.034)、肿瘤大小(hazard ratio,2.138;95%CI1.028-4.449;P=0.042)是影响患者OS的独立危险因素(图3A)。单因素COX比例风险模型显示影响患者DFS的预后因素有ELAVL1的表达水平、TNM分期、脉管侵袭、肿瘤大小、肿瘤分化、淋巴结转移、性别。将这些因素纳入多因素COX比例风险模型,结果显示TNM分期(hazardratio,7.655;95%CI 2.814-20.825;P<0.001)、ELAVL1的表达水平(hazard ratio,2.959;95%CI 1.446-6.053;P=0.003)和脉管侵袭(hazard ratio,2.590;95%CI 1.244-5.392;P=0.011)是影响患者DFS的独立危险因素(图3B)。 基于OS多因素分析的结果,将ELAVL1的表达水平、TNM分期、肿瘤分化、肿瘤大小纳入OS nomogram模型(图3C)。如图所示,第一个横轴为单因素分数轴(0~100)。分数轴以下依次为各个单因素的赋分轴、总分数轴(0~300)、1年总生存率轴、3年总生存率轴和5年总生存率轴。其中ELAVL1高表达水平得分为100,低表达水平得分为0;TNM分期III-IV得分为92,I-II的得分为0;肿瘤分化(differentiation)III-IV得分为54,I-II的得分为0;肿瘤直径(tumor size)>5cm得分为47,肿瘤直径≤5cm得分为0。使用本发明构建的可视化Nomogram时,在赋分轴上找到每个因素相应的得分,然后将所有因素的得分相加,在总分数轴上找到相应的点,通过该点画一条垂直于总分数轴的直线并与下面的1年总生存率轴、3年总生存率轴和5年总生存率轴相交,该交点的数值即是1年总生存率、3年总生存率和5年总生存率。 然后使用内部验证方法,检验nomogram模型的准确性。基于nomogram模型校正曲线显示由nomogram计算的预测结果与实际情况吻合较好(图3D)。OS nomogram的C-index为0.802,高于ELAVL1+TNM(0.748)、TNM(0.646)、ELAVL1(0.640)(图3E)。这些结果表明,基于OS多因素分析结果构建的nomogram模型对HCC患者的OS预后预测有较高的准确性。 基于DFS多因素分析的结果,将TNM分期、ELAVL1的表达水平和脉管侵袭纳入DFSnomogram模型(图3F)。如图所示,第一个横轴为单因素分数轴(0~100)。分数轴以下依次为各个单因素的赋分轴、总分数轴(0~220)、1年无病生存率轴、3年无病生存率轴和5年无病生存率轴。其中ELAVL1高表达水平得分为51.25,低表达水平得分为0;TNM分期III-IV得分为100,I-II的得分为0;有脉管侵袭(vessel invasion)得分为38,无脉管侵袭得分为0。使用本发明构建的可视化Nomogram时,在赋分轴上找到每个因素相应的得分,然后将所有因素的得分相加,在总分数轴上找到相应的点,通过该点画一条垂直于总分数轴的直线并与下面的1年无病生存率轴、3年无病生存率轴和5年无病生存率轴相交,该交点的数值即是1年无病生存率、3年无病生存率和5年无病生存率。 然后使用内部验证方法,检验nomogram模型的准确性。基于nomogram模型校正曲线显示由nomogram计算的预测结果与实际情况吻合较好(图3G)。DFS nomogram的C-index为0.787,高于TNM+ELAVL1(0.769)、TNM(0.687)、ELAVL1(0.620)(图3H)。这些结果表明,基于DFS多因素分析结果构建的nomogram模型对HCC患者的DFS预后预测有较高的准确性。 实施例2 一、材料和方法 1.细胞划痕实验 将处理后的细胞接种细胞于6孔板中,待细胞融合率达90%左右,然后用200ul移液器枪头轻划细胞表面,形成十字架(以作标记),PBS冲洗数遍。换用无血清的培养基培养。于0-72h(间隔24h)拍照记录细胞划痕愈合情况。 2.transwell侵袭实验 预先将稀释好的Matrigel胶铺于transwell小室上层,待其干燥后,将处理后的细胞接种于上室。上室使用无血清培养基,下室使用含10% FBS的培养基。培养48h后,取下小室,固定染色,显微镜下观察上室下表面的细胞数。 3.western blotting实验 采用RIPA裂解液提取细胞中的蛋白,然后进行蛋白浓度测定。制备SDS-PAGE凝胶,将蛋白样品进行电泳分离,然后进行转膜,封闭,相应的一抗稀释液孵育4℃过夜。随后,室温下孵育二抗,最后用ECL化学发光法进行显色。本实验所用的抗体及稀释比例如下:ELAVL1(Abcam,1:1000),E-cad(CST,1:1000),N-cad(CST,1:1000),Vimentin(CST,1:1000),Snail(CST,1:1000),β-actin(CST,1:1000)。 4.小干扰RNA(small interfering RNA,siRNA)与过表达质粒的构建和合成 (1)siRNA 本实施例中使用siRNA对ELAVL1表达水平进行下调,所用序列如表2所示: 表2 ELAVL1 siRNA以及阴性对照序列 (2)过表达载体 将ELAVL1的编码序列(NM_001419.3)构建到pcDNA3.1(-)/myc-his中,作为过表达载体。ELAVL1的编码序列(5’-3’)如SEQ ID NO:4所示: ATGTCTA ATGGTTATGA AGACCACATG GCCGAAGACT GCAGGGGTGA CATCGGGAGAACGAATTTGA TCGTCAACTA CCTCCCTCAG AACATGACCC AGGATGAGTT ACGAAGCCTG TTCAGCAGCATTGGTGAAGT TGAATCTGCA AAACTTATTC GGGATAAAGT AGCAGGACAC AGCTTGGGCT ATGGCTTTGTGAACTACGTG ACCGCGAAGG ATGCAGAGAG AGCGATCAAC ACGCTGAACG GCTTGAGGCT CCAGTCAAAAACCATTAAGG TGTCGTATGC TCGCCCGAGC TCAGAGGTGA TCAAAGACGC CAACTTGTAC ATCAGCGGGCTCCCGCGGAC CATGACCCAG AAGGACGTAG AAGACATGTT CTCTCGGTTT GGGCGGATCA TCAACTCGCGGGTCCTCGTG GATCAGACTA CAGGTTTGTC CAGAGGGGTT GCGTTTATCC GGTTTGACAA ACGGTCGGAGGCAGAAGAGG CAATTACCAG TTTCAATGGT CATAAACCCC CAGGTTCCTC TGAGCCCATC ACAGTGAAGTTTGCAGCCAA CCCCAACCAG AACAAAAACG TGGCACTCCT CTCGCAGCTG TACCACTCGC CAGCGCGACGGTTCGGAGGC CCCGTTCACC ACCAGGCGCA GAGATTCAGG TTCTCCCCCA TGGGCGTCGA TCACATGAGCGGGCTCTCTG GCGTCAACGT GCCAGGAAAC GCCTCCTCCG GCTGGTGCAT TTTCATCTAC AACCTGGGGCAGGATGCCGA CGAGGGGATC CTCTGGCAGA TGTTTGGGCC GTTTGGTGCC GTCACCAATG TGAAAGTGATCCGCGACTTC AACACCAACA AGTGCAAAGG GTTTGGCTTT GTGACCATGA CAAACTATGA AGAAGCCGCGATGGCCATAG CCAGCCTGAA CGGCTACCGC CTGGGGGACA AAATCTTACA GGTTTCCTTC AAAACCAACAAGTCCCACAA ATAA。 二、实验结果 1.ELAVL1对肝癌细胞迁移侵袭能力的影响 采用细胞划痕实验来探究ELAVL1对肝癌细胞迁移能力的影响。划痕实验表明:在Huh7和Hep3B中,ELAVL1蛋白上调后,细胞迁移愈合能力较对照组明显增强,而在MHCC97-H和HCCLM3中,ELAVL1蛋白下调后,细胞迁移愈合能力较对照组明显下降(P<0.01,图4A)。 采用transwell实验来探究ELAVL1对肝癌细胞侵袭能力的影响。Transwell实验结果表明:在Huh7和Hep3B中,ELAVL1蛋白上调后,细胞侵袭能力显著高于对照组,而在MHCC97-H和HCCLM3中,ELAVL1蛋白下调后,细胞侵袭能力显著低于对照组(P<0.01,图4B)。以上实验结果表明,抑制ELAVL1的表达能够抑制肝癌细胞的迁移和侵袭能力。 2.ELAVL1对肝癌EMT的影响 在Huh7中,ELAVL1蛋白上调后,western blotting显示上皮细胞标志物E-cad表达下降,间充质细胞标志物N-cad、Vimentin、Snail表达上升;在HCCLM3中,ELAVL1蛋白下调后,western blotting显示上皮细胞标志物E-cad表达上升,间充质细胞标志物N-cad、Vimentin、Snail表达下降(图5)。以上结果说明,抑制ELAVL1的表达能够抑制肝癌EMT进程,从而能够抑制肝癌转移。 上述实施例仅为本发明的优选实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 半乳凝素-3在肝癌骨转移中诊断、治疗和预后的应用
- 半乳凝素-3在肝癌骨转移中诊断、治疗和预后的应用
