一种利用有机酸非皂化萃取分离镍钴离子的方法和用途
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于化工分离领域,具体涉及一种利用有机酸非皂化萃取分离镍钴离子的方法和用途。
背景技术
通常情况下,由于Ni、Co的化学性质相似,它们之间的分离系数很小,导致分离和提纯困难。目前工业上镍钴元素的分离工艺和方法较多。其中溶剂萃取法因其简单、快速、收率高,并在工业上广泛使用,有机磷酸包括P204,P507,Cyanex 272,在工业过程中通常被用作萃取剂。镍和钴分离的萃取机制可以用公式(1)表示,其中HA代表萃取剂C272。分布规律如公式(2)所示,其中D是分布比率,K是萃取常数。很明显,由于萃取过程会不断释放H
M
lgD=lgK+2lg[HA]-2lg[H
针对上述皂化污染问题,有必要寻找一种合适的非皂化分离镍钴的方法来取代现有的皂化体系。为了取代皂化体系,早期已经进行了大量的协同萃取工作。例如,专利CN1824814发明了一种采用酸性有机磷酸萃取剂的2-3种混合在一起形成萃取剂在硝酸稀土溶液中萃取分离稀土元素。利用该方法能够提升了镍钴的分离效果,整个过程无需对萃取剂进行皂化处理,因此萃取过程中不会产生废水。但是该方法仅仅是利用了萃取剂之间的一种协同作用来提升镍钴的萃取效率。并没有能够起到调节水相pH的作用,因此萃取剂在电离过程中酸度依旧变化,因此没有解决酸度对萃取的影响。专利CN104513906A也是采用协同萃取分离的方法来分离金属元素,主要是利用磷酸萃取剂(P204,P507)和碱性萃取剂(N1923,N179,N116)按比例混合后形成协同萃取剂,尽管能够实现非皂化萃取。但是萃取过程需要不断加入萃取剂,成本较高。专利CN101709392A发明了一种通过稀释水相的方法减低水溶液中氢离子浓度的方法,尽管可以降低生产成本,但是当加入大量水之后金属溶液的浓度也显著降低,使得萃取效率大大降低。因此寻求一种更为经济以及能够在现有萃取体系下进行改造的方法具有较好的前景。
发明内容
本发明第一方面提供一种利用有机酸非皂化萃取分离镍钴离子的方法,所述方法包括以下步骤:
步骤A、将含镍离子和钴离子的初始水溶液和有机酸混合,然后调节pH为1~5,得到待分离混合物;
步骤B、将含萃取剂的有机混合物与待分离混合物混合、振荡、静置分层,分离得到有机相和水相,其中所述有机相内含有钴离子,所述水相中含有镍离子,即将镍离子和钴离子分离。
优选地,步骤B中,所述含萃取剂的有机混合物为:有机磷酸萃取剂二(2,4,4-三甲基戊基)次膦酸(C272)和磺化煤油体积比为3:7的混合物。
优选地,步骤A中,所述含镍离子和钴离子的初始水溶液中,镍离子浓度为0~2mol/L,钴离子浓度为0~2mol/L。
具体的,例如镍离子浓度可选择为0.001、0.01、0.1、0.5、1、1.5或2mol/L,钴离子浓度可选择为0.001、0.01、0.1、0.5、1、1.5或2mol/L。
优选地,步骤A中,所述待分离混合物中,有机酸的浓度为0~1mol/L,具体可选择0.025、0.05、0.075、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9或1mol/L。
优选地,步骤B中,含萃取剂的有机混合物与待分离混合物的体积比为1:1~5:1。例如,含萃取剂的有机混合物与待分离混合物的体积比为1:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1或5:1。
优选地,所述有机酸选自:α-羟基羧酸,α-羟基丙酸,α-羟基-α-甲基丙酸,α-羟基α-甲基丁酸,α-羟基-α-甲基戊酸,α-羟基-α,γ-二甲基戊酸和α-羟基-α-已基丁酸中的一种或几种。
优选地,将步骤B得到的有机相加入硫酸,得到含钴离子的反萃液和油相,然后通过沉淀和煅烧处理反萃液,得到氧化钴。
沉淀处理:在反萃液中加入碱,例如NaOH。
优选地,所述水相中还含有有机酸;将步骤B得到的水相加入硫酸,调节pH小于1,然后再加入磷酸三丁酯(TBP)和煤油的混合物,得到含镍离子的萃余液和含有机酸的负载有机相,然后通过沉淀和煅烧处理萃余液,得到氧化镍。
沉淀处理:在反萃液中加入碱,例如NaOH。
优选地,将含有机酸的负载有机相加入水,反萃3~8次,得到有机酸回收利用。
本发明第二方面提供第一方面所述的方法用于增强镍离子和钴离子的萃取效率和增强镍离子和钴离子的分离系数的用途。
相对于现有技术,本发明具有以下有益效果:
1、本发明首次提供了一种利用有机酸非皂化萃取分离镍钴离子的方法,意外发现,在萃取体系中,加入有机酸可以增大钴和镍各自的萃取效率,且能明显增大了钴和镍的分离系数。本发明其原因是:1、有机酸和两种离子的络合作用使得两种金属离子的活性差异增大,增大分离系数。2、有机酸和有机磷酸萃取剂电离的氢离子结合,具有缓冲氢离子的作用,因此,有机酸离子可防止水溶液的酸度急剧增加,从而改善镍钴元素的提取性能。
2、本发明的有机酸可以通过反萃提取出,实现循环利用,使得生产成本降低。
3、皂化过程存在有环境污染以及成本高的问题,该过程不需要使用皂化剂,使得生产成本增加,省略了皂化处理过程,省去了皂化投资设备,减少了环境污染,有利于生产过程控制和管理。
附图说明
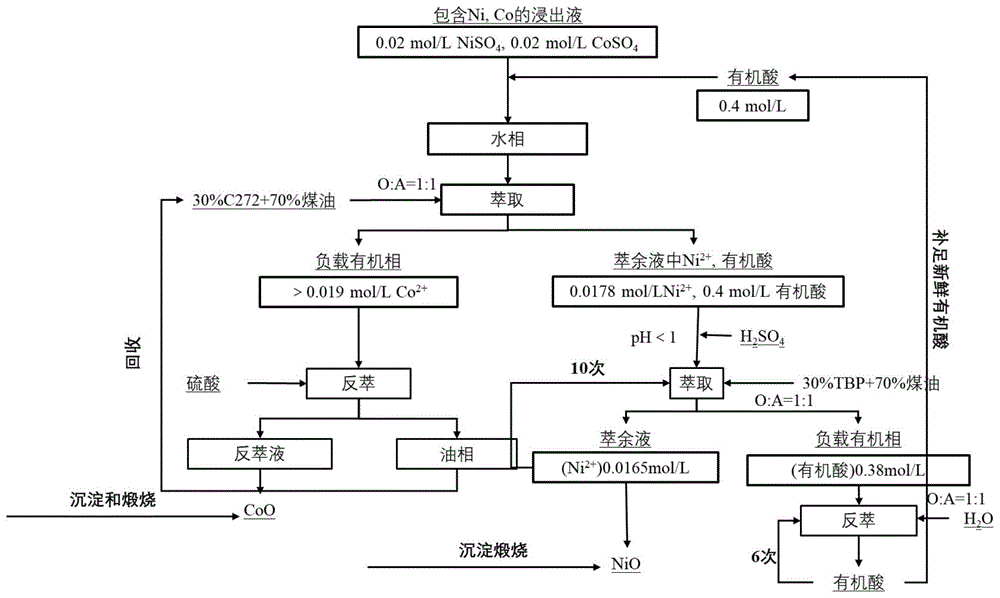
图1为实施例1的方法流程图。
具体实施方式
下面对本发明通过实施例作进一步说明,但不仅限于本实施例。实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件所用的通用设备、材料、试剂等,如无特殊说明,均可从商业途径得到。以下实施例和对比例中所需要的原料均为市售。
实施例1
一种利用有机酸非皂化萃取分离镍钴离子的方法,包括以下步骤:
1、含萃取剂的有机混合物的配制:将C272(市售)萃取剂用磺化煤油(市售)稀释为含有C272体积分数30%的有机相,该有机相与再与6mol/L硫酸1:1体积混合均匀,用去离子水多次洗涤至中性。
2、待分离混合物的配制:按照模拟料液配制得到硫酸镍钴溶液,即将硫酸镍和硫酸钴溶于水得到硫酸镍钴溶液。该溶液中含有镍钴元素的浓度为C
3、萃取操作:将步骤1配制好的含萃取剂的有机混合物与步骤2的待分离混合物按照体积比1:1(10mL:10mL)混合,然后投入到分液漏斗中进行离心振荡30min,静止分层10min,分离得到有机相和水相。
经测定,有机相中钴离子浓度为0.019mol/L,水相(萃余液)中含有浓度为0.019mol/L的镍离子和0.4mol/L的乳酸。
此步骤已经将镍离子和钴离子分离。钴的最大萃取效率为90%,镍的最大萃取效率为12%,分离系数为200。
钴的萃取效率计算公式为
钴的分配比计算公式为
钴和镍的分离系数为两者分配比之比,计算公式为
(以上各个计算公式中,C[Co]原料液-原始料液没有进行萃取前的钴的浓度、C[Co]萃余液-萃取之后钴的浓度、C[Ni]原料液-原始料液没有进行萃取前的镍的浓度、C[Ni]萃余液-萃取之后水溶液中镍的浓度、C[Co]负载-萃取之后有机相中钴元素的浓度、C[Ni]负载-萃取之后有机相中Ni元素的浓度;各个浓度单位均是mol/L)。
4、后处理操作:
4.1、对负载钴的有机相利用硫酸进行反萃,洗脱对应的钴:
将萃取操作得到的有机相加入10L浓度为6mol/L的硫酸,振荡,静置分离,得到含钴离子的反萃液和油相,然后在反萃液中加入6mol/LNaOH通过沉淀和煅烧处理反萃液,得到氧化钴。
4.2、对于含有机酸和镍的水相利用TBP进一步进行萃取,提取对应的有机酸:
将萃取操作得到的水相10mL(原pH为5),加入6mol/L的硫酸,将pH从5调节到0.6,然后再加入磷酸三丁酯(TBP)和煤油体积比为3:7的混合物10mL(TBP的体积分数为30%)再萃取,振荡,静置分离,得到含镍离子0.0165mol/L的萃余液10mL和含乳酸0.38mol/L的负载有机相10mL,然后通过沉淀和煅烧处理萃余液,得到氧化镍。将含乳酸的负载有机相加入同体积的30℃去离子水为反萃剂,反萃6次,得到乳酸回收利用,用于补充到步骤2中。本方法的流程图如图1所示。
实施例2~98和对比例1~9
萃取操作:通过改变实施例1中步骤2中,待分离混合物pH、待分离混合物中有机酸类型和有机酸浓度(浓度为0时作为对比例1-9),然后经过萃取操作,得到一系列含钴有机相和含镍、有机酸水相,测定此萃取步骤的钴的萃取效率、镍的萃取效率,钴和镍的分离系数,以及萃余液(萃取操作得到的水相)pH,见表1。
且,实施例2~8与实施例1的区别还在于:
实施例2~8中,硫酸镍钴溶液中镍离子浓度依次为0.001mol/L、0.01mol/L、0.1mol/L、0.5mol/L、1mol/L、1.5mol/L、2mol/L。钴离子浓度与镍离子浓度相等。萃取操作3中:将步骤1配制好的含萃取剂的有机混合物与步骤2的待分离混合物混合时的体积比依次为2:1(20mL:10mL)、2.5:1(25mL:10mL)、3:1(30mL:10mL)、3.8:1(38mL:10mL)、4:1(40mL:10mL)、4.5:1(45mL:10mL)5:1(50mL:10mL)。
且,实施例54~60与实施例1的区别还在于:
实施例54~60中,硫酸镍钴溶液中镍离子浓度依次为0.001mol/L、0.01mol/L、0.1mol/L、0.5mol/L、1mol/L、1.5mol/L、2mol/L。钴离子浓度与镍离子浓度相等。萃取操作3中:将步骤1配制好的含萃取剂的有机混合物与步骤2的待分离混合物混合时的体积比依次为2:1(20mL:10mL)、2.5:1(25mL:10mL)、3:1(30mL:10mL)、3.8:1(38mL:10mL)、4:1(40mL:10mL)、4.5:1(45mL:10mL)5:1(50mL:10mL)。
表1萃取操作变量和结果表
/>
/>
/>
/>
注:表中“-”为未测定结果。
从上表1可以得出以下结论:
1、相比不加入有机酸,在加入有机酸后能明显提高钴离子和镍离子的萃取效率和两者的分离系数,最高将钴的萃取效率提高到90%以上,镍的萃取效率提高到20%以上,最高能将两者分离系数提高到300以上。
2、对比不同pH下镍钴的萃取和分离效率,整体而言,在pH=5的初始条件下,镍钴的萃取效率更高,并且分离效率很高。
3、对于不同的有机酸,均能够显著提升钴的萃取效率,并且使得分离性能得到显著提升,并且随着有机酸体积的增加,镍钴反应性的差异减小,因此分离系数整体趋势是随着有机酸体积(浓度)的增加,分离系数先升高后基本持平或略微有波动。
实施例99-121和对比例10
按照实施例1的方式进行萃取操作,仅将之后的后处理操作进行改变。具体为:后处理操作中改变TBP浓度(即TBP的体积分数,以TBP和煤油混合物的总体积为基准)和萃余液pH(即用硫酸调节萃取操作得到的水相的pH),测定含镍水相和萃取有机相中乳酸的浓度,从而测定镍的萃取效率和乳酸的萃取效率。之后,改变实施例1中步骤4中反萃回收乳酸洗脱的次数,得到含乳酸的水相和含TBP的有机相,测定洗脱出来的水相中乳酸的浓度以计算乳酸回收率,见表2。
表2后处理操作变量和结果表
/>
注:表中“-”为未测定结果。
以实施例103为例,乳酸萃取效率计算方法为:
以实施例117为例,乳酸回收率计算方法为:
从上表2可以得出以下结论:
1、TBP浓度变化对于镍的萃取效率影响不显著,TBP几乎不会萃取镍,而只会萃取乳酸,并且随着TBP浓度的增加,其回收率也逐渐增大。
2、萃余液pH对于乳酸萃取效率的影响呈现先增大后减小的趋势,并且在pH=0.6的条件下达到最大值。
3、随着反萃回收乳酸洗脱的次数的增加,乳酸回收率逐渐增大,洗脱的次数为10时,乳酸回收率最大为85.15%。
本发明未详细阐述部分属于本领域技术人员的公知技术。以上所述的实施例仅是对本发明的优选实施方式进行描述,优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
