一种香豆素和半花菁偶联衍生物及其合成方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及过氧化氢与谷胱甘肽特异性荧光探针,具体属于一种香豆素和半花菁偶联衍生物DRSP-HYL及其合成方法和应用。
背景技术
适度的氧化还原应激通过信号传导对体内平衡产生积极影响,而当机体受到急性损伤或过度应激时会过表达活性氧(ROS)或活性硫(RSS)以缓解氧化还原失衡。铁死亡是一种过度的氧化还原的代谢过程,与肿瘤和缺血性损伤等疾病相关,其涉及复杂的信号级联和精确的分子介导机制,包含铁积累、脂质过氧化、氨基酸的代谢,与胱氨酸/谷氨酸逆向转运体、谷胱甘肽过氧化物酶4等密切相关,该调节机制依赖于ROS与RSS物种形成精密的调控网络。
目前临床上,已经有一些典型的铁死亡激动剂通过干预H
发明内容
本发明的目的是提供一种香豆素和半花菁偶联衍生物DRSP-HYL及其合成方法,以及DRSP-HYL可视化监测细胞铁死亡进程中氧化还原的应用。
本发明提供的一种香豆素和半花菁偶联衍生物DRSP-HYL,中文名称为1-(3-(4-((Z)-2-氰基-3-(7-(二乙基氨基)-2-氧代-2H-色烯-3-基)丙烯酰基)哌嗪-1-基)-3,3-二甲基-2-((E)-2-(6-((4-(4,4,5,5-四甲基-1,3,2-二氧杂硼-2-基)苄基)氧基)-2,3-二氢-1H-黄嘌呤-4-基)乙烯基)-3H-吲哚-1-鎓,英文名称为1-(3-(4-((Z)-2-cyano-3-(7-(diethylamino)-2-oxo-2H-chromen-3-yl)acryloyl)piperazin-1-yl)-3-oxopropyl)-3,3-dimethyl-2-((E)-2-(6-((4-(4,4,5,5-tetramet hyl-1,3,2-dioxaborolan-2-yl)benzyl)oxy)-2,3-dihydro-1H-xanthen-4-yl)vinyl)-3H-indol-1-ium。其结构式为:
DRSP-HYL的合成方法,步骤为:
(1)按摩尔比1:1.0~1.5向DMF中滴加三氯氧磷,并于室温搅拌20~50分钟;然后向反应体系中加入0.6~1.0当量环己酮于室温下继续搅拌1.5~4小时,用水淬灭反应,碳酸氢钠调节至中性;然后用乙酸乙酯萃取,收集并浓缩有机相,得黄色油状粗产物化合物1;
(2)按摩尔比1:0.7~0.9将化合物1和2-羟基-4-甲氧基苯甲醛合并溶于适量DMF中,然后添加2~3当量的碳酸铯,室温搅拌16~32小时;过滤并收集滤液,用乙酸乙酯和石油醚混合溶剂作为洗脱剂进行柱色谱纯化得黄色固体化合物2;
(3)将化合物2与三溴化硼按摩尔比1:5.0~10.0溶解于二氯甲烷溶液中,室温下搅拌6小时;用水淬灭,二氯甲烷萃取,收集并浓缩有机相。用二氯甲烷和甲醇混合溶剂作为洗脱剂进行柱色谱纯化得橙色固体化合物3;
(4)按摩尔比1:1.0~1.5将化合物3和1-(2-羧乙基)-2,3,3-三甲基吲哚-1-鎓溶于适量乙腈中,添加催化量的哌啶,加热回流12~20小时;减压蒸馏除去溶剂,用二氯甲烷和甲醇混合溶剂作为洗脱剂进行柱色谱纯化,得蓝紫色固体粉末化合物4;
(5)按摩尔比1:1~3:1~3将化合物4、EDCI和HOBT溶于二氯甲烷中,在0℃氮气环境下反应20~50分钟;然后加入1.0~2.0当量的1-叔丁氧羰基哌嗪,室温下继续反应20~30小时;减压蒸馏除去溶剂,用二氯甲烷和甲醇混合溶剂作为洗脱剂进行柱色谱分离纯化,得蓝绿色固体化合物5;
(6)按摩尔比1:1.2~1.5将化合物5和碳酸钾合并于乙腈中,45℃氮气环境中反应5~15分钟,然后加入1.2~1.5当量的碘化钾和1.5~2.5当量的4-溴甲基苯硼酸频哪醇酯于45℃继续反应3~5小时;减压蒸馏除去溶剂,二氯甲烷和甲醇混合溶剂作为洗脱剂进行柱色谱纯化分离得蓝色固体化合物6;
(7)按摩尔比1:50~80将化合物6和三氟乙酸溶于二氯甲烷中,室温下搅拌20~50分钟,减压浓缩得粗产物7直接用于下一步合成。接着,按摩尔比1:1.0~3.0:1.0~3.0将(Z)-2-氰基-3-(7-(二乙氨基)-2-氧代-2H-色烯-3-基)丙烯酸、EDCI和HOBT合并溶于二氯甲烷中,0℃氮气氛围下搅拌反应20~50分钟;然后向反应体系中加入1.0~2.0当量的化合物7和0.8~1.2当量的三乙胺,室温下继续反应20~30小时;减压浓缩,二氯甲烷和甲醇混合溶剂作为洗脱剂进行柱色谱纯化得紫黑色固体DRSO-HYL。
上述合成的DRSP-HYL用于体外特异性定性与定量荧光检测分析过氧化氢与谷胱甘肽,以及用该衍生物可视化监测细胞铁死亡进程中氧化还原的应用,包括:
(1)配置等体积二甲基亚砜和PBS(用磷酸二氢钠、磷酸氢二钠配制和氯化钠配置pH=7.4的磷酸缓冲液)混合缓冲溶液(简称测试体系),配制2mmol/LDRSP-HYL的二甲基亚砜溶液(简称探针母液)、配制200mmol/L谷胱甘肽水溶液、配制20mmol/L过氧化氢水溶液、配制10mmol/L埃拉斯汀(Erastin)的二甲基亚砜溶液、配制0.1mmol/L谷胱甘肽过氧化物酶4抑制剂(RSL3)的二甲基亚砜溶液;
(2)取2.0mL测试体系于比色皿中,向其加入10μL探针母液,添加20μL浓度为20mmol/L的过氧化氢水溶液,在荧光分光光度计上以695nm紫外可见吸收作为激发光源,监测723nm处荧光强度的变化。随着过氧化氢的加入,723nm处的荧光强度增强;
(3)取2.0mL测试体系于比色皿中,向其加入10μL探针母液,添加20μL浓度为200mmol/L的谷胱甘肽水溶液,在荧光分光光度计上以380nm紫外可见吸收作为激发光源,监测485nm处荧光强度的变化。随着谷胱甘肽的加入,485nm处的荧光强度增强;
(4)取10μL探针母液、2.0mL测试体系于比色皿中,添加20μL浓度为20mmol/L的过氧化氢水溶液,在荧光分光光度计上以695nm紫外可见吸收作为激发光源,监测723nm处荧光强度随时间的变化。探针DRSP-HYL与过氧化氢大约反应30分钟荧光强度趋于稳定;
(5)取10μL探针母液于含2.0mL测试体系的比色皿中,添加20μL浓度为200mmol/L的谷胱甘肽水溶液,在荧光分光光度计上以380nm紫外可见吸收作为激发光源,监测485nm处荧光强度随时间的变化。探针DRSP-HYL与谷胱甘肽立即反应且荧光强度趋于稳定;
(6)取10μL探针母液、2.0mL测试体系于比色皿中,向其中分别加入2μL、3μL、3.5μL、4μL、5μL、6μL、7μL浓度为20mmol/L的过氧化氢水溶液,30min后在荧光分光光度计上以695nm紫外可见吸收作为激发光源,监测723nm处荧光强度。随着过氧化氢浓度的增加,723nm处荧光强度逐渐增强;
(7)取10μL探针母液、2.0mL测试体系于比色皿中,向其中分别加入0μL、2μL、4μL、6μL、8μL、10μL、12μL、14μL、16μL、18μL、20μL浓度为200mmol/L的谷胱甘肽水溶液,30s后在荧光分光光度计上以380nm紫外可见吸收作为激发光源,监测485nm处荧光强度的变化。随着谷胱甘肽浓度的增加,485nm处荧光强度增强;
(8)取10μL探针母液溶于2.0mLPBS(探针终浓度为10μmol/L)用于孵育宫颈癌细胞(Hela细胞)20分钟后吸走该PBS溶液,并用PBS洗涤2次后置于荧光共聚焦显微镜上,以405nm和633nm为激发光源,分别监测455~515nm和693~753nm波长范围内双通道荧光强度;
(9)将宫颈癌细胞Hela分别与含20μL0.1 mmol/L RSL3母液的2.0mL DMEM培养液共孵育6h、12h、18h和24h,然后用PBS洗涤2次,取10μL探针母液溶于2.0mLPBS(探针终浓度为10μmol/L)用于孵育Hela细胞20分钟后置于荧光共聚焦显微镜上,以405nm和633nm为激发光源,分别监测455~515nm和693~753nm波长范围内双通道荧光强度。对比两通道的荧光强度随时间变化进行分析,显示693~753nm通路荧光强度随时间逐渐增强,455~515nm通路荧光强度随时间逐渐升高;
(10)将Hela细胞分别与含8μL浓度为10mmol/L Erastin母液的2.0mL DMEM培养液共孵育6h、12h、18h和24h,然后用PBS洗涤2次,取10μL探针母液溶于2.0mLPBS(探针终浓度为10μmol/L)用于孵育Hela细胞20分钟后置于荧光共聚焦显微镜上,以405nm和633nm为激发光源,分别监测455~515nm和693~753nm波长范围双通道荧光强度。对比两通道的荧光强度随时间变化进行分析,显示693-753nm通路荧光强度随时间逐渐增强,455~515nm通路荧光强度随时间先降低后升高。
与现有技术相比,本发明的有益效果:
1、本发明香豆素和半花菁偶联衍生物DRSP-HYL的合成便捷,操作方便;
2、DRSP-HYL作为荧光探针具有单分子,双位点同步检测H
3、检测手段简单,利用荧光光谱即可实现对H
附图说明
图1DRSP-HYL的核磁氢谱
图2DRSP-HYL的核磁碳谱
图3DRSP-HYL的质谱图
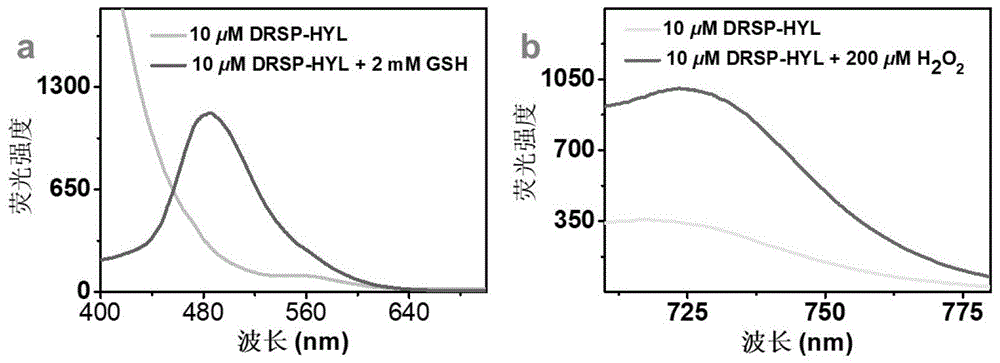
图4DRSP-HYL分别与GSH和H
图5DRSP-HYL分别与GSH和H
图6DRSP-HYL分别与不同浓度GSH和H
图7DRSP-HYL成像由谷胱甘肽过氧化物酶4抑制剂(RSL3)刺激不同时间对应H
图8DRSP-HYL成像由埃拉斯汀(Erastin)刺激不同时间对应H
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明保护范围不受下述实施例的限制。
实施例1
DRSP-HYL的制备和表征:
(1)将DMF(8.0mL,64.8mmol)置于50mL圆底烧瓶冷却至0℃,向其中滴加三氯氧磷(POCl
(2)将化合物1(4.0g,27.76mmol)、2-羟基-4-甲氧基苯甲醛(3.52g,23.12mmol)和碳酸铯(22.6g,69.33mmol)合并溶于100mL的DMF中,室温搅拌24小时,过滤并用二氯甲烷洗涤滤饼。减压蒸馏浓缩滤液,用乙酸乙酯和石油醚(体积比为3:1)混合溶剂作为洗脱剂进行柱色谱纯化得黄色固体化合物2(产率78%);
(3)将化合物2(3.0g,12.40mmol)溶解在50mL二氯甲烷中,于0℃下滴加三溴化硼(9.65mL,99.2mmol),在室温下继续搅拌6小时。用200mL的蒸馏水淬灭反应并用200mL的二氯甲烷萃取。有机相用水洗涤三次(每次200mL),收集并用无水硫酸钠干燥有机相,过滤后收集滤液并真空浓缩。用二氯甲烷和甲醇按体积比20:1作为洗脱剂通过柱色谱纯化,得橙色固体粉末化合物3(产率97%);
(4)将化合物3(2.5g,10.96mmol)和1-(2-羧乙基)-2,3,3-三甲基吲哚-1-鎓(3.1g,13.34mmol)溶于50mL乙腈中,然后添加100μL哌啶,加热至回流16小时。反应完成减压蒸馏除去溶剂,用二氯甲烷和甲醇按体积比15:1作为洗脱剂进行柱色谱纯化,得蓝紫色固体粉末化合物4(57%产率);
(5)将化合物4(2.2g,4.97mmol)、EDCI(1.9g,9.91mmol)和HOBT(1.34g,9.91mmol)溶于20mL二氯化物中,在0℃氮气环境下反应30min。然后加入1-叔丁氧羰基哌嗪(1.4g,7.51mmol)于室温下继续反应24小时。反应完成后减压蒸馏除去溶剂,用二氯甲烷和甲醇按体积比20:1进行柱色谱分离纯化,得蓝绿色固体粉末化合物5(产率62%)。
(6)将化合物5(1.5g,2.46mmol)和碳酸钾(K
(7)将化合物6(0.83g,1.0mmol)溶于二氯甲烷和三氟乙酸等体积的混合溶剂中(二氯甲烷和三氟乙酸等体积各5mL),于室温搅拌30分钟。然后减压蒸馏除去溶剂,得粗产物7直接用于下一步合成。将(Z)-2-氰基-3-(7-(二乙氨基)-2-氧代-2H-色烯-3-基)丙烯酸(0.16g,0.51mmol)、EDCI(0.19g,1.0mmol)和HOBT(0.14g,1.0mmol)合并溶于15mL二氯甲烷,于0℃氮气氛围下搅拌反应30min。然后向反应体系中加入化合物7(0.55g,0.75mmol)和80μL三乙胺在室温下继续反应。24小时后,减压蒸馏除去溶剂,用二氯甲烷和甲醇按体积比20:1进行柱色谱分离纯化,得紫黑色固体DRSP-HYL(产率23%)。
实施例2
配置等体积二甲基亚砜和PBS(用磷酸二氢钠、磷酸氢二钠配制和氯化钠配置pH=7.4的磷酸缓冲液)混合缓冲溶液(简称测试体系),配制2mmol/LDRSP-HYL的二甲基亚砜溶液(简称探针母液)。
实施例3
取2.0mL测试体系于比色皿中,向其加入10μL探针母液,添加20μL浓度为200mmol/L的谷胱甘肽水溶液,在荧光分光光度计上以380nm紫外可见吸收作为激发光源,监测485nm处荧光强度的变化。随着谷胱甘肽的加入,485nm处的荧光强度增强且强度不变(图4a)。取2.0mL测试体系于比色皿中,向其加入10μL探针母液,添加20μL浓度为20mmol/L的过氧化氢水溶液,在荧光分光光度计上以695nm紫外可见吸收作为激发光源,监测723nm处荧光强度的变化。随着过氧化氢的加入,723nm处的荧光强度增强(图4b)。
实施例4
取10μL探针母液于含2.0mL测试体系的比色皿中,添加20μL浓度为200mmol/L的谷胱甘肽水溶液,在荧光分光光度计上以380nm紫外可见吸收作为激发光源,监测485nm处荧光强度随时间的变化。探针DRSP-HYL与谷胱甘肽立即反应且荧光强度趋于稳定。取10μL探针母液、2.0mL测试体系于比色皿中,添加20μL浓度为20mmol/L的过氧化氢水溶液,在荧光分光光度计上以695nm紫外可见吸收作为激发光源,监测723nm处荧光强度随时间的变化。探针DRSP-HYL与过氧化氢大约反应30分钟荧光强度趋于稳定(图5a)(图5b)。
实施例5
取10μL探针母液、2.0mL测试体系于比色皿中,向其中分别加入0μL、2μL、4μL、6μL、8μL、10μL、12μL、14μL、16μL、18μL、20μL浓度为200mmol/L的谷胱甘肽水溶液,在荧光分光光度计上以380nm紫外可见吸收作为激发光源,30s后监测485nm处荧光强度的变化。随着谷胱甘肽浓度的增加,485nm处荧光强度增强(图6a)。取10μL探针母液、2.0mL测试体系于比色皿中,向其中分别加入2μL、3μL、3.5μL、4μL、5μL、6μL、7μL浓度为20mmol/L的过氧化氢水溶液,30min后在荧光分光光度计上以695nm紫外可见吸收作为激发光源,监测723nm处荧光强度。随着过氧化氢浓度的增加,723nm处荧光强度逐渐增强(图6b)。
实施例6
取10μL探针母液溶于2.0mLPBS(探针终浓度为10μmol/L)用于孵育宫颈癌细胞(Hela细胞)20分钟后吸走该PBS溶液,并用PBS洗涤2次后置于荧光共聚焦显微镜上,以405nm和633nm为激发光源,分别监测455~515nm和693~753nm波长范围内双通道荧光强度(图7A1和a1);将宫颈癌细胞Hela分别与含20μL0.1 mmol/L RSL3母液的2.0mL DMEM培养液共孵育6h、12h、18h和24h,然后用PBS洗涤2次,取10μL探针母液溶于2.0mLPBS(探针终浓度为10μmol/L)用于孵育Hela细胞20分钟后置于荧光共聚焦显微镜上,以405nm和633nm为激发光源,分别监测455~515nm和693~753nm波长范围内双通道荧光强度。对比两通道的荧光强度随时间变化进行分析,显示693~753nm通路荧光强度随时间逐渐增强,455~515nm通路荧光强度随时间逐渐升高(图7)。
实施例7
将Hela细胞分别与含8μL浓度为10mmol/L Erastin母液的2.0mL DMEM培养液共孵育6h、12h、18h和24h,然后用PBS洗涤2次,取10μL探针母液溶于2.0mLPBS(探针终浓度为10μmol/L)用于孵育Hela细胞20分钟后置于荧光共聚焦显微镜上,以405nm和633nm为激发光源,分别监测455~515nm和693~753nm波长范围双通道荧光强度。对比两通道的荧光强度随时间变化进行分析,显示693~753nm通路荧光强度随时间逐渐增强,455~515nm通路荧光强度随时间先降低后升高(图8)。
上述实验结果表明DRSP-HYL是体外和细胞内检测GSH和H
