一种变速悬浮诱导人多能干细胞分化为自然杀伤细胞的方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于细胞生物学领域,尤其是涉及一种变速悬浮诱导人多能干细胞分化为自然杀伤细胞的方法。
背景技术
目前NK细胞来源主要是外周血单个核细胞,脐血单个核细胞,NK92细胞系及多能干细胞诱导来源的NK细胞。外周血及脐血单个核来源的NK细胞主要存在的问题是细胞数量有限,细胞纯度较低及细胞存在个体差异造成实验结果不稳定。NK92细胞染色体为非整倍体,因此使用前需要进行辐照,影响细胞存活时长及功能发挥。多能干细胞由于其可以无限扩增获得大量的起始细胞,且细胞均一稳定,通过诱导分化的NK细胞纯度较高,批次稳定,且具有NK细胞的表型及功能,因此,可以实现NK细胞的实验室培养转化为工业规模化生产,利于推进细胞向临床应用。
目前,多能干细胞诱导分化NK细胞主要的方法有单层细胞诱导分化NK细胞的2D技术及低吸附96孔板产生spin-EB诱导的方法。2D诱导技术目前仍需要依赖异源基质细胞或者需要蛋白包被进行诱导分化,且诱导的NK细胞杀伤功能较差,诱导周期长,不利于NK的规模化培养。Spin-EB的方法存在操作繁杂,批间差异大,稳定性差,且耗材昂贵,同样不适合规模化生产等问题。
发明内容
有鉴于此,本发明旨在克服现有技术中的缺陷,提出一种变速悬浮诱导人多能干细胞分化为自然杀伤细胞的方法。
为达到上述目的,本发明的技术方案是这样实现的:
一种变速悬浮诱导人多能干细胞分化为自然杀伤细胞的方法,包括如下步骤:
S1:变速阶段一
将人多能干细胞配制细胞悬液,放入细胞培养容器中置于37℃,5%CO
S2:变速阶段二
将步骤S1培养后的细胞离心收集,加入变速阶段二诱导分化培养基后于37℃,2%-8%氧分压环境中以15-50rpm转速培养进行诱导分化3-6天;
S3:变速阶段三
将变速阶段二诱导分化培养基更换为变速阶段三诱导分化培养基,于37℃,5%CO
S4:变速阶段四
将变速阶段三诱导分化培养基更换为变速阶段四诱导分化培养基,并于37℃,5%CO
S5:变速阶段五
将变速阶段四诱导分化培养基更换为变速阶段五诱导分化培养基,并置于37℃,5%CO
其中,常规氧分压环境是指与大气中氧含量相同的环境。
在本发明的部分实施例中,所述步骤S1中的转速优选为50rpm。
在本发明的部分实施例中,所述步骤S2中的转速优选为20rpm。
在本发明的部分实施例中,所述步骤S3中的转速优选为20rpm。
在本发明的部分实施例中,所述步骤S4中的转速优选为10rpm。
在本发明的部分实施例中,所述步骤S5中的转速优选为10-40rpm。
在本发明的部分实施例中,所述步骤S1中放入细胞培养容器中的细胞悬液密度为0.5-2×10
在本发明的部分实施例中,所述步骤S2中的变速阶段二诱导分化培养基中含有GSK3β抑制剂、BMP信号通路激活剂、VEGF、SCF、 bFGF、IGF-1中的一种或几种。
在本发明的部分实施例中,所述步骤S2中的变速阶段二诱导分化培养基为含有GSK3β抑制剂、BMP信号通路激活剂、VEGF、SCF、 bFGF、IGF-1中的一种或几种的基础诱导分化培养基。
在本发明的一些实施方式中,所述变速阶段二诱导分化培养基中GSK3β抑制剂的浓度为1-10μM,BMP信号通路激活剂的浓度为1-100ng/ml,VEGF的浓度为1-100ng/ml,SCF的浓度为1-200ng/ml,bFGF的浓度为1-50ng/ml,IGF-1的浓度为1-200ng/ml。
在本发明的部分实施例中,所述步骤S3中的变速阶段三诱导分化培养基中含有TGF-β信号通路抑制剂、BMP信号通路激活剂、VEGF、bFGF、SCF、Flt3L、IL3、IL6、IGF-1中的一种或几种。
在本发明的部分实施例中,所述步骤S3中的变速阶段三诱导分化培养基为含有TGF-β信号通路抑制剂、BMP信号通路激活剂、VEGF、bFGF、SCF、Flt3L、IL3、IL6、IGF-1中的一种或几种的基础诱导分化培养基。
在本发明的一些实施方式中,所述变速阶段三诱导分化培养基中TGF-β信号通路抑制剂的浓度为1-10μM,BMP信号通路激活剂的浓度为1-100ng/ml,VEGF的浓度为1-100ng/ml,bFGF的浓度为1-50ng/ml,SCF的浓度为1-200ng/ml,Flt3L的浓度为1-100ng/ml,IL3的浓度为1-50ng/ml,IL6的浓度为1-50ng/ml,IGF-1的浓度为1-200ng/ml。
在本发明的部分实施例中,所述步骤S4中的变速阶段四诱导分化培养基中含有BMP4、VEGF、bFGF、SCF、Flt3L、IL3、IL6、IGF-1、UM171、UM729、SR1中的一种或几种。
在本发明的部分实施例中,所述步骤S4中的变速阶段四诱导分化培养基为含有BMP4、VEGF、bFGF、SCF、Flt3L、IL3、IL6、IGF-1、UM171、UM729、SR1中的一种或几种的基础诱导分化培养基。
在本发明的一些实施方式中,所述变速阶段四诱导分化培养基中BMP4的浓度为1-100ng/ml,VEGF的浓度为1-100ng/ml,bFGF的浓度为1-50ng/ml,SCF的浓度为1-200ng/ml,Flt3L的浓度为1-100ng/ml,IL3的浓度为1-50ng/ml,IL6的浓度为1-50ng/ml,IGF-1的浓度为1-200ng/ml,UM171的浓度为10-50nM,UM729的浓度为100-900nM,SR1的浓度为100-900nM。
在本发明的部分实施例中,所述步骤S5中的变速阶段五诱导分化培养基中含有IL3、IL7、IL15、SCF、Flt3L、UM729、IL2、IL21、IL12、IL18、CHIR99021中的一种或几种。
在本发明的部分实施例中,所述步骤S5中的变速阶段五诱导分化培养基为含有IL3、IL7、IL15、SCF、Flt3L、UM729、IL2、IL21、IL12、IL18、CHIR99021中的一种或几种的基础诱导分化培养基。
在本发明的一些实施方式中,所述变速阶段五诱导分化培养基中IL3的浓度为1-100ng/ml,IL7的浓度为1-100ng/ml,IL15的浓度为1-100ng/ml,SCF的浓度为1-100ng/ml,Flt3L的浓度为1-100ng/ml,MU729的浓度为100-900nM,IL2的浓度为1-1000U/ml,IL21的浓度为1-100ng/ml,IL12的浓度为1-100ng/ml,IL18的浓度为1-100ng/ml,CHIR99021的浓度为1-10uM。
在本发明的部分实施例中,所述步骤S2中加入变速阶段二诱导分化培养基后每2天半量更换变速阶段二诱导分化培养基。
在本发明的部分实施例中,所述步骤S5中加入变速阶段五诱导分化培养基后每3-7天半量更换变速阶段五诱导分化培养基。
在本发明的部分实施例中,所述步骤S5的具体步骤为:
S51:离心收集步骤S4诱导分化的细胞,向沉淀中加入变速阶段五诱导分化培养基M1,并置于37℃,5%CO
S52:离心收集步骤S51诱导分化的细胞,每5天半量换液变速阶段五诱导分化培养基M2,并置于37℃,5%CO
S53:离心收集步骤S52诱导分化的细胞,每3-4天半量换液变速阶段五诱导分化培养基M3,并置于37℃,5%CO
S54:离心收集步骤S53诱导分化的细胞,每3-4天半量更换变速阶段五诱导分化培养基M4,并置于37℃,5%CO
在本发明的部分实施例中,所述变速阶段五诱导分化培养基M1中IL3的浓度为1-100ng/ml,IL7的浓度为1-100ng/ml,IL15的浓度为1-100ng/ml,SCF的浓度为1-100ng/ml,Flt3L的浓度为1-100ng/ml。
在本发明的部分实施例中,所述变速阶段五诱导分化培养基M2中IL7的浓度为1-100ng/ml,IL15的浓度为1-100ng/ml,SCF的浓度为1-100ng/ml,Flt3L的浓度为1-100ng/ml。
在本发明的部分实施例中,所述变速阶段五诱导分化培养基M3中IL7的浓度为1-100ng/ml,IL15的浓度为1-100ng/ml,SCF的浓度为1-100ng/ml,Flt3L的浓度为1-100ng/ml,UM729的浓度为100-900nM,IL2的浓度为1-1000U /ml,IL21的浓度为1-100ng/ml,IL12的浓度为1-100ng/ml,IL18的浓度为1-100ng/ml。
在本发明的部分实施例中,所述变速阶段五诱导分化培养基M4中IL7的浓度为1-100ng/ml,IL15的浓度为1-100ng/ml,SCF的浓度为1-100ng/ml,Flt3L的浓度为1-100ng/ml,UM729的浓度为100-900nM,IL2的浓度为1-1000U/ml,IL21的浓度为1-100ng/ml,IL12的浓度为1-100ng/ml,IL18的浓度为1-100ng/ml,CHIR99021的浓度为1-10μM。
在本发明的部分实施例中,所述步骤S51中的转速优选为10rpm,所述步骤S52中的转速优选为10rpm,所述步骤S53中的转速优选为40rpm,所述步骤S54中的转速优选为40rpm。
在本发明的部分实施例中,步骤S5中变速阶段四的诱导产物通过NTC细胞培养瓶或者细胞培养袋进行诱导培养,或将变速阶段四诱导产物收集后接种于含有0.1%-2%明胶、0.5 µg/cm
相对于现有技术,本发明具有以下优势:
(1)本发明的变速悬浮诱导方法通过调节不同的转速及起始密度诱导多能干细胞向NK细胞分化,操作方便,适合规模化生产。
(2)本发明的变速悬浮诱导方法技术路线稳定,且诱导NK细胞阳性率大于90%,具有和外周血来源的NK细胞同样的表型及体外功能。
(3)本发明的变速悬浮诱导方法不依赖于饲养细胞或异源基质胶的使用,经体外实验验证其安全性,有利于细胞向临床使用转化。
附图说明
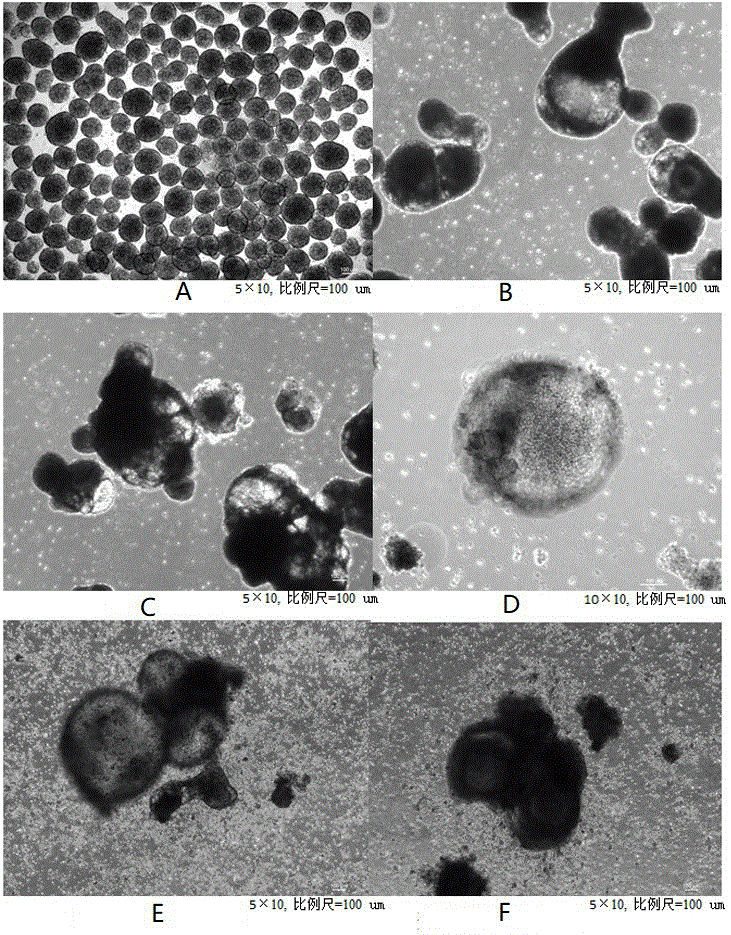
图1为实施例6在各个变速阶段的细胞发育图片(其中,A图为变速阶段一结束后细胞发育图片,B图为变速阶段二结束后细胞发育图片,C图为变速阶段三结束后细胞发育图片,D图为变速阶段四结束后细胞发育图片,E图为变速阶段五的S51结束后细胞发育图片,F图为变速阶段五的S54结束后细胞发育图片);
图2为实施例1以及对比例1在变速阶段一结束后的细胞发育状态图;
图3为实施例6-9以及对比例7-8在不同变速阶段的细胞发育图片;
图4为实施例6诱导分化得到的NK细胞肿瘤杀伤功能检测结果图;
图5为实施例6诱导分化得到的NK细胞因子释放检测结果图;
图6为实施例6诱导分化得到的NK细胞ADCC检测结果图;
图7为实施例6诱导分化得到的NK细胞脱颗粒检测结果图;
图8为实施例6诱导分化得到的NK细胞体外成瘤性检测结果图。
具体实施方式
除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
以下实施例及对比例中:
(1)诱导分化过程流式细胞术检测
变速阶段二:anti-CD326,anti-CD56,anti-KDR
变速阶段四:anti-CD34
变速阶段五:anti-CD56,anti-CD3
(2)基础诱导分化培养基成分见下表:
表1基础诱导分化培养基成分表
下面结合实施例来详细说明本发明。
一、各个变速阶段转速的确定
一种变速悬浮诱导人多能干细胞分化为自然杀伤细胞的方法,具体步骤如下:
(1)变速阶段一:Day0将hesA细胞通过 accutase消化成细胞悬液,加入DMEM/F12将消化终止,离心。
使用变速阶段一培养基人多潜能干细胞培养基PGM1将细胞沉淀重悬,加入10uMRock抑制剂Y27632。
根据细胞计数结果,取适量细胞配制细胞悬液,使细胞浓度处于0.5×10
将装有细胞悬液的容器置于37℃,5%CO
(2)变速阶段二:Day1通过离心收集细胞,加入30ml变速阶段二培诱导分化养基,即在基础诱导分化培养基加5uM CHIR-99021,20ng/ml BMP4,20ng/ml VEGF,40ng/ml SCF,2ng/ml bFGF,40ng/ml IGF-1,将悬液置于175cm
Day3-5,每两天进行半量换液,弃15ml原培养基,加入15ml新鲜变速阶段二诱导分化培养基,置于37℃,5%O
(3)变速阶段三:Day5-7更换为变速阶段三诱导分化培养基,弃15ml原培养基,加入15ml新鲜变速阶段三诱导分化培养基,即在基础诱导分化培养基添加TGF-β信号通路抑制剂5uM SB431542, 20ng/ml BMP4,20ng/ml VEGF,2ng/ml bFGF,40ng/ml SCF, 40ng/mlIGF-1因子。置于37℃,5%CO
(4)变速阶段四:Day7-15,每两天进行半两换液,更换为变速阶段四诱导分化培养基。弃原培养基15ml,补加15ml新鲜的造血干细胞诱导分化扩增培养基,即在基础诱导分化培养基添加小分子及细胞因子,20ng/ml BMP4,20ng/ml VEGF,2ng/ml bFGF,40ng/ml SCF,40ng/ml IGF-1,10ng/ml Flt3L,5ng/ml IL3,10ng/ml IL6,750mM UM729。置于37℃,5%CO
(5)变速阶段五:
S51:Day12-15离心收集细胞,向沉淀中加入30ml变速阶段五诱导分化培养基M1,即在基础诱导分化培养基加入诱导细胞因子5ng/ml IL3,20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L。置于37℃,5%CO
S52:Day20-30,每5天半量换液变速阶段五诱导分化培养基M2,通过离心收集细胞沉淀加入诱导体系,补加新鲜的分化培养基,即在基础诱导分化培养基加入诱导细胞因子20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L。置于37℃,5%CO
S53:Day30-40,每3-4天半量更换变速阶段五诱导分化培养基M3,通过离心收集细胞沉淀加入诱导体系,补加新鲜的分化培养基,即在基础诱导分化培养基加入诱导细胞因子及小分子20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L,750nM UM729,100U/ml IL2,10ng/ml IL21,10ng/ml IL12,10ng/ml IL18。置于37℃,5%CO
S54:Day40-50,每3-4天半量更换变速阶段五诱导分化培养基M4,通过离心收集细胞沉淀加入诱导体系,补加新鲜的分化培养基,即在基础诱导分化培养基加入诱导细胞因子及小分子20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L,750nM UM729,100U/ml IL2,10ng/mlI L21,10ng/ml IL12,10ng/ml IL18,5mM CHIR99021。置于37℃,5%CO
表2 不同实施例和对比例中各步骤转速
将实施例1-6以及对比例1-6的各个变速阶段进行流式细胞术检测,将实施例1-6以及对比例1-6各个变速阶段的中间态细胞以及最终诱导分化所得的自然杀伤细胞的细胞发育状态进行显微镜明场拍照,其中,实施例6在各个变速阶段的照片如图1所示,可以看出从人多能干细胞向NK细胞发育过程进展。
实施例1以及对比例1在变速阶段一结束后的细胞发育状态图如图2所示,可以看出40rpm转速形成的聚集体更匀质,发育更快,更利于分化实验开展。
实施例1-6以及对比例1-6在变速阶段二、四、五结束后的流式细胞术结果表3所示。
表3 流式细胞术检测结果
由表3可以看出,五个诱导阶段采用不同的速度,各阶段转速均对发育过程有影响,最终影响NK细胞的诱导效率。
二、 起始细胞密度的确定
一种变速悬浮诱导人多能干细胞分化为自然杀伤细胞的方法,具体步骤如下:
(1)Day0将hesA细胞通过 accutase消化成细胞悬液,加入DMEM/F12将消化终止,离心。
使用变速阶段一培养基人多潜能干细胞培养基PGM1将细胞沉淀重悬,加入10uMRock抑制剂Y27632。
根据细胞计数结果,取适量细胞配制细胞悬液,使细胞密度按照表4的密度设置,终体积为30ml。采用250ml细胞培养摇瓶进行聚集体形成。
将装有细胞悬液的容器置于37℃,5%CO
(2)Day1通过离心收集细胞,加入30ml变速阶段二培诱导分化养基,即在基础诱导分化培养基加5uM CHIR-99021,20ng/ml BMP4,20ng/ml VEGF,40ng/ml SCF,2ng/ml bFGF,40ng/ml IGF-1,将悬液置于175cm
Day3-5,每两天进行半量换液,弃15ml原培养基,加入15ml新鲜变速阶段二诱导分化培养基,置于37℃,5%O
(3)Day5-7更换为变速阶段三诱导分化培养基,弃15ml原培养基,加入15ml新鲜变速阶段三诱导分化培养基,即在基础诱导分化培养基添加TGF-β信号通路抑制剂5uMSB431542, 20ng/ml BMP4,20ng/ml VEGF,2ng/ml bFGF,40ng/ml SCF, 40ng/mlIGF-1因子。置于37℃,5%CO
(4)Day7-15,每两天进行半两换液,更换为变速阶段四诱导分化培养基。弃原培养基15ml,补加15ml新鲜的造血干细胞诱导分化扩增培养基,即在基础诱导分化培养基添加小分子及细胞因子,20ng/ml BMP4,20ng/ml VEGF,2ng/ml bFGF,40ng/ml SCF, 40ng/mlIGF-1,10ng/ml Flt3L,5ng/ml IL3,10ng/ml IL6,750mM UM729。置于37℃,5%CO
(5)Day12-15离心收集细胞,向沉淀中加入30ml变速阶段五诱导分化培养基M1,即在基础诱导分化培养基加入诱导细胞因子5ng/ml IL3,20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L。置于37℃,5%CO
Day20-30,每5天半量换液变速阶段五诱导分化培养基M2,通过离心收集细胞沉淀加入诱导体系,补加新鲜的分化培养基,即在基础诱导分化培养基加入诱导细胞因子20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L。置于37℃,5%CO
Day30-40,每3-4天半量更换变速阶段五诱导分化培养基M3,通过离心收集细胞沉淀加入诱导体系,补加新鲜的分化培养基,即在基础诱导分化培养基加入诱导细胞因子及小分子20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L,750nM UM729,100U/mlIL2,10ng/ml IL21,10ng/ml IL12,10ng/ml IL18。置于37℃,5%CO
Day40-50,每3-4天半量更换变速阶段五诱导分化培养基M4,通过离心收集细胞沉淀加入诱导体系,补加新鲜的分化培养基,即在基础诱导分化培养基加入诱导细胞因子及小分子20ng/ml IL7,10ng/ml IL15,20ng/ml SCF,10ng/ml Flt3L,750nM UM729,100U/mlIL2,10ng/mlI L21,10ng/ml IL12,10ng/ml IL18,5mM CHIR99021。置于37℃,5%CO
表4 不同实施例和对比例的细胞起始密度
实施例6-9以及对比例7-8在不同变速阶段的细胞发育图片如图3所示,由图3可以看出不同起始密度影响后续诱导发育过程,起始密度为0.5-2×10
实施例6-9以及对比例7-8在变速阶段二、变速阶段四诱导结束的流式细胞术检测结果如表5所示。
表5流式细胞术检测结果
由表5可以看出,不同起始密度影响后续诱导过程,起始密度为0.5-2×10
三、体外功能检测
将实施例6诱导分化得到的NK细胞分别进行如下测试:
1、肿瘤杀伤功能检测
培养K562-LUC细胞,使用RPMI 1640培养基调整细胞密度为1×10
2、因子释放检测
培养K562-LUC细胞,使用RPMI 1640培养基调整细胞密度为1×10
3、ADCC检测
培养A549-LUC细胞,将细胞酶解消化,使用RPMI 1640培养基重悬细胞,调整细胞密度为1×10
4、脱颗粒检测
培养K562细胞,使用RPMI 1640培养基调整细胞密度为1×10
四、体外安全性检测
1、TERT检测
各取2×10
使用逆转录试剂盒(TAKARA,CAT#RR047A)配置反应液,使用PCR基因扩增仪进行逆转录反应。使用SYBR® Green Premix Pro Taq HS qPCR Kit试剂盒(艾克瑞,CAT#AG11718)配置反应液,使用实时荧光定量PCR仪进行qPCR反应:
扩增端粒酶上游引物TERT-1-F、扩增端粒酶下游引物TERT-1-R的核苷酸序列获得自GETprime 网站(https://gecftools.epfl.ch/getprime),ID号为1959126。扩增内参上游引物β-actin-F、扩增内参下游引物β-actin-R的核苷酸序列获得自PrimerBank网站(https://pga.mgh.harvard.edu/primerbank/),ID号为4501885a1。
结果如表6所示,可以看出iNK细胞不具有端粒酶活性。
表6 TERT检测结果
2、ESRG检测
各取2×10
使用逆转录试剂盒(TAKARA,CAT#RR047A)配置反应液,使用PCR基因扩增仪进行逆转录反应。使用SYBR® Green Premix Pro Taq HS qPCR Kit试剂盒(艾克瑞,CAT#AG11718)配置反应液,使用实时荧光定量PCR仪进行qPCR反应:
扩增ESRG上游引物ESRG-P-F、扩增ESRG下游引物ESRG-P-R的核苷酸序列获得自GETprime 网站(https://gecftools.epfl.ch/getprime),ID号为1882295。扩增内参上游引物β-actin-F、扩增内参下游引物β-actin-R的核苷酸序列获得自PrimerBank网站(https://pga.mgh.harvard.edu/primerbank/),ID号为4501885a1。
结果如表7所示,可以看出iNK未检测到ESRG基因,没有hesA细胞残留。
表7 ESRG检测结果
3、体外成瘤性检测
取4ml DMEM稀释4×10
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
