Protein A免疫噬菌体展示抗体库的构建方法、ProteinA抗体及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明专利涉及一种Protein A免疫噬菌体展示抗体库的构建方法、Protein A单克隆抗体及其应用,以及含有该抗体的Protein A检测试剂盒,属于生物工程技术领域。
背景技术
金黄色葡萄球菌细胞壁中的A蛋白(Staphylococal ProteinA,SPA)又称ProteinA,是一种金黄色葡萄球菌细胞壁蛋白质,分子量42kDa,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合,通常在大规模抗体制备中用于纯化IgG。Protein A分为天然Protein A、天然重组Protein A以及非天然重组Protein A,这些Protein A通常与琼脂糖、树脂等相偶联用于制备亲和层析柱。在抗体药生产中,下游亲和层析过程中Protein A会不可避免的与目标抗体蛋白一起被洗脱下来,从而在最终纯化步骤中产生Protein A残留。这种杂质会严重影响产品质量、药效以及安全性。
WHO、ICH(国际人用药品注册协调会)、中国药典、USP<130>均对Protein A残留量做出了相关限定。《中华人民共和国药典》2020年版第三部,《人用重组单克隆抗体制品总论》中3.2.4工艺相关杂质中提出“采用适宜的方法对供试品宿主蛋白质、宿主细胞和载体DNA、蛋白A及其他工艺相关杂质进行检测”。《尼妥珠单抗注射液》3.1.3.3蛋白质A残留量中提出“用酶联免疫吸附法(通则3429)测定,蛋白质A残留量应不高于蛋白质总量的0.001%。”2005年药品审批中心《生物制品质量控制分析方法验证技术审评一般原则》,建议融合蛋白及单抗类制品Protein A残留量检测可以采用ELISA法。
因为Protein A是生物制品生产质控中必不可少的一个环节,且在工艺研究、终产品质量控制中都需要进行残留检测,所以研发一款基于ELISA方法的Protein A检测试剂盒是有必要的。
发明内容
本发明的目的是提供一种Protein A免疫噬菌体展示抗体库的构建方法。
一种Protein A免疫噬菌体展示抗体库的构建方法,其特征在于其步骤包括:
(1)用Protein A蛋白免疫公鸡,提取淋巴细胞的总RNA,逆转录成cDNA;
(2)利用PCR技术扩增重链可变区和轻链可变区片段并拼接成scFv基因;
(3)构建pCANTAB5E-2SFi1-scFv重组质粒,电转化至TG1感受态细胞,构建噬菌体单链抗体库;
(4)特异性富集噬菌体单链抗体库,从中筛选出阳性克隆;
(5)将阳性单链抗体转化成IgY抗体,并在真核表达系统中进行表达;
(6)IgY抗体的纯化
(7)IgY抗体作为原料应用于ELISA检测试剂盒
步骤(2)中PCR技术使用的引物如下:
步骤(2)中重链VH上游引物IgY-sfi1-VH-F和下游引物IgY-VH-R混合进行PCR,轻链VL上游引物IgY-VL-F和下游引物IgY-sfi1-VL-R混合进行PCR,将获得的轻链VL和重链VH的PCR产物回收并等物质的量混合作为模板,使用引物表中相对应的重链上游引物和轻链下游引物进行PCR。
步骤(4)中特异性富集噬菌体单链抗体库具体指取抗原用PBS,混匀后包被于96孔板,用5%BSA作为封闭液,添加噬菌体单链抗体库后室温孵育;
洗脱:加入100mM HCl,室温孵育5min后,用枪头用力吹打后收集,收集管内加入1MTris-HCl中和pH,再加入1%BSA溶液稀释;
洗脱产物扩增:取洗脱产物加入TG1菌液中培养,加入M13KO7辅助噬菌体继续培养,菌液离心,用2×YT培养基重悬沉淀,过夜震荡培养;第二天将菌液离心,上清液体转移至新的离心管,加入PEG-NaCl,冰上静置沉析后离心,然后去除上清,用1%BSA溶液重悬沉淀,转至另一EP管,离心,去除沉淀,上清即为扩增富集产物;
重复上述步骤,进行4轮淘选,提高每轮淘选严苛程度,富集得到具有亲和力的噬菌体。
步骤(5)中使用引物如下:
步骤(5)中将单链抗体转化成IgY具体指,将单链抗体的轻重链抗体基因克隆到pfuse(该载体已分别预先插入了IgY的重链和轻链恒定区基因)表达载体中,构建成完整的IgY重链和轻链表达载体。
本发明还公开了一种抗Protein A的IgY单克隆抗体,依次命名为IgY-80、IgY-81。
其中ProteinA抗体IgY-80,其氨基酸序列为:
重链可变区序列为:
AVTLDESGGGLQTPGGTLSLVCKASGFTFSDRGMHWVRQAPGKGLEWVAGTYTSGSITYYAPAVNGRATISRDNGQSTLRLQLNNLRAEDSGTYYCARDFGPSGWNAGSIDAWGHGTEVIVSS(SEQ ID No.1),
其中重链可变区CDR1氨基酸序列为:DRGMH,
重链可变区CDR2氨基酸序列为:GTYTSGSITYYAPAVNG,
重链可变区CDR3氨基酸序列为:DFGPSGWNAGSIDA。
轻链可变区序列为:
QAALTQPSSVSANLGGTVKITCSGGGSRYGYMYGWIQQTSPGSAPVTVIYDNTNRPSNIPSRFSGSLSGSTNTLTITGVQAEDEAVYFCGSYEGTTLTFGAGTTLTVL(SEQ ID No.2),
其中轻链可变区CDR1氨基酸序列为:SGGGSRYGYMYG,
轻链可变区CDR2氨基酸序列为:DNTNRPS,
轻链可变区CDR3氨基酸序列为:GSYEGTTLT。
其中ProteinA抗体IgY-81,其氨基酸序列为:
重链可变区序列为:
AVTLDESGGGLQTPGGALSLVCKASGFTFSSNGMGWVRQAPGKGLEYVASISNDGSLTDYASPVKGRATISRDNGQSTVRLQLNNLRAEDTGTYYCAKSPGGGWLADPIDAWGRGTEVIVSS(SEQ ID No.3),
其中重链可变区CDR1氨基酸序列为:SNGMG,
重链可变区CDR2氨基酸序列为:SISNDGSLTDYASPVKG,
重链可变区CDR3氨基酸序列为:SPGGGWLADPIDA;
轻链可变区序列为:
QAALTQPASVSANPGETVQITCSGGGSSRYYGWYQQKSPGSAPVTLIYDNINRPSGIPSRFSGSTSGSTGTLSITGVRAEDEAVYYCGSFDSSGTGIFGAGTTLTVL(SEQ ID No.4),
其中轻链可变区CDR1氨基酸序列为:SGGGSSRYYG,
轻链可变区CDR2氨基酸序列为:DNINRPS,
轻链可变区CDR3氨基酸序列为:GSFDSSGTGI。
本发明还公开了上述ProteinA抗体IgY-80和ProteinA抗体IgY-81在ELISA法检测样本中ProteinA的应用。
本发明还公开了一种Protein A检测试剂盒,含有上述的ProteinA抗体IgY-80和/或ProteinA抗体IgY-81。
本发明的Protein A免疫噬菌体展示抗体库的构建方法,可筛选得到具有高亲和力的鸡源单链抗体,可构建出库容量9.0×10
附图说明
图1是提取的总RNA电泳图。
图2是轻链VL、重链VH基因的PCR产物凝胶电泳图。
图3是IgY-80亲和力检测结果。
图4是IgY-81亲和力检测结果。
图5是scFv基因PCR产物凝胶电泳图。
图6是pCANTAB5E-2sfi1质粒双酶切前后电泳图。
图7是连接产物电转化的平板图。
图8是菌落PCR鉴定图。
图9是重组蛋白IgY纯化图。
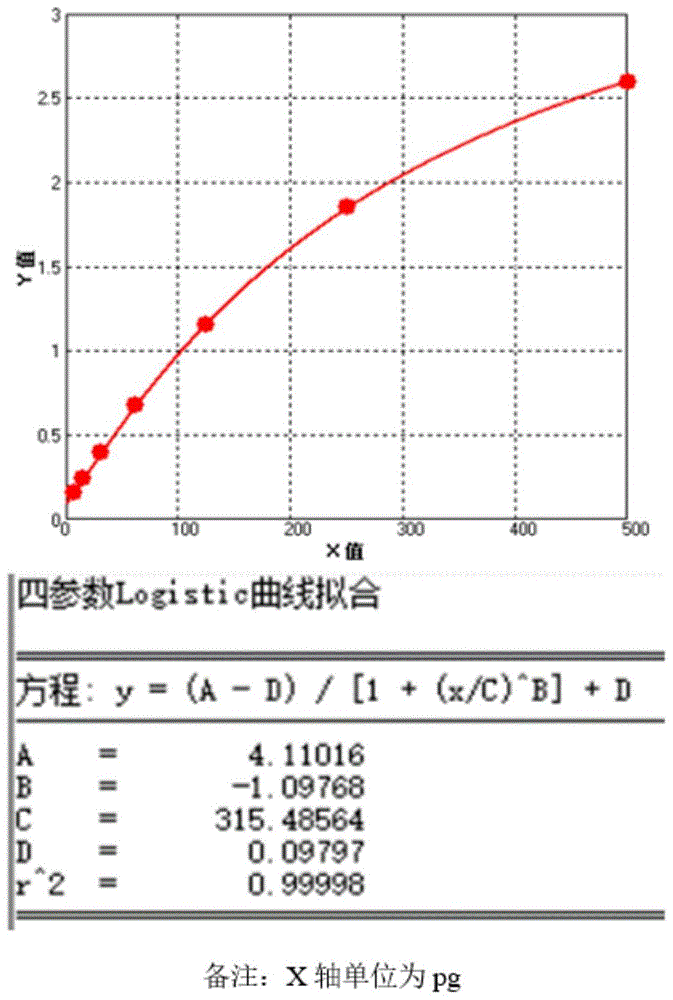
图10是ProteinA检测试剂盒对ProteinA的检测灵敏度的标准曲线。
具体实施方式
1.生物材料
公鸡,辉煌养殖场
2.实验试剂与耗材
表1实验试剂与耗材
/>
/>
实施例1噬菌体展示抗体库的构建
1.1动物免疫和脾细胞总RNA的提取
用ProteinA免疫约2kg的公鸡,每两周皮下免疫一次,初次免疫用弗式完全佐剂乳化ProteinA,加强免疫用非完全佐剂乳化,首次免疫剂量为0.5mg蛋白,以后每次免疫剂量为0.25mg,免疫2月后,即取脾脏前3天,用0.25mg的蛋白皮下冲击免疫。冲击免疫三天后,取脾脏组织块30-50mg。按照超纯RNA提取试剂盒(DNase I)的步骤提取总RNA。在液氮中充分研磨后加入1ml TRIzon Reagent,或在脾脏组织中加入1ml TRIzon Reagent后匀浆处理。样品中加入TRIzon Reagent后反复吹打几次,使样本充分裂解。室温放置5min,使蛋白核酸复合物完全分离。以每1ml TRIzon Reagent加入200μl三氯甲烷的比例加入三氯甲烷,盖好管盖,剧烈振荡15s,室温放置2min。4℃12,000rpm(~13,400×g)离心10min,此时样品分为三层:红色有机相,中间层和上层无色水相,RNA主要在上层水相中,将上层水相移到一个新的RNase-Free离心管(自备)中。
在得到的水相溶液中加入等体积的70%乙醇(无RNase水配制),约600μl-700μl,颠倒混匀。将上步所得溶液全部加入到已装入收集管的吸附柱(Spin Columns RM)中。若一次不能加完溶液,可分多次转入。12,000rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中。向吸附柱中加入350μl Buffer RW1,12,000rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中。配制DNase I混合液:取52μl RNase-Free Water,向其中加入8μl 10×Reaction Buffer和20μl DNase I(1U/μl),混匀,配制成终体积为80μl的反应液。向吸附柱中直接加入80μl DNase I混合液,20-30℃孵育15min。向吸附柱中加入500μlBuffer RW2(使用前检查是否已加入无水乙醇),12,000rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中。12,000rpm离心2min,倒掉收集管中废液。将吸附柱置于室温3min,彻底晾干。将吸附柱置于一个新的无RNase离心管中,向吸附柱的中间部位加入50μl RNase-Free Water,室温放置2min,12,000rpm离心1min,收集RNA溶液,取1μl样品跑电泳检测提取效果,结果如图1,其余的RNA样品于-80℃冰箱保存待用。
1.2 scFv基因克隆及拼接
本发明采用翌圣生物公司的逆转录试剂盒,以提取公鸡脾脏细胞RNA为模板按照表2-1所示逆转录反应体系,加入RNA模板,RNase free Water,
将上一步回收的重链和轻链基因等摩尔混合作为模板,使用相对应的重链VH上游引物和轻链下游引物进行PCR,拼接成为scFv。PCR反应体系如表2-5,反应条件同表2-4中VH基因扩增条件。反应结束后上样进行琼脂糖凝胶电泳检测,结果如图5,使用OMEGA公司胶回收试剂盒按照试剂盒实验步骤回收,回收产物-20℃保存。
表2-1逆转录反应体系
表2-2所用引物
Y代表C/T
表2-3 PCR反应体系
表2-4 PCR扩增条件
表2-5 PCR反应体系
1.3构建pCANTAB5E-2sfi1-scFv重组质粒
pCANTAB5E-2sfi1转化DH5α扩增,大提制备质粒。按照日本Takara公司酶切体系,对pCANTAB5E-2sfi1质粒和scFv片段分别进行Sfi1酶切处理,酶切反应如下表2-6所示。充分混匀,放置50℃水浴锅中,酶切2 h。pCANTAB5E-2sfi1质粒酶切结束后经1.2%琼脂糖凝胶电泳观察酶切结果,结果如图6,使用OMEGA公司胶回收试剂盒回收产物。使用YEASENT4连接酶,将酶切处理的scFv基因片段和pCANTAB5E-2sfi1质粒,按表2-7中连接反应体系,20℃连接2h。
表2-6酶切反应体系
表2-7酶连体系
1.4连接产物转化感受态TG1和库容及重组率测定
取TG1感受态细胞放置冰上融化后,加入1μl pCANTAB5E-2sfi1-scFv连接产物后轻轻混匀,沿管壁加入冰浴的电转杯中,放置5-10min后置于电转仪中,设置电压2.5kv,电击恒压时间5.0ms左右,电转化后立即加入1ml预热的SOC液体培养基重悬,经37℃摇床震荡活化培养1h。本次实验转化平行操作20管,每1μl电转一次,共转化20次,共获得20ml转化后感受态细胞。
转化复苏培养之后的菌液混合后取出100μl,10倍梯度稀释法进行稀释后取100μl涂在2×YT-C(含50mg/ml Carb)平板,37℃恒温培养箱倒置过夜计算库容,连接产物转化结果如图7。次日,取稀释平板中单菌落分散良好的平板挑取50个单菌落于2×YT-C(含50mg/ml Carb)液体培养基中,37℃,200rpm/min震荡培养过夜。50个扩大培养的单菌落各取1μl菌液作为模板,按照scFv基因拼接PCR体系进行菌液PCR,PCR产物跑电泳后于凝胶成像仪中分析结果,计算抗体库的重组率,PCR鉴定结果如图8。
计算公式:库容=单菌落数量×稀释倍数×总体积(公式1-1)
重组率(%)=阳性克隆/挑取单克隆个数(公式1-2)。
1.5噬菌体scFv抗体库的构建
1.5.1辅助噬菌体毒种制备
取过夜培养的TG1菌液按照1:100的比例接种于5ml SOB培养基中,37℃,200rpm/min震荡培养到OD600达0.4-0.6后加入5μl的M13KO7 helper phage,37℃,200rpm/min震荡培养1h后再加入5μl卡那霉素(50mg/ml),37℃,200rpm/min摇床培养1h。将培养好的菌液转接到100ml 2×YT液体培养基,加入卡那霉素(50mg/ml)至终浓度50μg/ml,37℃,200rpm/min过夜培养。次日,将过夜培养的菌液分装到50ml离心管中,4℃,12000rpm/min,离心20min,将上清转移至高温灭菌的500ml锥形瓶,加入为初始菌液1/5体积PEG/NaCl,本次操作加入体积为20ml,混匀之后分装到新的50ml离心管,冰上沉析2h后4℃,12000rpm/min,离心10min弃掉上清,用2ml(1/50体积)的1×PBS重悬沉淀,转移至无菌离心管中,再次12000rpm/min,4℃,离心5min小心取上清,用0.22μM滤膜过滤除菌,加入最终浓度50%甘油,分装到无菌离心管中,-20℃保存。
1.5.2辅助噬菌体毒种滴定
将制备好的噬菌体液用1% BSA(in 1×PBS)作稀释液进行10倍梯度稀释,取稀释倍数10
1.5.3初级噬菌体抗体库的构建
取转化保存的剩余培养物20ml加入到380ml 2×YT-C(25μg/ml Carb)培养基中37℃、200rpm摇床培养1h,加入Carb至终浓度50μg/ml,继续培养1h。按照感染复数moi=20:1加入辅助噬菌体M13KO7 10μl于上述培养物中,先于37℃、60rpm轻摇30min利于噬菌体侵染,再放置摇床震荡培养30min。将培养液在无菌超净台内转移至灭菌的离心管中,5000rpm离心15min,小心去上清。无菌条件下用400ml 2×YT-CK(50mg/ml Carb和50mg/ml Kan)培养基重悬细菌沉淀,震荡培养过夜。次日,将过夜的菌液全部转入无菌50ml离心管中,12000rpm 4℃离心20min。
将上清转移至新的无菌锥型瓶中,加入为初始菌液1/5体积的PEG-NaCl(80ml),冰上静置1h沉析。12000rpm、4℃离心20min后去除上清,离心管倒扣2-5min,尽可能去除多余液体。用1/50起始菌液体积的1% BSA(in 1×PBS)重悬沉淀,转至1.5ml无菌管,12000rpm离心5min,去除沉淀,上清转移至新的1.5ml无菌管,上清即为初级抗体库,加甘油至50%于-20℃保存。测定重组噬菌体的滴度,方法同1.5.2。
实施案例2噬菌体抗体库筛选
2.1酶标板筛选法特异性抗体的筛选
将10μg/ml的Protein A蛋白加入酶标孔板,每轮2个孔,每个孔100μL,4℃,包被过夜;去除96孔板里的包被液,每孔加入200μL的5%BSA,同时设置空白对照,空白孔直接加入200μL 5%BSA作为封闭液,室温下,在摇床上孵育2h;倒扣去除BSA封闭液,用200μL PBST清洗10次后,往抗原孔和BSA对照孔中加入100μL的噬菌体抗体库,室温下,在摇床上孵育2h;弃除抗体库液体,每孔加入200μL PBST,清洗10次,拍干;向孔中各加入100μL 100mM HCl,室温孵育5min后将产物洗脱下来加入40μL的1M Tris-HCl中和,混匀;将获得的洗脱产物各加入到含1mL TG1(OD600=0.4-0.6)细菌培养液中,37℃,220rpm,孵育1h后,各取液体20μL进行适宜倍数的稀释,并在含有Carb抗性的LB固体平板上进行滴度实验后,置于37℃孵育过夜;再分别加入1μL辅助噬菌体于蛋白管的EP管中(保证终浓度为10
表3-1 4轮筛选条件
表3-2 4轮筛选结果
2.2 Gator Prime检测IgY抗体亲和力
取纯化后的IgY抗体,用Gator Prime检测抗体的亲和力,具体操作如下:将Protein A抗原用生物素标记后过夜透析并检测其浓度。用SA探针先固化biotin-ProteinA,然后分别与制备好的裂解液结合。应用与ELISA试剂盒的2个阳性单克隆抗体的亲和力检测结果如图3和图4所示。
实施案例3 IgY抗体的顺转表达和纯化鉴定
以上13个阳性噬菌体克隆送测序。获得scFv基因序列后使用NCBI BLAST中的Immunoglobulin BLAST和Nucleotide.nucleotide BLAST分析软件,分析出CDR1,CDR2,CDR3区域(Numbering Scheme:Kabat)。根据scFv测序结果,构建成IgY表达载体。进行顺转表达和纯化,步骤如下:
3.1转染前细胞培养及准备
1)将HEK-293细胞置于5%的CO
2)在细胞瞬时转染前需确定其细胞密度及存活率。为确保转染效果,建议使用生长处于指数期(密度约为3-6×10
3)细胞无需离心,若细胞密度为4×10
4)摇瓶置于5%的CO2恒温摇床中,37℃、120rpm恒温震荡培养10min后开始转染。
3.2瞬时转染
1)准备两支15ml无菌离心管,在其中一支中加入5ml CD05培养基和250μg无菌质粒DNA,轻轻吹打混匀;取另一支离心管,加入5ml CD05培养基和750μl PEI转染试剂,轻轻吹打混匀;
2)将含有转染试剂的离心管中所有液体转移至含质粒的离心管中吹打混匀;
3)室温下静置10分钟制备出质粒-载体复合物;
4)从恒温摇床中取出细胞,边摇边加入制备好的质粒-载体复合物,放回CO
3.3产物表达与检测
1)瞬时转染CD05 profeed补料培养基可提高产物的表达量,在转染24小时后添加一次;
2)转染后第5天测定产物表达量;
3)IgY的重组蛋白的表达量在转染后第5天左右达到最高值,收取上清。
3.4 Anti ProteinA IgY纯化
1)瞬转后发酵液4000g离心取上清,0.45um滤膜过滤;
2)安装层析空柱,添加1ml ProteinA填料;
3)超纯水冲洗填料10CV,PBS平衡填料10CV;
4)过滤后上清上样,控制流速1ml/min;
5)PBS平衡10CV;
6)使用0.1M Gly洗脱15CV,加1/10 1M Tris(pH 8.5)中和洗脱液。
Nanodrop OD280测蛋白浓度,IgY-6,IgY-14,IgY-27,IgY-33,IgY-34,IgY-53,IgY-66,IgY-71,IgY-80,IgY-81,IgY-91,IgY-94,IgY-95的量分别为0.72mg,0.061mg,0.13mg,0.92mg,0.47mg,0.055mg。IgY的纯化结果如图9。将IgY抗体稀释到1μg/ml后二倍梯度稀释,Protein A包板,BSA封闭,对IgY稀释样本进行检测,二抗使用HRP标记的抗IgY抗体,BSA包被和封闭作对照。ELISA结果如下表所示,13个IgY均与Protein A结合,与BSA对照不结合。
表1-10 ELISA结果
实施案例4最终筛选到的2株IgY抗体配对形成免疫试剂盒
基于ELISA实验原理的配对实验过程如下:
4.1包被:包被抗体IgY-81保存于PBS溶液中,含50%甘油,-20℃储存。取适量抗体用PBS稀释至1ug/mL,每孔包被100ul,4度摇床100rpm过夜(16h)。包被过夜后PBST洗涤3次(每孔200ul)。
4.2封闭:使用1% BSA封闭,200μL/孔,37°反应2h,封闭后PBST洗涤3次(每孔200ul);
标准品加样及孵育:加入标准品Protein A(用PBS配制成500、250、125、62.5、31.25、15.625、7.8125pg/mL),100μL/孔,每个标准品浓度梯度两个复孔,37℃孵育1h。孵育完成后PBST洗涤5次(每孔200ul)。
4.3Biotin--conjugated检测抗体孵育:将预先配制至工作浓度(12.5ng/mL)的检测抗体IgY-80(用PBS配制)加入酶标板中,100μL/孔,37℃孵育1h。孵育完成后PBST洗涤5次(每孔200ul)。
4.4HRP-conjugated Streptavidin孵育:将预先配制至工作浓度的偶联HRP亲和素(用PBS配制,10000倍稀释)加入酶标板中,100μL/孔,37℃孵育40min。孵育完成后PBST洗涤7次(每孔200ul)。
4.5显色:显色前10min将底物液TMB恢复至室温,100μL/孔,37℃避光15min。
4.6终止:每孔加入50μL终止液(0.5mol/L硫酸)。
4.7读数:10分钟内读取450/630nm的双波长吸收值。
经配对后,选出IgY-80和IgY-81作为ELISA试剂盒原料,最终标准曲线如图10中所示。结果显示该对抗体对于ProteinA蛋白的检测灵敏度极高。
- Benzonase免疫噬菌体展示抗体库的构建方法、单克隆抗体、编码基因和试剂盒
- 噬菌体抗体库的构建方法及应用此库筛选到的抗CD6抗体
