一株高产β-葡聚糖酶的黑曲霉诱变菌株及其选育方法和应用
文献发布时间:2024-01-17 01:26:37
技术领域
本发明涉及微生物技术技术领域,具体为一株高产β-葡聚糖酶的黑曲霉诱变菌株及其选育方法和应用。
背景技术
β-葡聚糖是一类非淀粉性多糖,广泛存在于植物和微生物细胞壁中,是葡萄糖以β-1,3和β-1,4糖苷键连接而成的D型葡萄糖聚合物。其次β-葡聚糖是一类重要的抗营养因子,不能被单胃动物自身分泌的消化酶水解。β-葡聚糖分子量比较大,分为水溶性和水不溶性两种,水溶性β-葡聚糖遇水溶胀形成高黏度溶液,是胃肠道食糜黏度增加,阻碍营养物质的释放和扩散,降低消化酶活性,降低营养物质的消化和吸收。
β-葡聚糖酶是一类降解谷物中β-葡聚糖的水解酶的总称,β-葡聚糖酶的应用广泛,能够用于啤酒行业,主要作用是使啤酒更澄清;在饲料行业也拥有着重要的作用,在饲料中添加β-葡聚糖酶可以降解β-葡聚糖,消除其抗营养因子作用。另外该酶可以降低消化道内容物黏度、破坏细胞壁结构、改善肠道菌群结构、提高内源酶活性、促进营养物质的吸收;在植物中作为抗菌诱导剂抵御真菌病害等,因此在食品、饲料、农业、生物技术等领域具有广泛的应用前景。而现在国内外主要利用微生物发酵生产β-葡聚糖酶,由于筛选得到的产β-葡聚糖酶菌株酶活较低,故有不少研究者在致力于筛选和培养新的产酶菌株,期望筛选出产酶活高的β-葡聚糖酶菌株,本发明即提供了一株可高产β-葡聚糖酶的黑曲霉菌株,以满足工业生产需求,降低生产成本。
发明内容
鉴于现有技术中的上述缺陷或不足,本申请旨在提供一株高产β-葡聚糖酶的黑曲霉诱变菌株,该菌株分类学命名为Aspergillussp.HL-4。
一株高产β-葡聚糖酶的黑曲霉诱变菌株的选育方法,该选育方法包括以下步骤:
步骤一、将实验室保藏菌株黑曲霉从-80℃拿出活化培养在PDA固体培养基上,培养3d,用适量的无菌生理盐水洗下活化后新鲜的黑曲霉菌株,置于已灭菌的含有玻璃珠的锥形瓶中充分震荡,使孢子充分打散,取无菌的六层纱布过滤除去菌丝,得到孢子悬液,利用血球计数板在显微镜上观察,计算孢子个数,用无菌生理盐水稀释,致使最终的孢子悬液浓度为1.0×10
步骤二、将步骤一得到的孢子悬液放在15W紫外灯下距离25cm处搅拌照射1-10min,于红灯下,分别取1ml置于装有无菌生理盐水的试管中,进行梯度稀释,吸取100μL涂布于初筛选培养基平板上,在28℃培养箱中避光培养48h;
步骤三、将步骤二中初筛培养基上长出的菌株,用平板划线法分离纯化菌株;采用点接法将纯种菌株接种在初筛培养基平板上,待菌株长出后,用刚果红溶液对菌株进行染色,再用无菌生理盐水溶液进行洗脱,观察菌株是否有透明圈,测量产生透明圈的菌株直径(Dc)和透明圈直径(Dp),计算Dp/Dc比值,选择透明圈比值最大的几株,转接到PDA固体培养基中,28℃培养3d;用无菌生理盐水洗下孢子,倾入装有玻璃珠的无菌锥形瓶中充分振荡,使孢子充分打散,用无菌的六层纱布过滤除去菌丝,得到孢子悬液,利用血球计数板在显微镜上观察,计数,使孢子悬液浓度为1.0×10
步骤四、对诱变复筛得到的黑曲霉诱变菌株进行固态发酵工艺优化。
优选的,所述PDA固体培养基成分为:土豆200g/L,葡萄糖20g/L,琼脂20g/L,115℃灭菌30min。
优选的,步骤二所述的初筛固体培养基成分为:酵母膏2g/L,(NH
优选的,步骤三所述的固态发酵培养基成分为:麸皮18.97g,豆粕粉2.71g,(NH
优选的,步骤四所述的固态发酵培养基为:固态发酵培养基成分:以麸皮、花生壳粉、大麦粉、复合碳源(麸皮+花生壳粉+大麦粉、麸皮+大麦粉)等为供试碳源,以豆粕粉、酵母粉、硫酸铵、硝酸钠、硝酸铵作为氮源,以K+、Na+、Mg2+为金属离子,其中以麸皮和豆粕粉为固体基质,碳源添加量为14.97g、16.97g、18.97g、20.97g、22.97g。
优选的,步骤四所述的固态发酵条件如下:培养温度为25-33℃,培养PH为6.0-8.5,接种方式菌球和孢子,接种量2%-10%,装料量25-60g,发酵时长70h。
优选的,高产β-葡聚糖酶的黑曲霉诱变菌株的选育方法得到的β-葡聚糖酶可在食品、饲料行业中应用。
有益效果:该高产β-葡聚糖酶的黑曲霉诱变菌株及其选育方法和应用,本发明采用紫外诱变技术和刚果红染色法筛选出产β-葡聚糖酶的黑曲霉诱变菌株,其黑曲霉诱变菌株可广泛应用β-葡聚糖酶的生产,具有广泛的应用前景。而采用紫外诱变技术可有效的提高突变率,降低成本。本发明采用固态发酵培养菌株,产生的β-葡聚糖酶酶系丰富,酶活性高,其操作过程简便、能耗低,微生物易生长,不易产生大面积的污染等优点。
附图说明
通过阅读参照以下附图所作的对非限制性实施例所作的详细描述,本申请的其它特征、目的和优点将会变得更明显:
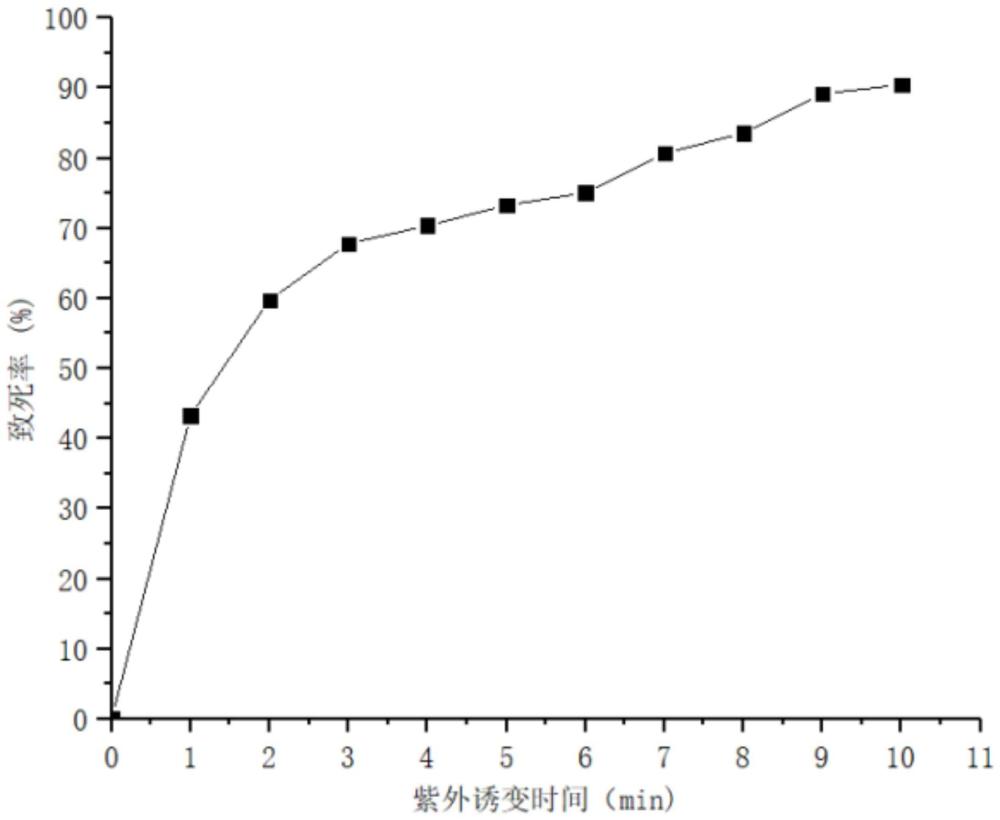
图1为紫外诱变致死率曲线;在图1中,横坐标为紫外照射时间,纵坐标为致死率;
图2经过刚果红染色产生透明圈的所筛菌株HL-4示意图;
图3为光学显微镜观察的CM96、HL-4示意图;
图4为扫描电镜观察的CM96、HL-4示意图;
图5为诱变菌株与原始菌株酶活力对比图,在图5中,横坐标为诱变菌株,纵坐标为β-葡聚糖酶活力;
图6为不同固体基质对黑曲霉诱变菌株产β-葡聚糖酶的影响曲线,在图6中,横坐标为碳源种类,纵坐标为β-葡聚糖酶活力;
图7为碳源添加量对黑曲霉诱变菌株产β-葡聚糖酶的影响曲线,在图7中,横坐标为碳源添加量,纵坐标为β-葡聚糖酶活力。
具体实施方式
下面结合附图和实施例对本申请作进一步的详细说明。可以理解的是,此处所描述的具体实施例仅用于解释相关发明,而非对该发明的限定。另外还需要说明的是,为了便于描述,附图中仅示出了与发明相关的部分。
本发明实施例中的附图:图中不同株类的剖面线不是按照国标进行标注的,也不对元件的材料进行要求,是对图中元件的剖视图进行区分。
请参阅图1-7,一株高产β-葡聚糖酶的黑曲霉诱变菌株该菌株分类学命名为Aspergillussp.HL-4;
一株高产β-葡聚糖酶的黑曲霉诱变菌株的选育方法,该选育方法包括以下步骤:
步骤一、将实验室保藏菌株黑曲霉从-80℃拿出活化培养在PDA固体培养基上,培养3d,用适量的无菌生理盐水洗下活化后新鲜的黑曲霉菌株,置于已灭菌的含有玻璃珠的锥形瓶中充分震荡,使孢子充分打散,取无菌的六层纱布过滤除去菌丝,得到孢子悬液,利用血球计数板在显微镜上观察,计算孢子个数,用无菌生理盐水稀释,致使最终的孢子悬液浓度为1.0×10
步骤二、将步骤一得到的孢子悬液放在15W紫外灯下距离25cm处搅拌照射1-10min,于红灯下,分别取1ml置于装有无菌生理盐水的试管中,进行梯度稀释,吸取100μL涂布于初筛选培养基平板上,在28℃培养箱中避光培养48h;
步骤三、将步骤二中初筛培养基上长出的菌株,用平板划线法分离纯化菌株;采用点接法将纯种菌株接种在初筛培养基平板上,待菌株长出后,用刚果红溶液对菌株进行染色,再用无菌生理盐水溶液进行洗脱,观察菌株是否有透明圈,测量产生透明圈的菌株直径(Dc)和透明圈直径(Dp),计算Dp/Dc比值,选择透明圈比值最大的几株,转接到PDA固体培养基中,28℃培养3d;用无菌生理盐水洗下孢子,倾入装有玻璃珠的无菌锥形瓶中充分振荡,使孢子充分打散,用无菌的六层纱布过滤除去菌丝,得到孢子悬液,利用血球计数板在显微镜上观察,计数,使孢子悬液浓度为1.0×10
步骤四、对诱变复筛得到的黑曲霉诱变菌株进行固态发酵工艺优化。
其中,PDA固体培养基成分为:土豆200g/L,葡萄糖20g/L,琼脂20g/L,115℃灭菌30min。
其中,步骤二所述的初筛固体培养基成分为:酵母膏2g/L,(NH
其中,步骤三所述的固态发酵培养基成分为:麸皮18.97g,豆粕粉2.71g,(NH
优选的,步骤四所述的固态发酵培养基为:固态发酵培养基成分:以麸皮、花生壳粉、大麦粉、复合碳源(麸皮+花生壳粉+大麦粉、麸皮+大麦粉)等为供试碳源,以豆粕粉、酵母粉、硫酸铵、硝酸钠、硝酸铵作为氮源,以K+、Na+、Mg2+为金属离子,其中以麸皮和豆粕粉为固体基质,碳源添加量为14.97g、16.97g、18.97g、20.97g、22.97g。
其中,步骤四所述的固态发酵条件如下:培养温度为25-33℃,培养PH为6.0-8.5,接种方式菌球和孢子,接种量2%-10%,装料量25-60g,发酵时长70h。
其中,高产β-葡聚糖酶的黑曲霉诱变菌株的选育方法得到的β-葡聚糖酶可在食品、饲料行业中应用。
实施例1
高产β-葡聚糖酶的黑曲霉诱变菌株的选育
(1)将实验室保藏菌株黑曲霉从-80℃拿出活化培养在PDA固体培养基上,培养3d,用适量的无菌生理盐水洗下活化后新鲜的黑曲霉菌株,置于已灭菌的含有玻璃珠的锥形瓶中充分震荡,使孢子充分打散。取无菌的六层纱布过滤除去菌丝,得到孢子悬液。利用血球计数板在显微镜上观察,计算孢子个数,用无菌的生理盐水稀释,致使最终的孢子悬液浓度为1.0×10
其中,PDA固体培养基成分:土豆200g/L,葡萄糖20g/L,琼脂20g/L,115℃灭菌30min;
(2)将步骤(1)得到的孢子悬液放在15W紫外灯下距离25cm处搅拌照射1-10min,于红灯下,分别取1ml置于装有无菌生理盐水的试管中,进行梯度稀释,吸取100μL涂布于初筛培养基平板上,在28℃培养箱中避光培养48h,计算致死率并绘制致死率曲线如图1所示。由图1可以看出,当紫外灯照射7min时,致死率达到80.7%,据报道当致死率达到80%左右时,正突变率较高。
即初筛培养基成分:酵母膏2g/L,β-葡聚糖10g/L,(NH
(3)将步骤(2)中初筛培养基上致死率达到80%的菌株,用平板划线法分离纯化菌株;采用点接法将纯种菌株接种在初筛培养基平板上,待菌株长出后,用刚果红溶液对菌株进行染色,再用无菌生理盐水溶液进行洗脱,观察菌株是否有透明圈,测量产生透明圈的菌株直径(Dc)和透明圈直径(Dp),计算Dp/Dc比值,选择透明圈比值最大的几株进行复筛,转接到PDA固体培养基中,28℃培养3d;用无菌生理盐水洗下孢子,倾入装有玻璃珠的无菌锥形瓶中充分振荡,使孢子充分打散,用无菌的六层纱布过滤除去菌丝,得到孢子悬液。利用血球计数板在显微镜上观察,计数,使孢子悬液浓度为1.0×10
其中,固态发酵培养基成分:麸皮18.97g,豆粕粉2.71g,(NH
(4)对诱变得到的黑曲霉诱变菌株进行固态发酵。测定各诱变菌株的β-葡聚糖酶的酶活力,选取酶活力相对原始菌株最高的诱变菌株为最终的目的菌株Aspergillussp.HL-4。从生长状况对比原始菌株CM96,诱变菌株HL-4生长速度比较慢且产孢子速度较慢。如图3所示,诱变菌株HL-4的菌丝更长,孢子更小更圆。由图4可以看出,两株菌的孢子均呈球状,但原始菌株CM96孢子表面有许多褶皱及突刺,而HL-4孢子表面褶皱变少,突刺消失。
实施例2
β-葡聚糖酶的酶活力测定
(1)粗酶液提取
取出恒温培养箱中已培养70h含β-葡聚糖酶的基质,称取烘干粉碎的β-葡聚糖酶发酵基质1g于容量瓶中加入缓冲液定容到50mL,摇床摇30min,4℃条件下避光浸提3h,摇匀,于3000r/min离心3min,上清液即为粗酶液。
(2)测定步骤
试样空白溶液:量取试样溶液2.00mL,置于具塞刻度试管中,37℃水浴中平衡10min。加人DNS试剂5.0mL,涡旋3s后加入β-葡聚糖溶液2.0mL,于37℃水浴保温30min。加入0.2mg/mL葡萄糖标准溶液1.00mL,混匀,置于沸水浴中反应5min。冷却至室温,加水定容至25mL摇匀。在540nm波长处测定吸光度值,用标准曲线回归方程计算试样空白反应溶液上机浓度C
试样溶液:以β-葡聚糖为底物测定β-葡聚糖酶各诱变菌株的酶活力。量取试样溶液2.00mL,置于具塞刻度试管中,37℃水浴中平衡10min。加入β-葡聚糖溶液2.0mL,涡旋3s后37℃保温30min,加DNS试剂5.0ml,涡旋3s,以终止酶解反应。加入0.2mg/mL葡萄糖标准溶液1.00mL,混匀,置于沸水浴中反应5min,冷却至室温加水定容至25ml,摇匀。以试剂空白溶液为空白对照,在540nm波长处测定吸光度值,用标准曲线回归方程计算试样反应溶液上机浓度C。
β-葡聚糖酶活力单位定义:在37℃,PH为5.5的条件下,每分钟从浓度为4mg/mL的β-葡聚糖溶液中降解释放1μmol还原糖所需要的酶量为1个β-葡聚糖酶活力单位,以U表示。
将各诱变菌株接种到固态发酵培养基中,接种量2mL孢子悬液,28℃培养70h,用DNS法测定诱变菌株和原始黑曲霉CM96的酶活,如图5所示,原始菌株的β-葡聚糖酶酶活力为2799.81U/g,经紫外诱变后酶活力为3341.29U/g,相比于原始菌株酶活提高了19.3%。
实施例3
β-葡聚糖酶发酵工艺的优化
(1)碳源种类及添加量对黑曲霉产β-葡聚糖酶的影响
以麸皮、花生壳粉、大麦粉、复合碳源(麸皮+花生壳粉+大麦粉、麸皮+大麦粉)等为供试碳源,28℃固态发酵70h,测定诱变菌株β-葡聚糖酶酶活力,结果如图6所示。由图6可以看出,当以麸皮为碳源时效果最佳,其次是复合碳源(麸皮+花生壳粉+大麦粉)、麸皮+大麦粉为碳源培养基时,其β-葡聚糖酶酶活力较高,大麦粉为碳源培养基时酶活力最差。因此选择麸皮作为碳源;
为进一步确定碳源添加量对β-葡聚糖酶的影响,选取添加量为14.97g、16.97g、18.97g、20.97g、22.97g进行试验,28℃固态发酵70h,测定β-葡聚糖酶酶活力,结果如图7所示,由图7可以看出,当麸皮添加量为20.97g时β-葡聚糖酶酶活力为最大值。因此,选择麸皮的添加量为20.97g;
本发明提供的突变菌株黑曲霉HL-4可广泛应用于β-葡聚糖酶的生产,能显著的降低该酶的生产成本,提高产量,有利于促进该酶在食品、饲料等行业的应用;
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本申请。
以上描述仅为本申请的较佳实施例以及对所运用技术原理的说明。本领域技术人员应当理解,本申请中所涉及的发明范围,并不限于上述技术特征的特定组合而成的技术方案,同时也应涵盖在不脱离所述发明构思的情况下,由上述技术特征或其等同特征进行任意组合而形成的其它技术方案。例如上述特征与本申请中公开的(但不限于)具有类似功能的技术特征进行互相替换而形成的技术方案。
- 一株高产α-半乳糖苷酶的黑曲霉诱变菌株及其选育方法和应用
- 一株高产耐高温酸性β-葡聚糖酶的菌株及其应用
