同种型选择性抗TGF-β抗体及使用方法
文献发布时间:2024-04-18 20:00:50
本申请是申请日为2021年03月18日、申请号为202180021223.4、发明名称为“同种型选择性抗TGF-β抗体及使用方法”的发明专利申请的分案申请。
相关专利申请的交叉引用
本申请要求2020年6月26日提交的美国临时申请号63/044,478和2020年3月19日提交的美国临时申请号62/991,806的优先权权益,这些临时申请的公开内容通过引用方式整体并入本文。
序列表
本申请含有序列表,所述序列表已经以ASCII格式以电子方式提交并且以全文引用的方式并入本文中。所述ASCII副本创建于2021年3月16日,命名为P35791-WO_SEQUENCE_LISTING,并且大小为492,334个字节。
技术领域
本发明涉及同种型选择性抗TGFβ抗体(例如,单特异性抗TGFβ2和抗TGFβ3抗体,以及双特异性抗TGFβ2/3抗体)及其使用方法,例如,用于治疗TGFβ相关疾病。
背景技术
TGFβ包含三种细胞因子的多效性组:TGFβ1、TGFβ2和TGFβ3,它们在细胞分化、组织发育、伤口修复、免疫调节以及失调时的组织纤维化中起关键作用。对于间质性肺疾病(ILD)诸如特发性肺纤维化(IPF),TGFβ活性与疾病发病机制的多个方面有关。IPF的遗传风险是由肺上皮细胞中表达的基因突变赋予的,这些突变增加了肺上皮细胞对损伤的易感性且/或损害它们的再生能力。这种上皮应激或损害可以活化先天免疫细胞诸如肺泡巨噬细胞,以产生细胞因子,该细胞因子活化间充质细胞以通过增殖、迁移、分化成肌成纤维细胞和分泌细胞外基质(ECM)来启动伤口愈合应答。TGFβ可以促成许多这些过程;特别是,它已被证明可促进肺上皮细胞的凋亡,同时促进肌成纤维细胞的活化、分化和生成。全身性硬化症(SSc)/硬皮病是一种自身免疫性疾病,其始于微血管炎症,发展为涉及皮肤、肺、心、肾和肠中组织的多器官结缔组织功能障碍。TGFβ牵涉到SSc中血管、结缔组织和免疫成分的调解异常中(Lafyatis R.Nat Rev Rheumatol.2014Dec;10(12):706-19)。
TGFβ信号传导也在癌症发病机制中发挥作用,特别是在肿瘤周围基质和免疫区室中,在该处它可以通过促进过量ECM产生(防止T细胞浸润到肿瘤组织内)并通过促进T调节细胞分化和活化(可抑制抗肿瘤免疫性)来抑制生产性抗肿瘤免疫应答。总之,这些发现暗示TGFβ作为纤维化疾病和癌症的潜在治疗靶标。然而,TGFβ的多种稳态功能和TGFβ活化的环境依赖性机制的复杂性导致以下方面的限制:建立TGFβ抑制剂在人类纤维化疾患中的介入研究中的有利治疗指数的安全性和有效性。例如,泛TGFβ抑制剂与不期望的安全信号有关。特别是,小分子ALK5抑制剂AZ12601011和AZ12799734(Anderton等人(2011)Toxicologic Pathology,39:916-924)引起大鼠心脏瓣膜显微病灶,而泛TGFβ1D11抗体(Lonning等人(2011)Current Pharmaceutical Biotechnology,12,2176-2189)引起用1D11治疗的小鼠发展出组织学病灶、体重减轻、非肿瘤性囊性上皮增生和舌头炎症、牙齿发育不良以及牙龈和食管的上皮增生。此外,主要对TGFβ1具有选择性的抗体CAT-192(美替木单抗(metelimumab))具有高严重不良事件发生率:在SSc的1至2期研究中观察到多处胃出血(Denton A&R 56:323(2007))。
因此,本领域仍然需要靶向TGFβ的安全且有效的分子。本发明提供此类分子和相关用途。
发明内容
本发明提供同种型选择性抗TGFβ抗体及其使用方法。
在一方面,提供一种分离的抗TGFβ3抗体,其中该抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ IDNO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列。在一些方面,该抗体选择性地中和TGFβ3。
在另一方面,提供一种分离的抗TGFβ3抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并且抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;(d)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;(e)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
在另一方面,提供一种分离的抗TGFβ3抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并且抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;(d)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;(e)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:23、37和42至50所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的重链可变区(VH)氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ ID NO:23、37和42至50所组成的组的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:29、59、64和65至72所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整重(H)链氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ IDNO:29、59、64和65至72所组成的组的完整重(H)链氨基酸序列。在进一步的方面,抗TGFβ3抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的轻链可变区(VL)氨基酸序列。在又其他方面,抗TGFβ3抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整轻(L)链氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。在一些方面,抗TGFβ3抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ IDNO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ IDNO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9)。在一些方面,抗TGFβ3抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)。在一些方面,抗TGFβ3抗体包含SEQ ID NO:22的VL,该WL包含选自由以下项所组成的组的一个或多个框架修饰:4L或4M、38H或38Q、43A或43Q和58V。在一些方面,抗TGFβ3抗体VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4),其中突变是相对于具有SEQ ID NO:22的大鼠2A10 VL。在其他方面,抗TGFβ3抗体包含SEQID NO:23的VH,该VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;以及76N、78D或78L,78A或78V。在一些方面,抗TGFβ3抗体VH包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);(iii)FR2中的47W(h2A10.v1.5);(iv):FR2中的49G(h2A10.v1.6);(v)FR3中的78A(h2A10.v1.7);(vi)FR2中的47W(h2A10.v2.5);(vii)FR2中的49S(h2A10.v2.6);(viii)FR3中的73N(h2A10.v2.7);(ix)FR3中的76N(h2A10.v2.8);(x)FR3中的78L(h2A10.v2.9);和(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4),其中突变是相对于具有SEQ ID NO:23的大鼠2A10。
在上述抗TGFβ3抗体的某些实施例中,抗TGFβ3抗体的VL保留框架I中的位置4处的亮氨酸(L)和框架II的位置47处的亮氨酸(L)(相对于具有SEQ ID NO:22的大鼠2A10 VL)。在一些实施例中,该VH保留来自大鼠2A10的VH的框架III中的位置73处的D(相对于具有SEQID NO:23的大鼠2A10)。
在另一方面,提供一种分离的抗TGFβ3抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并且抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;(d)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;(e)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。在该实施例的一些方面,抗TGFβ3抗体包含与SEQ ID NO:52的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:52的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含与SEQ IDNO:74的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:74的完整H链氨基酸序列。在一些方面,抗TGFβ3包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。在一些方面,抗TGFβ3包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。在进一步的方面,抗TGFβ3抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:52/36的氨基酸序列。在一些方面,抗TGFβ3抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:74/58的氨基酸序列。
在另一方面,提供一种分离的抗TGFβ3抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并且抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;(d)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;(e)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。在一些方面,抗TGFβ3抗体包含与SEQ ID NO:51或55的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:51或55的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含与SEQID NO:73或77的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:73的完整H链氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:77的完整H链氨基酸序列。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。在一些方面,抗TGFβ3抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:51/36或SEQ ID NO:55/54的氨基酸序列。在一些方面,抗TGFβ3抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:73/58或SEQ ID NO:77/76的氨基酸序列。
在另一方面,提供一种分离的抗TGFβ3抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并且抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;(d)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;(e)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。在一些方面,抗TGFβ3抗体包含与SEQ ID NO:53或57的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:53的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:57的VH氨基酸序列。在一些方面,抗TGFβ3抗体包含与SEQ ID NO:75/79的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:75的完整H链氨基酸序列。在一些方面,抗TGFβ3抗体包含SEQ ID NO:79的完整H链氨基酸序列。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。在一些方面,抗TGFβ3抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。在一些方面,抗TGFβ3抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:53/36或SEQID NO:57/56的氨基酸序列。在一些方面,抗TGFβ3抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:75/58或SEQ ID NO:79/78的氨基酸序列。
在另一方面,提供一种抗TGFβ3抗体,该抗体包含:(a)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。
在另一方面,提供一种分离的抗TGFβ2/3抗体,其中该抗体选择性地中和TGFβ2和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)关于选择性中和,通过该抗体的抗原结合结构域与氨基酸残基E373 TGFβ2或TGFβ3(人TGFβ2编号)的直接接触,实现抗TGFβ2/3抗体相对于人TGFβ1对TGFβ2和TGFβ3的选择性;(b)抗TGFβ2/3抗体经由变构机制而中和TGFβ2和/或TGFβ3;(c)抗TGFβ2/3抗体诱导TGFβ2和/或TGFβ3同源二聚体中的构象变化;(d)抗TGFβ2/3抗体诱导TGFβ2和/或TGFβ3同源二聚体中的构象变化,其中该构象变化包括两个单体夹在一起几度;(e)抗TGFβ2/3抗体为二价抗体或单价抗体;(f)抗TGFβ2/3抗体包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;(g)抗TGFβ2/3抗体与TGFβ2同源二聚体特异性地结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,并且其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触(i)第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和(ii)第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(人TGFβ2编号);(h)如(g)中的抗TGFβ2/3抗体,其中该抗原结合结构域位于TGFβ2和/或TGFβ3氨基酸残基的5埃内;(i)其中抗TGFβ2/3抗体与如(g)中的TGFβ3上的相同表位特异性地结合;和(j)所述抗TGFβ2/3抗体不中和单价形式的TGFβ2和/或TGFβ3。在一方面,抗TGFβ2/3抗体包含与选自由SEQ ID NO:27、81、83、86至88、93至100和102至105所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2/3抗体包含选自由SEQ ID NO:27、81、83、86至88、93至100和102至105所组成的组的VH氨基酸序列。在一方面,抗TGFβ2/3抗体包含与选自由SEQ IDNO:33、107、109、112至114和119至130所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。在一方面,抗TGFβ2/3包含与选自由SEQ ID NO:26、80、82、84、85、89至92和101所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。在一方面,抗TGFβ2/3抗体包含选自由SEQ ID NO:26、80、82、84、85、89至92和101所组成的组的VL氨基酸序列。在一方面,抗TGFβ2/3抗体包含与选自由SEQ ID NO:32、106、108、110、111、115至118和186所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。在一方面,抗TGFβ2/3抗体包含选自由SEQ ID NO:32、106、108、110、111、115至118和186所组成的组的完整L链氨基酸序列。在一方面,抗TGFβ2/3抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:27/26(兔4A11)、SEQ ID NO:81/80(v1)、SEQ ID NO:81/82(v2)、SEQ ID NO:83/80(v3)、SEQ ID NO:83/82(v4)、SEQ ID NO:81/84(v5)、SEQ ID NO:81/85(v6)、SEQ ID NO:83/84(v7)、SEQ ID NO:86/84(v7/1)、SEQ ID NO:87/84(v7.2)、SEQID NO:88/84(v7.3)、SEQ ID NO:83/89(v7.4)、SEQ ID NO:83/90(v7.5)、SEQ ID NO:83/91(v7.6)、SEQ ID NO:83/92(v7.7)、SEQ ID NO:93/84(v7.8)、SEQ ID NO:94/84(v7.9)、SEQID NO:95/84(v7.10)、SEQ ID NO:96/84(v7.11)、SEQ ID NO:97/84(v7.12)、SEQ ID NO:98/84(v7.13)、SEQ ID NO:99/84(v7.14)、SEQ ID NO:100/84(v7.15)、SEQ ID NO:102/101(v7.16)、SEQ ID NO:103/101(v7.17)、SEQ ID NO:104/101(v7.18)、SEQ ID NO:105/101(v7.19)和SEQ ID NO:83/85(v8)。在一方面,抗TGFβ2/3抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:32/33(兔4A11)、SEQID NO:107/106(v1)、SEQ ID NO:107/108(v2)、SEQ ID NO:109/106(v3)、SEQ ID NO:109/108(v4)、SEQ ID NO:107/110(v5)、SEQ ID NO:107/111(v6)、SEQ ID NO:109/110(v7)、SEQID NO:112/110(v7.1)、SEQ ID NO:113/110(v7.2)、SEQ ID NO:114/110(v7.3)、SEQ IDNO:114/115(v7.4)、SEQ ID NO:114/116(v7.5)、SEQ ID NO:114/117(v7.6)、SEQ ID NO:114/118(v7.7)、SEQ ID NO:119/110(v7.8)、SEQ ID NO:120/110(v7.9)、SEQ ID NO:121/110(v7.10)、SEQ ID NO:122/110(v7.11)、SEQ ID NO:123/110(v7.12)、SEQ ID NO:124/110(v7.13)、SEQ ID NO:125/110(v7.14)、SEQ ID NO:126/110(v7.15)、SEQ ID NO:127/186(v7.16)、SEQ ID NO:128/186(v7.17)、SEQ ID NO:129/186(v7.18)、SEQ ID NO:130/186(v7.19)和SEQ ID NO:114/111(v8)。在一方面,抗TGFβ2/3抗体包含VL,该WL包含SEQ IDNO:26的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:2A或2I、4L、36F或36Y、43P或43A和58V或58I。在一方面,抗TGFβ2/3抗体VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2A和4L,和FR2中的36F(h4A11.v1和h4A11.v3);(ii)FR1中的2A和4L,和FR2中的36F和43P(h4A11.v2和h4A11.v4);(iii)FR1中的2A,FR2中的36F和43P,和FR3中的58V(h4A11.v5和h4A11.v7);(iv)FR1中的2A和4L,和FR2中的36F(h4A11.v6和h4A11.v8);(v)FR1中的2I(h4A11.v7.4);(vi)FR2中的36Y(h4A11.v7.5);(vii)FR2中的43A(h4A11.v7.6);(viii)FR3中的58I(h4A11.v7.7);和(ix)FR1中的2I,FR2中的43A,FR3中的58I(h4A11.v7.16-19),其中突变是相对于包含SEQ ID NO:26的氨基酸序列的VL。在一方面,抗TGFβ2/3抗体包含VH,该WH包含SEQ ID NO:27的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:缺失1E、2Q或2V、24V、37V或37I、48I、49G、67F或67V、71K或71V、73S或73T,缺失75K和76N、78V或78F、91F或91Y、105P或105Q。在一方面,抗TGFβ2/3抗体VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2Q和24V,FR2中的48I和49G,FR3中的71K、73S、78V和91F,和FR4中的105P(h4A11.v1、h4A11.v2、h4A11.v5、h4A11.v6);(ii)FR1中的2Q,FR2中的37V,FR3中的67F、71K、73S、78V和91F,和FR4中的105P(h4A11.v3、h4A11.v4、h4A11.v7、h4A11.v8);(iii)缺失FR1中的1E(h4A11.v7.1);(iv)缺失FR3中的75K和76N(h4A11.v7.2);(v)缺失FR1中的1E和FR3中的75K76N(h4A11.v7.3);(vi)FR1中的2V(h4A11.v7.8);(vi)FR2中的37I(h4A11.v7.9);(vii)FR3中的67V(h4A11.v7.10);(viii)FR3中的71V(h4A11.v7.11);(ix)FR3中的73T(h4A11.v7.12);(x)FR3中的78F(h4A11.v7.13);(xi)FR3中的91Y(h4A11.v7.14);(xii)FR4中的105Q(h4A11.v7.15);(xiii)FR1中的2V,FR2中的37I,FR3中的67V、73T、78F,FR4中的105Q((h4A11.v7.16);(xiv)FR1中的2V,FR2中的37I,FR3中的67V、73T、91Y,FR4中的105Q(h4A11.v7.17);(xv)FR1中的2V,FR2中的37I,FR3中的67V、73T,FR4中的105Q(h4A11.v7.18);和(xvi)FR1中的2V,FR2中的37I,FR3中的67V、73T、缺失75K和76N,FR4中的105Q(h4A11.v7.19),其中突变是相对于包含SEQ ID NO:27的氨基酸序列的VH。
在另一方面,提供一种分离的抗TGFβ2抗体,其中该抗体包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ IDNO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ IDNO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一方面,抗TGFβ2抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体:(a)具有相对于泛TGFβ抗体1D11减少的毒性;(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。在一方面,抗TGFβ2抗体包含与选自由SEQ IDNO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的VH氨基酸序列。在一方面,抗TGFβ2抗体包含与选自由SEQ ID NO:31、146和152至156所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:31、146和152至156所组成的组的完整H链氨基酸序列。在一方面,抗TGFβ2抗体包含与选自由SEQ ID NO:24、131、133至137、143和144所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。在另一方面,抗TGFβ2抗体包含选自由SEQ ID NO:24、131、133至137、143和144所组成的组的VL氨基酸序列。在一方面,抗TGFβ2抗体包含与选自由SEQ ID NO:30、145、147至151、157和158所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:30、145、147至151、157和158所组成的组的完整L链氨基酸序列。在一方面,抗TGFβ2抗体包含VH/VL对,该VH/VL对包含选自由以下项所组成的组的氨基酸序列:SEQ IDNO:25/24(兔6F12)、SEQ ID NO:132/131(v1)、SEQ ID NO:132/133(v1.1)、SEQ ID NO:132/134(v1.2)、SEQ ID NO:132/135(v1.3)、SEQ ID NO:132/136(v1.4)、SEQ ID NO:132/137(v1.5)、SEQ ID NO:138/131(v1.6)、SEQ ID NO:139/131(v1.7)、SEQ ID NO:140/131(v1.8)、SEQ ID NO:141/131(v1.9)、SEQ ID NO:142/131(v2)、SEQ ID NO:132/143(v3)和SEQ ID NO:142/144(v4)。在一方面,抗TGFβ2包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:31/30(兔6F12)、SEQ ID NO:146/145(v1)、SEQ ID NO:146/147(v1.1)、SEQ ID NO:146/148(v1.2)、SEQ ID NO:146/149(v1.3)、SEQ ID NO:146/150(v1.4)、SEQ ID NO:146/151(v1.5)、SEQ ID NO:152/145(v1.6)、SEQID NO:153/145(v1.7)、SEQ ID NO:154/145(v1.8)、SEQ ID NO:155/145(v1.9)、SEQ IDNO:156/145(v2)、SEQ ID NO:146/157(v3)和SEQ ID NO:156/158(v4)。在一方面,抗TGFβ2抗体包含VL,该WL包含SEQ ID NO:24的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:43S或43A、66G、69T、71F和87Y。在一方面,抗TGFβ2抗体VL包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的43S,和FR3中的66E、69P、71Y和87F(h6F12.v1和h6F12.v2);(ii)FR2中的43S,和FR3中的58V、66E、69P、71Y和87F(h6F12.v3和h6F12.v4);(iii)FR2中的43A(h6F12.v1.1);(iv)FR3中的66G(h6F12.v1.2);(v)FR3中的69T(h6F12.v1.3);(vi)FR3中的71F(h6F12.v1.4);和(vii)FR3中的87Y(h6F12.v1.5),其中突变是相对于与包含SEQ ID NO:24的氨基酸序列的VL。在一方面,抗TGFβ2抗体包含VH,该WH包含SEQ ID NO:25的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:37V或37I、48M或48L、49G或49A、67L、71K和78V、和105P或105R。在一方面,抗TGFβ2抗体VH包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(ii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(h6F12.v2和h6F12.v4);(iii)FR2中的37I(h6F12.v1.6);(iv)FR2中的48L(h6F12.v1.7);(v)FR2中的49A(h6F12.v1.8);(vi)FR4中的105R(h6F12.v1.9);(vii)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(viii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(6F12.v2和h6F12.v4);(ix)FR2中的37I(h6F12.v1.6);(x)FR2中的48L(h6F12.v1.7);(xi):FR2中的49A(h6F12.v1.8);和(xii)FR4中的105R(h6F12.v1.9),其中突变是相对于包含SEQ ID NO:25的氨基酸序列的VH。
在任何上述方面的某些实施例中,抗TGFβ3抗体和/或抗TGFβ2/3抗体与人TGFβ3特异性地结合。在任何上述方面的一些实施例中,抗TGFβ3抗体与未成熟和成熟形式的TGFβ3特异性地结合。在任何上述方面的一些实施例中,抗TGFβ2/3抗体和/或抗TGFβ2与人TGFβ2特异性地结合。在任何上述方面的一些实施例中,抗体为单克隆抗体。在任何上述方面的一些实施例中,抗体为人抗体、人源化抗体或嵌合抗体。在任何上述方面的一些实施例中,抗体为抗体片段。在任何上述方面的一些实施例中,抗体包含人Fc区,该Fc区为IgG1或IgG4同种型。在任何上述方面的一些实施例中,抗体包含人Fc区,该Fc区为IgG1同种型。在任何上述方面的一些实施例中,抗体的F区经修饰以去除效应子功能。在一些方面,Fc区包含修饰以去除氨基酸残基位置N297处的糖基化位点(如Kabat中的EU编号)。在一些方面,修饰为选自N297G或N297A的突变。在一些方面,修饰为突变N297G。在任何上述方面的一些实施例中,抗体具有约230至260μg/ml的Cmax和/或约15至16天的半衰期(t
还提供编码根据任何上述方面和实施例的抗体的分离的核酸,以及包含该核酸的宿主细胞。在一些方面,提供一种产生抗体的方法。该方法可以包括培养本文提供的宿主细胞以产生抗体。在一些方面,该方法进一步包括从宿主细胞回收抗体。还提供一种通过产生抗体的方法产生的抗体。
在另一方面,提供一种免疫缀合物,其包含抗体诸如如上所述的任何抗体以及细胞毒性剂。在一些实施例中,该抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在一些实施例中,该抗体为抗TGFβ2抗体,其中该抗体包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一些实施例中,该抗体为抗TGFβ2/3抗体,其包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
在另一个方面,提供一种药物制剂或免疫偶联物,其包含上述方面和实施例中任一项的抗体和药用载体。在一些实施例中,该抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在一些实施例中,该抗体为抗TGFβ2抗体,其中该抗体包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在该药物制剂或缀合物的一些实施例中,该抗体为抗TGFβ2/3抗体,其包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
在一些方面,该物制剂进一步包括另外的治疗剂。在一些方面,该另外的治疗剂选自由以下项所组成的组:吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂、JAK抑制剂、IL-11抑制剂和PTX2。
还提供一种根据任何上述方面和实施例的抗体,其用作药物。在一些实施例中,用作药物的抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一些实施例中,用作药物的抗体为抗TGFβ2/3抗体,其包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
还提供一种根据任何上述方面和实施例的抗体,其用于治疗TGFβ相关疾患。在一些实施例中,用于治疗TGFβ相关疾患的抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ IDNO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ IDNO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ IDNO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ IDNO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ IDNO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ IDNO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ IDNO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在一些实施例中,用于治疗TGFβ相关疾患的抗体为抗TGFβ2抗体,其中该抗体包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQID NO:21的氨基酸序列。在一些实施例中,用于治疗TGFβ相关疾患的抗体为抗TGFβ2/3抗体,其包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
在一方面,提供根据任何上述方面和实施例的抗TGFβ3抗体和根据任何上述方面和实施例的抗TGFβ2抗体,其用于联合治疗TGFβ相关疾患。在一个实施例中,用于此类联合的抗TGFβ3抗体包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ IDNO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ IDNO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在另一实施例中,抗TGFβ2抗体包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一方面,抗TGFβ2抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体:(a)具有相对于泛TGFβ抗体1D11减少的毒性;(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。在一方面,抗TGFβ2抗体包含与选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的VH氨基酸序列。
还提供根据任何上述方面和实施例的抗体,其用于制造药物,该药物用于治疗TGFβ相关疾患、用于抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成。在一个实施例中,用于此类药物的抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在另一实施例中,用于此类药物的抗体为抗TGFβ2抗体,其包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一方面,抗TGFβ2抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体:(a)具有相对于泛TGFβ抗体1D11减少的毒性;(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。在一方面,抗TGFβ2抗体包含与选自由SEQ IDNO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在另一方面,该抗体为抗TGFβ2/3抗体,其包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ IDNO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ IDNO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
在上述用于治疗TGFβ相关疾患的用途和药物的一些实施例中,TGFβ相关疾患为纤维化。在一些实施例中,该纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。在一些方面,纤维化为选自由以下项所组成的组的肺部纤维化:特发性肺纤维化(IPF)、特发性肺上叶纤维化(Amitani病)、家族性肺纤维化、肺纤维化(例如,继发于全身性炎症性疾病的肺纤维化,诸如类风湿性关节炎、硬皮病、狼疮、隐原性纤维性肺泡炎、慢性阻塞性肺病(COPD)或慢性哮喘)、囊性纤维化、非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、硬皮病/全身性硬化症(SSc,包括局限性皮肤(lcSSc)和弥漫性皮肤(dcSSc)形式和SSc相关间质性肺病(SSc-ILD))、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)、过敏性肺炎、肺动脉高压、肺结核、矽肺、石棉肺、急性肺损和急性呼吸窘迫(ARD,包括细菌性肺炎引起的、创伤引起的和病毒性肺炎引起的、呼吸机引起的、非肺脓毒症引起的)。在一些方面,纤维化为选自由以下项所组成的组的肝纤维化病症:肝硬化、先天性肝纤维化、肥胖、脂肪肝、酒精引起的肝纤维化、非酒精性脂肪性肝炎(NASH)、胆管损伤、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)、感染或病毒引起的肝纤维化(例如,慢性乙型和丙型肝炎病毒感染)、囊性纤维化、自身免疫性肝炎、坏死型肝炎、原发性硬化性胆管炎、血色素沉着病、胆道系统疾患和可归因于感染的肝功能障碍。在一些方面,纤维化为选自由以下项所组成的组的心和/或心包膜纤维化病症:心内膜心肌纤维化、心脏同种移植物血管病(CAV)、心肌梗塞、心房纤维化、充血性心力衰竭、动脉硬化、动脉粥样硬化、血管狭窄、心肌炎、充血性心肌病、冠状动脉梗塞、静脉曲张、冠状动脉狭窄和其他缺血后病症、和特发性腹膜后纤维化。在一些方面,纤维化为选自由以下项所组成的组的肾纤维化病症:肾小球性肾炎(包括膜增生性、弥漫性增生性、急进型或硬化性、感染后和慢性形式)、糖尿病性肾小球硬化、局灶性节段性肾小球硬化、IgA肾病、糖尿病性肾病、缺血性肾病、小管间质性肾纤维化、HIV相关肾病、膜肾病、继发于全身性炎症性疾病(诸如狼疮、硬皮病和糖尿病性肾小球性肾炎)的肾小球性肾炎、特发性膜增生性肾小球性肾炎、系膜增生性肾小球性肾炎、新月体性肾小球肾炎、淀粉样变性(其影响肾及其他组织)、自身免疫性肾炎、肾小管间质性纤维化、肾动脉硬化、Alport综合征、肾病综合征、慢性肾衰竭、慢性肾病、肾小球周围纤维化/无肾小管的肾小球、合并肺尖肺气肿和基底纤维化综合征(肺气肿/纤维化综合征)、肾小球高血压、肾原性纤维化皮肤病、多囊性肾病、法布里病和肾性高血压。在一些方面,纤维化为选自由以下项所组成的组的胰腺纤维化病症:基质重塑性胰腺炎和基质纤维化。在一些方面,纤维化为选自由以下项所组成的组的胃肠道纤维化病症:克罗恩病、溃疡性结肠炎、胶原性结肠炎、结直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎。在一些方面,纤维化为选自由以下项所组成的组的眼纤维化病症:眼睛纤维化、眼部纤维化、增生性玻璃体视网膜病、任何病因的玻璃体视网膜病、与视网膜功能障碍有关的纤维化、与湿性或干性黄斑变性有关的纤维化、角膜和结膜中的瘢痕、角膜内皮中的纤维化、前囊下白内障和后囊膜混浊、眼前段纤维化疾病、角膜基质纤维化(例如,与角膜混浊有关)、小梁网纤维化(例如,与青光眼有关)、眼后段纤维化疾病、纤维血管瘢痕(例如,在眼的视网膜或脉络膜血管系统中)、视网膜纤维化、视网膜前膜纤维化、视网膜胶质增生、视网膜下纤维化(例如,与年龄相关性黄斑变性有关)、糖尿病性视网膜病中的牵引性视网膜脱离伴组织收缩、先天性眼眶纤维化、泪腺纤维化、角膜上皮下纤维化和格雷夫眼病。在一些方面,纤维化选自源自脊髓损伤/纤维化或中枢神经系统纤维化诸如卒中后的纤维化、杜氏肌肉营养不良、与神经退行性疾患诸如阿尔茨海默病或多发性硬化有关的纤维化、血管再狭窄、子宫纤维化、子宫内膜异位症、卵巢纤维瘤、佩罗尼氏病、多囊性卵巢综合征、强制性脊柱炎中的疾病相关肺尖纤维化、瘢痕、和由微生物感染(例如,细菌、病毒、寄生虫、真菌)引起的纤维化。在一个特定实施例中,纤维化为SSc。在一个特定实施例中,纤维化为IPE。在一个特定实施例中,纤维化为慢性阻塞性肺病(COPD)。在一个特定实施例中,纤维化为进行性纤维化间质性肺病(PF-ILD)。在一个特定实施例中,PF-ILD为选自由以下项所组成的组的疾病或病症:非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、煤矿工人尘肺病的并发症、硬皮病/全身性硬化、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)和过敏性肺炎。在一个具体实施例中,纤维化为肝硬化或慢性肝纤维化。在一个具体实施例中,纤维化为胃肠道纤维化。在一个具体实施例中,纤维化为眼纤维化病症,源自脊髓损伤、纤维化或中枢神经系统纤维化的纤维化,或与神经退行性疾患有关的纤维化。
在另一方面,提供一种治疗患有TGFβ相关疾患的受试者的方法。在一些实施例中,该方法包括向有此需要的受试者施用有效量的根据任何上述方面和实施例的抗体或药物制剂。另一方面,提供用于在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成的方法。在一些方面,该方法包括向有此需要的受试者施用有效量的根据任何上述方面和实施例的抗体以在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或抑制体新胶原蛋白合成。在一些方面,该方法包括向受试者施用另外的治疗剂。在一些方面,另外的治疗剂选自由吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗、沙利姆单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂和PTX2所组成的组。在此类方法的一个实施例中,该抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ IDNO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ IDNO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ IDNO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ IDNO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ IDNO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ IDNO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在此类方法的另一实施例中,该抗体为抗TGFβ2抗体,其包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一方面,抗TGFβ2抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体:(a)具有相对于泛TGFβ抗体1D11减少的毒性;(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。在一方面,抗TGFβ2抗体包含与选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在此类方法的另一实施例中,该抗体为抗TGFβ2/3抗体,其包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
在上述方法的进一步的方面,该方法可包括向受试者施用有效量的抗TGFβ3抗体和有效量的抗TGFβ2抗体。在一个实施例中,用于此类联合的抗TGFβ3抗体包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在另一实施例中,抗TGFβ2抗体包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一方面,抗TGFβ2抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体:(a)具有相对于泛TGFβ抗体1D11减少的毒性;(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。在一方面,抗TGFβ2抗体包含与选自由SEQ IDNO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的VH氨基酸序列。
在上述用于治疗TGFβ相关疾患的方法的进一步实施例中,该TGFβ相关疾患可以是纤维化。在一些实施例中,该纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。在一些方面,纤维化为选自由以下项所组成的组的肺部纤维化:特发性肺纤维化(IPF)、特发性肺上叶纤维化(Amitani病)、家族性肺纤维化、肺纤维化(例如,继发于全身性炎症性疾病的肺纤维化,诸如类风湿性关节炎、硬皮病、狼疮、隐原性纤维性肺泡炎、慢性阻塞性肺病(COPD)或慢性哮喘)、囊性纤维化、非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、硬皮病/全身性硬化症(SSc,包括局限性皮肤(lcSSc)和弥漫性皮肤(dcSSc)形式和SSc相关间质性肺病(SSc-ILD))、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)、过敏性肺炎、肺动脉高压、肺结核、矽肺、石棉肺、急性肺损和急性呼吸窘迫(ARD,包括细菌性肺炎引起的、创伤引起的和病毒性肺炎引起的、呼吸机引起的、非肺脓毒症引起的)。在一些方面,纤维化为选自由以下项所组成的组的肝纤维化病症:肝硬化、先天性肝纤维化、肥胖、脂肪肝、酒精引起的肝纤维化、非酒精性脂肪性肝炎(NASH)、胆管损伤、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)、感染或病毒引起的肝纤维化(例如,慢性乙型和丙型肝炎病毒感染)、囊性纤维化、自身免疫性肝炎、坏死型肝炎、原发性硬化性胆管炎、血色素沉着病、胆道系统疾患和可归因于感染的肝功能障碍。在一些方面,纤维化为选自由以下项所组成的组的心和/或心包膜纤维化病症:心内膜心肌纤维化、心脏同种移植物血管病(CAV)、心肌梗塞、心房纤维化、充血性心力衰竭、动脉硬化、动脉粥样硬化、血管狭窄、心肌炎、充血性心肌病、冠状动脉梗塞、静脉曲张、冠状动脉狭窄和其他缺血后病症、和特发性腹膜后纤维化。在一些方面,纤维化为选自由以下项所组成的组的肾纤维化病症:肾小球性肾炎(包括膜增生性、弥漫性增生性、急进型或硬化性、感染后和慢性形式)、糖尿病性肾小球硬化、局灶性节段性肾小球硬化、IgA肾病、糖尿病性肾病、缺血性肾病、小管间质性肾纤维化、HIV相关肾病、膜肾病、继发于全身性炎症性疾病(诸如狼疮、硬皮病和糖尿病性肾小球性肾炎)的肾小球性肾炎、特发性膜增生性肾小球性肾炎、系膜增生性肾小球性肾炎、新月体性肾小球肾炎、淀粉样变性(其影响肾及其他组织)、自身免疫性肾炎、肾小管间质性纤维化、肾动脉硬化、Alport综合征、肾病综合征、慢性肾衰竭、慢性肾病、肾小球周围纤维化/无肾小管的肾小球、合并肺尖肺气肿和基底纤维化综合征(肺气肿/纤维化综合征)、肾小球高血压、肾原性纤维化皮肤病、多囊性肾病、法布里病和肾性高血压。在一些方面,纤维化为选自由以下项所组成的组的胰腺纤维化病症:基质重塑性胰腺炎和基质纤维化。在一些方面,纤维化为选自由以下项所组成的组的胃肠道纤维化病症:克罗恩病、溃疡性结肠炎、胶原性结肠炎、结直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎。在一些方面,纤维化为选自由以下项所组成的组的眼纤维化病症:眼睛纤维化、眼部纤维化、增生性玻璃体视网膜病、任何病因的玻璃体视网膜病、与视网膜功能障碍有关的纤维化、与湿性或干性黄斑变性有关的纤维化、角膜和结膜中的瘢痕、角膜内皮中的纤维化、前囊下白内障和后囊膜混浊、眼前段纤维化疾病、角膜基质纤维化(例如,与角膜混浊有关)、小梁网纤维化(例如,与青光眼有关)、眼后段纤维化疾病、纤维血管瘢痕(例如,在眼的视网膜或脉络膜血管系统中)、视网膜纤维化、视网膜前膜纤维化、视网膜胶质增生、视网膜下纤维化(例如,与年龄相关性黄斑变性有关)、糖尿病性视网膜病中的牵引性视网膜脱离伴组织收缩、先天性眼眶纤维化、泪腺纤维化、角膜上皮下纤维化和格雷夫眼病。在一些方面,纤维化选自源自脊髓损伤/纤维化或中枢神经系统纤维化诸如卒中后的纤维化、杜氏肌肉营养不良、与神经退行性疾患诸如阿尔茨海默病或多发性硬化有关的纤维化、血管再狭窄、子宫纤维化、子宫内膜异位症、卵巢纤维瘤、佩罗尼氏病、多囊性卵巢综合征、强制性脊柱炎中的疾病相关肺尖纤维化、瘢痕、和由微生物感染(例如,细菌、病毒、寄生虫、真菌)引起的纤维化。在一个特定实施例中,纤维化为SSc。在一个特定实施例中,纤维化为IPE。在一个特定实施例中,纤维化为慢性阻塞性肺病(COPD)。在一个特定实施例中,纤维化为进行性纤维化间质性肺病(PF-ILD)。在一个特定实施例中,PF-ILD为选自由以下项所组成的组的疾病或病症:非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、煤矿工人尘肺病的并发症、硬皮病/全身性硬化、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)和过敏性肺炎。在一个具体实施例中,纤维化为肝硬化或慢性肝纤维化。在特定实施例中,纤维化为GI道纤维化,例如,肠纤维化,任选地选自由以下项所组成的组:与克罗恩病有关的纤维化、溃疡性结肠炎、胶原性结肠炎、结直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎。在一个具体实施例中,纤维化为眼纤维化病症,源自脊髓损伤、纤维化或中枢神经系统纤维化的纤维化,或与神经退行性疾患有关的纤维化。
在另一个方面,提供一种将受试者诊断为患有SSc的方法。在一些实施例中,该方法包括检测检测由PRSS23、PXDN、COL8A1、COL6A3、SERPINE2、TNC、COMP、THBS1、COL11A1、COL1A1、COL5A2、COL1A2、COL4A1、COL4A2、SFRP4、ALPK2、COL5A1和TAGLN所组成的18个基因特征组中所述基因的表达水平,以及如果所述基因的所述水平经确定为相对于健康对照组或参考基因特征中的基因水平是升高的,则将所述受试者诊断为患有SSc。在一些方面,如果相对于健康对照组或参考基因特征的表达增加是统计学显著的,任选地,相对于健康对照组或参考基因特征增加至少两倍、或增加至少三倍、或增加至少四倍,则基因水平是升高的。在一些方面,使用qPCR或微阵列或RNAseq检测基因表达水平。
在另一方面,提供一种监测对使用抗TGFβ2抗体和/或抗TGFβ3抗体对受试者的治疗的应答的方法。在一些方面,该方法包括确定来自受试者的样品中选自由serpine1、col1a1、col1a2和col3a1所组成的组的TGFβ诱导型基因中的一种或多种基因的表达水平,其中该受试者已经接受抗TGFβ2抗体和/或抗TGFβ3抗体的一次或多次施用。在一些方面,如果该一种或多种TGFβ诱导型基因的表达水平与该一种或多种TGFβ诱导型基因的治疗前水平相比显著减少,则确定受试者对使用抗TGFβ2抗体和/或抗TGFβ3抗体的治疗有应答,其中任选地该方法进一步包括,如果该一种或多种TGFβ诱导型基因的表达水平经确定为显著减少,则再次施用抗TGFβ2抗体和/或TGFβ3抗体的一次或多次附加施用。在一些方面,向受试者施用抗TGFβ2抗体作为单一疗法。在一些方面,向受试者施用抗TGFβ3抗体作为单一疗法。在一些方面,该一种或多种TGFβ诱导型基因的表达水平通过qPCR或微阵列分析进行确定。在该方法的一个实施例中,该抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。在该方法的另一实施例中,该抗体为抗TGFβ2抗体,其包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一方面,抗TGFβ2抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体:(a)具有相对于泛TGFβ抗体1D11减少的毒性;(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。在一方面,抗TGFβ2抗体包含与选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的VH氨基酸序列。
在用于治疗和诊断以及监测对治疗的应答的用途、药物和方法的任何上述方面和实施例中,受试者可以是人,例如人类患者。
在另一个方面,提供一种试剂盒,其包括任何上述方面和实施例的抗体。在该试剂盒的一个实施例中,该抗体为抗TGFβ3抗体,其包含:(a1)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a2)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:34的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(a3)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(a4)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:159的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;或(b)VH/VL对,该VH/VL对的VH包含SEQ IDNO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ IDNO:78的氨基酸序列。在该试剂盒的另一实施例中,该抗体为抗TGFβ2抗体,其包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一方面,抗TGFβ2抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体:(a)具有相对于泛TGFβ抗体1D11减少的毒性;(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。在一方面,抗TGFβ2抗体包含与选自由SEQ IDNO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。在一方面,抗TGFβ2抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的VH氨基酸序列。在该试剂盒的另一实施例中,该抗体为抗TGFβ2/3抗体,其包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
附图说明
图1示出人TGFβ1、TGFβ2和TGFβ3的一级氨基酸序列比对,其登录号如下:huTGFβ1:XP_011525544.1,huTGFβ2:NP_003229.1,huTGFβ3:ABQ59024.1,其中TGFβ1的结构域(α-折叠和β-链、潜伏型套索、紧固蛋白、整合素结合、弗林蛋白酶切割和细胞因子)如Shi等人,Nature 474:343(2011)所指示。残基从预测的ATG(蛋氨酸)起始位点开始编号;Shi等人的编号从α1螺旋开始处的L30起始。序列下方的黑色箭头指示受体结合结构域的起始。为清楚起见,省略了针对TGFβ2和TGFβ3报告的移码、提前终止和剪接位点突变。图中显示的序列分别对应于SEQ ID NO:1至3。
图2A示出以单次1或10mg/kg I.V.和10mg/kg I.P.剂量给予的6F12muIgG2a抗体在C57BL6小鼠中的药代动力学曲线(每个时间点n=3)。
图2B示出以单次10mg/kg I.V.剂量给予的16C10 muIgG2a、15A7muIgG2a、18B5muIgG2a、2A10 muIgG2a和非结合抗gD huIgG1对照抗体在C57BL6小鼠中的药代动力学曲线(每个时间点n=3)。
图2C示出以单次1或10mg/kg I.V.和10mg/kg I.P.剂量给予的4A11muIgG2a以及以单次10mg/kg I.V.剂量给予的6F12 muIgG2a抗体在C57BL6小鼠中的药代动力学曲线(每个时间点n=3)。
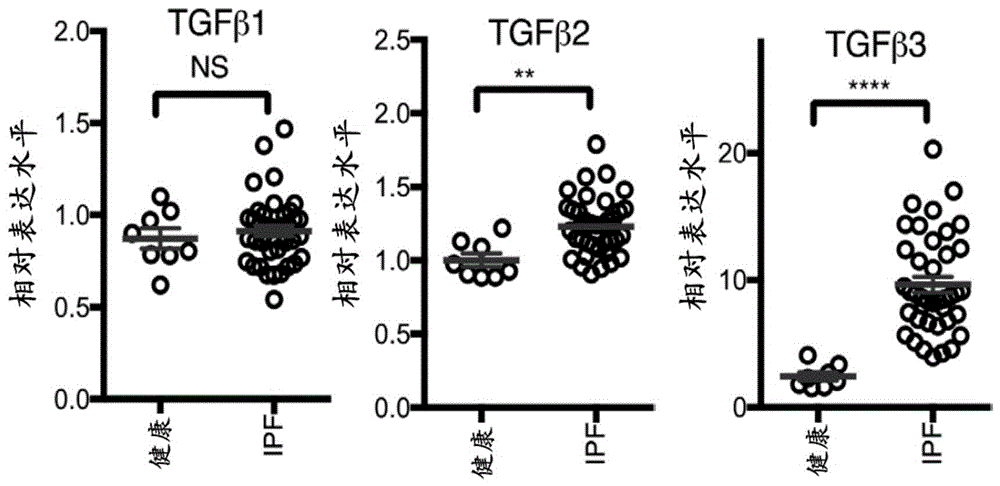
图3A为坐标图,其示出从来自对照(n=8)和IPF(n=40)肺的大块肺活检组织中TGFβ同种型的微阵列分析确定的表达水平。数据显示IPF中TGFβ2和TGFβ3的表达升高,而TGFβ1的表达不升高。**P<0.01;****P<0.0001(未配对的双尾学生t检验)。
图3B为对照和IPF肺组织的pSMAD2/3免疫组织化学(IHC)图像,其显示IPF肺组织的成纤维细胞病灶中的核pSMAD染色增加。
图4A为t-SNE图,其表示IPF肺的单细胞RNAseq(n=3,组合的),示出所标记的多个上皮细胞、间充质细胞和造血细胞谱系的表示。单个TGFβ同种型的表达显示TGFβ1的广泛表达,主要在造血细胞和内皮细胞中;TGFβ2表达主要在上皮细胞中;而TGFβ3主要在间充质细胞中。TGFβ靶基因的表达显示SERPINE1、COL1A1、POSTN和COMP与TGFβ3在成纤维细胞和肌成纤维细胞中的表达有很强的重叠。SERPINE1还与内皮细胞和巨噬细胞中的TGFβ1表达以及内皮细胞中的POSTN重叠。
图4B为pSMAD3的双重IHC和TGFβ3的原位杂交(ISH)的图像,其示出IPF肺组织中成纤维细胞病灶中的多个细胞中TGFβ3mRNA与核pSMAD3的共定位。
图5A含有示出TGFβ同种型的表达的图,该表达是从采集自入组FaSScinate试验的健康对照(HC)和基线时患有全身性硬化症(SSc)的患者的皮肤活检的微阵列分析确定的。
图5B示出通过将在体外用重组TGFβ1受体结合结构域处理的成纤维细胞中诱导的基因与在SSc vs.对照皮肤活检中显著上调的基因进行比较而得到的TGFβR信号依赖性皮肤基因表达特征。选择在两种情况下均显著升高的基因作为SSc皮肤中的候选TGFβ特征。
图6A为示出图5B中定义的特征的主要成分1的图,该特征作为SSc皮肤活检中所有特征基因的TGFβR依赖性基因表达量级的连续变量而得到并与那些活检中的TGFβ同种型表达水平进行比较。“TGFβ-高”和“TGFβ-低”SSc两类患者的这种基因特征水平均高于健康对照,且皮肤活检TGFβ基因特征与TGFβ3高度相关,但与TGFβ1或TGFβ2表达无关。
图6B为表格,其示出TGFβ诱导型的皮肤基因特征量度与TGFβ同种型、POSTN和COMP的皮肤基因表达水平之间的组间相关性;以及在FaSScinate研究中与POSTN和COMP蛋白的血清水平的组间相关性。
图6C为表格,其汇总了血清骨膜蛋白和COMP水平与改良Rodnan皮肤评分(MRSS)的相关性,MRSS是FaSScinate研究中使用的全身性皮肤纤维化的临床指数。
图7含有示出FaSScinate研究中患者的MRSS从基线到48周的变化分布的图,该研究按基线TGFβ皮肤基因特征簇分层。PBO:安慰剂;TCZ:托珠单抗治疗;Cum Prob:MRSS变化的累积概率。
图8A至8F示出在i.t.博来霉素滴注之后的指定时间从微阵列得到的表达:TGFβ1(图8A)、TGFβ2(图8B)、TGFβ3(图8C)、COL1A1(图8D)、Serpine1(图8E)和Fn1(图8F)。TGFβ2、TGFβ3、COL1A1、Serpine1和Fn1的表达遵循相似的动力学,在博莱霉素后第7至14天达到峰值。*,P<0.05;**,P<0.01;***,P<10
图9A为评估TGFβ抗体疗效的体内I.T.博莱霉素实验的示意图。在第14天或第24天处死独立队列的动物,以分别评估在TGFβ2/3表达峰值期间的肺基因表达或面临“纤维化”阶段结束时的肺胶原蛋白。从第9至23天向动物提供氘化饮用水,以评估该间隔期间新胶原蛋白产生的比例(氘化羟脯氨酸)。
图9B为示出经预防性施用抗TGFβ2和/或TGFβ3抗体(10mpk,TIW),在第24天肺氘化羟脯氨酸占总羟脯氨酸的分数的水平减少的图。每个点表示单个动物。
图9C为示出经预防性施用抗TGFβ2和/或TGFβ3抗体(10mpk,TIW),在i.t.博莱霉素滴注后第14天FN1的肺基因表达水平减少的图。**P<0.01;***P<0.001;****P<0.0001(单因素方差分析与Dunnett检验)。
图9D和图9E为示出在i.t.博来霉素后第24天,共同施用6F12和2A10(10mpk,TIW)或10mpk TIW、10mpk QW或2.5mpk QW的4A11对总羟脯氨酸(图9D)和氘代羟脯氨酸(图9E)的效应。针对10mpk的4A11 QW与TIW观察到类似的减少,但在2.5mpk QW时效应降低。**P<0.01;***P<0.001;****P<0.0001(单因素方差分析与Dunnett检验)。
图10为示出尝试表达2A10 mAb的各种人源化变体的示意图。
图11为表格,其示出在框架和CDR补平期间大多数h2A10v1变体的表达和稳定性的损失。
图12含有大鼠2A10抗体及其人源化变体v1至v4的轻链(上图)和重链(下图)可变区序列的氨基酸序列比对;图中显示的氨基酸序列为SEQ ID NO:22、36、36、54和56(上图,比对中从顶部序列到底部序列)和SEQ ID NO:23、37、45、55和57(下图,比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图13含有大鼠2A10和人源化h2A10 v2变体v2至v2.9的轻链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:22、36、38、39、40、41、36、36、36、36和36(比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图14含有大鼠2A10和人源化h2A10 v2变体v2至v2.9的重链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:23、45、45、45、45、45和46至50(比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图15含有大鼠2A10抗体和人源化v2变体的轻链(上图)和重链(下图)可变区序列的氨基酸序列比对;显示的氨基酸序列为SEQ ID NO:22、36、36、36和36(上图,比对中从顶部序列到底部序列)和SEQ ID NO:23、45和51至53(下图,比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图16含有大鼠2A10抗体及其人源化v4变体的轻链(上图)和重链(下图)可变区序列的氨基酸序列比对;显示的氨基酸序列为SEQ ID NO:22和56(上图,比对中从顶部序列到底部序列)和SEQ ID NO:23和57(下图,比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图17为线图,其示出在食蟹猴PK研究(每组n=4)中在10mg/kg的单次I.V.剂量后h2A10v3和h2A10v4的平均(±SD)血清浓度。
图18含有兔4A11及其人源化变体v1至v8的轻链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:26、80、82、80、82、84、85、84和84,比对中从顶部序列到底部序列。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图19含有兔4A11和人源化变体v1至v8的重链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:27、81、81、83、83、81、81、83和83(比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图20含有人源化4A11变体v7至v7.19的轻链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:84、84、84、84、89-92、101、101、101和101(比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图21含有人源化4A11变体v7至v7.19的重链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:83、86、87、88、83、83、83、83、93至100和102至105(比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图22含有兔6F12抗体和人源化变体v1至v4的轻链(上图)和重链(下图)可变区序列的氨基酸序列比对;显示的氨基酸序列为SEQ ID NO:24、131、131、143和144(上图,比对中从顶部序列到底部序列)和SEQ ID NO:25、132、142、132和142(下图,比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图23含有人源化6F12 v1变体v1至v1.9的轻链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:131、133至137、131、131、131和131(比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图24含有人源化6F12 v1变体v1至v1.9的重链可变区的氨基酸序列比对;所示序列对应于SEQ ID NO:132、132、132、132、132、132和138至141(比对中从顶部序列到底部序列)。残基编号根据Kabat;“*”表示游标区域。根据Chothia或Kabat(如所示)的CDR区被框起来;突出显示突变的残基。
图25为与人TGFβ3复合的2A10的晶体结构的图像。
图26为TGFβ3与2A10结合的图像,并与TGFβ1与TGFBR1/TGFBR2复合物进行比较。这指示2A10会在空间上阻止TGFBR2募集,但可能不会阻止TGFBR1募集。
图27为泛TGFβ抗体非苏木单抗(fresolimumab)(“freso”)的图像,与2A10比较。非苏木单抗阻断TGFβ3与TGFBR1/TGFBR2的结合,但由于结合角度不同,2A10仅阻断与TGFBR2的结合。
图28示出TGFβ3上被2A10结合的表位。2A10通过R394与TGFβ3的β6-β7“指”尖端的β-发夹结合。R325和K331之间也有极性触点。
图29示出TGFβ3上被2A10结合的表位;标记了
图30示出2A10抗体互补位(根据Kabat进行残基编号)。TGFβ3上的R394与2A10的D50接触。
图31示出TGFβ3/2A10表位和与TGFβ1的比较。与TGFβ3相比,TGβF1具有表位残基的三个变化。P387T、L389V和T395K取代可能巧妙地改变TGFβ2的β-发夹和β6-β7指的构象,并消除与2A10的一些有益接触。
图32示出TGFβ3/2A10表位和与TGFβ2的比较。与TGFβ3相比,TGFβ2具有表位残基的四个变化。TGFβ3与TGFβ2特异性的主要原因可能是基于R394K变化,该变化消除了表位R394-D50和V398I中优化的盐桥,增加了潜在的空间位阻。
图33示出TGFβ2与4A11v2(左卡通图)和4A11v7(右卡通图)结合的比较。抗原抗体复合物非常相似。重链在结合时彼此靠近,但第二Fab的结合肘角不同。
图34示出4A11v2/TGFβ2与TGFβ3/受体复合物的比较。4A11v2不直接与TGFBR1/2结合位点竞争;相反,4A11v2稍微改变了TGFβ2的结构,导致指“捏”在一起。这可能是4A11v2Fab之间空间位阻的结果。
图35示出被4A11结合的TGFβ2表位。TGFβ2氨基酸序列(TGFβ2编号)的位置E373处的谷氨酸位于接触界面的中心。TGFβ3在这个位置也有谷氨酸,类似于TGFβ2,而TGFβ1有一个甘氨酸。
图36含有卡通图,其示出由4A11v2诱导的TGFβ2(右图)和来自非苏木单抗(“freso”)复合物的TGFβ2(左图)的构象变化。TGFβ2结构的构象变化可能改变信号传导受体结合TGFβ2的能力。4A11还可以通过结合TGFβ2或TGFβ3的膜近侧来阻断膜栓系受体的进入。
图37为卡通图,其示出来自4A11v2复合物的TGFβ2(左图)和来自TGFβR1/TGFβR2复合物的TGFβ3。TGFβ2结构的构象变化可能改变TGFBR1结合在一个单体上的能力。
图38示出4A11v2(左结构)与4A11v7(右结构)残基的重链的相互作用;VH框架相互作用在两种结构中是互补的。
图39示出4A11v2与4A11v7 VH框架比较。在4A11v2中,Q81以高能旋转异构体方式并在尴尬位置抵靠R19。在4A11v7中,K81与S79形成弱H键,因此v2中的框架残基可能是排斥性的,而v7残基是更宽容的。
图40含有说明单价(左图)和二价(右图)4A11与TGFβ2结合的卡通图。
图41为坐标图,其绘制在与用编码FL-TGFβ1或FL-TGFβ3(野生型或RGE突变体)的质粒且使用或不使用编码整合素αv和β6的质粒转染的293T细胞共培养后,MLEC报告细胞的相对萤光素酶活性。**,P<0.01;***,P<10
图42为坐标图,其绘制来自MLEC报告细胞的上清液(SN)中的相对萤光素酶活性(测量TGFβ活性)。从用编码FL-TGFβ1、FL-TGFβ2、FL-TGFβ3的质粒或空载体(对照)转染的细胞中收集SN。如所示酸化上清液(HCl处理)。**,P<0.01;***,P<10
图43A和图43B为坐标图,其绘制通过由HEK-Blue TGFβ报告细胞释放的碱性磷酸酶(图43A)或使用MLEC报告细胞测定法(相对荧光素酶活性)(图43B)评估的TGFβ活性。在图43A中,从用编码FL-TGFβ1、FL-TGFβ2、FL-TGFβ3的质粒或空载体(对照)转染的293T细胞中收集上清液(SN)。在图43B中,从用编码FL-TGFβ1、FL-TGFβ3的质粒或空载体(对照)转染的COS-7细胞中收集SN。**,P<0.01;***,P<0.001;****,P<10
图44为坐标图,其绘制通过MLEC报告细胞测定法(相对萤光素酶活性)评估的TGFβ活性。用编码各种形式的FL-TGFβ以及整合素αv和β6的质粒转染293T细胞。在共培养后用MLEC报告细胞测量TGFβ活性。在指示的共培养开始时添加细胞松弛素D(30μM)(“Cyto D”)。“MLE”为对照。**,P<0.01;***,P<0.001;****,P<10
图45为坐标图,其绘制通过MLEC报告细胞测定法(相对萤光素酶活性)在从用编码野生型或弗林蛋白酶位点突变FL-TGFβ蛋白的质粒转染的293T细胞收集的上清液中评估的TGFβ活性,示出使用突变的蛋白质时TGFβ活性的损失。**,P<0.01;***,P<0.001;****,P<10
图46为Western印迹图像,其示出用重组蛋白质或上清液处理的NHLF细胞中smad2磷酸化的动力学。作为对照,NHLF细胞也用来自未转染的细胞(SN.ctrl)或重组BMP2处理1小时的上清液。为了控制不同样品之间的加载量,通过BCA测量上清液的蛋白质浓度,并在每个泳道中加载20μg蛋白质。
图47为坐标图,其绘制在与一系列浓度的人Fc-FL-TGFβ同种型融合蛋白孵育之后,在MLEC报告细胞中测量的TGFβ活性(相对荧光素酶活性)。“背景”意为未添加融合蛋白。数据是来自一式三份的实验的平均值±SEM,当误差线短于其相应符号的大小时,不显示误差线。
图48为坐标图,其绘制在与人Fc-FL-TGFβ2或Fc-FL-TGFβ3融合蛋白(30ng/ml)和3μg/ml的以下同种型特异性抗体孵育后,在MLEC报告细胞中测量的TGFβ活性(相对荧光素酶活性):19D8(抗TGFβ1);6F12(抗TGFβ2);2A10(抗TGFβ3);和1D11(泛抗TGFβ)。“背景”意为未添加融合蛋白。“无”表示未添加抗体。数据是来自一式三份的实验的平均值±SEM,当误差线短于其相应符号的大小时,不显示误差线。
图49为表格,其示出潜伏型相关肽(LAP)和成熟结构域(活性)的人TGFβ同种型之间一级氨基酸序列相似性(%)。
图50A、图50B和图50C为坐标图,其示出在将TGFβ1、TGFβ2或TGFβ3(从左到右)的成熟肽(1ng/ml)与一系列浓度的人Fc-LAP融合蛋白孵育之后,来自MLEC测定法(TGFβ活性)的滴定曲线。数据是来自一式三份的实验的平均值±SEM,当误差线短于其相应符号的大小时,不显示误差线。
图51为表格,其示出基于图50所示滴定曲线的IC50。
图52A和图52B为坐标图,其示出作为新合成胶原的指示物,在WT或TGFβ同种型CKO小鼠中测量的新羟脯氨酸的百分比(%)(平均值±SEM)。在图52A中,n=5(每个盐水组),n=20(WT,博来霉素处理(“BLM”)),n=24只小鼠(β2.cKO,BLM);在图52B中,n=7(WT,盐水),n=14(WT,BLM),n=13(β3.cKO,BLM)和n=13(β2/3.cDKO,BLM);*P<0.05,***P<0.001,单因素方差分析与Dunnett检验。
图53A和图53B为柱状图,其绘制在I.T.盐水或博来霉素滴注和用同种型对照抗体、抗TGFβ2抗体(6F12)(图53A)或抗TGFβ3抗体(2A10)(图53B)治疗后14天,通过定量RT-PCR确定的Serpine1、Fn1和Col1a1的全肺基因表达。在图53A中,n=5(盐水),n=15(对照,博来霉素(“BLM”))和n=14(6F12,BLM);在图53B中,n=5(盐水),n=19(对照,BLM)和n=20只小鼠(2A10,BLM)。*P<0.05,**P<0.01,***P<0.001,****P<0.0001,NS,P>0.05,单因素方差分析与Dunnett检验。
图53C为柱状图,其绘制在盐水(n=10)或博来霉素(“BLM”)滴注后第24天确定的新合成的胶原水平。用同种型对照(n=21)、6F12与2A10的组合(n=23)或抗TGFβ2/3抗体(4A11)治疗动物。4A11的剂量水平分别为高(10mg/kg;3次/周,n=23);中(10mg/kg;1次/周,n=24)或低(2.5mg/kg;1次/周,n=23)。*P<0.05,**P<0.01,***P<0.001,****P<0.0001,NS,P>0.05,单因素方差分析与Dunnett检验。
图53D为柱状图,其绘制由病理学分析确定的疾病评分。在盐水(n=5)或博来霉素(“BLM”)滴注并且后24天收获小鼠肺,且通过同种型对照(n=7)或4A11(高剂量,n=12)处理。*P<0.05,**P<0.01,***P<0.001,****P<0.0001,NS,P>0.05,单因素方差分析与Dunnett检验。
图53E含有对胶原III进行免疫组织化学染色的代表性小鼠肺图像。
图54A含有柱状图,其绘制在来自具有轻度纤维化(F0和F1)(N=40)与严重纤维化(F3和F4)(N=32)的NASH患者的肝脏中,TGFβ同种型的相对基因表达水平。
图54B含有点图,其示出小鼠肝脏中TGFβ同种型的相对基因表达水平,如通过定量RT-PCR在媒介物或CCl
图54C包含柱状图,其绘制Col1a1和Col3a1的肝脏基因表达,如通过定量RT-PCR在媒介物或CCl
图54D为柱状图,其绘制通过组织病理学分析确定的肝脏病理学评分;在媒介物或CCl
图55A为表格,其示出通过Biacore SPR确定的抗体6F12和4A11对人和小鼠TGFβ2的结合亲和力(K
图55B含有线图,其绘制用MLEC报告细胞测量的TGFβ活性。人或小鼠TGFβ2的成熟肽(1ng/ml)与一系列浓度的6F12或4A11抗体一起孵育。将曲线最佳拟合至剂量-应答抑制模型。BKGD(背景),未添加成熟肽。
图56A为用于评估与抗TGFβ抗体相关的增强炎症应答的结肠炎模型的示意图。
图56B提供在图56A的结肠炎模型中在第24天测量的结肠重量(克)。除未治疗组(n=6)外,对于所有组,N=10。
图56C提供图56A的结肠炎模型中炎性基因的相对表达(从结肠RNA分析)。如所示分析来自每组的三至五只小鼠。
图56D汇总了在图56A的结肠炎模型中每组(3至5只/组)中剩余小鼠的固有层中的免疫细胞数量,如通过流式细胞术使用它们的表面标志物所确定。
具体实施方式
I.定义
如本文所用,除非另有说明,否则术语“肿瘤坏死因子β”和“TGFβ”可互换使用,并且是指来自任何脊椎动物来源的任何天然TGFβ同种型,包括哺乳动物诸如灵长类动物(例如人)和啮齿动物(例如,小鼠和大鼠)。该术语涵盖“全长”的未加工TGFβ,以及由细胞中的加工所产生的任何形式的TGFβ。该术语还涵盖TGFβ的天然存在的变体,例如剪接变体或等位基因变体。TGFβ同种型具有前体形式(未成熟)和成熟形式。如图1所示,潜伏型相关肽在细胞内被弗林蛋白酶切割,并与受体结合结构域形成非共价相互作用。这种复合物由细胞分泌,单独存在或经由潜伏型相关肽与“环境”分子诸如GARP、LRRC33或潜在的TGFβ结合蛋白(LTBP)1至4共价结合。LAP与受体结合结构域的复合物称为小潜在复合物(SLC),且LAP、受体结合结构域和环境分子的复合物称为大潜在复合物(LLC)。
TGFβ1、TGFβ2和TGFβ3的氨基酸序列如下:
人TGFβ1
MPPSGLRLLPLLLPLLWLLVLTPGRPAAGLSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS(SEQ ID NO:1)。
人TGFβ2
MHYCVLSAFLILHLVTVALSLSTCSTLDMDQFMRKRIEAIRGQILSKLKLTSPPEDYPEPEEVPPEVISIYNSTRDLLQEKASRRAAACERERSDEEYYAKEVYKIDMPPFFPSENAIPPTFYRPYFRIVRFDVSAMEKNASNLVKAEFRVFRLQNPKARVPEQRIELYQILKSKDLTSPTQRYIDSKVVKTRAEGEWLSFDVTDAVHEWLHHKDRNLGFKISLHCPCCTFVPSNNYIIPNKSEELEARFAGIDGTSTYTSGDQKTIKSTRKKNSGKTPHLLLMLLPSYRLESQQTNRRKKRALDAAYCFRNVQDNCCLRPLYIDFKRDLGWKWIHEPKGYNANFCAGACPYLWSSDTQHSRVLSLYNTINPEASASPCCVSQDLEPLTILYYIGKTPKIEQLSNMIVKSCKCS(SEQ ID NO:2)。
人TGFβ3
MKMHLQRALVVLALLNFATVSLSLSTCTTLDFGHIKKKRVEAIRGQILSKLRLTSPPEPTVMTHVPYQVLALYNSTRELLEEMHGEREEGCTQENTESEYYAKEIHKFDMIQGLAEHNELAVCPKGITSKVFRFNVSSVEKNRTNLFRAEFRVLRVPNPSSKRNEQRIELFQILRPDEHIAKQRYIGGKNLPTRGTAEWLSFDVTDTVREWLLRRESNLGLEISIHCPCHTFQPNGDILENIHEVMEIKFKGVDNEDDHGRGDLGRLKKQKDHHNPHLILMMIPPHRLDNPGQGGQRKKRALDTNYCFRNLEENCCVRPLYIDFRQDLGWKWVHEPKGYYANFCSGPCPYLRSADTTHSTVLGLYNTLNPEASASPCCVPQDLEPLTILYYVGRTPKVEQLSNMVVKSCKCS(SEQ ID NO:3)。
如本文所用,除非另外指明,否则术语“TGFβ1”是指来自任何脊椎动物来源的任何天然TGFβ1,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)和啮齿动物(例如,小鼠和大鼠)。该术语涵盖“全长”的未加工TGFβ1,以及由细胞中的加工所产生的任何形式的TGFβ1。该术语还涵盖TGFβ1的天然存在的变体,例如剪接变体或等位基因变体。示例性人TGFβ1的氨基酸序列在图1中示出(SEQ ID NO:1)。
如本文所用,除非另外指明,否则术语“TGFβ2”是指来自任何脊椎动物来源的任何天然TGFβ2,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)和啮齿动物(例如,小鼠和大鼠)。该术语涵盖“全长”的未加工TGFβ2,以及由细胞中的加工所产生的任何形式的TGFβ2。该术语还涵盖TGFβ2的天然存在的变体,例如剪接变体或等位基因变体。示例性人TGFβ2的氨基酸序列在图1中示出(SEQ ID NO:2)。
如本文所用,除非另外指明,否则术语“TGFβ3”是指来自任何脊椎动物来源的任何天然TGFβ3,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)和啮齿动物(例如,小鼠和大鼠)。该术语涵盖“全长”的未加工TGFβ3,以及由细胞中的加工所产生的任何形式的TGFβ3。该术语还涵盖TGFβ3的天然存在的变体,例如剪接变体或等位基因变体。示例性人TGFβ3的氨基酸序列在图1中示出(SEQ ID NO:3)。
如本文所用,术语“TGFβ”意为如上所述的TGFβ同种型TGFβ1、TGFβ2和TGFβ3中的任何一种、两种或所有三种。
如本文所用,术语“特异性地结合”和“特异性结合”是指抗体选择性地或优先与其靶抗原结合。优选地,对抗原的结合亲和力为10
如本文所用,术语“抗TGFβ抗体”意为与一种或多种TGFβ同种型特异性地结合的抗体。因此,如本文所用,术语“抗TGFβ3抗体”是指与TGFβ3特异性地结合的单特异性抗体;术语“抗TGFβ2抗体”是指与TGFβ2(例如,人TGFβ2)特异性地结合的单特异性抗体;术语“抗TGFβ2/3抗体”是指与TGFβ2(例如,人TGFβ2)和TGFβ3(例如,人TGFβ3)特异性地结合的双特异性抗体;术语“抗TGFβ1抗体”是指与TGFβ1(例如,人TGFβ1)特异性地结合的单特异性抗体;并且术语“泛特异性TGFβ抗体”是指与所有三种TGFβ同种型(TGFβ1、TGFβ2和TGFβ3,例如,人TGFβ1、TGFβ2和TGFβ3)结合的抗体。本文所述的对某些TGFβ同种型具有单特异性或双重特异性的抗TGFβ抗体在本文中也称为“同种型选择性抗TGFβ抗体”。在一个实施例中,同种型选择性抗TGFβ抗体(例如,抗TGFβ1抗体、抗TGFβ2抗体、抗TGFβ2/3抗体或抗TGFβ3抗体)与抗体对其无特异性的TGFβ同种型的结合程度小于抗体与其靶TGFβ同种型结合的约10%,如通过例如放射免疫测定法(RIA)或表面等离子共振(SPR)所测量。在另一实施例中,同种型选择性抗TGFβ抗体与该抗体对其无特异性的一种或多种TGFβ同种型的结合程度小于抗体与其靶TGFβ同种型的结合的约9%、8%、7%、6%、5%、4%、3%、2%或优选小于约1%,如通过例如RIA或SPR所测量。在一个实施例中,同种型选择性抗TGFβ抗体是指能够以足够的亲和力结合该抗体对其具有特异的TGFβ同种型,使得该抗体在靶向TGFβ同种型方面可用作诊断剂和/或治疗剂。在一个实施例中,同种型选择性抗TGFβ抗体与无关蛋白质的结合程度小于该同种型选择性抗TGFβ抗体的该结合的约10%,或小于约9%、8%、7%、6%、5%、4%、3%、2%或优选小于约1%,如通过例如放射免疫测定法(RIA)所测量。在某些实施例中,抗TGFβ抗体与其靶标TGFβ同种型的解离常数(K
如本文所用,术语“选择性中和”及其语法变体,就本文所述的同种型选择性抗TGFβ抗体而言,意为抗体与抗体对其具有选择性的同种型特异性地结合并中和该同种型,但不会中和其他同种型。因此,例如,选择性地中和TGFβ1的抗TGFβ1抗体不中和TGFβ2或TGFβ3;选择性地中和TGFβ2的抗TGFβ2抗体不中和TGFβ1或TGFβ3;选择性地中和TGFβ3的抗TGFβ3抗体不中和TGFβ1或TGFβ2;选择性地中和TGFβ2和TGFβ3的抗TGFβ2/3抗体不中和TGFβ1。在某些实施例中,如本文所述的同种型选择性抗TGFβ抗体与跨不同物种保守的TGFβ同种型的表位特异性地结合。在一些实施例中,抗体(例如,本文所述的同种型选择性抗TGFβ抗体)选择性地中和一种或多种TGFβ同种型的能力可在体外抑制测(例如,下文中描述的基于细胞的抑制TGFβ测定)中确定。
如本文所用,“TGFBR”是指TGFβ受体。所有三种TGFβ同种型的二聚体受体结合结构域与TGFBR1和TGFBR2的异二聚体受体复合物对结合;然后四聚体受体复合物经由TGFBR1(也称为ALK5)的受体酪氨酸激酶(RTK)活性活化细胞内信号传导(Weiss等人,WileyInterdiscip.Rev.Dev.Biol.2:47-63(2013))。在经典的TGFBR信号传导中,ALK5磷酸化SMAD2和SMAD3,然后与SMAD4缔合,易位到细胞核,并引导基因转录。Smad复合物活化肌成纤维细胞基因(包括αSMA、钙调蛋白和胶原蛋白)的转录(Usuki等人,J.Nippon Med.Sch.79:46-59(2012);Carthy等人,PloS one 6:e19809(2011);和Gu等人,ActaPharmacol.Sin.28:382-391(2007))。在某些情况下,TGFβ可能活化其他非SMAD依赖性信号传导通路,包括MAP激酶、AKT、JAK-STAT和NFκB。生化和结构研究表明,TGFβ-TGFβR信号传导复合物的组装可能具有细微的同种型特异性差异:TGFβ1和TGFβ3与TGFβR2结合更强,并且仅在与TGFβR2复合时才与TGFβR1形成强相互作用,而TGFβ2与单独的TGFBR1和TGFBR2两者结合较弱,且亲合力可能驱动完全复合物形成(Radaev JBC 2009;285,14806-14814)。TGFβ1和TGFβ2以“闭合”结构结晶,有利于与TGFBR1和TGFBR2结合,而TGFβ3可以采用类似的“闭合”或不太有序的“开放”晶体形式结构,这可能导致配体-受体复合物组装的亲合力不同(Hinck,A.P.等人2016;Cold Spring Harb Perspect Biol doi:10.1101/cshperspect.a02210)。此外,TGFBR3(β聚糖)是一种非信号传导受体,可以促进TGFβ2与TGFβR1/2复合物的结合,但在TGFβ1或TGFβ3受体结合中似乎没有类似的作用(del Re,JBC2004;279,22765-22772)。虽然在大多数细胞(包括内皮细胞)中,TGFβ通过TGFBR1/2复合物发出信号,但在内皮细胞中,TGFβ1和TGFβ3也可以通过由内皮糖蛋白促进的TGFBR2/ALK1复合物发出信号,这有助于SMAD1/5依赖性血管内皮增生和血管生成(EMBO J.2004Oct 13;23(20):4018-28)。最终,尽管信号传导复合物组装存在这些差异,但TGFβ1、2和3的重组受体结合结构域都能够在基于细胞的体外测定中以相似程度诱导TGFBR依赖性SMAD信号传导。因此,内源性TGFβ同种型活性的任何生物学差异更可能是由于它们的表达模式和从SLC或LLC释放的机制的差异,而不是它们的受体结合结构域的差异。
如本文所用,术语“中和”及其语法变体,就本文所述的同种型选择性抗TGFβ抗体而言,意为抗体将其靶标TGFβ同种型通过TGFBR复合物诱导信号传导抑制到可测量的程度。
如本文所用,术语“直接接触”及其语法变体,就抗TGFβ抗体的抗原结合结构域而言,意为抗原结合结构域在其相应表位中的氨基酸残基的15-8、8、8-5或优选地在5埃内。
“TGFβ疾患”或“TGFβ相关疾患”是指将受益于用本文提供的同种型选择性抗TGFβ抗体治疗的任何疾患、疾病或病症。其包括慢性和急性疾患或疾病,包括使哺乳动物易患所述疾患的那些病理状态。本文待治疗的疾患包括以细胞外基质积聚为特征的疾病;由循环TGFβ或在局部位点活化的TGFβ(包括一种或多种TGFβ同种型)引起的疾病;由内源性TGFβ产生所致的免疫系统抑制引起的病症;严重伤害、烧伤和疾病诸如病毒或细菌感染导致的急性免疫缺陷;由于TGFβ产生或过度产生导致的多器官系统疾病;以及产生TGFβ的肿瘤。
如本文所用,术语“纤维化”、“纤维化病症”和“纤维化性病症”旨在具有相同的含义。在某些实施例中,纤维化病症是由纤维化刺激物介导的那些。示例性纤维化刺激物包括但不限于,TGFβ、内皮素、乳酸(经由乳酸脱氢酶)、IL-1、Thy-1(CD90)、结缔组织生长因子(“CTGF”)以及它们的组合。在某些实施例中,纤维化病症为由TGFβ介导的病症。在某些实施例中,纤维化病症为由TGFβ1、TGFβ2和TGFβ3中的一者或多者介导的病症。在某些实施例中,纤维化病症为由TGFβ2和TGFβ3中的一者或两者介导的病症。在某些实施例中,纤维化病症为由TGFβ2介导的病症。在某些实施例中,纤维化病症为由TGFβ3介导的病症。下文更详细地描述了示例性纤维化病症。
“全身性硬化症”(SSc)或“硬皮病”是一种复杂且异质的疾病,其主要特征包括皮肤和组织纤维化、血管改变和针对各种细胞抗原的自身抗体。全身性硬化症的临床表现范围可以从有限的皮肤受累到严重的内脏器官功能障碍。内脏器官病理为导致这种疾病发病率的主要因素,其中肾脏、食管、心脏和肺是最常受累的。普遍接受的SSc分类中有两个主要亚组:局限性皮肤SSc(lcSSc)和弥漫性皮肤SSc(dcSSc)。Gabrielli等人Mechanisms ofdisease.Scleroderma.N Engl J Med 360:1989-2003(2009)。在一个实施例中,患有全身性硬化症的患者已根据美国风湿病学会(前身为美国风湿病协会)全身性硬皮病分类标准进行分类,该标准基于:主要标准:弥漫性(躯干)硬化(皮肤紧绷、增厚和非凹痕蚀-硬结);和次要标准:(1)指端硬化(仅手指和/或脚趾),(2)手指凹陷性瘢痕或手指垫物质缺失(指腹损失),和(3)双侧基底肺纤维化,其中全身性硬化症患者应满足主要标准或三个次要标准中的两个。参见Subcommittee for Scleroderma Criteria of the AmericanRheumatism Association,Diagnostic and Therapeutic CriteriaCommittee.Preliminary criteria for the classification of systemic sclerosis(scleroderma).Arthritis Rheum 23:581–90(1980)。
如本文所用,慢性阻塞性肺病(“COPD”)是用于描述通常以气流阻塞或限制为特征的一组呼吸道疾病的总称。这种病症也可以称为慢性阻塞性呼吸道疾病(CORD)、慢性阻塞性气道疾病(COAD)、慢性阻塞性肺病(COLD)或慢性气道受限(CAL)。如本文所用,术语COPD旨在涵盖所有此类参考。慢性阻塞性肺病的临床过程以慢性失能为特征,在冬季更常出现间歇性急性加重。慢性阻塞性肺病的急性加重可以定义为患者症状从他或她通常的稳定状态持续恶化,超出正常的日常变化,并且是急性发作的。当发生急性加重时,它们通常表现为痰量增加、痰更多化脓、痰色改变、咳嗽增加、上呼吸道症状(例如,感冒和喉咙痛)、喘息增加、胸闷、运动耐量降低、疲劳增加、液体潴留、急性意识模糊和呼吸困难的恶化。尽管感染性病因是大多数加重的原因,但暴露于过敏原、污染物或吸入的刺激物也可能起作用。已知导致COPD急性加重的感染因子包括:鼻病毒、流感病毒、副流感病毒、冠状病毒、腺病毒、呼吸道合胞病毒、肺炎衣原体、流感嗜血杆菌、肺炎链球菌、卡他莫拉菌、金黄色葡萄球菌、肺炎支原体和铜绿假单胞菌。已知导致急性加重的污染物包括二氧化氮、颗粒物、二氧化硫和臭氧。尽管有这些已知原因,但在多达30%的已确诊COPD加重病例中,加重的确切原因可能无法鉴定。慢性阻塞性肺病全球倡议(GOLD)将COPD定义为一种以气流受限为特征的疾病症态,且不完全可逆。气流受限通常是进行性的,并与肺部对有害颗粒或气体的异常炎症应答有关。美国胸科学会(ATS)将COPD定义为由于慢性支气管炎、肺气肿或两者兼有而导致进行性慢性气流阻塞的疾病过程。慢性支气管炎在临床上定义为在至少连续两年中至少三个月的大多数日子里过度咳嗽和咳痰。肺气肿的特征是由肺组织破坏和气隙扩大引起的慢性呼吸困难(呼吸急促)。术语COPD通常涵盖的另一种病症为支气管扩张,其是由粘液积聚和阻塞引起的呼吸道异常伸展和扩大。在这种情况下,脆弱的通道可能变为瘢痕状和变形,使更多的粘液和细菌积聚,从而导致感染循环并阻塞气道。
如本文所用,术语“ILD”是指间质性肺病。间质性肺病包括超过200种肺病和呼吸系统病症,其特征是间质、肺气囊之间的组织和空间的炎症和纤维化(例如,参见du Bois,Nat.Rev.Drug Discov.2010,9,129-140)。在“进行性纤维化间质性肺病(PF-ILD)”中,纤维化ILD对肺损伤的应答包括纤维化的发展,该纤维化变得进行性、自我维持且独立于最初的临床关联或触发因素。
如本文所用,术语“特发性肺纤维化”和“IPF”是指以肺实质进行性间质纤维化为特征的限制性肺病,在美国影响约100,000名患者(Raghu等人,Am J Respir Crit CareMed 174:810-816(2006))。这种与IPF相关的间质纤维化导致肺功能的进行性损失,导致大多数患者因呼吸衰竭而死亡。诊断时的中位生存期为2至3年(Raghu等人,Am J RespirCrit Care Med183:788-824(2011))。IPF的病因和关键分子及病理生理学驱动因素尚不清楚。在一些实施例中,IPF的诊断通过在通过手术活检获得的肺组织的组织病理学评价中发现常见的间质性肺炎(UIP)来确认。IPF的诊断标准是已知的。Ryu等人(1998)MayoClin.Proc.73:1085-1101。
如本文所用,“GI道纤维化”是指胃肠道(包括例如口、食管、胃、小肠、大肠和肛门)的纤维化。“GI道纤维化”因此包括肠纤维化。“肠纤维化”为炎症性肠病(IBD)的常见并发症,通常定义为肠壁中瘢痕组织的过度堆积。肠纤维化可在两种形式的IBD中发生:溃疡性结肠炎和克罗恩病。“GI道纤维化”包括但不限于与克罗恩病相关的纤维化、溃疡性结肠炎、胶原性结肠炎、结肠直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎。
如本文所用,“监测疾病进展”是指以连续的时间间隔评估受试者(例如,患有TGFβ相关疾患的受试者,例如,正在接受如本文其他地方所述的抗TGFβ抗体治疗的受试者)以确定疾病症状是否恶化、稳定或改善(即变得不那么严重)。例如,在某些情况下,监测受试者的纤维化(例如,SSc或IPF,或其他纤维化)的进展可以包括监测下表2中描述的18个基因TGFβ特征组的变化、总应答率、缓解持续时间、生活质量、疾病标志物的表达和/或活性(例如,某些其他基因和/或蛋白质的表达)或本领域已知的其他标准。可以采用监测患有TGFβ相关疾患的患者的疾病进展的其他方法,包括例如通过成像技术测量对治疗的应答,这将在本文其他地方进一步详细描述。
如本文所用,术语“监测疾病进展”或“监测对治疗的应答”可互换使用,并且是指在治疗期间或之后以连续的时间间隔评估受试者(例如,患有TGFβ相关疾患的受试者,例如,正在接受如本文其他地方所述的抗TGFβ抗体治疗的受试者)以确定疾病症状是否恶化、稳定或改善(即变得不那么严重)作为该治疗的结果。例如,可以使用与用于监测疾病进展的标准相同的标准监测受试者(例如,已经或正在接受用免疫治疗剂,例如但不限于本文所述的抗TGFβ抗体治疗的受试者)中的治疗进展。
如本文所用,术语“检测”包括任何检测手段,包括直接检测和间接检测。
如本文所用,本文使用的术语“诊断”是指分子或病理状态、疾病或病症的鉴定或分类。例如,“诊断”可以指鉴定特定类型的纤维化(例如,SSc、IPF等)或其他TGFβ介导的疾患。“诊断”还可以是指纤维化病症的特定亚的分类,例如,通过组织病理学或影像学标准或分子特征(例如,以特定基因或由所述基因编码的蛋白质中的一种或组合的表达为特征的同种型)。
术语“预后”在本文中用于指预测随着时间的推移存活以及一种或多种可归因于TGFβ的疾病症状随着时间的推移而恶化的可能性。
如本文所用,“对照受试者”是指尚未被诊断为患有感兴趣的疾病或病症(例如纤维化,例如IPF、SSc等)并且没有遭受任何与该疾病或状况相关的体征或症状的健康受试者。
如本文所用,术语“样品”是指获自或衍生自目标受试者的组合物,其含有例如基于物理、生化、化学和/或生理特征待进行表征和/或鉴定的细胞和/或其他分子实体。例如,短语“疾病样品”及其变型是指从目的受试者获得的任何样品,其预期或已知包含待表征的细胞和/或分子实体。
“组织”或“细胞样品”是指从受试者或患者的组织获得的相似细胞的集合。组织或细胞样品的来源可以是来自新鲜的、冷冻的和/或保存的器官或组织样品或活检或吸出物的实体组织;血液或任何血液成分;体液,诸如脑脊髓液、羊水、腹膜液或间质液;受试者妊娠或发育中任何时候的细胞。组织样品也可以是原代或培养的细胞或细胞系。可选地,组织或细胞样品获自疾病组织/器官。组织样品可以包含在自然环境天然不与组织混合的化合物,例如防腐剂、抗凝剂、缓冲剂、固定剂、营养物、抗生素等。如本文所用,“参考样品”、“参考细胞”、“参考组织”、“对照样品”、“对照细胞”或“对照组织”是指从已知来源获得的样品、细胞或组织,或据信不患有使用本发明的方法或组合物对其进行鉴定的疾病或病症。在一个实施例中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织获自同一受试者或患者的身体的健康部分,在该受试者或患者中使用本发明的组合物或方法鉴定疾病或病症。在一个实施例中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织获自个体的身体的健康部分,该个体并非使用本发明的组合物或方法鉴定疾病或病症的受试者或患者。
如本文所用,术语“基因特征”与“基因表达特征”可互换使用,并且是指一种基因或基因集合,其表达指示受试者或分离自受试者的组织或其他样品具有高TGFβ活性和/或指示受试者可能受益于以某些分子、病理学、组织学、影像学和/或临床特征为特征的TGFβ同种型抑制剂的治疗。在某些实施例中,与对照受试者相比,包含基因特征的一种或多种基因的表达是升高的。
如本文所用,术语“升高的表达水平”或“升高的水平”是指受试者(例如,受试者,例如,患者,怀疑患有或诊断为患有TGFβ相关疾患,例如,纤维化,例如,IPF、COPD、PF-ILD(例如,SSc)、肝纤维化(例如,肝硬化或慢性肝纤维化))中相对于对照(诸如不患有TGFβ相关疾患的一个或多个个体)的mRNA或蛋白质的增加的表达。
出于本文目的的“受体人框架”是这样的框架,其包含来源于如下所定义的人免疫球蛋白框架或人共有框架的轻链可变结构域(VL)框架或重链可变结构域(VH)框架的氨基酸序列。“来源于”人免疫球蛋白框架或人共有框架的受体人框架可包含与所述人免疫球蛋白框架或人共有框架相同的氨基酸序列,或者其可以包含氨基酸序列变化。在一些实施例中,氨基酸变化的数量为10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少,或2个或更少。在一些实施例中,VL受体人框架在序列上与VL人免疫球蛋白框架序列或人共有框架序列相同。
“亲和力”是指分子(例如,抗体)的单个结合位点与其结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另有说明,否则如本文所用,“结合亲和力”是指内在结合亲和力,其反映了结合对的成员(例如,抗体和抗原)之间的1:1相互作用。分子X对其配偶体Y的亲和力一般可由解离常数(K
“亲和力成熟的”的抗体是指在一个或多个高变区(HVR)中具有一个或多个改变的抗体,与不具有此类改变的亲本抗体相比,此类改变导致了抗体对抗原的亲和力的改善。
本文中,术语“抗体”以最广泛的含义使用,并且包括各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出所需的抗原结合活性即可。
“抗体片段”是指除了完整抗体以外的分子,其包含完整抗体的一部分,该部分结合完整抗体所结合的抗原。抗体片段的示例包括但不限于Fv、Fab、Fab'、Fab'-SH、F(ab')
与参考抗体“结合至相同表位的抗体”是指在竞争测定中阻断参考抗体与其抗原的结合达50%或更高的抗体,反之,参考抗体在竞争测定中阻断该抗体与其抗原的结合达50%或更高。本文提供一种示例性竞争测定。
术语“嵌合”抗体是指这样的抗体,在该抗体中重链和/或轻链的一部分来源于特定来源或物种,而重链和/或轻链的其余部分来源于不同的来源或物种。
抗体的“类别”是指抗体的重链所具有的恒定结构域或恒定区的类型。存在五大类抗体:IgA、IgD、IgE、IgG和IgM,并且这些抗体中的一些可以进一步分为亚类(同种型),例如IgG
如本文所用,术语“细胞毒性剂”是指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒性剂包括但不限于放射性同位素(例如,At
“效应子功能”是指可归因于抗体的Fc区、随着抗体同种型的变化而变化的那些生物学活性。抗体效应子功能的实例包括:C1q结合和补体依赖性细胞毒性(CDC);Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如,B细胞受体)的下调;以及B细胞活化。
药剂(例如药物制剂)的“有效量”是指在必要的剂量和时间段下有效实现所需治疗或预防结果的量。
术语“治疗有效量”是指对于“治疗”受试者(例如,哺乳动物,诸如人)中的疾病或病症有效的例如免疫治疗剂(诸如本文其他地方描述的免疫治疗剂)的量。
如本文所用,“托珠单抗”是与人白介素6受体(IL-6R)结合的重组人源化单克隆抗体。它是一种IgG1κ(γ1,κ)抗体,具有两条重链和两条轻链,形成两个抗原结合位点。在一个优选的实施例中,托珠单抗的轻链和重链氨基酸序列分别包含SEQ ID NO187和188。
本文的术语“Fc区”用于定义免疫球蛋白重链的C末端区,该C末端区包含恒定区的至少一部分。该术语包括天然序列Fc区和变体Fc区。在一个实施例中,人IgG重链Fc区从Cys226或从Pro230延伸至重链的羧基末端。然而,Fc区的C末端赖氨酸(Lys447)可以存在或不存在。除非本文另有说明,否则Fc区或恒定区中氨基酸残基的编号是根据EU编号系统,也称为EU索引,如Kabat等人,Sequences of Proteins of Immunological Interest,第5版,美国卫生与公众服务部,国立卫生研究院,Bethesda,MD 1991中所述。
“框架”或“FR”是指除高变区(HVR)残基之外的可变结构域残基。可变结构域的FR通常由以下四个FR结构域组成:FR1、FR2、FR3和FR4。因此,HVR和FR序列通常在VH(或VL)中以如下序列出现:FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。
术语“全长抗体”、“完整抗体”及“全抗体”在本文中可互换地用于指代具有基本上类似于天然抗体结构的结构或具有含有如本文所定义的Fc区的重链的抗体。
术语“宿主细胞”、“宿主细胞系”与“宿主细胞培养物”可互换使用并且是指其中已引入外源核酸的细胞,包括此类细胞的后代。宿主细胞包括“转化体”和“转化细胞”,其包括原代转化细胞和来源于所述原代转化细胞的子代,不考虑传代次数。子代可能不与亲本细胞的核酸内容物完全一致,而是可能含有突变。本文包括如在原始转化细胞中筛选或选择的具有相同功能或生物活性的突变子代。
“人抗体”是这样的抗体,该抗体具有的氨基酸序列对应于由人或人细胞产生的抗体的氨基酸序列,或来源于利用人抗体全套库或其他人抗体编码序列的非人源的抗体的氨基酸序列。人抗体的该定义特别地排除了包含非人抗原结合残基的人源化抗体。
“人共有框架”是这样的框架,其表示在人免疫球蛋白VL或VH框架序列的选择中最常存在的氨基酸残基。一般而言,人免疫球蛋白VL或VH序列的选择来自于可变结构域序列的亚组。一般而言,序列的亚组是如Kabat等人,Sequences of Proteins ofImmunological Interest,第5版,NIH Publication 91-3242,Bethesda MD(1991),第1-3卷中所述的亚组。在一个实施例中,对于VL,该亚组是如Kabat等人(出处同上)中的亚组κI。在一个实施例中,对于VH,该亚组是如Kabat等人(出处同上)中的亚组III。
“人源化”抗体是指这样的嵌合抗体,其包含来自非人HVR的氨基酸残基和来自人FR的氨基酸残基。在某些实施例中,人源化抗体将基本上包含所有的至少一个,通常两个可变结构域,其中所有或基本上所有HVR(例如CDR)对应于非人抗体的HVR,并且所有或基本上所有的FR对应于人抗体的FR。人源化抗体任选地可以包含来源于人抗体的抗体恒定区的至少一部分。“人源化形式”的抗体,例如,非人抗体,是指已经进行过人源化的抗体。
如本文所用的术语“高变区”或“HVR”是指在序列中高变(“互补决定区”或“CDR”)和/或形成结构上限定的环(“高变环”)和/或含有抗原接触残基(“抗原接触点”)的抗体可变结构域的区域每一种。通常,抗体包含六个HVR(例如,CDR):三个在VH中(H1、H2、H3),并且三个在VL中(L1、L2、L3)。本文中的示例性HVR包括:
(a)在氨基酸残基26-32(L1)、50-52(L2)、91-96(L3)、26-32(H1)、53-55(H2)和96-101(H3)处发生的高可变环(Chothia和Lesk,J.Mol.Biol.196:901-917(1987));
(b)存在于氨基酸残基24-34(L1)、50-56(L2)、89-97(L3)、31-35b(H1)、50-65(H2)和95-102(H3)处的CDR(Kabat等人,Sequences of Proteins of ImmunologicalInterest,第5版,美国卫生与公众服务部,国立卫生研究院,Bethesda,MD(1991));
(c)存在于氨基酸残基27c-36(L1)、46--55(L2)、89--96(L3)、30-35b(H1)、47--58(H2)和93--101(H3)处的抗原接触点(MacCallum等人J.Mol.Biol.262:732-745(1996));和
(d)(a)、(b)和/或(c)的组合,包括HVR氨基酸残基46-56(L2)、47-56(L2)、48-56(L2)、49-56(L2)、26-35(H1)、26-35b(H1)、49-65(H2)、93-102(H3)和94-102(H3)。
在一个实施例中,HVR残基包括图12至16和18至24或本说明书其他地方鉴定的那些。
除非另外指明,否则可变结构域中的HVR残基和其他残基(例如,FR残基)在本文中根据Kabat等人,出处同上编号。
“免疫缀合物”是与一种或多种异源分子(包括但不限于细胞毒性剂)缀合的抗体。
“个体”或“受试者”是哺乳动物。哺乳动物包括但不限于驯养的动物(例如牛、绵羊、猫、犬和马)、灵长类动物(例如人和非人灵长类动物,诸如猴)、兔以及啮齿动物(例如小鼠和大鼠)。在某些实施例中,该个体或受试者为人。
“分离的”抗体为已从其自然环境的组分中分离的抗体。在一些实施例中,将抗体纯化至大于95%或99%的纯度,如通过例如电泳(例如,SDS-PAGE、等电聚焦(IEF)、毛细管电泳)或色谱(例如,离子交换或反相HPLC)所确定。关于用于评估抗体纯度的方法的综述,参见例如Flatman,S.等人,J.Chromatogr.B 848:79-87(2007)。
“经分离的”核酸是指已自其自然环境的组分中分离的核酸分子。分离的核酸包括这样的核酸分子,其包含在通常含有核酸分子的细胞中,但该核酸分子存在于染色体外或与其天然染色体位置不同的染色体位置处。
“编码同种型选择性抗TGFβ抗体的分离的核酸”是指编码抗体重链和轻链(或其片段)的一个或多个核酸分子,包括在单一载体或单独的载体中的此类核酸分子,以及存在于宿主细胞中一个或多个位置的此类核酸分子。
如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即,除了可能的变异抗体(例如,含有天然存在的突变或在单克隆抗体制剂的生产过程中产生,此类变体通常以少量形式呈递)之外,包含该群体的各个抗体是相同的和/或结合相同的表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂中的每种单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆”表示抗体的特征是从基本上同质的抗体群体获得的,并且不应解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可通过多种技术制备,包括但不限于杂交瘤方法、重组DNA方法、噬菌体展示方法,以及利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,在本文中描述了用于制备单克隆抗体的此类方法和其他示例性方法。
“裸抗体”是指不缀合至异源部分(例如,细胞毒性部分)或放射性标记的抗体。裸抗体可存在于药物制剂中。
“天然抗体”是指具有不同结构的天然存在的免疫球蛋白分子。例如,天然IgG抗体是约150,000道尔顿的异四聚体糖蛋白,由经二硫键合的两条相同轻链和两条相同重链构成。从N端至C端,每条重链均具有可变区(VH),亦称为可变重链结构域或重链可变结构域,随后为三个恒定结构域(CH1、CH2和CH3)。类似地,自N末端至C末端,各轻链具有可变区(VL),也称为可变轻链结构域或轻链可变结构域,继之以恒定轻链(CL)结构域。抗体的轻链基于其恒定结构域的氨基酸序列,可以归属于两种类型中的一种,这两种类型称为卡帕(κ)和兰姆达(λ)。
术语“包装插页”用于指治疗产品的商业包装中通常包括的说明书,其含有涉及此类治疗产品的使用的有关适应症、用法、剂量、施用、联合疗法、禁忌症和/或警告的信息。
相对于参照多肽序列的“氨基酸序列同一性百分比(%)”定义为在比对候选序列与参考多肽序列并引入空位(如果必要的话)以实现最大的序列同一性百分比之后,并且在不考虑将任何保守取代作为序列同一性的组成部分的情况下,候选序列中的氨基酸残基与参考多肽序列中的氨基酸残基相同的百分比。用于确定氨基酸序列同一性百分比的比对可以以本领域技术范围内的各种方式实现,例如使用可公开获得的计算机软件,诸如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域技术人员可确定用于比对序列的适当参数,包括在所比较的序列的全长上实现最大比对所需的任何算法。然而,为了本文的目的,使用序列比较计算机程序ALIGN-2来生成氨基酸序列同一性%的值。ALIGN-2序列比较计算机程序由基因泰克公司(Genentech,Inc.)编写,并且源代码已经与用户文档一起提交到U.S.Copyright Office,Washington D.C.,20559,在那里以美国版权登记号TXU510087注册。ALIGN-2程序可从基因泰克公司(Genentech,Inc.,South San Francisco,California)公开获得,或者可以从所述源代码编译。ALIGN-2程序应经编译以在UNIX操作系统上使用,所述UNIX操作系统包括数字UNIX V4.0D。所有序列比较参数均由ALIGN-2程序设置并且不变。
在采用ALIGN-2进行氨基酸序列比较的情况下,给定氨基酸序列A与给定氨基酸序列B的氨基酸序列同一性%(其可以替代地表达为给定氨基酸序列A具有或包含与给定氨基酸序列B的某一氨基酸序列同一性%)计算如下:
100乘以分数X/Y
其中X是由序列比对程序ALIGN-2在该程序对A和B的比对中评分为相同匹配的氨基酸残基的数目,而其中Y是B中氨基酸残基的总数。应当理解,在氨基酸序列A的长度不等于氨基酸序列B的长度的情况下,A与B的氨基酸序列同一性%将不等于B与A的氨基酸序列同一性%。除非另外特别指明,否则本文所使用的所有氨基酸序列同一性%的值是如前一段中所述使用ALIGN-2计算机程序获得的。
术语“药物制剂”是指处于允许包含在其中的活性成分的生物活性有效的形式,并且不含对于将被施用制剂的受试者具有不可接受的毒性的另外组分的制剂。
“药用载体”是指药物制剂中除活性成分外的对受试者无毒的成分。药用载体包括但不限于缓冲剂、赋形剂、稳定剂,或防腐剂。
如本文所用,“治疗(treatment)”(及其语法变型,诸如“治疗(treat)”或“治疗(treating)”)是指试图改变所治疗个体的自然进程的临床干预,并且可以是为了预防或在临床病理学的进程中进行。治疗的期望效果包括但不限于预防疾病的发生或复发、减轻症状、削弱疾病的任何直接或间接病理学后果、预防转移、降低疾病进展的速率、改善或减轻疾病状态,以及缓解或改善预后。在一些实施例中,本发明的抗体用于延迟疾病的发展或减缓疾病的进展。
术语“可变区”或“可变结构域”是指抗体重链或轻链的参与抗体与抗原结合的结构域。天然抗体的重链和轻链的可变结构域(分别为VH和VL)通常具有相似的结构,其中每个结构域包含四个保守框架区(FR)和三个高变区(HVR)。(参见,例如,Kindt等人。KubyImmunology,第6版,W.H.Freeman and Co.,第91页(2007)。)单个VH或VL结构域可足以赋予抗原结合特异性。此外,结合特定抗原的抗体可分别使用来自结合该抗原的抗体的VH或VL结构域来进行分离,以筛选互补VL或VH结构域的文库。参见例如,Portolano等人,J.Immunol.150:880-887(1993);Clarkson等人,Nature 352:624-628(1991)。
如本文所用的术语“载体”是指能够载运与其相连的另一核酸的核酸分子。该术语包括作为自我复制核酸结构的载体,以及并入其已被引入的宿主细胞的基因组中的载体。某些载体能够指导与其可操作地连接的核酸的表达。此类载体在本文中称为“表达载体”。
在本文中使用时,“和/或”将被视为两个特定特征或部件中的每一个的具体公开,其中包含或不包含另一个。例如,“A和/或B”将被视为(i)A、(ii)B和(iii)A和B中每一个的具体公开,就好像每一个在本文中单独列出一样。
II.用于校准和质量控制的
在一方面,本发明部分地基于提供同种型选择性抗TGFβ抗体(例如,单特异性抗TGFβ2和抗TGFβ3抗体,以及双特异性抗TGFβ2/3抗体)及其使用方法。TGFβ牵涉到对几种关键细胞功能的控制中,包括细胞增殖、分化、迁移、凋亡和细胞外基质产生。因此,生长因子影响许多生物学过程,包括胚胎发育、伤口修复、免疫功能、恶性转化和衰老。本发明的同种型选择性抗TGFβ抗体因此可用于例如诊断或治疗TGFβ相关疾患,诸如但不限于纤维化疾病和癌症。
在一些方面,提供由同种型选择性抗TGFβ抗体结合的表位。基于它们的晶体结构确定同种型选择性抗TGFβ抗体的抗原结合结构域。举例而言,2A10和4A11抗体的结合表位是通过解析它们的抗体/TGFβ复合物晶体结构来映射的。参见下文实例10。如本领域技术人员将理解的,来自实例10的结果证明,抗TGFβ2/3抗体4A11在何处与TGFβ2相互作用(并且通过推断,他还在何处结合在TGFβ3中相同的高度保守区域内),以及抗TGFβ3抗体2A10在何处与TGFβ3相互作用。因此,与TGFβ2或TGFβ3中的任何这些残基相互作用或阻断这些次残基的抗体可分别用作中和TGFβ2或TGFβ3的抗体。在一些实施例中,抗体在与其靶标TGFβ同种型结合,与TGFβ同种型上的残基相互作用或阻断该残基,或在该残基的15-8、8、8-7、8-6、8-5或5埃内时,预期提供对TGFβ同种型的有用中和。作为非限制性实例,抗TGFβ3抗体2A10被确定为与TGFβ3上含有氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398的表位在人TGFβ3上结合(即抗原结合结构域直接接触TGFβ3上的那些残基),且这种结合导致TGFβ3的中和。因此,在一些实施例中,当抗体与TGFβ3结合,与TGFβ3上的那些残基相互作用或阻断那些残基,或在那些残基的15-8、8、8-5或优选地5埃内时,预期提供TGFβ3的有用的中和作用。作为进一步的非限制性实例,确定抗TGFβ2/3抗体4A11与TGFβ2同源二聚体结合,并直接接触该同源二聚体的第一TGFβ2单体中的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347以及第二TGFβ2单体中的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377。因此,在一些实施例中,当抗体与TGFβ2结合,与TGFβ2上的那些残基相互作用或阻断那些残基,或在那些残基的15-8、8、8-5或优选地5埃内时,预期提供TGFβ2的有用的中和作用。在一些实施例中,抗原结合结构域在距上述残基中的一者或多者30、30-25、25-20、20-15、15-8、8、8-5、5、5-4、4埃或更小的范围内结合。在一些实施例中,当与TGFβ同种型结合时,抗原结合结构域对于上述残基中的超过一者在上述距离中的至少一者内。例如,在一些实施例中,抗原结合结构域对于上述残基中的至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、20-25、25-30、30-35、35-40、40-45、45-50、50-55、55-60、60-65、65-70、70-75或更多者在所述距离中的一者内(例如,30、30-25、25-20、20-15、15-8、8、8-5、5、5-4、4或更小)。在一些实施例中,抗原结合结构域对于在每个组或其亚组(诸如仅该组中的那些表面残基)中鉴定的残基中的至少1-10、10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90、90-95、95-99、99-100%在所述距离中的一者内。除非另有明确说明,否则抗原结合结构域与TGFβ同种型之间的距离为TGFβ同种型上的共价键合原子与抗原结合结构域的共价键合原子之间的最短距离,该共价键合原子为TGFβ同种型与抗原结合结构域的最接近的原子。类似地,除非另有明确说明,否则抗原结合结构域上的残基与该残基对于其有特异性的TGFβ同种型之间的距离是从已鉴定残基上的最近点到该TGFβ同种型最近共价结合部分的距离,或反之亦然。在一些实施例中,该距离可以从氨基酸链的主链测量。在一些实施例中,可以测量互补位的边缘与表位的边缘(彼此最接近)之间的距离。在一些实施例中,可以测量互补位表面中心与表位表面中心之间的距离。如本领域技术人员将理解的,本描述适用于本文列出的每组单独的残基。例如,对于实例10中列出的表位和互补位残基,一般且具体地考虑上述范围。
A.示例性同种型选择性抗TGFβ抗体
抗TGFβ2抗体
在一方面,本发明提供分离的抗体,其与TGFβ2结合。在某些实施例中,抗TGFβ2抗体选择性地中和TGFβ2。在某些实施例中,抗TGFβ2抗体具有以下特性中的一项或多项:(a)选择性地中和TGFβ2;(b)具有相对于泛TGFβ抗体1D11的减少的毒性;(c)具有相对于泛TGFβ抗体1D11的减少的毒性;(d)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(e)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(f)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。
在某些方面,本文提供的抗TGFβ2抗体以小于10pM的K
在一方面,本发明提供一种抗TGFβ2抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
在一方面,本发明提供一种抗TGFβ2抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列。在另一方面,本发明提供一种抗体,其包含(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列。
在另一方面,本发明提供一种抗TGFβ2抗体,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。在一个实施例中,该抗体包含(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
在另一实施例中,抗TGFβ2抗体包含:HVR-H3,其包含SEQ ID NO:18的氨基酸序列;和HVR-L3,其包含SEQ ID NO:21的氨基酸序列。在进一步的实施例中,抗TGFβ2抗体包含:HVR-H3,其包含SEQ ID NO:18的氨基酸序列;HVR-L3,其包含SEQ ID NO:21的氨基酸序列;和HVR-H2,其包含SEQ ID NO:17的氨基酸序列。
在另一个方面,本发明的抗TGFβ2抗体包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(ii)HVR-H2,其包含SEQ ID NO:17氨基酸序列;和(iii)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(i)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
在另一方面,本发明提供一种抗TGFβ2抗体,其包含a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQID NO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
在任何上述实施例中,抗TGFβ2抗体可以是人源化的。在一个实施例中,抗TGFβ2抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在任何上述实施例中,人源化抗TGFβ2抗体包含在VH框架中的一个或多个突变,该突变选自由以下项所组成的组:37V或37I、48M或48L、49G或49A、67L、71K和78V、和105P或105R。在一些实施例中,抗TGFβ2抗体包含VH,其中VH包含SEQ ID NO:25的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架突变:(i)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(ii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(h6F12.v2和h6F12.v4);(iii)FR2中的37I(h6F12.v1.6);(iv)FR2中的48L(h6F12.v1.7);(v)FR2中的49A(h6F12.v1.8);(vi)FR4中的105R(h6F12.v1.9);(vii)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(viii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(6F12.v2和h6F12.v4);(ix)FR2中的37I(h6F12.v1.6);(x)FR2中的48L(h6F12.v1.7);(xi):FR2中的49A(h6F12.v1.8);和(xii)FR4中的105R(h6F12.v1.9)。在任何上述实施例中,人源化抗TGFβ2抗体在包含VL框架中的一个或多个突变,该突变选自由以下项所组成的组:43S或43A、66G、69T、71F和87Y。在一些实施例中,抗TGFβ2抗体包含VL,其中VL包含SEQ ID NO:24的氨基酸序列,其中VL包含选自由以下项所组成的组的一组框架突变:(i)FR2中的43S,和FR3中的66E、69P、71Y和87F(h6F12.v1和h6F12.v2);(ii)FR2中的43S,和FR3中的58V、66E、69P、71Y和87F(h6F12.v3和h6F12.v4);(iii)FR2中的43A(h6F12.v1.1);(iv)FR3中的66G(h6F12.v1.2);(v)FR3中的69T(h6F12.v1.3);(vi)FR3中的71F(h6F12.v1.4);和(vii)FR3中的87Y(h6F12.v1.5)。
在另一方面,抗TGFβ2抗体包含与选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列。在某些实施例中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的VH序列含有相对于参考序列的取代(例如,保守取代)、插入或缺失,但是包含该序列的同种型选择性抗TGFβ抗体保留了与TGFβ2结合并选择性地中和TGFβ2的能力。在某些实施例中,在SEQ ID NO:25中,总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施例中,取代、插入或缺失发生在HVR之外的区域(即,在FR中)。任选地,抗TGFβ2抗体包含选自由以下项所组成的组的VH序列:SEQ IDNO:25、132和138至142,包括该序列的翻译后修饰。在一具体实施例中,VH包含一个、两个或三个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列。
在另一方面,提供一种抗TGFβ2抗体,其中该抗体包含与选自由SEQ ID NO:24、131、133至137、143和144所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL)。在某些实施例中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的VL序列包含相对于参考序列的取代(例如保守取代)、插入或缺失,但是包含该序列的抗TGFβ2抗体保留了与PRO结合的能力。在某些实施例中,在SEQ ID NO:24中,总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施例中,该取代、插入或缺失发生在HVR之外的区域(即,在FR中)。任选地,抗TGFβ2抗体包含选自由以下项所组成的组的VL序列:SEQ ID NO:24、131、133至137、143和144,包括该序列的翻译后修饰。在特定实施例中,该VL包含一个、两个或三个选自以下项的HVR:(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ IDNO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
在另一方面,提供一种抗TGFβ2抗体,其中该抗体包含如上述任一实施例中提供的VH和如上述任一实施例中提供的VL。在一个实施例中,该抗体包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:25/24(兔6F12)、SEQ ID NO:132/131(v1)、SEQ ID NO:132/133(v1.1)、SEQ ID NO:132/134(v1.2)、SEQ ID NO:132/135(v1.3)、SEQ ID NO:132/136(v1.4)、SEQ ID NO:132/137(v1.5)、SEQ ID NO:138/131(v1.6)、SEQ ID NO:139/131(v1.7)、SEQ ID NO:140/131(v1.8)、SEQ ID NO:141/131(v1.9)、SEQ ID NO:142/131(v2)、SEQ ID NO:132/143(v3)和SEQ ID NO:142/144(v4),包括那些序列的翻译后修饰。
在另一方面,提供一种抗TGFβ2抗体,其中该抗体包含与选自由SEQ ID NO:31、146和152至156所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:30、145、147至151、157和158所组成的组的氨基酸序列的完整L链氨基酸序列。在一些实施例中,抗TGFβ2抗体包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:31/30(兔6F12)、SEQ ID NO:146/145(v1)、SEQ ID NO:146/147(v1.1)、SEQ ID NO:146/148(v1.2)、SEQ ID NO:146/149(v1.3)、SEQ ID NO:146/150(v1.4)、SEQ ID NO:146/151(v1.5)、SEQ ID NO:152/145(v1.6)、SEQID NO:153/145(v1.7)、SEQ ID NO:154/145(v1.8)、SEQ ID NO:155/145(v1.9)、SEQ IDNO:156/145(v2)、SEQ ID NO:146/157(v3)和SEQ ID NO:156/158(v4)。
在又一方面,本发明提供一种抗体,其与本文所提供的抗TGFβ2抗体所结合的相同表位结合。例如,在某些实施例中,提供一种与抗TGFβ2抗体结合相同表位的抗体,该抗体包含a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQID NO:21的氨基酸序列。
抗TGFβ2/3抗体
另一方面,本发明提供与TGFβ2和TGFβ3两者结合的分离的抗体(抗TGFβ2/3抗体)。在某些方面,该抗体选择性地中和TGFβ2和TGFβ3,并且包括以下特征中的一项或多项:
(a)关于选择性中和,通过抗体的抗原结合结构域与TGFβ2或TGFβ3的氨基酸残基E373(人TGFβ2编号)的直接接触,实现抗TGFβ2/3抗体相对于人TGFβ1对TGFβ2和TGFβ3的选择性;
(b)抗TGFβ2/3抗体经由变构机制而中和TGFβ2和/或TGFβ3;
(c)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化;
(d)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化,其中该构象变化包括两个单体夹在一起几度;
(e)抗TGFβ2/3抗体为二价抗体或单价抗体;
(f)抗TGFβ2/3抗体包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;
(g)抗TGFβ2/3抗体与TGFβ2同源二聚体结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,并且其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触(i)第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和(ii)第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(人TGFβ2编号);
(h)如(g)中的抗TGFβ2/3抗体,其中该抗原结合结构域位于TGFβ2和/或TGFβ3氨基酸残基的5埃内;
(i)其中抗TGFβ2/3抗体与TGFβ3中的与(g)中基本类似的表位结合;且
(j)抗TGFβ2/3抗体不中和单臂形式的TGFβ2和/或TGFβ3。
在某些实施例中,抗TGFβ2/3抗体选择性地中和TGFβ2和TGFβ3。在某些方面,本文提供的抗TGFβ2/3抗体以小于10pM的K
在一方面,本发明提供包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸抗TGFβ2/3抗体序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:15的氨基酸序列。
在一方面,本发明提供一种抗TGFβ2/3抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸抗TGFβ2/3抗体序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列。在一方面,该抗体包含HVR-H3,其包含SEQ ID NO:12的氨基酸序列。在另一方面,该抗体包含HVR-H3,其包含SEQ ID NO:12的氨基酸序列;和HVR-L3,其包含SEQ ID NO:15的氨基酸序列。在进一步的方面,该抗体包含HVR-H3,其包含SEQ ID NO:12的氨基酸序列;HVR-L3,其包含SEQ ID NO:15的氨基酸序列;和HVR-H2,其包含SEQ ID NO:11的氨基酸序列。在进一步的方面,该抗体包含(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列。
在另一方面,本发明提供一种抗TGFβ2/3抗体,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(a)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:15的氨基酸序列。在一个实施例中,抗TGFβ2/3抗体包含:(a)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:15的氨基酸序列。
在另一个方面,本发明的抗TGFβ2/3抗体包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(ii)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;和(iii)HVR-H3,其包含选自SEQ ID NO:12的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VLHVR序列:(i)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:15的氨基酸序列。
在另一方面,本发明提供一种抗TGFβ2/3抗体,其包含(a)HVR-H1,其包含SEQ IDNO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:15的氨基酸序列。
在任何上述实施例中,抗TGFβ2/3抗体可以是人源化的。在一个实施例中,抗TGFβ2/3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在另一个实施例中,抗TGFβ2/3抗体包含如任何上述实施例中的HVR,并且进一步包含VH,该VH包含选自由以下项所组成的组的FR修饰:1E、2Q或2V、24V、37V或37I、48I、49G、67F或67V、71K或71V、73S或73T,缺失75K和76N、78V或78F、91F或91Y、105P或105Q。在一些实施例中,抗TGFβ2/3抗体包含VH,其中VH包含SEQ ID NO:27的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2Q和24V,FR2中的48I和49G,FR3中的71K、73S、78V和91F,和FR4中的105P(h4A11.v1、h4A11.v2、h4A11.v5、h4A11.v6);(ii)FR1中的2Q,FR2中的37V,FR3中的67F、71K、73S、78V和91F,和FR4中的105P(h4A11.v3、h4A11.v4、4A11.v7、h4A11.v8);(iii)缺失FR1中的1E(h4A11.v7.1);(iv)缺失FR3中的75K和76N(h4A11.v7.2);(v)缺失FR1中的1E和FR3中的75K76N(h4A11.v7.3);(vi)FR1中的2V(h4A11.v7.8);(vi)FR2中的37I(h4A11.v7.9);(vii)FR3中的67V(h4A11.v7.10);(viii)FR3中的71V(h4A11.v7.11);(ix)FR3中的73T(h4A11.v7.12);(x)FR3中的78F(h4A11.v7.13);(xi)FR3中的91Y(h4A11.v7.14);(xii)FR4中的105Q(h4A11.v7.15);(xiii)FR1中的2V,FR2中的37I,FR3中的67V、73T、78F,FR4中的105Q(h4A11.v7.16);(xiv)FR1中的2V,FR2中的37I,FR3中的67V、73T、91Y,FR4中的105Q(h4A11.v7.17);(xv)FR1中的2V,FR2中的37I,FR3中的67V、73T,FR4中的105Q(h4A11.v7.18);和(xvi)FR1中的2V,FR2中的37I,FR3中的67V、73T、缺失75K和76N,FR4中的105Q(h4A11.v7.19)。在另一实施例中,抗TGFβ2/3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:2A或2I、4L、36F或36Y、43P或43A、和58V或58I。在一些实施例中,抗TGFβ2/3抗体包含VL,其中VL包含SEQ ID NO:26的氨基酸序列,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2A和4L,和FR2中的36F(h4A11.v1和h4A11.v3);(ii)FR1中的2A和4L,和FR2中的36F和43P(h4A11.v2和h4A11.v4);(iii)FR1中的2A,FR2中的36F和43P,和FR3中的58V(h4A11.v5和h4A11.v7);(iv)FR1中的2A和4L,和FR2中的36F(h4A11.v6和h4A11.v8);(v)FR1中的2I(h4A11.v7.4);(vi)FR2中的36Y(h4A11.v7.5);(vii)FR2中的43A(h4A11.v7.6);(viii)FR3中的58I(h4A11.v7.7);和(ix)FR1中的2I,FR2中的43A,FR3中的58I(h4A11.v7.16-19)。
在另一方面,抗TGFβ2/3抗体包含与选自由SEQ ID NO:27、81、83、86至88、93至100和102至105所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列。在某些实施例中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的VH序列包含相对于参考序列的取代(例如保守取代)、插入或缺失,但是包含该序列的抗TGFβ2/3抗体保留了与TGFβ2结合和与TGFβ3结合的能力。在某些实施例中,在SEQ ID NO:27中,总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施例中,取代、插入或缺失发生在HVR之外的区域(即,在FR中)。任选地,抗TGFβ2/3抗体包含选自由以下项所组成的组的VH序列:SEQ ID NO:SEQ ID NO:27、81、83、86-88、93至100和102至105,包括该序列的翻译后修饰。在一具体实施例中,VH包含一个、两个或三个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列,(b)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;和(c)HVR-H3,其包含SEQ IDNO:12的氨基酸序列。
在另一方面,提供一种抗TGFβ2/3抗体,其中该抗TGFβ2/3抗体包含与选自由SEQID NO:26、80、82、84、85、89至92和101所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL)。在某些实施例中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的VL序列包含相对于参考序列的取代(例如保守取代)、插入或缺失,但是包含该序列的抗TGFβ2/3抗体保留了与TGFβ2结合和与TGFβ3结合的能力。在某些实施例中,在SEQ ID NO:26中,总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施例中,该取代、插入或缺失发生在HVR之外的区域(即,在FR中)。任选地,抗TGFβ2/3抗体包含选自由以下项所组成的组的VL序列:SEQ ID NO:26、80、82、84、85、89至92和101,包括该序列的翻译后修饰。在特定实施例中,该VL包含一个、两个或三个选自以下项的HVR:(a)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:15的氨基酸序列。
在另一方面,提供一种抗TGFβ2/3抗体,其中该抗体包含如上述任一实施例中提供的VH和如上述任一实施例中提供的VL。在一个实施例中,该抗TGFβ2/3抗体包含(分别)选自由以下项所组成的组的VH和VL序列:SEQ ID NO:27/26(兔4A11)、SEQ ID NO:81/80(v1)、SEQ ID NO:81/82(v2)、SEQ ID NO:83/80(v3)、SEQ ID NO:83/82(v4)、SEQ ID NO:81/84(v5)、SEQ ID NO:81/85(v6)、SEQ ID NO:83/84(v7)、SEQ ID NO:86/84(v7/1)、SEQ ID NO:87/84(v7.2)、SEQ ID NO:88/84(v7.3)、SEQ ID NO:83/89(v7.4)、SEQ ID NO:83/90(v7.5)、SEQ ID NO:83/91(v7.6)、SEQ ID NO:83/92(v7.7)、SEQ ID NO:93/84(v7.8)、SEQID NO:94/84(v7.9)、SEQ ID NO:95/84(v7.10)、SEQ ID NO:96/84(v7.11)、SEQ ID NO:97/84(v7.12)、SEQ ID NO:98/84(v7.13)、SEQ ID NO:99/84(v7.14)、SEQ ID NO:100/84(v7.15)、SEQ ID NO:102/101(v7.16)、SEQ ID NO:103/101(v7.17)、SEQ ID NO:104/101(v7.18)、SEQ ID NO:105/101(v7.19)、SEQ ID NO:83/85(v8),包括那些序列的翻译后修饰。
在另一方面,提供一种抗TGFβ2/3抗体,其中该抗体包含与选自由SEQ ID NO:33、107、109、112至114和119至130所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:32、106、108、110、111、115至118和186所组成的组的氨基酸序列的完整L链氨基酸序列。在一些实施例中,抗TGFβ2/3抗体包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:32/33(兔4A11)、SEQ ID NO:107/106(v1)、SEQ ID NO:107/108(v2)、SEQ ID NO:109/106(v3)、SEQ ID NO:109/108(v4)、SEQ ID NO:107/110(v5)、SEQ ID NO:107/111(v6)、SEQ ID NO:109/110(v7)、SEQ ID NO:112/110(v7.1)、SEQ ID NO:113/110(v7.2)、SEQ ID NO:114/110(v7.3)、SEQ ID NO:114/115(v7.4)、SEQ ID NO:114/116(v7.5)、SEQ ID NO:114/117(v7.6)、SEQ ID NO:114/118(v7.7)、SEQ ID NO:119/110(v7.8)、SEQ ID NO:120/110(v7.9)、SEQ ID NO:121/110(v7.10)、SEQ ID NO:122/110(v7.11)、SEQ ID NO:123/110(v7.12)、SEQ ID NO:124/110(v7.13)、SEQ ID NO:125/110(v7.14)、SEQ ID NO:126/110(v7.15)、SEQ ID NO:127/186(v7.16)、SEQ ID NO:128/186(v7.17)、SEQ ID NO:129/186(v7.18)、SEQ ID NO:130/186(v7.19)和SEQ ID NO:114/111(v8)。
在又一方面,本发明提供一种抗TGFβ2/3抗体,其与本文所提供的抗TGFβ2/3抗体所结合的相同表位结合。例如,在某些实施例中,提供一种与抗TGFβ2/3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQID NO:11的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:15的氨基酸序列。在某些实施例中,提供一种抗TGFβ2/3抗体,其与跨越TGFβ2同源二聚体的表位结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377,并且其中在一些实施例中,该抗TGFβ2/3抗体与TGFβ3中的相同表位结合。TGFβ2和TGFβ3在包含氨基酸位置368至377(TGFβ2编号)的区处高度保守,因此抗TGFβ2/3抗体与TGFβ2和TGFβ3中的相同区结合。
抗TGFβ3抗体
在一方面,本发明提供分离的抗体,其与TGFβ3结合。在某些实施例中,抗TGFβ3抗体选择性地中和TGFβ3。此外,目前发现,与泛TGFβ抑制剂相比以及与对于TGFβ2(实例2)和抗TGFβ1选择性抗体具有特异性的同种型选择性抗体相比,本文所述的抗TGFβ3抗体具有改进的安全性(例如,降低的毒性)。已经在临床前毒理学研究中研究了几种TGFβ信号传导抑制剂,包括TGFBR1(ALK5)激酶活性的小分子抑制剂(例如galunisertib)和基于抗体的TGFβ-TGFBR相互作用抑制剂(例如,非苏木单抗,一种泛TGFβ抗体)两者。来自不同化学系列的ALK5小分子抑制剂的大鼠毒理学研究一致地显示出血性、炎症性和退行性心脏瓣膜病灶和骨骺发育不良(Frazier Toxicol Pathol 35,284–95.2007;Anderton Toxicol Pathol39:916,2011)。在早期临床研究中,galunisertib以不完全抑制ALK5活性的水平给药相对较短的时间,临床上尚未出现心脏检查结果。用泛TGFβ抗体1D11盒子里的小鼠(Lonning等人(2011)Current Pharmaceutical Biotechnology,12,2176-2189)发展出组织学病灶、体重减轻、非肿瘤性囊性上皮增生和舌头炎症、牙齿发育不良以及牙龈和食管的上皮增生。非苏木单抗为GC1008抗体的人源化形式,可与所有三种TGFβ同种型结合并抑制其活性,对TGFβ同种型具有与1D11抗体相当的亲和力,在食蟹猴中进行了研究,并导致剂量依赖性出血、贫血以及泌尿系统、鼻和膀胱上皮细胞中的增生。在人类中,非苏木单抗治疗导致贫血和出血(牙龈、鼻腔和结膜下),以及随着治疗停止而逆转的角化棘皮瘤(癌前鳞状皮肤病变)发生率增加(Rice,JCI 125:2795(2015);Lacouture,Cancer Immunol Immunother64:437(2015))。主要对TGFβ1具有选择性的抗体CAT-192(美替木单抗)具有高严重不良事件发生率:在SSc的1至2期研究中观察到多处胃出血(Denton A&R 56:323(2007);也参见网站tripod.nih.gov/ginas/app/substance/4AR6718OL0)。总之,这些观察结果表明,出血、心脏病灶和上皮增生是长期慢性药理学TGFβ抑制的重要问题。
与过去在体内中和TGFβ的尝试中观察到的有关安全性问题相反,在某些方面,本发明提供了具有改善的安全性(例如,降低的毒性)的抗TGFβ3抗体。例如,在下面的实例2中,用以高达50mg/kg剂量每周三次施用持续4周的抗TGFβ3抗体治疗的小鼠没有或具有非常轻微的副效应(在最高剂量的骺发育不良),并且如上所述,没有观察到由小分子抑制剂、抗TGFβ1或泛TGFβ抗体引起的危重中副效应。还发现本文所述的抗TGFβ3抗体相对于同种型选择性抗TGFβ2/3和抗TGFβ2抗体具有改善的安全性(实例2,参见表8)。
在某些方面,提供一种分离的抗TGFβ3抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:
(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区结合;
(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;
(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;
(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性。
(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
在某些方面,本文提供的抗TGFβ3抗体以小于10pM的K
在另一方面,本文提供的抗TGFβ3抗体选择性地中和TGFβ3并且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性(参见Lonning等人,(2011))。在另一方面,本文提供的抗TGFβ3抗体选择性地中和TGFβ3并具有改善的安全性,例如相对于泛TGFβ抑制剂诸如Anderton等人描述的ALK5抑制剂和/或Lonning等人(2011)中所述的1D11抗体。在另一方面,相对于抗TGFβ1抗体CAT-192/美替木单抗,本文提供的抗TGFβ3抗体选择性地中和TGFβ3并且具有在小鼠中减少的毒性。
在某些方面,CAT-192抗体具有以下重链和轻链可变氨基酸序列:
VH
EVQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGKELEWVAVISYDGSIKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARTGEYSGYDTDPQYSWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKPTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:184)。
VL
EIVLTQSPSSLSASVGDRVTITCRASQGIGDDLGWYQQKPGKAPILLIYGTSTLQSGVPSRFSGSGSGTDFTLTINSLQPEDFATYYCLQDSNYPLTFGGGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSPVTKSFNRGEC(SEQ IDNO:185)。
在任何上述方面,本发明提供一种抗TGFβ3抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含选自SEQ ID NO:5、34、35和159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:9的氨基酸序列。
在一方面,本发明提供一种抗TGFβ3抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在另一方面,本发明提供一种抗TGFβ3抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在另一方面,本发明提供一种抗TGFβ3抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在另一方面,本发明提供一种抗TGFβ3抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ IDNO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。
在一方面,该抗体包含HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在另一方面,该抗体包含HVR-H3,其包含SEQ ID NO:6的氨基酸序列;和HVR-L3,其包含SEQ ID NO:9的氨基酸序列。在进一步的方面,该抗体包含HVR-H3,其包含SEQ ID NO:6的氨基酸序列;HVR-L3,其包含SEQ ID NO:9的氨基酸序列;和HVR-H2,其包含SEQ ID NO:5的氨基酸序列。在进一步的实施例中,抗TGFβ3抗体包含:HVR-H3,其包含SEQ ID NO:6的氨基酸序列;HVR-L3,其包含SEQ ID NO:9的氨基酸序列;和HVR-H2,其包含SEQ ID NO:34的氨基酸序列。在进一步的实施例中,抗TGFβ3抗体包含:HVR-H3,其包含SEQ ID NO:6的氨基酸序列;HVR-L3,其包含SEQID NO:9的氨基酸序列;和HVR-H2,其包含SEQ ID NO:35的氨基酸序列。在进一步的实施例中,抗TGFβ3抗体包含:HVR-H3,其包含SEQ ID NO:6的氨基酸序列;HVR-L3,其包含SEQ IDNO:9的氨基酸序列;和HVR-H2,其包含SEQ ID NO:159的氨基酸序列。在进一步的实施例中,抗TGFβ3抗体包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在进一步的实施例中,抗TGFβ3抗体包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在进一步的实施例中,抗TGFβ3抗体包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在进一步的实施例中,抗TGFβ3抗体包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。
在另一方面,本发明提供一种抗TGFβ3抗体,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(a)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:9的氨基酸序列。在一个实施例中,该抗体包含(a)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(b)HVR-L2,其包含SEQID NO:8的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:9的氨基酸序列。
在另一个方面,本发明的抗TGFβ3抗体包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(ii)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(iii)HVR-H3,其包含选自SEQ ID NO:6的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(i)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:9的氨基酸序列。在另一个方面,本发明的抗TGFβ3抗体包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(ii)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(iii)HVR-H3,其包含选自SEQ ID NO:6的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(i)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:9的氨基酸序列。在另一个方面,本发明的抗TGFβ3抗体包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(ii)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(iii)HVR-H3,其包含选自SEQ ID NO:6的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(i)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:9的氨基酸序列。在另一个方面,本发明的抗TGFβ3抗体包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(ii)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(iii)HVR-H3,其包含选自SEQ ID NO:6的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(i)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(c)HVR-L3,其包含SEQ IDNO:9的氨基酸序列。
在另一方面,本发明提供一种抗TGFβ3抗体,其包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;(c)HVR-H3,其包含SEQ IDNO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。在另一方面,本发明提供一种抗TGFβ3抗体,其包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。在另一方面,本发明提供一种抗TGFβ3抗体,其包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。在另一方面,本发明提供一种抗TGFβ3抗体,其包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。
在某些实施例中,如上提供的抗TGFβ3抗体的任何一个或多个氨基酸在以下HVR位置被取代:
-在HVR-H2(SEQ ID NO:5)中:在位置N54处(例如,N54S、N54Q)或T56处(例如,T56A)。
在某些实施例中,取代为如本文所提供的保守取代。
在任何上述实施例中,抗TGFβ3抗体可以是人源化的。在一些方面,经过一个或多个人源化步骤的本文提供的抗TGFβ3抗体具有与亲本抗体相似的TGFβ阻断能力和/或与亲本抗体相似的人TGFβ结合,和/或维持溶解性,和/或能够被表达,而此类能力在潜在地或实际地衍生自其他TGFβ3抗体的变体中可能是未知的或未观察到的(实例6,表9和10;图10、11)。在一个实施例中,抗TGFβ3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VH,该VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;以及76N、78D或78L,78A或78V。在一些实施例中,抗TGFβ3抗体包含VH,其中VH包含SEQ ID NO:23的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);(iii)FR2中的47W(h2A10.v1.5);(iv):FR2中的49G(h2A10.v1.6);(v)FR3中的78A(h2A10.v1.7);(vi)FR2中的47W(h2A10.v2.5);(vii)FR2中的49S(h2A10.v2.6);(viii)FR3中的73N(h2A10.v2.7);(ix)FR3中的76N(h2A10.v2.8);(x)FR3中的78L(h2A10.v2.9);和(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:4L或4M、38H或38Q、43A或43Q和58V(相对于SEQ ID NO:22的VL氨基酸序列)。在另一实施例中,该抗体包含SEQ IDNO:22的VL,其中该VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
在另一方面,抗TGFβ3抗体包含与选自由SEQ ID NO:23、37、42至50、55和57所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列。在另一方面,抗TGFβ3抗体包含与选自由SEQID NO:23、37和42至50所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列。在一些方面,抗TGFβ3抗体包含与SEQ ID NO:57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列。在某些实施例中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的VH序列包含相对于参考序列的取代(例如保守取代)、插入或缺失,但是包含该序列的抗TGFβ3抗体保留了与TGFβ3结合的能力。在某些实施例中,在SEQ ID NO:23中,总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施例中,取代、插入或缺失发生在HVR之外的区域(即,在FR中)。任选地,抗TGFβ3抗体包含选自由以下项所组成的组的VH序列:SEQ ID NO:23、37、42至50、55和57,包括该序列的翻译后修饰。任选地,抗TGFβ3抗体包含选自由以下项所组成的组的VH序列:SEQ ID NO:23、37和42至50,包括该序列的翻译后修饰。在一具体实施例中,VH包含一个、两个或三个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在一具体实施例中,VH包含一个、两个或三个选自以下项的HVR:(a)HVR-H1,其包含SEQID NO:4的氨基酸序列,(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在一具体实施例中,VH包含一个、两个或三个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在一具体实施例中,VH包含一个、两个或三个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。
在另一方面,提供一种抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36、38至41、54和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL)。在另一方面,提供一种抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL)。在一些方面,提供一种抗TGFβ3抗体,其中所述抗体包含与SEQ IDNO:56的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL)。在某些实施例中,具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的VL序列包含相对于参考序列的取代(例如保守取代)、插入或缺失,但是包含该序列的抗TGFβ3抗体保留了与TGFβ3结合的能力。在某些实施例中,在SEQ ID NO:22中,总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施例中,该取代、插入或缺失发生在HVR之外的区域(即,在FR中)。任选地,抗TGFβ3抗体包含选自由以下项所组成的组的VL序列:SEQ ID NO:22、36、38至41、54和56,包括该序列的翻译后修饰。任选地,抗TGFβ3抗体包含选自由以下项所组成的组的VL序列:SEQ ID NO:22、36和38至41,包括该序列的翻译后修饰。在特定实施例中,该VL包含一个、两个或三个选自以下项的HVR:(a)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:9的氨基酸序列。
在另一方面,提供一种抗TGFβ3抗体,其中该抗体包含如上述任一实施例中提供的VH和如上述任一实施例中提供的VL。在一个实施例中,该抗TGFβ3抗体包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQ ID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4),包括那些序列的翻译后修饰。在一个实施例中,该抗TGFβ3抗体包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9),包括那些序列的翻译后修饰。在一个实施例中,抗TGFβ3抗体包含(分别)为SEQID NO:57/56的VH/VL序列。
在另一方面,提供一种抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:29、59、64、65至72、77和79所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:28、58、60至63、76和78所组成的组的氨基酸序列的完整L链氨基酸序列。在另一方面,提供一种抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:29、59、64和65至72所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列的完整L链氨基酸序列。在一些实施例中,该抗体包含与SEQ ID NO:79具有至少95%序列同一性的完整H链氨基酸序列和/或SEQ ID NO:78的VL氨基酸序列。在一些实施例中,抗TGFβ3抗体包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)、SEQ ID NO:77/76(v3)和SEQ ID NO:79/78(v4)。在一些实施例中,抗TGFβ3抗体包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)。
在另一实施例中,提供一种抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:52的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列。在一些方面,该抗体包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:52/36的氨基酸序列(h2A10.v2.N54Q)。在一些方面,该抗体包含与SEQ ID NO:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链氨基酸序列和与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列。在一些方面,该抗体包含完整H/L序列,该完整H/L序列(分别)包含SEQ ID NO:74/58的氨基酸序列。
在另一实施例中,提供一种抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:22、36、38至41和54所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列。在一些方面,该抗TGFβ3抗体包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:51/36或SEQ ID NO:55/54的氨基酸序列(h2A10.v3)。在一些方面,该抗体包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链和/或该抗TGFβ3抗体包含与选自由SEQ ID NO:28、58、60至63和76所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列。在一些方面,该抗体包含完整H/L序列,该完整H/L序列(分别)包含SEQID NO:73/58或SEQ ID NO:77/76的氨基酸序列。
在另一实施例中,提供一种抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH。在一些方面,抗TGFβ3抗体包含与选自由SEQ ID NO:22、36、38至41和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列。在一些方面,抗TGFβ3抗体包含与SEQ ID NO:57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH。在其他些方面,抗TGFβ3抗体包含与SEQ ID NO:56的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL。在一些方面,抗TGFβ3抗体包含与SEQ ID NO:57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH序列以及与SEQ ID NO:56具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列序列.在一些方面,该抗TGFβ3抗体包含VH/VL序列,该VH/VL序列(分别)包含SEQ IDNO:53/36或SEQ ID NO:57/56的氨基酸序列(h2A10.v4)。在一些方面,该抗TGFβ3抗体包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:57/56(h2A10.v4)的氨基酸序列。在一些方面,该抗体包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链和/或与选自由SEQ ID NO:28、58、60至63、76和78所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列。在一些方面,该抗TGFβ3抗体包含与SEQ ID NO:79的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链。在其他方面,该抗TGFβ3抗体包含与SEQ ID NO:78的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链。在又进一步的方面,抗TGFβ3抗体包含与选自由SEQ ID NO:79的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链氨基酸序列,且包含与SEQ ID NO:78的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链。在一些方面,该抗体包含与SEQ ID NO:79的氨基酸序列具有至少95%序列同一性的完整H链和/或与SEQ ID NO:78的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列。在一些方面,该抗TGFβ3抗体包含完整H/L序列,该完整H/L序列(分别)包含SEQ ID NO:75/58或SEQID NO:79/78的氨基酸序列。在某些方面,该抗TGFβ3抗体包含完整H/L序列,该完整H/L序列(分别)包含SEQ ID NO:79/78的氨基酸序列。
在又一方面,本发明提供一种抗TGFβ3抗体,其与本文所提供的抗TGFβ3抗体所结合的相同表位结合。例如,在某些实施例中,提供一种与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在一个实施例中,提供一种与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在另一实施例中,提供一种与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。在另一实施例中,提供一种与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列。
在另一方面,提供一种抗TGFβ3抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ IDNO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ IDNO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQ ID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/v4)所组成的组。在另一方面,提供一种抗TGFβ3抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由以下项所组成的组:SEQID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ ID NO:52/36(h2A10.v2.N54Q)、SEQID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9)。
在一个实施例中,提供一种抗TGFβ3抗体,其与包含(分别)为SEQ ID NO:57/56的VH/VL序列的抗TGFβ3抗体(h2A10.v4)结合相同的表位。
在某些实施例中,提供一种分离的抗TGFβ3抗体,其包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398,其中该抗TGFβ3抗体选择性地中和TGFβ3。
在一些方面,本文提供一种分离的抗TGFβ3抗体,其包含:包含CDR-H1、CDR-H2和CDR-H3的重链CDR,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列。在一些实施例中,CDR-H2具有SEQ ID NO:35的氨基酸序列。在某些实施例中,该分离的抗TGFβ3抗体进一步包含与SEQ ID NO:57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH。在一些实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:56的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL。在某些实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:79的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链。在其他实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:78的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链。
在另一实施例中,提供一种分离的抗TGFβ3抗体,其选择性地中和TGFβ3并且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性。在一些实施例中,本文提供的抗TGFβ3抗体在50mg/kg的剂量具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性。1D11抗体在Lonning等人(Current Pharmaceutical Biotechnology,2011,12,2176-2189)中描述并具有以下氨基酸序列:
VH:
QVQLQQSGPELVRPGASVKLSCKASGYIFITYWMNWVKQRPGQGLEWIGQIFPASGSTNYNEMFEGKATLTVDTSSSTAYMQLSSLTSEDSAVYYCARGDGNYALDAMDYWGQGTSVTVSS(SEQ ID NO:160)
VL
DIVLTQSPASLAVSLGQRATISCRASESVDSYGNSFMHWYQQKSGQPPKLLIYLASNLESGVPARFSGSGSRTDFTLTIDPVEADDAATYYCQQNNEDPLTFGAGTKLEIK(SEQ ID NO:161)
在本发明的进一步方面,根据任何上述实施例的同种型选择性抗TGFβ抗体(例如,本文所述的单特异性抗TGFβ2和抗TGFβ3抗体,以及双重特异性抗TGFβ2/3抗体)为单克隆抗体,包括嵌合抗体、人源化抗体或人抗体。在一个实施例中,同种型选择性抗TGFβ抗体为抗体片段,例如,Fv、Fab、Fab'、scFv、双体抗体或F(ab')2片段。在另一实施例中,抗体为全长抗体,例如,完整的IgG1或IgG4抗体,优选人IgG1,更优选包含N297突变(如Kabat的EU编号)的人IgG1,例如,N297A或N297G,优选N297G,或本文定义的其他抗体类别或同种型。
在进一步的方面,根据任何上述实施例的同种型选择性抗TGFβ抗体可单独或组合地并入如以下1至7节所述的特征:
1.抗体亲和力
在某些实施例中,本文所述的抗体的解离常数(K
在一个实施例中,通过放射性标记的抗原结合测定法(RIA)测量K
根据另一实施例,使用
2.抗体片段
在某些实施例中,本文提供的抗体为抗体片段。抗体片段包括但不限于Fab、Fab’、Fab’-SH、F(ab’)
双体抗体是具有两个抗原结合位点的抗体片段,其可以是二价或双特异性的。参见例如,EP 404,097;WO 1993/01161;Hudson等人,Nat.Med.9:129-134(2003);和Hollinger等人,Proc.Natl.Acad.Sci.USA 90:6444-6448(1993)。三体抗体和四体抗体也在Hudson等人,Nat.Med.9:129-134(2003)中进行了描述。
单结构域抗体为包含抗体的全部或部分重链可变结构域或全部或部分轻链可变结构域的抗体片段。在某些实施例中,单结构域抗体是人单结构域抗体(Domantis,Inc.,Waltham,MA;参见例如,美国专利号6,248,516B1)。
抗体片段可以通过各种技术制备,包括但不限于完整抗体的蛋白水解消化以及由重组宿主细胞(例如大肠杆菌(E.coli)或噬菌体)产生,如本文所述。
3.嵌合抗体和人源化抗体
在某些实施例中,本文提供的抗体为嵌合抗体。某些嵌合抗体描述于,例如,美国专利号4,816,567和Morrison等人,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984)中。在一个实例中,嵌合抗体包含非人可变区(例如,源自小鼠、大鼠、仓鼠、兔或非人灵长类动物(诸如猴)的可变区)和人恒定区。在另一个实例中,嵌合抗体为其中类别或亚类已经与亲本抗体的类别或亚类改变的“类别转换”抗体。嵌合抗体包括其抗原结合片段。
在某些实施例中,嵌合抗体是人源化抗体。通常,将非人抗体人源化以减少对人的免疫原性,同时保留亲本非人抗体的特异性和亲和力。通常,人源化抗体包含一个或多个可变结构域,其中HVR,例如CDR(或其部分)源自非人抗体,而FR(或其部分)源自人抗体序列。人源化抗体任选地还将包含人恒定区的至少一部分。在一些实施例中,人源化抗体中的一些FR残基被来自非人抗体(例如,HVR残基所来源于的抗体)的相应残基取代,例如以恢复或改善抗体特异性或亲和力。
例如,人源化抗体及其制备方法在Almagro and Fransson,Front.Biosci.13:1619-1633(2008)中回顾,并进一步描述于例如Riechmann等人,Nature 332:323-329(1988);Queen等人,Proc.Nat’l Acad.Sci.USA86:10029-10033(1989);美国专利号5,821,337、7,527,791、6,982,321和7,087,409;Kashmiri等人,Methods 36:25-34(2005)(描述特异性决定区(SDR)移植);Padlan,Mol.Immunol.28:489-498(1991)(描述“表面重修”);Dall'Acqua等人,Methods 36:43-60(2005)(描述“FR改组”);以及Osbourn等人,Methods36:61-68(2005)和Klimka等人,Br.J.Cancer,83:252-260(2000)(描述FR改组的“引导选择”方法)。
可用于人源化的人框架区包括但不限于:使用“最佳拟合”方法选择的框架区(参见例如,Sims等人。J.Immunol.151:2296(1993));框架区来源于特定轻链或重链可变区亚组的人抗体的共有序列(参见例如,Carter等人Proc.Natl.Acad.Sci.USA,89:4285(1992);和Presta等人J.Immunol.,151:2623(1993));人成熟(体细胞突变)框架区或人种系框架区(参见例如,Almagro和Fransson,Front.Biosci.13:1619-1633(2008));以及来自筛选FR文库的框架区(参见例如,Baca等人,J.Biol.Chem.272:10678-10684(1997)和Rosok等人,J.Biol。Chem.271:22611-22618(1996))。
4.人抗体
在某些实施例中,本文提供的抗体为人抗体。可以使用本领域已知的各种技术来产生人抗体。人抗体在van Dijk and van de Winkel,Curr.Opin.Pharmacol.5:368-74(2001)和Lonberg,Curr.Opin.Immunol.20:450-459(2008)。
可以通过以下方式来制备人抗体:将免疫原施用于转基因动物,所述转基因动物已被修饰以响应于抗原激发而产生具有人可变区的完整人抗体或完整抗体。此类动物通常含有全部或部分人免疫球蛋白基因座,所述全部或部分人免疫球蛋白基因座替代内源性免疫球蛋白基因座,或者在动物的染色体外存在或随机整合至动物的染色体中。在此类转基因小鼠中,内源性免疫球蛋白基因座通常已被灭活。关于从转基因动物得到人抗体的方法的综述,参见Lonberg,Nat.Biotech.23:1117-1125(2005)。还参见例如描述XENOMOUSE
人抗体也可以通过基于杂交瘤的方法制备。已经描述了用于产生人单克隆抗体的人骨髓瘤和小鼠-人杂交骨髓瘤细胞系。(参见例如Kozbor J.Immunol.,133:3001(1984);Brodeur等人,Monoclonal Antibody Production Techniques and Applications,第51-63页(Marcel Dekker,Inc.,New York,1987);以及Boerner等人,J.Immunol.,147:86(1991)。)经由人B细胞杂交瘤技术产生的人抗体也如Li等人,Proc.Natl.Acad.Sci.USA,103:3557-3562(2006)所述。另外的方法包括例如在美国专利号7,189,826(描述了从杂交瘤细胞系产生单克隆人IgM抗体)和Ni,Xiandai Mianyixue,26(4):265-268(2006)(描述了人-人杂交瘤)中描述的那些方法。人类杂交瘤技术(Trioma技术)也描述于Vollmers和Brandlein,Histology and Histopathology,20(3):927-937(2005)和Vollmers和Brandlein,Methods and Findings in Experimental and Clinical Pharmacology,27(3):185-91(2005)中。
人抗体还可以通过分离选自人源噬菌体展示文库的Fv克隆可变结构域序列产生。然后可以将此类可变结构域序列与预期的人恒定结构域结合。从抗体文库中选择人抗体的技术描述如下。
5.源自文库的抗体
可以通过筛选组合文库中具有一个或多个所需活性的抗体来分离本发明的抗体。例如,本领域已知多种方法用于产生噬菌体展示文库并筛选此类文库以获得具有所需结合特征的抗体。此类方法在,例如,Hoogenboom等人,Methods in Molecular Biology 178:1-37(O'Brien等人,编,Human Press,Totowa,NJ,2001)中综述并且进一步描述于,例如,在McCafferty等人,Nature 348:552-554;Clackson等人,Nature 352:624-628(1991);Marks等人,J.Mol.Biol.222:581-597(1992);Marks和Bradbury,in Methods in MolecularBiology 248:161-175(Lo,ed.,Human Press,Totowa,NJ,2003);Sidhu等人,J.Mol.Biol.338(2):299-310(2004);Lee等人,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,Proc.Natl.Acad.Sci.USA 101(34);12467-12472(2004);和Lee等人,J.Immunol.Methods 284(1-2):119-132(2004)中。
在某些噬菌体展示方法中,将VH和VL基因的所有组成成分通过聚合酶链式反应(PCR)单独克隆,并在噬菌体文库中随机重组,然后可以从该噬菌体文库中筛选抗原结合噬菌体,如在Winter等人,Ann.Rev.Immunol.,12:433-455(1994)中所描述的。噬菌体通常将抗体片段展示为单链Fv(scFv)片段或Fab片段。来自经免疫的来源的文库提供针对免疫原的高亲和力抗体,而无需构建杂交瘤。替代地,可以克隆初始组库(例如,来自人)以提供针对广泛的非自身抗原和自身抗原的抗体的单一来源,而无需任何免疫,如Griffiths等人,EMBO J,12:725-734(1993)所描述的。最后,还可通过以下方式来制得初始文库:克隆来自干细胞的未重排的V基因区段;以及使用含有随机序列的PCR引物来编码高度可变的CDR3区域并完成体外重排,如由Hoogenboom和Winter,J.Mol.Biol.,227:381-388(1992)所述。描述人抗体噬菌体文库的专利出版物包括,例如:美国专利号5,750,373,和美国公开号2005/0079574、2005/0119455、2005/0266000、2007/0117126、2007/0160598、2007/0237764、2007/0292936和2009/0002360。
在本文中从人抗体文库分离出的抗体或抗体片段被认为是人抗体或人抗体片段。
6.多特异性抗体
在某些实施例中,本文提供的抗体为多特异性抗体,例如双特异性抗体。多特异性抗体是对至少两个不同位点具有结合特异性的单克隆抗体。在某些实施例中,结合特异性中的一者针对TGFβ同种型(例如,TGFβ1、TGFβ2、TGFβ3或TGFβ2/3),并且另一者针对任何其他抗原。在某些实施例中,结合特异性中的一者针对一种TGFβ同种型(例如,TGFβ1、TGFβ2或TGFβ3),并且另一者针对不同的TGFβ同种型。在某些实施例中,双特异性抗体可以与单一TGFβ同种型内的两个不同表位结合。双特异性抗体也可用于将细胞毒性剂定位于表达一种或多种TGFβ同种型的细胞。可以将双特异性抗体制成全长抗体或抗体片段。
制备多特异性抗体的技术包括但不限于,具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达(参见,Milstein和Cuello,Nature 305:537(1983)、WO 93/08829和Traunecker等人,EMBO J.10:3655(1991))和“杵臼”工程化(参见,例如,美国专利号5,731,168)。多特异性抗体也可以通过以下技术制造:工程化静电操纵效应以制造抗体Fc-异二聚体分子(WO 2009/089004A1);将两种或更多种抗体或片段交联(参见例如,美国专利号4,676,980和Brennan等人,Science 229:81(1985));使用亮氨酸拉链来产生双特异性抗体(参见例如,Kostelny等人,J.Immunol.148(5):1547--1553(1992));使用“双体抗体”技术制造双特异性抗体片段(参见例如,Hollinger等人,Proc.Natl.Acad.Sci.USA 90:6444--6448(1993));使用单链Fv(sFv)二聚体(参见例如,Gruber等人,J.Immunol.152:5368(1994));以及按照例如Tutt等人J.Immunol.147:60(1991)的描述制备三特异性抗体。
具有三个或更多个功能性抗原结合位点的工程化改造的抗体,包括“章鱼抗体”,也包括在本文中(参见,例如US2006/0025576A1)。
本文的抗体或片段还包括“双重作用Fab”或“DAF”,其包含与一种或多种TGFβ同种型(例如,TGFβ1、TGFβ2和/或TGFβ3)以及另一种不同抗原结合的抗原结合位点(参见例如,US2008/0069820)。
7.抗体变体
在某些实施例中,设想了本文提供的抗体的氨基酸序列变体。例如,可能期望改善抗体的结合亲和力和/或其他生物特性。抗体的氨基酸序列变体可以通过向编码抗体的核苷酸序列中引入适当的修饰或通过肽合成来制备。此类修饰包括例如抗体氨基酸序列内残基的缺失、和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以实现最终构建体,前提条件是最终构建体具有所需特征,例如抗原结合。
a)
在某些实施例中,提供了具有一或多个氨基酸取代的抗体变体。用于取代突变的目的位点包括HVR和FR。保守取代在表1中的“优选取代”标题下示出。更多实质性改变提供于表1的“示例性取代”标题下,并且在下文参考氨基酸侧链类别进行了进一步描述。可以将氨基酸取代引入目标抗体中,并对产物进行所需活性(例如保留/改善的抗原结合、降低的免疫原性,或改善的ADCC或CDC)筛选。
表1
/>
可根据共同的侧链特性将氨基酸分组:
(1)疏水性:正亮氨酸、Met、Ala、Val、Leu、Ile;
(2)中性亲水性:Cys、Ser、Thr、Asn、Gln;
(3)酸性:Asp、Glu;
(4)碱性:His、Lys、Arg;
(5)影响链取向的残基:Gly,Pro;
(6)芳族:Trp、Tyr、Phe。
非保守性取代将需要用这些类别中的一个的成员交换另一类别。
一种类型的置换变体涉及置换亲本抗体(例如,人源化抗体或人抗体)的一个或多个高变区残基。通常,相对于亲本抗体,选为用于进一步研究的一个或多个所得变体将在某些生物学特性方面(例如,亲和力增加、免疫原性降低)有改变(例如,改善)和/或将基本上保留亲本抗体的某些生物学特性。示例性取代变体是亲和力成熟抗体,其可例如使用诸如本文所述的那些基于噬菌体展示的亲和力成熟技术方便地生成。简言之,将一个或多个HVR残基突变并且将变体抗体展示在噬菌体上并针对特定生物活性(例如结合亲和力)进行筛选。
例如,可改变(例如,取代)HVR,以改善抗体亲和力。此类改变可发生于HVR“热点”中,即由体细胞成熟过程中发生高频突变的密码子编码的残基(参见例如:Chowdhury,Methods Mol.Biol.207:179-196(2008))和/或与抗原接触的残基(检测所得变体VH或VL的结合亲和力)。通过构建并自二级文库重新选择而实现的亲和力成熟已被例如Hoogenboom等人在Methods in Molecular Biology 178:1-37(O'Brien等人编,Human Press,Totowa,NJ,(2001))中进行描述。在亲和力成熟的一些实施例中,利用多种方法(例如,易错PCR、链改组或寡核苷酸定点诱变基因)中的任一种将多样性引入选择用于成熟的可变基因中。然后创建一个二级文库。随后对该文库进行筛选以鉴别具有所需亲和力的任何抗体变体。引入多样性的另一种方法涉及HVR定向方法,其中将若干HVR残基(例如,每次4至6个残基)随机化。参与抗原结合的HVR残基可例如使用丙氨酸扫描突变或建模来特异性地鉴别。具体而言,常常靶向CDR-H3和CDR-L3。
在某些实施例中,取代、插入或缺失可发生在一个或多个HVR内,只要此类改变基本上不降低抗体的抗原结合能力即可。例如,可在HVR中进行基本上不降低结合亲和力的保守性改变(例如,如本文提供的保守性取代)。此类改变可以在HVR的抗原接触残基之外。在上文提供的变体VH和VL序列的某些实施例中,每个HVR保持不变,或含有不超过一个、两个或三个氨基酸取代。
可用于鉴别可被靶向诱变的抗体残基或区域的方法称作“丙氨酸扫描诱变”,如Cunningham和Wells(1989)Science,244:1081-1085所述。在此方法中,鉴别残基或一组靶残基(例如,带电残基,诸如Arg、Asp、His、Lys和Glu)并用中性或带负电的氨基酸(例如,丙氨酸或多丙氨酸)替换以确定抗体与抗原的相互作用是否受到影响。可在对初始取代展示功能敏感性的氨基酸位置引入其他取代。可替代地或另外地,利用抗原-抗体复合物的晶体结构鉴别抗体与抗原之间的接触点。可靶向或消除作为取代的候选的此类接触残基和相邻残基。可筛选变体以确定它们是否具备期望的特性。
氨基酸序列插入包括长度范围为一个残基至含有一百个或更多个残基的多肽的氨基和/或羧基末端融合,以及一个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N末端甲硫氨酰残基的抗体。抗体分子的其他插入变体包括与增加抗体的血清半衰期的酶(例如对于ADEPT)或多肽的抗体的N末端或C末端的融合。
b)
在某些实施例中,改变本文提供的抗体以增加或降低抗体糖基化的程度。糖基化位点向抗体的添加或缺失可通过改变氨基酸序列以产生或去除一个或多个糖基化位点而方便地实现。
当抗体包含Fc区时,附接于其上的碳水化合物可以被改变。由哺乳动物细胞产生的天然抗体通常包含具有支链的双触角寡糖,所述双触角寡糖通常通过N-键结连接于Fc区的CH2结构域的Asn297。参见例如,Wright等人TIBTECH 15:26-32(1997)。寡糖可包括各种碳水化合物,例如,甘露糖、N-乙酰基葡糖胺(GlcNAc)、半乳糖和唾液酸,以及附接于双触角寡糖结构的“主干”中的GlcNAc的岩藻糖。在一些实施例中,可以对本发明的抗体中的寡糖进行修饰,以便产生具有某些改善的特性的抗体变体。
在一个实施例中,提供了抗体变体,其具有缺乏连接(直接或间接)至Fc区的岩藻糖的碳水化合物结构。例如,此类抗体中岩藻糖的含量可以为1%至80%、1%至65%、5%至65%或20%至40%。岩藻糖的量为通过计算相对于通过MALDI-TOF质谱测得的与Asn 297附接的所有糖结构(例如,复合、杂合和高甘露糖结构)的总和,糖链中在Asn297处的岩藻糖的平均量,确定,如WO 2008/077546中所述。Asn297是指位于Fc区中约297位的天冬酰胺残基(Fc区残基的EU编号);然而,由于抗体中的微小序列变化,Asn297也可以位于297位上游或下游大约±3个氨基酸,即在294位和300位之间。此类岩藻糖基化变体可以具有改善的ADCC功能。参见例如美国专利公开号US2003/0157108(Presta,L.);US2004/0093621(KyowaHakko Kogyo Co.,Ltd)。与“去岩藻糖基化”或“岩藻糖缺陷型”抗体变体有关的出版物的实例包括:US2003/0157108;WO 2000/61739;WO 2001/29246;US2003/0115614;US2002/0164328;US2004/0093621;US 2004/0132140;US2004/0110704;US2004/0110282;US2004/0109865;WO 2003/085119;WO 2003/084570;WO 2005/035586;WO 2005/035778;WO2005/053742;WO2002/031140;Okazaki等人,J.Mol.Biol.336:1239-1249(2004);Yamane-Ohnuki等人,Biotech.Bioeng.87:614(2004)。能够产生去岩藻糖基化抗体的细胞系的实例包括蛋白岩藻糖基化缺陷的Lec13 CHO细胞(Ripka等人Arch.Biochem.Biophys.249:533-545(1986);美国专利申请号US2003/0157108 A1,Presta,L;和WO 2004/056312 A1,Adams等人,特别是实例11),和敲除细胞系,诸如α-1,6-岩藻糖基转移酶基因(FUT8)敲除的CHO细胞(参见,例如,Yamane-Ohnuki等人Biotech.Bioeng.87:614(2004);Kanda,Y.等人,Biotechnol.Bioeng.,94(4):680-688(2006);和WO2003/085107)。
在某些实施例中,本发明的同种型选择性抗TGFβ抗体的CH2结构域中的N-糖基化位点经突变以防止糖基化。例如,具有非糖基化Fc区的同种型选择性抗TGFβ抗体可以通过诱变位置297处(如Fc区CH2结构域中的EU索引中(例如,N297))的氨基酸残基来制备。在某些实施例中,可以通过改变糖基化共有位点,即第297位的Asn,后跟任何氨基酸残基(在人IgG的情况下,Ser)和Thr,来消除Fc区的CH2结构域中的糖基化。糖基化位点可以通过氨基酸插入、缺失和/或取代而改变。例如,可以在Asn与Ser之间或Ser与Thr之间插入一个或多个氨基酸残基以改变原始糖基化位点,其中插入不会再生N-糖基化位点。在某些特定实施例中,人IgG Fc的CH2结构域内如EU索引中的位置297处的氨基酸残基(例如,Fc中的N-糖基化位点)被突变以消除糖基化位点。在某些特定实施例中,如EU索引中位置297处的氨基酸残基(例如,N297)改变为Gly、Ala、Gln、Asp或Glu。在一些特定实施例中,如EU索引中位置297处的氨基酸残基(例如,N297)改变为Gly或Ala。在其他特定实施例中,如EU索引中位置297处的氨基酸残基(例如,N297)改变为Gly。在某些其他实施例中,如EU索引中位置299处的氨基酸残基可以被另一种氨基酸例如Ala、Val或Gly取代。在某些特定实施例中,导致非糖基化Fc的突变不影响同种型选择性抗TGFβ抗体的结构和/或稳定性。
在某些实施例中,本发明的同种型选择性抗TGFβ抗体包含Fc区,其中CH2结构域中如EU索引中位置297处的氨基酸残基发生突变。在某些实施例中,如EU索引中位置297处的氨基酸残基改变为Gly或Ala,优选地改变为Gly。在某些其他实施例中,如在EU索引中位置297处的氨基酸残基缺失。在其他实施例中,与EU索引中位置297处的野生型氨基酸残基(例如,N297)连接的N-聚糖可以例如通过去糖基化而酶促去除。合适的糖酵解酶包括但不限于肽-N-糖苷酶(PNGase)。
进一步提供了包含两分型寡糖的抗体变体,例如,其中连接至抗体的Fc区的双角寡糖被GlcNAc两分。此类抗体变体可以具有减少的岩藻糖基化和/或改善的ADCC功能。此类抗体变体的实例描述于例如WO 2003/011878(Jean-Mairet等人)、美国专利号6,602,684(Umana等人)和US 2005/0123546(Umana等人)中。还提供了在连接于Fc区的寡糖中具有至少一个半乳糖残基的抗体变体。这样的抗体变体可以具有改善的CDC功能。此类抗体变体描述于例如WO 1997/30087(Patel等人);WO 1998/58964(Raju,S.);以及WO 1999/22764(Raju,S.)中。
c)
在某些实施例中,一个或多个氨基酸修饰可引入本文提供的抗体的Fc区中,从而生成Fc区变体。Fc区变体可以包含人Fc区序列(例如,人IgG1、IgG2、IgG3或IgG4 Fc区),其在一个或多个氨基酸位置上包含氨基酸修饰(例如,取代)。
在某些实施例中,本发明设想了具有一些但不是所有效应子功能的抗体变体,这使其成为应用的理想候选物,其中抗体在体内的半衰期很重要,但是某些效应子功能(诸如补体和ADCC)是不必要的或有害的。可以进行体外和/或体内细胞毒性测定,以确认CDC和/或ADCC活性的降低/耗尽。例如,可以进行Fc受体(FcR)结合测定以确保抗体缺乏FcγR结合(因此可能缺乏ADCC活性),但是保留FcRn结合能力。介导ADCC的主要细胞NK细胞仅表达Fc(RIII,而单核细胞表达Fc(RI、Fc(RII和Fc(RIII。造血细胞上的FcR表达总结在Ravetch和Kinet,Annu.Rev.Immunol.9:457-492(1991)的第464页的表3中。用于评估目标分子的ADCC活性的体外测定的非限制性实例描述于美国专利号5,500,362(参见例如Hellstrom,I.等人Proc.Natl.Acad.Sci.USA 83:7059-7063(1986))和Hellstrom,I等人,Proc.Natl.Acad.Sci.USA 82:1499-1502(1985);5,821,337(参见Bruggemann,M.等人,J.Exp.Med.166:1351-1361(1987))。可替代地,可使用非放射性测定方法(参见例如,用于流式细胞术的ACTI
具有降低的效应子功能的抗体包括具有Fc区残基238、265、269、270、297、327和329中一个或多个的取代的那些(美国专利号6,737,056)。此类Fc突变体包括在第265、269、270、297和327位氨基酸中两个或更多个处具有取代的Fc突变体,包括所谓的“DANA”Fc突变体,其残基265和297被取代为丙氨酸(美国专利号7,332,581)。
描述了具有改善的或降低的与FcR的结合的某些抗体变体。(参见例如美国专利号6,737,056;WO 2004/056312;以及Shields等人,J.Biol.Chem.9(2):6591-6604(2001)。)
在某些实施例中,抗体变体包含具有一个或多个氨基酸取代的Fc区,取代改善ADCC,例如,在Fc区的298、333和/或334位(残基的EU编号)处的取代。
在一些实施例中,在Fc区中进行改变,导致改变的(即,改善的或减少的)C1q结合和/或补体依赖性细胞毒性(CDC),例如,如美国专利号6,194,551,WO 99/51642,和Idusogie等人J.Immunol.164:4178-4184(2000)所述。
具有延长的半衰期和改善的新生儿Fc受体(FcRn)结合、负责将母体IgG转移至胎儿(Guyer等人,J.Immunol.117:587(1976);以及Kim等人,J.Immunol.24:249(1994))的抗体描述于US2005/0014934A1(Hinton等人)中。那些抗体包含这样的Fc区,所述Fc区中具有改善Fc区与FcRn的结合的一个或多个取代。此类Fc变体包括在以下Fc区残基中的一处或多处具有取代的Fc变体:238、256、265、272、286、303、305、307、311、312、317、340、356、360、362、376、378、380、382、413、424或434,例如对Fc区残基434的取代(美国专利号7,371,826)。
有关Fc区变体的其他实例,另外参见:Duncan和Winter,Nature 322:738-40(1988);美国专利号5,648,260;美国专利号5,624,821;以及WO 94/29351。
d)
在某些实施例,可期望产生经半胱氨酸工程化改造的抗体,例如“thioMAbs”,其中抗体的一个或多个残基被半胱氨酸残基取代。在特定实施例中,取代的残基存在于抗体的可接近位点。如本文进一步描述的,通过用半胱氨酸取代那些残基,从而将反应性硫醇基团定位于抗体的可接近位点,并且可用于将抗体与其他部分(诸如药物部分或接头-药物部分)缀合,以产生免疫缀合物。在某些实施例中,可用半胱氨酸取代下列残基中的任何一个或多个:轻链的V205(Kabat编号);重链的A118(EU编号);以及重链Fc区的S400(EU编号)。可如例如美国专利号7,521,541中所述生成半胱氨酸工程化的抗体。
e)
在某些实施例中,本文提供的抗体可以被进一步修饰以包含本领域已知的并且容易获得的另外的非蛋白质部分。适合于抗体衍生化的部分包括但不限于水溶性聚合物。水溶性聚合物的非限制性示例包括但不限于聚乙二醇(PEG)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三噁烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或随机共聚物)和葡聚糖或聚(n-乙烯吡咯烷酮)聚乙二醇、丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(例如甘油)、聚乙烯醇以及它们的混合物。由于其在水中的稳定性,聚乙二醇丙醛在制造中可具有优势。聚合物可具有任何分子量,并且可以具有支链或不具有支链。附接至抗体的聚合物的数目可变,并且如果附接了多于一个聚合物,那么它们可以为相同或不同的分子。通常,可基于以下考虑因素测定用于衍生化的聚合物的数目和/或类型,包括但不限于抗体待改善的特定特性或功能、抗体衍生物是否将用于限定条件下的疗法等。
在另一个实施例中,提供了抗体和可通过暴露于辐射而选择性地加热的非蛋白质部分的缀合物。在一个实施例中,非蛋白质部分是碳纳米管(Kam等人,Proc.Natl.Acad.Sci.USA 102:11600-11605(2005))。辐射可具有任何波长,并且包括但不限于对普通细胞没有伤害、但是将非蛋白质性部分加热至抗体-非蛋白质性部分近端的细胞被杀死的温度的波长。
B.重组方法和组合物
可以使用重组方法和组合物来产生抗体,例如,如在美国专利号4,816,567中所述。在一个实施例中,提供一种编码本文所述的同种型选择性抗TGFβ抗体的分离的核酸。此类核酸可编码构成抗体的VL的氨基酸序列和/或构成抗体的VH的氨基酸序列(例如抗体的轻链和/或重链)。在进一步实施例中,提供了包含此类核酸的一种或多种载体(例如表达载体)。在进一步的实施例中,提供了包括此类核酸的宿主细胞。在一个此类实施例中,宿主细胞包含以下(例如已被用以下转化):(1)包含核酸的载体,所述核酸编码包含抗体的VL的氨基酸序列和包含抗体的VH的氨基酸序列;或(2)第一载体和第二载体,所述第一载体包含核酸,所述核酸编码抗体的VL的氨基酸序列,所述第二载体包含核酸,所述核酸编码包含抗体的VH的氨基酸序列。在一个实施例中,宿主细胞为真核细胞,例如,中国仓鼠卵巢(CHO)细胞或淋巴样细胞(例如,Y0、NS0、Sp20细胞)。在一个实施例中,提供一种制备同种型选择性抗TGFβ抗体的方法,其中该方法包括在适于表达抗体的条件下培养如上所提供的包含编码该抗体的核酸的宿主细胞,以及任选地从宿主细胞(或宿主细胞培养基)回收该抗体。
对于同种型选择性抗TGFβ抗体重组生产,将编码抗体的核酸(例如,如上所述)分离并插入至一个或多个载体中以用于在宿主细胞中进一步克隆和/或表达。可以使用常规程序来容易地对此类核酸进行分离和测序(例如,通过使用能够与编码抗体的重链和轻链的基因特异性结合的寡核苷酸探针)。
用于克隆或表达编码抗体的载体的合适宿主细胞包括本文所述的原核或真核细胞。例如,可以在细菌中产生抗体,特别是当不需要糖基化和Fc效应子功能时。关于在细菌中表达抗体片段和多肽,参见例如美国专利No.5,648,237、No.5,789,199和No.5,840,523。(另见Charlton,Methods in Molecular Biology,Vol.248(B.K.C.Lo,ed.,Humana Press,Totowa,NJ,2003),pp.245-254,其描述抗体片段在大肠杆菌中的表达。)抗体可在表达后在可溶性级分中从细菌细胞糊中分离,并且可以进一步纯化。
除了原核生物外,诸如丝状真菌或酵母等真核微生物也是用于编码抗体的载体的合适克隆或表达宿主,所述真核微生物包括这样的真菌和酵母菌株,其糖基化途径已经“人源化”,从而导致产生具有部分或完全人糖基化模式的抗体。参见Gerngross,Nat.Biotech.22:1409-1414(2004),以及Li等人,Nat.Biotech.24:210-215(2006)。
用于表达糖基化抗体的合适宿主细胞也来源于多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物细胞和昆虫细胞。已经鉴定出了许多可以与昆虫细胞一起使用的杆状病毒株,特别是用于转染草地夜蛾(Spodoptera frugiperda)细胞。
植物细胞培养物也可用作宿主。参见例如,美国专利号5,959,177、6,040,498、6,420,548、7,125,978和6,417,429(描述了用于在转基因植物中产生抗体的PLANTIBODIES
脊椎动物细胞也可用作宿主。例如,适于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他实例为由SV40转化的猴肾CV1系(COS-7);人胚肾系(293或293细胞,如例如在Graham等人,J.Gen Virol.36:59(1977)中所述);幼仓鼠肾细胞(BHK);小鼠塞尔托利氏细胞(TM4细胞,如例如在Mather,Biol.Reprod.23:243-251(1980)中所述);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HELA);犬肾细胞(MDCK);布法罗大鼠肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳腺肿瘤细胞(MMT 060562);TRI细胞(如例如在Mather等人,Annals N.Y.Acad.Sci.383:44-68(1982));MRC 5细胞;和FS4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,其包括DHFR
C.测定
同种型选择性抗TGFβ可通过本技术领域中已知的各种测定,对本文所提供的抗体的物理/化学特性和/或生物活性来进行鉴别、筛选或表征,并且可以解析其结构。
1.结合测定和其他测定
在一方面,例如,通过已知方法诸如ELISA、Western印迹等,测试本发明的抗体的抗原结合活性。
在一方面,使用酶免疫测定法检测抗体结合。该技术在本领域是公知的。参见Schuurs和VanWeemen,ClinicaChimica Acta,81:1-40(1977)。在该技术中,酶被用作抗原或抗体上的标记,用于鉴定和定位免疫反应物。本发明包括任何测量酶标记的抗原或酶标记的抗体与其免疫反应物结合程度的方法。所用酶的种类、将酶与免疫成分连接的方法、缀合物的纯化以及各种测定原理和方法在Schuurs和VanWeemen(出处同上)中都有很好的描述。
在一方面,抗体结合亲和力是使用表面等离子体共振(SPR)测量和BIAcore
在另一方面,竞争测定可用于鉴定与本文所述的同种型特异性抗TGFβ抗体竞争的抗体。在某些实施例中,此类竞争抗体结合至由本文所述的4A11、6F12或2A10抗体及其人源化变体结合的相同表位(例如,线性或构象表位)。用于定位抗体与之结合的表位的详细示例性方法提供于:Morris(1996),“Epitope Mapping Protocols”,收录于Methods inMolecular Biology第66卷(Humana Press,Totowa,NJ)。
在示例性竞争测定中,将固定化的TGFβ同种型(例如,TGFβ1、TGFβ2或TGFβ3)在包含与TGFβ同种型结合的第一标记抗体(例如,4A11、6F12或2A10抗体或其人源化变体,例如,如表5、6、7、12、13、14、19、20、23和24中所示)和正在测试其与第一抗体竞争结合TGFβ同种型的第二标记抗体的溶液中孵育。该第二抗体可存在于杂交瘤上清液中。作为对照,将固定化TGFβ同种型在包含第一标记抗体而非包含第二未标记抗体的溶液中孵育。在容许第一抗体与TGFβ同种型结合的条件下孵育之后,去除过量未结合的抗体,并且测量与固定化TGFβ同种型缔合的标记的量。若与固定化TGFβ同种型缔合的标记的量相对于对照样品在测试样品中基本上减少,则表明第二抗体与第一抗体竞争结合TGFβ同种型。参见Harlow和Lane(1988)Antibodies:A Laboratory Manual第14章(Cold Spring Harbor Laboratory,ColdSpring Harbor,NY)。
在另一实例中,使用放射免疫测定法(RIA)测定抗体结合和/或结合竞争。RIA是一种公知的技术。参见,例如,Chard,“An Introduction to Radioimmunoassy and RelatedTechniques”,North-Holland Publishing Company,1978。可以使用RIA的许多变体中的任何一种,诸如均相RIA,或异相或固相RIA,单抗体方法或“双”抗体方法,以及直接(正向)或反向夹心测定法。特别优选的是固相系统,其中与不溶性支持物共价偶联,使得孵育后抗体和结合的复合物可以容易地与可溶性游离部分分离。已经描述了多种固相载体,其包括葡聚糖颗粒、纤维素、连续表面诸如聚苯乙烯或聚丙烯盘、塑料管壁、玻璃盘、玻璃颗粒等。颗粒固相广泛用于各种不同的测定法并包括在本发明中。通过设计用于在蛋白质与颗粒之间产生不可逆共价或非共价连接的多种技术中的任何一种,例如直接或通过溴化氰活化,将抗体附接到颗粒上。其他替代方法是使用入陷在聚丙烯酰胺凝胶间隙中或与磁性颗粒结合的抗体。测定管设置有样品或标准品、示踪剂和适量的固相结合抗体,以及防止颗粒聚集和示踪剂非特异性吸收的洗涤剂。在管子连续混合的孵育期后,通过离心沉淀固相;去除上清液并用缓冲液对固相进行两次或多次洗涤,以便去除颗粒内和颗粒之间的游离示踪剂。然后测量固相(结合部分)的计数。也可以使用免疫放射测定法,Chards(出处同上),在423。
2.活性测定
在一方面,提供用于鉴定其具有生物活性的同种型选择性抗TGFβ抗体的测定法。生物活性可以包括例如在体外和/或体内与一种或多种TGFβ同种型结合并中和该同种型的能力。
在某些实施例中,在体外测定中测试本发明的抗体的这种生物活性。在一个实施例中,在与三个Smad3/4结合元件(SBE)融合的β-珠蛋白最小启动子的控制下稳定地表达人TGFβRI、Smad3、Smad4蛋白和分泌的碱性磷酸酶(SEAP)报告基因的HEK-Blue
在另一实施例中,本发明的抗TGFβ抗体的生物活性可以使用Abe等人AnalyticalBiochemistry(1994);216(2):276-284中描述的测定法来评估。简而言之,该测定法使用基于水貂肺上皮(MLE)细胞的TGFβ阻断测定法,其中用含有血纤维蛋白溶酶原活化因子抑制剂1启动子下游的荧光素酶基因的质粒转染MLE细胞。将抗体与每种TGFβ同种型(PeproTech,Rocky Hill,NJ)在25℃孵育1小时,然后添加到4x 10
D.免疫缀合物
本发明还提供免疫缀合物,其包含与一种或多种细胞毒性剂缀合的本发明的同种型选择性抗TGFβ抗体,该一种或多种细胞毒性剂为诸如化疗剂或药物、生长抑制剂、毒素(例如细菌、真菌、植物或动物来源的蛋白质毒素、酶活性毒素,或它们的片段)或放射性同位素。
在一个实施例中,免疫缀合物为抗体-药物缀合物(ADC),其中性抗体缀合至一种或多种药物,包括但不限于美登木素类(参见美国专利号5,208,020、5,416,064和欧洲专利EP 0 425 235 B1);奥瑞他汀(auristatin),诸如单甲基奥瑞他汀药物部分DE和DF(MMAE和MMAF)(参见美国专利号5,635,483和5,780,588以及7,498,298);多拉司他汀;卡奇霉素或其衍生物(参见美国专利号5,712,374、5,714,586、5,739,116、5,767,285、5,770,701、5,770,710、5,773,001和5,877,296;Hinman等人,Cancer Res.53:3336-3342(1993);和Lode等人,Cancer Res.58:2925-2928(1998));蒽环类药物,诸如柔红霉素或多柔比星(参见Kratz等人,Current Med.Chem.13:477-523(2006);Jeffrey等人,Bioorganic&Med.Chem.Letters 16:358-362(2006);Torgov等人,Bioconj.Chem.16:717-721(2005);Nagy等人,Proc.Natl.Acad.Sci.USA 97:829-834(2000);Dubowchik等人,Bioorg.&Med.Chem.Letters 12:1529-1532(2002);King等人,J.Med.Chem.45:4336-4343(2002);以及美国专利号6,630,579);甲氨蝶呤;长春地碱;紫杉烷,诸如多西他赛、紫杉醇、拉罗他赛、替塞他赛和奥他他赛;单端孢菌素和CC1065。
在另一个实施例中,免疫缀合物包含与酶活性毒素或其片段缀合的本文所述的抗体,所述酶活性毒素或其片段包括但不限于白喉A链、白喉毒素的非结合活性片段、外毒素A链(来自铜绿假单胞菌)、蓖麻毒蛋白质A链、相思豆毒蛋白质A链、蒴莲根毒素A链、α-帚曲霉素、油桐蛋白、石竹黄素蛋白、美洲商陆抗病毒蛋白(PAPI、PAPII和PAP-S)、苦瓜抑制剂、姜黄素、巴豆素、肥皂草抑制剂、明胶、米托菌素、局限曲霉素、酚霉素、依诺霉素和单端孢菌素。
在另一个实施例中,免疫缀合物包括与放射性原子缀合以形成放射性缀合物的本文所述的抗体。多种放射性同位素可用于生产放射性缀合物。实例包括At
可以使用多种双功能蛋白偶联剂,诸如N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)、4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(SMCC)、亚氨基硫杂环戊烷(IT)、亚氨基酯的双官能衍生物(诸如己二酸二甲酯盐酸盐)、活性酯(诸如辛二酸二琥珀酰亚胺基酯)、醛(诸如戊二醛)、双叠氮基化合物(诸如双(对叠氮基苯甲酰基)己二胺)、双重氮衍生物(诸如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(诸如甲苯2,6-二异氰酸酯)和双活性氟化合物(诸如1,5-二氟-2,4-二硝基苯)制备抗体和细胞毒剂的缀合物。例如,可以如Vitetta等人,Science 238:1098(1987)中所述制备蓖麻毒蛋白免疫毒素。碳-14标记的1-异硫氰基苄基-3-甲基二亚乙基三胺五乙酸(MX-DTPA)为一种示例性螯合剂,用于将放射性核苷酸缀合至抗体。参见WO94/11026。接头可以为促进细胞中细胞毒性药物释放的“可切割接头”。例如,可以使用对酸不稳定的连接基、肽酶敏感的连接基、对光不稳定的连接基、二甲基连接基或含二硫键的连接基(Chari等人,Cancer Res.52:127-131(1992);美国专利号5,208,020)。
本文的免疫缀合物或ADC明确考虑但不限于用交联剂制备的此类缀合物,包括但不限于市售的(例如,来自Pierce Biotechnology,Inc.,Rockford,IL.,U.S.A)BMPS、EMCS、GMBS、HBVS、LC-SMCC、MBS、MPBH、SBAP、SIA、SIAB、SMCC、SMPB、SMPH、磺基-EMCS、磺基-GMBS、磺基-KMUS、磺基-MBS、磺基-SIAB、磺基-SMCC、磺基-SMPB和SVSB(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯)。
E.用于诊断和检测的方法和组合物
在某些实施例中,本文提供的任何同种型选择性抗TGFβ抗体可用于检测生物样品中一种或多种TGFβ同种型(例如,TGFβ1、TGFβ2或TGFβ3)的存在。如本文所用的术语“检测”涵盖定量或定性检测。在某些实施例中,生物样品包括细胞或组织,诸如来自肺、肾、心脏、胰腺、肝或皮肤的细胞或组织。
在一个实施例中,提供一种用于诊断或检测方法中的同种型选择性抗TGFβ抗体。在进一步的方面,提供一种检测生物样品中一种或多种TGFβ同种型(例如,TGFβ1、TGFβ2或TGFβ3)的存在的方法。在某些实施例中,该方法包括在允许同种型选择性抗TGFβ抗体与一种或多种TGFβ同种型(例如,TGFβ1、TGFβ2和/或TGFβ3)结合的条件下是该生物样品与如本文所述的同种型选择性抗TGFβ接触,并检测该同种型选择性抗TGFβ抗体与该TGFβ同种型之间是否形成复合物。此类方法可以是体外或体内方法。在一个实施例中,抗TGFβ抗体用于选择能够用同种型选择性抗TGFβ抗体进行治疗的受试者,例如其中TGFβ为用于选择患者的生物标志物。
例如,在下文的实例4中证明,SSc患者中TGFβ3表达与健康对照相比显著上调,此外,在来自患有特发性肺纤维化(IPF)的患者的大量肺活检样品的qPCR分析中,TGFβ3和TGFβ2(在较小程度上)以与对照肺相比显著更高的水平表达,而TGFβ1在IPF中的平均表达与对照相比略低。因此,在一些实施例中,例如在特定组织中,TGFβ同种型的表达水平可用于诊断患有该组织病症的患者。
在一些实施例中,TGFβ2和/或TGFβ3的表达水平可用于鉴定可能对用本发明的同种型选择性抗TGFβ抗体(例如,如本文所述的抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)治疗有应答的患者。在一些实施例中,如果患者的选自TGFβ2、TGFβ3、骨膜蛋白(POSTN)和软骨寡聚基质蛋白(COMP)的一种或多种或所有生物标志物的基线水平(在用同种型选择性抗TGFβ抗体治疗之前)是相对于参考水平(例如,健康或对照受试者)升高的,则确定该患者可能对用本发明的同种型选择性抗TGFβ抗体治疗有应答。在一些实施例中,此类患者先前已施用IL-6抑制剂疗法,并且对所述疗法具有不足、最低限度的应答或没有应答。在一些实施例中,IL-6抑制剂为托珠单抗。
在一些实施例中,将生物标志物(例如,TGFβ2、TGFβ3、COMP和/或POSTN)的血清水平定量以确定患者是否可能对同种型选择性抗TGFβ抗体的治疗有应答。在一些实施例中,如果一种或多种生物标志物(例如,TGFβ2、TGFβ3、COMP和/或POSTN)的血清水平在基线相对于参考水平(例如,在健康受试者中)是升高,则选择该受试者进行治疗。在进一步的实施例中,向被鉴定为可能对用本发明的同种型选择性抗TGFβ抗体治疗有应答和/或被选择用于治疗的患者施用同种型选择性抗TGFβ抗体,例如,以治疗有效量施用。
在某些实施例中,将生物标志物(例如,TGFβ2、TGFβ3、COMP和/或POSTN)的血清水平定量以确定,如果向患者施用包含除本发明的同种型选择性抗TGFβ抗体外的治疗剂,则该患者较不可能得以改善。
测量血清生物标志物例如TGFβ2、TGFβ3、POSTN和COMP的水平在本领域技术范围内。上文已经提供了TGFβ同种型序列。COMP和POSTN的核酸和氨基酸序列是本领域已知的并且为了参考,示例性氨基酸序列提供如下:
人POSTN的经典氨基酸序列为:
MIPFLPMFSLLLLLIVNPINANNHYDKILAHSRIRGRDQGPNVCALQQILGTKKKYFSTCKNWYKKSICGQKTTVLYECCPGYMRMEGMKGCPAVLPIDHVYGTLGIVGATTTQRYSDASKLREEIEGKGSFTYFAPSNEAWDNLDSDIRRGLESNVNVELLNALHSHMINKRMLTKDLKNGMIIPSMYNNLGLFINHYPNGVVTVNCARIIHGNQIATNGVVHVIDRVLTQIGTSIQDFIEAEDDLSSFRAAAITSDILEALGRDGHFTLFAPTNEAFEKLPRGVLERIMGDKVASEALMKYHILNTLQCSESIMGGAVFETLEGNTIEIGCDGDSITVNGIKMVNKKDIVTNNGVIHLIDQVLIPDSAKQVIELAGKQQTTFTDLVAQLGLASALRPDGEYTL LAPVNNAFSDDTLSMDQRLLKLILQNHILKVKVGLNELYNGQILETIGGKQLRVFVYRTAVCIENSCMEKGSKQGRNGAIHIFREIIKPAEKSLHEKLKystQDKRFSTFLSLLEAADLKELLTQPGDWTLFVPTNDAFKGMTSEEKEILIRDKNALQNIILYHLTPGVFIGKGFEPGVTNILKTTQGSKIFLKEVNDTLLVNELKSKESDIMTTNGVIHVVDKLLYPADTPVGNDQLLEILNKLIKYIQIKFVRGSTFKEIPVTVYTTKIITKVVEPKIKVIEGSLQPIIKTEGPTLTKVKIEGEPEFRLIKEGETITEVIHGEPIIKKYTKIIDGVPVEITEKETREERIITGPEIKYTRISTGGGETEETLKKLLQEEVTKVTKFIEGGDGHLFEDEEIKRLLQGDTPVRKLQANKKVQGSRRRLREGRSQ(SEQ ID NO:162)。
编码人POSTN的核酸序列和其他变体氨基酸序列是本领域已知的,并且可以在Uniprot数据库中找到,该数据库可在万维网uniprot.org/uniprot/Q15063上访问UniprotID Q15063。
人COMP的经典氨基酸序列为:
MVPDTACVLLLTLAALGASGQGQSPLGSDLGPQMLRELQETNAALQDVRELLRQQVREITFLKNTVMECDACGMQQSVRTGLPSVRPLLHCAPGFCFPGVACIQTESGARCGPCPAGFTGNGSHCTDVNECNAHPCFPRVRCINTSPGFRCEACPPGYSGPTHQGVGLAFAKANKQVCTDINECETGQHNCVPNSVCINTRGSFQCGPCQPGFVGDQASGCQRRAQRFCPDGSPSECHEHADCVLERDGSRSCVCAVGWAGNGILCGRDTDLDGFPDEKLRCPERQCRKDNCVTVPNSGQEDVDRDGIGDACDPDADGDGVPNEKDNCPLVRNPDQRNTDEDKWGDACDNCRSQKNDDQKDTDQDGRGDACDDDIDGDRIRNQADNCPRVPNSDQKDSDGDGIGDACDNCPQKSNPDQADVDHDFVGDACDSDQDQDGDGHQDSRDNCPTVPNSAQEDSDHDGQGDACDDDDDNDGVPDSRDNCRLVPNPGQEDADRDGVGDVCQDDFDADKVVDKIDVCPENAEVTLTDFRAFQTVVLDPEGDAQIDPNWVVLNQGREIVQTMNSDPGLAVGYTAFNGVDFEGTFHVNTVTDDDYAGFIFGYQDSSSFYVVMWKQMEQTYWQANPFRAVAEPGIQLKAVKSSTGPGEQLRNALWHTGDTESQVRLLWKDPRNVGWKDKKSYRWFLQHRPQVGYIRVRFYEGPELVADSNVVLDTTMRGGRLGVFCFSQENIIWANLRYRCNDTIPEDYETHQLRQA(SEQ ID NO:163)。
编码人COMP的核酸序列和其他变体氨基酸序列是本领域已知的,并且可以在Uniprot数据库中找到,该数据库可在万维网uniprot.org/uniprot/P49747上访问UniprotID P49747。
POSTN和COMP的血清水平可以通过本领域已知的任何合适的方法来确定,例如,ELISA、微阵列或PCR。在另一实施例中,可以使用基于IMPACT的特异性免疫测定法来检测POSTN和COMP的蛋白质水平,例如,如下文实例4中所述。例如,可以根据本领域合适的方法从受试者或患者收集全血,使其凝结,然后离心。使用基于IMPACT的特异性免疫测定法(罗氏诊断公司,Penzberg,Germany)确定血清生物标志物水平。简而言之,样品可以与包被有生物素化F(ab')2抗体片段的IMPACT芯片一起孵育,该片段对感兴趣的靶蛋白(例如,生物标志物,例如TGFβ2、TGFβ3、COMP或POSTN)具有特异性。在洗涤步骤之后,添加标记有地高辛的生物标志物特异性检测抗体并孵育。洗涤后,添加荧光抗地高辛-胶乳偶联物,用电荷耦合检测相机检测特异性结合的荧光标记。使用由重组蛋白标准品(R&D Systems,Minneapolis,MN,USA)构成的标准曲线和专用软件(Roche Diagnostics)将发射的荧光转化为信号强度。
根据本文所述的任何方法,核酸可以是从基因集DNA转录的RNA或从RNA产生的cDNA。核酸可以来源于脊椎动物,例如,哺乳动物。如果核酸直接从特定来源获得或者如果它是在该来源中发现的核酸的拷贝,则称该核酸“源自”该特定来源。
核酸包括核酸的拷贝,例如,扩增产生的拷贝。在某些情况下可能需要扩增,例如,为了获得用于检测变异的所需量的材料。然后可以对扩增子进行变异检测方法,诸如下文描述的那些,以确定某些基因的表达。
微阵列是一种多重技术,其通常使用一系列排列的数千个核酸探针在高严格条件下与例如cDNA或cRNA样品杂交。通常通过检测荧光团、银或化学发光标记的靶来检测探针-靶标杂交并定量,以确定靶标中核酸序列的相对丰度。在典型的微阵列中,探针通过与化学基质的共价键(经由环氧-硅烷、氨基-硅烷、赖氨酸、聚丙烯酰胺或其他)附接到固体表面。固体表面为例如玻璃、硅芯片或微珠。各种微阵列是可商购的,包括例如由Affymetrix,Inc.和Illumina,Inc.制造的微阵列。
在另一实施例中,血清生物标志物水平可以使用旨在用于cobas e601(罗氏诊断公司)的Elecsys(罗氏诊断公司)POSTN免疫测定的临床试验版本来测量。
在一些实施例中,提供一种确定患有纤维化病症的受试者的疾病负担和/或预后的方法。在一些非限制性实施例中,纤维化病症为SSc或IPF。该方法可以包括检测受试者中POSTN和/或COMP的外周血血清水平。
用于检测蛋白质水平的方法是本领域已知的。可以检测全血、血浆或血清样品中蛋白质的表达水平。用于检测此类生物样品中蛋白质表达水平的各种方法在本领域中是已知的,包括各种免疫测定方法。先前已经描述了范围广泛的免疫测定技术,参见例如美国专利号4,016,043、4,424,279和4,018,653。这些技术包括非竞争性类型的单位点和双位点或“夹心”测定,以及传统的竞争性结合测定。这些测定还包括标记抗体与靶标生物标记物的直接结合。
夹心测定法是最有用和最常用的测定法之一。存在多种夹心测定技术的变体,并且所有变体都旨在为本发明所涵盖。简而言之,在典型的正向测定中,未标记的抗体被固定在固体底物上,并且使待测样品与结合的分子接触。在适当的孵育期后,添加用能够产生可检测信号的报告分子标记的对抗原具有特异性的第二抗体并孵育足以允许形成抗体-抗体复合物的时间段,从而使时间足以形成抗体-抗原-标记的抗体的另一复合物。可将任何未反应的材料洗去,并且通过观察由与报告分子产生的信号来确定抗原的存在。结果可以通过简单观察可见信号来定性,或者可以通过与含有已知量的生物标记物的对照样品进行比较来定量。
在其他实施例中,一种或多种TGFβ同种型的升高水平的存在可用于诊断性地确定源自TGFβ相关病症(例如,纤维化或癌症)的病理的存在或初期存在。例如,利用抗TGFβ抗体的免疫测定法提供了这样的诊断测试。此类测定法的各种形式是可用的并且为本领域技术人员所熟知,包括RIA、ELISA和免疫荧光。一般参见Ruoslahti等人,M.Enz.,82:803-831(1982)。替代性地,出于相同目的,核酸探针可用于检测TGFβmRNA并定量。此类方法在本技术领域中也是公知的。
在一些实施例中,随着时间的推移监测受试者,并将生物标志物的起始血清水平与治疗期间稍后时间点的水平进行比较,以评估受试者的疾病负担是否正在改变和/或受试者的预后是否正在改善或恶化。在一些实施例中,如果POSTN和COMP中的一者或两者的表达水平相对于健康对照或参考标准或相对于受试者的POSTN或COMP水平在TGFβ相关疾患(例如,IPF或SSc)的治疗方案开始或开始之前是增加的,则受试者的病症或预后较不可能改善。
在一些方面,提供一种将受试者鉴定为具有高TGFβ活性和/或可能受益于用TGFβ同种型抑制剂,例如,用本发明的同种型选择性抗TGFβ抗体(例如,如本文所述的抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)治疗的受试者。在一些方面,受试者患有SSc。在一些方面,受试者患有IPF。在一些方面,该方法包括检测具有以下基因的18个基因特征组中的一个或多个基因的表达水平:PRSS23、PXDN、COL8A1、COL6A3、SERPINE2、TNC、COMP、THBS1、COL11A1、COL1A1、COL5A2、COL1A2、COL4A1、COL4A2、SFRP4、ALPK2、COL5A1、TAGLN。18个基因特征组的基因描述于下表2中。在一些方面,该方法包括,如果该18个基因特征组中的1个或更多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个、16个或更多个、17个或更多个或所有18个基因的水平相对于健康对照组中的基因水平(例如,参考值)是升高的,则将受试者鉴定为具有高TGFβ活性和/或可能受益于用TGFβ同种型抑制剂治疗的受试者。在一方面,该方法包括,如果该18个基因特征组中的每一个和所有18个基因的水平相对于健康对照组中相应基因的水平是升高的,则将受试者鉴定为具有高TGFβ活性和/或可能受益于用TGFβ同种型抑制剂治疗的受试者。
表2:18个基因特征组
在具体实施例中,如果选自m SERPINE1、COL1A1、COL1A2和COL3A1的一个或多个基因的水平相对于健康对照组(例如,参考值)是升高的,则将受试者鉴定为具有高TGFβ活性和/或可能受益于用TGFβ同种型的抑制剂治疗的受试者。该基因集的基因在下表3中更详细地描述。在一些方面,该方法包括,如果SERPINE1、COL1A1、COL1A2和COL3A1中的1个或更多个、2个或更多个、3个或更多个,或所有4个基因的水平相对于健康对照组中相应基因的水平(例如参考值)是升高的,则将受试者鉴定为具有高TGFβ活性和/或可能受益于用TGFβ同种型的抑制剂治疗的受试者。
表3
在上述方法的一些实施例中,如果基因表达水平相对于该基因的对照或参考水平的表达增加是统计学显著的,则认为基因表达水平是升高的。用于确定统计显著性的方法在本领域中是公知的。作为非限制性示例,可以使用例如未配对双尾学生t检验来确定统计显著性。在其他实施例中,如果基因表达水平相对于该基因的对照或参考水平增加至少2倍、至少3倍或至少4倍,则认为基因表达水平是升高的。
在其他方面,提供监测对使用TGFβ抑制剂(例如,如本文所述的抗TGFβ2抗体和/或抗TGFβ3抗体)对受试者的治疗的应答的方法。该方法包括确定选自PRSS23、PXDN、COL8A1、COL6A3、SERPINE2、TNC、COMP、THBS1、COL11A1、COL1A1、COL5A2、COL1A2、COL4A1、COL4A2、SFRP4、ALPK2、COL5A1、TAGLN的一种或多种TGFβ诱导型基因和/或选自SERPINE1、COL1A1、COL1A2和COL3A1的一种或多种基因的表达水平。在一些实施例中,该方法进一步包括,如果选自PRSS23、PXDN、COL8A1、COL6A3、SERPINE2、TNC、COMP、THBS1、COL11A1、COL1A1、COL5A2、COL1A2、COL4A1、COL4A2、SFRP4、ALPK2、COL5A1、TAGLN的一种或多种基因和/或选自SERPINE1、COL1A1、COL1A2和COL3A1的一种或多种基因的表达水平相对于较早时间点(例如,在TGFβ抑制剂治疗开始之前或在开始时)的相应水平没有降低,则停止用TGFβ抑制剂治疗。
在另一实施例中,提供一种选择受试者以用TGFβ抑制剂(例如,如本文所述的抗TGFβ2抗体和/或抗TGFβ3抗体)治疗的方法。该方法可包括检测受试者的血清POSTN和COMP中的一种或两种的水平,并且如果血清POSTN和COMP中的一种或两种的水平与健康对照水平相比是升高的,则向受试者施用TGFβ抑制剂。在一些实施例中,TGFβ抑制剂为抗TGFβ3抗体,例如,抗体2A10或其人源化变体,例如,如图12至16或下文实例1中的表5至7所示。
在一些实施例中,将受试者鉴定为具有高TGFβ活性和/或可能受益于用TGFβ同种型抑制剂治疗的受试者的方法和/或用于选择用TGFβ抑制剂治疗的受试者的方法包括向该受试者施用疗法。在一些实施例中,该疗法用于治疗TGFβ相关疾患,例如,如本文所述。在一些实施例中,该疗法用于治疗纤维化病症,例如,如本文所述。在一些实施例中,治疗包括施用如本文所述的抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体。在一个优选的实施例中,该疗法包括施用如本文所述的抗TGFβ3抗体,例如,分离的抗TGFβ3抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区结合;(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并且抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;(d)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394;(e)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
在上述实施例的一些方面,抗TGFβ3抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ IDNO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9)。在一些实施例中,抗TGFβ3抗体包含VH/VL对,该VH/VL对包含(分别)为SEQ ID NO:52/36的氨基酸序列,或(分别)为SEQ ID NO:51/36或SEQ ID NO:55/54的氨基酸序列,或(分别)为SEQID NO:53/36或SEQ ID NO:57/56的氨基酸序列。在一些实施例中,抗TGFβ3抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:57/56的氨基酸序列。
在上述实施例的一些方面,抗TGFβ3抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9),或(分别)为SEQ ID NO:74/58的氨基酸序列,或(分别)为SEQ ID NO:73/58或SEQID NO:77/76的氨基酸序列,或(分别)为SEQ ID NO:75/58或SEQ ID NO:79/78的氨基酸序列。在一些方面,抗TGFβ3抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:79/78的氨基酸序列。
在上述实施例的一些方面,该疗法包括施用如本文所述的抗TGFβ2/3抗体,例如,分离的抗TGFβ2/3抗体,其中该抗体选择性地中和TGFβ2和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:(a)关于选择性中和,通过该抗体的抗原结合结构域与TGFβ2或TGFβ3的氨基酸残基E373(人TGFβ2编号)的直接接触,实现抗TGFβ2/3抗体相对于人TGFβ1对TGFβ2和TGFβ3的选择性;(b)抗TGFβ2/3抗体经由变构机制而中和TGFβ2和/或TGFβ3;(c)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化;(d)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化,其中该构象变化包括两个单体夹在一起几度;(e)抗TGFβ2/3抗体为二价抗体或单价抗体;(f)抗TGFβ2/3抗体包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;(g)抗TGFβ2/3抗体与TGFβ2同源二聚体结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,并且其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触(i)第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和(ii)第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(人TGFβ2编号);(h)如(g)中的抗TGFβ2/3抗体,其中该抗原结合结构域位于TGFβ2和/或TGFβ3氨基酸残基的5埃内;(i)其中抗TGFβ2/3抗体与如(g)中的TGFβ3上的相同表位结合;和(j)所述抗TGFβ2/3抗体不中和单臂形式的TGFβ2和/或TGFβ3。
在上述实施例的一些方面,抗TGFβ2/3抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:27/26(兔4A11)、SEQ ID NO:81/80(v1)、SEQ ID NO:81/82(v2)、SEQ ID NO:83/80(v3)、SEQ ID NO:83/82(v4)、SEQ ID NO:81/84(v5)、SEQ ID NO:81/85(v6)、SEQ ID NO:83/84(v7)、SEQ ID NO:86/84(v7/1)、SEQ ID NO:87/84(v7.2)、SEQ ID NO:88/84(v7.3)、SEQ ID NO:83/89(v7.4)、SEQ ID NO:83/90(v7.5)、SEQ ID NO:83/91(v7.6)、SEQ ID NO:83/92(v7.7)、SEQ ID NO:93/84(v7.8)、SEQID NO:94/84(v7.9)、SEQ ID NO:95/84(v7.10)、SEQ ID NO:96/84(v7.11)、SEQ ID NO:97/84(v7.12)、SEQ ID NO:98/84(v7.13)、SEQ ID NO:99/84(v7.14)、SEQ ID NO:100/84(v7.15)、SEQ ID NO:102/101(v7.16)、SEQ ID NO:103/101(v7.17)、SEQ ID NO:104/101(v7.18)、SEQ ID NO:105/101(v7.19)和SEQ ID NO:83/85(v8)。
在上述实施例的一些方面,抗TGFβ2/3抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:32/33(兔4A11)、SEQ ID NO:107/106(v1)、SEQ ID NO:107/108(v2)、SEQ ID NO:109/106(v3)、SEQ ID NO:109/108(v4)、SEQ ID NO:107/110(v5)、SEQ ID NO:107/111(v6)、SEQ ID NO:109/110(v7)、SEQ IDNO:112/110(v7.1)、SEQ ID NO:113/110(v7.2)、SEQ ID NO:114/110(v7.3)、SEQ ID NO:114/115(v7.4)、SEQ ID NO:114/116(v7.5)、SEQ ID NO:114/117(v7.6)、SEQ ID NO:114/118(v7.7)、SEQ ID NO:119/110(v7.8)、SEQ ID NO:120/110(v7.9)、SEQ ID NO:121/110(v7.10)、SEQ ID NO:122/110(v7.11)、SEQ ID NO:123/110(v7.12)、SEQ ID NO:124/110(v7.13)、SEQ ID NO:125/110(v7.14)、SEQ ID NO:126/110(v7.15)、SEQ ID NO:127/186(v7.16)、SEQ ID NO:128/186(v7.17)、SEQ ID NO:129/186(v7.18)、SEQ ID NO:130/186(v7.19)和SEQ ID NO:114/111(v8)。
在上述实施例的一些方面,该疗法包括施用如本文所述的抗TGFβ2抗体,例如分离的抗TGFβ2抗体,其中该抗体包含:(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。在一些方面,该抗体选择性地中和TGFβ2。在一些方面,抗TGFβ2抗体具有以下特性中的一项或多项:(a)选择性地中和TGFβ2;(b)具有相对于泛TGFβ抗体1D11的减少的毒性;(c)具有相对于泛TGFβ抗体1D11的减少的毒性;(d)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;(e)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或(f)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。
在上述实施例的一些方面,抗TGFβ2抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:25/24(兔6F12)、SEQ ID NO:132/131(v1)、SEQ ID NO:132/133(v1.1)、SEQ ID NO:132/134(v1.2)、SEQ ID NO:132/135(v1.3)、SEQID NO:132/136(v1.4)、SEQ ID NO:132/137(v1.5)、SEQ ID NO:138/131(v1.6)、SEQ IDNO:139/131(v1.7)、SEQ ID NO:140/131(v1.8)、SEQ ID NO:141/131(v1.9)、SEQ ID NO:142/131(v2)、SEQ ID NO:132/143(v3)和SEQ ID NO:142/144(v4)。
在上述实施例的一些方面,抗TGFβ2抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:31/30(兔6F12)、SEQ ID NO:146/145(v1)、SEQ ID NO:146/147(v1.1)、SEQ ID NO:146/148(v1.2)、SEQ ID NO:146/149(v1.3)、SEQ ID NO:146/150(v1.4)、SEQ ID NO:146/151(v1.5)、SEQ ID NO:152/145(v1.6)、SEQ ID NO:153/145(v1.7)、SEQ ID NO:154/145(v1.8)、SEQ ID NO:155/145(v1.9)、SEQ ID NO:156/145(v2)、SEQ ID NO:146/157(v3)和SEQ ID NO:156/158(v4)。
可以根据本发明诊断和/或治疗的示例性病症和疾患(例如,如上所述)包括TGFβ相关疾患,例如,以细胞外基质积聚为特征的疾病;由循环TGFβ或在局部位点活化的TGFβ(包括一种或多种TGFβ同种型)引起的疾病;由内源性TGFβ产生所致的免疫系统抑制引起的病症;严重伤害、烧伤和疾病诸如病毒或细菌感染导致的急性免疫缺陷;由于TGFβ产生或过度产生导致的多器官系统疾病;以及产生TGFβ的肿瘤。在一些实施例中,可以使用本发明的同种型选择性抗TGFβ抗体诊断的疾患包括纤维化疾病,例如,如本文所述。在一些实施例中,纤维化疾病为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化疾患。在一些实施例中,纤维化为如下文G节中所述的纤维化病症或疾患。
在一些实施例中,可以使用本发明的抗体诊断的TGFβ相关疾患使用抗体4A11、6F12和2A10或其人源化变体中的一种或多种来诊断,例如,如本文所述,例如在图12至16和18至24中。
在某些实施例中,提供标记的同种型选择性抗TGFβ抗体,例如,上述抗体。标记包括但不限于直接检测的标记或部分(诸如荧光标记、发色标记、电子致密标记、化学发光标记,以及放射性标记),以及间接(例如通过酶促反应或分子相互作用)检测的部分(诸如酶或配体)。示例性标记包括但不限于放射性同位素
F.药物制剂
如本文所述的同种型选择性抗TGFβ抗体的药物制剂通过将此类具有所需纯度的抗体与一种或多种任选的药用载体混合(Remington's Pharmaceutical Sciences第16版,Osol,A.编(1980)),制成冻干制剂或水溶液的形式。药用载体在所采用的剂量和浓度下通常对受体无毒,包括但不限于:缓冲剂,例如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;六甲基氯化铵;苯扎氯铵;苄索氯铵;苯酚,丁醇或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖,二糖和其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖,如蔗糖、甘露醇、海藻糖或山梨醇;成盐的抗衡离子,例如钠;金属络合物(例如锌蛋白络合物);和/或非离子表面活性剂,例如聚乙二醇(PEG)。本文的示例性药用的载体还包括间质药物分散剂例如可溶性中性活性透明质酸酶糖蛋白(sHASEGP),诸如人可溶性PH-20透明质酸酶糖蛋白,例如rHuPH20(
示例性的冻干抗体制剂描述于美国专利号6,267,958中。水性抗体制剂包括在美国专利号6,171,586和WO2006/044908中描述的那些,后一者中的制剂包含组氨酸-乙酸盐缓冲剂。
本文的制剂还可含有多于一种对于所治疗的特定适应症是必需的活性成分,优选是具有不会彼此不利地影响的互补活性的活性成分。例如,可能需要进一步提供选自吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗,参见例如,美国专利号9,539,263,沙利姆单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂、JAK抑制剂、IL-11抑制剂和血清淀粉样蛋白P(PTX2)的治疗剂。(参见Raghu等人European Respiratory Journal2012 40:2819)(FG-309,Ninou等人(2018)Front Med(Lausanne);5:180(自分泌运动因子抑制剂)。)此类活性成分适当地以对预期目的有效的量组合存在。
活性成分可以包埋在例如通过凝聚技术或通过界面聚合而制备的微胶囊(例如分别为羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)中;包埋在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米粒子和纳米胶囊)中;或包埋在粗乳液中。此类技术公开于Remington's Pharmaceutical Sciences第16版,Osol,A.编(1980)中。
可以制备缓释制备物。缓释制剂的合适实例包括含有抗体的固态疏水聚合物的半透性基质,这些基质是例如膜或微胶囊等成型制品的形式。
用于体内施用的制剂通常是无菌的。例如,无菌可以通过无菌过滤膜过滤而容易地实现。
G.治疗方法和组合物
目前发现本文所述的同种型选择性抗TGFβ抗体可用于治疗方法中。长期以来,TGFβ一直被认为是病理性纤维化的关键介质,但其多种稳态功能对开发具有可接受治疗指数的治疗性TGFβ抑制剂提出了挑战。虽然三种TGFβ同种型能够在靶细胞上介导类似的信号传导活动,但它们不同的LAP结构域和表达模式暗示了每种同种型的独特作用,这得到了小鼠和人类遗传功能损失的证据的支持。尽管不欲受任何一种特定理论或作用机制束缚,但本文发现潜在TGFβ2和TGFβ3的活化阈值和机制不同于TGFβ1阈值和机制(参见例如,实例14);与TGFβ1不同,TGFβ2和TGFβ3在人类纤维化组织以及肺和肝小鼠模型中以升高的水平表达;并且用有效的变构抗体对TGFβ2和TGFβ3进行同种型选择性治疗性抑制可以减轻体内实验性纤维化。这些发现支持同种型选择性TGFβ2和/或TGFβ3抑制作为患有慢性纤维化疾患的患者的治疗策略。例如,在下文的实例4中,证明了TGFβ2和/或TGFβ3表达水平在人纤维化组织中是升高的并且TGFβ3表达与两种不同的纤维化疾患IPF和SSc中的TGFβR信号传导高度相关,并且在实例5中,该实例描述博莱霉素诱导型肺纤维化小鼠模型,在该模型中,用6F12中和TGFβ2、用2A10中和TGFβ3以及用6F12+2A10抗体的组合或双重特异性(抗TGFβ2/3)4A11抗体中和TGFβ2和TGFβ3两者减少了新胶原蛋白的合成。此外,在FaSScinate试验的基线处进行的皮肤活检中(皮肤的SSc,参见Khanna等人(2016)The Lancet;vol.387:10038,p.2630-2640),目前证明,SSc患者的TGFβ3表达以及TGFβ特征中一组特定基因的表达与健康对照相比显著上调,并且TGFβ3表达与TGFβ特征呈强烈的正相关,支持使用如本文所述的抗TGFβ3抗体治疗SSc的对TGβ3的抑制。此外,实例16中的数据显示,用TGFβ2和TGFβ3的中和抗体治疗可以减少体内肺纤维化,并且实例17中的数据显示,TGFβ2和TGFβ3抑制可以减少体内肝纤维化。因此,这些数据支持对TGFβ2和/或TGFβ3的抑制用于治疗TGFβ相关疾患,诸如但不限于纤维化病症。
因此,在某些方面,同种型选择性抗TGFβ抗体可用于治疗TGFβ相关疾患。TGFβ相关疾患的非限制性具体示例包括神经元、神经胶质、星形胶质细胞、下丘脑和其他腺体、巨噬细胞、上皮、间质和囊胚腔疾患;纤维化;瘢痕形成;诸如由辐射引起的组织损害和伤口愈合期间的粘连;纤维化皮肤病,诸如硬皮病、CNS病理性瘢痕组织、皮肤瘢痕、瘢痕疙瘩和神经瘢痕;腹膜腔、肺、肝和肾的纤维化疾病,诸如慢性肝纤维化、急性肝损伤、间质性肺和肾纤维化以及肝硬化;囊性纤维化;血管疾患,例如心脏纤维化、动脉损伤诸如动脉粥样硬化和动脉硬化;良性和恶性肿瘤;某些不受TGFβ抑制的白血病和恶性肿瘤(例如,肉瘤、癌和黑色素瘤),包括前列腺、纤维化、卵巢恶性黑色素瘤、乳腺、肺、结肠、直肠、结肠直肠或宫颈癌症和转移性癌症,以及消化系统的神经内分泌肿瘤和胶质母细胞瘤;血管病;血管病变;全身性硬化症;感染,诸如巨噬细胞病原体感染和病毒感染诸如丙型肝炎和HIV;免疫、血管生成和炎症性疾患和缺陷,诸如类风湿性关节炎;眼部疾患,尤其是那些涉及眼部纤维化的疾患,包括增生性视网膜病、视网膜脱离和青光眼引流手术后诸如人眼神经视网膜、视网膜色素上皮-脉络膜和玻璃体的疾患,以及白内障;骨质疏松症;成人呼吸窘迫综合征;术后-心肌梗塞;血管成形术后再狭窄;肾小球性肾炎;糖尿病相关病症,诸如高血糖症、糖尿病、糖尿病性肾脏疾病、糖尿病性肾病变、糖尿病神经病或视网膜病;以及巨噬细胞缺乏病。
优选地,TGFβ相关疾患为纤维化、动脉损伤、感染、类风湿性关节炎、糖尿病或糖尿病性病症或恶性肿瘤,诸如表达TGFβ的癌症,更优选其中癌症的特征为TGFβ的过度活化。此类癌症可能过度表达TGFβ,或者替代性地不以TGFβ过度表达为特征。
在其他方面,同种型选择性抗TGFβ抗体可用于治疗纤维化疾病,例如,肺、肝、肾、皮肤、心脏、胰腺、胃肠器官和泌尿生殖器官;血管组织;以及眼组织,例如角膜组织、视网膜组织和泪腺组织的纤维化疾病。在一些实施例中,同种型选择性抗TGFβ抗体可用于治疗与异常TGFβ调节和功能相关的疾病和疾患,例如但不限于,肺纤维化、肾小球性肾炎和糖尿病肾脏疾病、充血性心力衰竭、肝硬化、马凡综合征肥厚性瘢痕和SSc。在某些实施例中,纤维化病症与自身免疫病症有关。在其他实施例中,纤维化病症是在损伤(包括辐射、碱烧伤、物理烧伤、手术、物理创伤或其组合)之后发生的。参见Niessen等人,“On the nature ofhypertrophic scars and keloids:a review”,Plast.Reconstr.Surg.104:1435-1458(1999);Friedlander M.,“Fibrosis and diseases of the eye”,J.Clin.Invest.117:576-586(2007);Noble等人,“Pulmonary fibrosis:patterns and perpetrators”,J.Clin.Invest.122:2756-2762(2012);Bahn R.S.,“Graves'ophthalmopathy”,N.Engl.J.Med.362:726-738(2010);Hinz B.,“Formation and function of themyofibroblast during tissue repair”,J.Invest.Dermatol.127:526-537(2007);Gauglitz等人,“Hypertrophic scarring and keloids:pathomechanisms and currentand emerging treatment strategies”,Mol.Med.17:113-125(2011);Lehmann等人,“Immune mechanisms in thyroid eye disease”,Thyroid:official journal of theAmerican Thyroid Association 18:959-965(2008);Phan S.
H.,“The myofibroblast in pulmonary fibrosis”,Chest 122:286S-289S(2002);Kuriyan等人,“The eye and thyroid disease”,Curr.Opin.Ophthalmol.19:499-506(2008)。
下文更详细地描述了可以用本文描述的同种型选择性抗TGFβ抗体治疗的示例性纤维化病症。
1.肺的纤维化
示例性的肺的纤维化包括但不限于:特发性肺纤维化(IPF);特发性肺上叶纤维化(Amitani病);家族性肺纤维化;继发于全身性炎症性疾病的肺纤维化,诸如类风湿性关节炎、硬皮病、狼疮、隐原性纤维性肺泡炎、慢性阻塞性肺病(COPD)或慢性哮喘;囊性纤维化;非特异性间质性肺炎(NSIP);隐原性机化性肺炎(COP);进行性大块纤维化,煤矿工人尘肺的一种并发症;硬皮病/全身性硬化症(SSc,包括局限性皮肤(lcSSc)和弥漫性皮肤(dcSSc)形式和SSc相关间质性肺病(SSc-ILD));闭塞性细支气管炎合并机化性肺炎;结缔组织病相关ILD(CT-ILD)、进行性纤维化ILD、过敏性肺炎、肺动脉高压;肺结核;矽肺;石棉肺;急性肺损伤;和急性呼吸窘迫(ARD;包括细菌性肺炎引起的、创伤引起的和病毒性肺炎引起的、呼吸机引起的、非肺脓毒症引起的)。
2.肝脏的纤维化
示例性的肝脏的纤维化病症(例如,肝纤维化)包括但不限于,由于所有病因的肝纤维化;先天性肝纤维化;肥胖;脂肪肝;酒精引起的肝纤维化;非酒精性脂肪性肝炎(NASH);胆管损伤;原发性胆汁性肝硬化(PBC);原发性硬化性胆管炎(PSC);感染或病毒引起的肝纤维化(例如,慢性乙型和丙型肝炎病毒感染);囊性纤维化;自身免疫性肝炎;坏死型肝炎;原发性硬化性胆管炎;血色素沉着病;胆道系统疾患;可归因于感染的肝功能障碍。
3.心脏的纤维化
示例性的心和/或心包膜的纤维化病症(即,心或心包膜纤维化,或相关血管的纤维化)包括但不限于,心内膜心肌纤维化;心脏同种移植物血管病(CAV);心肌梗塞;心房纤维化;充血性心力衰竭;动脉硬化;动脉粥样硬化;血管狭窄;心肌炎;充血性心肌病;冠状动脉梗塞;静脉曲张;冠状动脉狭窄和其他缺血后病症;和特发性腹膜后纤维化。
4.肾脏的纤维化
示例性的肾脏的纤维化病症(即,肾纤维化)包括但不限于,肾小球性肾炎(包括膜增生性、弥漫性增生性、急进型或硬化性、感染后和慢性形式);糖尿病性肾小球硬化;局灶性节段性肾小球硬化;IgA肾病;糖尿病性肾病;缺血性肾病;小管间质性肾纤维化;HIV相关肾病;膜肾病;继发于全身性炎症性疾病(诸如狼疮、硬皮病和糖尿病性肾小球性肾炎)的肾小球性肾炎;特发性膜增生性肾小球性肾炎;系膜增生性肾小球性肾炎;新月体性肾小球肾炎;淀粉样变性(其影响肾及其他组织);自身免疫性肾炎;肾小管间质性纤维化;肾动脉硬化;Alport综合征;肾病综合征;慢性肾衰竭;慢性肾病;肾小球周围纤维化/无肾小管的肾小球;合并肺尖肺气肿和基底纤维化综合征(肺气肿/纤维化综合征);肾小球高血压;肾原性纤维化皮肤病;多囊性肾病;法布里病和肾性高血压。
5.胰腺的纤维化
示例性的胰腺的纤维化病症(即,胰腺纤维化)包括但不限于,间质重塑胰腺炎和间质纤维化。
示例性的胃肠道的纤维化病症(即,GI道纤维化)包括但不限于,克罗恩病;溃疡性结肠炎;胶原性结肠炎;结肠直肠纤维化;绒毛萎缩;隐窝增生;息肉形成;愈合性胃溃疡;和显微镜下结肠炎。
6.眼睛的纤维化
示例性的眼睛的纤维化病症包括但不限于,眼睛纤维化;眼部纤维化;增生性玻璃体视网膜病;任何病因的玻璃体视网膜病;与视网膜功能障碍有关的纤维化;与湿性或干性黄斑变性有关的纤维化;角膜和结膜中的瘢痕;角膜内皮中的纤维化;前囊下白内障和后囊膜混浊;眼前段纤维化疾病;角膜基质纤维化(例如,与角膜混浊有关);小梁网纤维化(例如,与青光眼有关);眼后段纤维化疾病;纤维血管瘢痕(例如,在眼的视网膜或脉络膜血管系统中);视网膜纤维化;视网膜前膜纤维化;视网膜胶质增生;视网膜下纤维化(例如,与年龄相关性黄斑变性有关);糖尿病性视网膜病中的牵引性视网膜脱离伴组织收缩;先天性眼眶纤维化;泪腺纤维化;角膜上皮下纤维化和格雷夫眼病。
7.其他纤维化疾患
由前述病症中任一项导致的其他纤维化疾患或纤维化包括但不限于,脊髓损伤/纤维化或中枢神经系统纤维化诸如卒中后的纤维化、杜氏肌肉营养不良、dupuytren痉挛、与神经退行性疾患诸如阿尔茨海默病或多发性硬化有关的纤维化;血管再狭窄;子宫纤维化;子宫内膜异位症;卵巢纤维瘤;佩罗尼氏病;多囊性卵巢综合征;强制性脊柱炎中的疾病相关肺尖纤维化;术后粘连、瘢痕和由微生物感染(例如,细菌、病毒、寄生虫、真菌等)引起的纤维化。皮肤的纤维化可以包括,例如但不限于,硬皮病、瘢痕疙瘩和硬斑病。
治疗方法
如本文所用,纤维化或纤维化病症的治疗,例如上述那些,意为包括破坏纤维化过程以停止纤维化病症的进展、减缓纤维化病症的进展或引起纤维化病症的消退(即,在受影响组织或器官的纤维化程度方面改善患者的健康状态)。在某些实施例中,其中在纤维化病症发作之前进行治疗,即在已知或以其他方式预期的纤维化发作之前进行治疗,则此类治疗可包括预防纤维化病症的发展或发作。因此,各种活性剂的施用可以进行适当的持续时间以控制或停止纤维化病症的进展,或防止其发作。
因此,在一些方面,本发明提供一种治疗纤维化的方法,其中纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。在一方面,纤维化为选自以下的肺纤维化:特发性肺纤维化(IPF);特发性肺上叶纤维化(Amitani病);家族性肺纤维化;继发于全身性炎症性疾病的肺纤维化,诸如类风湿性关节炎、硬皮病、狼疮、隐原性纤维性肺泡炎、慢性阻塞性肺病(COPD)或慢性哮喘;囊性纤维化;非特异性间质性肺炎(NSIP);隐原性机化性肺炎(COP);进行性大块纤维化,煤矿工人尘肺的一种并发症;硬皮病/全身性硬化症(SSc,包括局限性皮肤(lcSSc)和弥漫性皮肤(dcSSc)形式和SSc相关间质性肺病(SSc-ILD));闭塞性细支气管炎合并机化性肺炎;结缔组织病相关ILD(CT-ILD)、进行性纤维化ILD、过敏性肺炎、肺动脉高压;肺结核;矽肺;石棉肺;急性肺损伤;和急性呼吸窘迫(ARD;包括细菌性肺炎引起的、创伤引起的和病毒性肺炎引起的、呼吸机引起的、非肺脓毒症引起的)。在另一方面,纤维化为选自以下的肝脏的纤维化病症:由于所有病因的肝硬化;先天性肝纤维化;肥胖;脂肪肝;酒精引起的肝纤维化;非酒精性脂肪性肝炎(NASH);胆管损伤;原发性胆汁性肝硬化(PBC);原发性硬化性胆管炎(PSC);感染或病毒引起的肝纤维化(例如,慢性乙型和丙型肝炎病毒感染);囊性纤维化;自身免疫性肝炎;坏死型肝炎;原发性硬化性胆管炎;血色素沉着病;胆道系统疾患;可归因于感染的肝功能障碍。在另一方面,纤维化是选自以下的心和/或心包膜的纤维化病症(即,心或心包膜纤维化,或相关血管的纤维化):心内膜心肌纤维化;心脏同种移植物血管病(CAV);心肌梗塞;心房纤维化;充血性心力衰竭;动脉硬化;动脉粥样硬化;血管狭窄;心肌炎;充血性心肌病;冠状动脉梗塞;静脉曲张;冠状动脉狭窄和其他缺血后病症;和特发性腹膜后纤维化。在另一方面,纤维化为选自以下肾纤维化病症:肾小球性肾炎(包括膜增生性、弥漫性增生性、急进型或硬化性、感染后和慢性形式);糖尿病性肾小球硬化;局灶性节段性肾小球硬化;IgA肾病;糖尿病性肾病;缺血性肾病;小管间质性肾纤维化;HIV相关肾病;膜肾病;继发于全身性炎症性疾病(诸如狼疮、硬皮病和糖尿病性肾小球性肾炎)的肾小球性肾炎;特发性膜增生性肾小球性肾炎;系膜增生性肾小球性肾炎;新月体性肾小球肾炎;淀粉样变性(其影响肾及其他组织);自身免疫性肾炎;肾小管间质性纤维化;肾动脉硬化;Alport综合征;肾病综合征;慢性肾衰竭;慢性肾病;肾小球周围纤维化/无肾小管的肾小球;合并肺尖肺气肿和基底纤维化综合征(肺气肿/纤维化综合征);肾小球高血压;肾原性纤维化皮肤病;多囊性肾病;法布里病和肾性高血压。在另一方面,纤维化为选自以下的胰腺纤维化病症:基质重塑性胰腺炎和基质纤维化。在另一方面,纤维化为选自以下的胃肠道纤维化病症(即,GI道纤维化):克罗恩病;溃疡性结肠炎;胶原性结肠炎;结直肠纤维化;绒毛萎缩;隐窝增生;息肉形成;愈合性胃溃疡;和显微镜下结肠炎。在另一方面,纤维化为选自以下的眼纤维化病症:眼睛纤维化;眼部纤维化;增生性玻璃体视网膜病;任何病因的玻璃体视网膜病;与视网膜功能障碍有关的纤维化;与湿性或干性黄斑变性有关的纤维化;角膜和结膜中的瘢痕;角膜内皮中的纤维化;前囊下白内障和后囊膜混浊;眼前段纤维化疾病;角膜基质纤维化(例如,与角膜混浊有关);小梁网纤维化(例如,与青光眼有关);眼后段纤维化疾病;纤维血管瘢痕(例如,在眼的视网膜或脉络膜血管系统中);视网膜纤维化;视网膜前膜纤维化;视网膜胶质增生;视网膜下纤维化(例如,与年龄相关性黄斑变性有关);糖尿病性视网膜病中的牵引性视网膜脱离伴组织收缩;先天性眼眶纤维化;泪腺纤维化;角膜上皮下纤维化和格雷夫眼病。在另一方面,纤维化选自源自脊髓损伤/纤维化或中枢神经系统纤维化诸如卒中后的纤维化、杜氏肌肉营养不良、dupuytren痉挛、与神经退行性疾患诸如阿尔茨海默病或多发性硬化有关的纤维化;血管再狭窄;子宫纤维化;子宫内膜异位症;卵巢纤维瘤;佩罗尼氏病;多囊性卵巢综合征;强制性脊柱炎中的疾病相关肺尖纤维化;瘢痕;涉及皮肤、肺、心、肾和/或肠组织的多器官结缔组织功能障碍,例如,全身性硬化(SSc)、皮肤的SSc和由微生物感染(例如,细菌、病毒、寄生虫、真菌等)引起的纤维化。
在一个实施例中,本发明提供一种用于治疗TGFβ相关疾患的方法,其中该方法包括向患有此类TGFβ相关疾患的受试者施用有效量的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。在一个此类实施例中,该方法进一步包括向受试者施用有效量的至少一种另外的治疗剂,如下文所述。在另一实施例中,本发明提供一种用于治疗纤维化(例如,如上所述的纤维化病症)的方法,其中该方法包括向患有此类纤维化的受试者施用有效量的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。在一个此类实施例中,该方法进一步包括向受试者施用有效量的至少一种另外的治疗剂,如下文所述。在进一步的实施例中,本发明提供一种用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成的方法。在另一实施例中,该方法包括向受试者施用有效量的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)以抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制体新胶原蛋白合成。下面提供了使用本发明的同种型选择性抗TGFβ抗体的示例性实施例。
治疗特发性肺纤维化的方法
本发明提供治疗特发性肺纤维化(IPF)的方法。该方法通常包括向患有IPF的个体施用有效量的本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。在一些实施例中,可以通过对通过手术活检获得的肺组织进行组织病理学评估来逆转或减缓普通型间质性肺炎(UIP)的进展来监测治疗的剂量和疗效。IPF的诊断标准是已知的。Ryu等人(1998)Mayo Clin.Proc.73:1085-1101。在其他实施例中,IPF的诊断是通过高分辨率计算机断层扫描(HRCT)确定的或可能的IPF。在HRCT诊断中,注意到以下特征的存在:(1)存在以基底和外周为主的网状异常和/或牵拉性支气管扩张;(2)存在以基底和周边为主的蜂窝状;和(3)不存在非典型特征,诸如微结节、支气管血管周围结节、实变、孤立(非蜂窝状)囊肿、磨玻璃样衰减(或,如果存在,不如网状混浊广泛)和纵隔淋巴结肿大(或,如果存在,不够广泛,无法在胸部X光片上看到)。如果满足特征(1)、(2)和(3),则诊断为明确的IPF。如果满足特征(1)和(3),则诊断为可能的IPF。在某些优选的实施例中,治疗导致肺功能增加,诸如统计学上显著的增加。非功能值在本技术领域中是公知的。以下是可以使用的肺功能值的示例。其他肺功能值或其组合旨在落入本发明的范围内。这些值包括但不限于FEV(用力呼气量)、FVC(用力肺活量)、FEF(用力呼气流量)、Vmax(最大流量)、PEFR(呼气峰值流速)、FRC(功能残气量)、RV(残气量)、TLC(总肺活量)。FEV通过在完全吸气后立即用力呼气来测量在预定时间段内呼出的空气量。FVC测量完全吸气后立即呼出的空气总量。强制呼气流量测量FVC期间呼出的空气量除以时间(以秒为单位)。Vmax为FVC期间测得的最大流量。PEFR测量从完全吸气开始的强制呼气期间的最大流速。RV是完全呼气后留在肺部的空气量。
治疗肝纤维化的方法
本发明提供治疗肝纤维化的方法,包括减少临床肝纤维化、减少将会发生肝纤维化的可能性以及减少与肝纤维化相关的参数。在许多实施例中特别感兴趣的是对人的治疗。肝纤维化是与肝硬化相关的并发症的前兆,诸如门静脉高压症、进行性肝功能不全和肝细胞癌。因此,肝纤维化的减少会降低此类并发症的发生率。因此,本发明进一步提供通过联合疗法降低个体将会发展出与肝硬化相关的并发症的可能性的方法,该联合疗法包括施用有效量的本文所述同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。用有效量的本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)治疗是否有效减少肝纤维化是通过多种用于测量肝纤维化和肝功能的成熟技术中的任一种确定的。通过分析肝活检样品来确定肝纤维化是否减少。肝活检分析包括对两个主要组成部分的评估:通过“等级”评估的坏死性炎症作为严重程度和正在进行的疾病活动的量度,以及通过“阶段”评估的纤维化和实质或血管重塑的病变反映长期疾病进展。参见例如,Brunt(2000)Hepatol。31:241-246;和METAVIR(1994)Hepatology 20:15-20。基于肝活检的分析,分配一个评分。存在许多标准化评分系统,它们提供对纤维化程度和严重程度的定量评估。这些系统包括METAVIR、Knodell、Scheuer、Ludwig和Ishak评分系统。METAVIR评分系统基于对肝活检各种特征的分析,该特征包括纤维化(门静脉纤维化、小叶中心纤维化和肝硬化);坏死(碎片性和小叶性坏死、嗜酸性回缩和气球样变性);炎症(门静脉炎症、门静脉淋巴聚集和门静脉炎症的分布);胆管改变;和Knodell指数(门静脉周围坏死、小叶性坏死、门静脉炎症、纤维化和整体疾病活动的评分)。METAVIR系统中各个阶段的定义如下:评分:0,无纤维化;评分:1,门静脉星状扩大,但无间隔形成;评分:2,门静脉扩大,间隔形成少见;评分:3,大量隔,无肝硬化;以及评分:4,肝硬化。Knodell的评分系统,也称为肝炎活动指数,基于四类组织学特征的评分对标本进行分类:I.门静脉周围和/或桥接坏死;II.小叶内变性和局灶性坏死;III.门脉炎症;和IV.纤维化。在Knodell分期系统中,评分如下:评分:0,无纤维化;评分:1,轻度纤维化(纤维门静脉扩张);评分:2,中度纤维化;评分:3,重度纤维化(桥接纤维化);和评分:4,肝硬化。评分越高,肝组织损害越严重。Knodell(1981)Hepatol.1:431。在Scheuer评分系统中评分如下:评分:0,无纤维化;评分:1,扩大、纤维化的门静脉;评分:2,门静脉或门静脉隔,但结构完整;评分:3,纤维化伴架构扭曲,但无明显肝硬化;评分:4,可能或确定的肝硬化。Scheuer(1991)J.Hepatol.13:372。Ishak评分系统在Ishak(1995)J.Hepatol.22:696-699中描述。0期,无纤维化;1期,部分门管区纤维扩张,伴或不伴短纤维间隔;2期,大部分门管区纤维扩张,伴或不伴短纤维间隔;3期,大多数门管区纤维扩张,偶见门静脉到门静脉(P--P)桥接;4期,门管区纤维扩张,伴明显接(P--P)以及门静脉到中心静脉桥接(P--C);5期,明显桥接(P--和/或P--C),偶见结节(不完全性肝硬化);6期,肝硬化,可能的或确定的。还可以通过使用Child-Pugh评分系统来测量和评估抗纤维化疗法的益处,该评分系统包括基于血清胆红素水平、血清白蛋白水平、凝血酶原时间的异常、腹水的存在和严重程度以及脑病的存在和严重程度的多成分评分系统。基于这些参数异常的存在和严重程度,患者可能被置于临床疾病严重程度增加的三类之一:A、B或C。
治疗肾纤维化的方法
肾纤维化的特征为细胞外基质(ECM)成分的过度积累。TGFβ的过量产生被认为是由ECM过度沉积引起的组织纤维化的基础,从而导致疾病。TGFβ的纤维化作用源于同时刺激基质蛋白合成、抑制基质降解和促进ECM组装的整合素表达增强。本发明提供治疗肾纤维化的方法。该方法通常包括向患有肾纤维化的个体施用本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。如本文所用,本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)的“有效量”为有效减少肾纤维化的剂量;和/或有效降低个体将会发展出肾纤维化的可能性;和/或有效降低与肾纤维化相关的参数;和/或有效减少与肾脏纤维化相关的疾病。在一个实施例中,本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)的有效量是,与用同种型选择性抗TGFβ抗体治疗前个体的肾纤维化程度相比,足以将肾纤维化减少至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少20约35%、至少约40%、至少约45%、至少约50%的量。使用任何已知方法确定肾脏中的纤维化是否减少。例如,对肾活检样品进行组织化学分析以了解ECM沉积和/或纤维化的程度。其他方法在本技术领域中是已知的。参见例如,Masseroli等人(1998)Lab.Invest.78:511-522;美国专利No.6,214,542所示的氨基酸序列。在一些实施例中,本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)的有效量是,与用本发明的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)治疗前个体的肾功能基础水平相比,将肾功能有效增加至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%的量。在一些实施例中,同种型选择性抗TGFβ抗体的有效量是,与不存在用本发明的同种型选择性抗TGFβ抗体治疗下将会发生的肾功能下降相比,将肾功能下降延缓至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%的量。可以使用任何已知的测定法来测量肾功能,包括但不限于,血浆肌酐水平(其中正常水平通常在约0.6至约1.2mg/dL范围内);肌酐清除率(其中肌酐清除率的正常范围是男性约97至约137mL/min,女性约88至约128mL/min);肾小球滤过率(通过菊糖清除率或其他方法计算或获得)、血尿素氮(正常范围为约7至约20mg/dL);和尿蛋白水平。本发明还提供一种治疗个体的肾纤维化的方法,包括向个体施用对预防或治疗个体肾纤维化有效的量的同种型选择性抗TGFβ抗体,例如,在个体中增加到血清肌酐水平加倍的时间,增加到需要进行肾脏替代疗法(例如,透析或移植)的终末期肾病的时间,增加生存概率,减少死亡风险,减轻疾病负担或减缓疾病进展,同时减少在不进行这种治疗的情况下通常会出现的一种或多种副效应的发生率或降低其严重程度。
抗TGFβ2抗体
在上述提供用于治疗TGFβ相关疾患诸如但不限于纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化)的方法的一些方面,该方法包括向患有此类TGFβ相关疾患的受试者施用有效量的本发明的抗TGFβ2抗体,该抗体具有以下特性中的一项或多项:
该抗TGFβ2抗体:
(a)选择性地中和TGFβ2;
(b)具有相对于泛TGFβ抗体1D11的减少的毒性;
(c)具有相对于泛TGFβ抗体1D11的减少的毒性;
(d)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;
(e)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或
(f)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。
在另一个方面,本发明提供一种用于治疗纤维化病症例如上述纤维化病症的方法,该方法包括向患有此类纤维化的受试者施用有效量的同种型选择性抗TGFβ抗体,该抗体具有以下特性中的一项或多项:
该抗TGFβ2抗体选择性地中和TGFβ2;该抗TGFβ2以小于10pM的K
在一方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的选自以下的同种型选择性抗TGFβ抗体:
(i)抗TGFβ2抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQID NO:21的氨基酸序列;
(ii)抗TGFβ2抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列。在另一方面,本发明提供一种抗体,其包含(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;
(iii)抗TGFβ2抗体,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。在一个实施例中,该抗体包含(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列;
(iv)抗TGFβ2抗体包含:HVR-H3,其包含SEQ ID NO:18的氨基酸序列;和HVR-L3,其包含SEQ ID NO:21的氨基酸序列。在进一步的实施例中,抗TGFβ2抗体包含:HVR-H3,其包含SEQ ID NO:18的氨基酸序列;HVR-L3,其包含SEQ ID NO:21的氨基酸序列;和HVR-H2,其包含SEQ ID NO:17的氨基酸序列;
(v)抗TGFβ2抗体,其包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(ii)HVR-H2,其包含SEQ ID NO:17氨基酸序列;和(iii)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(i)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列;和
(vi)抗TGFβ2抗体包含:a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
在用于治疗纤维化的方法的任何上述实施例中,抗TGFβ2抗体可以是人源化的。在一个实施例中,该同种型选择性抗TGFβ抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在任何上述实施例中,人源化抗TGFβ2抗体包含在VH框架中的一个或多个突变,该突变选自由以下项所组成的组:37V或37I、48M或48L、49G或49A、67L、71K和78V、和105P或105R。在一些实施例中,抗TGFβ2抗体包含VH,其中VH包含SEQ ID NO:25的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架突变:(i)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(ii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(h6F12.v2和h6F12.v4);(iii)FR2中的37I(h6F12.v1.6);(iv)FR2中的48L(h6F12.v1.7);(v)FR2中的49A(h6F12.v1.8);(vi)FR4中的105R(h6F12.v1.9);(vii)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(viii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(6F12.v2和h6F12.v4);(ix)FR2中的37I(h6F12.v1.6);(x)FR2中的48L(h6F12.v1.7);(xi):FR2中的49A(h6F12.v1.8);和(xii)FR4中的105R(h6F12.v1.9)。在任何上述实施例中,人源化抗TGFβ2抗体在包含VL框架中的一个或多个突变,该突变选自由以下项所组成的组:43S或43A、66G、69T、71F和87Y。在一些实施例中,抗TGFβ2抗体包含VL,其中VL包含SEQ ID NO:24的氨基酸序列,其中VL包含选自由以下项所组成的组的一组框架突变:(i)FR2中的43S,和FR3中的66E、69P、71Y和87F(h6F12.v1和h6F12.v2);(ii)FR2中的43S,和FR3中的58V、66E、69P、71Y和87F(h6F12.v3和h6F12.v4);(iii)FR2中的43A(h6F12.v1.1);(iv)FR3中的66G(h6F12.v1.2);(v)FR3中的69T(h6F12.v1.3);(vi)FR3中的71F(h6F12.v1.4);和(vii)FR3中的87Y(h6F12.v1.5)。
在进一步的方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的选自以下的同种型选择性抗TGFβ抗体:
抗TGFβ2抗体,其包含与选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列;或该VH包含选自以下项的一个、两个或三个HVR:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;并且该抗体包含与选自由SEQ ID NO:24、131、133至137、143和144所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL),或该VL包含选自以下项的一个、两个或三个HVR:(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列;
抗TGFβ2抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:25/24(兔6F12)、SEQ ID NO:132/131(v1)、SEQ ID NO:132/133(v1.1)、SEQ ID NO:132/134(v1.2)、SEQ ID NO:132/135(v1.3)、SEQ ID NO:132/136(v1.4)、SEQ ID NO:132/137(v1.5)、SEQ ID NO:138/131(v1.6)、SEQ ID NO:139/131(v1.7)、SEQ ID NO:140/131(v1.8)、SEQ ID NO:141/131(v1.9)、SEQ ID NO:142/131(v2)、SEQ ID NO:132/143(v3)和SEQ ID NO:142/144(v4);或者
抗TGFβ2抗体,其包含与选自由SEQ ID NO:31、146和152至156所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:30、145、147至151、157和158所组成的组的氨基酸序列的完整L链氨基酸序列;
抗TGFβ2抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:31/30(兔6F12)、SEQ ID NO:146/145(v1)、SEQ ID NO:146/147(v1.1)、SEQ ID NO:146/148(v1.2)、SEQ ID NO:146/149(v1.3)、SEQ ID NO:146/150(v1.4)、SEQ ID NO:146/151(v1.5)、SEQ ID NO:152/145(v1.6)、SEQ ID NO:153/145(v1.7)、SEQ ID NO:154/145(v1.8)、SEQ ID NO:155/145(v1.9)、SEQ ID NO:156/145(v2)、SEQ ID NO:146/157(v3)和SEQ ID NO:156/158(v4);或者
与抗TGFβ2抗体结合相同表位的抗体,该抗体包含a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ IDNO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
抗TGFβ2/3抗体
在上述提供用于治疗TGFβ相关疾患诸如但不限于纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化)的方法的一些方面,该方法包括向患有此类TGFβ相关疾患(例如,纤维化)的受试者施用有效量的本发明的同种型选择性抗TGFβ2/3抗体,该抗体选择性地中和TGFβ2和TGFβ3并且具有以下特性中的一项或多项:
(a)关于选择性中和,通过抗体的抗原结合结构域与TGFβ2或TGFβ3的氨基酸残基E373(人TGFβ2编号)的直接接触,实现抗TGFβ2/3抗体相对于人TGFβ1对TGFβ2和TGFβ3的选择性;
(b)抗TGFβ2/3抗体经由变构机制而中和TGFβ2和/或TGFβ3;
(c)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化;
(d)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化,其中该构象变化包括两个单体夹在一起几度;
(e)抗TGFβ2/3抗体为二价抗体或单价抗体;
(f)所述抗TGFβ2/3抗体包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;
(g)抗TGFβ2/3抗体与TGFβ2同源二聚体结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,并且其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触(i)第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和(ii)第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(人TGFβ2编号);
(h)如(g)中的抗TGFβ2/3抗体,其中该抗原结合结构域位于TGFβ2和/或TGFβ3氨基酸残基的5埃内;
(i)其中抗TGFβ2/3抗体与TGFβ3中的与(g)中基本类似的表位结合;且
(j)抗TGFβ2/3抗体不中和单臂形式的TGFβ2和/或TGFβ3。
在进一步的方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的抗TGFβ2/3抗体,该抗体具有以下特性中的一项或多项:
选择性地中和TGFβ2和TGFβ3;以小于10pM的K
以小于约10pM、约9pM、约8pM、约7pM、约6pM、约5pM、约4pM、约3pM、约2pM或约1pM的K
对于抑制TGFβ2具有小于或等于约250pM、约200pM、约150pM、约100pM、约75pM或约50pM的基于细胞的IC
对于抑制TGFβ3具有小于或等于约250pM、约200pM、约150pM、约100pM、约75pM、约50pM、约40pM、约30pM或小于约30pM的基于细胞的IC
对于抑制TGFβ2具有约250pM的基于细胞的IC
在进一步的方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的选自以下的抗TGFβ2/3抗体:
抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸抗TGFβ2/3抗体序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ IDNO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:15的氨基酸序列;
抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸抗TGFβ2/3抗体序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列,和至少一个、至少两个或所有三个选自以下的VL HVR序列:(a)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:15的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:15的氨基酸序列。
在用于治疗纤维化的任何上述实施例中,抗TGFβ2/3抗体可以是人源化的。在一个实施例中,抗TGFβ2/3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在一些实施例中,抗TGFβ2/3抗体包含VH,其中VH包含SEQ ID NO:27的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2Q和24V,FR2中的48I和49G,FR3中的71K、73S、78V和91F,和FR4中的105P(h4A11.v1、h4A11.v2、h4A11.v5、h4A11.v6);(ii)FR1中的2Q,FR2中的37V,FR3中的67F、71K、73S、78V和91F,和FR4中的105P(h4A11.v3、h4A11.v4、4A11.v7、h4A11.v8);(iii)缺失FR1中的1E(h4A11.v7.1);(iv)缺失FR3中的75K和76N(h4A11.v7.2);(v)缺失FR1中的1E和FR3中的75K76N(h4A11.v7.3);(vi)FR1中的2V(h4A11.v7.8);(vi)FR2中的37I(h4A11.v7.9);(vii)FR3中的67V(h4A11.v7.10);(viii)FR3中的71V(h4A11.v7.11);(ix)FR3中的73T(h4A11.v7.12);(x)FR3中的78F(h4A11.v7.13);(xi)FR3中的91Y(h4A11.v7.14);(xii)FR4中的105Q(h4A11.v7.15);(xiii)FR1中的2V,FR2中的37I,FR3中的67V、73T、78F,FR4中的105Q((h4A11.v7.16);(xiv)FR1中的2V,FR2中的37I,FR3中的67V、73T、91Y,FR4中的105Q(h4A11.v7.17);(xv)FR1中的2V,FR2中的37I,FR3中的67V、73T,FR4中的105Q(h4A11.v7.18);和(xvi)FR1中的2V,FR2中的37I,FR3中的67V、73T、缺失75K和76N,FR4中的105Q(h4A11.v7.19)。在另一实施例中,抗TGFβ2/3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:2A或2I、4L、36F或36Y、43P或43A和58V或58I,相对于SEQ ID NO:26的VL氨基酸序列。在一些实施例中,抗TGFβ2/3抗体包含VL,其中VL包含SEQ ID NO:26的氨基酸序列,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2A和4L,和FR2中的36F(h4A11.v1和h4A11.v3);(ii)FR1中的2A和4L,和FR2中的36F和43P(h4A11.v2和h4A11.v4);(iii)FR1中的2A,FR2中的36F和43P,和FR3中的58V(h4A11.v5和h4A11.v7);(iv)FR1中的2A和4L,和FR2中的36F(h4A11.v6和h4A11.v8);(v)FR1中的2I(h4A11.v7.4);(vi)FR2中的36Y(h4A11.v7.5);(vii)FR2中的43A(h4A11.v7.6);(viii)FR3中的58I(h4A11.v7.7);和(ix)FR1中的2I,FR2中的43A,FR3中的58I(h4A11.v7.16-19)。
在进一步的方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的选自以下的抗TGFβ2/3抗体:
抗体,其包含与选自由SEQ ID NO:27、81、83、86至88、93至100和102至105所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:26、80、82、84、85、89至92和101所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗体,其包含(分别)选自由以下项所组成的组的VH和VL序列:SEQ ID NO:27/26(兔4A11)、SEQ ID NO:81/80(v1)、SEQ ID NO:81/82(v2)、SEQ ID NO:83/80(v3)、SEQ IDNO:83/82(v4)、SEQ ID NO:81/84(v5)、SEQ ID NO:81/85(v6)、SEQ ID NO:83/84(v7)、SEQID NO:86/84(v7/1)、SEQ ID NO:87/84(v7.2)、SEQ ID NO:88/84(v7.3)、SEQ ID NO:83/89(v7.4)、SEQ ID NO:83/90(v7.5)、SEQ ID NO:83/91(v7.6)、SEQ ID NO:83/92(v7.7)、SEQID NO:93/84(v7.8)、SEQ ID NO:94/84(v7.9)、SEQ ID NO:95/84(v7.10)、SEQ ID NO:96/84(v7.11)、SEQ ID NO:97/84(v7.12)、SEQ ID NO:98/84(v7.13)、SEQ ID NO:99/84(v7.14)、SEQ ID NO:100/84(v7.15)、SEQ ID NO:102/101(v7.16)、SEQ ID NO:103/101(v7.17)、SEQ ID NO:104/101(v7.18)、SEQ ID NO:105/101(v7.19)、SEQ ID NO:83/85(v8);
抗体,其包含与选自由SEQ ID NO:33、107、109、112至114和119至130所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ IDNO:32、106、108、110、111、115至118和186所组成的组的氨基酸序列的完整L链氨基酸序列;
抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:32/33(兔4A11)、SEQ ID NO:107/106(v1)、SEQ ID NO:107/108(v2)、SEQ ID NO:109/106(v3)、SEQ ID NO:109/108(v4)、SEQ ID NO:107/110(v5)、SEQ IDNO:107/111(v6)、SEQ ID NO:109/110(v7)、SEQ ID NO:112/110(v7.1)、SEQ ID NO:113/110(v7.2)、SEQ ID NO:114/110(v7.3)、SEQ ID NO:114/115(v7.4)、SEQ ID NO:114/116(v7.5)、SEQ ID NO:114/117(v7.6)、SEQ ID NO:114/118(v7.7)、SEQ ID NO:119/110(v7.8)、SEQ ID NO:120/110(v7.9)、SEQ ID NO:121/110(v7.10)、SEQ ID NO:122/110(v7.11)、SEQ ID NO:123/110(v7.12)、SEQ ID NO:124/110(v7.13)、SEQ ID NO:125/110(v7.14)、SEQ ID NO:126/110(v7.15)、SEQ ID NO:127/186(v7.16)、SEQ ID NO:128/186(v7.17)、SEQ ID NO:129/186(v7.18)、SEQ ID NO:130/186(v7.19)和SEQ ID NO:114/111(v8);
与抗TGFβ2/3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ IDNO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:15的氨基酸序列;
抗体,其与跨越TGFβ2同源二聚体的表位结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377,并且其中在一些实施例中,该抗TGFβ2/3抗体与TGFβ3中的相同表位结合。
抗TGFβ3抗体
在上述提供用于治疗TGFβ相关疾患诸如但不限于纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化)的方法的一些方面,该方法包括向患有此类TGFβ相关疾患的受试者施用有效量抗TGFβ3抗体,该抗体选择性地中和TGFβ3并且具有以下特性中的一项或多项:
(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区结合;
(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;
(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;
(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;
(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
在进一步的方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的同种型选择性抗TGFβ抗体,该抗体具有以下特性中的一项或多项:
抗体,其选择性地中和TGFβ3;
抗体,其以小于10pM的K
抗体,其以小于约5pM、约4pM、约3pM或小于约2pM的K
抗体,其具有小于约200pM、约150pM、约100pM、约75pM或约50pM的基于细胞的IC
本文提供的抗体,其对于TGFβ3抑制(中和)的基于细胞的IC
抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;
抗体,其选择性中和TGFβ3并具有改善的安全性。
在进一步的方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的选自以下的抗TGFβ3抗体:
抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含选自SEQ ID NO:5、34、35和159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含SEQID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;和
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。
在某些实施例中,如上提供的抗TGFβ3抗体的任何一个或多个氨基酸在以下HVR位置被取代:
-在HVR-H2(SEQ ID NO:5)中:在位置N54处(例如,N54S、N54Q)或T56处(例如,T56A)。
在某些实施例中,取代为如本文所提供的保守取代。
在用于治疗纤维化的方法任何上述实施例中,抗TGFβ3抗体可以是人源化的。在一个实施例中,抗TGFβ3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VH,该VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;以及76N、78D或78L,78A或78V,相对于具有SEQ ID NO:23的氨基酸序列的VH。在一些实施例中,抗TGFβ3抗体包含VH,其中VH包含SEQ ID NO:23的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);(iii)FR2中的47W(h2A10.v1.5);(iv):FR2中的49G(h2A10.v1.6);(v)FR3中的78A(h2A10.v1.7);(vi)FR2中的47W(h2A10.v2.5);(vii)FR2中的49S(h2A10.v2.6);(viii)FR3中的73N(h2A10.v2.7);(ix)FR3中的76N(h2A10.v2.8);(x)FR3中的78L(h2A10.v2.9);和(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:4L或4M、38H或38Q、43A或43Q和58V,相对于具有SEQ ID NO:22的氨基酸序列的VL。在另一实施例,该抗体包含SEQ ID NO:22的VL,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
在进一步的方面,本发明提供一种治疗纤维化的方法,该方法包括向患有此类纤维化的受试者施用有效量的选自以下的抗TGFβ3抗体:
抗体,其包含与选自由SEQ ID NO:23、37和42至50所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQID NO:50/v2.9)所组成的组。
抗体,其包含与选自由SEQ ID NO:23、37、42至50、55和57所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:22、36、38至41、54和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4);
抗体包含与选自由SEQ ID NO:29、59、64和65至72所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列的完整L链氨基酸序列;
抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ IDNO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9);
抗体,其包含与选自由SEQ ID NO:29、59、64、65至72、77和79所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列,和/或具有选自由SEQ ID NO:28、58、60至63、76和78所组成的组的氨基酸序列的完整L链氨基酸序列;
抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ IDNO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)、SEQ ID NO:77/76(v3)和SEQID NO:79/78;
抗体,其包含与SEQ ID NO:52的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:52/36的氨基酸序列(h2A10.v2.N54Q);
抗体,其包含与选自由SEQ ID NO:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链氨基酸序列和与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:74/58的氨基酸序列(h2A10.v2.N54Q);
抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36、38至41和54所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:51/36(h2A10.v2.N54S)或SEQ ID NO:55/54(h2A10.v3)的氨基酸序列;
抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链和/或该抗TGFβ3抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链,和/或抗TGFβ3抗体,其包含与选自由SEQ ID NO:28、58、60至63和76所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:73/58(h2A10.v2.N54S)或SEQ ID NO:77/76(h2A10.v3)的氨基酸序列;
抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH,和与选自由SEQ ID NO:22、36、38至41和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:53/36(h2A10.v2.T56A)或SEQ ID NO:57/56(h2A10.v4)的氨基酸序列;
抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58、60至63和78所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:75/58(h2A10.v2.T56A)或SEQ ID NO:79/78(h2A10.v4)的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ IDNO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ ID NO:52/36(h2A10.v2.N54Q)、SEQID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/v2.9)所组成的组。
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由以下项所组成的组:SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ IDNO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ IDNO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQ ID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4);
抗体,其与包含(分别)为SEQ ID NO:57/56的VH/VL序列的抗TGFβ3抗体(h2A10.v4)结合相同的表位;
抗体,其包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398,其中该抗TGFβ3抗体选择性地中和TGFβ3;
抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;
抗体,其在50mg/kg的剂量具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性。
在上述用于治疗TGFβ相关疾患的方法的一些方面,该方法包括向患有全身性硬化症(SSc)的受试者施用有效量的抗TGFβ3抗体,该抗体选择性地中和TGFβ3且具有以下特性中的一项或多项:
(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区结合;
(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;
(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;
(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;
(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
在进一步的方面,本发明提供一种治疗SSc的方法,该方法包括向患有SSc的受试者施用有效量的同种型选择性抗TGFβ抗体,该抗体具有以下特性中的一项或多项:
抗体,其选择性地中和TGFβ3;
抗体,其以小于10pM的K
抗体,其以小于约5pM、约4pM、约3pM或小于约2pM的K
抗体,其具有小于约200pM、约150pM、约100pM、约75pM或约50pM的基于细胞的IC
本文提供的抗体,其对于TGFβ3抑制(中和)的基于细胞的IC
抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;
抗体,其选择性中和TGFβ3并具有改善的安全性。
在进一步的方面,本发明提供一种治疗SSc的方法,该方法包括向患有SSc的受试者施用有效量的选自以下的抗TGFβ3抗体:
抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含选自SEQ ID NO:5、34、35和159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含SEQID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;和
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。
在某些实施例中,如上提供的抗TGFβ3抗体的任何一个或多个氨基酸在以下HVR位置被取代:
-在HVR-H2(SEQ ID NO:5)中:在位置N54处(例如,N54S、N54Q)或T56处(例如,T56A)。
在某些实施例中,取代为如本文所提供的保守取代。
在用于治疗SSc的方法任何上述实施例中,抗TGFβ3抗体可以是人源化的。在一个实施例中,抗TGFβ3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VH,该VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;以及76N、78D或78L,78A或78V。在一些实施例中,抗TGFβ3抗体包含VH,其中VH包含SEQ ID NO:23的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);(iii)FR2中的47W(h2A10.v1.5);(iv):FR2中的49G(h2A10.v1.6);(v)FR3中的78A(h2A10.v1.7);(vi)FR2中的47W(h2A10.v2.5);(vii)FR2中的49S(h2A10.v2.6);(viii)FR3中的73N(h2A10.v2.7);(ix)FR3中的76N(h2A10.v2.8);(x)FR3中的78L(h2A10.v2.9);和(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:4L或4M、38H或38Q、43A或43Q、和58V。在另一实施例中,该抗体包含SEQ ID NO:22的VL,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
在进一步的方面,本发明提供一种治疗SSc的方法,该方法包括向患有SSc的受试者施用有效量的选自以下的抗TGFβ3抗体:
抗体,其包含与选自由SEQ ID NO:23、37和42至50所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列,和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQID NO:50/36(v2.9);
抗体,其包含与选自由SEQ ID NO:23、37、42至50、55和57所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:22、36、38至41、54和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4);
抗体,其包含与选自由SEQ ID NO:29、59、64和65至72所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列,和/或具有选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列的完整L链氨基酸序列;
抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ IDNO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9);
抗体包含与选自由SEQ ID NO:29、59、64、65至72、77和79所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:28、58、60至63、76和78所组成的组的氨基酸序列的完整L链氨基酸序列;
抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ IDNO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)、SEQ ID NO:77/76(v3)和SEQID NO:79/78(v4);
抗体,其包含与SEQ ID NO:52的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:52/36(h2A10.v2.N54Q)的氨基酸序列;
抗体,其包含与SEQ ID NO:79的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链,和与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:74/58(h2A10.v2.N54Q)的氨基酸序列;
抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36、38至41和54所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:51/36(h2A10.v2.N54S)或SEQ ID NO:55/54(h2A10.v3)的氨基酸序列;
抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链,和/或抗TGFβ3抗体,其包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链,和/或抗TGFβ3抗体,其包含与选自由SEQ ID NO:28、58、60至63和76所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:73/58(h2A10.v2.N54S)或SEQ ID NO:77/76(h2A10.v3)的氨基酸序列;
抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH,和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH,和与选自由SEQ ID NO:22、36、38至41和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:53/36(h2A10.v2.T56A)或SEQ ID NO:57/56(h2A10.v4)的氨基酸序列;
抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58、60至63和78所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:75/58(h2A10.v2.T56A)或SEQ ID NO:79/78(h2A10.v4)的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ IDNO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由以下项所组成的组:SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ IDNO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ IDNO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9);
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由以下项所组成的组:SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ IDNO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ IDNO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQ ID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4);
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)为SEQ ID NO:57/56(h2A10.v4);
抗体,其包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398,其中该抗TGFβ3抗体选择性地中和TGFβ3;
抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;
抗体,其在50mg/kg的剂量具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性。
在上述用于治疗TGFβ相关疾患的方法的一些方面,该方法包括向患有特发性肺纤维化(IPF)的受试者施用有效量的抗TGFβ3抗体,该抗体选择性地中和TGFβ3且具有以下特性中的一项或多项:
(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区结合;
(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;
(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;
(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;
(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
在进一步的方面,本发明提供一种治疗IPF的方法,该方法包括向患有IPF的受试者施用有效量的同种型选择性抗TGFβ抗体,该抗体具有以下特性中的一项或多项:
抗体,其选择性地中和TGFβ3;
抗体,其以小于10pM的K
抗体,其以小于约5pM、约4pM、约3pM或小于约2pM的K
抗体,其具有小于约200pM、约150pM、约100pM、约75pM或约50pM的基于细胞的IC
本文提供的抗体,其对于TGFβ3抑制(中和)的基于细胞的IC
抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;
抗体,其选择性中和TGFβ3并具有改善的安全性。
在进一步的方面,本发明提供一种治疗IPF的方法,该方法包括向患有IPF的受试者施用有效量的选自以下的抗TGFβ3抗体:
抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含选自SEQ ID NO:5、34、35和159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含SEQID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;和
抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。
在某些实施例中,如上提供的抗TGFβ3抗体的任何一个或多个氨基酸在以下HVR位置被取代:
-在HVR-H2(SEQ ID NO:5)中:在位置N54处(例如,N54S、N54Q)或T56处(例如,T56A)。
在某些实施例中,取代为如本文所提供的保守取代。
在用于治疗IPF的方法任何上述实施例中,抗TGFβ3抗体可以是人源化的。在一个实施例中,抗TGFβ3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VH,该VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;以及76N、78D或78L,78A或78V。在一些实施例中,抗TGFβ3抗体包含VH,其中VH包含SEQ ID NO:23的VH,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);(iii)FR2中的47W(h2A10.v1.5);(iv):FR2中的49G(h2A10.v1.6);(v)FR3中的78A(h2A10.v1.7);(vi)FR2中的47W(h2A10.v2.5);(vii)FR2中的49S(h2A10.v2.6);(viii)FR3中的73N(h2A10.v2.7);(ix)FR3中的76N(h2A10.v2.8);(x)FR3中的78L(h2A10.v2.9);和(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:4L或4M、38H或38Q、43A或43Q、和58V。在另一实施例中,该抗体包含SEQ ID NO:22的VL,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
在进一步的方面,本发明提供一种治疗IPF的方法,该方法包括向患有IPF的受试者施用有效量的选自以下的抗TGFβ3抗体:
抗体,其包含与选自由SEQ ID NO:23、37和42至50所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列,和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQID NO:50/36(v2.9);
抗体,其包含与选自由SEQ ID NO:23、37、42至50、55和57所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:22、36、38至41、54和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4);
抗体,其包含与选自由SEQ ID NO:29、59、64和65至72所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列,和/或具有选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ IDNO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9);
抗体,其包含与选自由SEQ ID NO:29、59、64、65至72、77和79所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列,和/或具有选自由SEQ ID NO:28、58、60至63、76和78所组成的组的氨基酸序列的完整L链氨基酸序列;
抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ IDNO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)、SEQ ID NO:77/76(v3)和SEQID NO:79/78;
抗体,其包含与SEQ ID NO:52的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:52/36(h2A10.v2.N54Q)的氨基酸序列;
抗体,其包含与SEQ ID NO:79的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链,和与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:74/58(h2A10.v2.N54Q)的氨基酸序列;
抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36、38至41和54所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:51/36(h2A10.v2.N54S)或SEQ ID NO:55/54(h2A10.v3)的氨基酸序列;
抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链,和/或抗TGFβ3抗体,其包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链,和/或抗TGFβ3抗体,其包含与选自由SEQ ID NO:28、58、60至63和76所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:73/58(h2A10.v2.N54S)或SEQ ID NO:77/76(h2A10.v3)的氨基酸序列;
抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH,和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH,和与选自由SEQ ID NO:22、36、38至41和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:53/36(h2A10.v2.T56A)或SEQ ID NO:57/56(h2A10.v4)的氨基酸序列;
抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58、60至63和78所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:75/58(h2A10.v2.T56A)或SEQ ID NO:79/78(h2A10.v4)的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ IDNO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQID NO:6的氨基酸序列;
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由以下项所组成的组:SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ IDNO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ IDNO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9);
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由以下项所组成的组:SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ IDNO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ IDNO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQ ID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4);
抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)为SEQ ID NO:57/56(h2A10.v4);
抗体,其包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398,其中该抗TGFβ3抗体选择性地中和TGFβ3;
抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;
抗体,其在50mg/kg的剂量具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性。
根据治疗纤维化的方法的上述任一方面的同种型选择性抗TGFβ抗体可以是单克隆抗体,包括嵌合抗体、人源化抗体或人抗体。在一个实施例中,同种型选择性抗TGFβ抗体为抗体片段,例如,Fv、Fab、Fab'、scFv、双体抗体或F(ab')
在所提供的用于治疗TGFβ相关疾患的方法的一些方面,该方法包括向患有TGFβ相关疾患的受试者施用有效量的抗TGFβ3抗体,该抗体包含:重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列。在一些实施例中,CDR-H2具有SEQ ID NO:35的氨基酸序列。在某些实施例中,该分离的抗TGFβ3抗体进一步包含与SEQ ID NO:57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH。在一些实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:56的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL。在某些实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:79的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链。在其他实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:78的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链。在一些实施例中,该疾患为纤维化。在某些实施例中,该疾患为SSc。在一些实施例中,该疾患为IPF。在某些实施例中,抗TGFβ3抗体为单克隆抗体,诸如嵌合抗体、人源化抗体或人抗体。在一些实施例中,抗TGFβ3抗体为抗体片段,例如,Fv、Fab、Fab'、scFv、双体抗体或F(ab')
抗体的药物和用途
如本文所用,包含本发明的同种型选择性抗TGFβ抗体的药物、此类药物的制造以及本发明的药物和同种型选择性抗TGFβ抗体用于治疗TGFβ相关疾患的用途可以包括破坏TGFβ驱动的过程以停止TGFβ相关疾患的进展、减缓TGFβ相关疾患的进展或引起TGFβ相关疾患的消退(即,在受影响组织或器官中TGFβ相关疾患的程度方面改善受试者(患者)的健康状态)。在某些实施例中,当此类使用和治疗在TGFβ相关疾患发作之前时,即在已知或以其他方式预期的TGFβ相关疾患发作之前进行使用或治疗,则此类使用或治疗可包括预防TGFβ相关疾患的发展或发作。因此,各种活性剂的施用可以进行适当的持续时间以控制或停止TGFβ相关疾患的进展,或防止其发作。
如本文所用,包含本发明的同种型选择性抗TGFβ抗体的药物、此类药物的制造以及本发明的药物和同种型选择性抗TGFβ抗体用于治疗纤维化或纤维化病症的用途,包括破坏纤维化过程以停止纤维化病症的进展、减缓纤维化病症的进展或引起纤维化病症的消退(即,在受影响的组织或器官中纤维化程度方面改善受试者(患者)的健康状态)。在某些实施例中,其中此类使用和治疗在纤维化病症发作之前,即在已知或以其他方式预期的纤维化发作之前进行使用或治疗,则此类使用或治疗可包括预防纤维化病症的发展或发作。因此,各种活性剂的施用可以进行适当的持续时间以控制或停止纤维化病症的进展,或防止其发作。
因此,在一些方面,本发明提供包含本发明的同种型选择性抗TGFβ抗体的药物和/或此类药物或抗体用于治疗纤维化的用途,其中纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。在一方面,纤维化为选自以下的肺纤维化:特发性肺纤维化(IPF);特发性肺上叶纤维化(Amitani病);家族性肺纤维化;继发于全身性炎症性疾病的肺纤维化,诸如类风湿性关节炎、硬皮病、狼疮、隐原性纤维性肺泡炎、慢性阻塞性肺病(COPD)或慢性哮喘;囊性纤维化;非特异性间质性肺炎(NSIP);隐原性机化性肺炎(COP);进行性大块纤维化,煤矿工人尘肺的一种并发症;硬皮病/全身性硬化症(SSc,包括局限性皮肤(lcSSc)和弥漫性皮肤(dcSSc)形式和SSc相关间质性肺病(SSc-ILD));闭塞性细支气管炎合并机化性肺炎;结缔组织病相关ILD(CT-ILD)、进行性纤维化ILD、过敏性肺炎、肺动脉高压;肺结核;矽肺;石棉肺;急性肺损伤;和急性呼吸窘迫(ARD;包括细菌性肺炎引起的、创伤引起的和病毒性肺炎引起的、呼吸机引起的、非肺脓毒症引起的)。在另一方面,纤维化为选自以下的肝脏的纤维化病症:由于所有病因的肝硬化;先天性肝纤维化;肥胖;脂肪肝;酒精引起的肝纤维化;非酒精性脂肪性肝炎(NASH);胆管损伤;原发性胆汁性肝硬化(PBC);原发性硬化性胆管炎(PSC);感染或病毒引起的肝纤维化(例如,慢性乙型和丙型肝炎病毒感染);囊性纤维化;自身免疫性肝炎;坏死型肝炎;原发性硬化性胆管炎;血色素沉着病;胆道系统疾患;可归因于感染的肝功能障碍。在另一方面,纤维化是选自以下的心和/或心包膜的纤维化病症(即,心或心包膜纤维化,或相关血管的纤维化):心内膜心肌纤维化;心脏同种移植物血管病(CAV);心肌梗塞;心房纤维化;充血性心力衰竭;动脉硬化;动脉粥样硬化;血管狭窄;心肌炎;充血性心肌病;冠状动脉梗塞;静脉曲张;冠状动脉狭窄和其他缺血后病症;和特发性腹膜后纤维化。在另一方面,纤维化为选自以下肾纤维化病症:肾小球性肾炎(包括膜增生性、弥漫性增生性、急进型或硬化性、感染后和慢性形式);糖尿病性肾小球硬化;局灶性节段性肾小球硬化;IgA肾病;糖尿病性肾病;缺血性肾病;小管间质性肾纤维化;HIV相关肾病;膜肾病;继发于全身性炎症性疾病(诸如狼疮、硬皮病和糖尿病性肾小球性肾炎)的肾小球性肾炎;特发性膜增生性肾小球性肾炎;系膜增生性肾小球性肾炎;新月体性肾小球肾炎;淀粉样变性(其影响肾及其他组织);自身免疫性肾炎;肾小管间质性纤维化;肾动脉硬化;Alport综合征;肾病综合征;慢性肾衰竭;慢性肾病;肾小球周围纤维化/无肾小管的肾小球;合并肺尖肺气肿和基底纤维化综合征(肺气肿/纤维化综合征);肾小球高血压;肾原性纤维化皮肤病;多囊性肾病;法布里病和肾性高血压。在另一方面,纤维化为选自以下的胰腺纤维化病症:基质重塑性胰腺炎和基质纤维化。在另一方面,纤维化为选自以下的胃肠道纤维化病症(即,GI道纤维化):克罗恩病;溃疡性结肠炎;胶原性结肠炎;结直肠纤维化;绒毛萎缩;隐窝增生;息肉形成;愈合性胃溃疡;和显微镜下结肠炎。在另一方面,纤维化为选自以下的眼纤维化病症:眼睛纤维化;眼部纤维化;增生性玻璃体视网膜病;任何病因的玻璃体视网膜病;与视网膜功能障碍有关的纤维化;与湿性或干性黄斑变性有关的纤维化;角膜和结膜中的瘢痕;角膜内皮中的纤维化;前囊下白内障和后囊膜混浊;眼前段纤维化疾病;角膜基质纤维化(例如,与角膜混浊有关);小梁网纤维化(例如,与青光眼有关);眼后段纤维化疾病;纤维血管瘢痕(例如,在眼的视网膜或脉络膜血管系统中);视网膜纤维化;视网膜前膜纤维化;视网膜胶质增生;视网膜下纤维化(例如,与年龄相关性黄斑变性有关);糖尿病性视网膜病中的牵引性视网膜脱离伴组织收缩;先天性眼眶纤维化;泪腺纤维化;角膜上皮下纤维化和格雷夫眼病。在另一方面,纤维化选自源自脊髓损伤/纤维化或中枢神经系统纤维化诸如卒中后的纤维化、杜氏肌肉营养不良、dupuytren痉挛、与神经退行性疾患诸如阿尔茨海默病或多发性硬化有关的纤维化;血管再狭窄;子宫纤维化;子宫内膜异位症;卵巢纤维瘤;佩罗尼氏病;多囊性卵巢综合征;强制性脊柱炎中的疾病相关肺尖纤维化;瘢痕;和由微生物感染(例如,细菌、病毒、寄生虫、真菌等)引起的纤维化。
在一个实施例中,本发明提供一种包含本发明的同种型选择性抗TGFβ抗体的药物和/或此类药物或抗体用于治疗TGFβ相关疾患的用途,其中该用途包括向患有此类TGFβ相关疾患的受试者施用有效量的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。在一个此类实施例中,该用途进一步包括向受试者施用有效量的至少一种另外的治疗剂,如下文所述。
在一个实施例中,本发明提供一种包含本发明的同种型选择性抗TGFβ抗体的药物和/或此类药物或抗体用于治疗纤维化(例如,如上所述的纤维化病症)的用途,其中该用途包括向患有此类纤维化的受试者施用有效量的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。在一个此类实施例中,该用途进一步包括向受试者施用有效量的至少一种另外的治疗剂,如下文所述。
在进一步的方面,提供如所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),其用作药物。在进一步的方面,提供一种同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),其用于治疗TGFβ相关疾患(例如,纤维化,例如,肺(例如,IPF)、肝、胰、心、肾、眼和/或皮肤(例如,SSc)的纤维化)。在某些实施例中,提供一种同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),其用于治疗方法中。在某些实施例中,本发明提供一种同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),其用于治疗患有纤维化的受试者的方法中,该方法包括向个体施用有效量的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)。在一个此类实施例中,该用途进一步包括向个体施用有效量的至少一种另外的治疗剂,例如,如下文所述。在进一步的实施例中,本发明提供一种同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),其用于在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成。在某些实施例中,本发明提供一种同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),其用于在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成的方法中,该方法包括向受试者施用有效量的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),以在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新的胶原蛋白合成。根据任何上述实施例的受试者优选为人。
在进一步的方面,本发明提供同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)用于制造或制备药物的用途。在一个实施例中,该药物用于治疗TGFβ相关疾患,例如,纤维化,诸如但不限于纤维化,例如,肺(例如,IPF)、肝、胰腺、心、肾、眼和/或皮肤(例如,SSc)的纤维化。在进一步的实施例中,该药物用于治疗纤维化的方法中,该方法包括向患有纤维化的受试者施用有效量的该药物。在一个此类实施例中,该用途进一步包括向受试者施用有效量的至少一种另外的治疗剂,例如,如下文所述。在进一步的实施例中,该药物用于在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成的方法。在进一步的实施例中,该药物用于在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或抑制新胶原合成的方法中,该方法包括向个体施用有效量的该药物,以在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或抑制新胶原合成。
抗TGFβ2抗体
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺(例如,IPF)、肝、胰腺、心、肾、眼和/或皮肤(例如,SSc)的纤维化),本发明的抗TGFβ2抗体可以具有以下特性中的一项或多项:
该抗TGFβ2抗体:
(a)选择性地中和TGFβ2;
(b)具有相对于泛TGFβ抗体1D11的减少的毒性;
(c)具有相对于泛TGFβ抗体1D11的减少的毒性;
(d)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;
(e)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;且/或
(f)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;并且
其中在一些实施例中,该用途、药物或方法用于治疗纤维化并且其中该纤维化为SSc或IPF。
在进一步的方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的抗TGFβ2抗体可以具有以下特性中的一项或多项:
该抗TGFβ2抗体选择性地中和TGFβ2;该抗TGFβ2以小于10pM的K
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的抗TGFβ抗体可以具有以下特性中的一项或多项:
抗TGFβ2抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQ IDNO:21的氨基酸序列;
抗TGFβ2抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列。在另一方面,本发明提供一种抗体,其包含(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;
抗TGFβ2抗体,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。在一个实施例中,该抗体包含(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列;
抗TGFβ2抗体,其包含:HVR-H3,其包含SEQ ID NO:18的氨基酸序列;和HVR-L3,其包含SEQ ID NO:21的氨基酸序列。在进一步的实施例中,抗TGFβ2抗体包含:HVR-H3,其包含SEQ ID NO:18的氨基酸序列;HVR-L3,其包含SEQ ID NO:21的氨基酸序列;和HVR-H2,其包含SEQ ID NO:17的氨基酸序列;
抗TGFβ2抗体,其包含(a)VH结构域,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(i)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(ii)HVR-H2,其包含SEQID NO:17氨基酸序列;和(iii)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;和(b)VL结构域,其包含至少一个、至少两个或所有三个选自以下的VL HVR序列:(i)HVR-L1,其包含SEQID NO:19的氨基酸序列;(ii)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列;和
抗TGFβ2抗体,其包含:a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
在任何上述方面,同种型选择性抗TGFβ抗体可以是人源化的。在一个实施例中,该同种型选择性抗TGFβ抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在任何上述实施例中,人源化抗TGFβ2抗体包含在VH框架中的一个或多个突变,该突变选自由以下项所组成的组:37V或37I、48M或48L、49G或49A、67L、71K和78V、和105P或105R。在一些实施例中,抗TGFβ2抗体包含VH,其中VH包含SEQ IDNO:25的氨基酸序列,其中VH包含选自由以下项所组成的组的一组框架突变:(i)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(ii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(h6F12.v2和h6F12.v4);(iii)FR2中的37I(h6F12.v1.6);(iv)FR2中的48L(h6F12.v1.7);(v)FR2中的49A(h6F12.v1.8);(vi)FR4中的105R(h6F12.v1.9);(vii)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);(viii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(6F12.v2和h6F12.v4);(ix)FR2中的37I(h6F12.v1.6);(x)FR2中的48L(h6F12.v1.7);(xi):FR2中的49A(h6F12.v1.8);和(xii)FR4中的105R(h6F12.v1.9)。在任何上述实施例中,人源化抗TGFβ2抗体在包含VL框架中的一个或多个突变,该突变选自由以下项所组成的组:43S或43A、66G、69T、71F和87Y,相对于具有SEQ ID NO:24的氨基酸序列的VL。在一些实施例中,抗TGFβ2抗体包含VL,其中VL包含SEQ ID NO:24的氨基酸序列,其中VL包含选自由以下项所组成的组的一组框架突变:(i)FR2中的43S,和FR3中的66E、69P、71Y和87F(h6F12.v1和h6F12.v2);(ii)FR2中的43S,和FR3中的58V、66E、69P、71Y和87F(h6F12.v3和h6F12.v4);(iii)FR2中的43A(h6F12.v1.1);(iv)FR3中的66G(h6F12.v1.2);(v)FR3中的69T(h6F12.v1.3);(vi)FR3中的71F(h6F12.v1.4);和(vii)FR3中的87Y(h6F12.v1.5)。
在任何上述方面,关于如本文所述的同种选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的同种型选择性抗TGFβ抗体可以具有以下特性中的一项或多项:
抗TGFβ2抗体,其包含与选自由SEQ ID NO:25、132和138至142所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列,或VH,其包含选自以下项的一个、两个或三个HVR:(a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:18的氨基酸序列,和抗TGFβ2抗体,其包含与选自由SEQID NO:24、131、133至137、143和144所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(Vl),或VL,该VL包含一个、两个或三个选自以下项的HVR:(a)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:21的氨基酸序列;
抗TGFβ2抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:25/24(兔6F12)、SEQ ID NO:132/131(v1)、SEQ ID NO:132/133(v1.1)、SEQ ID NO:132/134(v1.2)、SEQ ID NO:132/135(v1.3)、SEQ ID NO:132/136(v1.4)、SEQ ID NO:132/137(v1.5)、SEQ ID NO:138/131(v1.6)、SEQ ID NO:139/131(v1.7)、SEQ ID NO:140/131(v1.8)、SEQ ID NO:141/131(v1.9)、SEQ ID NO:142/131(v2)、SEQ ID NO:132/143(v3)和SEQ ID NO:142/144(v4);或者
抗TGFβ2抗体,其包含与选自由SEQ ID NO:31、146和152至156所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列,和/或具有选自由SEQ ID NO:30、145、147至151、157和158所组成的组的氨基酸序列的完整L链氨基酸序列;
抗TGFβ2抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:31/30(兔6F12)、SEQ ID NO:146/145(v1)、SEQ ID NO:146/147(v1.1)、SEQ ID NO:146/148(v1.2)、SEQ ID NO:146/149(v1.3)、SEQ ID NO:146/150(v1.4)、SEQ ID NO:146/151(v1.5)、SEQ ID NO:152/145(v1.6)、SEQ ID NO:153/145(v1.7)、SEQ ID NO:154/145(v1.8)、SEQ ID NO:155/145(v1.9)、SEQ ID NO:156/145(v2)、SEQ ID NO:146/157(v3)和SEQ ID NO:156/158(v4);
与抗TGFβ2抗体结合相同表位的抗体,该抗体包含a)HVR-H1,其包含SEQ ID NO:16的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:17的氨基酸序列;(c)HVR-H3,其包含SEQ IDNO:18的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:19的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:20的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:21的氨基酸序列。
抗TGFβ2/3抗体
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),如本文所述的选择性地中和TGFβ2和TGFβ3的抗TGFβ2/3抗体可以具有以下特性中的一项或多项:
(a)关于选择性中和,通过抗体的抗原结合结构域与TGFβ2或TGFβ3的氨基酸残基E373(人TGFβ2编号)的直接接触,实现抗TGFβ2/3抗体相对于人TGFβ1对TGFβ2和TGFβ3的选择性;
(b)抗TGFβ2/3抗体经由变构机制而中和TGFβ2和/或TGFβ3;
(c)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化;
(d)抗TGFβ2/3抗体诱导TGFβ2同源二聚体中的构象变化,其中该构象变化包括两个单体夹在一起几度;
(e)抗TGFβ2/3抗体为二价抗体或单价抗体;
(f)抗TGFβ2/3抗体包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;
(g)抗TGFβ2/3抗体与TGFβ2同源二聚体结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,并且其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触(i)第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和(ii)第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(人TGFβ2编号);
(h)如(g)中的抗TGFβ2/3抗体,其中该抗原结合结构域位于TGFβ2和/或TGFβ3氨基酸残基的5埃内;
(i)其中抗TGFβ2/3抗体与TGFβ3中的与(g)中基本类似的表位结合;且
(j)抗TGFβ2/3抗体不中和单臂形式的TGFβ2和/或TGFβ3;并且
其中在一些实施例中,该用途、药物或方法用于治疗纤维化并且其中该纤维化为SSc或IPF。
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的抗TGFβ2/3抗体可以具有以下特性中的一项或多项:
选择性地中和TGFβ2和TGFβ3;以小于10pM的K
以小于约10pM、约9pM、约8pM、约7pM、约6pM、约5pM、约4pM、约3pM、约2pM或约1pM的K
对于抑制TGFβ2具有小于或等于约250pM、约200pM、约150pM、约100pM、约75pM或约50pM的基于细胞的IC
对于抑制TGFβ3具有小于或等于约250pM、约200pM、约150pM、约100pM、约75pM、约50pM、约40pM、约30pM或小于约30pM的基于细胞的IC
对于抑制TGFβ2具有约250pM的基于细胞的IC
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(及其制造或制备)和/或用于治疗方法中,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),该同种型选择性抗TGFβ抗体可以选自:
抗TGFβ2/3抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸抗TGFβ2/3抗体序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:15的氨基酸序列;
抗TGFβ2/3抗体,其包含至少一个、至少两个或所有三个选自以下的VH HVR序列:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸抗TGFβ2/3抗体序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列,和至少一个、至少两个或所有三个选自以下的VL HVR序列:(a)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(b)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(c)HVR-L3,其包含SEQ ID NO:15的氨基酸序列;
抗TGFβ2/3抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:15的氨基酸序列。
在任何上述用途中,抗TGFβ2/3抗体可以是人源化的。在一个实施例中,抗TGFβ2/3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在一些实施例中,抗TGFβ2/3抗体包含VH,其中VH包含SEQ ID NO:27的VH,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2Q和24V,FR2中的48I和49G,FR3中的71K、73S、78V和91F,和FR4中的105P(h4A11.v1、h4A11.v2、h4A11.v5、h4A11.v6);(ii)FR1中的2Q,FR2中的37V,FR3中的67F、71K、73S、78V和91F,和FR4中的105P(h4A11.v3、h4A11.v4、4A11.v7、h4A11.v8);(iii)缺失FR1中的1E(h4A11.v7.1);(iv)缺失FR3中的75K和76N(h4A11.v7.2);(v)缺失FR1中的1E和FR3中的75K76N(h4A11.v7.3);(vi)FR1中的2V(h4A11.v7.8);(vi)FR2中的37I(h4A11.v7.9);(vii)FR3中的67V(h4A11.v7.10);(viii)FR3中的71V(h4A11.v7.11);(ix)FR3中的73T(h4A11.v7.12);(x)FR3中的78F(h4A11.v7.13);(xi)FR3中的91Y(h4A11.v7.14);(xii)FR4中的105Q(h4A11.v7.15);(xiii)FR1中的2V,FR2中的37I,FR3中的67V、73T、78F,FR4中的105Q(h4A11.v7.16);(xiv)FR1中的2V,FR2中的37I,FR3中的67V、73T、91Y,FR4中的105Q(h4A11.v7.17);(xv)FR1中的2V,FR2中的37I,FR3中的67V、73T,FR4中的105Q(h4A11.v7.18);和(xvi)FR1中的2V,FR2中的37I,FR3中的67V、73T、缺失75K和76N,FR4中的105Q(h4A11.v7.19)。在另一实施例中,抗TGFβ2/3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:2A或2I、4L、36F或36Y、43P或43A和58V或58I,相对于具有SEQ ID NO:26的氨基酸序列的VL。在一些实施例中,抗TGFβ2/3抗体包含VL,其中VL包含SEQ ID NO:26的VL,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的2A和4L,和FR2中的36F(h4A11.v1和h4A11.v3);(ii)FR1中的2A和4L,和FR2中的36F和43P(h4A11.v2和h4A11.v4);(iii)FR1中的2A,FR2中的36F和43P,和FR3中的58V(h4A11.v5和h4A11.v7);(iv)FR1中的2A和4L,和FR2中的36F(h4A11.v6和h4A11.v8);(v)FR1中的2I(h4A11.v7.4);(vi)FR2中的36Y(h4A11.v7.5);(vii)FR2中的43A(h4A11.v7.6);(viii)FR3中的58I(h4A11.v7.7);和(ix)FR1中的2I,FR2中的43A,FR3中的58I(h4A11.v7.16-19)。
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的抗TGFβ2/3抗体可以具有以下特性中的一项或多项:
抗TGFβ2/3抗体,其包含与选自由SEQ ID NO:27、81、83、86至88、93至100和102至105所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:26、80、82、84、85、89至92和101所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗TGFβ2/3抗体,其包含(分别)选自由以下项所组成的组的VH和VL序列:SEQ IDNO:27/26(兔4A11)、SEQ ID NO:81/80(v1)、SEQ ID NO:81/82(v2)、SEQ ID NO:83/80(v3)、SEQ ID NO:83/82(v4)、SEQ ID NO:81/84(v5)、SEQ ID NO:81/85(v6)、SEQ ID NO:83/84(v7)、SEQ ID NO:86/84(v7/1)、SEQ ID NO:87/84(v7.2)、SEQ ID NO:88/84(v7.3)、SEQ IDNO:83/89(v7.4)、SEQ ID NO:83/90(v7.5)、SEQ ID NO:83/91(v7.6)、SEQ ID NO:83/92(v7.7)、SEQ ID NO:93/84(v7.8)、SEQ ID NO:94/84(v7.9)、SEQ ID NO:95/84(v7.10)、SEQID NO:96/84(v7.11)、SEQ ID NO:97/84(v7.12)、SEQ ID NO:98/84(v7.13)、SEQ ID NO:99/84(v7.14)、SEQ ID NO:100/84(v7.15)、SEQ ID NO:102/101(v7.16)、SEQ ID NO:103/101(v7.17)、SEQ ID NO:104/101(v7.18)、SEQ ID NO:105/101(v7.19)、SEQ ID NO:83/85(v8);
抗TGFβ2/3抗体,其包含与选自由SEQ ID NO:33、107、109、112至114和119至130所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:32、106、108、110、111、115至118和186所组成的组的氨基酸序列的完整L链氨基酸序列;
抗TGFβ2/3抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:32/33(兔4A11)、SEQ ID NO:107/106(v1)、SEQ ID NO:107/108(v2)、SEQ ID NO:109/106(v3)、SEQ ID NO:109/108(v4)、SEQ ID NO:107/110(v5)、SEQ ID NO:107/111(v6)、SEQ ID NO:109/110(v7)、SEQ ID NO:112/110(v7.1)、SEQID NO:113/110(v7.2)、SEQ ID NO:114/110(v7.3)、SEQ ID NO:114/115(v7.4)、SEQ IDNO:114/116(v7.5)、SEQ ID NO:114/117(v7.6)、SEQ ID NO:114/118(v7.7)、SEQ ID NO:119/110(v7.8)、SEQ ID NO:120/110(v7.9)、SEQ ID NO:121/110(v7.10)、SEQ ID NO:122/110(v7.11)、SEQ ID NO:123/110(v7.12)、SEQ ID NO:124/110(v7.13)、SEQ ID NO:125/110(v7.14)、SEQ ID NO:126/110(v7.15)、SEQ ID NO:127/186(v7.16)、SEQ ID NO:128/186(v7.17)、SEQ ID NO:129/186(v7.18)、SEQ ID NO:130/186(v7.19)和SEQ ID NO:114/111(v8);
与抗TGFβ2/3抗体结合相同表位的抗体,该抗体包含(a)HVR-H1,其包含SEQ IDNO:10的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:11的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:12的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:13的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:14的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:15的氨基酸序列;
抗TGFβ2/3抗体,其与TGFβ2同源二聚体的片段内的表位结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377,并且其中在一些实施例中,该抗TGFβ2/3抗体与TGFβ3中的相同区和/或表位结合。
抗TGFβ3抗体
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),如本文所述的选择性地中和TGFβ3的抗TGFβ3抗体可以具有以下特性中的一项或多项:
(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区结合;
(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)抗TGFβ3抗体结合人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;
(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;
(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;
(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内;并且
其中在一些实施例中,该用途、药物或方法用于治疗纤维化并且其中该纤维化为SSc或IPF。
在进一步的方面,关于如本文所述的同种选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的同种型选择性抗TGFβ抗体可以具有以下特性中的一项或多项:
抗TGFβ3抗体,其选择性地中和TGFβ3;
抗TGFβ3抗体,其以小于10pM的K
抗TGFβ3抗体,其以小于约5pM、约4pM、约3pM或小于约2pM的K
抗TGFβ3抗体,其具有小于约200pM、约150pM、约100pM、约75pM或约50pM的基于细胞的IC
本文提供的抗TGFβ3抗体,其对于TGFβ3抑制(中和)的基于细胞的IC
抗TGFβ3抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;和
抗TGFβ3抗体,其选择性中和TGFβ3并具有改善的安全性;并且
其中在一些实施例中,该用途、药物或方法用于治疗纤维化并且其中该纤维化为SSc或IPF。
在任何上述方面,关于如本文所述的同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的抗TGFβ3抗体可以具有以下特性中的一项或多项:
抗TGFβ3抗体,其包含至少一个、两个、三个、四个、五个或六个选自以下项的HVR:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列,(b)HVR-H2,其包含选自SEQ ID NO:5、34、35和159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含SEQ ID NO:9的氨基酸序列;
抗TGFβ3抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗TGFβ3抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗TGFβ3抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列;
抗TGFβ3抗体,其包含:(a)HVR-H1,其包含SEQ ID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;(d)HVR-L1,其包含SEQ ID NO:7的氨基酸序列;(e)HVR-L2,其包含SEQ ID NO:8的氨基酸序列;和(f)HVR-L3,其包含选自SEQ ID NO:9的氨基酸序列。
在某些实施例中,如上提供的抗TGFβ3抗体的任何一个或多个氨基酸在以下HVR位置被取代:
-在HVR-H2(SEQ ID NO:5)中:在位置N54处(例如,N54S、N54Q)或T56处(例如,T56A)。
在某些实施例中,取代为如本文所提供的保守取代。
在任何上述实施例中,抗TGFβ3抗体可以经人源化。在一个实施例中,抗TGFβ3抗体包含任何上述实施例中的HVR,并且进一步包含受体人类框架,例如人免疫球蛋白框架或人共有框架。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VH,该VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;以及76N、78D或78L,78A或78V。在一些实施例中,抗TGFβ3抗体包含VH,其中VH包含SEQ ID NO:23的VH,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);(iii)FR2中的47W(h2A10.v1.5);(iv):FR2中的49G(h2A10.v1.6);(v)FR3中的78A(h2A10.v1.7);(vi)FR2中的47W(h2A10.v2.5);(vii)FR2中的49S(h2A10.v2.6);(viii)FR3中的73N(h2A10.v2.7);(ix)FR3中的76N(h2A10.v2.8);(x)FR3中的78L(h2A10.v2.9);和(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。在另一实施例中,抗TGFβ3抗体包含如任何上述实施例中的HVR,并且进一步包含VL,该VL包含选自由以下项所组成的组的FR修饰:4L或4M、38H或38Q、43A或43Q和58V,相对于具有SEQ ID NO:22的氨基酸序列的VL。在另一实施例中,该抗体包含SEQ ID NO:22的VL,其中VL包含选自由以下项所组成的组的一组框架修饰:(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
在任何上述方面,关于如本文所述的同种选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)作为药物(以及其制造或制备或使用)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),本发明的同种型选择性抗TGFβ抗体可以具有以下特性中的一项或多项:
抗TGFβ3抗体,其包含与选自由SEQ ID NO:23、37和42至50所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗TGFβ3抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9);
抗TGFβ3抗体,其包含与选自由SEQ ID NO:23、37、42至50、55和57所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列和与选自由SEQ ID NO:22、36、38至41、54和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL);
抗TGFβ3抗体,其包含(分别)选自由以下项所组成的组的VH/VL序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQ ID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4);
抗TGFβ3抗体包含与选自由SEQ ID NO:29、59、64和65至72所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列的完整L链氨基酸序列;
抗TGFβ3抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9);
抗TGFβ3抗体,其包含与选自由SEQ ID NO:29、59、64、65至72、77和79所组成的组的氨基酸序列具有至少95%序列同一性的完整H链氨基酸序列和/或具有选自由SEQ IDNO:28、58、60至63、76和78所组成的组的氨基酸序列的完整L链氨基酸序列;
抗TGFβ3抗体,其包含完整H/L链对,该完整H/L链对(分别)包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)、SEQ ID NO:77/76(v3)和SEQ ID NO:79/78;
抗TGFβ3抗体,其包含与SEQ ID NO:52的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗TGFβ3抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:52/36的氨基酸序列(h2A10.v2.N54Q);
抗TGFβ3抗体,其包含与选自由SEQ ID NO:74的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链氨基酸序列和与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗TGFβ3抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:74/58的氨基酸序列(h2A10.v2.N54Q);
抗TGFβ3抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ IDNO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗TGFβ3抗体,其包含与SEQ ID NO:51或55的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH和与选自由SEQ IDNO:22、36、38至41和54所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗TGFβ3抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:51/36(h2A10.v2.N54S)或SEQ ID NO:55/54(h2A10.v3)的氨基酸序列;
抗TGFβ3抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链和/或该抗TGFβ3抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗TGFβ3抗体,其包含与SEQ ID NO:73或77的氨基酸序列具有至少95%序列同一性的完整H链,和/或抗TGFβ3抗体,其包含与选自由SEQ ID NO:28、58、60至63和76所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗TGFβ3抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:73/58(h2A10.v2.N54S)或SEQ ID NO:77/76(h2A10.v3)的氨基酸序列;
抗TGFβ3抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH,和与选自由SEQ IDNO:22、36和38至41所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗TGFβ3抗体,其包含与SEQ ID NO:53或57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH,和与选自由SEQ IDNO:22、36、38至41和56所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL氨基酸序列;
抗TGFβ3抗体,其包含VH/VL序列,该VH/VL序列(分别)包含SEQ ID NO:53/36(h2A10.v2.T56A)或SEQ ID NO:57/56(h2A10.v4);
抗TGFβ3抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗TGFβ3抗体,其包含与SEQ ID NO:74或79的氨基酸序列具有至少95%序列同一性的完整H链,和/或与选自由SEQ ID NO:28、58、60至63和78所组成的组的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链氨基酸序列;
抗TGFβ3抗体,其包含完整H/L链序列,该完整H/L链序列(分别)包含SEQ ID NO:75/58(h2A10.v2.T56A)或SEQ ID NO:79/78(h2A10.v4)的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗TGFβ3抗体,该抗体包含(a)HVR-H1,其包含SEQID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:5的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗TGFβ3抗体,该抗体包含(a)HVR-H1,其包含SEQID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:34的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗TGFβ3抗体,该抗体包含(a)HVR-H1,其包含SEQID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:35的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;
与抗TGFβ3抗体结合相同表位的抗TGFβ3抗体,该抗体包含(a)HVR-H1,其包含SEQID NO:4的氨基酸序列;(b)HVR-H2,其包含SEQ ID NO:159的氨基酸序列;和(c)HVR-H3,其包含SEQ ID NO:6的氨基酸序列;
抗TGFβ3抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由以下项所组成的:SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ IDNO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ IDNO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9);
抗TGFβ3抗体,其与包含VH/VL序列的抗TGFβ3抗体结合相同的表位,该VH/VL序列(分别)选自由SEQ ID NO:53/36(h2A10.v2.t56A)、SEQ ID NO:57/56(h2A10.v4)、SEQ IDNO:51/36(h2A10.v2.N54S)、SEQ ID NO:55/54(h2A10.v3)、SEQ ID NO:52/36(h2A10.v2.N54Q)、SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ IDNO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQ ID NO:50/36(v2.9)、SEQ ID NO:55/54(v3)和SEQID NO:57/56(v4);
抗TGFβ3抗体,其与包含(分别)为SEQ ID NO:57/56的VH/VL序列的抗TGFβ3抗体(h2A10.v4)结合相同的表位;
抗TGFβ3抗体,其包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398,其中该抗TGFβ3抗体选择性地中和TGFβ3;
抗TGFβ3抗体,其选择性中和TGFβ3且具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性;
抗TGFβ3抗体,其在50mg/kg的剂量具有相对于泛TGFβ抗体1D11的在小鼠中减少的毒性。
根据治疗任何上述用途(例如,作为用于治疗纤维化的药物)的同种型选择性抗TGFβ抗体可以是单克隆抗体,包括嵌合抗体、人源化抗体或人抗体。在一个实施例中,同种型选择性抗TGFβ抗体为抗体片段,例如,Fv、Fab、Fab'、scFv、双体抗体或F(ab')
在本文提供的任何方面,抗TGFβ3抗体作为药物的用途(及其制造或制备或用途)和/或用于治疗方法中,和/或用于在受试者中抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导,和/或用于抑制新的胶原合成,例如,用于治疗纤维化(例如,肺、肝、胰腺、心、肾、眼和/或皮肤的纤维化),抗TGFβ3抗体为如本文所述的选择性地中和TGFβ3的抗体,并且包含:重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列。在一些实施例中,CDR-H2具有SEQ ID NO:35的氨基酸序列。在某些实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:57的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VH。在一些实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:56的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的VL。在某些实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:79的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整H链。在其他实施例中,该抗TGFβ3抗体进一步包含与SEQ ID NO:78的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的完整L链。在一些实施例中,该疾患为纤维化。在某些实施例中,该疾患为SSc。在一些实施例中,该疾患为IPF。在某些实施例中,抗TGFβ3抗体为单克隆抗体,诸如嵌合抗体、人源化抗体或人抗体。在一些实施例中,抗TGFβ3抗体为抗体片段,例如,Fv、Fab、Fab'、scFv、双体抗体或F(ab')
药物制剂的用途
在进一步的方面,本发明提供包含本文提供的任何同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)的药物制剂,例如,用于任何上述治疗方法、用途和药物。在一个实施例中,药物制剂包含本文提供的任何同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)和药用载体。在另一个实施例中,药物制剂包含本文提供的任何同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体,例如具有图12至16和18至24或表5、6、7、12、13、14、19、20、23和24中任一者中所示VL和VH氨基酸序列的抗体)和至少一种另外的治疗剂,例如,如下所述。
组合疗法
本发明的抗体可以单独使用或与其他药剂组合用于疗法中。例如,本发明的抗体可与至少一种另外的治疗剂共同施用。在一些实施例中,该治疗剂选自由吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗、沙利姆单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂、JAK抑制剂、IL-11抑制剂和血清淀粉样蛋白P(PTX2)。参见,Raghu等人European Respiratory Journal 2012 40:2819)(FG-309,Ninou et al.(2018)FrontMed(Lausanne);5:180(自分泌运动因子抑制剂)。在一个优选的实施例中,将抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)与托珠单抗组合向有此需要的受试者施用。在一个优选的实施例中,有此需要的受试者为患有SSc的患者。在一些实施例中,抗TGFβ抗体为选择性地中和TGFβ3的抗TGFβ3抗体。根据本发明的可施用于受试者的托珠单抗(例如,与抗TGFβ3抗体(或抗TGFβ2或抗TGFβ2/3抗体)组合)的治疗剂量在美国专利号9,539,263中描述,并且包括例如每次给药约162mg的剂量,例如,每周或每两周施用,其中优选的施用途径为皮下。
在某些实施例中,将本发明的抗TGFβ抗体与用于治疗IPF的治疗剂组合向受试者施用。某些治疗剂先前已被描述为治疗IPF的候选物或药剂。这些已在已发表的文献中进行了描述,并在例如Rafli等人,J.Thorac.Dis(2013)5(1):48-73中进行了综述。此类药剂包括具有抗氧化剂、免疫抑制剂和/或抗炎活性的药剂,诸如N-乙酰半胱氨酸;具有抗纤维化、抗炎和/或抗氧化剂活性的药剂,诸如吡非尼酮,一种已被批准用于临床治疗IPF的口服施用的吡啶类药物;或针对αvβ6整合素的抗体(例如,STX-100);抑制结缔组织生长因子(CTGF)的药剂,诸如抗CTGF抗体(例如,FG-3019);抑制生长抑素受体的药剂,诸如生长抑素类似物(例如SOM230、奥曲肽);抑制IL-13、IL-4和CCL2的药剂,诸如抗IL13抗体(例如QAX576、曲罗芦单抗(tralokinumab)、来瑞组单抗(lebrikizumab))、抗IL4抗体、组合抗IL13/抗IL4剂(例如,双特异性抗IL13/抗IL4抗体,诸如SAR156597)、抗IL-6抑制剂(例如,托珠单抗、沙利姆单抗)、抗CCL2抗体(例如,CNTO888);具有抗血管生成、免疫调节和/或抗炎活性的药剂,诸如沙利度胺或米诺环素;抑制酶赖氨酰氧化酶样2(LOXL2)的药剂,诸如抗LOXL2抗体(例如,GS-6624[辛妥珠单抗(simtuzumab)]);抑制血管生成的药剂,诸如酪氨酸激酶抑制剂、BIBF 1120、四硫代钼酸盐;抑制细胞外基质沉积和/或破坏胶原沉积的药剂,诸如强力霉素;靶向肾素-血管紧张素系统的药剂,诸如氯沙坦;和其他具有抗增生和/或抗纤维化活性的药剂,诸如一氧化碳。
上述此类组合疗法涵盖组合施用(其中两种或更多种治疗剂包括在相同或单独的制剂中)和单独施用,在单独施用的情况下,本发明的抗体的施用可以在施用另外的治疗剂或药剂之前、同时和/或之后进行。在一个实施例中,同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)的施用和另外的治疗剂(例如,抗IL-6抑制剂(例如,托珠单抗(tozilumab)、沙利姆单抗))的施用在彼此相距约一个月内,或在约一周、两周或三周内,或在约一天、二天、三天、四天、五天或六天之内进行。
在具体实施例中,组合疗法包括向需要这种组合疗法的受试者(例如,被诊断为患有TGFβ相关疾患,例如纤维化,例如IPF、COPD、PF-ILD(例如,SSc)、肝纤维化(例如,肝硬化或慢性肝纤维化,或本文所述的其他纤维化病症或癌症的患者)施用治疗有效量的本发明的抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体)与选自由以下项所组成的组的药剂组合:N-乙酰半胱氨酸;具有抗纤维化、抗炎和/或抗氧化剂活性的药剂,诸如吡非尼酮,一种已被批准用于临床治疗IPF的口服施用的吡啶类药物;或针对αvβ6整合素的抗体(例如,STX-100);抑制结缔组织生长因子(CTGF)的药剂,诸如抗CTGF抗体(例如,FG-3019);抑制生长抑素受体的药剂,诸如生长抑素类似物(例如SOM230、奥曲肽);抑制IL-13、IL-4和CCL2的药剂,诸如抗IL13抗体(例如QAX576、曲罗芦单抗(tralokinumab)、来瑞组单抗(lebrikizumab))、抗IL4抗体、组合抗IL13/抗IL4剂(例如,双特异性抗IL13/抗IL4抗体,诸如SAR156597)、抗IL-6抑制剂(例如,托珠单抗、沙利姆单抗)、抗CCL2抗体(例如,CNTO888);具有抗血管生成、免疫调节和/或抗炎活性的药剂,诸如沙利度胺或米诺环素;抑制酶赖氨酰氧化酶样2(LOXL2)的药剂,诸如抗LOXL2抗体(例如,GS-6624[辛妥珠单抗(simtuzumab)]);抑制血管生成的药剂,诸如酪氨酸激酶抑制剂、BIBF 1120、四硫代钼酸盐;抑制细胞外基质沉积和/或破坏胶原沉积的药剂,诸如强力霉素;靶向肾素-血管紧张素系统的药剂,诸如氯沙坦;和其他具有抗增生和/或抗纤维化活性的药剂,诸如一氧化碳。
施用和制剂
本发明的抗体(和任何另外的治疗剂)可以通过任何合适的方式施用,包括肠胃外、肺内和鼻内,并且如果需要的话用于局部治疗、病灶内施用。肠胃外输注包括肌内、静脉内、动脉内、腹膜内或皮下施用。投配可以通过任何合适的途径进行,例如通过注射,诸如静脉内或皮下注射,部分取决于施用是短暂的还是长期的。在优选的实施例中,本文所述的抗TGFβ抗体的施用是皮下或静脉内的。本文考虑了各种给药时间安排,包括但不限于在各个时间点处的单次或多次施用、推注施用和脉冲输注。
本发明的抗体将以符合良好医学实践的方式配制、给药和施用。在这种情况下需要考虑的因素包括所治疗的特定疾患、所治疗的特定哺乳动物、个体患者的临床病症、疾患的原因、药剂的递送部位、施用的用途、施用的时间安排,以及执业医师已知的其他因素。抗体不是必须地而是任选地与一种或多种目前用于预防或治疗所讨论的疾患的制剂共同配制。此类其他药剂的有效量取决于所用制剂中存在的抗体的量、疾患或治疗的类型,以及上面讨论的其他因素。这些通常以与本文所述相同的剂量和施用途径使用,或以本文所述剂量的约1%至99%使用,或以任何剂量且通过经验/临床上确定为合适的任何途径使用。
为了预防或治疗疾病,本发明抗体的适当剂量(当单独使用或与一种或多种其他药物联合使用时)将取决于待治疗的疾病类型、抗体的类型、疾病的严重程度和病程、施用抗体用于预防还是治疗目的、先前的治疗、患者的病史和对抗体的应答以及主治医师的酌处权。抗体适当地一次或在一系列治疗中施用于患者。取决于疾病的类型和严重性,约1μg/kg至15mg/kg(例如0.1mg/kg至10mg/kg)的抗体可以是例如通过一次或多次单独施用或通过连续输液而施用于患者的初始候选剂量。取决于上述因素,一种典型的日剂量的范围可以为约1μg/kg至100mg/kg或更多。对于历时数天或更长时间的重复施用,取决于病症,治疗通常会持续直至发生期望的疾病症状抑制。抗体的一种示例性剂量的范围为约0.05mg/kg至约10mg/kg。因此,可以向患者施用约0.5mg/kg、2.0mg/kg、4.0mg/kg或10mg/kg(或它们的任何组合)的一种或多种剂量。此类剂量可以间歇施用,例如每周或每三周施用(例如,使得患者接受约两次至约二十次,或例如约六次剂量的抗体)。可以施用初始较高的负荷剂量,之后施用一次或多次较低剂量。然而,其他剂量方案可能有用。这种疗法的进展易于通过常规的技术和测定法来监测。
根据任何上述实施例的“受试者”或“个体”可以为人。应当理解,任何上述制剂或治疗方法可以使用本发明的免疫缀合物代替同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),或除了该抗体之外还包括本发明的免疫缀合物来进行。
H.制品
在本发明的另一个方面中,提供了一种制品,其含有可用于治疗、预防和/或诊断上述病症的物质。该制品包括容器和在该容器上或与该容器相关的标签或包装说明书。合适的容器包括例如瓶子、小瓶、注射器、IV溶液袋等。所述容器可以由诸如玻璃或塑料等多种材料形成。所述容器容纳组合物,该组合物本身或与另一种组合物组合能够有效地治疗、预防和/或诊断病症,并且所述容器可以具有无菌进入口(例如,所述容器可以是静脉内溶液袋或具有可由皮下注射针刺穿的塞子的小瓶)。组合物中的至少一种活性剂是本发明的抗体。标签或包装插页指示该组合物用于治疗所选择的病症。此外,所述制品可包括(a)第一容器,所述第一容器中含有其中包含本发明的抗体的组合物;以及(b)第二容器,所述第二容器中含有其中包含另外的细胞毒性剂或其他治疗剂组合物。本发明该实施例中的制品还可包含包装插页,该包装插页指示组合物可用于治疗特定病症。可替代地或另外地,所述制品还可包括第二(或第三)容器,所述第二(或第三)容器包括药用缓冲液,诸如抑菌性注射用水(BWFI)、磷酸盐缓冲盐水、林格氏溶液和葡萄糖溶液。所述制品可以还包括从商业和用户角度来看所需的其他物质,包括其他缓冲剂、稀释剂、过滤器、针头和注射器。
应当理解,任何上述制品可以包括本发明的免疫缀合物来代替同种型选择性抗TGFβ抗体(例如,抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体),或除了该抗体之外还包括本发明的免疫和最和未。
III.枚举实施例
实施例1.一种分离的抗肿瘤坏死因子β3(TGFβ3)抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:
(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;
(b)所述抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;
(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;
(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;
(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
实施例2.一种分离的抗TGFβ3抗体,其中该抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列。
实施例3.如实施例1或实施例2所述的抗TGFβ3抗体,其中该抗体包含具有SEQ IDNO:5的氨基酸序列的CDR-H2。
实施例4.如实施例1至3中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:23、37和42至50所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的重链可变区(VH)氨基酸序列。
实施例5.如实施例1至4中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQID NO:23、37和42至50所组成的组的VH氨基酸序列。
实施例6.如实施例1至5中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:29、59、64和65至72所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整重(H)链氨基酸序列。
实施例7.如实施例1至6中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQID NO:29、59、64和65至72所组成的组的完整H链氨基酸序列。
实施例8.如实施例1至7中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的轻链可变区(VL)氨基酸序列。
实施例9.如实施例1至8中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整轻(L)链氨基酸序列。
实施例10.如实施例1至9中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。
实施例11.如实施例1至10中任一项所述的抗TGFβ3抗体,其中该述抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ IDNO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)和SEQID NO:50/36(v2.9)。
实施例12.如实施例1至11中任一项所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)。
实施例13.如实施例1至10中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ IDNO:22的VL,该WL包含选自由以下项所组成的组的一个或多个框架修饰:4L或4M、38H或38Q、43A或43Q和58V。
实施例14.如实施例1至10中任一项所述的抗TGFβ3抗体,其中该VL包含选自由以下项所组成的组的一组框架修饰:
(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);
(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);
(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);
(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);
(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);
(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);
(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和
(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
实施例15.如实施例1至10、13和14中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:23的VH,该WH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;和76N、78D或78L、78A或78V。
实施例16.如实施例15所述的抗TGFβ3抗体,其中该VH包含选自由以下项所组成的组的一组框架修饰:
(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);
(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);
(iii)FR2中的47W(h2A10.v1.5);
(iv):FR2中的49G(h2A10.v1.6);
(v)FR3中的78A(h2A10.v1.7);
(vi)FR2中的47W(h2A10.v2.5);
(vii)FR2中的49S(h2A10.v2.6);
(viii)FR3中的73N(h2A10.v2.7);
(ix)FR3中的76N(h2A10.v2.8);
(x)FR3中的78L(h2A10.v2.9);和
(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。
实施例17.如实施例13或15所述的抗体,其包含VL,其中该VL保留框架I中位置4处的亮氨酸(L)和框架II中位置47处的亮氨酸(L)。
实施例18.如实施例15或17所述的抗体,其中该VH保留来自r2A10的VH的框架III中位置73处的D。
实施例19.如实施例1或2所述的抗TGFβ3抗体,其中该抗TGFβ3抗体包含具有SEQID NO:159的氨基酸序列的CDR-H2。
实施例20.如实施例19所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:52的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例21.如实施例19或20所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:52的VH氨基酸序列。
实施例22.如实施例19至21中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQID NO:74的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例23.如实施例19至22中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ IDNO:74的完整H链氨基酸序列。
实施例24.如实施例19至23中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例25.根据实施例19至实施例24中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。
实施例26.如实施例19至25中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
实施例27.根据实施例19至实施例26中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。
实施例28.如实施例19所述的抗TGFβ3抗体,其中该抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:52/36的氨基酸序列。
实施例29.如实施例19所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:74/58的氨基酸序列。
实施例30.如实施例1或2所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:34的氨基酸序列的CDR-H2。
实施例31.如实施例30所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:51或55的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例32.如实施例30或31所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:51或55的VH氨基酸序列。
实施例33.如实施例30至32中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQID NO:73或77的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例34.如实施例30至33中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ IDNO:73的氨基酸序列。
实施例35.如实施例30至33中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ IDNO:77的完整H链氨基酸序列。
实施例36.如实施例30至35中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例37.根据实施例30至实施例36中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。
实施例38.如实施例30至37中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
实施例39.如实施例30至38中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。
实施例40.如实施例30所述的抗TGFβ3抗体,其中该抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:51/36或SEQ ID NO:55/54的氨基酸序列。
实施例41.如实施例30所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该完整H/L链对(分别)包含SEQ ID NO:73/58或SEQ ID NO:77/76的氨基酸序列。
实施例42.如实施例1或2所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:35的氨基酸序列的CDR-H2。
实施例43.如实施例42所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:53或57的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例44.如实施例42或43所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:53的VH氨基酸序列。
实施例45.如实施例42或43所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:57的VH氨基酸序列。
实施例46.如实施例42至45所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:75或79的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例47.如实施例42至46中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ IDNO:75的完整H链氨基酸序列。
实施例48.如实施例42至46中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ IDNO:79的完整H链氨基酸序列。
实施例49.根据实施例42至实施例48中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例50.如实施例42至49中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。
实施例51.如实施例42至50中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
实施例52.根据实施例42至实施例51中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。
实施例53.如实施例42所述的抗TGFβ3抗体,其中该抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:53/36或SEQ ID NO:57/56的氨基酸序列。
实施例54.如实施例42所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:75/58或SEQ ID NO:79/78的氨基酸序列。
实施例55.一种抗TGFβ3抗体,其包含:
(a)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或
(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。
实施例56.一种分离的抗TGFβ2/3抗体,其中该抗体选择性地中和TGFβ2和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:
(a)关于选择性中和,通过该抗体的抗原结合结构域与氨基酸残基E373TGFβ2或TGFβ3(人TGFβ2编号)的直接接触,实现抗TGFβ2/3抗体相对于人TGFβ1对TGFβ2和TGFβ3的选择性;
(b)抗TGFβ2/3抗体经由变构机制而中和TGFβ2和/或TGFβ3;
(c)抗TGFβ2/3抗体诱导TGFβ2和/或TGFβ3同源二聚体中的构象变化;
(d)抗TGFβ2/3抗体诱导TGFβ2和/或TGFβ3同源二聚体中的构象变化,其中该构象变化包括两个单体夹在一起几度;
(e)抗TGFβ2/3抗体为二价抗体或单价抗体;
(f)抗TGFβ2/3抗体包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;
(g)抗TGFβ2/3抗体与TGFβ2同源二聚体特异性地结合,该TGFβ2同源二聚体具有第一和第二TGFβ2单体,并且其中抗TGFβ2/3抗体包含抗原结合结构域,该抗原结合结构域直接接触(i)第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和(ii)第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(人TGFβ2编号);
(h)如(g)中的抗TGFβ2/3抗体,其中该抗原结合结构域位于TGFβ2和/或TGFβ3氨基酸残基的5埃内;
(i)其中抗TGFβ2/3抗体与如(g)中的TGFβ3上的相同表位特异性地结合;和
(j)抗TGFβ2/3抗体不中和单价形式的TGFβ2和/或TGFβ3。
实施例57.如实施例56所述的抗TGFβ2/3抗体,其中该抗体包含与选自由SEQ IDNO:27、81、83、86至88、93至100和102至105所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例58.如实施例56至57所述的抗TGFβ2/3抗体,其中该抗体包含选自由SEQ IDNO:27、81、83、86至88、93至100和102至105所组成的组的VH氨基酸序列。
实施例59.如实施例56至58中任一项所述的抗TGFβ2/3抗体,其中该抗体包含与选自由SEQ ID NO:33、107、109、112至114和119至130所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例60.如实施例56至59中任一项所述的抗TGFβ2/3抗体,其中该抗体包含与选自由SEQ ID NO:26、80、82、84、85、89至92和101所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例61.如实施例56至60中任一项所述的抗TGFβ2/3抗体,其中该抗体包含选自由SEQ ID NO:26、80、82、84、85、89至92和101所组成的组的VL氨基酸序列。
实施例62.如实施例56至61中任一项所述的抗TGFβ2/3抗体,其中该抗体包含与选自由SEQ ID NO:32、106、108、110、111、115至118和186所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
实施例63.如实施例56至62中任一项所述的抗TGFβ2/3抗体,其中该抗体包含选自由SEQ ID NO:32、106、108、110、111、115至118和186所组成的组的完整L链氨基酸序列。
实施例64.如实施例56所述的抗TGFβ2/3抗体,其中该抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:27/26(兔4A11)、SEQ IDNO:81/80(v1)、SEQ ID NO:81/82(v2)、SEQ ID NO:83/80(v3)、SEQ ID NO:83/82(v4)、SEQID NO:81/84(v5)、SEQ ID NO:81/85(v6)、SEQ ID NO:83/84(v7)、SEQ ID NO:86/84(v7.1)、SEQ ID NO:87/84(v7.2)、SEQ ID NO:88/84(v7.3)、SEQ ID NO:83/89(v7.4)、SEQID NO:83/90(v7.5)、SEQ ID NO:83/91(v7.6)、SEQ ID NO:83/92(v7.7)、SEQ ID NO:93/84(v7.8)、SEQ ID NO:94/84(v7.9)、SEQ ID NO:95/84(v7.10)、SEQ ID NO:96/84(v7.11)、SEQ ID NO:97/84(v7.12)、SEQ ID NO:98/84(v7.13)、SEQ ID NO:99/84(v7.14)、SEQ IDNO:100/84(v7.15)、SEQ ID NO:102/101(v7.16)、SEQ ID NO:103/101(v7.17)、SEQ ID NO:104/101(v7.18)、SEQ ID NO:105/101(v7.19)和SEQ ID NO:83/85(v8)。
实施例65.如实施例56中所述的抗TGFβ2/3抗体,其中该抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:32/33(兔4A11)、SEQ ID NO:107/106(v1)、SEQ ID NO:107/108(v2)、SEQ ID NO:109/106(v3)、SEQID NO:109/108(v4)、SEQ ID NO:107/110(v5)、SEQ ID NO:107/111(v6)、SEQ ID NO:109/110(v7)、SEQ ID NO:112/110(v7.1)、SEQ ID NO:113/110(v7.2)、SEQ ID NO:114/110(v7.3)、SEQ ID NO:114/115(v7.4)、SEQ ID NO:114/116(v7.5)、SEQ ID NO:114/117(v7.6)、SEQ ID NO:114/118(v7.7)、SEQ ID NO:119/110(v7.8)、SEQ ID NO:120/110(v7.9)、SEQ ID NO:121/110(v7.10)、SEQ ID NO:122/110(v7.11)、SEQ ID NO:123/110(v7.12)、SEQ ID NO:124/110(v7.13)、SEQ ID NO:125/110(v7.14)、SEQ ID NO:126/110(v7.15)、SEQ ID NO:127/186(v7.16)、SEQ ID NO:128/186(v7.17)、SEQ ID NO:129/186(v7.18)、SEQ ID NO:130/186(v7.19)和SEQ ID NO:114/111(v8)。
实施例66.如实施例56所述的抗TGFβ2/3抗体,其中该抗体包含VL,该VL包含SEQID NO:26的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:2A或2I、4L、36F或36Y、43P或43A、和58V或58I。
实施例67.如实施例56所述的抗TGFβ2/3抗体,其中该VL包含选自由以下项所组成的组的一组框架修饰:
(i)FR1中的2A和4L,和FR2中的36F(h4A11.v1和h4A11.v3);
(ii)FR1中的2A和4L,和FR2中的36F和43P(h4A11.v2和h4A11.v4);
(iii)FR1中的2A,FR2中的36F和43P,和FR3中的58V(h4A11.v5和h4A11.v7);
(iv)FR1中的2A和4L,和FR2中的36F(h4A11.v6和h4A11.v8);
(v)FR1中的2I(h4A11.v7.4);
(vi)FR2中的36Y(h4A11.v7.5);
(vii)FR2中的43A(h4A11.v7.6);
(viii)FR3中的58I(h4A11.v7.7);和
(ix)FR1中的2I,FR2中的43A,FR3中的58I(h4A11.v7.16-19)。
实施例68.根据实施例56所述的抗TGFβ2/3抗体,其中该抗体包含VH,该VH包含SEQID NO:27的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:缺失1E、2Q或2V、24V、37V或37I、48I、49G、67F或67V、71K或71V、73S或73T,缺失75K和76N、78V或78F、91F或91Y、105P或105Q。
实施例69.如实施例56或68所述的抗TGFβ2/3抗体,其中该VL包含选自由以下项所组成的组的一组框架修饰:
(i)FR1中的2Q和24V,FR2中的48I和49G,FR3中的71K、73S、78V和91F,和FR4中的105P(h4A11.v1、h4A11.v2、h4A11.v5、h4A11.v6);
(ii)FR1中的2Q,FR2中的37V,FR3中的67F、71K、73S、78V和91F,和FR4中的105P(h4A11.v3、h4A11.v4、h4A11.v7、h4A11.v8);
(iii)缺失FR1中的1E(h4A11.v7.1);
(iv)缺失FR3中的75K和76N(h4A11.v7.2);
(v)缺失FR1中的1E和FR3中的75K76N(h4A11.v7.3);
(vi)FR1中的2V(h4A11.v7.8);
(vi)FR2中的37I(h4A11.v7.9);
(vii)FR3中的67V(h4A11.v7.10);
(viii)FR3中的71V(h4A11.v7.11);
(ix)FR3中的73T(h4A11.v7.12);
(x)FR3中的78F(h4A11.v7.13);
(xi)FR3中的91Y(h4A11.v7.14);
(xii)FR4中的105Q(h4A11.v7.15);
(xiii)FR1中的2V,FR2中的37I,FR3中的67V、73T、78F,FR4中的105Q((h4A11.v7.16);
(xiv)FR1中的2V,FR2中的37I,FR3中的67V、73T、91Y,FR4中的105Q(h4A11.v7.17);
(xv)FR1中的2V,FR2中的37I,FR3中的67V、73T,FR4中的105Q(h4A11.v7.18);和
(xvi)FR1中的2V,FR2中的37I,FR3中的67V、73T、缺失75K和76N,FR4中的105Q(h4A11.v7.19)。
实施例70.一种分离的抗TGFβ2抗体,其中该抗体包含:
(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和
(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。
实施例71.如实施例70所述的抗TGFβ2抗体,其中该抗体选择性地中和TGFβ2。
实施例72.如实施例71所述的抗TGFβ2抗体,其中该抗体:
(a)具有相对于泛TGFβ抗体1D11的减少的毒性;
(b)具有相对于泛TGFβ抗体1D11的在啮齿动物中减少的毒性;
(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;和/或
(d)具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。
实施例73.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含与选自由SEQ IDNO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例74.如实施例73所述的抗TGFβ2抗体,其中该抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的VH氨基酸序列。
实施例75.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含与选自由SEQ IDNO:31、146和152至156所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例76.如实施例75所述的抗TGFβ2抗体,其中该抗体包含选自由SEQ ID NO:31、146和152至156所组成的组的完整H链氨基酸序列。
实施例77.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含与选自由SEQ IDNO:24、131、133至137、143和144所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例78.根据实施例77所述的抗TGFβ2抗体,其中该抗体包含选自由SEQ ID NO:24、131、133至137、143和144所组成的组的VL氨基酸序列。
实施例79.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含与选自由SEQ IDNO:30、145、147至151、157和158所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
实施例80.如实施例79所述的抗TGFβ2抗体,其中该抗体包含选自由SEQ ID NO:30、145、147至151、157和158所组成的组的完整L链氨基酸序列。
实施例81.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含VH/VL对,该VH/VL对包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:25/24(兔6F12)、SEQ ID NO:132/131(v1)、SEQ ID NO:132/133(v1.1)、SEQ ID NO:132/134(v1.2)、SEQ ID NO:132/135(v1.3)、SEQ ID NO:132/136(v1.4)、SEQ ID NO:132/137(v1.5)、SEQ ID NO:138/131(v1.6)、SEQ ID NO:139/131(v1.7)、SEQ ID NO:140/131(v1.8)、SEQ ID NO:141/131(v1.9)、SEQ ID NO:142/131(v2)、SEQ ID NO:132/143(v3)和SEQ ID NO:142/144(v4)。
实施例82.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含完整H/L链对,该完整H/L链对包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:31/30(兔6F12)、SEQID NO:146/145(v1)、SEQ ID NO:146/147(v1.1)、SEQ ID NO:146/148(v1.2)、SEQ ID NO:146/149(v1.3)、SEQ ID NO:146/150(v1.4)、SEQ ID NO:146/151(v1.5)、SEQ ID NO:152/145(v1.6)、SEQ ID NO:153/145(v1.7)、SEQ ID NO:154/145(v1.8)、SEQ ID NO:155/145(v1.9)、SEQ ID NO:156/145(v2)、SEQ ID NO:146/157(v3)和SEQ ID NO:156/158(v4)。
实施例83.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含VL,该WL包含SEQID NO:24的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:43S或43A、66G、69T、71F和87Y。
实施例84.如实施例83所述的抗TGFβ2抗体,其中该VL包含选自由以下项所组成的组的一组框架突变:
(i)FR2中的43S,和FR3中的66E、69P、71Y和87F(h6F12.v1和h6F12.v2);
(ii)FR2中的43S,和FR3中的58V、66E、69P、71Y和87F(h6F12.v3和h6F12.v4);
(iii)FR2中的43A(h6F12.v1.1);
(iv)FR3中的66G(h6F12.v1.2);
(v)FR3中的69T(h6F12.v1.3);
(vi)FR3中的71F(h6F12.v1.4);和
(vii)FR3中的87Y(h6F12.v1.5)。
实施例85.如实施例70或71所述的抗TGFβ2抗体,其中该抗体包含VH,该WH包含SEQID NO:25的氨基酸序列,该氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:37V或37I、48M或48L、49G或49A、67L、71K和78V、和105P或105R。
实施例86.如实施例85所述的抗TGFβ2抗体,其中该VH包含选自由以下项所组成的组的一组框架突变:
(i)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);
(ii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(h6F12.v2和h6F12.v4);
(iii)FR2中的37I(h6F12.v1.6);
(iv)FR2中的48L(h6F12.v1.7);
(v)FR2中的49A(h6F12.v1.8);
(vi)FR4中的105R(h6F12.v1.9);
(vii)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);
(viii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(6F12.v2和h6F12.v4);
(ix)FR2中的37I(h6F12.v1.6);
(x)FR2中的48L(h6F12.v1.7);
(xi):FR2中的49A(h6F12.v1.8);和
(xii)FR4中的105R(h6F12.v1.9)。
实施例87.如实施例1至55中任一项所述的抗TGFβ3抗体,或如实施例56至68中任一项所述的抗TGFβ2/3抗体,其中该抗体与人TGFβ3特异性地结合。
实施例88.如实施例1至55中任一项所述的抗TGFβ3抗体,其中该抗体与不成熟和成熟形式的TGFβ3两者特异性地结合。
实施例89.如实施例56至68中任一项所述的抗TGFβ2/3抗体,或如实施例70至83中任一项所述的抗TGFβ2抗体,其中该抗体与人TGFβ2特异性地结合。
实施例I-1.一种分离的抗肿瘤坏死因子β3(TGFβ3)抗体,其中该抗体选择性地中和TGFβ3,并且其中该抗体包括以下特征中的一项或多项:
(n)抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(a)抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;
(b)抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与抗TGFβ3抗体在重链CDR2中形成离子盐桥;
(f)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现抗TGFβ3相对于TGFβ2对TGFβ3的同种型选择性;
(h)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;
(o)抗TGFβ3抗体包含抗原结合结构域,该抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中该抗原结合结构域位于TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
实施例I-2.一种分离的抗TGFβ3抗体,其中该抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列。
实施例I-3.如实施例I-1或实施例I-2所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:23、37、42至53、55和57所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的重链可变区(VH)氨基酸序列。
实施例I-4.如实施例I-1至实施例I-3中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:23、37、42至53、55和57所组成的组的VH氨基酸序列。
实施例I-5.如实施例I-1至实施例I-4中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:29、59、64、65至75、77和79所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整重(H)链氨基酸序列。
实施例I-6.如实施例I-1至实施例I-5中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:29、59、64、65至75、77和79所组成的组的完整重(H)链氨基酸序列。
实施例I-7.如实施例I-1至实施例I-6中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36、38至41、54和56所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的轻链可变区(VL)氨基酸序列。
实施例I-8.如实施例I-1至实施例I-7中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:22、36、38至41、54和56所组成的组的VL氨基酸序列。
实施例I-9.如实施例I-1至实施例I-8中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:28、58、60至63、76和78所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整轻(L)链氨基酸序列。
实施例I-10.如实施例I-1至实施例I-9中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:28、58和60至63、76和78所组成的组的完整L链氨基酸序列。
实施例I-11.如实施例I-1至实施例I-10中任一项所述的抗TGFβ3抗体,其中该述抗体包含VH/VL对,该VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ IDNO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQ ID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ ID NO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ ID NO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQ ID NO:50/36(v2.9)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:52/36(h2A10.v2.N54Q)、SEQ ID NO:53/36(h2A10.v2.T56A)、SEQ ID NO:55/54(v3)和SEQ IDNO:57/56(v4)。
实施例I-12.如实施例I-1至实施例I-11中任一项所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ IDNO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ ID NO:64/58(v1.5)、SEQ ID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ IDNO:67/60(v2.1)、SEQ ID NO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQ ID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)、SEQ ID NO:73/58(h2A10.v2.N54S)、SEQ IDNO:74/58(h2A10.v2.N54Q)、SEQ ID NO:75/58(h2A10.v2.T56A)、SEQ ID NO:77/76(v3)和SEQ ID NO:79/78(v4)。
实施例I-13.如实施例I-1至实施例I-10中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:22的VL,该WL包含选自由以下项所组成的组的一个或多个框架修饰:4L或4M、38H或38Q、43A或43Q和58V。
实施例I-14.如实施例I-1至实施例I-10中任一项所述的抗TGFβ3抗体,其中该VL包含选自由以下项所组成的组的一组框架修饰:
(i)FR1中的4L、FR2中的43Q和38H、FR3中的58I(h2A10.v1和h2A10.v2);
(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);
(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);
(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);
(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);
(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);
(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和
(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
实施例I-15.如实施例I-1至实施例I-10、实施例I-13和实施例I-14中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ ID NO:23的VH,所述VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;和76N、78D或78L、78A或78V。
实施例I-16.如实施例I-15所述的抗TGFβ3抗体,其中该VH包含选自由以下项所组成的组的一组框架修饰:
(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);
(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);
(iii)FR2中的47W(h2A10.v1.5);
(iv):FR2中的49G(h2A10.v1.6);
(v)FR3中的78A(h2A10.v1.7);
(vi)FR2中的47W(h2A10.v2.5);
(vii)FR2中的49S(h2A10.v2.6);
(viii)FR3中的73N(h2A10.v2.7);
(ix)FR3中的76N(h2A10.v2.8);
(x)FR3中的78L(h2A10.v2.9);和
(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。
实施例I-17.如实施例I-13或实施例I-15所述的抗体,其包含VL,其中该VL保留框架I中位置4处的亮氨酸(L)和框架II中位置47处的亮氨酸(L)。
实施例I-18.如实施例I-15或实施例I-17所述的抗体,其中该VH保留来自r2A10的VH的框架III中位置73处的D。
实施例I-19.如实施例I-1至实施例I-12中任一项所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:5的氨基酸序列的CDR-H2。
实施例I-20.如实施例I-1至实施例I-12中任一项所述的抗TGFβ3抗体,其中该抗TGFβ3抗体包含具有SEQ ID NO:159的氨基酸序列的CDR-H2。
实施例I-21.如实施例I-20所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:52的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例I-22.如实施例I-20或实施例I-21所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:52的VH氨基酸序列。
实施例I-23.如实施例I-20至实施例I-22中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:74的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例I-24.如实施例I-20至实施例I-23中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:74的完整H链氨基酸序列。
实施例I-25.如实施例I-20至实施例I-24中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例I-26.如实施例I-20至实施例I-25中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。
实施例I-27.如实施例I-20至实施例I-26中任一项所述的抗TGFβ3抗体,其中该抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
实施例I-28.如实施例I-20至实施例I-27中任一项所述的抗TGFβ3抗体,其中该抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。
实施例I-29.如实施例I-20所述的抗TGFβ3抗体,其中该抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:52/36的氨基酸序列。
实施例I-30.如实施例I-20所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:74/58的氨基酸序列。
实施例I-31.如实施例I-1至实施例I-12中任一项所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:34的氨基酸序列的CDR-H2。
实施例I-32.如实施例I-31所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:55的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例I-33.如实施例I-31或实施例I-32所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:55的VH氨基酸序列。
实施例I-34.如实施例I-31至实施例I-33中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:77的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例I-35.如实施例I-31至实施例I-34中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:77的完整H链氨基酸序列。
实施例I-36.如实施例I-31至实施例I-35中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:54的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例I-37.如实施例I-31至实施例I-37中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:54的VL氨基酸序列。
实施例I-38.如实施例I-31至实施例I-37中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:76的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
实施例I-39.如实施例I-31至实施例I-38中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:76的完整L链氨基酸序列。
实施例I-40.如实施例I-31所述的抗TGFβ3抗体,其中该抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:55/54的氨基酸序列。
实施例I-41.如实施例I-31所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:77/76的氨基酸序列。
实施例I-42.如实施例I-1至实施例I-12中任一项所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:35的氨基酸序列的CDR-H2。
实施例I-43.如实施例I-42所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:57的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
实施例I-44.如实施例I-42或实施例I-43所述的抗TGFβ3抗体,其中该抗体包含具有SEQ ID NO:57的VH氨基酸序列。
实施例I-45.如实施例I-42至实施例I-44中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:79的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
实施例I-46.如实施例I-42至实施例I-45中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:79的完整H链氨基酸序列。
实施例I-47.如实施例I-42至实施例I-46中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:56的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
实施例I-48.如实施例I-42至实施例I-47中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:56的VL氨基酸序列。
实施例I-49.如实施例I-42至实施例I-48中任一项所述的抗TGFβ3抗体,其中该抗体包含与SEQ ID NO:76的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列
实施例I-50.如实施例I-42至实施例I-49中任一项所述的抗TGFβ3抗体,其中该抗体包含SEQ ID NO:76的完整L链氨基酸序列。
实施例I-51.如实施例I-42所述的抗TGFβ3抗体,其中该抗体包含VH/VL对,该VH/VL对(分别)包含SEQ ID NO:57/56的氨基酸序列。
实施例I-52.如实施例I-42所述的抗TGFβ3抗体,其中该抗体包含完整H/L链对,该H/L链对(分别)包含SEQ ID NO:79/78的氨基酸序列。
实施例I-53.一种抗TGFβ3抗体,其包含:
(a)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或
(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78.
实施例90.如实施例1至89或实施例I-1至I-53中任一项所述的抗体,其为单克隆抗体。
实施例91.如实施例1至89或实施例I-1至I-53中任一项所述的抗体,其为人抗体、人源化抗体或嵌合抗体。
实施例92.如实施例1至89或实施例I-1至I-53中任一项所述的抗体,其为抗体片段。
实施例93.如实施例1至89或实施例I-1至I-53中任一项所述的抗体,其包含人Fc区,所述人Fc区为IgG1或IgG4亚型。
实施例94.如实施例93所述的抗体,其包含人Fc区,该人Fc区为IgG1亚型。
实施例95.如实施例93或94所述的抗体,其中该Fc区包含修饰以去除氨基酸残基位置N297(如Kabat中的EU编号)处的糖基化位点。
实施例96.如实施例95所述的抗体,其中该修饰为选自N297G或N297A的突变。
实施例97.如实施例96所述的抗体,其中该修饰为突变N297G。
实施例98.如实施例93至97中任一项所述的抗体,其中该Fc区经修饰以去除效应子功能。
实施例99.如实施例1至98或实施例I-1至I-53中任一项所述的抗体,其中该抗体具有约230至260μg/ml的Cmax和/或约15至16天的半衰期(t
实施例100.一种分离的核酸,其编码如实施例1至99或实施例I-1至I-53中任一项所述的抗体。
实施例101.一种宿主细胞,其包含如实施例100所述的核酸。
实施例102.一种产生抗体的方法,其包括培养如实施例101所述的宿主细胞,从而产生该抗体。
实施例103.如实施例102所述的方法,其进一步包括从该宿主细胞回收该抗体。
实施例104.一种抗体,其通过如实施例102或实施例103所述的方法产生。
实施例105.一种免疫缀合物,其包含如实施例1所述的抗体,以及细胞毒性剂。
实施例I-105.一种免疫缀合物,其包含如实施例1至89或实施例I-1至I-53中任一项所述的抗体,以及细胞毒性剂。
实施例106.一种药物制剂,其包含如实施例1至99或实施例I-1至I-53中任一项所述的抗体,或如实施例105所述的免疫缀合物,或如实施例I-105所述的免疫缀合物,以及药用载体。
实施例107.一种药物制剂,其包含如实施例106所述的抗体,进一步包含另外的治疗剂。
实施例108.如实施例107所述的药物制剂,其中该另外的治疗剂选自由吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂、JAK抑制剂、IL-11抑制剂和PTX2所组成的组。
实施例109.如实施例1至99或实施例I-1至I-53中任一项所述的抗体,其用作药物。
实施例110.如实施例1至99或实施例I-1至I-53中任一项所述的抗体,其用于治疗TGFβ相关疾患。
实施例111.如实施例1所述的抗体和如实施例70所述的抗体,其用于组合使用来治疗TGFβ相关疾患。
实施例112.如实施例110或权111所述的抗体,其中该TGFβ相关疾患为纤维化。
实施例113.如实施例112所述的抗体,其中该纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。
实施例114.如实施例1至99或实施例I-1至I-53中任一项所述的抗体用于制造药物的用途,该药物用于抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成。
实施例115.如实施例1至99或实施例I-1至I-53中任一项所述的抗体用于制造药物的用途,该药物用于治疗受试者的TGFβ相关疾患。
实施例116.如实施例115所述的用途,其中该TGFβ相关疾患为纤维化,其中任选地该纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。
实施例117.如实施例1至99或实施例I-1至I-53中任一项所述的抗体用于制造药物的用途,该药物用于抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成。
实施例118.一种治疗患有TGFβ相关疾患的受试者的方法,该方法包括向有此需要的受试者施用有效量的如实施例1至99或实施例I-1至I-53中任一项所述的抗体或向该受试者施用如实施例106所述的药物制剂。
实施例119.一种用于在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或抑制新胶原合成的方法,其包括向有此需要的受试者施用有效量的如实施例1至99或实施例I-1至I-53中任一项所述的抗体,以在该受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或抑制新胶原合成。
实施例120.如实施例118或119所述的方法,其进一步包括向该受试者施用另外的治疗剂。
实施例121.如实施例120所述的方法,其中该另外的治疗剂选自由以下项所组成的组:吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗、沙利姆单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂和PTX2。
实施例122.如实施例118至121中任一项所述的方法,其包括向该受试者施用有效量的根据权利要求1所述的抗TGFβ3抗体和有效量的根据实施例70所述的抗TGFβ2抗体。
实施例123.如实施例118至122中任一项所述的方法,其中该受试者患有TGFβ相关疾患,该疾患为纤维化。
实施例124.如实施例123所述的方法,其中该纤维化为选自由以下项所组成的组的肺部纤维化:特发性肺纤维化(IPF)、特发性肺上叶纤维化(Amitani病)、家族性肺纤维化、肺纤维化(例如,继发于全身性炎症性疾病的肺纤维化,诸如类风湿性关节炎、硬皮病、狼疮、隐原性纤维性肺泡炎、慢性阻塞性肺病(COPD)或慢性哮喘)、囊性纤维化、非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、硬皮病/全身性硬化症(SSc,包括局限性皮肤(lcSSc)和弥漫性皮肤(dcSSc)形式和SSc相关间质性肺病(SSc-ILD))、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)、过敏性肺炎、肺动脉高压、肺结核、矽肺、石棉肺、急性肺损和急性呼吸窘迫(ARD,包括细菌性肺炎引起的、创伤引起的和病毒性肺炎引起的、呼吸机引起的、非肺脓毒症引起的)。
实施例125.如实施例123所述的方法,其中该纤维化为选自由以下项所组成的组的肝纤维化病症:肝硬化、先天性肝纤维化、肥胖、脂肪肝、酒精引起的肝纤维化、非酒精性脂肪性肝炎(NASH)、胆管损伤、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)、感染或病毒引起的肝纤维化(例如,慢性乙型和丙型肝炎病毒感染)、囊性纤维化、自身免疫性肝炎、坏死型肝炎、原发性硬化性胆管炎、血色素沉着病、胆道系统疾患和可归因于感染的肝功能障碍。
实施例126.如实施例123所述的方法,其中该纤维化为选自由以下项所组成的组的心和/或心包膜的纤维化病症:心内膜心肌纤维化、心脏同种移植物血管病(CAV)、心肌梗塞、心房纤维化、充血性心力衰竭、动脉硬化、动脉粥样硬化、血管狭窄、心肌炎、充血性心肌病、冠状动脉梗塞、静脉曲张、冠状动脉狭窄和其他缺血后病症、和特发性腹膜后纤维化。
实施例127.如实施例123所述的方法,其中该纤维化为选自由以下项所组成的组的肾纤维化病症:肾小球性肾炎(包括膜增生性、弥漫性增生性、急进型或硬化性、感染后和慢性形式)、糖尿病性肾小球硬化、局灶性节段性肾小球硬化、IgA肾病、糖尿病性肾病、缺血性肾病、小管间质性肾纤维化、HIV相关肾病、膜肾病、继发于全身性炎症性疾病诸如狼疮、硬皮病和糖尿病性肾小球性肾炎的肾小球性肾炎、特发性膜增生性肾小球性肾炎、系膜增生性肾小球性肾炎、新月体性肾小球肾炎、淀粉样变性(其影响肾及其他组织)、自身免疫性肾炎、肾小管间质性纤维化、肾动脉硬化、Alport综合征、肾病综合征、慢性肾衰竭、慢性肾病、肾小球周围纤维化/无肾小管的肾小球、合并肺尖肺气肿和基底纤维化综合征(肺气肿/纤维化综合征)、肾小球高血压、肾原性纤维化皮肤病、多囊性肾病、法布里病和肾性高血压。
实施例128.如实施例123所述的方法,其中该纤维化为选自由以下项所组成的组的胰腺纤维化病症:基质重塑性胰腺炎和基质纤维化。
实施例129.如实施例123所述的方法,其中该纤维化为选自由以下项所组成的组的胃肠道纤维化病症:克罗恩病、溃疡性结肠炎、胶原性结肠炎、结直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎。
实施例130.如实施例123所述的方法,其中该纤维化为选自由以下项所组成的组的眼纤维化病症:眼睛纤维化、眼部纤维化、增生性玻璃体视网膜病、任何病因的玻璃体视网膜病、与视网膜功能障碍有关的纤维化、与湿性或干性黄斑变性有关的纤维化、角膜和结膜中的瘢痕、角膜内皮中的纤维化、前囊下白内障和后囊膜混浊、眼前段纤维化疾病、角膜基质纤维化(例如,与角膜混浊有关)、小梁网纤维化(例如,与青光眼有关)、眼后段纤维化疾病、纤维血管瘢痕(例如,在眼的视网膜或脉络膜血管系统中)、视网膜纤维化、视网膜前膜纤维化、视网膜胶质增生、视网膜下纤维化(例如,与年龄相关性黄斑变性有关)、糖尿病性视网膜病中的牵引性视网膜脱离伴组织收缩、先天性眼眶纤维化、泪腺纤维化、角膜上皮下纤维化和格雷夫眼病。
实施例131.如实施例123所述的方法,其中该纤维化选自源自脊髓损伤/纤维化或中枢神经系统纤维化诸如卒中后的纤维化、杜氏肌肉营养不良、与神经退行性疾患诸如阿尔兹海默病或多发性硬化有关的纤维化、血管再狭窄、子宫纤维化、子宫内膜异位症、卵巢纤维瘤、佩罗尼氏病、多囊性卵巢综合征、强制性脊柱炎中的疾病相关肺尖纤维化、瘢痕、和由微生物感染(例如,细菌、病毒、寄生虫、真菌)引起的纤维化。
实施例132.如实施例123所述的方法,其中该纤维化为SSc。
实施例133.如实施例123所述的方法,其中该纤维化为IPF。
实施例134.如实施例123所述的方法,其中该纤维化为慢性阻塞性肺病(COPD)。
实施例135.如实施例123所述的方法,其中该纤维化为进行性纤维化间质性肺病(PF-ILD)。
实施例136.如实施例135所述的方法,其中该PF-ILD为选自由以下项所组成的组的疾病或病症:非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、煤矿工人尘肺病的并发症、硬皮病/全身性硬化、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)和过敏性肺炎。
实施例137.如实施例123所述的方法,其中该纤维化为肝硬化或慢性肝纤维化。
实施例138.如实施例123所述的方法,其中该纤维化为GI道纤维化,例如,肠纤维化,任选地选自由以下项所组成的组:与克罗恩病有关的纤维化、溃疡性结肠炎、胶原性结肠炎、结直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎。
实施例139.如实施例123所述的方法,其中该纤维化为眼纤维化病症,源自脊髓损伤、纤维化或中枢神经系统纤维化的纤维化,或与神经退行性疾患有关的纤维化。
实施例140.如实施例118至139中任一项所述的方法,其中该抗体为抗TGFβ2抗体。
实施例141.如实施例140所述的方法,其中该抗TGFβ2抗体包含:
(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。
实施例142.如实施例118至139中任一项所述的方法,其中该抗体为抗TGFβ3抗体。
实施例143.如实施例142所述的方法,其中该抗TGFβ3抗体包含:
(a)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(b)VH/VL对,该VH/VL对的VH包含SEQ ID NO:57的氨基酸序列,并且该VH/VL对的VL包含SEQ ID NO:56的氨基酸序列;或
(c)完整H/L链对,该H/L链对的H链包含SEQ ID NO:79的氨基酸序列,且该H/L链对的L链包含SEQ ID NO:78的氨基酸序列。
实施例144.如实施例118至139中任一项所述的方法,其中该抗体为抗TGFβ2/3抗体。
实施例145.如实施例144所述的方法,其中该抗TGFβ2/3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;
实施例146.一种将受试者诊断为患有SSc的方法,该方法包括检测由PRSS23、PXDN、COL8A1、COL6A3、SERPINE2、TNC、COMP、THBS1、COL11A1、COL1A1、COL5A2、COL1A2、COL4A1、COL4A2、SFRP4、ALPK2、COL5A1和TAGLN所组成的18个基因特征组中该基因的表达水平,以及如果该基因的水平经确定为相对于健康对照组或参考基因特征中的该基因水平是升高的,则将该受试者诊断为患有SSc。
实施例147.如实施例146所述的方法,其中如果该相对于健康对照组或参考基因特征的表达增加是统计学显著的,任选地,相对于健康对照组或参考基因特征增加至少两倍、或增加至少三倍、或增加至少四倍,则基因水平是升高的。
实施例148.一种监测对使用抗TGFβ2抗体和/或抗TGFβ3抗体对受试者的治疗的应答的方法,该方法包括确定来自该受试者的样品中选自由serpine1、col1a1、col1a2和col3a1所组成的组的TGFβ诱导型基因中的一种或多种基因的表达水平,其中该受试者已经接受所述抗TGFβ2抗体和/或抗TGFβ3抗体的一次或多次施用。
实施例149.如实施例148所述的方法,其中如果该一种或多种TGFβ诱导型基因的表达水平与该一种或多种TGFβ诱导型基因的治疗前水平相比显著减少,则确定受试者对使用抗TGFβ2抗体和/或抗TGFβ3抗体的治疗有应答,其中任选地该方法进一步包括,如果该一种或多种TGFβ诱导型基因的表达水平经确定为显著减少,则再次施用所述抗TGFβ2抗体和/或所述TGFβ3抗体的附加施用。
实施例150.如实施例148或149所述的方法,其中向受试者施用抗TGFβ2抗体作为单一疗法。
实施例151.如实施例148或149所述的方法,其中向受试者施用抗TGFβ3抗体作为单一疗法。
实施例152.如实施例148所述的方法,其中该一种或多种TGFβ诱导型基因的表达水平通过qPCR或微阵列分析进行确定。
实施例153.如实施例100至152中任一项所述的方法或用途,其中受试者为人。
实施例154.一种试剂盒,其包括如实施例1至99或实施例I-1至I-53中任一项所述的抗体。
实施例I-155.一种用于治疗有此需要的受试者的TGFβ相关疾患的方法,该方法包括:
确定来自该受试者的样品包含升高水平的一种或多种生物标志物;和
向受试者施用有效量的同种型选择性抗TGFβ抗体。
实施例I-156.一种为患有自身免疫性或炎性疾病的受试者选择疗法的方法,其包括:
确定受试者的一种或多种生物标志物的水平;和
基于该一种或多种生物标志物的水平而选择药物,其中如果该一种或多种生物标志物的水平是升高的,则选择的药物为同种型选择性抗TGFβ抗体。
实施例I-157.一种用于治疗有此需要的受试者的TGFβ相关疾患的方法,包括向该受试者施用有效量的同种型选择性抗TGFβ抗体,其中在开始施用之前,该受试者具有升高的一种或多种生物标志物。
实施例I-158.如实施例I-155至I-157中任一项所述的方法,其中该一种或多种生物标志物选自由TGFβ2、TGFβ3、骨膜蛋白(POSTN)和软骨寡聚基质蛋白(COMP)所组成的组。
实施例I-159.如实施例I-155至I-157中任一项所述的方法,其中该一种或多种生物标志物选自由PRSS23、PXDN、COL8A1、COL6A3、SERPINE2、TNC、COMP、THBS1、COL11A1、COL1A1、COL5A2、COL1A2、COL4A1、COL4A2、SFRP4、ALPK2、COL5A1和TAGLN所组成的组。
实施例I-160.如实施例I-155至I-157中任一项所述的方法,其中该一种或多种生物标志物选自由SERPINE1、COL1A1、COL1A2和COL3A1所组成的组。
实施例I-161.如实施例I-155至I-160中任一项所述的方法,其中该一种或多种生物标志物的水平在来自受试者的样品中是升高的,其中该样品为皮肤、肺或血液样品。
实施例I-162.如实施例I-158所述的方法,其中该样品为血清样品。
实施例I-160.如实施例I-155至I-159中任一项所述的方法,其中同种型选择性抗TGFβ抗体为抗TGFβ2、抗TGFβ2/3或抗TGFβ3抗体。
实施例I-161.如实施例I-155至I-160中任一项所述的方法,其中升高的生物标志物为骨膜蛋白和COMP中的一种或两种。
实施例I-162.如实施例I-155至I-161中任一项所述的方法,其中该疾患为纤维化疾患。
实施例I-163.如实施例I-162所述的方法,其中该纤维化病症为肺纤维化、肝脏纤维化病症、心和/或心包纤维化病症、肾脏纤维化病症、胰腺纤维化病症、胃肠道纤维化病症、眼纤维化病症或由脊髓损伤/纤维化或中枢神经系统纤维化引起的纤维化。
实施例I-164.如实施例I-162所述的方法,其中该纤维化病症选自由IPF、SSc、COPD和PF-ILD所组成的组。
实施例I-165.如实施例I-155至I-164中任一项所述的方法,其中升高的水平是相对于健康个体或对照组的,并且其中升高是统计学显著的,任选地,相对于健康个体或对照组增加至少两倍、或增加至少三倍、或增加至少四倍。
实施例I-166.如实施例I-155至I-164中任一项所述的方法,其中该受试者对于抗IL-6抑制剂疗法没有应答。
实施例I-167.如实施例I-166所述的方法,其中抗IL-6疗法为托珠单抗。
实施例I-168.如实施例I-155至I-167中任一项所述的方法,其中同种型选择性抗TGFβ抗体为实施例1至99或实施例I-1至I-53中任一项所述的抗体。
本发明还包含以下项目:
1.一种分离的抗肿瘤坏死因子β3(TGFβ3)抗体,其中所述抗体选择性地中和TGFβ3,并且其中所述抗体包括以下特征中的一项或多项:
(n)所述抗TGFβ3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(a)所述抗TGFβ3抗体与TGFβ3的β6/β7发夹区特异性地结合;
(b)所述抗TGFβ3抗体的结合在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力;
(c)所述抗TGFβ3抗体与TGFβ3的结合阻断TGFΒR2结合并且抑制TGFBR1/TGFBR2信号传导受体与TGFβ3的结合;
(d)所述抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394;
(e)所述抗TGFβ3抗体直接接触人TGFβ3的β6/β7发夹区中的氨基酸残基R394,且TGFβ3的残基R394与所述抗TGFβ3抗体在所述重链CDR2中形成离子盐桥;
(f)通过所述抗TGFβ3抗体的抗原结合结构域与TGFβ3的氨基酸残基T387、L389和T395(人TGFβ3编号)的直接接触,实现所述抗TGFβ3相对于TGFβ1对TGFβ3的同种型选择性;
(g)通过所述抗TGFβ3抗体的所述抗原结合结构域与TGFβ3的氨基酸残基R325、R394和V398(人TGFβ3编号)的直接接触,实现所述抗TGFβ3相对于TGFβ2对TGFβ3的所述同种型选择性;
(h)所述抗TGFβ3抗体具有相对于泛TGFβ抗体1D11的减少的毒性;
(i)所述抗TGFβ3抗体具有相对于所述泛TGFβ抗体1D11的在啮齿动物或食蟹猴中减少的毒性;
(j)所述抗TGFβ3抗体具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;
(k)所述抗TGFβ3抗体具有相对于所述泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性;
(l)所述抗TGFβ3抗体具有相对于抗TGFβ1抗体CAT-192的减少的毒性;
(m)所述抗TGFβ3抗体具有相对于同种型选择性抗TGFβ2抗体和/或抗TGFβ2/3抗体的减少的毒性;
(o)所述抗TGFβ3抗体包含抗原结合结构域,所述抗原结合结构域直接接触人TGFβ3上的氨基酸残基R325、K331、W332、H334、E335、T387、I388、L389、Y391、V392、G393、R394、P396、K397和V398;和
(p)如(o)中的抗TGFβ3抗体,其中所述抗原结合结构域位于所述TGFβ3氨基酸残基的15-8、8、8-5、7-5、6-5或5埃内。
2.一种分离的抗TGFβ3抗体,其中所述抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:5、34、35和159中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列。
3.根据项目1或项目2所述的抗TGFβ3,其中所述抗体包含与选自由SEQ ID NO:23、37、42至53、55和57所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的重链可变区(VH)氨基酸序列。
4.根据项目1至项目3中任一项所述的抗TGFβ3抗体,其中所述抗体包含选自由SEQID NO:23、37、42至53、55和57所组成的组的VH氨基酸序列。
5.根据项目1至项目4中任一项所述的抗TGFβ3,其中所述抗体包含与选自由SEQID NO:29、59、64、65至75、77和79所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整重(H)链氨基酸序列。
6.根据项目1至项目5中任一项所述的抗TGFβ3抗体,其中所述抗体包含选自由SEQID NO:29、59、64、65至75、77和79所组成的组的完整重(H)链氨基酸序列。
7.根据项目1至项目6中任一项所述的抗TGFβ3抗体,其中所述抗体包含与选自由SEQ ID NO:22、36、38至41、54和56所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的轻链可变区(VL)氨基酸序列。
8.根据项目1至项目7中任一项所述的抗TGFβ3抗体,其中所述抗体包含选自由SEQID NO:22、36、38至41、54和56所组成的组的VL氨基酸序列。
9.根据项目1至项目8中任一项所述的抗TGFβ3抗体,其中所述抗体包含与选自由SEQ ID NO:28、58、60至63、76和78所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整轻(L)链氨基酸序列。
10.根据项目1至项目9中任一项所述的抗TGFβ3抗体,其中所述抗体包含选自由SEQ ID NO:28、58和60至63、76和78所组成的组的完整L链氨基酸序列。
11.根据项目1至项目10中任一项所述的抗TGFβ3抗体,其中所述抗体包含VH/VL对,所述VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:23/22(大鼠2A10)、SEQ ID NO:37/36(v1)、SEQ ID NO:37/38(v1.1)、SEQ ID NO:37/39(v1.2)、SEQID NO:37/40(v1.3)、SEQ ID NO:37/41(v1.4)、SEQ ID NO:42/36(v1.5)、SEQ ID NO:43/36(v1.6)、SEQ ID NO:44/36(v1.7)、SEQ IDNO:45/36(v2)、SEQ ID NO:45/38(v2.1)、SEQ IDNO:45/39(v2.2)、SEQ ID NO:45/40(v2.3)、SEQ ID NO:45/41(v2.4)、SEQ ID NO:46/36(v2.5)、SEQ ID NO:47/36(v2.6)、SEQ ID NO:48/36(v2.7)、SEQ ID NO:49/36(v2.8)、SEQID NO:50/36(v2.9)、SEQ ID NO:51/36(h2A10.v2.N54S)、SEQ ID NO:52/36(h2A10.v2.N54Q)、SEQ IDNO:53/36(h2A10.v2.T56A)、SEQ ID NO:55/54(v3)和SEQ ID NO:57/56(v4)。
12.根据项目1至项目11中任一项所述的抗TGFβ3抗体,其中所述抗体包含完整H/L链对,所述完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:29/28(大鼠2A10)、SEQ ID NO:59/58(v1)、SEQ ID NO:59/60(v1.1)、SEQ ID NO:59/61(v1.2)、SEQ ID NO:59/62(v1.3)、SEQ ID NO:59/63(v1.4)、SEQ IDNO:64/58(v1.5)、SEQID NO:65/58(v1.6)、SEQ ID NO:66/58(v1.7)、SEQ ID NO:67/58(v2)、SEQ ID NO:67/60(v2.1)、SEQ IDNO:67/61(v2.2)、SEQ ID NO:67/62(v2.3)、SEQ ID NO:67/63(v2.4)、SEQID NO:68/58(v2.5)、SEQ ID NO:69/58(v2.6)、SEQ ID NO:70/58(v2.7)、SEQ ID NO:71/58(v2.8)、SEQ ID NO:72/58(v2.9)、SEQ ID NO:73/58(h2A10.v2.N54S)、SEQ ID NO:74/58(h2A10.v2.N54Q)、SEQ ID NO:75/58(h2A10.v2.T56A)、SEQ ID NO:77/76(v3)和SEQ IDNO:79/78(v4)。
13.根据项目1至项目10中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:22的VL,所述VL包含选自由以下项所组成的组的一个或多个框架修饰:4L或4M、38H或38Q、43A或43Q、和58V。
14.根据项目1至项目10中任一项所述的抗TGFβ3抗体,其中所述VL包含选自由以下项所组成的组的一组框架修饰:
(i)FR1中的4L、FR2中的38H和43Q、FR3中的58I(h2A10.v1和h2A10.v2);
(ii)FR1中的4M(h2A10.v1.1和h2A10.v2.1);
(iii)FR2中的38Q(h2A10.v1.2和h2A10.v2.2);
(iv)FR2中的43A(h2A10.v1.3和h2A10.v2.3);
(v)FR3中的58V(h2A10.v1.4和h2A10.v2.4);
(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4);
(vii)FR3中的58V(h2A10.v1.4和h2A10.v2.4);和
(vi)FR2中的38Q、43A,FR3中的58V(h2A10.v3和h2A10.v4)。
15.根据项目1至项目10、项目13和项目14中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ ID NO:23的VH,所述VH包含选自由以下项所组成的组的一个或多个框架修饰:47L或47W;49A、49S或49G;73D或73N;和76N、78D或78L、78A或78V。
16.根据项目15所述的抗TGFβ3抗体,其中所述VH包含选自由以下项所组成的组的一组框架修饰:
(i)FR2中的47L、49A,FR3中的78V(h2A10.v1);
(ii)FR2中的47L、49A,FR3中的73D、76S、78V(h2A10.v2);
(iii)FR2中的47W(h2A10.v1.5);
(iv):FR2中的49G(h2A10.v1.6);
(v)FR3中的78A(h2A10.v1.7);
(vi)FR2中的47W(h2A10.v2.5);
(vii)FR2中的49S(h2A10.v2.6);
(viii)FR3中的73N(h2A10.v2.7);
(ix)FR3中的76N(h2A10.v2.8);
(x)FR3中的78L(h2A10.v2.9);和
(xi)FR2中的49S,FR3中的76N、78L(h2A10.v3和h2A10.v4)。
17.根据项目13或项目15所述的抗体,其包含VL,其中所述VL保留框架I中位置4处的亮氨酸(L)和框架II中位置47处的亮氨酸(L)。
18.根据项目15或项目17所述的抗体,其中所述VH保留来自r2A10的VH的框架III中位置73处的D。
19.根据项目1至项目12中任一项所述的抗TGFβ3抗体,其中所述抗体包含具有SEQID NO:5的氨基酸序列的CDR-H2。
20.根据项目1至项目12中任一项所述的抗TGFβ3抗体,其中所述抗TGFβ3抗体包含具有SEQ ID NO:159的氨基酸序列的CDR-H2。
21.根据项目20所述的抗TGFβ3抗体,其中所述抗体包含与SEQ ID NO:52的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
22.根据项目20或项目21所述的抗TGFβ3抗体,其中所述抗体包含SEQ ID NO:52的VH氨基酸序列。
23.根据项目20至项目22中任一项所述的抗TGFβ3抗体,其中所述抗体包含与SEQID NO:74的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
24.根据项目20至项目23中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:74的完整H链氨基酸序列。
25.根据项目20至项目24中任一项所述的抗TGFβ3抗体,其中所述抗体包含与选自由SEQ ID NO:22、36和38至41所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
26.根据项目20至项目25中任一项所述的抗TGFβ3抗体,其中所述抗体包含选自由SEQ ID NO:22、36和38至41所组成的组的VL氨基酸序列。
27.根据项目20至项目26中任一项所述的抗TGFβ3抗体,其中所述抗体包含与选自由SEQ ID NO:28、58和60至63所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或
100%序列同一性的完整L链氨基酸序列。
28.根据项目20至项目27中任一项所述的抗TGFβ3抗体,其中所述抗体包含选自由SEQ ID NO:28、58和60至63所组成的组的完整L链氨基酸序列。
29.根据项目20所述的抗TGFβ3抗体,其中所述抗体包含VH/VL对,所述VH/VL对(分别)包含SEQ ID NO:52/36的氨基酸序列。
30.根据项目20所述的抗TGFβ3抗体,其中所述抗体包含完整H/L链对,所述H/L链对(分别)包含SEQ ID NO:74/58的氨基酸序列。
31.根据项目1至项目12中任一项所述的抗TGFβ3抗体,其中所述抗体包含具有SEQID NO:34的氨基酸序列的CDR-H2。
32.根据项目31所述的抗TGFβ3抗体,其中所述抗体包含与SEQ ID NO:
55的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
33.根据项目31或项目32所述的抗TGFβ3抗体,其中所述抗体包含SEQ ID NO:55的VH氨基酸序列。
34.根据项目31至项目33中任一项所述的抗TGFβ3抗体,其中所述抗体包含与SEQID NO:77的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
35.根据项目31至项目34中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:77的完整H链氨基酸序列。
36.根据项目31至项目35中任一项所述的抗TGFβ3抗体,其中所述抗体包含与SEQID NO:54的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
37.根据项目31至项目36中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:54的VL氨基酸序列。
38.根据项目31至项目37中任一项所述的抗TGFβ3抗体,其中所述抗体包含与SEQID NO:76的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
39.根据项目31至项目38中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:76的完整L链氨基酸序列。
40.根据项目31所述的抗TGFβ3抗体,其中所述抗体包含VH/VL对,所述VH/VL对(分别)包含SEQ ID NO:55/54的氨基酸序列。
41.根据项目31所述的抗TGFβ3抗体,其中所述抗体包含完整H/L链对,所述H/L链对(分别)包含SEQ ID NO:77/76的氨基酸序列。
42.根据项目1至项目12中任一项所述的抗TGFβ3抗体,其中所述抗体包含具有SEQID NO:35的氨基酸序列的CDR-H2。
43.根据项目42所述的抗TGFβ3抗体,其中所述抗体包含与SEQ ID NO:
57的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
44.根据项目42或项目43所述的抗TGFβ3抗体,其中所述抗体包含SEQ ID NO:57的VH氨基酸序列。
45.根据项目42至项目44中任一项所述的抗TGFβ3抗体,其中所述抗体包含与SEQID NO:79的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
46.根据项目42至项目45中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:79的完整H链氨基酸序列。
47.根据项目42至项目46中任一项所述的抗TGFβ3抗体,其中所述抗体包含与SEQID NO:56的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
48.根据项目42至项目47中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:56的VL氨基酸序列。
49.根据项目42至项目48中任一项所述的抗TGFβ3抗体,其中所述抗体包含与SEQID NO:76的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
50.根据项目42至项目49中任一项所述的抗TGFβ3抗体,其中所述抗体包含SEQ IDNO:76的完整L链氨基酸序列。
51.根据项目42所述的抗TGFβ3抗体,其中所述抗体包含VH/VL对,所述VH/VL对(分别)包含SEQ ID NO:57/56的氨基酸序列。
52.根据项目42所述的抗TGFβ3抗体,其中所述抗体包含完整H/L链对,所述H/L链对(分别)包含SEQ ID NO:79/78的氨基酸序列。
53.一种抗TGFβ3抗体,其包含:
(a)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35中的一者的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ IDNO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(b)VH/VL对,所述VH/VL对的所述VH包含SEQ ID NO:57的氨基酸序列,并且所述VH/VL对的所述VL包含SEQ ID NO:56的氨基酸序列;或
(c)完整H/L链对,所述H/L链对的所述H链包含SEQ ID NO:79的氨基酸序列,且所述H/L链对的所述L链包含SEQ ID NO:78的氨基酸序列。
54.一种分离的抗TGFβ2/3抗体,其中所述抗体选择性地中和TGFβ2和TGFβ3,并且其中所述抗体包括以下特征中的一项或多项:
(a)关于选择性中和,通过所述抗体的抗原结合结构域与TGFβ2或TGFβ3的氨基酸残基E373(人TGFβ2编号)的直接接触,实现所述抗TGFβ2/3抗体相对于人TGFβ1对TGFβ2和TGFβ3的选择性;
(b)所述抗TGFβ2/3抗体经由变构机制而中和TGFβ2和/或TGFβ3;
(c)所述抗TGFβ2/3抗体诱导TGFβ2和/或TGFβ3同源二聚体中的构象变化;
(d)所述抗TGFβ2/3抗体诱导TGFβ2和/或TGFβ3同源二聚体中的构象变化,其中所述构象变化包括夹在一起几度的两个单体;
(e)所述抗TGFβ2/3抗体为二价抗体或单价抗体;
(f)所述抗TGFβ2/3抗体包含(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ ID NO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ ID NO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列;
(g)所述抗TGFβ2/3抗体与TGFβ2同源二聚体特异性地结合,所述TGFβ2同源二聚体具有第一和第二TGFβ2单体,并且其中所述抗TGFβ2/3抗体包含抗原结合结构域,所述抗原结合结构域直接接触(i)所述第一TGFβ2单体的氨基酸残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,和(ii)所述第二TGFβ2单体的氨基酸残基N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(人TGFβ2编号);
(h)如(g)中的抗TGFβ2/3抗体,其中所述抗原结合结构域位于所述TGFβ2和/或TGFβ3氨基酸残基的5埃内;
(i)其中所述抗TGFβ2/3抗体与如(g)中的TGFβ3上的相同表位特异性地结合;和
(j)所述抗TGFβ2/3抗体不以单价形式中和TGFβ2和/或TGFβ3。
55.根据项目54所述的抗TGFβ2/3抗体,其中所述抗体包含与选自由SEQ ID NO:27、81、83、86至88、93至100和102至105所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
56.根据项目54或项目55所述的抗TGFβ2/3抗体,其中所述抗体包含选自由SEQ IDNO:27、81、83、86至88、93至100和102至105
所组成的组的VH氨基酸序列。
57.根据项目54至项目56中任一项所述的抗TGFβ2/3抗体,其中所述抗体包含与选自由SEQ ID NO:33、107、109、112至114和119至130所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整H链氨基酸序列。
58.根据项目54至项目57中任一项所述的抗TGFβ2/3抗体,其中所述抗体包含与选自由SEQ ID NO:26、80、82、84、85、89至92和101
所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VL氨基酸序列。
59.根据项目54至项目56中任一项所述的抗TGFβ2/3抗体,其中所述抗体包含选自由SEQ ID NO:26、80、82、84、85、89至92和101
所组成的组的VL氨基酸序列。
60.根据项目54至项目59中任一项所述的抗TGFβ2/3抗体,其中所述抗体包含与选自由SEQ ID NO:32、106、108、110、111、115至118
和186所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的完整L链氨基酸序列。
61.根据项目54至项目60中任一项所述的抗TGFβ2/3抗体,其中所述抗体包含选自由SEQ ID NO:32、106、108、110、111、115至118
和186所组成的组的完整L链氨基酸序列。
62.根据项目54所述的抗TGFβ2/3抗体,其中所述抗体包含VH/VL对,所述VH/VL对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:27/26(兔4A11)、SEQ IDNO:81/80(v1)、SEQ ID NO:81/82(v2)、SEQ ID NO:83/80(v3)、SEQ ID NO:83/82(v4)、SEQID NO:81/84(v5)、SEQ ID NO:81/85(v6)、SEQ ID NO:83/84
(v7)、SEQ ID NO:86/84(v7/1)、SEQ ID NO:87/84(v7.2)、SEQ ID
NO:88/84(v7.3)、SEQ ID NO:83/89(v7.4)、SEQ ID NO:83/90
(v7.5)、SEQ ID NO:83/91(v7.6)、SEQ ID NO:83/92(v7.7)、SEQ ID
NO:93/84(v7.8)、SEQ ID NO:94/84(v7.9)、SEQ ID NO:95/84
(v7.10)、SEQ ID NO:96/84(v7.11)、SEQ ID NO:97/84(v7.12)、SEQ ID NO:98/84(v7.13)、SEQ ID NO:99/84(v7.14)、SEQ ID NO:100/84
(v7.15)、SEQ ID NO:102/101(v7.16)、SEQ ID NO:103/101(v7.17)、SEQ ID NO:104/101(v7.18)、SEQ ID NO:105/101(v7.19)和SEQ ID
NO:83/85(v8)。
63.根据项目54所述的抗TGFβ2/3抗体,其中所述抗体包含完整H/L链对,所述完整H/L链对包含(分别)选自由以下项所组成的组的氨基酸序列:SEQ ID NO:32/33(兔4A11)、SEQ ID NO:107/106(v1)、SEQ ID NO:107/108(v2)、SEQ ID NO:109/106(v3)、SEQ ID NO:
109/108(v4)、SEQ ID NO:107/110(v5)、SEQ ID NO:107/111(v6)、SEQ ID NO:109/110(v7)、SEQ ID NO:112/110(v7.1)、SEQ ID NO:
113/110(v7.2)、SEQ ID NO:114/110(v7.3)、SEQ ID NO:114/115
(v7.4)、SEQ ID NO:114/116(v7.5)、SEQ ID NO:114/117(v7.6)、SEQ ID NO:114/118(v7.7)、SEQ ID NO:119/110(v7.8)、SEQ ID
NO:120/110(v7.9)、SEQ ID NO:121/110(v7.10)、SEQ ID NO:
122/110(v7.11)、SEQ ID NO:123/110(v7.12)、SEQ ID NO:124/110
(v7.13)、SEQ ID NO:125/110(v7.14)、SEQ ID NO:126/110(v7.15)、SEQ ID NO:127/186(v7.16)、SEQ ID NO:128/186(v7.17)、SEQ ID
NO:129/186(v7.18)、SEQ ID NO:130/186(v7.19)和SEQ ID NO:
114/111(v8)。
64.根据项目54所述的抗TGFβ2/3抗体,其中所述抗体包含VL,所述VL包含SEQ IDNO:26的氨基酸序列,所述氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:2A或2I、4L、36F或
36Y、43P或43A、和58V或58I。
65.根据项目54所述的抗TGFβ2/3抗体,其中所述VL包含选自由以下
项所组成的组的一组框架修饰:
(i)FR1中的2A和4L,和FR2中的36F(h4A11.v1和h4A11.v3);
(ii)FR1中的2A和4L,和FR2中的36F和43P(h4A11.v2和h4A11.v4);
(iii)FR1中的2A,FR2中的36F和43P,和FR3中的58V
(h4A11.v5和h4A11.v7);
(iv)FR1中的2A和4L,和FR2中的36F(h4A11.v6和h4A11.v8);
(v)FR1中的2I(h4A11.v7.4);
(vi)FR2中的36Y(h4A11.v7.5);
(vii)FR2中的43A(h4A11.v7.6);
(viii)FR3中的58I(h4A11.v7.7);和
(ix)FR1中的2I,FR2中的43A,FR3中的58I(h4A11.v7.16-19)。
66.根据项目54所述的抗TGFβ2/3抗体,其中所述抗体包含VH,所述VH包含SEQ IDNO:27的氨基酸序列,所述氨基酸序列包含选自由以下项所组成的组的一个或多个框架修饰:缺失1E、2Q或2V、24V、37V或37I、48I、49G、67F或67V、71K或71V、73S或73T,缺失75K和76N、78V或78F、91F或91Y、105P或105Q。
67.根据项目54或项目66所述的抗TGFβ2/3抗体,其中所述VL包含选自由以下项所组成的组的一组框架修饰:
(i)FR1中的2Q和24V,FR2中的48I和49G,FR3中的71K、73S、78V和91F,和FR4中的105P(h4A11.v1、h4A11.v2、h4A11.v5、h4A11.v6);
(ii)FR1中的2Q,FR2中的37V,FR3中的67F、71K、73S、78V和91F,和FR4中的105P(h4A11.v3、h4A11.v4、h4A11.v7、h4A11.v8);
(iii)缺失FR1中的1E(h4A11.v7.1);
(iv)缺失FR3中的75K和76N(h4A11.v7.2);
(v)缺失FR1中的1E和FR3中的75K76N(h4A11.v7.3);
(vi)FR1中的2V(h4A11.v7.8);
(vi)FR2中的37I(h4A11.v7.9);
(vii)FR3中的67V(h4A11.v7.10);
(viii)FR3中的71V(h4A11.v7.11);
(ix)FR3中的73T(h4A11.v7.12);
(x)FR3中的78F(h4A11.v7.13);
(xi)FR3中的91Y(h4A11.v7.14);
(xii)FR4中的105Q(h4A11.v7.15);
(xiii)FR1中的2V,FR2中的37I,FR3中的67V、73T、78F,FR4中的105Q((h4A11.v7.16);
(xiv)FR1中的2V,FR2中的37I,FR3中的67V、73T、91Y,FR4中的105Q(h4A11.v7.17);
(xv)FR1中的2V,FR2中的37I,FR3中的67V、73T,FR4中的105Q(h4A11.v7.18);和
(xvi)FR1中的2V,FR2中的37I,FR3中的67V、73T、缺失FR3中的75K和76N,FR4中的105Q(h4A11.v7.19)。
68.一种分离的抗TGFβ2抗体,其中所述抗体包含:
(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和
(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。
69.根据项目68所述的抗TGFβ2抗体,其中所述抗体选择性地中和TGFβ2。
70.根据项目69所述的抗TGFβ2抗体,其中所述抗体:
(a)具有相对于泛TGFβ抗体1D11的减少的毒性;
(b)具有相对于所述泛TGFβ抗体1D11的在啮齿动物中减少的毒性;
(c)具有相对于泛TGFβ小分子抑制剂galunisertib的减少的毒性;和/或
(d)具有相对于所述泛TGFβ小分子抑制剂galunisertib的在啮齿动物中减少的毒性。
71.根据项目68或项目69所述的抗TGFβ2抗体,其中所述抗体包含与选自由SEQ IDNO:25、132和138至142所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少99%或100%序列同一性的VH氨基酸序列。
72.根据项目71所述的抗TGFβ2抗体,其中所述抗体包含选自由SEQ ID NO:25、132和138至142所组成的组的VH氨基酸序列。
73.根据项目68或项目69中任一项所述的抗TGFβ2抗体,其中所述抗体包含与选自由SEQ ID NO:31、146和152至156所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少
99%或100%序列同一性的完整H链氨基酸序列。
74.根据项目73所述的抗TGFβ2抗体,其中所述抗体包含选自由SEQ ID NO:31、146和152至156所组成的组的完整H链氨基酸序列。
75.根据项目68或项目69所述的抗TGFβ2抗体,其中所述抗体包含与选自由SEQ IDNO:24、131、133至137、143和144所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少98%、至少
99%或100%序列同一性的VL氨基酸序列。
76.根据项目75所述的抗TGFβ2抗体,其中所述抗体包含选自由SEQ ID NO:24、131、133至137、143和144所组成的组的VL氨基酸序列。
77.根据项目68或项目69中任一项所述的抗TGFβ2抗体,其中所述抗体包含与选自由SEQ ID NO:30、145、147至151、157和158所组成的组的氨基酸序列具有至少95%、至少96%、至少97%、至少
98%、至少99%或100%序列同一性的完整L链氨基酸序列。
78.根据项目77所述的抗TGFβ2抗体,其中所述抗体包含选自由SEQ ID NO:30、145、147至151、157和158所组成的组的完整L链氨基酸序列。
79.根据项目68或项目69所述的抗TGFβ2抗体,其中所述抗体包含VH/VL对,所述VH/VL对包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:25/24(兔6F12)、SEQ IDNO:132/131(v1)、SEQ ID NO:132/133(v1.1)、SEQ ID NO:132/134(v1.2)、SEQ ID NO:
132/135(v1.3)、SEQ ID NO:132/136(v1.4)、SEQ ID NO:132/137
(v1.5)、SEQ ID NO:138/131(v1.6)、SEQ ID NO:139/131(v1.7)、SEQ ID NO:140/131(v1.8)、SEQ ID NO:141/131(v1.9)、SEQ ID NO:
142/131(v2)、SEQ ID NO:132/143(v3)和SEQ ID NO:142/144(v4)。
80.根据项目68或项目69所述的抗TGFβ2抗体,其中所述抗体包含完整H/L链对,所述完整H/L链对包含选自由以下项所组成的组的氨基酸序列:SEQ ID NO:31/30(兔6F12)、SEQ ID NO:146/145(v1)、SEQ ID NO:146/147(v1.1)、SEQ ID NO:146/148(v1.2)、SEQ IDNO:146/149(v1.3)、SEQ ID NO:146/150(v1.4)、SEQ ID NO:146/151(v1.5)、SEQ ID NO:152/145(v1.6)、SEQ ID NO:153/145(v1.7)、SEQ ID NO:154/145(v1.8)、SEQ ID NO:155/145(v1.9)、SEQ ID NO:156/145(v2)、SEQ ID NO:146/157(v3)和SEQ ID NO:156/158(v4)。
81.根据项目68或项目69所述的抗TGFβ2抗体,其中所述抗体包含VL,所述VL包含SEQ ID NO:24的氨基酸序列,所述氨基酸序列包含选自由以下项所组成的组的一个或多个框架突变:43S或43A、66G、69T、71F和87Y。
82.根据项目81所述的抗TGFβ2抗体,其中所述VL包含选自由以下项所组成的组的一组框架突变:
(i)FR2中的43S,和FR3中的66E、69P、71Y和87F(h6F12.v1和h6F12.v2);
(ii)FR2中的43S,和FR3中的58V、66E、69P、71Y和87F(h6F12.v3和h6F12.v4);
(iii)FR2中的43A(h6F12.v1.1);
(iv)FR3中的66G(h6F12.v1.2);
(v)FR3中的69T(h6F12.v1.3);
(vi)FR3中的71F(h6F12.v1.4);和
(vii)FR3中的87Y(h6F12.v1.5)。
83.根据项目68或项目69所述的抗TGFβ2抗体,其中所述抗体包含VH,所述VH包含SEQ ID NO:25的氨基酸序列,所述氨基酸序列包含选自由以下项所组成的组的一个或多个框架突变:37V或37I、48M或48L、49G或49A、67L、71K和78V、和105P或105R。
84.根据项目83所述的抗TGFβ2抗体,其中所述VH包含选自由以下项所组成的组的一组框架突变:
(i)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);
(ii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(h6F12.v2和h6F12.v4);
(iii)FR2中的37I(h6F12.v1.6);
(iv)FR2中的48L(h6F12.v1.7);
(v)FR2中的49A(h6F12.v1.8);
(vi)FR4中的105R(h6F12.v1.9);
(vii)FR2中的37V、48M和49G,和FR4中的105P(h6F12.v1和h6F12.v3);
(viii)FR2中的37V和48M,FR3中的67L、71K和78V,和FR4中的105P(6F12.v2和h6F12.v4);
(ix)FR2中的37I(h6F12.v1.6);
(x)FR2中的48L(h6F12.v1.7);
(xi):FR2中的49A(h6F12.v1.8);和
(xii)FR4中的105R(h6F12.v1.9)。
85.根据项目1至项目53中任一项所述的抗TGFβ3抗体,或根据项目54至项目66中任一项所述的抗TGFβ2/3抗体,其中所述抗体与人TGFβ3特异性地结合。
86.根据项目1至项目53中任一项所述的抗TGFβ3抗体,其中所述抗体与不成熟和成熟形式的TGFβ3两者特异性地结合。
87.根据项目54至项目66中任一项所述的抗TGFβ2/3抗体,或根据项目68至项目81中任一项所述的抗TGFβ2抗体,其中所述抗体与人TGFβ2特异性地结合。
88.根据项目1至项目87中任一项所述的抗体,其为单克隆抗体。
89.根据项目1至项目87中任一项所述的抗体,其为人抗体、人源化抗体或嵌合抗体。
90.根据项目1至项目87中任一项所述的抗体,其为抗体片段。
91.根据项目1至项目87中任一项所述的抗体,其包含人Fc区,所述人Fc区为IgG1或IgG4同种型。
92.根据项目91所述的抗体,其包含人Fc区,所述人Fc区为IgG1同种型。
93.根据项目91或项目92所述的抗体,其中所述Fc区包含修饰以去除氨基酸残基位置N297(如Kabat中的EU编号)处的糖基化位点。
94.根据项目93所述的抗体,其中所述修饰为选自N297G或N297A的突变。
95.根据项目94所述的抗体,其中所述修饰为所述突变N297G。
96.根据项目91至项目95中任一项所述的抗体,其中所述Fc区经修饰以去除效应子功能。
97.根据项目1至项目96中任一项所述的抗体,其中所述抗体具有约230至260μg/ml的Cmax和/或约15至16天的半衰期(t
98.一种分离的核酸,其编码根据项目1至项目97中任一项所述的抗体。
99.一种宿主细胞,其包含根据项目98所述的核酸。
100.一种产生抗体的方法,其包括培养根据项目99所述的宿主细胞,从而产生所述抗体。
101.根据项目100所述的方法,其进一步包括从所述宿主细胞回收所述抗体。
102.一种抗体,其通过根据项目100或项目101所述的方法产生。
103.一种免疫缀合物,其包含根据项目1至项目97中任一项所述的抗体,以及细胞毒性剂。
104.一种药物制剂,其包含根据项目1至项目97中任一项所述的抗体,或根据项目103所述的免疫缀合物,和药用载体。
105.一种药物制剂,其包含根据项目104所述的抗体,进一步包含另外的治疗剂。
106.根据项目105所述的药物制剂,其中所述另外的治疗剂选自由以下项组成的组:吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂、JAK抑制剂、IL-11抑制剂和PTX2。
107.根据项目1至项目97中任一项所述的抗体,其用作药物。
108.根据项目1至项目97中任一项所述的抗体,其用于治疗TGFβ相关疾患。
109.根据项目1所述的抗体和根据项目68所述的抗体,其联合用于治疗TGFβ相关疾患。
110.根据项目108或项目109所述的抗体,其中所述TGFβ相关疾患为纤维化。
111.根据项目110所述的抗体,其中所述纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。
112.根据项目1至项目97中任一项所述的抗体用于制造药物的用途,所述药物用于抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成。
113.一种根据项目1至项目97中任一项所述的抗体的用途,其用于制造用于治疗受试者的TGFβ相关疾患的药物。
114.根据项目113所述的用途,其中所述TGFβ相关疾患为纤维化,其中任选地所述纤维化为肺、肝、心、肾、胰腺、眼和/或皮肤的纤维化病症。
115.根据项目1至项目97中任一项所述的抗体用于制造药物的用途,所述药物用于抑制TGFBR依赖性SMAD信号传导、用于抑制TGFβ-TGFBR信号传导复合物的组装、用于抑制通过TGFBR1/R2复合物的TGFβ信号传导、用于抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或用于抑制新胶原合成。
116.一种治疗患有TGFβ相关疾患的受试者的方法,所述方法包括向有此需要的受试者施用有效量的根据项目1至项目97中任一项所述的抗体或向所述受试者施用根据项目104所述的药物制剂。
117.一种用于在受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或抑制新胶原合成的方法,其包括向有此需要的受试者施用有效量的根据项目1至项目97中任一项所述的抗体,以在所述受试者中抑制TGFBR依赖性SMAD信号传导、抑制TGFβ-TGFBR信号传导复合物的组装、抑制通过TGFBR1/R2复合物的TGFβ信号传导、抑制由内皮糖蛋白促进的通过TGFBR2/ALK1复合物的TGFβ信号传导和/或抑制新胶原合成。
118.根据项目116或项目117所述的方法,其进一步包括向所述受试者施用另外的治疗剂。
119.根据项目118所述的方法,其中所述另外的治疗剂选自由以下项组成的组:吡非尼酮、尼达尼布、霉酚酸酯、IL-6抑制剂(例如,托珠单抗、沙利姆单抗)、抗CTFG抗体(例如,FG-3019)、自分泌运动因子抑制剂和PTX2。
120.根据项目116至项目119中任一项所述的方法,其包括向所述受试者施用有效量的根据项目1所述的抗TGFβ3抗体和有效量的根据项目68所述的抗TGFβ2抗体。
121.根据项目116至项目120中任一项所述的方法,其中所述受试者患有TGFβ相关疾患,所述疾患为纤维化。
122.根据项目121所述的方法,其中所述纤维化为选自由以下项所组成的组的肺部纤维化:特发性肺纤维化(IPF)、特发性肺上叶纤维化(Amitani病)、家族性肺纤维化、肺纤维化(例如,继发于全身性炎症性疾病诸如类风湿性关节炎、硬皮病、狼疮、隐原性纤维性肺泡炎、慢性阻塞性肺病(COPD)或慢性哮喘的肺纤维化)、囊性纤维化、非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、硬皮病/全身性硬化症(SSc,包括局限性皮肤(lcSSc)和弥漫性皮肤(dcSSc)形式和SSc相关间质性肺病(SSc-ILD))、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)、过敏性肺炎、肺动脉高压、肺结核、矽肺、石棉肺、急性肺损和急性呼吸窘迫(ARD,包括细菌性肺炎引起的、创伤引起的和病毒性肺炎引起的、呼吸机引起的、非肺脓毒症引起的)。
123.根据项目121所述的方法,其中所述纤维化为选自由以下项所组成的组的肝纤维化病症:肝硬化、先天性肝纤维化、肥胖、脂肪肝、酒精引起的肝纤维化、非酒精性脂肪性肝炎(NASH)、胆管损伤、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)、感染或病毒引起的肝纤维化(例如,慢性乙型和丙型肝炎病毒感染)、囊性纤维化、自身免疫性肝炎、坏死型肝炎、原发性硬化性胆管炎、血色素沉着病、胆道系统疾患和可归因于感染的肝功能障碍。
124.根据项目121所述的方法,其中所述纤维化为选自由以下项所组成的组的心和/或心包膜纤维化病症:心内膜心肌纤维化、心脏同种移植物血管病(CAV)、心肌梗塞、心房纤维化、充血性心力衰竭、动脉硬化、动脉粥样硬化、血管狭窄、心肌炎、充血性心肌病、冠状动脉梗塞、静脉曲张、冠状动脉狭窄和其他缺血后病症、和特发性腹膜后纤维化。
125.根据项目121所述的方法,其中所述纤维化为选自由以下项所组成的组的肾纤维化病症:肾小球性肾炎(包括膜增生性、弥漫性增生性、急进型或硬化性、感染后和慢性形式)、糖尿病性肾小球硬化、局灶性节段性肾小球硬化、IgA肾病、糖尿病性肾病、缺血性肾病、小管间质性肾纤维化、HIV相关肾病、膜肾病、继发于全身性炎症性疾病诸如狼疮、硬皮病和糖尿病性肾小球性肾炎的肾小球性肾炎、特发性膜增生性肾小球性肾炎、系膜增生性肾小球性肾炎、新月体性肾小球肾炎、淀粉样变性(其影响肾及其他组织)、自身免疫性肾炎、肾小管间质性纤维化、肾动脉硬化、Alport综合征、肾病综合征、慢性肾衰竭、慢性肾病、肾小球周围纤维化/无肾小管的肾小球、合并积脓和基底纤维化综合征(积脓/纤维化综合征)、肾小球高血压、肾原性纤维化皮肤病、多囊性肾病、法布里病和肾性高血压。
126.根据项目121所述的方法,其中所述纤维化为选自由以下项所组成的
组的胰腺纤维化病症:基质重塑性胰腺炎和基质纤维化。
127.根据项目121所述的方法,其中所述纤维化为选自由以下项所组成的组的胃肠道纤维化病症:克罗恩病、溃疡性结肠炎、胶原性结肠炎、结直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎。
128.根据项目121所述的方法,其中所述纤维化为选自由以下项所组成的组的纤维化病症:眼纤维化、眼部纤维化、增生性玻璃体视网膜病、任何病因的玻璃体视网膜病、与视网膜功能障碍有关的纤维化、与湿性或干性黄斑变性有关的纤维化、角膜和结膜中的瘢痕、角膜内皮中的纤维化、前囊下白内障和后囊膜混浊、眼前段纤维化疾病、角膜基质纤维化(例如,与角膜混浊有关)、小梁网纤维化(例如,与青光眼有关)、眼后段纤维化疾病、纤维血管瘢痕(例如,在眼的视网膜或脉络膜血管系统中)、视网膜纤维化、视网膜前膜纤维化、视网膜胶质增生、视网膜下纤维化(例如,与年龄相关性黄斑变性有关)、糖尿病性视网膜病中的牵引性视网膜脱离伴组织收缩、先天性眼眶纤维化、泪腺纤维化、角膜上皮下纤维化和格雷夫眼病。
129.根据项目121所述的方法,其中所述纤维化选自由以下导致的纤维
化:脊髓损伤/纤维化或中枢神经系统纤维化诸如卒中后的纤维化、杜氏肌肉营养不良、与神经退行性疾患诸如阿尔茨海默病或多发性硬化有关的纤维化、血管再狭窄、子宫纤维化、子宫内膜异位症、卵巢纤维瘤、佩罗尼氏病、多囊性卵巢综合征、强直性脊柱炎中的疾病相关肺尖纤维化、瘢痕、和由微生物感染(例如,细菌、病毒、寄生虫、真菌)引起的纤维化。
130.根据项目121所述的方法,其中所述纤维化为SSc。
131.根据项目121所述的方法,其中所述纤维化为IPF。
132.根据项目121所述的方法,其中所述纤维化为慢性阻塞性肺病(COPD)。
133.根据项目121所述的方法,其中所述纤维化为进行性纤维化间质性肺
病(PF-ILD)。
134.根据项目133所述的方法,其中所述PF-ILD为选自由以下项所组成的组的疾病或病症:非特异性间质性肺炎(NSIP)、隐原性机化性肺炎(COP)、进行性大块纤维化、煤矿工人尘肺病的并发症、硬皮病/全身性硬化、闭塞性细支气管炎合并机化性肺炎、结缔组织病相关ILD(CT-ILD)和过敏性肺炎。
135.根据项目121所述的方法,其中所述纤维化为肝硬化或慢性肝纤维化。
136.根据项目121所述的方法,其中所述纤维化为胃肠道纤维化,例如,肠纤维化,任选地选自由以下项所组成的组:与克罗恩病、溃疡性结肠炎、胶原性结肠炎、结直肠纤维化、绒毛萎缩、隐窝增生、息肉形成、愈合性胃溃疡和显微镜下结肠炎有关的纤维化。
137.根据项目121所述的方法,其中所述纤维化为眼纤维化病症,源自脊髓损伤、纤维化或中枢神经系统纤维化的纤维化,或与神经退行性疾患有关的纤维化。
138.根据项目116至项目137中任一项所述的方法,其中所述抗体为抗TGFβ2抗体。
139.根据项目138所述的方法,其中所述抗TGFβ2抗体包含:
(a)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:16的氨基酸序列,CDR-H2具有SEQ ID NO:17的氨基酸序列,且CDR-H3具有SEQ ID NO:18的氨基酸序列;和(b)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:19的氨基酸序列,CDR-L2具有SEQ ID NO:20的氨基酸序列,且CDR-L3具有SEQ ID NO:21的氨基酸序列。
140.根据项目116至项目137中任一项所述的方法,其中所述抗体为抗TGFβ3抗体。
141.根据项目140所述的方法,其中所述抗TGFβ3抗体包含:
(a)(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:4的氨基酸序列,CDR-H2具有SEQ ID NO:35的氨基酸序列,且CDR-H3具有SEQ ID NO:6的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:7的氨基酸序列,CDR-L2具有SEQ ID NO:8的氨基酸序列,且CDR-L3具有SEQ ID NO:9的氨基酸序列;
(b)VH/VL对,所述VH/VL对的所述VH包含SEQ ID NO:57的氨基酸序列,并且所述VH/VL对的所述VL包含SEQ ID NO:56的氨基酸序列;或
(c)完整H/L链对,所述H/L链对的所述H链包含SEQ ID NO:79的氨基酸序列,且所述H/L链对的所述L链包含SEQ ID NO:78的氨基酸序列。
142.根据项目116至项目137中任一项所述的方法,其中所述抗体为抗TGFβ2/3抗体。
143.根据项目142所述的方法,其中所述抗TGFβ2/3抗体包含:(i)重链CDR,其包含CDR-H1、CDR-H2和CDR-H3,其中CDR-H1具有SEQ ID NO:10的氨基酸序列,CDR-H2具有SEQ IDNO:11的氨基酸序列,且CDR-H3具有SEQ ID NO:12的氨基酸序列;和(ii)轻链CDR,其包含CDR-L1、CDR-L2和CDR-L3,其中CDR-L1具有SEQ ID NO:13的氨基酸序列,CDR-L2具有SEQ IDNO:14的氨基酸序列,且CDR-L3具有SEQ ID NO:15的氨基酸序列。
144.一种将受试者诊断为患有SSc的方法,所述方法包括检测由PRSS23、PXDN、COL8A1、COL6A3、SERPINE2、TNC、COMP、THBS1、COL11A1、COL1A1、COL5A2、COL1A2、COL4A1、COL4A2、SFRP4、ALPK2、COL5A1和TAGLN所组成的18个基因特征组中所述基因的表达水平,以及如果所述基因的所述水平经确定为相对于健康对照组或参考基因特征中的基因水平是升高的,则将所述受试者诊断为患有SSc。
145.根据项目144所述的方法,其中如果相对于所述健康对照组或参考基因特征的表达增加是统计学显著的,任选地,相对于所述健康对照组或参考基因特征增加至少两倍、或增加至少三倍、或增加至少四倍,则基因水平是升高的。
146.一种监测对使用抗TGFβ2抗体和/或抗TGFβ3抗体对受试者的治疗的应答的方法,所述方法包括确定来自所述受试者的样品中选自由serpine1、col1a1、col1a2和col3a1所组成的组的TGFβ诱导型基因中的一种或多种基因的表达水平,其中所述受试者已经接受所述抗TGFβ2抗体和/或所述抗TGFβ3抗体的一次或多次施用。
147.根据项目146所述的方法,其中如果所述一种或多种TGFβ诱导型基因的所述表达水平与所述一种或多种TGFβ诱导型基因的治疗前水平相比显著减少,则确定所述受试者对使用所述抗TGFβ2抗体和/或抗TGFβ3抗体的治疗有应答,其中任选地所述方法进一步包括,如果所述一种或多种TGFβ诱导型基因的所述表达水平经确定为显著减少,则施用所述抗TGFβ2抗体和/或所述TGFβ3抗体的附加施用。
148.根据项目146或项目147所述的方法,其中向所述受试者施用所述抗TGFβ2抗体作为单一疗法。
149.根据项目146或项目147所述的方法,其中向所述受试者施用所述抗TGFβ3抗体作为单一疗法。
150.根据项目146所述的方法,其中所述一种或多种TGFβ诱导型基因的所述表达水平通过qPCR或微阵列分析进行确定。
151.根据项目98至项目150中任一项所述的方法或用途,其中所述受试者为人。
152.一种试剂盒,其包括根据项目1至项目97中任一项所述的抗体。
IV.实例
以下是本发明的方法和组合物的实例。应当理解,在给出以上提供的一般描述的情况下,可以实践各种其他实施方案。
实例1:同种型选择性TGFβ抗体的生成和筛选
材料和方法:
兔抗人TGFβ单克隆抗体的生成
用人TGFβ2和TGFβ3同种型(Peprotech)对新西兰白兔进行免疫,并使用与已发表文献相关的修改方案分离单个B细胞(Offner等人PLoS ONE 9(2),2014)。简而言之,通过使用
大鼠抗人TGFβ杂交瘤抗体的开发
Sprague Dawley大鼠(Charles River,Hollister,CA)每两周用100μg人TGFβ2或TGFβ3蛋白(Peprotech)进行免疫,将该蛋白质与RIBI佐剂(Sigmal,St.Louis,MO)混合并在尾巴根部注射,或与不完全弗氏佐剂(BD)混合并分布在多个部位:I.P.、尾巴根部S.C.、颈背s.c.和两个后踝s.c.。在最后一次免疫后三天收获多个淋巴结。使用磁分离(MiltenyiBiotec,San Diego,CA)从淋巴细胞中纯化来自这些大鼠的IgM阴性B细胞,并经由电融合(Harvard Apparatus)与Sp2ab小鼠骨髓瘤细胞(Enzo Life Sciences)进行融合。融合细胞在37℃、7%CO2下在培养基C(StemCell Technologies,Vancouver,BC,Canada)中孵育过夜,然后铺板至含有以HAT(Sigma-Aldrich,St.Louis,MO)补充的培养基E(StemCellTechnologies,Vancouver,BC,Canada)的6孔板中,并在37℃、7%CO2下孵育三天。收集TGFβ2杂交瘤并用抗大鼠IgG(Sigma-Aldrich)分选,TGFβ3杂交瘤用抗大鼠IgG(Sigma-Aldrich)和标记的人TGFβ3-PE通过Lightning-Link R-PE抗体标记试剂盒(Novus,Centennial,CO)进行分选。
基于HEKBlue细胞的TGFβ阻断测定
使用在与三个Smad3/4结合元件(SBE)融合的β-珠蛋白最小启动子的控制下稳定地表达人TGFβRI、Smad3、Smad4蛋白和分泌的碱性磷酸酶(SEAP)报告基因的HEK-Blue
ELISA筛选
酶联免疫吸附测定法(ELISA)用于筛选候选克隆物与TGFβ1、TGFβ2和TGFβ3的结合。首先,用包被缓冲液(50mM碳酸盐,pH 9.6)将每种TGFβ同种型(Peprotech)以1μg/ml固定到Grenier Bio-One 384孔ELISA板的孔中;μ50L/孔,在4℃孵育过夜。然后用每孔100μl的ELISA稀释缓冲液(PBS/0.5%Tween20)洗涤包被的ELISA板3次。接着用100μl/孔的ELISA稀释缓冲液封闭ELISA板一小时。封闭后,丢弃缓冲液,将样品和对照从96孔板添加到384孔板(50μl/孔)。然后将具有样品的ELISA板在室温孵育30分钟,同时将板在振荡器上摇动。接着用100ul/wee的洗涤缓冲液(PBS/0.05%TWEEN 20、20X Stock Hyclone SH3A649-01)洗涤板三次。然后将稀释的HRP缀合物(过氧化物酶AffiniPure山羊抗大鼠IgG(H+L)JacksonImmunoResearch Laboratories,INC.112-035-003以1:10000稀释,50μl/孔)添加到每个孔中,并将ELISA板在室温孵育30分钟。孵育后,将板用洗涤缓冲液(100μl/孔)洗涤3次,然后添加底物(BIOFX TMB Substrate TMBW-1000-01,50μl/孔)。在室温孵育5分钟,5分钟后,添加终止溶液(BIOFX终止试剂LBSP-1000-01,50μl/孔)。最后,在659nm处读取板的吸光度。
结果:
针对结合经由直接ELISA和表面等离子体共振(SPR),并且针对它们在报告细胞系(HEKBlue SMAD2/3SEAP报告基因)中抑制成熟受体结合结构域诱导的TGFβR依赖性信号传导的能力,筛选从用人TGFβ1、TGFβ2和TGFβ3的成熟受体结合结构域免疫的大鼠和兔生成的单克隆抗体,如上所述。在表现出与TGFβ2结合的96种初始兔克隆物和与TGFβ3结合的85种克隆物中,选择48种克隆物进行进一步筛选。对于兔抗体,使用FACSAria Fusion分选器(BDBiosciences,Franklin Lakes,NJ)将1,995个IgG+TGFβ2杂交瘤和2,660个IgG+TGFβ3+杂交瘤经单细胞分选到96孔板中。铺板后七天,通过针对人TGFβ2或TGFβ3蛋白的ELISA筛选上清液。从28个TGFβ2和48个TGFβ3杂交瘤收获通过ELISA证明与它们各自的抗原结合的上清液,并通过蛋白G(GammaBind Plus,GE Healthcare,Pittsburgh,PA)进行纯化。在28种TGFβ2+克隆物中,4种显示出针对TGFβ2的功能性阻断(包括6F12)。在48种TGFβ3+克隆物中,28种克隆物显示出针对人TGFβ3的功能性阻断(包括2A10)。
将潜在抑制性抗体(K
这些抗体对选定的TGFβ同种型的相对效力与“泛TGFβ”抗体1D11的活性相当或更高(Dasch,JR等人J.Immunol.142:1536-41(1989))(见下表4)。值得注意的是,TGFβ2特异性抗体6F12在阻断细胞中TGFβ2依赖性报告基因活性方面的效力为1D11的近100倍(IC
此外,人和小鼠成熟TGFβ2之间存在三个氨基酸差异,并且6F12和4A11以相似的亲和力与两种肽结合(图S5A)并且对两者具有相似的抑制效力(图55)。
表4:同种型选择性TGFβ抗体的效力
单克隆抗体的序列在下表5至7中提供。
表5:抗TGFβ同种型选择性单克隆抗体的CDR序列
/>
表6:同种型选择性抗TGFβ单克隆抗体的重链和轻链可变区序列
表7:同种型选择性抗TGFβ单克隆抗体的完整重链和轻链序列
/>
实例2:使用同种型选择性抗TGFβ单克隆抗体抑制TGFβ2和TGFβ3的不同毒性特征
TGFβ2和TGFβ3的组成性种系敲除由于发育缺陷(包括两者中的腭裂和TGFβ2敲除中的心血管缺陷)而无法在围产期存活,并且如上所述,泛TGFβ抑制剂具有显著的毒性。为了评估抑制TGFβ2、TGFβ3或两者的潜在毒性,使用6F12、2A10和4A11执行4周的毒理学研究,如下所示:
TGFb3(2A10):
在先导性毒理学研究中,每周三次(TIW)向CD-1小鼠施用2A10mAb,持续4周(总计12个剂量),剂量为0(对照)、10和50mg/kg I.P.TIW和50mg/kg I.V.TIW,在由磷酸盐缓冲盐水组成的媒介物中。将雄性和雌性(n=5/性别/组)分配到所有剂量水平的毒性组,并安排在给药期结束时(第29天)进行尸检。从对照组(n=6只雄性/组)和2A10 mAb治疗组(n=9只雄性/组)中的其他小鼠收集用于毒代动力学评价的血液。评价标准包括以下参数:临床观察、体重、临床病理学(血液学和临床化学)、解剖病理学和毒代动力学。
随着剂量从10增加到50mg/kg,2A10 AUC暴露量大约与剂量成比例增加。
所有动物都存活到安排的尸检,并且没有与2A10相关的临床观察、对体重的影响或临床病理学变化。归因于2A10的发现仅限于在高剂量的一部分小鼠(50mg/kg下的6只小鼠)中观察到的骺板发育不良。总之,以10和50mg/kg TIW向CD-1小鼠施用2A10 mAb持续4周具有良好的耐受性,并且与2A10相关的发现是在高剂量下的有限骨骺发育不良。
TGFb2(6F12):
在先导性毒理学研究中,每周三次(TIW)向CD-1小鼠施用6F12mAb,持续4周(总计12个剂量),剂量为0(对照)、10和50mg/kg I.P.,在由磷酸盐缓冲盐水组成的媒介物中。将雄性和雌性(n=5/性别/组)分配到所有剂量水平的毒性组,并安排在给药期结束时(第29天)进行尸检。从6F12 mAb治疗组(n=9只雄性/组)中的其他小鼠收集用于毒代动力学评价的血液。评价标准包括以下参数:临床观察、体重、临床病理学(血液学和临床化学)、解剖病理学和毒代动力学。
随着剂量从10增加到50mg/kg,6F12 AUC暴露量大约与剂量成比例增加。
所有动物在10mg/kg下存活到安排的尸检,并且在10和50mg/kg下没有与6F12相关的临床观察。
在10和50mg/kg下的6F12相关发现包括雌性中性粒细胞和淋巴细胞的最低限度至轻度增加,其组织病理学与指示慢性炎症的腹膜炎症相关,以及与组织病理学无关的ALT和AST增加。在50mg/kg下的其他6F12相关发现包括毒代动力学组中3只小鼠的早期安乐死,原因是体重下降超过20%(在第8天观察到),以及两种性别的球蛋白的最低限度至轻度增加伴相对应的白蛋白与球蛋白的比率降低。毒性组中的所有小鼠都在第29天进行了安排的尸检,并且没有观察到体重变化。
总之,以10和50mg/kg TIW向CD-1小鼠施用6F12 mAb持续4周,在10和50mg/kg下观察到与慢性炎症一致的结果。
TGFb2/3(4A11):
在先导性毒理学研究中,每周三次(TIW)向CD-1小鼠施用4A11mAb,持续4周(总计12个剂量),剂量为0(对照)、10和50mg/kg I.P.和50mg/kg I.V.,在由磷酸盐缓冲盐水组成的媒介物中。将雄性和雌性(n=5/性别/组)分配到所有剂量水平的毒性组,并安排在给药期结束时(第29天)进行尸检。从对照组(n=6只雄性/组)和4A11 mAb治疗组(n=9只雄性/组)中的其他小鼠收集用于毒代动力学评价的血液。评价标准包括以下参数:临床观察、体重、临床病理学(血液学和临床化学)、解剖病理学和毒代动力学。
10和50mg/kg下的关键毒理学发现包括3只小鼠死亡(在10mg/kg下1只,且在50mg/kg下2只)和腹股沟/阴囊疝。在50mg/kg下的其他关键发现包括后肢功能损失的临床观察,直肠周围浆膜出血和血腹的病理学发现,动脉周围炎/动脉炎以及心血管(升主动脉和心肌)系统中的壁和间质出血,以及骨骼肌的退化和坏死。
总之,以10和50mg/kg TIW向CD-1小鼠施用4A11 mAb持续4周,导致在10和50mg/kg下的死亡以及在所有剂量下的疝气和在50mg/kg下的心血管系统中的不良病理学发现。
毒物发现总结在下表8中。
表8:毒理学研究结果
实例3:用抗TGFβ单克隆抗体进行的鼠PK研究
材料和方法:
抗TGFβ抗体的Fab区与具有LALA-PG突变的小鼠IgG2a的Fc区融合,以减弱体内小鼠研究的效应子功能(参见Lo,M.等人Journal of Biological Chemistry 292,3900–3908(2017);Schlothauer,T.等人Protein Engineering Design and Selection 29,457–466(2016))。
结果:
抗TGFβ抗体的Fab区与具有LALA-PG突变的小鼠IgG2a的Fc区融合,以减弱体内小鼠研究的效应子功能。在C57/B6小鼠单剂量药代动力学研究中,这些嵌合抗体表现出线性药代动力学,具有剂量依赖性积累,没有抗药物抗体形成的证据。具有最大体外效力的抗体(6F12(抗TGFβ2);2A10(抗TGFβ3);和4A11(双特异性抗TGFβ2/3))均表现出约95%的体内生物利用度和约4mL/天/kg的清除率,而16C10是一种效力稍弱的抗TGFβ3抗体,其表现出约2mL/天/kg的清除率(图2)。
实例4:人纤维化组织中TGFβ2和TGFβ3表达水平是升高的,并且TGFβ3表达与IPF和SSc中的TGFβR信号传导高度相关
材料和方法:
组织分离(IPF)和RNA分析
先前描述了人组织的RNA分析(Depianto,DJ,等人Thorax.2015Jan;70(1):48-56;Chandriani,S,等人J Immunol.2014Jul 1;193(1):111-9)。简而言之,在活检或肺移植时,在加利福尼亚大学旧金山肺中心从患有IPF的患者获得人组织。未患病的正常肺组织取自北加州移植供体网络未使用的肺。从速冻肺样品中分离RNA。按照制造商的建议(Agilent,Santa Clara,CA)进行微阵列分析。
SSc皮肤相关TGFβ基因集和特征评分的推导:
通过对用5ng/ml人TGFβ1(RnD系统)或对照培养基刺激24小时的原代人肺成纤维细胞进行RNA测序来鉴定TGFβ应答基因。测序数据使用R编程语言和来自Bioconductor项目的程序包(参见万维网bioconductor.org)进行处理,以在基因水平上将其表达为每千碱基每百万读段的归一化读段(nRPKM)。从NCBI Gene Expression Omnibus下载先导SSc和正常对照皮肤活检微阵列数据集(GSE58095)。为了鉴定在SSc皮肤中是上调的并可能归因于成纤维细胞中的TGFβ活性的一组基因,进行了4向比较,对比了在体外显著失调的基因(通过TGFβ增加≥4倍)和SSc与HC中的基因(在疾病中的≥50%增加)。该候选基因集如图5B所示。该基因集在来自FaSScinate皮肤活检的微阵列数据集中进行了评价(参见Khanna等人(2016)The Lancet;vol.387:10038,p.2630-2640,用于描述FaSSCinate研究),并修剪为18个基因的核心特征组,如上表2所示,使得所有基因对第一主成分具有均匀的贡献(对于PC1加载,>0.7)。使用第一主成分加载为该基因集定义了复合基因表达评分,以将每个受试者的18个基因特征的聚集表达减少为单一连续变量。
ScRNAseq
人肺组织的制备:
通过多学科讨论和临床材料审查,从病理诊断为普通型间质性肺炎和IPF临床共识诊断的患者中获得外植的肺组织。支气管肺泡灌洗后,将新鲜的肺外植体组织在湿冰上的完全培养基中储存过夜。组织在HBSS中洗涤,然后在消化缓冲液(HBSS、2.5mg/mL胶原酶D、100μg/mL DNase)中彻底切碎。将切碎的组织在37℃摇动45分钟。将剩余的组织材料转移到新鲜的消化缓冲液中,并在37℃再摇动45分钟。将来自两轮消化的单个细胞合并并用于下游分析。使用gentleMACS解离器(Miltenyi Biotec)处理剩余的组织以将额外的细胞释放到单细胞悬浮液中。然后将该制备物过滤并添加到先前分离的细胞中。
细胞群的FACS分离:
确定细胞总数并将其重新悬浮在适当体积的以2mM EDTA和2%胎牛血清(FBS)补充的1x PBS中。根据制造商的方案,使用Miltenyi Biotec FcR阻断试剂进行FcR阻断。然后将细胞用包括CD45-BUV395、EPCAM-PE、CD31-BV605和Live/Dead-Efluor 780在内的抗体混合物在冰上染色30分钟,然后用补充的PBS缓冲液洗涤3次。为下游scRNA-seq收集了5个细胞群:未分选的活细胞、CD45
单细胞RNA-seq:
根据制造商的用户指南(10x Genomics),使用Chromium单细胞3'文库和凝胶珠试剂盒v2在10x Genomics平台上进行单细胞RNA-seq。利用细胞密度估算逆转录(RT)主混合物所需的单细胞悬液的体积,目的是使每个样品达到约6,000个细胞。cDNA和文库遵循制造商的用户指南(10x Genomics)制备。通过Bioanalyzer高灵敏度DNA试剂盒(AgilentTechnologies)对文库进行分析,并使用Kapa文库定量试剂盒(Kapa Biosystems)进行定量。每个文库都按照制造商的测序规范(10x Genomics)在HiSeq4000(Illumina)的一个泳道中进行测序。
测序数据的处理:
Cell Ranger v2.1.0(10X Genomics,Pleasanton CA)用于将原始测序读段与GRCh38人类参考比对、计数基因特征、过滤空液滴、聚类细胞和鉴定聚类标记基因。使用Loupe Cell Browser v3.1(10X Genomics,Pleasanton CA)对Cell Ranger的tSNE结果进行可视化。
pSMAD3的免疫组织化学和TGFβ3的原位杂交
使用兔单克隆抗体(EP823Y,0.76μg/ml;Abcam)在福尔马林固定的石蜡包埋切片上进行phoshpho-SMAD3的免疫组织化学。简而言之,切片去蜡并用于在自动染色平台(BondRX;Leica Biosystems)上使用用于抗原修复的专有试剂(ER2;Leica Biosystems)进行免疫组织化学分析,检测结合的一抗(抗兔PowerVision polymer-HR;Leica Biosystems)。使用DAB将信号可视化。
血清骨膜蛋白和COMP水平的定量
通过标准静脉穿刺技术从患者和25名年龄和性别匹配的健康对照中采集全血到血清分离管中,使其凝结30分钟,然后在4℃离心10分钟。收集血清并储存在-70℃直至分析。使用基于IMPACT的特异性免疫测定法(罗氏诊断公司,Penzberg,Germany)测定软骨寡聚基质蛋白(COMP)水平。简而言之,样品与包被有生物素化COMP F(ab')2抗体片段的IMPACT芯片一起孵育。在洗涤步骤之后,添加标记有地高辛的生物标志物特异性检测抗体并孵育。洗涤后,添加荧光抗地高辛-胶乳偶联物,用电荷耦合检测相机检测特异性结合的荧光标记。使用由重组蛋白标准品(R&D Systems,Minneapolis,MN,USA)构成的标准曲线和专用软件(Roche Diagnostics)将发射的荧光转化为信号强度。对于COMP的灵敏度为0·25ng/mL。骨膜蛋白血清水平使用Elecsys(罗氏诊断公司)骨膜蛋白免疫测定的临床试验版本确定的,该方法旨在用于cobas e601(罗氏诊断公司)。
结果:
在来自患有特发性肺纤维化(IPF)的患者的大量肺活检样品的qPCR分析中,TGFβ3和TGFβ2(在较小程度上)以与对照肺相比显著更高的水平表达,而TGFβ1在IPF中的平均表达与对照相比略低(图3A)。免疫组织化学分析显示,与对照相比,IPF组织中的核磷酸化SMAD2/3染色大量增加,特别是在成纤维细胞病灶中,该病灶是活化的成纤维细胞和肌成纤维细胞区,这些区是普通型间质性肺炎(UIP,IPF标志)的组织学诊断的示病性区(图3B)。由于大体积IPF肺组织中基因表达的差异可能反映样品的细胞学组成,因此接下来试图使用单细胞RNA测序(scRNAseq)在单细胞基础上表征TGFβ同种型的细胞来源。来自IPF肺的scRNAseq数据的全球基因表达模式区分了多个细胞谱系,包括造血细胞(巨噬细胞、淋巴细胞、浆母细胞、肥大细胞)、上皮细胞(AEC2和基底、纤毛和分泌性支气管上皮细胞)、间充质细胞(成纤维细胞、肌成纤维细胞、平滑肌)和血管(内皮)细胞类型。
TGFβ1广泛地表达,在造血细胞、内皮细胞和肌成纤维细胞中表达水平最高。TGFβ2受到更多限制,主要在上皮源性细胞中检测到。TGFβ3表达高度局限于间充质细胞(成纤维细胞、肌成纤维细胞和平滑肌细胞)。TGFβR依赖性靶基因的表达显示出不同的模式,SERPINE1在成纤维细胞、巨噬细胞和内皮细胞中表达,骨膜蛋白(POSTN)在肌成纤维细胞和内皮细胞中表达,而COL1A1和COMP在肌成纤维细胞中表达,很大程度上与TGFβ3重叠(图4A)。pSMAD3的双重免疫组织化学分析和TGFβ3的原位杂交显示成纤维细胞病灶中的许多肌成纤维细胞共表达TGFβ3和核pSMAD3(图4B),这表明在UIP病灶中,TGFβ3可能以自分泌或旁分泌方式驱动TGFβR依赖性信号传导。
在FaSScinate试验的基线皮肤活检中,与健康对照组相比,SSc患者的TGFβ3表达显著上调,而TGFβ1和TGFβ2水平相当(图5A)。为了评估TGFβ信号传导对SSc皮肤中差异表达基因的潜在贡献,我们得出了一个基因集,该基因集既可归因于成纤维细胞对TGFβ信号传导的应答,又可归因于SSc皮肤中的失调。鉴于已知存在于来自SSc患者的皮肤活检中的基因表达谱存在显著的异质性,假设在任何给定时间,只有SSc队列中的一个子集会表现出高TGFβ活性谱。
使用18个基因TGFβ特征,对SSc患者进行k均值聚类,并确定了两个聚类:一个“TGFβ-高”聚类,该聚类的许多基因成员表现出较高的表达水平,一个“TGFβ-低”聚类,其中基因集的大多数成员都记录了较低的表达值。
TGFβ3表达与TGFβ诱导型特征呈强烈正相关(Spearmanρ=0.92,p<0.0001),而其他两种TGFβ同种型与评分无关(图6A和图6B)。
TGFβ诱导型皮肤基因特征也与编码可溶性分泌ECM成分POSTN和COMP的两个基因的表达水平高度相关。POSTN和COMP是由这些基因编码的蛋白质,可在外周血清中作为可溶性生物标志物检测到,并且它们的水平与同时采集的血液样品中的皮肤活检TGFβ基因特征显著相关(图6B)。此外,血清骨膜蛋白和COMP水平与改良Rodnan皮肤评分(MRSS)显著相关,MRSS是SSc试验中使用的全身性皮肤纤维化的临床指标(图6C)。为了评估皮肤TGFβ活性与疾病进展之间的关系,评估了48周研究进程中MRSS的变化,发现与TGFβ特征“低”患者相比,TGFβ特征“高”患者改善的可能性较小,无论治疗分配如何(托珠单抗与安慰剂在研究中的MRSS结果测量方面没有显著益处;图7)。总之,这些数据表明,孤立的皮肤活检中TGFβ3的表达和信号传导活动反映了SSc的总体疾病负担和预后。因此,这些数据支持TGFβ3抑制作为治疗IPF和SSc的靶标,以及使用血清骨膜蛋白和COMP蛋白水平或组织TGFβ特征基因表达水平作为TGFβ3活性的生物标志物。
实例5:同种型选择性抗TGFβ2和TGFβ3抗体在肺纤维化模型中的体内活性
材料和方法:
博来霉素滴注
对于博来霉素研究,在研究前将成年小鼠(>12周)根据其体重随机分组,以尽量减少实验组与对照组之间的差异。对于气管内(I.T.)给药,所有小鼠在诱导室中用异氟醚轻轻麻醉。一旦麻醉,将动物从腔室中取出,手动约束,张开动物的嘴并将舌头放在一边。将装有50微升无菌可注射等渗盐水或博来霉素(0.70U/kg(DNC#0703-3155-01;TEVA)的50μl无菌等渗盐水)的1ml注射器连接到24号管饲针。将管饲针插入气管,并在气管内输送一定剂量的媒介物或博来霉素。递送后,对动物进行连续监测,直至完全清醒并能走动。
对于促纤维化基因表达分析,在博来霉素递送后14天获取动物。从整个小鼠肺中采集RNA,并通过RT-qPCR确定基因表达。
为了测量肺中的胶原蛋白沉积,在博来霉素施用后24天获取小鼠。氘代水标记用于评估研究中的新胶原蛋白合成(Blaauboer ME,等人Matrix Biol.2013;32(7-8):424-31。)。在我们的研究中,在博来霉素递送后第9天开始标记,I.P.注射氘化水(Cat#DLM-4-99.8-1000;Cambridge Isotope Laboratories)35ml/kg,分2次注射,间隔4小时。之后,将饮用水中8%的氘化水随意提供在水瓶中,直到研究结束。
如前所述分析氘化水并入羟脯氨酸中(Gardner JL,等人Am J PhysiolGastrointest Liver Physiol.2007;292(6):G1695-705)。质谱和分析通过代谢溶液进行。新的羟脯氨酸含量表示为“μg/肺”。
基因表达
博莱霉素诱导的小鼠肺纤维化模型中的基因表达分析是通过分析已发布的数据集进行的,该数据集可以通过GEO系列登录号GSE37635访问(参见万维网ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE37635)(另见Blaauboer,2013,MatrixBiol 32,424-431)。
RNA测序
为了在小鼠博莱霉素模型中对不同肺细胞群进行RNAseq研究,在博莱霉素施用后第14天收获小鼠全肺。生理盐水对照组5只,博来霉素组8只。按照我们之前发布的方案(SunT等人,2019,JCI Insight;Jun 18;5(14):e128674)在蛋白酶消化后分离单细胞。洗涤后,用纯化的大鼠抗小鼠CD16/CD32抗体(Cat#553142;BD Biosciences)封闭细胞,并用CD45(Cat#17-0451-82,eBioscience)、EpCAM(Cat#11-5791-82,eBioscience)和CD31(Cat#25-0311-82,eBioscience)染色。基于细胞表面标志物对来自每只小鼠的四个细胞群进行分类:白细胞(CD45
条件性敲除
两个靶向构建体分别靶向Tgfb2或Tgfb3基因座中的外显子6s。Adeno-FLP用于处理阳性ES克隆物以去除ES细胞阶段的PGK新霉素选择标志物。创建了两个loxP位点,位于其各自cKO小鼠中TGFβ2或β3基因座的外显子6侧翼。
qPCR
从他莫昔芬治疗的小鼠中分离出肺基因组DNA,并通过定量PCR(与Tert)进行评价。外显子3位于floxed基因座之外并用作实验对照。
结果:
气管内(I.T.)博莱霉素攻击是一种常用的肺纤维化体内啮齿动物模型。博来霉素选择性地损伤肺泡上皮细胞,引发先天免疫应答,随后成纤维细胞分化为肌成纤维细胞和ECM沉积。与慢性进行性疾病诸如IPF不同,博来霉素模型具有特定的阶段:损伤、炎症、纤维化以及在年轻动物中的消退。为了确定TGFβ同种型表达在该模型中是否相关以及在哪个阶段相关,在i.t.博来霉素滴注后的不同时间点评估小鼠的肺基因表达。
为了评估该模型中TGFβ同种型表达的动力学,基于已发表的转录组数据集(Blaauboer,出处同上),在i.t.博来霉素滴注后的不同时间点评估小鼠的肺基因表达。虽然Tgfb1在博来霉素攻击小鼠中的表达在任何时间点均未显著升高,实际上在第21天和第28天略有下降,但在攻击后第7天和第14天博莱霉素滴注后,Tgfb2和Tgfb3表达显著增加(图8A、图8B、图8C)。这种模式与诱导与纤维化和TGFβ信号传导相关的基因诸如Serpine1、Fn1和Col1a1有很好的重叠(图8D、图8E、图8F)。
在模型的纤维化期间Tgfb2和Tgfb3的显著上调与在IPF肺中观察到的表达模式一致(图3A)。为了进一步表征该模型中负责每种TGFβ同种型表达的特定细胞类型,在博莱霉素施用后第14天,当多个纤维化相关基因达到峰值时,对分选的肺细胞群进行RNAseq。与来自人类IPF肺组织的scRNAseq数据一致(图4A),白细胞(CD45
由于Tgfb2或Tgfb3的组成性缺失导致胚胎或围产期致死,这些基因的诱导型敲除通过分别在Tgfb2(Tgfb2
在模型的“纤维化”期间,TGFβ2和TGFβ3的显著上调反映了在IPF肺中观察到的同种型分布。因此,优先考虑在第14天的TGFβR诱导的靶基因表达和在第24天的胶原蛋白积累作为在研究过程中用抗TGFβ抗体进行预防性治疗的关键读数,以评估它们的体内活性和效力(示意图,图9A)。
当每周三次以10mg/kg给药时,用6F12对TGFβ2的单一抑制、用2A10对TGFβ3的单一抑制、或用6F12+2A10的组合或用4A11的单一疗法对两者的抑制减少新的胶原合成,这反映在博莱霉素后第9至23天在饮用水中施用D
实例6:抗TGFβ3mAb 2A10的人源化
材料和方法:
通过BIAcore进行抗体亲和力测量
对于所有人源化2A10抗体的结合亲和力确定,使用BIAcoreTM-T200仪器进行表面等离子体共振(SPR)测量。简而言之,首先应用带有蛋白A的S系列CM5生物传感器芯片来捕获每种人源化2A10变体,以在每个流动池上实现大约100个应答单位(RU),然后在25℃以50μl/min的流速注射人TGFβ1、TGFβ2或TGFβ3在HBS-EP缓冲液(0.01M HEPES pH7.4、0.15MNaCl、3mM EDTA和0.05%v/v表面活性剂P20)中的3倍系列稀释液(0.02nM至5nM),用于动力学测量。缔合率(k
基于HEKBlue细胞的TGFβ阻断测定
使用在与三个Smad3/4结合元件(SBE)融合的β-珠蛋白最小启动子的控制下稳定地表达人TGFβRI、Smad3、Smad4蛋白和分泌的碱性磷酸酶(SEAP)报告基因的HEK-Blue
结果:
2A10的人源化:
2A10人源化步骤1:大鼠2A10 CDR移植到人类框架中:
如下所述将单克隆抗体2A10人源化。残基编号是根据Kabat等人(Sequences ofproteins of immunological interest,第5版,Public Health Service,NationalInstitutes of Health,Bethesda,MD(1991))进行。对于2A10抗体人源化,将来自大鼠2A10(r2A10)抗体的高变区工程改造到人种系IGKV1D-39和IGHV3-49受体框架中,以生成人源化2A10版本1(h2A10.v1)和人种系IGKV1D-39,以及工程改造到IGHV3-23受体框架中以生成人源化2A10版本2(h2A10.v2)。具体而言,从r2A10轻链可变结构域(VL),将位置24至34(L1)、50至56(L2)和89至97(L3)移植到IGKV1D-39中。从r2A10重链可变结构域(VH),将位置26至35(H1)、50至65(H2)和95至102(H3)分别移植到IGHV3-49和IGHV3-23中。
此外,保留h2A10.v1中的来自大鼠序列VL的框架I中的位置4、框架II中的位置38和43以及框架III中的位置58,和VH中的框架II中的位置47和49位以及框架III中的位置78。与h2A10.v1一样,也保留h2A10.v2中的来自大鼠序列的VH的框架III中的两个额外位置(73和76)。发现那些残基是充当“游标”区域的框架残基的一部分,其可以调整CDR结构并微调抗原拟合。参见例如,Foote和Winter,J.Mol.Biol.224:487-499(1992)。这些CDR定义包括由它们的序列超变性定义的位置(Wu,T.T.&Kabat,E.A.(1970))、它们的结构定位(Chothia,C.&Lesk,A.M.(1987))以及它们参与抗原-抗体接触(MacCallum等人J.Mol.Biol.262:732-745(1996))。
两种主要的人源化版本都在BIAcore中进行人TGFβ同种型结合,且结果表明h2A10.v2在保留人TGFβ3结合方面相较于r2A10与h2A10.v1更具可比性(表9)。有趣的是,在人源化后,与r2A10相比,两种人源化版本都显示出人TGFβ2结合下降。
2A10人源化步骤2:框架补平:
在人源化2A10框架补平中,通过用来自种系序列的相对应人残基取代人源化2A10在游标区域的每个大鼠残基,生成更多人源化2A10变体。然后通过BIAcore中的人TGFβ同种型结合和HEKBlue中的阻断效力评价每种变体,以阐明其重要性。
在h2A10.v1中,这些框架补平变体为h2A10.v1.1(VL:L4M),h2A10.v1.2(VL:H38Q),h2A10.v1.3(VL:Q43A),h2A10.v1.4(VL:I58V),h2A10.v1.5(VH:L47W),h2A10.v1.6(VH:A49G),h2A10.v1.7(VH:V78A)(表9)。在纯化过程中,h2A10.v1中的一些框架补平变体往往具有表达(h2A10.v1.1)和聚集(对于h2A10.v1.3、h2A10.v1.4、h2A10.v1.6,单体<95%)问题。因此,决定使用h2A10.v2变体推进研究。
在h2A10.v2中,这些框架补平变体为h2A10.v2.1(VL:L4M),h2A10.v2.2(VL:H38Q),h2A10.v2.3(VL:Q43A),h2A10.v2.4(VL:I58V),h2A10.v2.5(VH:L47W),h2A10.v2.6(VH:A49S),h2A10.v2.7(VH:D73N),h2A10.v2.8(VH:S76N),h2A10.v2.9(VH:V78L)。与h2A10.v1变体不同,所有h2A10.v2变体均在纯化过程中表达并表现良好(单体>99%)。在BIAcore结合研究中,大多数变体似乎与亲本h2A10.v2相同,除了h2A10.v2.1(VL:L4M)和h2A10.v2.7(VH:D73N)变体在TGFβ3结合方面略有下降(2至3倍)且h2A10.v2.5(VH:L47W)变体在TGFβ3结合方面的下降更为剧烈(385倍)(表9)。令人惊讶的是,在细胞HEKBlue TGFβ阻断研究中,h2A10.v2.5(VH:L47W)和h2A10.v2.7(VH:D73N)显示TGFβ3阻断的显著损失(>10倍),但h2A10.v2.1(VL:L4M没有这种效应)(表9)。总体而言,已确定h2A10.v2的游标区域的所有大鼠残基都可以用人种系残基替换,除了VL的框架I中的位置4、框架II中的位置47以及VH的框架III中的位置73。
表9:h2A10.v1和h2A10.v2框架补平变体特征汇总
2A10人源化步骤3:固定CDR-H2N-联糖基化位点(N
在h2A10.v2中,CDR-H2中潜在的N-联糖基化位点(
表10:h2A10.v2 CDR-H2 N
2A10人源化步骤4:最终版本生成
通过结合框架补平和CDR-H2 N-联糖基化位点修复的结果,基于h2A10.v2的进一步工程化改造生成了最终的两个人源化2A10版本h2A10.v3和h2A10.v4。两个版本都在r2A10的VL框架I的位置4处保留了L,在框架II的位置47处保留了L,在VH的框架III的位置73处保留了D。游标区域处源自r2A10的其他六个框架残基变为相对应的人种系残基,即VL的框架II中位置38处的Q和位置43处的A、框架III中位置58处的V以及VH的框架II中位置49处的S、框架III中位置76处的N和位置78处的L。两个版本之间的唯一区别在于CDR-H2 N-联糖基化位点,即h2A10.v3中的
总体而言,2A10的人源化过程非常具有挑战性。源自大鼠的2A10人源化的挑战包括在第1步(将2A10 CDR移植到最接近的人VH/VL框架配对上)的抗体表达的意外困难以及在框架补平的第2步中变体的稳定性问题(参见图10、图11)。
表11:h2A10.v3和h2A10.v4表征汇总
人源化2A10抗体变体的序列(选择变体、可变区和完整序列的CDR)显示在下表12、表13和表14中,且序列比对显示在图12、图13、图14、图15和图16中。
表12:人源化2A10变体的重链和轻链CDR氨基酸序列
表13:人源化2A10变体的重链和轻链可变区氨基酸序列
/>
/>
/>
表14:人源化2A10变体的完整重链和轻链序列
/>
/>
/>
/>
/>
/>
/>
实例7:2A10人源化变体的食蟹猴PK研究
材料和方法:
将八只初次参与实验的雌性食蟹猴(Macaca fascicularis,柬埔寨起源)被分配到两组中的一组(n=4只/组)。在研究开始时(第-1天),动物大约4岁,体重大约2.5-4kg,只有看起来健康且没有明显异常的动物用于研究。第1组或第2组中的动物分别接受单次10mg/kg I.V.推注抗TGFβ3h2A10.v3或h2A10.v4。剂量通过前臂的头静脉施用。在给药后直至43天的各个时间点,收集血清样品(每个时间点,n=4)并通过ELISA方法分析血清测试品浓度。
通过ELISA方法确定给药10mg/kg抗TGFβ3变体h2A10.v3和h2A10.v4的动物的血清浓度。用稀释在包被缓冲液(0.05M碳酸盐/碳酸氢盐缓冲液pH 9.6)中的0.5μg/mL绵羊抗人IgG抗体(Binding Site,San Diego,CA,USA)包被384孔板,并在4℃孵育过夜。用洗涤缓冲液(PBS缓冲液中的0.5%Tween-20,pH 7.4)洗涤板3次,并在室温(RT)用封闭缓冲液(PBS/0.5%BSA/15ppm Proclin,pH 7.4)处理1至2小时。将板再次用洗涤缓冲液洗涤3次,然后将用样品稀释剂(PBS/0.5%BSA/0.05%Tween 20/5mM EDTA/0.25%CHAPS/0.35M NaCl/15ppm Proclin,pH 7.4)稀释的样品添加至孔并在RT孵育2小时。次日,用洗涤缓冲液洗涤板6次。将在测定缓冲液(PBS/0.5%BSA/将15ppm Proclin/0.05%Tween 20,pH7.4)中稀释至100ng/mL中的检测抗体山羊抗人IgG(H+L)-辣根过氧化物酶(HRP)(BethylLaboratories,Inc.,Montgomery,TX,USA)添加到孔中,并在室温在振荡器上孵育1小时。将板用洗涤缓冲液洗涤6次并使用TMB过氧化物酶底物(Moss Inc.,Pasadena,Maryland)显色20分钟,然后用1M磷酸终止反应。相对于620nm的参考波长,在450nm处测量吸光度。从标准曲线的4参数拟合外推样品浓度。可报告的检测范围为0.156至10ng/mL。所需的最低稀释度为1:100,最低可定量浓度为16ng/mL。
结果:
在以10mg/kg进行抗TGFβ3h2A10.v3的单次I.V.推注后,平均清除率(CL)为4.35mL/天/kg,C
在以10mg/kg进行抗TGFβ3h2A10.v4的单次I.V.推注后,分别地,平均清除率(CL)为4.21mL/天/kg,C
以10mg/kg进行抗TGFβ3变体h2A10.v3和h2A10.v4的单次I.V.推注施用后的药代动力学预期与人IgG1单克隆抗体在食蟹猴中的一致,并且与典型的IgG1和IgG4单克隆抗体相似。
PK数据汇总于下表15中。
表15:cyno PK研究结果
实例8:4A11(双特异性抗TGFβ2/3抗体)的人源化
材料和方法:
通过BIAcore进行抗体亲和力测量
所有人源化4A11抗体的结合亲和力测定通过使用BIAcore
基于HEKBlue细胞的TGFβ阻断测定
如上文实例6中所述进行基于HEKBlue细胞的TGFβ3阻断测定。
结果:
4A11的人源化:
4A11人源化步骤1:将兔4A11 CDR移植到人类框架上:
如下所述将源自兔B细胞的单克隆抗体4A11人源化。残基编号是根据Kabat etal.,Sequences of proteins of immunological interest,5th Ed.,Public HealthService,National Institutes of Health,Bethesda,MD(1991)。
首先将兔4A11(Rbt 4A11)抗体的可变区与所有人类种系进行比对。将四种轻链人种系(IGKV4-1、IGKV1D-39、IGKV3-20、IGKV2-24)和两种重链人种系(IGHV3-48、IGHV4-59)鉴定为最接近分别用于移植Rbt 4A11轻链和重链高变区(CDR)的受体框架。具体而言,从Rbt 4A11轻链可变结构域(VL),将位置24至34(L1)、50至56(L2)和89至97(L3)移植到IGKV4-1、IGKV1D-39、IGKV3-20和IGKV2-24中。从Rbt 4A11重链可变结构域(VH),将位置26至35(H1)、50至65(H2)和95至102(H3)分别移植到IGHV3-48和IGHV4-59中。
通过改组不同的移植受体框架生成了八种人源化变体:人源化4A11版本1(h4A11.v1)是通过IGKV4-1和IGHV3-48;人源化4A11版本2(h4A11.v2)是通过IGKV1D-39和IGHV3-48;人源化4A11版本3(h4A11.v3)是通过IGKV4-1和IGHV4-59;人源化4A11版本4(h4A11.v4)是通过IGKV1D-39和IGHV4-59;人源化4A11版本5(h4A11.v5)是通过IGKV3-20和IGHV3-48;人源化4A11版本6(h4A11.v6)是通过IGKV2-24和IGHV3-48;人源化4A11版本7(h4A11.v7)是通过IGKV3-20和IGHV4-59;人源化4A11版本8(h4A11.v8)是通过IGKV2-24和IGHV4-59(表16)。
除了移植到上述最接近的受体框架上的CDR外,还进行了如下修饰:
轻链框架:
h4A11.v1和h4A11.v3使用相同的IGKV4-1受体框架,保留来自Rbt4A11的VL的框架I中位置2和4处以及框架II中位置36处的兔残基。
h4A11.v2和h4A11.v4使用相同的IGKV1D-39受体框架,保留来自Rbt4A11的VL的框架I中位置2和4处以及框架II中位置36和43处的兔残基。
h4A11.v5和h4A11.v7使用相同的IGKV3-20受体框架,保留来自Rbt4A11的VL的框架I中位置2处、框架II中位置36和43处以及框架III中位置58处的兔残基。
h4A11.v6和h4A11.v8使用相同的IGKV2-24受体框架,保留来自Rbt4A11的VL的框架I中位置2和4处以及框架II中位置36处的兔残基。
重链框架:
h4A11.v1、h4A11.v2、h4A11.v5、h4A11.v6使用相同的IGHV3-48受体框架,保留来自Rbt 4A11的VH的框架I中位置2和24处、框架II中位置48和49处、框架III中位置71、73、78和91处以及框架IV中位置105处的兔残基。
h4A11.v3、h4A11.v4、h4A11.v7、h4A11.v8使用相同的IGHV4-59受体框架,保留来自Rbt 4A11的VH的框架I中位置2处、框架II中位置37处、框架III中位置67、71、73、78和91处以及框架IV中位置105处的兔残基。
发现所有残基是充当“游标”区域的框架残基的一部分,其可以调整CDR结构并微调抗原拟合。参见例如,Foote和Winter,J.Mol.Biol.224:487-499(1992)。这些CDR定义包括由它们的序列超变性定义的位置(Wu,T.T.&Kabat,E.A.(1970))、它们的结构定位(Chothia,C.&Lesk,A.M.(1987))以及它们参与抗原-抗体接触(MacCallum等人J.Mol.Biol.262:732-745(1996))。
进一步对所有八种人源化4A11变体进行用于人TGFβ同种型结合亲和力确定的BIAcore和用于人TGFβ同种型阻断效力评估的基于HEKBlue细胞的测定。尽管对于大多数变体,人TGFβ2&3结合有一定程度的下降(3至10倍),但人TGFβ2&3阻断的下降程度更明显和显著(表16)。在所有八个人源化版本中,只有h4A11.v7保留了与Rbt 4A11具有可比性的人TGFβ2&3阻断,尽管人TGFβ2&3结合下降了几倍。因此,将该克隆物推进到下一步的人源化、框架补平。
表16:4A11人源化步骤1变体表征汇总
4A11人源化步骤2:h4A11.v7框架补平:
在h4A11.v7的框架补平中,生成了三种变体(v7.1至v7.3)以使从步骤1人源化中引入的氨基酸插入缺失。接下来,通过用相对应的人种系残基替换游标区域处的每个h4A11.v7兔残基来生成其他人源化变体(v7.4至v7.15)。为了确定保留哪些残基是必要的,然后通过BIAcore评价与每种变体的TGFβ同种型的结合,并在基于HEKBlue细胞的测定中评估阻断效力。
在h4A11.v7中,这些框架补平变体为h4A11.v7.1(VH:缺失E1),h4A11.v7.2(VH:缺失K75和N76)、h4A11.v7.3(VH:缺失E1、K75和N76)、h4A11.v7.4(VL:A2I),h4A11.v7.5(VL:F36Y),h4A11.v7.6(VL:P43A),h4A11.v7.7(VL:V58I),h4A11.v7.8(VH:Q2V),h4A11.v7.9(VH:V37I),h4A11.v7.10(VH:F67V),h4A11.v7.11(VH:K71V),h4A11.v7.12(VH:S73T),h4A11.v7.13(VH:V78F),h4A11.v7.14(VH:F91Y),h4A11.v7.15(VH:P105Q)(表17)。
在结合和效力测定中,大多数变体似乎类似于亲本h4A11.v7或与之相比有轻微改善,除了对h4A11.v7.11(VH:K71V)有主要影响,其中TGFβ2结合(6倍)和TGFβ3结合(2倍)有所下降,TGFβ2阻断(>2000倍)和TGFβ3阻断(118倍)的损失显著更大。有一个具有次要影响的变体:h4A11.v7.5(VL:F36Y),其中在TGFβ2结合和阻断两个方面下降了近2倍,并且有两个具有次次要影响的变体:h4A11.v7.13(VH:V78F),其TGFβ2结合下降2.5倍;h4A11.v7.14(VH:F91Y),其TGFβ2阻断下降4倍(表17)。总之,已确定h4A11.v7的游标区域的所有兔残基都可以用人种系残基替换,除了VH的框架III中的主要位置71、VL的框架II中的次要位置36和/或VH的框架III中的次次要位置78和91。
表17:4A11人源化步骤2变体表征汇总
4A11人源化步骤3:最终版本生成和选择
根据h4A11.v7框架补平的结果,h4A11.v7.18通过以下生成:首先将游标区域处的h4A11.v7非关键框架残基替换为相对应的人种系残基,即VL框架中位置2处的A到I、框架II中位置43处的P到A和框架III中位置58处的V到I,以及VH的框架I中位置2处的Q到V、框架II中位置37处的V到I、框架III中位置67处的F到V、框架III中位置73处的S到T、框架IV中位置105处的P到Q(表18)。与所有上述取代一起,h4A11.v7中的两个次次要框架残基,即VH的框架III中的V78或F91也被相对应的人种系残基替换,以生成其他2个人源化版本,h4A11.v7.16(VH:V78F)和h4A11.v7.17(VH:F91Y)。另一个人源化版本h4A11.v7.19通过将K75和N76的缺失合并到VH的框架III中而生成,这有利于改善h4A11.v7框架补平中的TGFβ2&3阻断(上表17:h4A11.v7.2和h4A11.v7.3)。
通过比较所有4个最终人源化版本,有趣的是,只有h4A11.v7.19似乎优于h4A11.v7,并且不仅在人TGFβ2和TGFβ3结合方面,而且在人TGFβ2和TGFβ3阻断方面都与亲本Rbt 4A11具有可比性。
表18:4A11人源化步骤3变体表征汇总
4A11变体的氨基酸序列提供在下表19和表20中,且序列比对在图18、图19、图20和图21中示出。
表19:人源化4A11变体的重链和轻链可变区氨基酸序列
/>
/>
/>
/>
表20:人源化4A11变体的完整重链和轻链序列
/>
/>
/>
/>
/>
/>
/>
/>
/>
实例9:6F12(抗TGFβ2)的人源化
材料和方法:
通过BIAcore进行抗体亲和力测量
所有人源化4A11抗体的结合亲和力测定通过使用BIAcore
基于HEKBlue细胞的TGFβ阻断测定
如上文实例6中所述进行基于HEKBlue细胞的TGFβ3阻断测定。
结果:
6F12人源化步骤1:大鼠6F12 CDR移植到人类框架中
如下所述将单克隆抗体6F12人源化。残基编号是根据Kabat等人(出处同上)。
首先将大鼠6F12(r6F12)抗体的可变区与所有人类种系进行比对。将两种轻链人种系(IGKV1-5、IGKV3-15)和两种重链人种系(IGHV2-26、IGHV4-59)鉴定为最接近分别用于移植r6F12轻链和重链高变区(CDR)的受体框架。具体而言,从r6F12轻链可变结构域(VL),将位置24至34(L1)、50至56(L2)和89至97(L3)移植到IGKV1-5和IGKV3-15中。从r6F12重链可变结构域(VH),将位置26至35(H1)、50至65(H2)和95至102(H3)分别移植到IGHV2-26和IGHV4-59中。
此外,通过改组不同的移植受体框架生成了总计四种人源化变体:人源化6F12版本1(h6F12.v1)是通过IGKV1-5和IGHV2-26;人源化6F12版本2(h6F12.v2)是通过IGKV1-5和IGHV4-59;人源化6F12版本3(h6F12.v3)是通过IGKV3-15和IGHV2-26;人源化6F12版本4(h6F12.v4)是通过IGKV3-15和IGHV4-59。除了CDR移植到上述最接近的受体框架上之外,对于轻链框架,h6F12.v1和h6F12.v2使用相同的IGKV1-5受体框架,保留来自r6F12的VL的框架II中位置43处和框架III中位置66、69、71和87处的大鼠残基;h6F12.v3和h6F12.v4使用相同的IGKV3-15受体框架,保留来自r6F12的VL的框架II中位置43处和框架III中位置58、66、69、71和87处的大鼠残基。对于重链框架,h6F12.v1和h6F12.v3使用相同的IGHV2-26受体框架,保留来自r6F12的VH的框架II中位置37、48和49处以及框架IV中位置105处的大鼠残基;h6F12.v2和h6F12.v4使用相同的IGHV4-59受体框架,保留来自r6F12的VH的框架II中位置37和48处、框架III中位置67、71和78处以及框架IV中位置105处的大鼠残基。发现所有残基是充当“游标”区域的框架残基的一部分,其可以调整CDR结构并微调抗原拟合。参见例如,Foote和Winter,J.Mol.Biol.224:487-499(1992)。这些CDR定义包括由它们的序列超变性定义的位置(Wu,T.T.&Kabat,E.A.(1970))、它们的结构定位(Chothia,C.&Lesk,A.M.(1987))以及它们参与抗原-抗体接触(MacCallum等人J.Mol.Biol.262:732-745(1996))。
进一步对所有4种人源化6F12变体进行用于人TGFβ同种型结合亲和力确定的BIAcore和用于人TGFβ同种型阻断效力评估的基于HEKBlue细胞的测定。在BIAcore分析中,虽然所有4种人源化6F12变体都显示出与亲本r6F12相当的与人TGFβ2的选择性和相似结合,但结合亲和力超出了仪器检测限,因此结果不能用于确定将哪个变体向前推进。有趣的是,在基于HEKBlue细胞的效力测定中,结果表明除h6F12.v3之外的所有变体在阻断人TGFβ2方面存在约2.5至5倍的下降(表21)。
表21:6F12人源化步骤1变体表征汇总
6F12人源化步骤2:h6F12.v1框架补平
在人源化6F12框架补平中,通过用来自种系序列的相对应人残基取代6F12在游标区域的每个大鼠残基,生成更多人源化h6F12.v1变体。由于仪器限制,BIAcore没有对每个变体进行评价,而是通过基于HEKBlue细胞的测定来确定人TGFβ同种型阻断效力。
这些框架补平变体为h6F12.v1.1(VL:S43A),h6F12.v1.2(VL:E66G),h6F12.v1.3(VL:P69T),h6F12.v1.4(VL:Y71F),h6F12.v1.5(VL:F87Y),h6F12.v1.6(VH:V37I),h6F12.v1.7(VH:M48L),h6F12.v1.8(VH:G49A)和h6F12.v1.9(VH:P105R)。在效力测定中,大多数变体似乎类似于亲本h6F12.v1或与之相比有轻微改善,除了对h6F12.v1.6(VH:V37I)和h6F12.v1.9(VH:P105R),其TGFβ2阻断有约5至8倍的下降。有两个具有次要影响的变体:h6F12.v1.5(VL:F87Y)和h6F12.v1.8(VH:G49A),其中TGFβ2阻断分别下降2倍和4倍(表22)。总之,已确定h6F12.v1的游标区域的所有大鼠残基都可以用人种系残基替换,除了VH的框架II中的主要位置37和框架IV中的主要位置105以及VL的框架III中的次要位置87和VH的框架II中的次要位置49。
表22:6F12人源化步骤2变体表征汇总
6F12变体的序列提供在下表23和表24中,且序列比对在图22、图23和图24中示出。
表23:人源化6F12变体的重链和轻链可变区氨基酸序列
/>
/>
表24:人源化6F12变体的完整重链和轻链序列
/>
/>
/>
/>
实例10:同种型选择性抗TGFβ抗体的结构表征
材料和方法
Fab从CHO细胞表达。人TGFβ2和TGFβ3购自Peprotech(Rocky Hill,NJ)。Fab和TGFβ2/3在冰上以1:1.5的比率混合30分钟,在25mM Tris pH7.5和50mM NaCl中从HiLoadSuperdex S200 16/600柱(GE医疗保健生命科学)中分离复合物。将样品浓缩至10mg/ml以进行结晶。气相扩散法用于生长晶体。将1μl蛋白质与1μl母液在500μl孔溶液中混合。使2A10 TGFβ3在25%PEG 1000和0.1M Hepes pH 7.5中结晶。使4A11v2/TGFβ2复合物在15%PEG 4000和0.1M二甲胂酸钠pH 6中结晶。使4A11v7和TGFβ2复合物在30%PEG 1000和0.1MTris pH 8.5中结晶。在收集数据之前,用20%甘油对晶体进行冷冻保护并在液氮中冷冻。
结果:
2A10/β3
2A10v4 Fab(在CHO中表达)和人TGFβ3的成熟二聚体形式(A301-S412,在大肠杆菌中表达,购自Peprotech(Rocky Hill,NJ))的晶体结构在
表25:TGFβ3/2A10v4结构的数据收集和细化统计
*括号中的值适用于具有最高分辨率的外壳。
图25中的结构显示TGFβ3的每个二聚体被两个2A10 Fab结合。2A10与TGFβ3的β6/β7发夹区结合。将2A10/TGFβ3结构与TGFβ1结合至TGFΒR1和TGFΒR2的结构进行比较(图26)(另见,Radaev JBC 2011,PDB 3KFD),表明2A10 Fab将在空间上阻断TGFΒR2结合TGFβ3的能力,但不阻断TGFΒR1结合TGFβ3的能力。由于已知TGFβ与TGFΒR1和TGFΒR2的信号传导复合物协同组装,首先通过TGFβ与TGFΒR2结合然后募集TGFΒR1,因此预期阻断TGFΒR2结合足以完全阻止R1/R2信号传导受体与TGFβ3结合。2A10的结合模式不同于泛TGFβ抗体非苏木单抗,后者经由阻断TGFΒR1和TGFΒR2结合的表位与所有TGFβ同种型结合(PDB ID4KV5、4KXZ、3EO1、3KFD)。
TGFβ3上的由2A10结合的表位显示在图28和图29中,并总结在表26中的接触列表中。与2A10(
表26:TGFβ3和抗TGFβ3mAb 2A10上的接触残基
/>
2A10互补位如图30所示。重链和轻链两者对TGFβ3的结合贡献了相对相等的表面积。~
对于这些同种型中的每一种,可能以不同的方式实现相对于TGFβ1和TGFβ2的对TGFβ3的选择性。对于人TGFβ1,TGFβ1与TGFβ3之间在2A10表位附近或之内存在三个氨基酸差异。这些残基T387P(意味着残基是TGFβ3(人TGFβ3编号)中的“T”和TGFβ1中的P(TGFβ1中的P365))、L389V和T395K表明沿着β6链的残基(T387P、L389V)在2A10结合中发挥重要作用(图31)。在TGFβ3中,T395不在晶体结构中与2A10直接相互作用,因此该残基变为赖氨酸的效应尚不清楚。
对于TGFβ2,TGFβ2和TGFβ3之间在2A10表位内或附近有四个氨基酸变化。在这四个残基(R325K(意味着残基是TGFβ3中的“R”和TGFβ2中的K(人TGFβ3编号)、V392I、R394K、V398I)中,三个可能破坏与2A10的有效接触(图32)。TGFβ3R325与重链残基Y32形成氢键,这种情况在变为赖氨酸时会发生改变。在位置V398处变为异亮氨酸可能会引入与2A10的空间位阻。最重要的是,高度接触的R394残基的变化(在TGFβ2中变为赖氨酸)也可能以不利的方式改变与2A10相互作用的化学性质。鉴于异亮氨酸在表位中的位置和变化的保守性质,预计在392位用异亮氨酸替换缬氨酸不会对结合产生大的影响。总体而言,与TGFβ3结合的2A10的结构有力地表明了2A10如何在TGFβ同种型之间实现高选择性。
4A11/TGFβ2
为了更好地了解人源化4A11克隆物之间功能差异的原因,使用上述关于2A10的方法解析了与成熟形式的人TGFβ2结合的4A11的两个版本v2和v7的结构。V2和v7分别经人源化为VL1VH3和VL3VH4框架。图33示出了这两种结构。4A11v2/TGFβ2以
表27:TGFβ2/4A11结构的数据收集和细化统计
*括号中的值适用于具有最高分辨率的外壳。
发现4A11的表位在TGFβ2二聚体的下侧,其中两个Fab与相同的表位结合,如针对对称同源二聚体所预期(图34)。4A11的表位涵盖一个TGFβ2单体中的TGFβ2残基V313、Q314、D315、R320、L322、Y323、R328、D329、F345和A347,以及第二TGFβ2单体中的N368、T369、I370、N371、P372、E373、A374、S375、A376和S377(图35以及表28和29)。对于4A11v2/TGFβ2结构,~
表28:TGFβ2链A和4A11 Mab上的接触残基
表29:TGFβ2链B和4A11 Mab上的接触残基
/>
/>
如图34所示,4A11表位远离TGFΒR1/TGFΒR2结合位点,并且4A11分子都不会在空间上竞争受体结合。相反,4A11 Fab似乎诱导TGFβ2的构象变化,导致两个单体“夹”在一起几度(图36)。将4A11所结合的TGFβ2与结合至TGFΒR1和TGFΒR2的TGFβ3进行比较,表明至少一种TGFβ2单体的受体结合位点受到这种构象变化的影响(图37)。这些晶体结构中明显的变化表明4A11使用变构机制通过一个或两个受体结合位点的构象破坏来抑制TGFβ2/3信号传导。重要的是,需要4A11 IgG分子的二价结合来诱导TGFβ2/3的这种构象变化,从而抑制TGFβ2/3信号传导。与其中阻断TGFβ二聚体上的一个R1/R2受体结合位点可以阻断信号传导的受体阻断抗体不同,4A11的单臂结合不太可能足以抑制信号传导。鉴于表位的定位,完整的4A11 IgG分子的二价结合也可以在空间上阻止IgG所结合的TGFβ2/3分子与任何TGFβ受体的膜足够接近。
在4A11的人源化期间,注意到许多抗体框架序列在基于细胞的测定中导致抗体亲和力与IC
4A11v2和v7与TGFβ2的结构表明,重链框架在结构中靠得很近,实际上确实相互作用形成界面。因此,这些框架区内的残基可能对4A11 IgG分子形成二价复合物的能力产生影响。对这个HC/HC框架界面的仔细检查表明,v2框架残基是一个比针对v7所见者更宽松的界面(图39)。例如,HC位置19在v2中为精氨酸而在v7中为丝氨酸,且HC位置81在v2中是为谷氨酰胺而在v7中为赖氨酸。在v2中,R19和Q81靠得很近,形成了一种看起来对熵不利的接触,没有稳定的极性相互作用。在v7中,S19残基为K81作成空间并与Ser79形成氢键。此外,v2有两个大体积残基(Y79和N82a),它们不会形成明显的有效接触。重要的是,这些位置为v7(S79和S82a)中较小的残基,这可能允许HC框架界面以更宽松的方式结合在一起。虽然v7中的这些HC框架接触似乎不是特别互补,但它们似乎比两个v2重链之间的框架接触更宽容(不太不利)。由于空间体积庞大和掩埋大型柔性侧链的潜在熵损失,这些相互作用似乎是不利的。
进一步证实了上述分析,计算v2和v7结构中HC/HC框架相互作用的掩埋表面积表明v7 HC/HC接触更具互补性。在4A11v2/TGFβ2结构中,HC/HC界面(链D和链F)掩埋了大约
这些框架差异的含义对于解释4A11v2与v7的细胞活性差异很重要(图40)。如果在低浓度下,v2不能与TGFβ2/3二聚体二价结合,该抗体将不会诱导TGFβ中必要的构象变化来阻断第二受体位点并抑制信号传导。对于v7,框架接触允许与TGFβ2/3二聚体的二价结合,因此该抗体可以诱导构象变化(该构象变化阻断受体四聚体形成),并因此可以抑制信号传导。这些数据都指向4A11抗体借以对TGFβ2/3产生变构抑制的新机制,它不依赖于对受体的空间阻断(干扰),而是需要与TGFβ二聚体的二价结合来阻断信号传导。
实例11:与泛TGFβ1D11抗体的安全性比较
在本实例中,每周三次(TIW)向CD-1小鼠施用2A10 mAb、具有2A10.v4可变区和鼠IgG1 Fc区的抗体或泛TGFβ抗体1D11,持续4周(总计12个剂量),剂量为0(对照)、10和50mg/kg I.P.TIW,和50mg/kg I.V.TIW,在由磷酸盐缓冲盐水组成的媒介物中。将雄性和雌性分配到所有剂量水平的毒性组,并安排在给药期结束时(第29天)进行尸检。从对照组和2A10/2A10v4 mAb治疗组(n=9只雄性/组)中的其他小鼠收集用于毒代动力学评价的血液。评价标准包括以下参数:临床观察、体重、临床病理学(血液学和临床化学)、解剖病理学和毒代动力学。
确定AUC暴露,并预计随着剂量从10增加到50mg/kg,该暴露大约与剂量成比例地增加。
预计没有2A10或2A10.v4相关的临床观察、对体重的效应或临床病理学变化,而对于用1D11抗体治疗的小鼠则预计此类相关的临床观察、对体重的效应或表明毒性增加的临床病理学变化,例如,组织学病灶、体重减轻、非肿瘤性囊性上皮增生和舌头炎症以及牙齿发育不良和牙龈和食管上皮增生,如Lonning等人(2011)Current PharmaceuticalBiotechnology,12,2176-2189中所述。
实例12:与抗TGFβ1选择性抗体的安全性比较
在本例中,每周三次(TIW)向CD-1小鼠施用2A10 mAb、具有与鼠IgG1 Fc区融合的2A10.v4可变区的抗体、可变区与鼠IgG1 Fc融合的抗TGFβ1抗体CAT-192(美替木单抗)中的每一者,持续4周(总计12个剂量),剂量为0(对照)、10和50mg/kg I.P.TIW,和50mg/kgI.V.TIW,在由磷酸盐缓冲盐水组成的媒介物中。将雄性和雌性分配到所有剂量水平的毒性组,并安排在给药期结束时(第29天)进行尸检。从对照组和2A10/2A10v4 mAb治疗组(n=9只雄性/组)中的其他小鼠收集用于毒代动力学评价的血液。评价标准包括以下参数:临床观察、体重、临床病理学(血液学和临床化学)、解剖病理学和毒代动力学。
确定AUC暴露,并预计随着剂量从10增加到50mg/kg,该暴露大约与剂量成比例地增加。
预计没有与2A10或2A10.v4相关的临床观察、对体重的效应或临床病理学变化,而对于用CAT-192治疗的小鼠则预计此类相关的临床观察、对体重的效应或表明毒性增加的临床病理学变化,例如,如Denton A&R56:323(2007)中所述。
实例13:全长TGFβ3条件培养基在体外抑制肺泡形成
材料和方法
肺细胞分离
遵循先前公布的方案分离肺细胞(参见Rock等人,2011Proceedings of theNational Academy of Sciences of the United States of America 108,E1475-1483)。在肺膨胀并用蛋白酶溶液混合物(5U/ml分散酶、450U/ml I型胶原酶、4U/ml弹性蛋白酶和0.33U/ml DNaseI,在DMEM/F12中)在37℃在频繁搅拌下消化45分钟后,组织被破坏并收集单细胞。然后用具有10%胎牛血清(FBS,Invitrogen)的DMEM洗涤细胞并在ACK裂解缓冲液中重新悬浮3分钟以裂解红细胞。洗涤后,用纯化的大鼠抗小鼠CD16/CD32抗体(Cat#553142;BD Biosciences)封闭细胞,并用CD45(Cat#17-0451-82,eBioscience)、EpCAM(Cat#11-5791-82,eBioscience)染色。AEC2细胞在BD FACSAria Fusion细胞分选仪(BDBiosciences)上基于以下标志物进行分选:CD45
AEC3-D类器官培养
AEC类器官培养遵循先前公布的稍作修改的方案进行(参见Barkauskas,2013JCI123,3025-3036;Sun T,等人,2019,JCI Insight;Jun 18;5(14):e128674)。将分选的AEC2细胞与人基质细胞NHLF(Cat#CC-2512;Lonza Walkersville Inc.USA)以1:10的比率混合。将细胞重新悬浮在预冷的1:1MTEC/Plus和减少生长因子的Matrigel(Cat#356231;BDBiosciences)混合培养基中。将10
显微镜检查
在Nikon Ti-E Perfect Focus倒置显微镜上捕获整个类器官培养图像。通过使用电动载物台从多点采集中自动拼接多个相邻帧来生成大图像。通过ImageJ软件分析图像。
分泌组文库筛选
分泌组文库是在哺乳动物表达载体上表达单个人类cDNA的质粒集合,包含约1,700个编码所分泌蛋白的个体全长基因。为了鉴定肺泡类器官系统中可能与AEC生物学有关的因素,首先将该文库分为96个子文库,每个子文库包含大约10至20种个体质粒。按照制造商的建议,使用Lipofectamine 2000(Cat#11668019,ThermoFisher)将每个子文库质粒池瞬时转染到293T细胞中。两天后收集条件培养基,保持在4℃,直到用于肺泡培养。在培养结束时鉴定阳性子文库。在第二轮筛选过程中,生成并测试来自每个阳性子文库中个体质粒的条件培养基。最终鉴定负责类器官培养表型的阳性单基因。
结果
肺泡上皮通过2型肺泡上皮细胞(AEC2)的增殖和增生得到维持和修复,之后分化为1型肺泡上皮细胞(AEC1)。为了研究AEC生物学,采用了3-D肺泡球类器官培养系统,其中命运映射的AEC2在他莫昔芬诱导后从Sftpc-CreER
实例14:全长TGFβ2和TGFβ3可以在体外活化TGFβR依赖性信号传导,而不依赖于整合素结合
由于整合素结合是TGFβ1活化的既定机制,并且在肺泡模型中观察到TGFβ1和TGFβ3的差异活性,接下来试图确定TGFβ3活化的整合素依赖性。使用2个细胞的体外报告系统,其中将编码全长TGFβ1或TGFβ3的表达载体与编码αv和β6整合素的表达载体共转染到293T细胞中,并与驱动SMAD依赖性启动子元件(“MLEC”)下游的荧光素酶表达的报告细胞系共培养(参见Abe等人,1994;Anal Biochem,216,276-284)。虽然全长TGFβ1需要αvβ6整合素的共表达以诱导报告基因活性,但发现全长TGFβ3强烈诱导报告基因活性,而无需共转染αv和β6整合素构建体。αvβ6的共表达进一步增加了全长TGFβ3依赖性报告基因活性,并且这种进一步增加通过TGFβ3的LAP中的RGD整合素结合基序突变为RGE而减弱(图41)。
与上述肺泡球实验观察到的效果一致,来自用全长TGFβ3而非TGFβ1转染的细胞的上清液强烈诱导报告基因活性(图42)。用来自全长TGFβ2转染细胞的上清液观察到类似的报告基因诱导;由于TGFβ2缺乏RGD基序(图1),它的活化可能与整合素无关(图42)。在酸化步骤后,这三种上清液的总TGFβ活性相当,酸化步骤将TGFβ的受体结合结构域从其潜在复合物中释放出来(图42)。为了排除这些效应对我们使用的报告细胞系具有特异性的可能性,将HEK-Blue(InvivoGen)和SCOS-7细胞分别评估为替代TGFβ报告细胞系和转染受体细胞系。在两种情况下都观察到TGFβ2和/或TGFβ3的高“内在”活性(图43A和图43B)。
在整合素αvβ6介导的潜伏型TGFβ1活化过程中,需要细胞骨架张力来传递力。为了降低其他细胞骨架依赖性整合素活性的可能参与,该培养系统用细胞松弛素D处理以抑制肌动蛋白聚合,从而减少整合素αvβ6介导的TGFβ1和TGFβ3活化。然而,TGFβ3的“内在”活性不受影响(图44),表明该活性不依赖于整合素。
在高尔基体中,TGFβ1的前肽(pro-TGFβ1)被弗林蛋白酶蛋白水解切割,导致SLC的形成。这种蛋白水解消化对于产生功能性TGFβ1是必不可少的。所有三种TGFβ同种型都具有保守的弗林蛋白酶切割位点(RKKR或RHRR,图1)。为了评估这种蛋白酶切割对我们的系统中TGFβ2/3活性的要求,每种TGFβ同种型中的弗林蛋白酶切割位点都发生了突变。突变的全长TGFβ2和β3完全丧失其内在活性(图45)。因此,与TGFβ1一样,尽管SLC具有不同的细胞外活化机制,但TGFβ2/3活性需要弗林蛋白酶切割。为了评估“固有”TGFβ2和TGFβ3活性的动力学,在用转染上清液处理后在正常人肺成纤维细胞(NHLF)中评估磷酸-SMAD2,并观察到与用重组TGFβ受体结合结构域处理的细胞相似的动力学,pSMAD2峰值约在刺激后1小时(图46)。
为了排除转染细胞的条件培养基中存在的其他因素可能导致TGFβ2和TGFβ3活化的可能性,产生了重组全长TGFβ同种型。为了提高表达和稳定性并促进纯化,将人IgG1(“Fc”)的恒定结构域与每种同种型(Fc-FL-TGFβ1、2和3)进行框内N末端融合。与在条件培养基中观察到的效果一致,纯化的重组Fc-FL-TGFβ1不活化MLEC中的报告基因活性。然而,Fc-FL-TGFβ2和Fc-FL-TGFβ3强烈诱导报告基因活性(图47),这被它们各自的同种型特异性抗体抑制(图48)。
先前的研究表明,来自TGFβ1的重组LAP(LAP1)可以在体外和体内强烈抑制TGFβ1、2和3的受体结合结构域,可能是通过将它们重组为SLC。虽然TGFβ同种型的受体结合结构域高度同源,但LAP结构域更加多样化(图49)。因此,推测来自TGFβ1、2和3的LAP(分别为LAP1、2和3)可能具有不同的抑制能力。产生了人IgG1与人LAP1、2和3(Fc-LAP1、2和3)的重组N末端融合蛋白。针对每种Fc-LAP,观察到显著不同的中和能力。与使用条件培养基和重组全长TGFβ蛋白的观察结果一致,Fc-LAP1比Fc-LAP2或Fc-LAP3更有效地抑制所有三种TGFβ同种型的受体结合结构域(图50A、50B和50C以及图51)。总之,这些数据表明LAP1、2和3抑制TGFβ活性的相对效力是不同的,这可能解释了针对TGFβ1未观察到的全长TGFβ2和TGFβ3的“内在”活性。
总之,这些数据表明FL-TGFβ2和TGFβ3可能具有与TGFβ1不同的活化机制和阈值。尽管FL-TGFβ1可以通过αvβ6整合素的异位表达而活化,并且FL-TGFβ3的活性可以通过结合αvβ6整合素而增加,但FL-TGFβ2和FL-TGFβ3似乎都具有“内在”活性,和/或通过尚未确定的机制活化。LAP1、2和3的生化抑制效力不同,LAP1对每种受体结合同种型的生化IC50比LAP2和LAP3低几个数量级。鉴于潜伏型TGFβ1具有比潜伏型TGFβ2或TGFβ3高得多的活化阈值,这些机制观察表明TGFβ2和TGFβ3基因表达比TGFβ1基因表达更可能反映它们在组织中的活性。
TGFβ1、2和3的受体结合结构域高度同源,具有83-90%的氨基酸相似性。所有三种异构体的二聚体受体结合结构域与TGFβR1和TGFβR2的异二聚体受体复合物对结合;然后,四聚体受体复合物通过TGFβR1(也称为ALK5)的受体酪氨酸激酶(RTK)活性活化细胞内信号传导。在典型的TGFβR信号传导中,ALK5磷酸化SMAD2和SMAD3,然后与SMAD4结合,易位到细胞核,并指导基因转录。在某些情况下,其他非SMAD依赖性信号传导通路(例如MAP激酶、AKT、JAK-STAT和NFκB)可能在TGFβR下游被活化(Derynck,2019Science signaling 12)。生化和结构研究表明,TGFβ-TGFβR信号传导复合物的组装具有细微的同种型特异性差异:TGFβ1和TGFβ3更强烈地与TGFβR2结合,并且仅在与TGFβR2复合时才与TGFβR1形成强烈的相互作用,而TGFβ2与单独的TGFβR1和TGFβR2两者结合较弱,并且亲和力可能驱动完全复合物的形成(Radaev,2010,JBC 285,14806-14814)。TGFβ1和TGFβ2以“闭合”结构结晶,有利于与TGFβR1和TGFβR2结合,而TGFβ3可以采用晶体形式的类似“闭合”或不太有序的“开放”结构,这可能导致配体-受体复合物组装的亲合力不同。此外,TGFβR3(β聚糖)是一种非信号传导受体,可以促进TGFβ2与TGFβR1/2复合物的结合,但在TGFβ1或TGFβ3受体结合中似乎没有类似的作用(del Re,2004JBC 279,22765-22772)。在此证明的4A11的变构抑制机制的结构分析表明,与TGFβ2或TGFβ3二聚体结合的二价抗体以排除同时结合两组受体异二聚体的形式限制TGFβ(图7)。最终,尽管信号传导复合物组装存在这些差异,但TGFβ1、2和3的重组受体结合结构域都能够在基于细胞的体外测定中以相似程度诱导TGFβR依赖性SMAD信号传导。因此,内源性TGFβ同种型体内活性的任何差异更可能是由于它们的表达模式和从SLC或LLC释放的机制的差异,而不是它们的受体结合结构域的差异。
讨论
TGFβ1、2和3的LAP结构域的同源性明显低于受体结合结构域,只有42-56%的氨基酸相似性。所有三种同种型在LAP与受体结合结构域之间都具有保守的弗林蛋白酶切割位点(RKKR或RHRR),以及保守的“紧固蛋白”序列(YYAKE)。TGFβ1和TGFβ3具有RGD整合素结合序列,但TGFβ2在该位点具有R-S取代,并且未显示通过整合素结合而活化。包括LAP和受体结合结构域在内的SLC结构已针对TGFβ1解析,但尚未针对TGFβ2或3解析。与TGFβR2相互作用的TGFβ1受体结合结构域的“指”区被“潜伏套索”屏蔽,后者是LAP的α1与α2螺旋之间的环,与紧固蛋白序列相关。在所有三种同种型中,LAPα1螺旋的C末端序列高度保守,其中一个赖氨酸残基(GQILSKL)与TGFβ1紧固蛋白中的两个保守酪氨酸(YYAKE)相互作用;此外,丙氨酸(YYAKE)与LAP C末端附近的α5螺旋中的精氨酸相互作用,该精氨酸在三种同种型中是保守的(Shi等人2011;Nature 474,343-349)。
三种TGFβLAP同种型的潜伏套索显示出一定的序列多样性,TGFβ1中有6个脯氨酸,TGFβ2中有5个,TGFβ3中有4个,且套索的长度在TGFβ2和TGFβ3中分别比在TGFβ1中短1个和2个残基。RGD整合素结合位点周围的三种同种型之间存在显著的序列差异:TGFβ2具有SGD序列,不太可能结合整合素,并且在β9与β10链之间比TGFβ1长9个残基;TGFβ3具有RGD,并且在β9与β10链之间比TGFβ1长3个残基;并且在β4和β5链与β7和β8链之间的环在TGFβ2和TGFβ3中比它们在TGFβ1中的长得多。虽然尚未阐明这些区域的结构-功能关系,但与TGFβ1相比,它们可能有助于TGFβ2和TGFβ3的LAP结构域的不同活化模式和/或抑制效力。杂合功能丧失突变已在与Loeys-Dietz综合征相关的TGFB2和TGFB3基因中在LAP结构域的关键残基中进行了描述(Lindsay,2012Nature Genetics;44,922-927;Bertoli-Avella,2015J Am CollCardiol 65,1324-1336;Schepers,2018Human Mutation 39,621-634),暗示了TGFβ2中的紧固蛋白和TGFβ3中的RGD整合素结合位点两者中的弗林蛋白酶切割位点,表明这些保守基序对于TGFβ2和TGFβ3的至少一些功能而言很重要。虽然本文显示全长TGFβ2和TGFβ3具有“内在”活性,但该活性仍然依赖于弗林蛋白酶的切割,并且在TGFβ3的情况下,可以通过整合素结合增强。与LAP而不是受体结合结构域赋予活化特异性的概念一致,本文显示TGFβ1的LAP可以有效抑制所有三种同种型,而TGFβ2和TGFβ3的LAP的抑制性显著降低。
实例15:C57BL/6小鼠抗TGFβ同种型特异性抗体的药代动力学
三种嵌合抗体(6F2、2A10和4A11)的药代动力学(PK)在雌性C57BL/6小鼠中的单次静脉内(IV)剂量1或10mg/kg或腹膜内(IP)剂量10mg/kg后表征。所有三种抗体均表现出良好的PK曲线,具有明显的双相分布,其特征是分布期较短,然后是较长的消除期。在所有队列中观察到在1与10mg/kg之间的线性和与剂量成比例的(C
表30:抗TGFβ同种型特异性抗体在C57BL/6小鼠中的PK
C
CL=清除率:T
实例16:同种型选择性抗TGFβ2和TGFβ3抗体在肺纤维化模型中的体内活性
材料和方法
肺基因组DNA分离和定量PCR
使用DNeasy血液与组织试剂盒(Cat#69506;Qiagen)从小鼠全肺中分离基因组DNA。使用Taqman Copy Number Assays(Applied Biosystems)通过qPCR对TGFβDNA水平进行定量。阈值循环值(Ct)归一化为内部参考Tert(ΔCT)。通过2-ΔΔCT方法计算基因组DNA水平。使用了来自Applied Biosystems的以下Taqman测定法:
Tgfb2外显子3(Mm00035180_cn)
Tgfb2外显子6(Mm00035822_cn)
Tgfb3外显子3(Mm00381025_cn)
Tgfb3外显子6(Mm00381036_cn)
和Tert(4458373)。
博莱霉素诱导模型中小鼠肺纤维化的组织学分析
将福尔马林固定的小鼠肺(5个肺叶)样品作为一个整体嵌入并处理成每只动物1个载玻片,用H&E或Masson's Trichrome染色。替代性地,使用抗胶原蛋白III抗体(Cat#ab7778,Abcam)通过免疫组织化学评价纤维化。根据以下标准对肺纤维化程度进行评分:
(A)间质纤维化模式-病灶数:0,未检测到;1,≤10;2,≤15;3,>15/所有切片,但不同;4,多灶合并或局部广泛;5,弥漫性
(B)间质纤维化——病灶大小:0,未检测到;1,最大病灶≤~2个肺泡腔面积;2,最大病灶≤~4个肺泡腔面积;3,聚结(>4个患者肺泡腔);4,局部广泛(整个叶的60-90%);5,弥漫性(>90%的整个肺叶);
(C)总评分:病灶数量x病灶大小
结果
为了评估抗TGFβ2(6F12)和抗TGFβ3(2A10)抗体的体内抗纤维化作用,对小鼠进行预防性治疗,并在博莱霉素施用后第14天当TGFβ诱导的基因表达达到顶峰时,检查那些基因在肺中的表达。在用任一抗体治疗的小鼠中,Serpine1、Fn1和Col1a1表达均显著降低(图53A和53B)。抗体4A11在体外有效抑制TGFβ2和TGFβ3同种型的活性(上表30)。在体内,与6F12和2A10的组合相当,4A11治疗在第24天减少了新的胶原蛋白积累(图53C)。进行了4A11的剂量滴定,并观察到在以10mg/kg的剂量每周三次或一次施用时观察到具有可比性的效率,但在3mg/kg/周的剂量下没有观察到(图53C)。与对照组相比,第24天的肺病理学检查显示,高剂量4A11治疗组的疾病评分和胶原积累显著降低(图53D和53E)。总之,这些数据表明用针对TGFβ2和TGFβ3的中和抗体治疗可以减少体内肺纤维化。
实例17:TGFβ2和TGFβ3有助于肝纤维化
材料和方法
CCl4模型
每周三次向8至10周龄的雄性C57BL/6J小鼠(Jackson West)腹腔注射0.5ml/kg体重的四氯化碳(Sigma-Aldrich,#319961,1:6v/v,在玉米油中稀释)或玉米油(Sigma-Aldrich),持续6周。小鼠以10mg/kg每周三次接受抗TGFb2/3(4A11)-mIgG2a-LALAPG抗体或对照(抗gp120-mIgG2a-DANA),持续6周。在最后一次CCl
从小鼠组织分离RNA和定量RT-PCR
分离出整个小鼠肺(博来霉素研究)或小鼠肝叶(CCl
使用了来自Applied Biosystems的以下Taqman基因表达测定试剂盒:
Serpine(Mm00435858_m1)
Fn1(Mm01256744_m1)
Col1a1(Mm00801666_g1)
Col3a1(Mm01254476_m1)
Tgfb1(Mm01178820_m1)
Tgfb2(Mm00436955_m1)
Tgfb3(Mm00436960_m1)
Gapdh小鼠(Cat#4352661)。
CCl4模型中小鼠肝纤维化的组织学分析
处理福尔马林固定的小鼠肝脏样品。对于每只动物,一个切片用H&E染色,一个切片用三色染色法染色。在对组身份不知情的情况下,基于先前公布的方法(Zhao等人,2008Pathol Int 58,580-588),对病变的机构破坏程度和纤维化程度进行评分。
结果
为了扩展上述实例16的观察结果,除了肺纤维化之外,人NAFLD/NASH患者样品中的TGFβ同种型基因表达从已发表的比较轻度与晚期纤维化的数据集进行评估(GSE49541,(Murphy等人,2013Gastroenterology 145,1076-1087;Moylan等人,2014Hepatology 59,471-482))。与IPF肺组织类似,TGFB1的表达水平在疾病严重程度方面相当,而在患有更晚期纤维化疾病的患者的肝脏中,TGFB2和TGFB3均显著增加(图54A)。在四氯化碳(CCl
实例18:在结肠炎模型中,TGFβ2和TGFβ3阻断不促进与泛抗TGFβ阻断相关的增强免疫应答
材料和方法
8至10周龄C57BL/6小鼠(Envigo)连续两天口服接种0.2ml 1X10
按照制造商的建议(Cat#130-097-410,Miltenyi)从盲肠和近端结肠分离小鼠肠固有层。确定总细胞数,并用针对CD3e(Cat#553064,BD Biosciences)、CD4(Cat#553729,BDBiosciences)、CD8(Cat#553036,BD Biosciences)、CD11b(Cat#553312,BD Biosciences)、Ly6G(Cat#551460,BD Biosciences)、Ly6C(Cat#1760-09,Southern Biotech)的抗体染色细胞。数据由Flowjo软件分析。
图56D提供每组(3至5只/组)中剩余小鼠的固有层中的免疫细胞数量,如通过流式细胞术使用它们的表面标志物所确定:T细胞(CD3+;CD4+或CD8+);粒细胞(“Gra”、CD11b+;Ly6G+);单核细胞(“单核细胞”,CD11b+;Ly6C+)。*P<0.05,**P<0.01,NS,P>0.05,单因素方差分析与Dunnett检验。数据代表平均值±SEM。为清楚起见,统计条未显示在实验组之间缺乏名义上显著差异的图表中。
结果
TGFβ信号传导在免疫应答的调节中起关键作用。先前对TGFβ信号传导进行遗传或药理学阻断的研究表明,多个器官中出现过度炎症和白细胞浸润,导致严重的不良毒性(M.J.Anderton等人,Toxicol Pathol 39,916-924(2011);M.S.Mitra等人,Tox Sci,175,24-34(2020);J.C.Marie,等人,Immunity 25,441-454(2006);M.O.Li,等人Immunity 25,455-471(2006))。为了评估TGFβ2和TGFβ3阻断对全身免疫应答的贡献,采用肝螺杆菌感染的IL-10R阻断结肠炎模型(图56A)。该模型通常用于评估失调的免疫应答和肠道微生物群的参与,这是人类炎症性肠病(IBD)的两个主要组成部分(M.C.Kullberg等人,Infectionand immunity 66,5157-5166(1998);M.C.Kullberg等人,Infection and immunity 69,4232-4241(2001);M.C.Kullberg等人,JEM 203,2485-2494(2006))。与先前的研究结果一致,用抗IL10R抗体治疗的肝螺杆菌感染小鼠发展为结肠炎。用泛抗TGFβ抗体(1D11)治疗促进炎症增加,如通过结肠重量增加、炎性细胞因子表达和免疫细胞浸润所证明(图56B至56D)。用保留TGFβ1的抗TGFβ2/3抗体(4A11)治疗的小鼠在这些参数上没有表现出炎症增加。这些结果表明,选择性TGFβ2/3阻断不诱导毒性炎症应答,如使用泛TGFβ阻断所观察到的。
**********
尽管为了清楚理解的目的先前已通过举例说明和实施方案相当详细地描述了本发明,但是这些描述和实施方案不应解释为限制本发明的范围。本文引用的所有专利和科学文献的公开内容均全文以引用方式明确地并入。
- 一种基于传统机器视觉的N95口罩缺陷检测方法
- 一种基于深度学习的N95口罩面脏污破损褶皱缺陷检测方法
