一种热稳定α-淀粉酶
文献发布时间:2023-06-19 11:47:31
技术领域
本发明属于基因工程与酶工程领域,具体涉及一种热稳定α-淀粉酶。
背景技术
α-淀粉酶,即α-1,4-葡聚糖-4-葡聚糖水解酶(EC.3.2.1.1),α-淀粉酶随机作用于淀粉、糖原、寡糖或多聚糖分子内的α-1,4-糖苷键,并将淀粉水解成葡萄糖、麦芽糖、低聚糖等小分子物质。淀粉酶是用途最广、产量最大的一类酶制剂品。工业用α-淀粉酶按微生物来源不同分为细菌α-淀粉酶和真菌α-淀粉酶两大类。细菌α-淀粉酶水解淀粉的主要产物是糊精及少量寡糖和葡萄糖,真菌α-淀粉酶可以水解淀粉和麦芽三糖,终产物主要为麦芽糖和部分低聚寡糖及少量葡萄糖。麦芽糖因其优良的特性,广泛应用于医药工业、食品工业,由于真菌α-淀粉酶具有特殊的高麦芽糖生成能力,使其在很多工业上的应用逐年增加,例如高麦芽糖浆、烘焙和酿造工业等。目前大部分商用真菌α-淀粉酶在麦芽糖浆生产中的最适作用温度在50-55℃之间,但是目前真菌a-淀粉酶普遍存在热稳定性较差的问题。本发明通过大通量筛选获得了热稳定性提高的突变子。
发明内容
本发明的目的是提供一种热稳定α-淀粉酶,使得热稳定α-淀粉酶的最适作用温度有很大的提高,其具有更高的应用潜力和经济价值。
本发明的制备过程如下:
1.从NCBI上获得α-淀粉酶序列(α-amylase,GenBank:KX216807.1,Seq No.1),交生物公司合成,设计PCR引物:5′-TATCGGAATTAATTCGGATCCATGAAGTCTTTCTTAAGTCTCCTTTGC-3′(Seq No.2),5′-TGGTGGTGCTCGAGTGCGGCCGCTTAGTTCTTTTGGAATATGGCAGG-3′(Seq No.3),PCR反应结束后,加20μl Cloning Enh ancer到PCR体系中,37℃孵育15min,80℃孵育15min,采用BamH I、Not I酶切pET20b(+)质粒,酶切产物经过0.75%琼脂糖凝胶电泳后回收,溶于灭菌双蒸水中,将孵育后的PCR产物与纯化的线性载体混合均匀,加入In-Fusion酶,50℃反应15min,转化E.coli JM109,挑取阳性克隆,送生物公司测序,将鉴定正确的质粒转化宿主E.coli BL21进行表达,得到含有野生型序列质粒的基因工程菌;
2.质粒DNA的提取
将携带有质粒pET20b(+)/α-amylase的E.coli BL21基因工程菌接种于LB/Amp(Amp终浓度100μg/mL)液体培养基中,于37℃,200r/min过夜培养后,使用质粒小量提取试剂盒抽提质粒,具体操作按照说明书进行;
3.易错PCR扩增与突变文库的构建
以步骤2获得的质粒为模板,用Not I酶切使质粒线性化,用引物序列5′-TATCGGAATTAATTCGGATCCATGAAGTCTTTCTTAAGTCTCCTTTGC-3′(Seq No.2),5′-TGGTGGTGCTCGAGTGCGGCCGCTTAGTTCTTTTGGAATATGGCAGG-3′(Seq No.3),进行易错PCR扩增基因,易错PCR扩增体系(50μl)为10×TaKaRa Taq Buffer,dNT Ps Mixture,引物各0.2μmol/L,模板DNA 200ng,Taq DNA聚合酶2.5U,5mmol/LMn
4.突变文库的高通量筛选
将步骤3得到的转化E.coli BL21,37℃孵育1h后收集菌体涂布氨苄青霉素抗性培养基(100μg/mL),37℃温育12h,将平板上菌落全部刮取,接种至含100μg/mL氨苄青霉素的100mL LB培养基中,37℃振荡培养14h后提取混合质粒,混合质粒经XbaI酶切后电击转化毕赤酵母GS115,涂布MD平板,待MD平板上出现菌落后,将菌落挑至涂有X-gal的MM培养基上,使X-gal变蓝的菌株即为阳性突变子,挑取阳性菌株接种于48孔培养板中,每孔加入YPD培养基500μL、2%接种量,于28℃、200r/min培养48h,离心收集菌体以500μL BMMY培养基重悬菌体,28℃、200r/min培养48h,每12h补加甲醇至终浓度为0.5%,诱导结束后离心取上清即为粗酶液;
5.酶蛋白纯化
配制AKTA使用的缓冲液,其中A液:20mmol/L磷酸氢二钠-柠檬酸缓冲液(pH7.5),B液:1mol/L氯化钠溶液(20mmol/L磷酸氢二钠-柠檬酸缓冲液,pH7.5),以5倍柱床体积的A液平衡柱子后,粗酶液经A液流入captorQ(1mL)阴离子柱中,通过B液进行梯度洗脱:以5倍柱床体积的11%的B液洗脱杂蛋白,再以5%B液洗脱目的蛋白;
6.粗酶液中蛋白含量的测定
标准曲线绘制:以牛血清蛋白(BSA)为标准品,配置10mg/mL BSA母液,稀释为以下几个梯度:10.0mg/mL、8.0mg/mL、6.0mg/mL、4.0mg/mL、2.0mg/mL、1.0mg/mL、0.5mg/mL,取不同浓度BSA溶液或超纯水40μL,加入5倍稀释后的Bio-Rad考马斯亮蓝蛋白染液260μL,震荡混匀后室温静置15min,取200μL加入酶标板中,于595nm下测定吸光度,记录数值,绘制标准曲线,取粗酶液或纯化后的酶液40μL,加入稀释后染液260μL,混匀后室温静置15min,取200μL加入酶标板中于595nm下测定吸光度,记录数值,根据标准曲线计算酶液的蛋白浓度;
7.酶活及比活力测定
于35℃、45℃、55℃、65℃、75℃测定酶活及比酶活,采用DNS法(3,5-二硝基水杨酸)测定酶活力,比酶活=酶活/蛋白浓度;
8.将比酶活最高的突变子,送生物公司测序。
本发明的有益效果是:
获得的突变α-淀粉酶具有更高的最适反应温度,可以适用于高温环境。
附图说明
图1易错PCR电泳图
图2蛋白标准曲线
图3DNS标准曲线
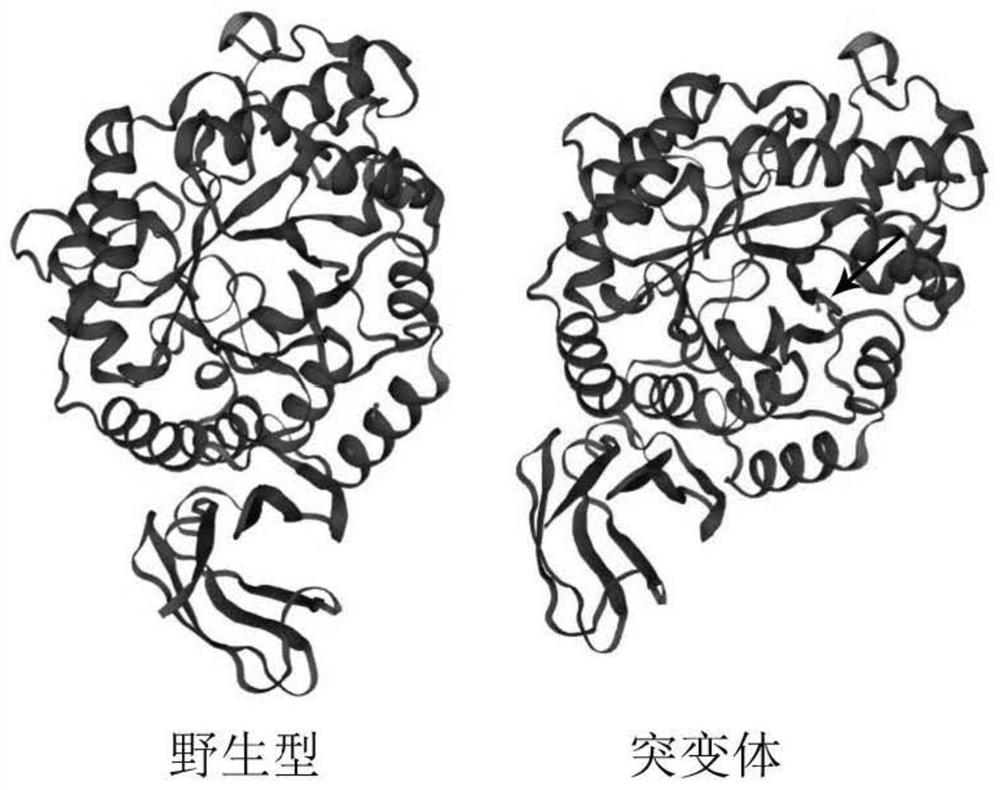
图4突变α-淀粉酶与野生型α-淀粉酶三维建模
具体实施方式
下面通过实施例对本发明做进一步详细说明,实施例仅用来说明本发明,并不限制本发明的范围。
实施例1
本实施例涉及的材料和试剂见表1,实验仪器见表2;
表1实验材料和试剂
表2实验仪器设备
LB培养基配方:胰蛋白胨10g/l,酵母粉5g/l,NaCl 10g/l,pH7.0;
固体LB培养基:每100mL液体LB培养基加2g琼脂粉,高压灭菌;
YPD培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖,pH6.0;
MD固体培养基:0.00004%Biotin,1.34%YNB,2%葡萄糖,1.5%琼脂糖;
MM固体培养基:0.00004%Biotin,1.34%YNB,0.5%甲醇,1.5%琼脂糖;
BMMY培养基:2%蛋白胨,1%酵母提取物,03%K
PTM微量盐:0.6%CuSO
酵母发酵基础盐培养基:0.5%KH
酵母发酵基础盐诱导培养基:0.5%KH
IPTG储存液(200mg/mL):用去离子水配制成200mg/mL异丙基硫代-β-D-半乳糖苷,用0.22μm过滤器过滤除菌,分装成每管1mL,贮存于-20℃;
氨苄青霉素储存液(200mg/mL):用去离子水配制成200mg/mL的氨苄青霉素(Amp)贮存液,用0.22μm过滤器过滤除菌,分装成每管1mL,贮存于-20℃;
50×TAE电泳缓冲液:Tris 242g,冰乙酸57.1mL,0.5mol/L EDTA(pH8.0)100mL,用蒸馏水定容至1L;
琼脂糖溶液(1.2%):称取0.60g琼脂糖,溶解于50mL巴比妥钠-HCl缓冲液中;
1.从NCBI上获得α-淀粉酶序列(α-amylase,GenBank:KX216807.1,Seq No.1),交生物公司合成,设计PCR引物:5′-TATCGGAATTAATTCGGATCCATGAAGTCTTTCTTAAGTCTCCTTTGC-3′(Seq No.2),5′-TGGTGGTGCTCGAGTGCGGCCGCTTAGTTCTTTTGGAATATGGCAGG-3′(Seq No.3),PCR反应结束后,加20μl Cloning Enhancer到PCR体系中,37℃孵育15min,80℃孵育15min,采用BamH I、Not I酶切pET20b(+)质粒,酶切产物经过0.75%琼脂糖凝胶电泳后回收,溶于灭菌双蒸水中,将孵育后的PCR产物与纯化的线性载体混合均匀,加入In-Fusion酶,50℃反应15min,转化E.coli JM109,挑取阳性克隆,送生物公司测序,将鉴定正确的质粒转化宿主E.coli BL21进行表达,得到含有野生型序列质粒的基因工程菌;
2.质粒DNA的提取
将携带有质粒pET20b(+)/α-amylase的E.coli BL21基因工程菌接种于LB/Amp(Amp终浓度100μg/mL)液体培养基中,于37℃,200r/min过夜培养后,使用质粒小量提取试剂盒抽提质粒,具体操作按照说明书进行;
3.易错PCR扩增与突变文库的构建
以步骤2获得的质粒为模板,用Not I酶切使质粒线性化,用引物序列5′-TATCGGAATTAATTCGGATCCATGAAGTCTTTCTTAAGTCTCCTTTGC-3′(Seq No.2),5′-TGGTGGTGCTCGAGTGCGGCCGCTTAGTTCTTTTGGAATATGGCAGG-3′(Seq No.3),进行易错PCR扩增基因(见图1),易错PCR扩增体系(50μl)为10×TaKaRa Taq Buffer,dNTPs Mixture,引物各0.2μmol/L,模板DNA 200ng,Taq DNA聚合酶2.5U,5mmol/LMn
4.突变文库的高通量筛选
将步骤3得到的转化E.coli BL21,37℃孵育1h后收集菌体涂布氨苄青霉素抗性培养基(100μg/mL),37℃温育12h,将平板上菌落全部刮取,接种至含100μg/mL氨苄青霉素的100mL LB培养基中,37℃振荡培养14h后提取混合质粒,混合质粒经XbaI酶切后电击转化毕赤酵母GS115,涂布MD平板,待MD平板上出现菌落后,将菌落挑至涂有X-gal的MM培养基上,使X-gal变蓝的菌株即为阳性突变子,挑取阳性菌株接种于48孔培养板中,每孔加入YPD培养基500μL、2%接种量,于28℃、200r/min培养48h,离心收集菌体以500μL BMMY培养基重悬菌体,28℃、200r/min培养48h,每12h补加甲醇至终浓度为0.5%,诱导结束后离心取上清即为粗酶液;
5.酶蛋白纯化
配制AKTA使用的缓冲液,其中A液:20mmol/L磷酸氢二钠-柠檬酸缓冲液(pH7.5),B液:1mol/L氯化钠溶液(20mmol/L磷酸氢二钠-柠檬酸缓冲液,pH7.5),以5倍柱床体积的A液平衡柱子后,粗酶液经A液流入captorQ(1mL)阴离子柱中,通过B液进行梯度洗脱:以5倍柱床体积的11%的B液洗脱杂蛋白,再以5%B液洗脱目的蛋白;
6.粗酶液中蛋白含量的测定
标准曲线绘制:以牛血清蛋白(BSA)为标准品,配置10mg/mL BSA母液,稀释为以下几个梯度:10.0mg/mL、8.0mg/mL、6.0mg/mL、4.0mg/mL、2.0mg/mL、1.0mg/mL、0.5mg/mL,取不同浓度BSA溶液或超纯水40μL,加入5倍稀释后的Bio-Rad考马斯亮蓝蛋白染液260μL,震荡混匀后室温静置15min,取200μL加入酶标板中,于595nm下测定吸光度,记录数值,绘制标准曲线(见图2),取粗酶液或纯化后的酶液40μL,加入稀释后染液260μL,混匀后室温静置15min,取200μL加入酶标板中于595nm下测定吸光度,记录数值,根据标准曲线计算酶液的蛋白浓度(见表3);
表3酶液蛋白浓度(mg/mL)
7.酶活及比活力测定
7.1配制麦芽糖标准溶液(10mmol/L):称取34.2mg麦芽糖,加蒸馏水定容到10mL:
7.2配制DNS试剂:称取DNS 0.63g溶于50mL水中,置于45℃水浴不断搅拌,加入2mol/L NaOH 26.2mL,缓慢滴加,不断搅拌,称取18.2g酒石酸钾钠、0.5g苯酚、0.5g亚硫酸钠溶于水中;在45℃水浴锅中不断搅拌混匀上述物质,使完全溶解;冷却,加水定容至100mL,置于棕色瓶中保存,4℃冰箱存放至少一周后实用;
7.3绘制DNS标准曲线:取6支试管编号1-6,按照下表4加入麦芽糖标准溶液(10mmol/L)、蒸馏水、DNS试剂,混合均匀后放入沸水浴中煮15min;反应结束后,立即用流动的冷水使其冷却,补加蒸馏水10.5mL,上下颠倒混匀,以6号管作为对照,测定混合液在550nm处的吸光值(见图3);
表4 DNS标准曲线试剂配比
7.4酶活力测定
取400μL用蒸馏水配制的1%(W/V)可溶性淀粉溶液,加入EP管中;加入100μL酶液,于35℃、45℃、55℃、65℃、75℃反应30min;立即吸取250μL反应液于试管中,向试管中加入750μLDNS试剂,混合均匀后在沸水中煮15min;取出试管立即用流动的水冷却,加5.25mL蒸馏水,混匀;用分光光度计测定混合液在550nm处的吸光值;一个酶活力单位(U):一定条件下(45℃),每分钟水解淀粉生成1μmol麦芽糖所需的酶量;酶活的计算公式为:(OD
表5乳糖酶比酶活
7.将比酶活最高的突变子,送生物公司测序。
将比酶活最高的突变子,送生物公司测序(见表6)。
表6比酶活最高突变子序列与野生型序列对比
本发明获得的突变子最适温度比野生型提高20℃。
8.在https://swissmodel.expasy.org/血eractive上,对野生型α-淀粉酶和突变型酶α-淀粉酶进行三维建模(见图4)。
序列表
<110> 广州博识生物科技有限公司
<120> 一种热稳定α-淀粉酶
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1389
<212> DNA
<213> Rhizopus oryzae
<400> 1
atgaagtctt tcttaagtct cctttgcagc gtcttccttt tacctttggt tgtacagtct 60
gtgcctgtca tcaagcgagc ctcagccagc gactgggaga accgagtcat ctaccaattg 120
ttaactgatc gatttgcaaa atcgaccgat gataccaatg gctgcaataa cctgagtgac 180
tactgtggcg gaacatttca aggaatcatt aatcacttgg attacattgc cggaatggga 240
tttgatgcta tctggatatc acctatcccc aaaaatgcga atggaggtta ccatggctat 300
tgggctactg acttttctca aataaatgag cattttggaa ctgctgatga cttgaaaaag 360
ttggttgcag ctgctcatgc aaagaacatg tacgttatgc tggacgttgt tgccaatcat 420
gctggcattc cttcatcagg tggcgactac tctggctaca cgttcggtca aagctctgaa 480
taccacacag cctgtgatat caattacaac agccagacct ctattgagca gtgctggatt 540
tctggtttgc ctgatatcaa cactgaagac tcggccattg ttagcaaatt gaattcgatt 600
gtttctggtt gggtatctga ttatggcttt gacggtcttc gaatcgacac tgtgaagcac 660
attcgtaaag atttctggga cggctatgtc tctgctgctg gtgtatttgc taccggagaa 720
gtgcttagcg gcgatgtttc ttatgtctca ccctatcagc agcatgttcc ttctttactc 780
aactacccat tgtattatcc agtctatgat gtattcacca aatcccgtac catgagccgt 840
ttaagctctg gcttttctga tattaaaaat ggaaacttta aagacattga tgtcttggtc 900
aactttattg acaatcacga tcagcctcgt ttgttatcca aagctgatca aagtctcgtc 960
aagaatgctc ttgcttattc tttcatggtc caaggtatcc ctgtcttgta ctatggtaca 1020
gaacaatcct tcaagggtgg taacgatcct aacaacagag aggtcttatg gaccactggt 1080
tactcgacca catctgatat gtacaagttt gtcactactc ttgtcaaggc acgcaagggc 1140
tcaaactcca cagtaaatat gggaattgct caaaccgata acgtctatgt gttccaaaga 1200
ggtggctctc tggttgttgt caataactat ggtcaaggat caacaaacac aattactgta 1260
aaggctggct cgttctctaa tggagatact ttgactgatg tgttctccaa caaatctgtt 1320
actgttcaaa ataaccagat cacattccaa ttgcagaatg gaaaccctgc catattccaa 1380
aagaactaa 1389
<210> 2
<211> 48
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
tatcggaatt aattcggatc catgaagtct ttcttaagtc tcctttgc 48
<210> 3
<211> 47
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
tggtggtgct cgagtgcggc cgcttagttc ttttggaata tggcagg 47
- 一种热稳定α-淀粉酶
- 一种热稳定性提高的β-淀粉酶突变体
