用于通过照射图案化的薄膜进行局部加热的方法和系统
文献发布时间:2023-06-19 11:55:48
相关申请的交叉引用
本申请要求2018年10月16日提交的标题为“METHOD AND SYSTEM FOR LOCALIZEDHEATING BY ILLUMINATION OF PATTERNED THIN FILMS,”的美国临时专利申请号62/746,490的优先权,据此为了所有目的以引证的方式将该申请的公开全文并入。
背景技术
反应容器通常用于对DNA链执行各种操作,这些操作可以包括例如聚合酶链反应(Polymerase Chain Reaction,PCR)和DNA测序的操作。聚合酶链反应(PCR)已经成为临床实验室、农业科学、环境科学和法医学领域的基本技术。PCR需要热循环或在两个或三个离散温度之间重复改变温度以扩增特定的核酸靶序列。为了实现这样的热循环,常规的台式热循环仪通常使用由珀耳帖(Peltier)元件供电的金属加热块。不幸的是,这种在反应容器内对材料进行热循环的方法可能比期望的慢。至少由于这些原因,期望改进热循环的速度和/或可靠性的替代装置。
发明内容
本公开涉及适于与反应容器一起使用的方法、系统以及设备。
公开了一种反应容器系统,包括:反应容器,该反应容器可以包括:壳体部件;反应室,该反应室由壳体部件限定;以及光吸收层,该光吸收层与限定反应室的壳体部件的面向内部的表面的一部分一致,光吸收层包括多个离散区域;以及第一能量源(例如,被构造为发射例如可见光、红外光、紫外A光等的发光二极管),该第一能量源被构造为引导光穿过壳体部件在光吸收层的多个离散区域中的一个或多个离散区域处的至少一部分。在一些实施例中,反应容器的壳体部件可以限定通道,该通道被构造为在多个离散区域中的两个或更多个不同的离散区域之间引导溶液。在一些实施例中,多个离散区域可以与通道的不同段一致并且可以沿着通道的不同段布置。在一些实施例中,光吸收层可以包括形成或沉积(例如,电镀)到壳体部件的面向内部的表面上的薄金属膜。
在一些实施例中,反应容器组件还可以包括第二能量源。多个离散区域中的第一个可以被构造为接收来自第一能量源的光,并且多个离散区域中的第二个可以被构造为接收来自第二能量源的光。
在一些实施例中,多个离散区域中的每个离散区域可以与布置在反应室内的溶液直接接触。
在一些实施例中,第一离散区域可以与第二离散区域隔开第一距离。在一些实施例中,第一离散区域可以流体地联接到第二离散区域,使得反应容器系统内的溶液不被物理屏障禁止在第一离散区域与第二离散区域之间流动。在一些实施例中,第一能量源可以布置在偏移位置,使得与朝向第二离散区域相比,来自第一能量源的光的更大部分被朝向第一离散区域引导。在一些实施例中,反应容器组件可以包括位于第一离散区域与第二离散区域之间的反射器元件,其中,反射器元件被构造为将来自第一能量源的光的一部分朝向第一离散区域反射。
在一些实施例中,反应容器可以包括:入口,该入口用于接受溶液;通道,该通道联接到入口,溶液被使得流动通过通道;光吸收层,该光吸收层包括多个离散区域,其中,各个离散区域与通道的段相邻,并且其中,离散区域被构造为吸收来自能量源的光能。反应容器还可以包括用于从反应容器中去除溶液的出口。
在一些实施例中,至少一部分通道以蛇形图案布置在反应容器内。离散区域可以布置在反应容器的单个表面上,靠近反应容器的相对端部。在一些实施例中,通道可以被构造为将溶液的一部分从与第一离散区域相邻的通道的第一段引导至与第二离散区域相邻的通道的第二段,其中,第一离散区域可以被构造为当溶液的部分在第一段中时将第一热量传递至溶液的所述一部分,并且其中,第二离散区域可以被构造为当溶液的所述一部分在第二段中时将第二热量传递至溶液的所述一部分。通道可以包括在第一段与第二段之间的居间段,其中,居间段可以例如被构造为当溶液的部分在居间段中时使溶液的所述一部分冷却。在一些实施例中,第一离散区域可以包括第一金属膜,并且第二离散区域可以包括第二金属膜,其中,第一金属膜可以比第二金属膜厚,并且其中,第一热量可以大于第二热量(例如,因为较厚的第一金属膜可以吸收更多的光能)。在一些实施例中,第一金属膜可以具有第一组成,该第一组成具有第一温度分布,并且第二金属膜可以具有第二组成,该第二组成具有第二温度分布。在这些实施例中,第一热量可大于第二热量(例如,由于组成的差异)。
在一些实施例中,通道的第一段可具有第一平均横截面积,并且第二段具有第二平均横截面积,其中,第一平均横截面积大于第二平均横截面积。在这些实施例中,与第二段相比溶液可以更慢地流过第一段。
在一些实施例中,反应容器可以包括:入口,该入口用于接受溶液进入反应室,其中,反应室可以由形成外周边的一个或多个壁限定;光吸收层,该光吸收层包括布置在外周边内的多个离散区域,其中,离散区域可被构造为吸收来自能量源的光能,并且其中,离散区域可流体地联接,使得溶液不被物理屏障禁止在离散区域之间流动。在一些实施例中,反应容器还可以包括用于从反应容器中去除溶液的出口。
在一些实施例中,光吸收层可以包括形成或沉积(例如,电镀)到反应容器的面向内部的表面上的薄金属膜,使得离散区域被构造为直接接触溶液。在其它实施例中,基底可以覆盖光吸收层,使得溶液不直接接触离散区域。
在一些实施例中,多个离散区域可以包括第一离散区域和第二离散区域,其中,第一离散区域可以包括第一金属膜,并且第二离散区域可以包括第二金属膜,其中,第一金属膜比第二金属膜厚。在这些实施例中,第一离散区域可具有与第二离散区域不同的温度分布(例如,因为较厚的第一金属膜可吸收更多的光能)。在一些实施例中,第一金属膜可以具有第一组成,该第一组成具有第一温度分布,并且第二金属膜可以具有第二组成,该第二组成具有第二温度分布。在这些实施例中,第一温度分布可以不同于第二温度分布(例如,由于组成的差异)。
在一些实施例中,反应容器可以至少部分地由顶部壳体部件和底部壳体部件限定,其中,多个离散区域可以包括形成或沉积到顶部壳体部件的面向内部的表面上的多个顶部离散区域和形成或沉积到底部壳体部件的面向内部的表面上的多个底部离散区域。特定的顶部离散区域可布置为与特定的底部离散区域直接相对,使得当特定的顶部离散区域和特定的底部离散区域被加热至阈值温度时,溶液的一部分中的分子可被热约束在由特定的顶部离散区域和特定的底部离散区域限定的区域内。在一些实施例中,顶部离散区域和底部离散区域可具有不同的阈值温度。在其它实施例中,顶部离散区域和底部离散区域可具有相同的阈值温度。
在一些实施例中,多个离散区域中的第一离散区域可被构造为结合一个或多个核苷酸序列。在一些实施例中,第一离散区域可被构造为经由弱共价相互作用结合核苷酸序列。例如,第一离散区域可以包括金膜,并且弱共价相互作用可以包括Au-硫醇键。
在一些实施例中,一种操作反应容器的方法可以包括:经由反应容器的入口将溶液接受到反应容器中;使得溶液在光吸收层的多个离散区域上流过反应容器;将第一光引导到光吸收层的多个离散区域中的第一离散区域处,这使得来自第一光的能量被第一离散区域吸收;以及使得溶液的与第一离散区域相邻的部分被加热(例如,当溶液在第一离散区域附近流动时经由传导或对流)。
在一些实施例中,该方法还可以包括:将第二光引导到第二离散区域处,以使得来自第二光的能量被第二离散区域吸收。在一些实施例中,第一光可以来自第一光源,并且第二光可以来自第二光源。第二光源可以被设置为比第一光源低的功率水平。在一些实施例中,第一光源可被定位为使得其离第一离散区域比第二离散区域更近。在一些实施例中,第一离散区域和第二离散区域可以沿着反应容器的第一面向内部区域布置。第一离散区域和第二离散区域可流体地联接,使得溶液不被物理屏障禁止在离散区域之间流动。
在一些实施例中,使得溶液流过反应容器可包括:使得溶液流过具有与第一离散区域相邻的第一段和与第二离散区域相邻的第二段的通道。第一离散区域可与第二离散区域隔开。
在一些实施例中,反应容器可以至少部分地由顶部壳体部件和底部壳体部件限定,其中,多个离散区域可以包括形成或沉积到顶部壳体部件的面向内部的表面上的多个顶部离散区域和形成或沉积到底部壳体部件的面向内部的表面上的多个底部离散区域。在这些实施例中的一些中,特定的顶部离散区域可布置为与特定的底部离散区域直接相对。在这些实施例中,第一光可被引导到特定的顶部离散区域处,以使得特定的顶部离散区域达到第一阈值温度,并且第二光可被引导到特定的底部离散区域处,以使得特定的底部离散区域达到第二阈值温度,使得溶液的一部分中的分子可被热约束在由特定的顶部离散区域和特定的底部离散区域限定的区域内。
在一些实施例中,一个或多个核苷酸序列可以经由弱共价相互作用结合到第一离散区域。例如,第一离散区域可以包括金膜,并且弱共价相互作用可以包括Au-硫醇键。
本发明的其它方面和优点将通过结合附图采取的以下详细描述而变得显而易见,附图以示例的方式例示了所描述的实施例的原理。
附图说明
本公开将通过以下结合附图的详细描述来容易地理解,附图中,同样的附图标记指示同样的结构元件,并且附图中:
图1A示出了适于与所述实施例一起使用的示例性反应容器;
图1B示出了适于与所述实施例一起使用的另一示例性反应容器;
图1C示出了气隙区域如何建立减少热在相邻示例反应容器之间的侧向传递的健壮的屏障;
图2示出了示例反应容器的示意性横截面侧视图以及反应室可以如何关闭;
图3A示出了示例反应容器的横截面侧视图以及光吸收层可以如何分离成离散区域;
图3B至图3C示出了由能量源阵列照射的示例反应容器的横截面侧视图;
图3D示出了在光吸收层的离散区域之间具有不同尺寸间隙的示例反应容器的一部分的热分布的横截面侧视图;
图3E示出了示例反应容器的横截面侧视图,其中在相对的面向内部的表面上的离散区域限定反应室的至少一部分;
图4A示出了具有采用蛇形通道形式的反应室的示例反应容器的示意性透视图;
图4B示出了图4A中描绘的示例反应容器的顶视图;
图4C示出了包括具有一致离散区域的光吸收层的示例反应容器的另一实施例;
图4D至图4F示出了示例反应容器(例如图4C所示的反应容器)的侧向横截面;
图5A示出了包括壳体部件的示例反应容器,壳体部件具有由两个离散区域组成的光吸收层;
图5B示出了可以如何将能量源朝向两个离散区域中的一个偏移使得离散区域中的一个比另一个离散区域从能量源接收更多的能量;
图5C示出了图5A和图5B所描绘的示例反应容器的顶视图、以及示例反应容器可以如何包括用于在两个离散区域之间来回引导溶液的通道;
图6例示了反应容器的示例温度分布,清楚地示出了与单个PCR循环相关联的各个步骤;
图7A至图7C示出了在具有光吸收层的反应容器中的杂交和固相PCR操作的示例,光吸收层具有多个离散区域;
图7D示出了固相PCR的另一示例,其中单链DNA与附着于光吸收层的离散区域的单链DNA结合;以及
图8例示了用于操作反应容器的示例方法800。
具体实施方式
在以下详细描述中,参考附图,附图形成描述的一部分,并且在附图中,以例示的方式示出了根据所描述实施例的特定实施例。尽管足够详细地描述了这些实施例以使得本领域技术人员能够实践所描述的实施例,但是应当理解,这些示例不是限制性的;从而可以使用其它实施例,并且可以在不脱离所述实施例的精神和范围的情况下进行改变。
微流体系统或装置在化学和生物学中具有广泛的用途。在这样装置中,流体被输送、混合、分离或以其它方式处理。在许多微流体装置中,各种应用依赖于使用毛细力的被动流体控制。在其它应用中,外部致动装置(例如,旋转驱动器)用于流体的定向输送。“主动微流体”指代通过例如微型泵或微型阀的主动(微型)部件对工作流体的限定操纵。微型泵以连续方式供应流体或用于定量给料。微型阀确定所泵送液体的流动方向或移动模式。通常在实验室中进行的过程可以在单个芯片上被小型化,以便提高效率和移动性而且减少样品和试剂体积。微流体结构可以包括微型气动系统,即,用于处理片外流体的微型系统(液体泵、气体阀等)以及用于纳升(nl)和皮升(pl)体积的片上处理的微流体结构(Nguyen和Wereley,Fundamentals and Applications of Microfluidics,Artech House,2006年)。
微流体技术的进步正在彻底改革用于酶分析(例如,葡萄糖和乳酸测定)、DNA分析(例如,聚合酶链反应和高通量测序)和蛋白质组学的分子生物学程序。微流体生物芯片将例如检测的测定操作以及样本预处理和样本制备集成在一个芯片上(Herold和Rasooly,editors,Lab-on-a-Chip Technology:Fabrication and Microfluidics,CaisterAcademic Press,2009年;Herold和Rasooly,editors,Lab-on-a-Chip Technology:Biomolecular Separation and Analysis,Caister Academic Press,2009年)。生物芯片的新兴应用领域是临床病理学,尤其是疾病的即时定点护理诊断。另外,一些基于微流体的装置能够对于生化毒素和其它危险病原体连续取样和实时测试空气/水样品。
目前使用许多类型的微流体结构,包括开放式微流体、连续流微流体、基于液滴的微流体、数字微流体、基于纸的微流体和DNA芯片(微阵列)。
在开放式微流体中,系统的至少一个边界被去除,这将流体暴露于空气或另一界面(即,液体)(Berthier等人,Open microfluidics,Hoboken,NJ:Wiley,ScrivenerPublishing,2016年;Pfohl等人,Chem Phys Chem.4:1291-1298,2003年;Kaigala等人,Angewandte Chemie International Edition.51:11224-11240,2012年)。开放式微流体的优点包括可进入流动液体以进行干预、较大的液气表面积和最小化的气泡形成(Berthier等人,Open microfluidics,Hoboken,NJ:Wiley,Scrivener Publishing,2016年;Kaigala等人,Ange.Chemie Int.Ed.51:11224-11240,2012年;Li等人,Lab on a Chip 17:1436-1441)。开放式微流体的另一个优点是将开放系统与表面张力驱动的流体流整合的能力,这消除了对例如蠕动泵或注射泵的外部泵送方法的需要(Casavant等人,Proc.Nat.Acad.Sci.USA 110:10111-10116,2013年)。开放式微流体装置通过研磨、热成型和热压印制造也是廉价的(Guckenberger等人,Lab on a Chip,15:2364-2378,2015年;Truckenmuller等人,J.Micromechanics and Microengineering,12:375-379,2002年;Jeon等人,Biomed.Microdevices 13:325-333,2010年;Young等人,Anal.Chem.83:1408-1417,2011年)。另外,开放式微流体消除了对胶合或结合用于装置的盖的需要,该盖对于毛细流动可能是有害的。开放式微流体的示例包括开放通道微流体、基于轨道的微流体、基于纸的微流体和基于线的微流体(Berthier等人,Open microfluidics,Hoboken,NJ:Wiley,Scrivener Publishing,2016年;Casavant等人,Proc.Nat.Acad.Sci.USA 110:10111-10116,2013年;Bouaidat等人,Lab on a Chip 5:827,2005年)。
连续流微流体基于通过微制造通道的连续液流的操纵(Nguyen等人,Micromachines 8:186,2017年;Antfolk和Laurell,Anal.Chim.Acta 965:9-35,2017年)。液体流的致动通过外部压力源、外部机械泵、集成机械微型泵或通过毛细力和电动机构的组合来实现。连续流装置对于许多明确限定的和简单的生化应用以及对于例如化学分离的某些任务是有用的,但是它们不太适合于需要高度灵活性或流体操纵的任务。连续流系统中的工艺监测能力可以利用基于微机电系统(MEMS)技术的高灵敏度微流体流量传感器来实现,该技术提供了下至纳升范围的分辨率。
基于液滴的微流体以低雷诺数和层流态操纵不混溶相的离散体积的流体(参见以下文献的综述:Shembekar等人,Lab on a Chip 8:1314-1331,2016年;Zhao-Miao等人,Chinese J.Anal.Chem.45:282-296,2017年)。微滴允许方便地操纵微小体积(μl至fl)的流体,提供良好的混合、封装、分选和感测,并且适于高通量应用(Chokkalingam等人,Lab ona Chip 13:4740-4744,2013年)。
封闭通道连续流系统的替代包括开放结构,其中,使用电润湿在基底上操纵离散的、独立可控的液滴。通过使用离散的单位体积液滴(Chokkalingam等人,Appl.PhysicsLett.93:254101,2008年),微流体功能可以降低为一组重复的基本操作,即,在一个单位的距离上移动一个单位的流体。这种“数字化”方法便于将分级的、基于细胞的方法用于微流体生物芯片设计。因此,数字微流体提供了灵活的、可扩展的系统架构以及高容错性。而且,因为可以独立地控制各个液滴,所以这些系统还具有动态可重构性,据此,可以重构微流体阵列中的单位细胞组以在一组生物测定的同时执行期间改变它们的功能性。替代性地,可以在受约束的微流体通道中操纵液滴。数字微流体的一种常见的致动方法是介质上电润湿(Electrowetting-on-Dielectric,EWOD)(参见Nelson和Kim,J.Adhesion Sci.Tech.,26:12-17,1747-1771,2012年)。在使用电润湿的数字微流体范例中已经证明了许多芯片实验室应用。然而,最近,还已经使用磁力((Zhang和Nguyen,Lab on a Chip 17.6:994-1008,2017年)、表面声波、光电润湿、机械致动(Shemesh等人,Biomed.Microdevices 12:907-914,2010年)等证明了用于液滴操纵的其他技术。
基于纸的微流体(Berthier等人,Open Microfluidics,John Wiley&Sons,Inc.第229–256页,2016年)依赖于在多孔介质中的毛细渗透现象。为了在二维和三维上调节流体在例如纸的多孔基底中的渗透,可以控制微流体装置的孔结构、润湿性和几何形状,而液体的粘度和蒸发速率起到更重要的作用。许多这样的装置的特征在于在亲水性纸上的疏水性屏障,这些屏障被动地将水溶液输送到发生生物反应的出口(Galindo-Rosales,ComplexFluid-Flows in Microfluidics,Springer,2017年)。
早期的生物芯片基于DNA微阵列的思想,例如,来自美国昂飞公司(Affymetrix)的GeneChip DNA阵列,它是一块玻璃、塑料或硅基底,上面以阵列附连DNA分子(探针)。与DNA微阵列类似,蛋白质阵列是其中在芯片表面上沉积大量不同捕获剂(例如单克隆抗体)的阵列。捕获剂用于确定例如血液的生物样品中的蛋白质的存在和/或量。对于综述,参见例如Bumgarner,Curr.Protoc.Mol.Biol.101:22.1.1-22.1.11,2013年。
除了微阵列之外,生物芯片已经被设计用于二维电泳、转录组分析和PCR扩增。其它应用包括用于蛋白质和DNA的各种电泳和液相色谱应用、细胞分离(特别是血细胞分离)、蛋白质分析、细胞操纵和分析(包括细胞活性分析和微生物捕获)。
反应容器通常用于对DNA链执行各种类型的操作,包括聚合酶链反应(PCR)和DNA测序。反应容器可以并入有上面列出的微流体架构中的一个或多个,但是应当理解,反应容器可以大于微流体装置,并且由于该原因可以不并入上面描述的微流体架构中的任何一个。反应容器的操作通常包括需要在反应容器内进行快速温度变化。例如,在PCR操作中,将含有DNA链的溶液定位在由反应容器限定的反应室内。加热元件用于热循环溶液,以便分解和/或构建各种不同类型的DNA。不幸的是,热循环溶液的常规手段通常比期望的慢,并且不能改变反应容器内的反应室的特定区域的温度。
该问题的一种解决方案是将光吸收层定位在反应容器的反应室内,该光吸收层具有光吸收特性,该光吸收特性允许吸收由光吸收层吸收的任何光中50%至90%之间的光子能量。能量源可被构造为将光引导到光吸收层处,光吸收层从被引导到光吸收层处的光的光子高效地吸收能量。光子能量的吸收迅速地提高光吸收层的温度。然后,通过热传导将光吸收层接收到的该能量传递到反应室内的溶液。
在一些实施例中,光吸收层被分成离散区域。将光吸收层分成离散区域具有以下优点:(1)将离散区域图案化成不同的形状和厚度允许在反应容器的反应室内实现特定的空间加热分布;(2)光学传感器能够通过离散区域之间的间隙读取反应室内的溶液;并且(3)可以使用能量源阵列来将不同量的能量加到光吸收层的各个离散区域,从而允许反应室第一区域内的溶液具有与反应室第二区域内的溶液大幅不同的温度。
下面参考图1A至图6D讨论这些和其它实施例;然而,本领域技术人员将容易地理解,本文关于这些附图给出的详细描述仅用于说明目的,而不应被解释为限制性的。在以下描述中,参考附图,附图形成描述的一部分,并且在附图中,以例示的方式示出了可以实现本发明的具体实施例。例如“顶部”和“底部”的术语参考所描述的附图的方位来使用。因为本发明的实施例的部件可以以多个不同的方位定位,所以这些术语用于例示的目的而不旨在是限制性的。
图1A示出了适于与所述实施例一起使用的示例性反应容器100的透视图。特别地,反应容器100包括由限定反应室104的光学透明材料形成的壳体部件102。虽然反应室104被描绘为具有基本上圆形的几何形状,但是应当理解,反应室104的所描绘的形状不应当被解释为限制性的,并且例如椭圆形、菱形和矩形的其他形状也是可能的。在一些实施例中,形成壳体部件102的光学透明材料可以仅对用于加热反应室100的那些波长的光是光学透明的。例如,光学透明材料可以是光学透明的,以仅选择可见、红外或紫外频率的光。反应室104可以由第二壳体部件(未描绘)封闭,该第二壳体部件封闭在反应室104内被加热的液体。这样,反应室104内的液体溶液中的DNA链可以经历快速的热循环,并且溶液的任何蒸发部分的至少一部分可以随后在热循环之间或在热循环完成之后冷凝回到溶液中。光吸收层106可以形成或沉积(例如,电镀)或以其他方式粘附到反应室104的面向内部的表面上。光吸收层106具有良好的光吸收特性,并且可以与布置在反应室104内的任何液体直接接触。例如,光吸收层106可以被构造为吸收入射到光吸收层106的光子能量的大约50-90%。在一些实施例中,光吸收层106可以是由元素金、铬、钛、锗或金合金形成的金属膜,金合金例如为金-锗、金-铬、金-钛、金-铬-锗和金-钛-锗。在一些实施例中,光吸收层106可以是由元素金、铬、钛、锗或金合金形成的多层金属膜,金合金例如为金-锗、金-铬、金-钛、金-铬-锗和金-钛-锗。光吸收层106可以具有约5-200nm的厚度。壳体部件102还限定了入口通道108和出口通道110,它们可以用于使各种化学品、引物、DNA链和其它生物材料循环进出反应室104。在一些实施例中,壳体部件152可具有约7mm乘14mm的尺寸;然而,应当理解,该尺寸可以变化。在一些实施例中,壳体部件的最大尺寸可小于500微米。
图1B示出了另一示例性反应容器150的透视图。类似于反应容器100,反应容器150包括壳体部件152、反应室104、光吸收层106、入口通道108和出口通道110。装置壳体152包括容纳气隙区域154和156的包括的加宽中心区域。可以使气隙区域154和156为空,以便阻止热侧向传递到相邻的反应容器。在一些实施例中,通过气隙区域154和156的热传递可以通过从气隙区域154和156去除空气来进一步减少。在一些实施例中,壳体部件152的直径可为约5mm;然而,应当理解,该尺寸可以变化。例如,壳体部件152的直径可在2mm至15mm之间变化。
图1C示出了壳体部件152的形状如何允许反应容器150紧密地包装成蜂窝或六边形模式。图1C还例示了气隙区域154和156如何能够建立减少相邻反应容器150之间的侧向热传递的健壮屏障。当反应容器150的直径为约5mm时,反应室104可保持约10μl的溶液,并且具有800μm的深度。通常,这些装置被构造为保持2.5μl至500μl,深度为200-1500μm。
图2示出了示例反应容器100的示意性横截面侧视图以及由壳体部件102限定的反应室104可以如何被壳体部件202封闭,该壳体部件可以采取盖的形式。在一些实施例中,壳体部件102和202可密封在一起以防止污染并允许控制其它因素,例如反应室104内的压力。图2还示出了被构造为将光投射到光吸收层106上的能量源204。由能量源204投射的光的频率可以变化。在一些实施例中,能量源204可以采取发光二极管的形式,该发光二极管被构造为发射具有450nm波长、890mW功率和700mA电流的光。在一些实施例中,发光二极管可以被构造为发射近红外或紫外(例如,紫外A)光。当光吸收层106被能量源照射时,在热金属表与布置在反应室104内的较冷的周围溶液之间出现大的温差,这导致周围溶液的加热。当能量源停止照射光吸收层106时,产生的光吸收层106的快速冷却有助于促进加热溶液的快速冷却。
图3A示出了示例反应容器100的横截面侧视图以及光吸收层106可以如何分离成离散区域302、304和306。这些离散区域可以叠加在一个或多个面向内部的表面(例如,面向内部的表面301)的顶部上。在一些实施例中,这些离散区域可以被设置成帮助建立进入反应室104的目标量的能量。与延伸跨越反应室104的整个底表面的光吸收层相比,区域302、304和306之间的间隙减小了从能量源204接收光所跨越的总表面积。增加或减小区域302、304和306之间的间隙的尺寸可以用于调节输入到反应室104中的能量。与反应室104内的溶液接触的总面积也减小,从而降低了从离散区域302、304和306到溶液的传热效率。区域302、304和306之间的间隙还允许光学监测反应室104内的溶液。区域302、304和306之间的间隙的尺寸可以不一致,这允许反应室104内的一些区域比其它区域被大幅更多地加热。在一些实施例中,离散区域中的一个或多个可具有不同的尺寸以允许不同的加热分布。例如,如图3A例示,离散区域306可以比离散区域302和304厚,从而提高了将热吸入离散区域306附近的反应室104中的效率。结果,在其他都相同(例如,假设离散区域具有相同的组成)的情况下,该示例中的离散区域306可以从能量源204吸收更多的能量,因此在给定的时间段内经历比离散区域302和304更快或更大的温度升高。在一些实施例中,离散区域中的一个或多个可具有不同的组成,这允许不同的温度分布。例如,参考图3A,离散区域302可以是由元素金形成的金属膜,而离散区域304和306可以是由多层金属膜形成的金属膜(替代性地或另外地,这些区域可以由金合金或其他合适的材料形成)。在这些实施例中,在其他都相同(例如,假设一致的尺寸)的情况下,离散区域302和304可以以第一速率从能量源204吸收能量,而离散区域306可以以第二速率从能量源204吸收能量。如对本领域技术人员而言将显而易见的,本文公开的反应容器的离散区域允许微调的加热控制,与常规反应容器相比,这允许提高的灵活性和更大量的应用。尽管图3A至图3D所例示的反应容器仅示出了三个离散区域(302、304、306),但是本公开考虑了任何数量的离散区域,各个离散区域的尺寸和组成可以如本文所述进行修改。
尽管本文所述的离散区域(例如,图3A的离散区域302、304和306)彼此分离,但至少出于本公开的目的,它们仍然是同一单层的一部分,因为它们叠加在同一表面(例如,图3A的面向内部的表面301)的顶部上。而且,尽管离散区域的厚度和/或高度可以变化,但是为了本公开的目的,离散区域可以仍然是同一单层的一部分。层的部分可以具有不同的厚度和/或高度。例如,参考图3A,尽管离散区域306的厚度不同于其它离散区域(例如,离散区域302和304)的厚度,但是所有三个离散区域302、304和306可以被认为是同一层的一部分。
图3B示出了由能量源阵列照射的另一示例反应容器100的横截面侧视图。在一些实施例中,可以使用多个能量源来加热反应容器。在一些实施例中,多个能量源可以如图3B中所描绘的那样布置成阵列。参考图3B,通过允许能量源308仅将能量聚焦在离散区域302、304和306上,多个能量源308的使用可以减少耗散在离散区域302、304和306之间的壳体部件102的区域中的光量。使用离散能量源308还可允许对各个离散区域进行更一致的加热以及总体上更高效地加热。这可能是因为来自各个能量源的能量可以被优化为聚焦在一个或多个对应的离散区域上,从而确保对应的离散区域从能量源接收最优量的能量。例如,参考图3B,能量源308-1可以聚焦在离散区域302上,使得整个离散区域302从能量源308-1接收最大量的能量,其中来自能量源308-1的能量耗散最小。在一些实施例中,能量源308可以包括专门的聚焦光学器件,以专门瞄准离散区域302、304或306中的一个。在一些实施例中,可以单独控制能量源308阵列的各个能量源308,以在反应室104内产生期望的热梯度。这种控制程度在例如不同类型的生物材料被附着到离散区域302、304和306的附近或直接附着到其上的情况下可以是有用的。因为能量源308可以单独控制,所以与特定离散区域相关联的生物材料可以根据定制的加热分布来加热。例如,接近离散区域306的生物材料可以具有比接近离散区域302和304的生物材料大幅更低的变性温度。由此可见,能量源308-1和308-2可以在比能量源308-3更高的功率水平下操作,这可以允许实现两种类型的生物材料的期望变性温度。
图3C示出了由能量源阵列照射的示例反应容器100的横截面侧视图。图3C示出了壳体部件202可以如何包括多个突起或脊303,其与壳体部件102的突起或脊305接触,以将反应室104分成多个更小的反应室104-1、104-2和104-3。这样,反应室104内的溶液可以被分离,这进一步改善了由离散区域302、304和306实现的热隔离。尽管壳体部件202和102都被示出为包括各自的突起303和305,但是应当理解,在一些实施例中,突起303可以一直延伸到壳体部件102的平坦的面向内部的表面,或者突起305可以一直延伸到壳体部件202的平坦的面向内部的表面。在一些实施例中,反应容器100可包括具有不同构造的突起303的多个不同的壳体部件202。例如,没有突起的壳体部件202可以允许用单个反应室104进行反应,并且在随后的实验或操作中,所描绘的具有突起303的壳体部件202可以将反应室分成多个较小的反应室,如图描绘。在一些实施例中,突起303和305可以被成形并确定尺寸以限定不同尺寸的反应室。例如,参考图3C,突起303和305被成形和确定尺寸,使得反应室104-2小于反应室104-1和104-3。控制反应室的尺寸可以用于影响反应室的温度分布。例如,相对小的反应室(例如104-2)可比相对大的反应室(例如104-1和104-3)更快地加热。在一些实施例中,也可以改变能量源308的能量水平以影响反应室的温度分布。例如,如图3C例示,能量源308-2可以以低于能量源308-1和308-3的功率水平操作。
在一些实施例中,壳体部件202可以包括限定不同尺寸的反应室104的突起303的构造。例如,壳体部件202可以仅包括一个突起303,该突起限定包括两个离散区域302和304的一个反应室和仅包括离散区域306的另一个反应室。在一些实施例中,为了类似的效果,可以调节壳体部件102的突起305的构造。例如,壳体部件102可以仅包括一个突起305,该突起限定包括两个离散区域302和304的一个反应室和仅包括离散区域306的另一个反应室。在一些实施例中,突起303和305可以彼此对应。基于前述示例,壳体部件202可包括一个突起303,壳体部件102可包括一个突起305,其中,突起303和305限定包括两个离散区域302和304的一个反应室和仅包括离散区域306的另一个反应室。应当理解,突起303和/或305可以在它们的远端包括密封元件,这些密封元件有助于防止溶液在相邻反应室104之间通过。
图3D示出了在光吸收层的离散区域302、304和306之间具有不同尺寸间隙的示例反应容器的一部分的热分布的横截面侧视图。特别地,壳体部件102被描绘为具有四个不同的离散区域构造,它们通过标记102-1、102-2、102-3和102-4来区分。这些构造描绘了两组轮廓,这些轮廓指示在与离散区域302、304和306相邻的溶液部分中发生的能量或温度变化量。特别地,这些描绘示出了调节相邻离散区域之间的间隙尺寸可以如何改变具有溶液的反应室的加热分布。壳体部件102-4仅示出了大的单个离散区域,或者替代性地,由区域302、304和306组成的离散区域,区域302、304和306彼此抵靠接触,使得它们有效地形成单个离散区域。应当注意,虽然将离散区域302、304和306放置成抵靠接触在壳体部件102-4的中心部分中产生最大的加热区域,但是在一些实施例中,壳体部件102的外围端可以降到期望温度以下。
图3E示出了示例反应容器100的横截面侧视图,其中在(例如,顶部壳体部件202和底部壳体部件102的)相对的面向内部的表面301和309上的离散区域302-307限定反应室104的至少一部分。在所例示的示例中,离散区域302-307接收来自能量源204的能量,这使得离散区域302-307被加热,从而提高了布置在反应室104内的溶液的温度。如图例示,离散区域302-307可以被电镀或以其它方式形成或沉积到面向内部的表面301和309上。替代性地,在一些实施例中,离散区域302-307可布置在壳体部件(例如,顶部壳体部件202和底部壳体部件102)内或外部。在一些实施例中,参考图3E,虽然热可以随时间扩散穿过整个反应室104,但是该扩散足够慢,使得存在其中与离散区域302-307相邻(例如,在加热区域311、312和313内)的溶液部分可以被加热到比周围溶液更高的温度的时间段。在一些实施例中,这些部分可以是圆柱形、凹圆柱形、凸圆柱形、球形等。在一些实施例中,加热区域(例如,加热区域311、312和313)与周围区域之间的温度梯度可导致加热区域中分子的热约束。例如,即使在加热区域311、312和313之间可能不存在物理屏障,温差也可禁止分子从这些区域扩散到周围溶液,使得可以说各个加热区域内的分子被热约束在它们各自的区域内。这样,加热区域311、312和313可以形成可以用于执行不同反应的子室。在一些实施例中,这种热约束可以通过将顶部壳体部件202和底部壳体部件102的离散区域加热到至少阈值温度来引起,该阈值温度可以是已知引起反应容器100内的热约束的预定温度。例如,离散区域303可被加热至第一阈值温度,并且离散区域302可被加热至第二阈值温度。在一些情况下,第一阈值温度和第二阈值温度可以相同或基本上相同。在其它情况下,第一阈值温度和第二阈值温度可以不同。
图4A示出了包括壳体部件402的示例反应容器400的示意性透视图。壳体部件402包括分布到多个离散区域406中的光吸收层,该光吸收层被构造为接收来自能量源408的光学辐射,以用于对布置在反应容器400内的溶液进行局部加热。在一些实施例中,光吸收层可以是连续的、非离散的层,其中除了对应于离散区域406的部分之外,所有部分都被壳体部件402遮蔽。在其他实施例中,光吸收层可以是与施加在壳体部件402上或内的离散区域406对应的离散部分。如图例示,壳体部件402可具有采取蛇形通道形式的反应室,溶液可通过该蛇形通道流过各个离散区域406。溶液通过蛇形通道410的流动可以以许多方式促进,包括通过泵、通过重力或通过芯吸结构。应当理解,各个离散区域406也可以构造有其自己的相应能量源408,类似于图3B所描绘的构造。
图4B示出了具有形成光吸收层的多个离散区域406-1至406-8的示例反应容器400的顶视图。虽然图4B示出了溶液沿第一方向流过蛇形通道410的方向,但是应当理解,溶液通过蛇形通道410的流通可沿与第一方向相反的第二方向移动。例如,在包括泵机构的实施例中,溶液通过蛇形通道410的流动可以在反应期间的不同点反向,以实现布置在通道410内的溶液的期望的热加热分布。在一些实施例中,单链DNA可以被附连到定位于一个或多个离散区域406-1至406-8顶部的结合物,这允许溶液内的生物材料沿着通道410传导,以在由传递到离散区域406-1至406-8处的溶液的热所生成的各种温度下与单链DNA相互作用。在一些实施例中,离散区域406-1至406-8所吸收的热可以通过本文公开的任何机制(例如,通过改变离散区域的组成、离散区域的厚度、对应光源的功率水平、相应光源的位置等)而改变。在一些实施例中,溶液通过通道410的部分的速度可通过增加通道的宽度和/或深度而变化。通过增加通道的一部分的宽度和/或深度,增加了通道沿着该部分的横截面积A。因此,在其它都相同的情况下,通过该部分的流动速度降低。例如,与具有相对大的平均横截面积的通道部分相比,溶液可以更快地流过具有相对小的平均横截面积的通道部分。根据不可压缩流体的连续性方程(其近似适用于大多数溶液)A
图4C示出了包括具有一致离散区域414的光吸收层的示例反应容器400的另一实施例。如图4C例示,一致的离散区域414通常与通道410的段的形状一致。一致离散区域允许来自能量源的能量以通道410的特定段为目标。在这样的实施例中,可以增加或减小在连续离散区域之间的通道410的段的长度(并且类似地,可以增加或减小与一致离散区域414相关联的通道410的段的长度)。例如,流过段410-1(布置在离散区域414-1与414-2之间的通道410的段)或段410-2(布置在离散区域414-2与414-3之间的通道410的段)的溶液比溶液通过段410-3(布置在离散区域414-3与414-4之间的通道410的段)时具有更少的冷却时间。这可能是由于如下事实:如所描绘的,段410-1和410-2比段410-3短,因此在它们流过加热的离散区域之间的通道410期间具有较少的机会冷却。作为另一个示例,当溶液沿着区域414-1流动时比沿着区域414-2流动时加热更长的时间(例如,因为如所描绘的,离散区域414-1比离散区域414-2长)。如前所述,图4C所例示实施例的离散区域可以被修改以改变它们各自的温度分布(例如,通过改变它们的组成、它们的厚度和其它尺寸等),或者可以从一个或多个能量源接收不同量的能量(例如,通过将相应的能量源设置在不同水平)。同样如前所述,图4C所例示实施例的通道410可被修改以改变流动(例如,通过改变通道的横截面积A)。同样如前所述,各个离散区域414可以由共享的能量源、由其自己的专用能量源、或由照射离散区域414的子集的能量源来支持。应当理解,尽管反应室是在如图1A至图3B所示的单一室、如图3C所示的分开的反应室和图4A至图4C中的通道的上下文中描述的,但是其它反应室构造也是可能的。例如,反应室可以采取由定位于两个平板之间的一系列胶通道限定的内部体积的形式,或者可以简单地由反应容器基底上的位置构成。通常,反应室可以被认为是由反应容器限定的任何流体路径,沿着该流体路径可以引发各种反应。在某些实施例中,流体路径可以是封闭/密封的或对环境开放的。
图4D至图4F示出了示例反应容器(例如图4C所示的反应容器)的侧向横截面。图4D示出了第一示例,其中,离散区域414-2、414-4、414-6和414-8布置在通道410的段(例如,段410-2a、410-2b、410-4a、410-4b、410-6a、410-6b、410-8a、410-8b)的下面。如图例示,能量源408可以将能量引向离散区域,以便加热通道410的对应段(例如,在离散区域正上方的段)内的溶液。图4E示出了第二示例,其中,离散区域414-2、414-4、414-6和414-8包括加热通道410的侧面的侧向部分(例如,侧向部分415-1、415-2)。如图例示,在一些实施例中,侧向部分可具有被构造为从倾斜能量源409接收光的倾斜斜坡。在所例示的实施例中,对于各个离散区域,侧向部分沿着通道410的段的外部部分布置。例如,如图例示,侧向部分415-1沿着段410-2a的外侧表面布置,并且侧向部分415-2沿着段410-2b的外侧表面布置。在其它实施例中,侧向部分可以沿着通道410的各个段的两个侧向表面布置。例如,侧向部分可以沿着段410-2a的两个侧向表面布置。图4F示出了第三示例,其中,离散区域414-2、414-4、414-6和414-8还包括覆盖通道410的段的顶部部分。在该例示的示例中,离散区域的底部部分被构造为接收来自能量源408-1的光,离散区域的顶部部分被构造为接收来自能量源408-2的光,并且离散区域的侧向部分被构造为接收来自能量源409的光。如本文别处所公开的,由各个离散区域吸收的能量可通过例如具有功率水平可变的多个能量源、改变离散区域的尺寸或组成或任何其它合适的手段来改变。
图5A示出了包括壳体部件502的示例反应容器500,壳体部件具有由两个离散区域504-1和504-2组成的光吸收层。在一些实施例中,离散区域504-1和504-2可以由单个能量源506驱动,这允许各个离散区域504-1和504-2接收类似量的能量。在其它实施例中,可使用多个能量源,如本文别处所述。图5B示出了可以如何使能量源506朝向离散区域504-1偏移,使得离散区域504-1从能量源506接收比离散区域504-2更多的能量。离散区域504-1与504-2之间的该能量差异可通过可选的反射器元件508来增加更多,该反射器元件进一步限制到达离散区域504-2的光量,并且能够通过如所描绘地将能量源506发射的光的一部分朝向离散区域504-1反射来增加到达离散区域504-1的光。在一些实施例中,反射器元件508的位置可以改变以获得类似的效果。例如,能量源506可以定位在离散区域504-1与504-2之间的中点处,但是反射器元件508可以定位为更靠近离散区域504-2,使得来自能量源506的光的更大部分被阻挡而不能到达离散区域504-2(例如,而是朝向离散区域504-1反射)。在一些实施例中,反射器元件508可倾斜以改变来自能量源506的光能的分布。例如,反射器元件508可朝向离散元件504-1倾斜,以进一步增加从能量源506接收的光量。
图5C示出了示例反应容器500的顶视图以及它可以如何包括用于在离散区域504-1与504-2之间来回引导溶液的通道510。在一些实施例中,离散区域504-1和504-2可以接收相同量的能量,使得它们都处于相同温度。在这种类型的加热构造中,参考图5C,流过通道510的溶液在时间T1从离散区域504-1通过,在时间T2通过通道510的布置在离散区域504-1与504-2之间的部分,然后在时间T3通过离散区域504-2。这样,通道510所携带的溶液从时间T1的第一温度循环至时间T2的第二温度,然后在时间T3回到第一温度。在其他实施例中,离散区域504-1和504-2可以通过使相关联的能量源朝向一个离散区域504偏移、通过为各个离散区域504包括专用能量源、通过增大或减小组成一个离散区域504的光吸收层的一部分的厚度、通过改变光吸收层的组成等来接收不同量的能量。通过将系统构造为在离散区域504-1和504-2处提供不同量的能量,当溶液从通道510的一端流到另一端时,流过通道510的溶液能够达到更多种的温度。尽管图5C所例示的实施例仅描绘了两个离散区域504-1和504-2,但是本公开考虑了具有任何数量的离散区域(例如,布置在离散区域504-1与504-2之间的设定为第三温度的第三离散区域)的类似实施例。所述的加热模式可特别适于多步骤反应(例如,用于PCR)。
示例性PCR反应
PCR扩增DNA链的特定区域(DNA靶)。大多数PCR方法扩增0.1至10千碱基对(kb)的DNA片段。扩增产物的量由反应中可用的底物确定,底物随着反应进行而变得有限。基本的PCR设置需要几种组分和试剂,包括:含有待扩增的DNA靶区域的DNA模板;DNA聚合酶,一种使新DNA链聚合的酶;耐热Taq聚合酶特别常见,因为它在高温DNA变性过程期间更可能保持完整;两条DNA引物,这些引物与DNA靶的有义链和反义链中的每一条的3’末端互补;预先选择与DNA靶区域互补的特异性引物,并且通常在实验室中定制或购自商业生化供应商;脱氧核苷三磷酸或dNTP;提供DNA聚合酶最佳活性和稳定性的合适化学环境的缓冲溶液;二价阳离子,典型地为镁(Mg)或锰(Mn)离子;Mg2+是最常见的,但Mn2+可用于PCR介导的DNA突变,因为较高的Mn2+浓度增加DNA合成期间的错误率;和一价阳离子,通常是钾(K)离子。
反应通常在热循环仪中的小反应室(0.2-0.5ml体积)中以10-200μl的体积进行,该热循环仪加热和冷却反应管以达到反应的各个步骤所需的温度。薄壁反应管允许有利的热导率以允许快速的热平衡。
图6例示了反应容器的示例温度分布,清楚地示出了与单个PCR循环相关联的各个步骤。通常,PCR由一系列20-40次重复的温度变化构成,这些变化称为循环,其中各个循环通常由两个或三个离散温度步骤构成。循环之前通常是在非常高的温度(>90℃【194°F】)下的单个温度步骤,随后是在最后一次保持以用于最终产物延伸或短暂储存。在各个循环中使用的温度和它们所应用的时间长度取决于多种参数,包括用于DNA合成的酶、反应中二价离子和dNTP的浓度、以及引物的解链温度(Tm)。大多数PCR方法的共同的各个步骤如下:
(1)初始化:该步骤仅对于需要通过热启动PCR热激活的DNA聚合酶是需要的。该步骤包括将反应室加热至94-96℃(201-205°F)的温度,或者如果使用极热稳定的聚合酶,则加热至98℃(208°F),然后保持1-10分钟。该步骤在图6中未例示。
(2)变性:该步骤是第一个常规循环事件,并且包括将反应室加热至94-98℃(201-208°F)20-30秒。这通过断裂互补碱基之间的氢键(这产生两个单链DNA分子)引起双链DNA模板的DNA解链或变性。
(3)退火:在下一步骤中,将反应温度降低至50-65℃(122-149℉)20-40秒,这允许引物到各个单链DNA模板的退火。反应混合物中通常包括两种不同的引物:一个用于含有靶区域的两个单链补体中的每一个。引物本身是单链序列,但比靶区域的长度短得多,仅与每条链的3’末端的非常短的序列互补。退火步骤的正确温度是重要的,因为该温度强烈影响效率和特异性。该温度必须足够低以允许引物与链杂交,但也必须足够高以使杂交具有特异性,即引物应仅与链的完全互补部分结合,而不是其它地方。如果温度太低,引物可能结合不完全。如果该值太高,引物可能根本不结合。典型的退火温度比所用引物的Tm低约3-5℃。只有当引物序列与模板序列非常紧密地匹配时,才形成互补碱基之间的稳定氢键。该步骤期间,聚合酶结合到引物-模板杂合体并开始DNA形成。
(4)延伸/伸长:该步骤的温度取决于所用的DNA聚合酶;Taq(水生栖热菌)聚合酶的热稳定DNA聚合酶的最佳活性温度为约75-80℃(167-176°F),尽管72℃(162°F)的温度通常与该酶一起使用。在该步骤中,DNA聚合酶通过从反应混合物加入沿5’至3’方向与模板互补的游离dNTP(这使dNTP的5’-磷酸基团与新生(伸长)DNA链末端的3’-羟基缩合)来合成与DNA模板链互补的新DNA链。伸长所需的精确时间取决于所用的DNA聚合酶和待扩增的DNA靶区域的长度。根据经验,在它们的最佳温度下,大多数DNA聚合酶每分钟聚合上千个碱基。在最佳条件下(即,如果没有由于限制性底物或试剂所致的限制),在每个延伸/伸长步骤,DNA靶序列的数目加倍。随着各个连续循环,原始模板链加上所有新生成的链变成用于下一轮伸长的模板链,这导致特定DNA靶区域的指数(几何)扩增。
变性、退火和伸长的过程构成单个循环。需要多个循环来将DNA靶扩增到数百万个拷贝。用于计算在给定循环数后形成的DNA拷贝数的公式是2n,其中,n是循环数。
(5)最终伸长:该单个步骤是可选的,但在最后一个PCR循环后在70-74℃(158-165°F)(PCR中使用的大多数聚合酶的最佳活性所需的温度范围)的温度下执行5-15分钟,以确保任何剩余的单链DNA被完全伸长。
(6)最终保持:最后一步将反应室冷却到4-15℃(39-59°F)无限期,并可用于PCR产物的短期储存。
为了检查PCR是否成功地生成了预期的DNA靶区域(有时也称为扩增引物或扩增子),可以采用琼脂糖凝胶电泳对PCR产物进行尺寸分离。PCR产物的尺寸通过与DNA梯比较来确定,DNA梯是一种含有已知尺寸的DNA片段的分子量标记,这些片段与PCR产物一起在凝胶上运行。与其它化学反应一样,PCR的反应速率和效率受到限制因素的影响。因此,整个PCR过程可以基于反应历程进一步分成三个阶段:
(1)指数式扩增:在每个循环中,产物的量加倍(假设100%反应效率)。30个循环后,DNA的单拷贝可增加到十亿拷贝。反应非常敏感:仅必须存在微量的DNA。
(2)趋平阶段:随着DNA聚合酶丧失活性以及随着例如dNTP和引物的试剂的消耗使它们变得有限,反应减慢。
(3)稳定期:由于试剂和酶耗尽,不再有产物积累。
在装载和密封时,系统可以通过热循环产生扩增产物。热循环可以包括在变性温度下温育反应混合物变性时间段、随后在退火温度下温育混合物退火时间段、进一步随后在伸长温度下温育混合物伸长时间段的一个或多个循环。系统可以通过使用如前所述的一个或多个光源来加热反应孔中的孔。也可使用通过光源与反应孔之间的透镜聚焦的光。嵌入透镜可用于聚焦来自反应容器/孔中集成的荧光染料的发射。为了冷却样品和试剂,可以将一个或多个光源关闭冷却时间段。在一些情况下,流体循环通道可以如前所述用于冷却反应孔中的孔中的试剂和样品。
样品的扩增可以通过使用前述系统执行一个或多个热循环来进行,热循环包括变性循环、退火循环和伸长循环。扩增反应可以产生扩增产物形式的可检测结果的时间可以根据靶核酸、样品、所用试剂和PCR方案而变化。在一些情况下,扩增过程可以在小于1分钟内执行。在一些情况下,扩增过程可以在约1分钟至约40分钟内执行。在一些情况下,扩增过程可以在至少约1分钟内执行。在一些情况下,扩增过程可以在至多约40分钟内执行。在一些情况下,扩增过程可以在约1分钟至约5分钟、约1分钟至约10分钟、约1分钟至约15分钟、约1分钟至约20分钟、约1分钟至约25分钟、约1分钟至约30分钟、约1分钟至约35分钟、约1分钟至约40分钟、约5分钟至约10分钟、约5分钟至约15分钟、约5分钟至约20分钟、约5分钟至约25分钟、约5分钟至约30分钟、约5分钟至约35分钟、约5分钟至约40分钟、约10分钟至约15分钟、约10分钟至约20分钟、约10分钟至约25分钟、约10分钟至约30分钟、约10分钟至约35分钟、约10分钟至约40分钟、约15分钟至约20分钟、约15分钟至约25分钟、约15分钟至约30分钟、约15分钟至约35分钟、约15分钟至约40分钟、约20分钟至约25分钟、约20分钟至约30分钟、约20分钟至约35分钟、约20分钟至约40分钟、约25分钟至约30分钟、约25分钟至约35分钟、约25分钟至约40分钟、约30分钟至约35分钟、约30分钟至约40分钟、或约35分钟至约40分钟内执行。在一些情况下,扩增过程可在约1分钟、约5分钟、约10分钟、约15分钟、约20分钟、约25分钟、约30分钟、约35分钟或约40分钟内执行。
在一些情况下,样品的扩增可以通过重复热循环5至40次来执行。在一些情况下,热循环可重复至少5次。在一些情况下,热循环可重复至多60次。在一些情况下,热循环可重复5次、10次、15次、20次、25次、30次、35次、40次、45次、50次、55次或60次。
热循环可以在热循环时间段内完成。在一些情况下,热循环时间段的范围可以是每个循环2秒至60秒。在一些情况下,热循环可在约2秒至约60秒内完成。在一些情况下,热循环可以在至少约2秒内完成。在一些情况下,热循环可以在至多约60秒内完成。在一些情况下,热循环可在约2秒至约5秒、约2秒至约10秒、约2秒至约20秒、约2秒至约40秒、约2秒至约60秒、约5秒至约10秒、约5秒至约20秒、约5秒至约40秒、约5秒至约60秒、约10秒至约20秒、约10秒至约40秒、约10秒至约60秒、约20秒至约40秒、约20秒至约60秒或约40秒至约60秒内完成。在一些情况下,热循环可在约2秒、约5秒、约10秒、约20秒、约40秒或约60秒内完成。
变性循环的温度和时间段可取决于待识别样品的特性、试剂和所用的扩增方案。变性循环可以在范围从约80℃至约110℃的温度下执行。变性循环可以在至少约80℃的温度下执行。变性循环可以在至多约110℃的温度下执行。变性循环可以在约80℃至约85℃、约80℃至约90℃、约80℃至约95℃、约80℃至约100℃、约80℃至约105℃、约80℃至约110℃、约85℃至约90℃、约85℃至约95℃、约85℃至约100℃、约85℃至约105℃、约85℃至约110℃、约90℃至约95℃、约90℃至约100℃、约90℃至约105℃、约90℃至约110℃、约95℃至约100℃、约95℃至约105℃、约95℃至约110℃、约100℃至约105℃、约100℃至约110℃或约105℃至约110℃的温度下执行。变性循环可以在约80℃、约85℃、约90℃、约95℃、约100℃、约105℃或约110℃的温度下执行。
在一些情况下,变性循环的时间段可小于约1秒。在一些情况下,变性循环的时间段可为至多约100秒。在一些情况下,变性循环的时间段可以是约0秒至1秒、约1秒至约5秒、约1秒至约10秒、约1秒至约20秒、约1秒至约40秒、约1秒至约60秒、约1秒至约100秒、约5秒至约10秒、约5秒至约20秒、约5秒至约40秒、约5秒至约60秒、约5秒至约100秒、约10秒至约20秒、约10秒至约40秒、约10秒至约60秒、约10秒至约100秒、约20秒至约40秒、约20秒至约60秒、约20秒至约100秒、约40秒至约60秒、约40秒至约100秒、或约60秒至约100秒。在一些情况下,变性循环的时间段可小于约1秒、约5秒、约10秒、约20秒、约40秒、约60秒或约100秒。
退火和伸长循环的温度和时间段可取决于待识别样品的特性、试剂和所用的扩增方案。退火和/或伸长循环可以在约40℃至约70℃的温度下执行。退火和/或伸长循环可以在至少约40℃的温度下执行。退火和/或伸长循环可以在至多约70℃的温度下执行。退火和/或伸长循环可以在约40℃至约45℃、约40℃至约50℃、约40℃至约55℃、约40℃至约60℃、约40℃至约65℃、约40℃至约70℃、约45℃至约50℃、约45℃至约55℃、约45℃至约60℃、约45℃至约65℃、约45℃至约70℃、约50℃至约55℃、约50℃至约60℃、约50℃至约65℃、约50℃至约70℃、约55℃至约60℃、约55℃至约65℃、约55℃至约70℃、约60℃至约65℃、约60℃至约70℃或约65℃至约70℃的温度下执行。退火和/或伸长循环可以在约40℃、约45℃、约50℃、约55℃、约60℃、约65℃或约70℃的温度下执行。
在一些情况下,退火和/或伸长循环的时间段可小于约1秒。在一些情况下,退火和/或伸长循环的时间段可以是至多约60秒。在一些情况下,退火和/或伸长循环的时间段可以是约0秒至1秒、约1秒至约5秒、约1秒至约10秒、约1秒至约20秒、约1秒至约40秒、约1秒至约60秒、约5秒至约10秒、约5秒至约20秒、约5秒至约40秒、约5秒至约60秒、约10秒至约20秒、约10秒至约40秒、约10秒至约60秒、约20秒至约40秒、约20秒至约60秒、或约40秒至约60秒。在一些情况下,退火和/或伸长循环的时间段可以小于约1秒、约5秒、约10秒、约20秒、约40秒或约60秒。
在一些情况下,冷却循环可在变性循环与退火和/或伸长循环之间执行。在一些情况下,冷却循环可以执行约1秒至约60秒。在一些情况下,冷却循环可以执行至少约1秒。在一些情况下,冷却循环可以执行至多约60秒。在一些情况下,冷却循环可以执行约1秒至约5秒、约1秒至约10秒、约1秒至约20秒、约1秒至约30秒、约1秒至约40秒、约1秒至约50秒、约1秒至约60秒、约5秒至约10秒、约5秒至约20秒、约5秒至约30秒、约5秒至约40秒、约5秒至约50秒、约5秒至约60秒、约10秒至约20秒、约10秒至约30秒、约10秒至约40秒、约10秒至约50秒、约10秒至约60秒、约20秒至约30秒、约20秒至约40秒、约20秒至约50秒、约20秒至约60秒、约30秒至约40秒、约30秒至约50秒、约30秒至约60秒、约40秒至约50秒、约40秒至约60秒或约50秒至约60秒。在一些情况下,冷却循环可以执行约1秒、约5秒、约10秒、约20秒、约30秒、约40秒、约50秒或约60秒。
扩增产物的检测可以在扩增过程的各个阶段执行。在一些情况下,扩增产物的检测可以在扩增过程结束时执行。在一些情况下,扩增产物的检测可以在热循环期间执行。替代性地,在一些情况下,检测可以在各个热循环结束时执行。除了本文所述的检测方法之外,扩增产物的检测还可以使用凝胶电泳、毛细管电泳、测序、短串联重复分析和其它已知方法来执行。
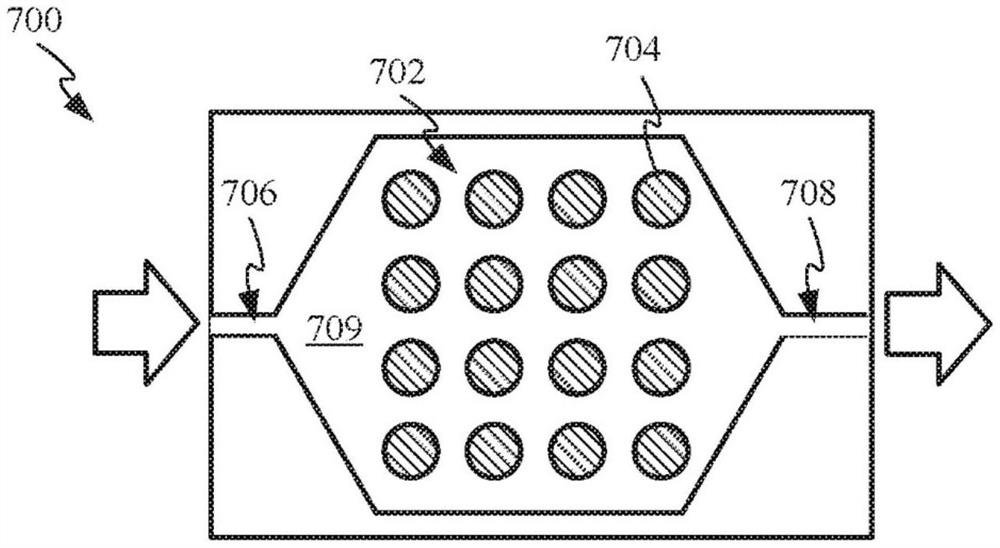
图7A至图7C示出了在具有光吸收层的反应容器700中的杂交和固相PCR操作的示例,光吸收层具有多个离散区域。图7A示出了具有光吸收层702的反应容器700的顶视图,该光吸收层包括以网格模式排列的离散区域704的阵列。反应容器700包括入口706和出口708,它们被构造为允许溶液流入和流出反应室709。在一些实施例中,反应室709可以不包括分离不同的离散区域704的任何物理屏障。相反,参考图7A中的示例实施例,可以使溶液经由入口706流入反应容器700中,并且流过反应室709的内表面,使得溶液接触各个离散区域704。溶液可经由出口708离开反应容器700。其中反应室709不需要通过物理屏障分离的这样的实施例可以是有利的,因为当与具有物理分离的反应室709的反应容器相比时,它们相对较不复杂且更有成本效益。具有未被物理屏障分离的单个室的反应容器所提供的简单性可转化为较少的故障和/或缺陷、以及减少的制造和组装的劳动力和成本要求。在其它实施例中,一个或多个离散区域704可以通过物理屏障(例如,通过从顶部和/或底部壳体部件延伸的一个或多个突起,或通过任何其它合适的机构,例如本文其它地方公开的那些)与一个或多个其它离散区域704分离,使得在反应容器700内可以存在多于一个反应室。在一些实施例中,反应室709可以包括在相对侧上的离散区域(例如,沿着顶部面向内部表面和沿着底部面向内部表面形成或沉积)。在这些实施例中的一些中,热约束的概念(如本文别处所述)可用于使溶液的各部分彼此分离。在一些实施例中,可以改变与离散区域704相关联的结合区域的表面积。例如,第一离散区域704可具有比第二离散区域704小的表面积。结果,第一离散区域704的温度分布可不同于第二离散区域704的温度分布。另外,第二离散区域704由于具有较大的表面积,可结合比第一离散区域704更大数目的序列,这可用于例如使扩增过程偏斜以有利于结合至第二离散区域704的序列。在一些实施例中,如本文别处所公开的,离散区域704的温度分布还可通过改变递送到离散区域704的光能的量(例如,通过调制对应于离散区域704的能量源的能量水平)和/或离散区域704所吸收的光能的量(例如,通过调节例如离散区域704的组成和厚度的特性)来改变。
在一些实施例中,反应容器的一个或多个离散元件可以结合到一个或多个核苷酸序列。例如,参考图7B所例示的示例,各个离散元件704具有例如通过弱共价相互作用(例如,Au-硫醇)结合的独特探针或引物序列710-713。如图例示,包括靶分子710’、711’和713’的溶液可以在离散区域704上流动。靶分子710’、711’和713’可以是与结合至离散区域704的序列(即序列710、711和713)互补的序列,但靶分子715’可以不与结合至离散区域704的序列互补。在一些实施例中,靶分子710’、711’、713’和715’可以被标记用于检测目的。
在一些实施例中,当使溶液流过离散区域704时,溶液中与结合到离散区域704的序列互补的靶分子可与这些序列杂交。图7C示出了靶分子如何仅与它们结合在表面上的互补序列杂交。例如,如图7C例示,靶分子710’、711’和713’与它们各自的互补序列710、711和713杂交,互补序列本身结合到它们各自的离散区域704。因此,靶分子710’、711’和713’经由它们各自的互补序列结合到离散区域704。不具有互补序列的靶分子(例如靶分子715’)无法杂交,因此可以在溶液中保持未结合。当使溶液流出反应容器时(例如,经由出口708,参考模糊的7A),这些未结合的分子可以离开反应容器。类似地,结合到在溶液中不具有互补靶分子的离散区域704的序列不杂交。例如,如图7C例示,序列712保持未杂交。如前所述,在一些实施例中,靶分子可以被标记用于检测目的。例如,靶分子可以被荧光标记。一旦溶液流入和流出反应容器(在允许杂交足够的时间之后),可以使用检测机构来检测已被标记的靶分子的存在。例如,检测机构可以包括设计成激发结合到靶分子的荧光标记的光源和用于检测荧光标记的存在的照相机装置。在该示例中,荧光光源可以照射在反应容器上,并且在各个离散区域处得到的荧光强度可以用于检测给定靶分子的存在或不存在。例如,参考图7C,在允许溶液离开反应容器之后(与例如靶分子715’的未结合的靶分子一起)在离散区域704照射合适的光源可以使所有结合的靶分子的荧光标记发出荧光。照相机可检测和与序列710、711和713相关联的离散区域704对应的区域发出高于阈值强度的荧光,而和与序列712相关联的离散区域704对应的区域不发出高于阈值强度的荧光(因为其缺乏具有荧光标记的靶分子)。
在靶分子与结合到离散区域的序列杂交之后,可以执行固相PCR以产生离散扩增子的群体,然后可以经由结合到DNA的分子检测该群体,并且可以将其用于检测所述分子的存在(例如,通过荧光和/或电化学信号)。固相PCR在离散区域上使用表面结合的引物而不是自由扩散的引物来扩增DNA。这将核酸扩增限制到离散区域上的二维表面,因此允许在单个反应容器系统中的DNA扩增和检测的容易并行化和高度复用。替代性地,可对扩增子进行测序以识别所述分子的存在。
图7D示出了另一个示例,其中,各个离散区域704具有通过弱共价相互作用(例如,Au-硫醇)结合的独特引物序列711’。如图例示,可以使包括目标分子711、710’的溶液在离散区域704上流动。我们的靶分子711、710’可以包括与独特引物序列711’互补的衔接子部分711和第二部分(例如,DNA分子或RNA分子的一部分)。例如,衔接子部分711可以是绑扎到第二部分710’的衔接子(被构造为结合到独特引物序列711’),该第二部分可以是DNA分子。在该示例中,衔接子部分711对于靶DNA分子可以是外来的。杂交后,可以执行固相PCR以产生离散扩增子的群体,然后可以对其测序以识别所述分子的存在。
如将对本领域技术人员而言显而易见的,与常规系统相比,本文所述的加热机构提供了优越的性能和功能。例如,在容纳反应室的反应容器内(例如,在反应室内或与反应室相邻)使用光吸收层(例如,由图7A中的离散区域704组成的层)加热反应室比具有在反应容器外部的加热器的常规系统显著更高效且更快。这部分是因为,与这些常规系统不同,所公开的加热机构不需要热能来穿透多层材料以到达反应室内的溶液。所公开的加热机构还确保了更均匀的加热,因为耗散到壳体的热量被最小化,从而确保了更均匀的热传递。所公开的加热机构还允许更受控的加热,因为如本文别处所公开的,传递到各个离散区域的光能的量可被控制(例如,通过调制对应于离散区域的能量源的能量水平),和/或由各个离散区域吸收的光能的量可被控制(例如,通过调节例如离散区域的组成和厚度的特性)。这种控制水平对于使用具有不同温度要求的引物的应用可能特别有用。例如,参考图7B,引物710可能需要第一温度用于杂交,而引物711可能需要第二温度用于杂交。所公开的加热机构可以通过确保将结合有引物710的离散区域704加热至第一温度并且将结合有引物711的离散区域704加热至第二温度来容易地适应这种差异。
图8例示了用于操作反应容器的示例方法800。该方法可以在步骤810处开始,其中,可以经由反应容器的入口将溶液接受到反应容器中。在步骤820处,可以使溶液在光吸收层的多个离散区域上围绕反应容器流动。在步骤830处,可以将第一光引导到光吸收层的多个离散区域中的第一离散区域处,这使得来自第一光的能量被第一离散区域吸收。在步骤840处,可以使溶液的与第一离散区域相邻的部分被加热。尽管图8中未例示,但是应当理解,本公开也考虑了离散区域的冷却(例如,通过关闭发射第一光的光源),这可以用于例如对于不同步骤采用不同温度的多步骤反应中。
在适当的情况下,特定实施例可以重复图8的方法的一个或多个步骤。尽管本公开将图8的方法的特定步骤描述和例示为以特定顺序发生,但是本公开考虑了图8的方法的任何合适的步骤以任何合适的顺序发生。而且,尽管本公开描述和例示了用于操作反应容器的示例方法(包括图8的方法的特定步骤),但是本公开考虑了用于操作反应容器的任何合适的方法(包括任何合适的步骤),在适当的情况下,该方法包括图8的方法的步骤中的全部、一些或不包括这些步骤。此外,尽管本公开描述和例示了进行图8的方法的特定步骤的特定部件、装置或系统,但是本公开考虑了进行图8的方法的任何合适步骤的任何合适部件、装置或系统的任何合适组合。
前面的描述为了说明的目的使用特定术语来提供所述实施例的彻底理解。然而,将对本领域技术人员显而易见的是,不为了实践所述实施例而需要特定细节。因此,为了例示和描述的目的而提出了具体实施例的前面描述。它们并非旨在对所述实施例进行穷尽,或者将所述实施例限于所公开的精确形式。对于本领域的普通技术人员来说将显而易见的是,根据上述示教,许多修改和变化是可能的。
- 用于通过照射图案化的薄膜进行局部加热的方法和系统
- 用于薄膜电容器制作的溶胶-凝胶及掩模图案化,由此制作的薄膜电容器,以及含有薄膜电容器的系统
