一种髓样分化因子88抑制剂及其制备方法和应用
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及有机物合成技术领域,尤其涉及一种髓样分化因子88抑制剂及其制备方法和应用。
背景技术
固有免疫是人体应对外源性或内源性异质物刺激的生理过程。通常情况下,固有免疫能通过炎症反应清除产生刺激的异质物,保护人体健康。但当某些疾病发生时,免疫调节出现异常,使病变部位产生过量的炎症反应,即炎症风暴,进一步损害人体健康。
固有免疫系统依赖于种系编码受体,即模式识别受体(pattern recognitionreceptors,PRRs),这些受体可以识别一种或多种病原相关模式分子(pathogen-associated molecular pattern,PAMPs),以及损伤相关分子模式(damage-associatedmolecular pattern,DAMPs),是启动固有免疫应答的免疫受体的代表。常见的模式识别受体包括Toll样受体(Toll-like receptors),RIG-I样受体(RIG-I like receptors),NOD样受体(NOD like receptors),AIM2样受体(AIM2 like receptors)和C型凝集素受体,以及cGas和其他细胞内DNA传感器。Toll样受体是研究最多的PRR之一,哺乳动物中目前共发现有10种Toll样受体,其识别DAMPs或PAMPs后通过下游的衔接蛋白进行信号转导。目前发现5种衔接蛋白,分别为MyD88,TRIF,TRAM,MAI和SARM,其中MyD88和TRIF作为主要的衔接蛋白将信号转导至下游。TRIF参与TLR3和TLR4的信号转导,介导IFNβ的产生,主要作为MyD88非依赖途径参与炎性信号转导,而MyD88则参与除TLR3外的所有TLRs家族的信号转导,其是TLRs/IL-1R信号转导的中心分子,也是炎症相关信号通路调节的关键蛋白。
MyD88的激活,一方面导致下游MAPKs/p38/JNK通路激活,从而使AP-1活化,另一方面激活TAK1/TAB复合物,激活NF-κB,使其入核,进而产生促炎因子如TNF-α和IL-6,使得大量炎症相关因子和化学因子转录和表达。有多项研究表明,基因敲除MyD88的小鼠对脂多糖以及葡萄球菌肠毒素诱导的死亡有所耐受。MyD88作为TLRs/IL-R信号通路的一个关键蛋白靶点,有作为治疗炎症相关疾病的潜在能力,已逐渐受到越来越多的研究者关注。但是,目前现有技术中MyD88抑制剂却有限,亟需研发一些新的MyD88抑制剂。
发明内容
本发明的目的在于提供一种髓样分化因子88抑制剂及其制备方法和应用,以弥补现有技术的不足。
本发明提供了一种髓样分化因子88抑制剂,为结构如式(Ⅰ)所示的化合物或其药学上可接受的盐、水合物、溶剂化物或前药;
其中:X和Y独立的包含CH
优选的,当X为C(O)或S(O)
优选的,R
优选的,为以下化合物及其药学上可接受的盐、溶剂化物或前药:
化合物1:N-(2-甲氧基吡啶-5-基)-3-硝基-4-[4-(嘧啶-2-基)哌嗪-1-基]苯磺酰胺
化合物2:4-(4-苄基哌嗪-1-基)-N-(2-甲氧基吡啶-5-基)-3-硝基苯磺酰胺
化合物3:N-(2-甲氧基吡啶-5-基)-3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}苯磺酰胺
化合物4:N-(2-甲氧基吡啶-5-基)-3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}苯磺酰胺
化合物5:4-{4-[(4-甲氧基苯基)甲基]哌嗪-1-基}-N-(2-甲氧基吡啶-5-基)-3-硝基苯磺酰胺
化合物6:N-(5-{[4-(4-{[(6-甲氧基吡啶-3-基)氨基]二氧亚基-λ6-硫基}-2-硝基苯基)哌嗪-1-基]甲基}-1,3-噻唑-2-基)乙酰胺
化合物7:N-(萘-1-基)-3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}苯甲酰胺
化合物8:3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
化合物9:3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
化合物10:4-(4-苄基哌嗪-1-基)-3-硝基-N-(吡啶-2-基甲基)苯甲酰胺
化合物11:3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯甲酰胺
化合物12:3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯甲酰胺
化合物13:3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯甲酰胺
化合物14:3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯甲酰胺
化合物15:3-硝基-4-[4-(4-硝基苯基)哌嗪-1-基]-N-苯基苯甲酰胺
化合物16:2-(4-{2-硝基-4-[(苯基氨基)甲基]苯基}哌嗪-1-基)乙-1-醇
化合物17:4-[4-(2-甲氧基乙基)哌嗪-1-基]-3-硝基-N-苯基苯甲酰胺
化合物18:4-[4-(2-羟基乙基)哌嗪-1-基]-N-(6-甲氧基吡啶-3-基)-3-硝基苯磺酰胺
化合物19:4-[4-(2-甲氧基乙基)哌嗪-1-基]-N-(6-甲氧基吡啶-3-基)-3-硝基苯磺酰胺
化合物20:4-[4-(2-甲氧基乙基)哌嗪-1-基]-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
化合物21:4-[4-(2-羟基乙基)哌嗪-1-基]-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
化合物22:4-[4-(2-甲氧基乙基)哌嗪-1-基]-3-硝基-N-苯基苯磺酰胺
化合物23:4-[4-(2-羟基乙基)哌嗪-1-基]-3-硝基-N-苯基苯磺酰胺
化合物24:3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯磺酰胺
化合物25:3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯磺酰胺
化合物26:3-硝基-4-[4-(4-硝基苯基)哌嗪-1-基]-N-苯基苯磺酰胺
化合物27:4-(4-苄基哌嗪-1-基)-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
化合物28:3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
化合物29:3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
化合物30:3-硝基-4-[4-(4-硝基苯基)哌嗪-1-基]-N-(吡啶-2-基甲基)苯磺酰胺
化合物31:4-{4-[(4-甲氧基苯基)甲基]哌嗪-1-基}-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
化合物32:3-硝基-N-(吡啶-2-基甲基)-4-[4-(嘧啶-2-基)哌嗪-1-基]苯磺酰胺
化合物33:N-(5-{[4-(4-{二氧亚基[(吡啶-2-基甲基)氨基]-λ6-硫基}-2-硝基苯基)哌嗪-1-基]甲基}-1,3-噻唑-2-基)乙酰胺
化合物34:1-[4-(苄基磺酰基)-2-硝基苯基]-3-甲基哌啶
化合物35:1-[4-(苄基磺酰基)-2-硝基苯基]-4-甲基哌嗪
化合物36:1-[4-(苄基磺酰基)-2-硝基苯基]-4-乙基哌嗪
化合物37:1-{4-[4-(苄基磺酰基)-2-硝基苯基]哌嗪-1-基}乙-1-酮
化合物38:1-[4-(苄基磺酰基)-2-硝基苯基]-4-(4-硝基苯基)哌嗪
化合物39:2-{4-[4-(苄基磺酰基)-2-硝基苯基]哌嗪-1-基}乙-1-醇
化合物40:1-[4-(苄基磺酰基)-2-硝基苯基]-4-(2-甲氧基乙基)哌嗪
化合物41:1-[4-(苄基磺酰基)-2-硝基苯基]-4-(3-硝基苄基)哌嗪
化合物42:4-[(3-氟苄基)磺酰基]-N,N-二甲基-2-硝基苯胺
化合物43:1-乙基-4-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}哌嗪
化合物44:1-(4-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
化合物45:1-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
化合物46:2-(4-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
化合物47:1-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}-4-(2-甲氧基乙基)哌嗪
化合物48:1-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}-4-(3-硝基苄基)哌嗪
化合物49:4-[(4-氟苄基)磺酰基]-N,N-二甲基-2-硝基苯胺
化合物50:1-乙基-4-[4-(4-氟苄基)磺酰基]-2-硝基苯基哌嗪
化合物51:1-(4-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
化合物52:1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
化合物53:2-(4-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
化合物54:1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(2-甲氧基乙基)哌嗪
化合物55:1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(3-硝基苄基)哌嗪
化合物56:1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苄基)哌嗪
化合物57:1-乙基-4-[4-(4-甲基苄基)磺酰基]-2-硝基苯基)哌嗪
化合物58:1-(4-{4-[(4-甲基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
化合物59:1-{4-[(4-甲基苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
化合物60:2-(4-{4-[(4-甲基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
化合物61:1-(2-甲氧基乙基)-4-[4-(4-甲基苄基)磺酰基]2-硝基苯基)哌嗪
化合物62:4-[(4-甲氧基苄基)磺酰基]-N,N-二甲基-2-硝基苯胺
化合物63:1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪
化合物64:1-乙基-4-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪
化合物65:1-(4-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
化合物66:1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
化合物67:2-(4-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
化合物68:1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}-4-(2-甲氧基乙基)哌嗪
化合物69:1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}-4-(3-硝基苄基)哌嗪
化合物70:4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮
化合物71:4-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-6-(4-甲氧基苯基)-1,2-二氢嘧啶-2-酮
化合物72:4-{4-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]苯基}-6-苯基-1,2-二氢嘧啶-2-酮
化合物73:4-{4-[(苯并[d][1,3]噻唑-2-基氨基)甲基]苯基}-6-苯基-1,2-二氢嘧啶-2-酮
化合物74:4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-6-(4-甲氧基苯基)-1,2-二氢嘧啶-2-酮
化合物75:4-{4-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]苯基}-6-(4-甲氧基苯基)-1,2-二氢嘧啶-2-酮
化合物76:4-{4-[(戊基氨基)甲基]苯基}-6-苯基-1,2-二氢嘧啶-2-酮
化合物77:6-(4-甲氧基苯基)-4-{4-[(戊基氨基)甲基]苯基}-1,2-二氢嘧啶-2-酮
化合物78:4-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮
化合物79:6-(4-溴苯基)-4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-1,2-二氢嘧啶-2-酮
化合物80:4-(4-{[4-(4-硝基苯基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮
化合物81:6-(4-溴苯基)-4-{4-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]苯基}-1,2-二氢嘧啶-2-酮
化合物82:6-(4-甲氧基苯基)-4-(4-{[4-(4-硝基苯基)哌嗪-1-基]甲基}苯基)-1,2-二氢嘧啶-2-酮
化合物83:6-(4-溴苯基)-4-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-1,2-二氢嘧啶-2-酮
化合物84:4-{4-[(4-乙酰基哌嗪-1-基)甲基]苯基}-6-(4-溴苯基)-1,2-二氢嘧啶-2-酮
化合物85:2-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-3,4-二氢喹唑啉-4-酮
化合物86:2-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-3,4-二氢喹唑啉-4-酮
化合物87:2-(4-{[4-(4-硝基苯基)哌嗪-1-基]甲基}苯基)-3,4-二氢喹唑啉-4-酮
化合物88:2-{4-[(4-乙酰基哌嗪-1-基)甲基]苯基}-3,4-二氢喹唑啉-4-酮
化合物89:7-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}-2-苯基-3,4-二氢喹唑啉-4-酮
化合物90:7-{[4-(2-羟基乙基)哌嗪-1-基]甲基}-2-苯基-3,4-二氢喹唑啉-4-酮
化合物91:7-{[4-(4-硝基苯基)哌嗪-1-基]甲基}-2-苯基-3,4-二氢喹唑啉-4-酮
化合物92:7-[(4-乙酰基哌嗪-1-基)甲基]-2-苯基-3,4-二氢喹唑啉-4-酮
化合物93:7-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]-2-苯基-3,4-二氢喹唑啉-4-酮。
本发明还提供了所述髓样分化因子88抑制剂的制备方法,化合物1~33的制备方法包含如下步骤:
(1)将
(2)将
本发明还提供了所述髓样分化因子88抑制剂的制备方法,化合物34~69的制备方法包含如下步骤:
(1)将碳酸氢钠、亚硫酸钠、4-氯-3-硝基苯磺酰氯和水混后合后进行反应,生成4-氯-3-硝基苯亚磺酸;所述碳酸氢钠、亚硫酸钠、4-氯-3-硝基苯磺酰氯和水的用量比为7~9mmol:7~9mmol:3~5mmol:20~40mL;所述反应的温度为室温,时间为1~5h;
(2)将4-氯-3-硝基苯亚磺酸、溴苄类物质和N,N-二甲基甲酰胺混合后进行反应,生成
(3)将
本发明还提供了所述髓样分化因子88抑制剂的制备方法,化合物70~84的制备方法包含如下步骤:
(1)将苯乙酮、氢氧化钠、
(2)在保护气氛下,将
(3)将
(4)在保护气氛下,将
本发明还提供了所述髓样分化因子88抑制剂的制备方法,化合物85~93的制备方法包含如下步骤:
(1)将
所述
所述反应的温度为80~90℃,时间为1~5h;
所述
所述
所述R
(2)在保护气氛下,将
所述
所述反应的温度为80~90℃,时间为1~5h;
(3)在保护气氛下,将中间产物、2-甲氧基乙基哌嗪、三乙胺和乙腈混合后进行反应,生成化合物85~93中的一种;
所述中间产物、2-甲氧基乙基哌嗪、三乙胺和乙腈的用量比为0.1~0.5mmol:0.1~0.5mmol:45~55μL:5~15mL;
所述反应的温度为80~90℃,时间为1~5h。
本发明还提供了所述髓样分化因子88抑制剂在制备治疗炎症相关疾病的药物制剂中的应用。
优选的,所述炎症相关疾病包含急性肺损伤和/或脓毒血症。
本发明提供了一种新的髓样分化因子88抑制剂及其制备方法和应用。所述新的髓样分化因子88抑制剂可以抑制炎症细胞因子超出正常量表达和释放,并以此为药理机制治疗过度炎症相关的疾病。实验表明,本发明提供的MyD88抑制剂具有有效的炎症因子的抑制作用以及更优的体内抗炎活性。
本发明通式I的MyD88抑制剂可以与酸生成它的药学上可接受的盐。酸可以包括无机酸或有机酸,与下列酸形成的盐是特别优选的:盐酸、氢溴酸、硫酸、磷酸、甲磺酸、乙磺酸、甲苯磺酸、苯磺酸、萘二磺酸、乙酸、丙酸、乳酸、三氟乙酸、马来酸、柠檬酸、富马酸、酒石酸、苯磺酸、苯甲酸或对甲苯磺酸等。
本发明还包括通式IMyD88抑制剂的前药。依据本发明,前药是通式I化合物的衍生物,它们自身可能具有较弱的活性或甚至没有活性,但是在给药后,在生理条件下(例如通过代谢、溶剂分解或另外的方式)被转化成相应的生物活性形式。
本发明可以含有上述通式I含有MyD88抑制剂,及其药学上可接受的盐、水合物或溶剂化物作为活性成份,与药学上可接受的载体或赋型剂混合制备成组合物,并制备成临床上可接受的剂型,上述药学上可接受的赋型剂是指任何可用于药学领域的稀释剂、辅助剂和/或载体。本发明的衍生物可以与其他活性成份组合使用,只要它们不产生其他不利的作用,例如过敏反应。
发明的药用组合物可配制成若干种剂型,其中含有药物领域中一些常用的赋形剂。如上所述的若干种剂型可以采用注射剂、片剂、胶囊剂、气雾剂、栓剂、膜剂、滴丸剂、外用搽剂、软膏剂等剂型药物。
用于本发明药物组合物的载体是药物领域中可得到的常见类型,包括:粘合剂、润滑剂、崩解剂、助溶剂、稀释剂、稳定剂、悬浮剂、无色素、矫味剂、防腐剂、加溶剂和基质等。药物制剂可以经口服或胃肠外方式(例如静脉内、皮下、腹膜内或局部)给药,如果某些药物在胃部条件下不稳定的,可将其配制成肠衣片剂。
附图说明
图1为实施例3化合物与MyD88蛋白的结合亲和力与浓度的关系。
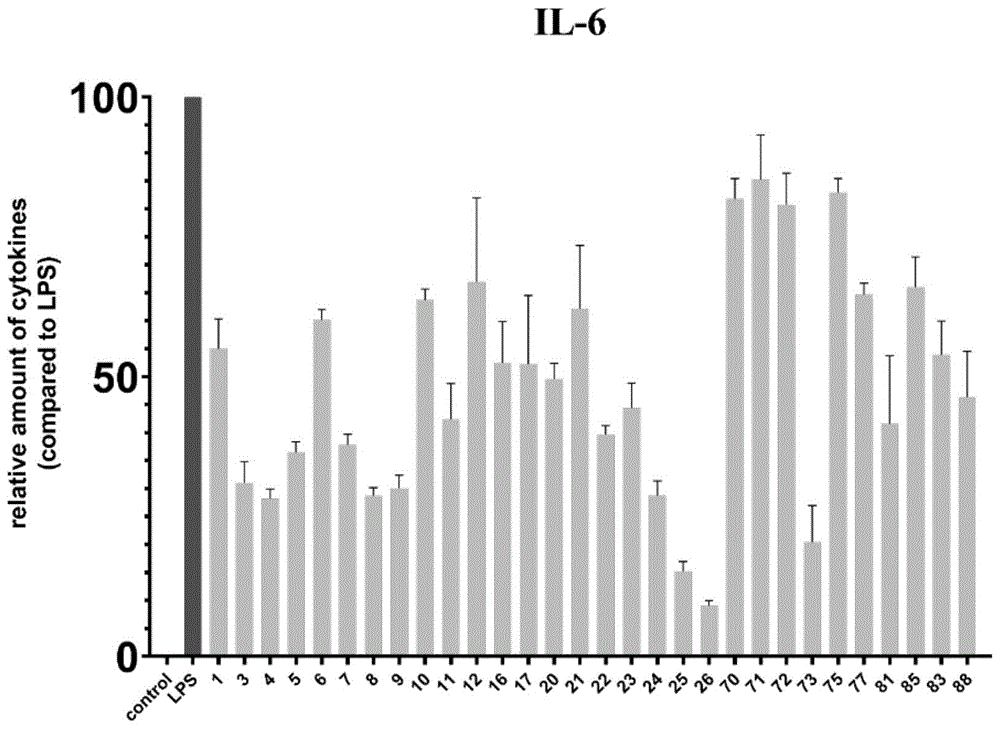
图2为部分实施例化合物抑制LPS刺激J774A.1细胞释放IL-6的量效关系。
图3为部分实施例化合物抑制LPS刺激J774A.1细胞释放TNF-α的量效关系。
图4为以急性肺损伤为例,实施例3化合物缓解炎症引起的小鼠生理学变化效果。A湿重/干重比(W/D);B肺泡灌洗液中白细胞蛋白浓度;C肺泡灌洗液中IL-6表达量;D肺泡灌洗液中TNF-α表达量;E血清中IL-6表达量;F血清TNF-α表达量。
图5为以急性肺损伤中肺组织为例,实施例3化合物缓解炎症引起的病理学变化。
图6为以脓毒血症为例,实施例3化合物缓解炎症引起小鼠死亡的变化。
图7为以脓毒血症为例,实施例3化合物缓解炎症引起小鼠脾脏的病理学变化。
具体实施方式
按照本发明的通式Ⅰ化合物,R
抑或:
抑或:
抑或:
化合物1~33的制备方法中:
所述
步骤(1)所述反应的温度为-5~5℃,优选为-2~2℃,进一步优选为0℃;时间为5~15h,优选为8~12h,进一步优选为10h;
所述
步骤(2)所述反应的温度为60~80℃,优选为65~75℃,进一步优选为70~72℃;时间为1~10h,优选为2~8h,进一步优选为4~6h。
化合物34~69的制备方法中:
所述碳酸氢钠、亚硫酸钠、4-氯-3-硝基苯磺酰氯和水的用量比为7~9mmol:7~9mmol:3~5mmol:20~40mL,优选为8mmol:8mmol:4mmol:25~30mL;
步骤(1)所述反应的温度为室温,时间为1~5h,优选为2~4h;
所述4-氯-3-硝基苯亚磺酸、溴苄类物质和N,N-二甲基甲酰胺的用量比为0.4~0.5mmol:0.6~0.8mmol:2~8mL,优选为0.42~0.45mmol:0.65~0.7mmol:4~6mL;
步骤(2)所述反应的温度为70~90℃,优选为75~85℃,进一步优选为80℃;时间为1~5h,优选为2~4h,进一步优选为3h;
所述
步骤(3)所述反应的温度为80~90℃,优选为85~87℃;时间为1~5h,优选为2~4h。
化合物70~84的制备方法中:
所述苯乙酮、氢氧化钠、
步骤(1)中所述反应的温度为室温,时间为5~15h,优选为8~12h;
步骤(2)所述保护气氛优选为氮气或者氩气;
所述
步骤(2)所述反应的温度为80~90℃,优选为85~87℃;时间为1~5h,优选为2~3h;
所述
步骤(3)所述反应的温度为80~90℃,优选为85~87℃;时间为1~5h,优选为2~3h;
步骤(4)所述保护气氛优选为氮气或者氩气;
所述
步骤(4)所述反应的温度为80~90℃,优选为85~87℃;时间为1~5h,优选为2~3h。
化合物85~93的制备方法中:
步骤(1)中所述
所述反应的温度为80~90℃,优选为85~87℃;时间为1~5h,优选为2~3h;
步骤(2)中所述
所述反应的温度为80~90℃,优选为85~87℃;时间为1~5h,优选为2~3h;
步骤(3)中所述中间产物、2-甲氧基乙基哌嗪、三乙胺和乙腈的用量比为0.1~0.5mmol:0.1~0.5mmol:45~55μL:5~15mL,优选为0.2~0.3mmol:0.3~0.4mmol:48~53μL:8~12mL;
所述反应的温度为80~90℃,优选为85~87℃;时间为1~5h,优选为2~3h;
步骤(2)和步骤(3)中所述保护气氛独立的包含氮气或氩气。
本发明按照制备通式I的方法,分别制得实施例1~93的化合物,结构式如下表1所示。
表1实施例1~93的结构式
实施例1、N-(2-甲氧基吡啶-5-基)-3-硝基-4-[4-(嘧啶-2-基)哌嗪-1-基]苯磺酰胺
步骤一:4-氯-N-(6-甲氧基吡啶-3-基)-3-硝基苯磺酰胺
在25mL圆底烧瓶中加入二氯甲烷(5mL)溶解5-氨基-2-甲氧基吡啶(200mg,1.61mmol),而后在0℃下分批加入4-氯-3-硝基苯磺酰氯(413mg,1.61mmol),室温反应过夜。减压蒸干二氯甲烷,加入水中溶解产物,并用EtOAc萃取水层。将合并的有机提取物用无水硫酸钠干燥。减压蒸干乙酸乙酯,柱层析分离(PE:EA=4:1)得,即为4-氯-N-(6-甲氧基吡啶-3-基)-3-硝基苯磺酰胺,收率为70%。
步骤二:N-(6-甲氧基吡啶-3-基)-3-硝基-4-(4-嘧啶-2-基)哌嗪-1-基)苯磺酰胺
在25mL圆底烧瓶中依次将步骤一中合成的4-氯-N-(6-甲氧基吡啶-3-基)-3-硝基苯磺酰胺(50mg,0.15mmol),2-(哌嗪-1-基)嘧啶(35mg,0.22mmol),碳酸钾(40mg,0.29mmol),碘化钠(44mg,0.29mmol)加入6mL无水四氢呋喃中,70℃下回流4h。反应结束后减压蒸干四氢呋喃,用EA萃取,有机层用饱和氯化钠溶液洗涤三次,无水硫酸镁干燥。减压蒸干EA,柱层析分离(DCM:Methanol=20:1)得,即为N-(6-甲氧基吡啶-3-基)-3-硝基-4-(4-嘧啶-2-基)哌嗪-1-基)苯磺酰胺,收率为90%。
按照实施例1的方法,分别制得实施例2~33化合物
实施例2、4-(4-苄基哌嗪-1-基)-N-(2-甲氧基吡啶-5-基)-3-硝基苯磺酰胺
实施例3、N-(2-甲氧基吡啶-5-基)-3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}苯磺酰胺
实施例4、N-(2-甲氧基吡啶-5-基)-3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}苯磺酰胺
实施例5、4-{4-[(4-甲氧基苯基)甲基]哌嗪-1-基}-N-(2-甲氧基吡啶-5-基)-3-硝基苯磺酰胺
实施例6、N-(5-{[4-(4-{[(6-甲氧基吡啶-3-基)氨基]二氧亚基-λ6-硫基}-2-硝基苯基)哌嗪-1-基]甲基}-1,3-噻唑-2-基)乙酰胺
实施例7、N-(萘-1-基)-3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}苯甲酰胺
实施例8、3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
实施例9、3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
实施例10、4-(4-苄基哌嗪-1-基)-3-硝基-N-(吡啶-2-基甲基)苯甲酰胺
实施例11、3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯甲酰胺
实施例12、3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯甲酰胺
实施例13、3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯甲酰胺
实施例14、3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯甲酰胺
实施例15、3-硝基-4-[4-(4-硝基苯基)哌嗪-1-基]-N-苯基苯甲酰胺
实施例16、2-(4-{2-硝基-4-[(苯基氨基)甲基]苯基}哌嗪-1-基)乙-1-醇
实施例17、4-[4-(2-甲氧基乙基)哌嗪-1-基]-3-硝基-N-苯基苯甲酰胺
实施例18、4-[4-(2-羟基乙基)哌嗪-1-基]-N-(6-甲氧基吡啶-3-基)-3-硝基苯磺酰胺
实施例19、4-[4-(2-甲氧基乙基)哌嗪-1-基]-N-(6-甲氧基吡啶-3-基)-3-硝基苯磺酰胺
实施例20、4-[4-(2-甲氧基乙基)哌嗪-1-基]-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
实施例21、4-[4-(2-羟基乙基)哌嗪-1-基]-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
实施例22、4-[4-(2-甲氧基乙基)哌嗪-1-基]-3-硝基-N-苯基苯磺酰胺
实施例23、4-[4-(2-羟基乙基)哌嗪-1-基]-3-硝基-N-苯基苯磺酰胺
实施例24、3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯磺酰胺
实施例25、3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-苯基苯磺酰胺
实施例26、3-硝基-4-[4-(4-硝基苯基)哌嗪-1-基]-N-苯基苯磺酰胺
实施例27、4-(4-苄基哌嗪-1-基)-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
实施例28、3-硝基-4-{4-[(3-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
实施例29、3-硝基-4-{4-[(4-硝基苯基)甲基]哌嗪-1-基}-N-(吡啶-2-基甲基)苯磺酰胺
实施例30、3-硝基-4-[4-(4-硝基苯基)哌嗪-1-基]-N-(吡啶-2-基甲基)苯磺酰胺
实施例31、4-{4-[(4-甲氧基苯基)甲基]哌嗪-1-基}-3-硝基-N-(吡啶-2-基甲基)苯磺酰胺
实施例32、3-硝基-N-(吡啶-2-基甲基)-4-[4-(嘧啶-2-基)哌嗪-1-基]苯磺酰胺
实施例33、N-(5-{[4-(4-{二氧亚基[(吡啶-2-基甲基)氨基]-λ6-硫基}-2-硝基苯基)哌嗪-1-基]甲基}-1,3-噻唑-2-基)乙酰胺
实施例34、1-[4-(苄基磺酰基)-2-硝基苯基]-3-甲基哌啶
步骤一:4-氯-3-硝基苯亚磺酸
在25mL圆底烧瓶中将碳酸氢钠(656.16mg,7.81mmol),亚硫酸钠(984.46mg,7.81mmol),4-氯-3-硝基苯磺酰氯(1.00g,3.91mmol)依次加入水(30mL)中,室温反应2小时。减压蒸干乙醇,用EA萃取,乙醇重结晶得,即为4-氯-3-硝基苯亚磺酸,收率为90%。
步骤二:4-苄基磺酰基-1-氯-2-硝基苯
在25mL圆底烧瓶中将步骤一制得的4-氯-3-硝基苯亚磺酸(100.00mg,0.45mmol),溴苄(115.77mg,0.67mmol),依次加入DMF(5mL)中,80℃反应2小时。加入冰水淬灭反应,用EA萃取,柱层析分离(DCM:MeOH=20:1)得,即为4-苄基磺酰基-1-氯-2-硝基苯,收率为36%。
步骤三:1-[4-(苄基磺酰基)-2-硝基苯基]-3-甲基哌啶
在25mL圆底烧瓶中将步骤二制得的4-苄基磺酰基-1-氯-2-硝基苯(30mg,0.096mmol),碘化钾(19.17mg,0.12mmol),三甲基哌啶(11.45mg,0.12mmol),碳酸钾(15.96mg,0.12mmol)依次加入乙腈(5mL)中,85℃反应2小时。加入冰水淬灭反应,用EA萃取,柱层析分离(DCM:MeOH=20:1)得,即为1-(4-苄基磺酰基)-2-硝基苯基-3-甲基哌啶,收率为76%。
按照实施例34的方法,分别制得实施例35~69化合物
实施例35、1-[4-(苄基磺酰基)-2-硝基苯基]-4-甲基哌嗪
实施例36、1-[4-(苄基磺酰基)-2-硝基苯基]-4-乙基哌嗪
实施例37、1-{4-[4-(苄基磺酰基)-2-硝基苯基]哌嗪-1-基}乙-1-酮
实施例38、1-[4-(苄基磺酰基)-2-硝基苯基]-4-(4-硝基苯基)哌嗪
实施例39、2-{4-[4-(苄基磺酰基)-2-硝基苯基]哌嗪-1-基}乙-1-醇
实施例40、1-[4-(苄基磺酰基)-2-硝基苯基]-4-(2-甲氧基乙基)哌嗪
实施例41、1-[4-(苄基磺酰基)-2-硝基苯基]-4-(3-硝基苄基)哌嗪
实施例42、4-[(3-氟苄基)磺酰基]-N,N-二甲基-2-硝基苯胺
实施例43、1-乙基-4-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}哌嗪
实施例44、1-(4-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
实施例45、1-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
实施例46、2-(4-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
实施例47、1-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}-4-(2-甲氧基乙基)哌嗪
实施例48、1-{4-[(3-氟苄基)磺酰基]-2-硝基苯基}-4-(3-硝基苄基)哌嗪
实施例49、4-[(4-氟苄基)磺酰基]-N,N-二甲基-2-硝基苯胺
实施例50、1-乙基-4-[4-(4-氟苄基)磺酰基]-2-硝基苯基哌嗪
实施例51、1-(4-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
实施例52、1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
实施例53、2-(4-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
实施例54、1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(2-甲氧基乙基)哌嗪
实施例55、1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(3-硝基苄基)哌嗪
实施例56、1-{4-[(4-氟苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苄基)哌嗪
实施例57、1-乙基-4-[4-(4-甲基苄基)磺酰基]-2-硝基苯基)哌嗪
实施例58、1-(4-{4-[(4-甲基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
实施例59、1-{4-[(4-甲基苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
实施例60、2-(4-{4-[(4-甲基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
实施例61、1-(2-甲氧基乙基)-4-[4-(4-甲基苄基)磺酰基]2-硝基苯基)哌嗪
实施例62、4-[(4-甲氧基苄基)磺酰基]-N,N-二甲基-2-硝基苯胺
实施例63、1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪
实施例64、1-乙基-4-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪
实施例65、1-(4-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-酮
实施例66、1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}-4-(4-硝基苯基)哌嗪
实施例67、2-(4-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}哌嗪-1-基)乙-1-醇
实施例68、1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}-4-(2-甲氧基乙基)哌嗪
实施例69、1-{4-[(3-甲氧基苄基)磺酰基]-2-硝基苯基}-4-(3-硝基苄基)哌嗪
实施例70、4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮
步骤一:(E)-1-苯基-3-(对甲苯基)丙-2-烯-1-酮
在25mL圆底烧瓶中将苯乙酮(2.00g,16.65mmol),氢氧化钠(1.00g,25.00mmol),对甲基苯甲醛(2.00g,16.65mmol)依次加入乙醇(10mL)中,室温反应过夜。抽滤得,即为(E)-1-苯基-3-(对甲苯基)丙-2-烯-1-酮,收率为90%。
步骤二:(E)-3-[4-(溴甲基)苯基]-1-苯基丙-2-烯-1-酮
在25mL圆底烧瓶中将步骤一制得的(E)-1-苯基-3-(对甲苯基)丙-2-烯-1-酮(500.00mg,2.25mmol),N-溴代琥珀酰亚胺(440.38mg,2.47mmol),偶氮二异丁腈(73.87mg,0.45mmol)依次加入四氯化碳(20mL)中,氮气保护下85℃反应2h。旋蒸蒸干四氯化碳,EA萃取。蒸干EA,柱层析(PE:EA=10:1)得,即为(E)-3-[4-(溴甲基)苯基]-1-苯基丙-2-烯-1-酮,收率为60%。
步骤三:(E)-3-(4-{[4-(2-羟乙基)哌嗪-1-基]甲基}苯基)-1-苯基丙-2-烯-1-酮
在25mL圆底烧瓶中将步骤二制得的(E)-3-[4-(溴甲基)苯基]-1-苯基丙-2-烯-1-酮(200mg,0.66mmol),2-羟乙基哌嗪(129.68mg,1.00mmol),三乙胺(100.80mg,1.00mmol)依次加入乙腈(10mL)中,85℃反应2h。旋蒸蒸干乙腈,EA萃取。蒸干EA,柱层析(PE:EA=1:1)得,即为(E)-3-(4-{[4-(2-羟乙基)哌嗪-1-基]甲基}苯基)-1-苯基丙-2-烯-1-酮,收率为60%。
步骤四:4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮
在25mL圆底烧瓶中将步骤三制得的E)-3-(4-{[4-(2-羟乙基)哌嗪-1-基]甲基}苯基)-1-苯基丙-2-烯-1-酮(100.00mg,0.29mmol),脲(25.70mg,0.43mmol),叔丁醇钠(32.91mg,0.34mmol)依次加入四氢呋喃(5mL)中,氮气保护下85℃反应2h。旋蒸蒸干四氢呋喃,EA萃取。蒸干EA,柱层析(PE:EA=1:1)得,即为4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮,收率为40%。
按照实施例70的方法,分别制得实施例71~84化合物
实施例71、4-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-6-(4-甲氧基苯基)-1,2-二氢嘧啶-2-酮
实施例72、4-{4-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]苯基}-6-苯基-1,2-二氢嘧啶-2-酮
实施例73、4-{4-[(苯并[d][1,3]噻唑-2-基氨基)甲基]苯基}-6-苯基-1,2-二氢嘧啶-2-酮
实施例74、4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-6-(4-甲氧基苯基)-1,2-二氢嘧啶-2-酮
实施例75、4-{4-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]苯基}-6-(4-甲氧基苯基)-1,2-二氢嘧啶-2-酮
实施例76、4-{4-[(戊基氨基)甲基]苯基}-6-苯基-1,2-二氢嘧啶-2-酮
实施例77、6-(4-甲氧基苯基)-4-{4-[(戊基氨基)甲基]苯基}-1,2-二氢嘧啶-2-酮
实施例78、4-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮
实施例79、6-(4-溴苯基)-4-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-1,2-二氢嘧啶-2-酮
实施例80、4-(4-{[4-(4-硝基苯基)哌嗪-1-基]甲基}苯基)-6-苯基-1,2-二氢嘧啶-2-酮
实施例81、6-(4-溴苯基)-4-{4-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]苯基}-1,2-二氢嘧啶-2-酮
实施例82、6-(4-甲氧基苯基)-4-(4-{[4-(4-硝基苯基)哌嗪-1-基]甲基}苯基)-1,2-二氢嘧啶-2-酮
实施例83、6-(4-溴苯基)-4-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-1,2-二氢嘧啶-2-酮
实施例84、4-{4-[(4-乙酰基哌嗪-1-基)甲基]苯基}-6-(4-溴苯基)-1,2-二氢嘧啶-2-酮
实施例85、2-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-3,4-二氢喹唑啉-4-酮
步骤一:2-(4-甲基苯基)-3,4-二氢喹唑啉-4-酮
在25mL圆底烧瓶中将2-氨基苯甲酰胺(1.00g,7.34mmol),碘(2.05g,8.08mmol),对甲基苯甲醛(1.06g,8.81mmol)依次加入乙醇(10mL)中,85℃反应2小时。5%亚硫酸钠溶液淬灭反应,抽滤得,即为2-(4-甲基苯基)-3,4-二氢喹唑啉-4-酮,收率为90%。
步骤二:2-[4-(溴甲基)苯基]-3,4-二氢喹唑啉-4-酮
在25mL圆底烧瓶中将步骤一制得的2-(4-甲基苯基)-3,4-二氢喹唑啉-4-酮(1.70g,7.20mmol),N-溴代琥珀酰亚胺(1.41g,7.91mmol),偶氮二异丁腈(236.30mg,1.44mmol)依次加入四氯化碳(30mL)中,氮气保护下85℃反应2h。旋蒸蒸干四氯化碳,EA萃取。蒸干EA,柱层析(PE:EA=5:1)得,即为2-[4-(溴甲基)苯基]-3,4-二氢喹唑啉-4-酮,收率为60%。
步骤三:2-(4-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}苯基)-3,4-二氢喹唑啉-4-酮
在25mL圆底烧瓶中将步骤二制得的(E)-3-[4-(溴甲基)苯基]-1-苯基丙-2-烯-1-酮(100mg,0.32mmol),2-甲氧基乙基哌嗪(50.33mg,0.35mmol),三乙胺(48.51μL)依次加入乙腈(10mL)中,氮气保护下85℃反应2h。旋蒸蒸干乙腈,EA萃取。蒸干EA,柱层析(PE:EA=1:1)得,即为(E)-3-(4-{[4-(2-羟乙基)哌嗪-1-基]甲基}苯基)-1-苯基丙-2-烯-1-酮,收率为60%。
按照实施例85的方法,分别制得实施例86~93化合物
实施例86、2-(4-{[4-(2-羟基乙基)哌嗪-1-基]甲基}苯基)-3,4-二氢喹唑啉-4-酮
实施例87、2-(4-{[4-(4-硝基苯基)哌嗪-1-基]甲基}苯基)-3,4-二氢喹唑啉-4-酮
实施例88、2-{4-[(4-乙酰基哌嗪-1-基)甲基]苯基}-3,4-二氢喹唑啉-4-酮
实施例89、7-{[4-(2-甲氧基乙基)哌嗪-1-基]甲基}-2-苯基-3,4-二氢喹唑啉-4-酮
实施例90、7-{[4-(2-羟基乙基)哌嗪-1-基]甲基}-2-苯基-3,4-二氢喹唑啉-4-酮
实施例91、7-{[4-(4-硝基苯基)哌嗪-1-基]甲基}-2-苯基-3,4-二氢喹唑啉-4-酮
实施例92、7-[(4-乙酰基哌嗪-1-基)甲基]-2-苯基-3,4-二氢喹唑啉-4-酮
实施例93、7-[(4-{2-[(2-羟基乙基)氧基]乙基}哌嗪-1-基)甲基]-2-苯基-3,4-二氢喹唑啉-4-酮
本发明产物的药理研究
(1)实施例化合物与MyD88蛋白的结合亲和力与浓度的关系
本实施例测试了实施例3化合物与MyD88蛋白的结合亲和力与浓度的关系。具体方法如下:利用标准氨基化学偶联法固定rh MyD88蛋白于CM7传感芯片表面,先20μg/mL蛋白溶于醋酸缓冲液(pH 5.5、5.0、4.5、4.0)以静电吸附作用预富集在CM7传感芯片(流速10μL/min),再以100μL的0.05M NHS和0.2M EDC混合溶液活化,反应10min催化蛋白的氨基和芯片上的活性羧基基团交联。最后用150μL的1M盐酸乙醇胺封闭未反应的活性羧基基团并洗去非共价吸附的物质(蛋白偶联量至少25000RFU)。PBSP缓冲液冲洗直至基线稳定。取出CM7芯片备用。动力学测定时,实施例3化合物用PBSP(含5%DMSO)稀释50μM,分别注射到已固定rhMyD88的CM7传感芯片上,每次注射50μl,测定3次。每次测定后,用含10mM Gly-Hcl(pH 2.5)溶液再生传感芯片,然后进行下一次测定。实验结果用评估软件BIAevaluation评估其结合力。实验结果如图1所示,所测试的实施例3化合物可直接结合MyD88,其结合亲和力的Kd值为5.3×10
(2)实施例化合物抑制LPS刺激巨噬细胞释放炎症因子的量效关系
本实施例测试了部分活性实施例化合物抑制LPS刺激J774A.1小鼠巨噬细胞释放IL-6和TNF-α的量效关系。具体方法如下:1.2×10
(3)实施例化合物缓解由炎症引起的小鼠生理学变化
以缓解急性肺损伤所引起的生理学变化为例。用0.5%羧甲基纤维素钠与实施例化合物制成混悬液用于腹腔给药。各组小鼠乙醚麻醉后暴露气管,除对照组外,其余各组气管内缓慢滴入50μL 5mg/kg LPS,造成小鼠急性肺损伤,对照组以相同的方式滴入等量生理盐水,缝合伤口,建立急性肺损伤模型。动物造模24h后,按照5mL/kg的剂量腹腔注射10%的水合氯醛麻醉老鼠,开胸结扎左肺,右肺用1mL生理盐水进行支气管肺泡灌洗,收集灌洗液,相同操作重复3次。
肺泡灌洗液收集后,4℃1000rpm离心5分钟,取上清液,测肺泡灌洗液的蛋白浓度。肺泡灌洗液离心后,用50μL生理盐水重悬沉淀,混匀后取20μL用细胞计数仪Standard计数肺泡灌洗液中的总细胞数。此外,取右肺上叶,滤纸吸去组织上的水分后称取湿重,放入60℃烘烤48h以上,直到其重量不再发生变化为止,称取干重,计算肺组织湿重/干重比(W/D),判断肺水肿程度。以实施例3化合物为例,实验数据见图4,其中3代表实施例3化合物,结果表明实施例化合物在生理学上可有效缓解小鼠急性肺损伤。
(4)实施例化合物缓解炎症引起的小鼠病理学变化试验
以缓解由急性肺损伤引起的小鼠肺组织病理学变化为例。实验数据见图5,正常对照组小鼠肺泡腔清晰,结构完整,壁光滑;气管滴注LPS造成急性肺损伤模型后,肺泡壁明显水肿、增厚,炎症细胞浸润增加;给予实施例3化合物治疗后细胞水肿、增厚显著减弱,且炎症细胞浸润明显减少,与正常组差别不大,说明实施例3化合物可有效缓解急性肺损伤中肺组织损伤。
(5)实施例化合物缓解炎症引起的小鼠生存率变化试验
以缓解脓毒血症所引起的小鼠生存率变化为例。用0.5%羧甲基纤维素钠与实施例3化合物制成混悬液用于腹腔给药。各组小鼠乙醚麻醉后暴露气管,除对照组外,其余各组腹腔注射20μL 20mg/kg LPS,造成小鼠脓毒血症,对照组以相同的方式注射等量生理盐水,建立脓毒血症模型。动物造模7天内,每日记录小鼠存活情况。实验数据见图6,结果表明实施例化合物可以有效降低脓毒血症引起的小鼠的死亡率。
(6)实施例化合物缓解炎症引起的小鼠脾脏病理学变化试验
以缓解由脓毒血症引起的小鼠脾脏组织病理学变化为例。实验数据见图7,正常对照组小鼠脾脏清晰,结构完整,白髓红髓分明;腹腔注射LPS造成脓毒血症模型后,小鼠脾脏肿大,白髓扩散;给予实施例3化合物治疗后脾脏肿大减少,白髓与正常组差别不大,说明实施例3化合物可有效缓解脓毒血症引起的脾脏损伤。
从上述试验结果可以清楚地看出,本发明所要保护的通式Ⅰ的化合物,具有良好的抗炎活性。
