一种同时测定染发产品中54种染发剂的定量和/或定性方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于化妆品检测技术领域,具体涉及一种采用高效液相色谱-高分辨质谱联用技术同时测定染发产品中54种染发剂的定量和/或定性方法。
背景技术
染发化妆品是用来改变头发颜色,达到美化毛发目的的一类化妆品。随着国民经济的发展,人们的爱美需求不断提高,染发已成为当代不可或缺的美容方式之一。虽然许多染发产品宣称“纯植物成分”、“天然”、“无氨温和”,但由于染发剂过敏患者频繁出现,致使使用染发化妆品是否健康安全的问题,成为公众关心和争论的焦点。
依据染发后色彩的持续时间长短,染发化妆品可分为暂时性、半永久性、持久性三类。目前市场销售的染发剂大多数为持久性染发化妆品,又称氧化型染发产品,常含有芳香胺类和酚类小分子氧化型染料,具有一定的皮肤致敏性,长期使用具有不同程度的致癌性和致突变性,因此氧化型产品需经过安全性评价,取得特殊用途化妆品许可证之后方可生产销售。但从近几年国家食品药品监督管理局公布的不合格染发类化妆品的检验结果可以看出,染发剂成分存在严重问题,很多企业随意更改配方,不按批件配方生产,存在严重质量和安全隐患。暂时性和半永久类染发产品含有的染发剂多数为合成染料,长期使用亦具有光敏反应、生殖毒性等潜在危害。
因此,染发化妆品的安全质量控制的重点和难点是产品中的染发剂种类是否按批件或备案配方生产,以及各染发剂含量是否超过我国《化妆品安全技术规范》(2015年版,后称《规范》)中所列限度,即专属定性和准确定量问题。
目前,染发剂的检测方法主要包括纸色谱法、液相色谱法、液相色谱-质谱法、气相色谱法、气相色谱-质谱法、离子色谱法及胶束电动色谱等,基于染发剂多为多组分芳香极性小分子的性质,最普遍和适宜的测定方法为高效液相色谱-紫外/光电二极管列阵检测器(后简称“高效液相色谱法”)和液相色谱-质谱法。
《规范》共列出准用染发剂共75项,以游离基计为56种。目前《规范》收载的对苯二胺等32种染发剂的测定方法,虽然为染发剂质量和安全性监测提供了有力支撑,但是仅包含24个准用和8个禁用染发剂。在日常检验中发现依然有许多染发产品标签标识的染发剂不在32种组分之列,致使近半数染发产品无法得到有效的市场监管,存在不法企业钻监督检验标准缺失空子的风险。《规范》方法收录的高效液相色谱法测定不管是采用C18还是C16系统,均需要分成多个液相系统才能达到32种组分的完全分离,且依然无法完全排除基质的干扰;其附带的液质联用确证方法,受分离度和灵敏度的限制,需建立正负两个检测系统。
在染发产品的实际检验发现,单独采用,无法满足染发剂检验的需要。原因如下:虽然经过优化和分系统,采用高效液相色谱法可以分离数十种染发剂组分,但是不同染发产品中的存在其他物质无法避免干扰目标染发剂的检出;特别是当染发剂含量较低的情况下,无法采用紫外光谱图判定专属性;另外,高效液相色谱法为了保障分离度,色谱运行时间往往超过40min,而染发剂稳定性差,无法实现大批量检验。
因此,液相色谱-质谱法具有高专属性和高通量(除同分异构体,不需要完全分离)特点,在染发剂的检验上具有显著优势。虽然目前有文献报道《规范》中测定的32种染发剂的其他液质联用方法,但仍然存在以下问题:
(1)染发剂的同时测定种类严重不足,无法满足产品质量和安全控制的需要;
(2)根据实际染发样品中染发剂的添加量,文献中的前处理方法均会造成常见组分含量远远超过定量上限(一般一个到两个数量级以上),容易污染仪器,形成交叉污染,故不适用于大批量筛查。并且,如筛查计算后再稀释样品,极可能出现染发剂降解,需要重新称量、处理样品,无法真正做到快速测定,缺乏实际应用价值。
(3)无法兼顾正、负离子模式下染发剂组分的灵敏度。在正离子模式下各物质完全分离的情况下,负离子模式下测定的组分灵敏度较差,远低于正离子测定的染发剂组分,导致各物质线性范围重合度低,造成准确定量困难;
(4)基质效应严重:为了迁就灵敏度低的组分,样品稀释程度低;染发剂主要为极性小分子(绝大部分染发剂分子量在200Da以下),共洗脱无法避免。虽然,部分文献采用基质匹配法配制标线,但是空白基质的代表性无法保障,进而回收率测定结果不可靠;
(5)没有解决染发剂组分稳定性问题的确切方案。《规范》方法中加入亚硫酸氢钠作为抗氧剂配制染发剂的储备液(染发剂浓度大于2.5g/L),保存于0℃~4℃冰箱中,应于48小时内使用;但标准曲线溶液要求“临用现配”。中国专利202010662203.2的方法考察发现液质联用测定浓度下的多数染发剂,20小时内显著降解。染发剂的不稳定性对大规模准确定量产生严重的不确定性和不可控性。尤其是经验证:1,3-双-(2,4-二氨基苯氧)丙烷、2,6-二甲氧基-3,5-吡啶二胺盐酸盐和2-氨基-4-羟乙氨基茴香醚等《规范》中测定的32种外的染发剂,加入亚硫酸氢钠作为抗氧剂无法保证12h内稳定,无法满足定量测定要求。
发明内容
针对现有技术中存在的上述技术问题,本发明建立了一种专属、灵敏、耐用、高通量的高效液相色谱-高分辨质谱方法,能够同时检测54种染发剂成分,既囊括市面上染发产品(尤其是氧化类染发产品)中常见禁限用组分,又具有实际应用价值,可以在同一个流动相下同时实现正离子模式下多组同分异构体的分离,并保障负离子模式下苯酚、氢醌、1-萘酚等组分的灵敏度;解决染发产品提取液过滤难和滤膜吸附、染发剂在不同溶液和基质中稳定性和基质效应存在差异、染发剂组分在样品中的含量存在差异等影响定量结果准确性和测定方法耐用性的问题。
本发明的检测方法能够在一个色谱系统下保障同分异构体的充分分离,保障定性的专属性,并兼顾负离子条件下的灵敏度;前处理策略适用于多数染发产品的应用,解决基质效应、稳定性、滤膜吸附等影响定量准确性的问题;提出的测定方案,可大大提高检验过程的结果可控性。
本发明的第一个目的是提供一种采用高效液相色谱-四极杆/静电场轨道阱高分辨质谱同时测定染发产品中54种染发剂的方法,所述染发剂为1-羟乙基-4,5-二氨基吡唑硫酸盐(编号:A01)、羟乙基对苯二胺硫酸盐(编号:A02)、四氨基嘧啶硫酸盐(编号:A03)、2,6-二羟乙基氨甲苯(编号:A04)、2-氨基-6-氯-4-硝基苯酚(编号:A05)、2-甲基-5-羟乙氨基苯酚(编号:A06)、3-硝基对羟乙氨基酚(编号:A07)、4-羟丙氨基-3-硝基苯酚(编号:A08)、5-氨基-4-氯-邻甲酚(编号:A09)、5-氨基-6-氯-邻甲酚(编号:A10)、HC黄2号(编号:A11)、羟苯并吗啉(编号:A12)、羟乙基-2-硝基对甲苯胺(编号:A13)、1,3-双-(2,4-二氨基苯氧)丙烷(编号:A14)、2,6-二甲氧基-3,5-吡啶二胺盐酸盐(编号:A15)、2-氨基-4-羟乙氨基茴香醚(编号:A16)、苯酚(编号:A17)、N-羟乙基-3,4-亚甲二氧基苯胺盐酸盐(编号:A18)、HC黄4号(编号:A19)、HC红1号(编号:A20)、HC橙1号(编号:A21)、分散紫(编号:A22)、对苯二胺(编号:S01)、对氨基苯酚(编号:S02)、甲苯-2,5-二胺硫酸盐(编号:S03)、间氨基苯酚(编号:S04)、邻苯二胺(编号:S05)、2-氯对苯二胺硫酸盐(编号:S06)、邻氨基苯酚(编号:S07)、间苯二酚(编号:S08)、2-硝基对苯二胺(编号:S09)、甲苯-3,4-二胺(编号:S10)、4-氨基-2-羟基甲苯(编号:S11)、2-甲间苯二酚(编号:S12)、6-氨基间甲酚(编号:S13)、苯基甲基吡唑啉酮(编号:S14)、N,N-二乙基甲苯-2,5-二胺盐酸盐(编号:S15)、4-氨基-3-硝基苯酚(编号:S16)、间苯二胺(编号:S17)、2,4-二氨基苯氧基乙醇盐酸盐(编号:S18)、氢醌(编号:S19)、4-氨基间甲酚(编号:S20)、2-氨基-3-羟基吡啶(编号:S21)、N,N-双(2-羟乙基)对苯二胺硫酸盐(编号:S22)、对甲基氨基苯酚硫酸盐(编号:S23)、4-硝基邻苯二胺(编号:S24)、2,6-二氨基吡啶(编号:S25)、N,N-二乙基对苯二胺硫酸盐(编号:S26)、6-羟基吲哚(编号:S27)、4-氯间苯二酚(编号:S28)、2,7-萘二酚(编号:S29)、N-苯基对苯二胺(编号:S30)、1,5-萘二酚(编号:S31)、1-萘酚(编号:S32);
所述方法包括以下步骤:
S1配制对照品溶液
S1-1配制混合标准定性溶液
将54种染发剂对照品溶于10%~30%甲醇溶液,配制得到氢醌(S19)的质量浓度为400~4000ng/mL,其他染发剂的质量浓度为100~1000ng/mL的混合标准定性溶液Ⅰ,用于邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)的定性;
将54种染发剂对照品溶于采用含有抗氧化剂的10%~30%甲醇溶液,配制得到氢醌(S19)的质量浓度为400~4000ng/mL,其他染发剂的质量浓度为100~1000ng/mL的混合标准定性溶液Ⅱ,用于其他51种染发剂的定性;
S1-2系列混合标准曲线溶液的制备
将54种染发剂对照品溶于10%~30%甲醇溶液,连续稀释得到氢醌(S19)浓度范围在32~8000ng/mL之间,其他染发剂浓度在8~2000ng/mL之间若干浓度的系列混合标准曲线溶液Ⅰ,用于邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)的定性和/或定量;
将54种染发剂对照品溶于含有抗氧化剂的10%~30%甲醇溶液,连续稀释得到氢醌浓度范围在32~8000ng/mL之间,其他染发剂浓度范围在8~2000ng/mL之间若干浓度的系列混合标准曲线溶液Ⅱ,用于除邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)以外的51个成分的定性和/或定量;
S2样品溶液的配制
S2-1配制样品储备液:
称取样品,醇溶液稀释至不超过20mg/mL,冰浴超声提取5~20min,摇匀,经有机滤膜过滤,取续滤液备用,即得样品储备液;
优选的,称取样品,醇溶液稀释至10~20mg/mL,冰浴超声提取5~20min,摇匀,经有机滤膜过滤,取续滤液备用,即得样品储备液;
所述醇溶液为50%~80%的甲醇或50%~80%乙醇;
S2-2配制样品溶液Ⅰ、样品溶液Ⅱ:
取样品储备液采用10%~30%甲醇溶液稀释,配制样品溶液Ⅰ-1、样品溶液Ⅰ-2,所述样品溶液Ⅰ-1中样品储备液浓度为20μL/mL,所述样品溶液Ⅰ-2中样品储备液浓度为2μL/mL;用于邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)的准确定性和/或定量;
取样品储备液采用含抗氧化剂的10%~30%甲醇溶液稀释,配制样品溶液Ⅱ-1、样品溶液Ⅱ-2,所述样品溶液Ⅱ-1中样品储备液浓度为20μL/mL,所述样品溶液Ⅱ-2中样品储备液浓度为2μL/mL;用于其他51种组分的准确定性和/或定量;
S3色谱-质谱检测条件
色谱条件:
色谱柱:C18柱,柱温:40℃;流动相:A相为0.5~5mmol/L氟化铵水溶液;B相为甲醇或乙腈,流速:0.2~0.5mL/min。梯度洗脱程序:0~2.0min,10%B;2.0~8.5min,10%B~60%B;8.5~10.0min,60%B~95%B;10.0~12.0min,95%B;12.0~12.1min,95%B~10%B;12.1~15.0min,10%B;进样量:0.5~10μL;进样盘温度:4℃;
质谱条件:
喷雾电压:正离子模式1~4.5kV,负离子模式-1~-4kV;雾化温度:300~400℃;离子传输管温度:300~350℃;鞘气压力:50Arb;辅助气压力:10Arb;一级质谱全扫描(Fullscan),扫描范围(m/z):50~300Da;分辨率:R=60 000或120 000;数据依赖二级离子全扫描(Full MS/Intensity/Dynamic Exclusion/Targeted Mass/ddMS2),强度阈值:1.0e5;ddMS2分辨率:R=15000或30 000;在某一个特殊的实施例中,离子传输管温度:325℃。
S4样品的定性和/或定量测定
当需要进行定量和定性测定时,进行S4a定性和定量测定:
S4a-1注入S1-1配制的混合标准定性溶液Ⅰ,确定邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)的保留时间,三个色谱峰的信噪比均应大于100;注入样品溶液Ⅰ-1确定邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)是否检出;如果未检出,进行步骤S4a-3;如检出,进行步骤S4a-2和S4a-3;
S4a-2注入S1-2配制的系列混合标准曲线溶液Ⅰ,以邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)的色谱峰面积对其浓度进行线性回归,绘制线性方程;依次注入样品溶液Ⅰ-2和样品溶液Ⅰ-1,将峰面积带入系列混合标准曲线溶液Ⅰ的线性方程式,以外标法计算邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)的含量;
S4a-3注入S1-2配制的系列混合标准曲线溶液Ⅱ,以各色谱峰面积对其浓度进行线性回归,绘制线性方程;依次注入样品溶液Ⅱ-2和样品溶液Ⅱ-1,将峰面积带入系列混合标准曲线溶液Ⅱ的线性方程式,以外标法计算除邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)以外的51个成分的含量;
当仅需要进行定性测定时,进行S4b定性判定:
将样品溶液Ⅰ-1、样品溶液Ⅰ-2与S1-1配制的混合标准定性溶液Ⅰ进行色谱-质谱检测,当样品溶液Ⅰ的色谱保留时间与混合标准定性溶液Ⅰ一致,且样品溶液Ⅰ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅰ一致,则所述样品中包括邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)中的一种或多种;
将样品溶液Ⅱ-1、样品溶液Ⅱ-2与S1-1配制的混合标准定性溶液Ⅱ进行色谱-质谱检测,当样品溶液Ⅱ的色谱保留时间与混合标准定性溶液Ⅱ一致,且样品溶液Ⅱ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅱ一致,则所述样品中包括括除邻苯二胺(S05)、甲苯-3,4-二胺(S10)、4-硝基邻苯二胺(S24)以外的51种成分中的一种或多种。
由于本申请54种染发剂具有同分异构体,在定性检测中,保留时间和二级质谱中的碎片离子检出碎片需要同时满足。
进一步的,S1-1所述混合标准定性溶液采用(1)或(2)所述方法配制:
(1)配制混标储备液,所述混标储备液的配制方法为:取54种染发剂对照品,混合,用50%~80%甲醇溶液溶解,得到混标储备液;可直接进行如下配制或于-20℃下避光保存,使用时:
用10%~30%甲醇溶液稀释混标储备液,配制得到混合标准定性溶液Ⅰ;
用含有抗氧化剂的10%~30%甲醇溶液稀释混标储备液,配制得到混合标准定性溶液Ⅱ;
(2)配制单标储备液,所述单标储备液的配制方法为:将S05、S10、S24对照品分别采用50%~80%甲醇溶液溶解;其他染发剂对照品分别采用含有抗氧化剂的50%~80%甲醇溶液溶解;分别得到54种单标储备液;可直接进行如下配制或于-20℃下避光保存,使用时:
将邻苯二胺、甲苯-3,4-二胺、4-硝基邻苯二胺的单标储备液混合,加入10%~30%甲醇溶液,配制得到混合标准定性溶液Ⅰ;
将54种单标储备液混合,加入含有抗氧化剂的10%~30%甲醇溶液,配制得到混合标准定性溶液Ⅱ。
进一步的,S1-2所述系列混合标准曲线溶液采用(1)或(2)所述方法配制:
(1)配制混标储备液,所述混标储备液的配制方法为:取54种染发剂对照品,混合,用50%~80%甲醇溶液溶解,配制得到混标储备液;,可直接进行如下配制或于-20℃下避光保存,使用时:
用10%~30%甲醇溶液连续稀释混标储备液,得到所述若干浓度的系列混合标准曲线溶液Ⅰ;
用含有抗氧化剂的10%~30%甲醇溶液连续稀释混标储备液,得到所述若干浓度的系列混合标准曲线溶液Ⅱ;
(2)配制单标储备液,所述单标储备液的配制方法为:将邻苯二胺、甲苯-3,4-二胺、4-硝基邻苯二胺对照品分别采用50%~80%甲醇溶液溶解;其他染发剂对照品分别采用含有抗氧化剂的50%~80%甲醇溶液溶解;分别得到54种单标储备液,可直接进行如下配制或于-20℃下避光保存,使用时:
将邻苯二胺、甲苯-3,4-二胺、4-硝基邻苯二胺的单标储备液混合,加入10%~30%甲醇溶液,配制得到混合标准定性溶液Ⅰ;
将54种单标储备液混合,加入含有抗氧化剂的10%~30%甲醇溶液,配制得到混合标准定性溶液Ⅱ。
进一步的,所述混标储备液、单标储备液中54种染发剂的质量浓度不高于5000μg/mL;
优选的,所述混标储备液、单标储备液中氢醌(S19)的质量浓度不高于800μg/mL,其他染发剂质量浓度不高于200μg/mL;进一步优选的,
进一步优选的,所述混标储备液、单标储备液中氢醌(S19)的质量浓度不高于40μg/mL,其他染发剂质量浓度不高于10μg/mL。
进一步的,S1-1、S1-2、S2-2所述10%~30%甲醇溶液为25%甲醇溶液;S1-1、S1-2、S2-2所述含有抗氧化剂的10%~30%甲醇溶液为含有抗氧化剂的25%甲醇溶液。
进一步的,S1-1、S1-2、S2-2含抗氧化剂的10%~30%甲醇溶液中所述抗氧化剂为D-异抗坏血酸或L-抗坏血酸;优选的,所述氧化剂为D-异抗坏血酸。
进一步的,S1-1、S1-2、S2-2含抗氧化剂的10%~30%甲醇溶液中所述抗氧化剂浓度不低于0.05%;优选的,所述氧化剂浓度为0.05%。
本申请在研究过程中系统考察了不同抗氧剂下各组分的稳定性,包括亚硫酸氢钠、D-异抗坏血酸、L-抗坏血酸、焦性没食子酸、柠檬酸等。结果发现D-异抗坏血酸与L-抗坏血酸的抗氧效果最好,且效果相似,对大部分染发剂的稳定性提高效果显著,尤其是A14、A15和A16;但是一些染发剂在抗氧剂的存在下稳定性反而降低,如A02、S03、S06在亚硫酸氢钠溶液中稳定性较差,含有邻苯二胺结构的组分(S05、S10和S24)会与D-异抗坏血酸(L-抗坏血酸)发生化学反应从而稳定性显著降低。S21、S25、A07、A08、A09、A11、A13、A21和A22的在各种溶剂中稳定均较好。不同氧化剂除会影响染发剂的稳定性外,对于保留较弱的组分还会产生基质效应,如亚硫酸氢钠溶液会产生基质抑制效应,而抗坏血酸类会产生较强烈的基质增强效应,其效应的强度与抗氧剂的浓度存在一定正相关关系。此外,D-异抗坏血酸、L-抗坏血酸或焦性没食子酸的存在会显著改善A02、S03、S14、S15、S22和S26等物质,尤其是S30的峰形。浓度需大于0.05%D-异抗坏血酸产生基质效应,浓度大于0.05%后,基质效应稳定。
进一步的,S1还包括S1-3配制定位溶液:
取前述单标储备液,加入10%~30%甲醇溶液,配制得到邻苯二胺、甲苯-3,4-二胺、4-硝基邻苯二胺的质量浓度为400~4000ng/mL,其他染发剂的质量浓度为100~1000ng/mL的定位溶液Ⅰ;
取前述单标储备液,分别加入含有抗氧化剂的10%~30%甲醇溶液,配制得到S19的质量浓度为400~4000ng/mL,其他染发剂的质量浓度为100~1000ng/mL的定位溶液Ⅱ。
在本申请技术方案研究过程中,采用单标储备液进行稳定性考察,运用本发明方法检测的实际操作时,考虑本申请的54中染发剂中,约有8组同分异构体,因此需采用单标储备液进行定位;
由于54种染发剂含有多组同分异构体,故建立方法时,采用单标定位溶液确定其异构体的出峰顺序;如完全采用本发明的色谱条件,可参考相对保留而不须配制定位溶液。
进一步的,S2-2所述样品溶液Ⅰ-1、样品溶液Ⅱ-1浓度为200~400μg/mL;S2-2所述样品溶液Ⅰ-2、样品溶液Ⅱ-2浓度为20~40μg/mL。
进一步的,S2中所述醇溶液为50%~80%的甲醇溶液或50%~80%的乙醇溶液,优选的,所述醇溶液为70%甲醇溶液,利于目标物质的溶解和过滤。
进一步的,S2中所述有机滤膜孔径为0.22μm或0.45μm,优选的,由于样品溶液过滤较困难,后一步还会稀释,所述有机滤膜孔径为0.45μm。
进一步的,S2中所述有机滤膜为聚四氟乙烯膜。
本申请研究过程中系统考察了水膜和有机膜,水膜容易溶膜,回收率较差,故不合适。有机膜中,尼龙膜和偏氟乙烯滤膜(PVDF)不同品牌差异较大,个别厂家的对负离子检测的物质(如S08、S12、S27、S29、S30和S32)吸附严重。A20、A21和A22极易被滤膜吸附,滤膜吸附随溶剂中有机相比例的降低而降低,不同厂家聚四氟乙烯膜回收率相对稳定。
进一步的,S3所述色谱条件为:色谱柱:ACE Excel C18柱(150mm×2.0mm,3μm),柱温:40℃;流动相:A相为1mmol/L氟化铵水溶液;B相为乙腈,流速:0.3mL/min。梯度洗脱程序:0~2.0min,10%B;2.0~8.5min,10%B~60%B;8.5~10.0min,60%B~95%B;10.0~12.0min,95%B;12.0~12.1min,95%B~10%B;12.1~15.0min,10%B;进样量:1μL;进样盘温度:4℃。
进一步的,S3所述质谱条件为:喷雾电压:正离子模式1.5kV,负离子模式-2.5kV;雾化温度:350℃;离子传输管温度:325℃;鞘气压力:50Arb;辅助气压力:10Arb;一级质谱全扫描(Full scan),扫描范围(m/z):50~300Da;全扫分辨率:R=60 000;数据依赖二级离子全扫描(Full MS/Intensity/Dynamic Exclusion/Targeted Mass/ddMS2),强度阈值:1.0e5;ddMS2分辨率:R=15 000。
进一步的,S3所述二级离子全扫描(Full MS/Intensity/Dynamic Exclusion/Targeted Mass/ddMS2)的Targeted Mass中,设定目标母离子的保留时间、分子式、加和离子形式和碰撞能量,54种染发剂的质谱信息如下:
/>
/>
本发明的有益效果:
(1)本发明方法解决了染发剂实际检测过程中必然遇到的稳定性、分离度和专属性、过滤难和膜吸附等问题,弥补了现有文献、标准染发剂覆盖不全面问题,建立了一种专属、灵敏、耐用、高通量的高效液相色谱-高分辨质谱同时检测54种染发剂的方法,覆盖了市面上常见染发产品中可能添加的准用染发剂和禁用染发剂,为有效的市场监管提供了有力的技术支持,预防不法企业钻监督检验标准和方法缺失的空子。
(2)本发明可在一个色谱-质谱系统下保障8组同分异构体的充分分离,保障定性的专属性,并大大提高负离子条件下检测染发剂组分的灵敏度,使54种染发剂的检测和定量范围重合度更高,减少因稀释倍数不同导致的检验次数增加,真正做到高效筛查。
(3)本发明精细设置了染发剂稳定性的解决方案,保障大批量检验结果的可靠性。
(4)本发明在提高灵敏度的基础上,稀释样品溶液,采用溶剂匹配标准曲线计算含量,提高了定量的准确性。
(5)本发明建立的前处理策略适用于多数染发产品的应用。
(6)采用本发明方法,覆盖了《规范》“7.2”中的32种染发剂,并增加了22种常见禁限用染发剂,本发明的处理条件下,尤其是采用70%甲醇溶液超声提取,25%甲醇溶液(含和不含D-异抗坏血酸)2种溶剂稀释样品,并匹配溶剂标线的定量方法,大大提高了染发剂的稳定性和测定结果的准确性;通过选择色谱柱和选用氟化铵溶液-乙腈作为流动相,保障了所有同分异构体的分离,大大提高了苯酚、氢醌等负离子监测组分的灵敏度;通过正负离子模式同时扫描和数据依赖二级离子全扫描(Full MS/Intensity/Dynamic Exclusion/Targeted Mass/ddMS2),实现了54种染发剂的准确定性和定量。
附图说明
图1正离子模式下检测的42种染发剂的提取离子流图(质量偏差:5ppm);其中:
a-1提取m/z从上到下依次为109.07602、110.06004、110.07127、111.05529、123.09167、124.07569、141.08832和143.03705,
a-2提取m/z从上到下依次为143.09274、152.07061、153.10224、154.06110、158.03672、165.13863、168.10191和169.09715,
a-3提取m/z从上到下依次为170.09240、175.08659、179.15428、182.08117、183.07642、183.11280、185.10732和197.09207,
a-4提取m/z从上到下依次为197.12845、211.14410、213.08698、230.09240、231.08642、239.08150、243.09755和289.16590;
图2负离子模式下检测的12种染发剂的提取离子流图(质量偏差:5ppm);其中:
b-1提取m/z从上到下依次为93.03459、109.02950、123.04515、132.04549和142.99053,
b-2提取m/z从上到下依次为143.05024、153.03057、159.04515、186.99159和197.05678;
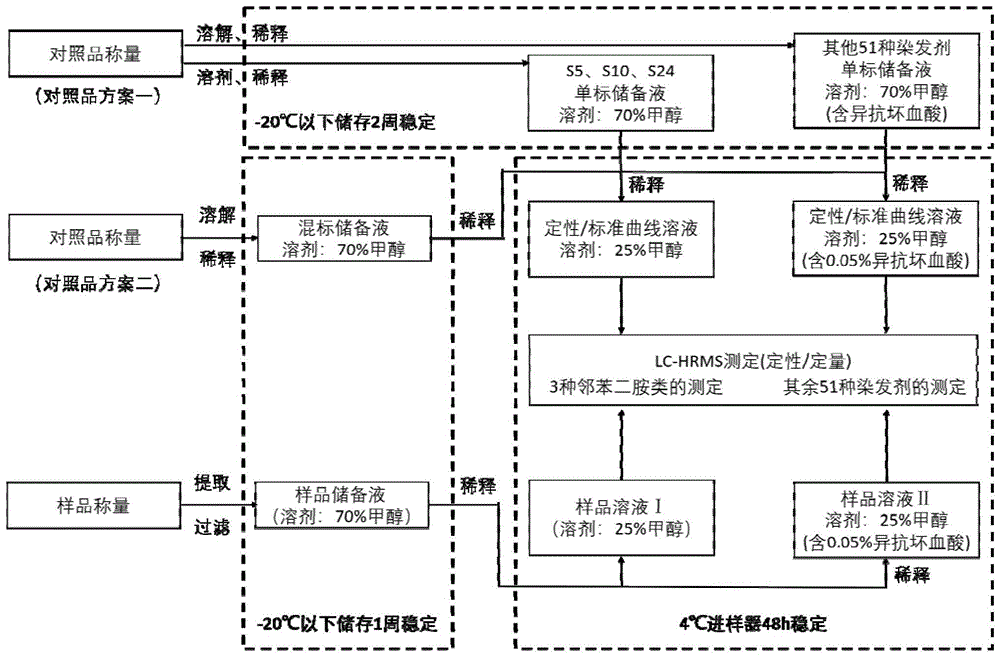
图3操作流程图
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
本发明实施例中“合格样品”、“问题样品”、“不合格样品”按照2021年国家化妆品监督抽检要求判定;检出标签标识或批件以外的染发剂的产品判定为问题样品;染发剂的含量超过《规范》限度规范限度的产品为不合格样品;在产品标签与批件载明的技术要求一致时,未出现前述两种情况的产品判定为合格样品。
1仪器
Vanquish-Orbitrap Exploris 120液相色谱-静电场轨道阱高分辨质谱联用仪(美国Thermo Fisher Scientific公司);XP6百万分之一电子天平(瑞士Mettler Toledo公司);CPA224S万分之一电子天平(德国Satorius公司);UA22MFD超声清洗仪(德国Wiggens公司);Milli-QIQ 7000超纯水系统(美国Millipore公司)。
2试剂
甲醇、乙腈、乙醇(色谱纯,美国Merck公司);甲酸(色谱纯,美国ACS恩科化学公司)、乙酸(上海麦克林生化科技有限公司)、乙酸铵(色谱纯德国Sigma-Aldrich公司)、氨水(色谱纯,上海阿拉丁生化科技有限公司);焦性没食子酸、亚硫酸氢钠、柠檬酸、柠檬酸钠(分析纯,国药集团化学试剂有限公司);D-异抗坏血酸(99%,上海阿拉丁生化科技有限公司);氟化铵(优级纯,国药集团化学试剂有限公司)。
3对照品(对照品的编号规则:S代表《技术规范》收录的染发剂检验方法“7.2对苯二酚等32种组分”;A为本发明增加的22种染发剂组分)
54种染发剂对照品编号和信息详见表1。其中,对照品A11、A18~22购自天津Altascientific公司;S01、S02、S03、S01~05、S07~10和S32购自德国Dr.Ehrenstorfer公司;S11~13、A02和A16购自美国Panphy-chemicals公司;A01、A03~10、A12~14、A17、S14~31购自美国Stanford Analytical Chemicals公司;S06购自加拿大TRC公司;A15购自上海源叶生物科技有限公司。所有对照品纯度均不低于97%。
表1 54种染发剂的编号与对照品信息
/>
/>
实施例1同时测定染发产品中54种染发剂的方法
本实施例以一批标识为“某品牌染发膏(红色)”染发产品的测定为例,详细介绍54种染发剂的定量和定性判定方法。
1对照品溶液的配制
1.1配制混标储备液
准确称取氢醌(S19)约20mg,其他对照品5.0mg,置同一25mL量瓶中,用70%甲醇溶解并稀释至刻度,摇匀,得到S19的质量浓度为800μg/mL,其他染发剂为200μg/mL的混标溶液。
精密量取上述混标溶液1mL,置20mL量瓶,用70%甲醇稀释定容至刻度,摇匀,即得S19的质量浓度为40μg/mL,其他染发剂为10μg/mL的混标储备液。
混标溶液和混标储备液于-20℃下避光保存,一周内稳定。
1.2配制混合标准定性溶液
量取混标储备液40.0μL,置进样小瓶中,加入25%甲醇溶液960μL,摇匀,即得混合标准定性溶液Ⅰ(S19的质量浓度为1600ng/mL,其他染发剂的质量浓度为400ng/mL),用于S05、S10、S24的定性。
量取混标储备液40.0μL,置进样小瓶中,加入含0.05%D-异抗坏血酸的25%甲醇溶液960μL,摇匀,即得混合标准定性溶液Ⅱ(S19的质量浓度为1600ng/mL,其他染发剂的质量浓度为400ng/mL),用于除S05、S10、S24以外的其他51种染发剂的定性。
1.3系列混合标准曲线的制备
精密量取混标储备液适量,用25%甲醇溶液连续稀释得到系列混合标准曲线溶液Ⅰ;
精密量取混标储备液适量,用25%甲醇溶液(含0.05%D-异抗坏血酸)连续稀释得到系列混合标准曲线溶液Ⅱ。
系列混合标准曲线溶液Ⅰ、系列混合标准曲线溶液Ⅱ中,S19的浓度范围:32~8000ng/mL,除S19以外的其他染发剂的浓度范围:8~2000ng/mL,现用现配;
本实施例中,系列混合标准曲线溶液Ⅰ、系列混合标准曲线溶液Ⅱ中,S19的浓度为:32、80、160、320、800、1600、3200、8000ng/mL;除S19以外的其他染发剂的浓度为:8、20、40、80、200、400、800、2000ng/mL。
1.4定位溶液
配制单标储备液,所述单标储备液的配制方法为:将邻苯二胺、甲苯-3,4-二胺、4-硝基邻苯二胺对照品分别采用70%甲醇溶液溶解;其他染发剂对照品分别采用70%甲醇溶液(含0.05%D-异抗坏血酸)溶解;分别得到54种单标储备液;
将邻苯二胺、甲苯-3,4-二胺、4-硝基邻苯二胺的单标储备液,分别用25%甲醇溶液稀释,配制得到3种染发剂的质量浓度为400ng/mL的定位溶液Ⅰ;
将54种单标储备液混合,分别用含有抗氧化剂的25%甲醇溶液稀释,配制得到S19的质量浓度为1600ng/mL,其他染发剂的质量浓度为400ng/mL的定位溶液Ⅱ。
所述定位溶液用于定位和稳定性考察。
2样品溶液的配制
精密称取样品0.2g,置10mL具塞比色管中,加70%甲醇溶液1mL,涡旋30s,加70%甲醇溶液定容至刻度,冰浴超声提取10min,摇匀,即得样品溶液,经0.45μm聚四氟乙烯膜滤膜过滤,取续滤液即得样品储备液,于-20℃下避光保存。
(1)精密量取样品储备液200μL,置10mL量瓶,加25%甲醇稀释至刻度,摇匀,即得样品溶液Ⅰ-1,所述样品溶液Ⅰ-1中样品储备液浓度为20μL/mL。
精密量取样品储备液20μL,置10mL量瓶,加25%甲醇稀释至刻度,摇匀,即得样品溶液Ⅰ-2,所述样品溶液Ⅰ-2中样品储备液浓度为2μL/mL。
样品溶液Ⅰ-1、样品溶液Ⅰ-2用于S05、S10、S24的准确定性和定量。
(2)精密量取样品储备液200μL,置10mL量瓶,加25%甲醇(含0.05%异抗坏血酸)至刻度,摇匀,即得样品溶液Ⅱ-1。
精密量取样品储备液20μL,置10mL量瓶,加25%甲醇(含0.05%异抗坏血酸)至刻度,摇匀,即得样品溶液Ⅱ-2.。
样品溶液Ⅱ-1、样品溶液Ⅱ-2用于除S05、S10、S24以外其他51种组分的准确定性和定量。
3色谱-质谱条件
3.1色谱条件
色谱柱:ACE Excel C18柱(150mm×2.0mm,3μm),柱温:40℃;流动相:A相为1mM氟化铵水溶液;B相为乙腈,流速:0.3mL/min。梯度洗脱程序:0~2.0min,10%B;2.0~8.5min,10%B~60%B;8.5~10.0min,60%B~95%B;10.0~12.0min,95%B;12.0~12.1min,95%B~10%B;12.1~15.0min,10%B。进样量:1μL;进样盘温度:4℃。
由于54种染发剂含有多组同分异构体,故建立方法时,采用定位溶液分别进样,确定其异构体的出峰顺序;如完全采用本发明的色谱条件,可参考相对保留而不须配制定位溶液。
3.2质谱条件
喷雾电压:正离子模式1.5kV,负离子模式-2.5kV;雾化温度:350℃;离子传输管温度:325℃;鞘气压力:50Arb;辅助气压力:10Arb;一级质谱全扫描(Full scan),扫描范围(m/z):50~300Da;全扫分辨率:R=60 000;数据依赖二级离子全扫描(Full MS/Intensity/Dynamic Exclusion/Targeted Mass/ddMS2),强度阈值:1.0e5;ddMS2分辨率:R=15 000。数据依赖二级离子全扫描(Full MS/Intensity/Dynamic Exclusion/TargetedMass/ddMS2)的Targeted Mass中,设定了目标母离子的保留时间、母离子(m/z)和极性。
54种染发剂的色谱-质谱信息见表2。
表2 54种染发剂的色谱信息和质谱信息
/>
/>
4样品的定性和定量测定(仪器校准通过后)
(1)注入混合标准定性溶液Ⅰ,确定S05、S10、S24保留时间,三个色谱峰的信噪比均应大于100。注入样品溶液Ⅰ-1确定S05、S10、S24是否检出。结果未检出,跳步骤(3)。
(2)注入系列混合标准曲线溶液Ⅰ,以S05、S10和S24的色谱峰面积对其浓度进行线性回归,绘制线性方程。依次注入样品溶液Ⅰ-2和样品溶液Ⅰ-1,将峰面积带入系列混合标准曲线溶液Ⅰ的线性方程式,以外标法计算S05、S10和S24含量。(因步骤(1)中S05、S10和S24未检出,此步骤(2)未进行)。
(3)注入系列混合标准曲线溶液Ⅱ,以各色谱峰面积对其浓度进行线性回归,绘制线性方程。依次注入样品溶液Ⅱ-2和样品溶液Ⅱ-1,将峰面积带入系列混合标准曲线溶液Ⅱ的线性方程式,以外标法计算含量。结果检出S02、S03、S11、S32和A01,折合配比和以游离基计算,含量分别为0.079%、0.066%、0.333%、0.017%和0.095%。
(4)定性判定:
将样品溶液Ⅰ-1、样品溶液Ⅰ-2与S1-2配制的混合标准定性溶液Ⅰ进行色谱、质谱检测:当样品溶液Ⅰ的色谱保留时间与混合标准定性溶液Ⅰ一致,且当样品溶液Ⅰ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅰ一致,则所述样品中包括S05、S10、S24中的一种或多种;
本实施例样品溶液未检出S05、S10和S24。
将样品溶液Ⅱ-1、样品溶液Ⅱ-2与S1-2配制的混合标准定性溶液Ⅱ进行色谱、质谱检测;当样品溶液Ⅱ的色谱保留时间与混合标准定性溶液Ⅱ一致,且当样品溶液Ⅰ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅰ一致,则所述样品中包括除S05、S10、S24以外的51种成分中的一种或多种。
本实施例样品溶液中S02、S03、S11、S32和A01的与对照品溶液中染发剂的和保留时间和二级质谱中的碎片离子检出碎片均一致,即本实施例样品中包括S02、S03、S11、S32和A01,定性结果与定量结果对应。
(5)结果分析:该样品标签标识与批件成分不符,为问题样品。采用《规范》收载的高效液相色谱法测定对苯二胺等32种染发剂,均未检出,无法判断成分与标签相符还是与批件相符。经本发明建立的LC-HRMS测定,该样品的实际成分与标签均相符,与批件不符。5种染发剂(S02、S03、S11、S32和A01)的含量均以样品溶液Ⅱ-2计算;在样品溶液Ⅱ-1中,除S32外的4种染发剂浓度均超出了线性范围。
实施例2同时测定染发产品中54种染发剂的方法
本实施例以一批标识为“某派染发膏(自然黑色)”染发产品的测定为例,详细介绍54种染发剂的定性和定量方法。
1对照品溶液的配制
同“实施例1”
2样品溶液的配制
同“实施例1”
3色谱-质谱条件
同“实施例1”
4样品的定性和定量测定(仪器校准通过后)
(1)注入混合标准定性溶液Ⅰ,确定S05、S10、S24保留时间,三个色谱峰的信噪比均应大于100。注入样品溶液Ⅰ-1确定S05、S10、S24是否检出。
结果未检出,跳步骤(3)。
(2)注入系列混合标准曲线溶液Ⅰ,以S05、S10和S24的色谱峰面积对其浓度进行线性回归,绘制线性方程。依次注入样品溶液Ⅰ-2和样品溶液Ⅰ-1,将峰面积带入系列混合标准曲线溶液Ⅰ的线性方程式,以外标法计算S05、S10和S24含量。(因步骤(1)中S05、S10和S24未检出,此步骤(2)未进行)
(3)注入系列混合标准曲线溶液Ⅱ,以各色谱峰面积对其浓度进行线性回归,绘制线性方程。依次注入样品溶液Ⅱ-2和样品溶液Ⅱ-1,将峰面积带入系列混合标准曲线溶液Ⅱ的线性方程式,以外标法计算含量。结果检出S01、S04、S14、S25和A02,折合配比和以游离基计算,含量分别为1.31%、0.302%、0.248%、0.066%和0.0011%。
(4)定性判定:
将样品溶液Ⅰ-1、样品溶液Ⅰ-2与S1-2配制的混合标准定性溶液Ⅰ进行色谱、质谱检测:当样品溶液Ⅰ的色谱保留时间与混合标准定性溶液Ⅰ一致,且样品溶液Ⅰ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅰ一致,则所述样品中包括S05、S10、S24中的一种或多种;
本实施例样品溶液未检出S05、S10和S24。
将样品溶液Ⅱ-1、样品溶液Ⅱ-2与S1-2配制的混合标准定性溶液Ⅱ进行色谱、质谱检测;当样品溶液Ⅱ的色谱保留时间与混合标准定性溶液Ⅱ一致,且样品溶液Ⅰ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅰ一致,则所述样品中包括括除S05、S10、S24以外的51种成分中的一种或多种。
本实施例样品溶液中S01、S04、S14、S25和A02的与对照品溶液中染发剂的和保留时间和二级质谱中的碎片离子检出碎片均一致,即本实施例样品中包括S01、S04、S14、S25和A02,定性结果与定量结果对应。
(5)结果分析:
该产品没有标签标识,为问题样品。批件中含S01、S04和S08三种染发剂。经本发明建立的LC-HRMS测定,该样品的实际成分与批件不完全相符,检出批件成分以外的染发剂:S14、S25和A02。检出的5种染发剂中,S01、S04、S14和S25的含量用样品溶液Ⅱ-2计算,A02用样品溶液Ⅱ-1的浓度计算。批件中的S08未检出,以样品溶液Ⅱ-1计算,本方法S08的检出限为4.0μg/g,是《规范》方法的1/8。
实施例3(对比液相)同时测定染发产品中54种染发剂的方法
本实施例以一批标识为“某品牌染发膏4G”染发产品的测定为例,详细介绍54种染发剂的定性和定量方法。
1对照品溶液的配制
同“实施例1”
2样品溶液的配制
同“实施例1”
3色谱-质谱条件
同“实施例1”
4样品的定性和定量测定(仪器校准通过后)
(1)注入混合标准定性溶液Ⅰ,确定S05、S10、S24保留时间,三个色谱峰的信噪比均应大于100。注入样品溶液Ⅰ-1确定S05、S10、S24是否检出。
结果未检出,跳步骤(3)。
(2)注入系列混合标准曲线溶液Ⅰ,以S05、S10和S24的色谱峰面积对其浓度进行线性回归,绘制线性方程。依次注入样品溶液Ⅰ-2和样品溶液Ⅰ-1,将峰面积带入系列混合标准曲线溶液Ⅰ的线性方程式,以外标法计算S05、S10和S24含量。(因步骤(1)中S05、S10和S24未检出,此步骤(2)未进行)
(3)注入系列混合标准曲线溶液Ⅱ,以各色谱峰面积对其浓度进行线性回归,绘制线性方程。依次注入样品溶液Ⅱ-2和样品溶液Ⅱ-1,将峰面积带入系列混合标准曲线溶液Ⅱ的线性方程式,以外标法计算含量。结果检出S03、S18和A14,折合配比计算,含量分别为0.0039%、0.0013%和0.0025%。
(4)定性判定:
将样品溶液Ⅰ-1、样品溶液Ⅰ-2与S1-2配制的混合标准定性溶液Ⅰ进行色谱、质谱检测:当样品溶液Ⅰ的色谱保留时间与混合标准定性溶液Ⅰ一致,且样品溶液Ⅰ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅰ一致,则所述样品中包括S05、S10、S24中的一种或多种;
本实施例样品溶液未检出S05、S10和S24。
将样品溶液Ⅱ-1、样品溶液Ⅱ-2与S1-2配制的混合标准定性溶液Ⅱ进行色谱、质谱检测;当样品溶液Ⅱ的色谱保留时间与混合标准定性溶液Ⅱ一致,且样品溶液Ⅰ的和二级质谱中的碎片离子检出碎片与混合标准定性溶液Ⅰ一致,则所述样品中包括除S05、S10、S24以外的51种成分中的一种或多种。
本实施例样品溶液中S03、S18和A01的与对照品溶液中染发剂的保留时间和二级质谱中的碎片离子检出碎片均一致,即本实施例样品中包括S03、S18和A14,定性结果与定量结果对应。
(5)结果分析:
该产品批件和标签标识一致,应含有S01、S02、S04、S08、S11和S24,但是按照《规范》HPLC法检验,以上6种染发剂均未检出,为合格样品。
经本发明建立的LC-HRMS测定,该样品的实际成分与批件(及标签)成分不符,为问题样品。不仅批件标识的6种染发剂均未检出,还检出批件(及标签)标识成分以外的染发剂:S03、S18和A14。检出的3种染发剂用样品溶液Ⅱ-1的浓度计算。
实施例4色谱条件的优化
本发明考察了54种染发剂以0.1%乙酸溶液、5mmol/L乙酸溶液、5mmol/L乙酸铵溶液、5mmol/L甲酸铵溶液、5mmol/L乙酸铵溶液(氨水调pH 7.5)、5mmol/L乙酸铵溶液(氨水调pH 8.0)、1mmol/L氟化铵溶液和2mmol/L氟化铵溶液作为水相,在ACE Excel 3 C18(2.1mm×150mm,3μm)、WATERS
结果表明在偏酸性的流动相下,m/z 109.07602、m/z 110.06004和m/z 124.07569三组同分异构体在各色谱柱上均不能完全分离,其中Agilent PFP色谱柱分离情况最好。
各甲酸铵、乙酸铵、氟化铵溶液分离情况相似,pH越高,染发剂的保留越强,灵敏度有所提高。但是WATERS Atlantis
在正离子模式下,5mmol/L乙酸铵溶液的峰对称性最好;但是在负离子模式下,各物质的响应尤其是S19(氢醌)和A17(苯酚)在氟化铵溶液的响应显著强于乙酸铵和甲酸铵溶液,灵敏度相差一个数量级以上。2mmol/L氟化铵的峰形优于1mmol/L氟化铵溶液,但灵敏度略差。在甲酸铵、乙酸铵、氟化铵溶液作为水相时,Agilent PFP色谱柱的峰形最差,尤其是S15、S21和S26。负离子模式下的同分异构体S29和S31在ACE Excel 3 C18和WATERS
故最终选择1mmol/L氟化铵溶液作为水相,ACE Excel 3 C18作为固定相。54种染发剂在甲醇中的保留较强,但S15和S26等组分的峰形明显差于乙腈;甲醇和乙腈在ACEExcel 3C18色谱柱上均可分离异构体,本发明优选乙腈作为有机相。优化后的54种染发剂可在15min内完成分离和测定(如图1和图2所示)。
实施例5质谱参数的优化
对各物质的监测模式进行考察,结果如表2所示。A05等12个染发剂在负离子模式下监测,其余42种组分在正离子模式下测定,其中S27在《规范》中为正离子模式测定,本文条件下选择负离子模式测定。对离子源参数喷雾电压、雾化温度和离子传输管温度等参数进行优化。几乎所有染发剂在雾化温度为350℃、离子传输管温度为325℃有最高响应,但是最优喷雾电压存在差异,大多数正离子监测的染发剂的响应随喷雾电压的降低而提高,最终选择1.5kV作为正离子喷雾电压,在负离子模式下S19灵敏度最低,选择其最优电压-2.5kV作为负离子喷雾电压。
表2列出了54种目标物的母离子的理论精确质量数和保留时间,采用正负离子切换全扫描模式,通过一级质谱提取离子流图积分定量,设定质量公差(Mass tolerance)为5.0ppm,可满足专属性和定量需求。优化了目标化合物的碰撞能量,以获得较丰富的碎片信息,如表2所示,设定当在一级质谱扫描时发现列表中的母离子且强度达到设定阀值时,自动进行二级质谱扫描。测定样品时通过保留时间、母离子精密质量和二级碎片离子精密质量对比进行定性确证。
实施例6样品前处理的优化
(1)提取溶剂的选择
染发类化妆品的特点常含有多种染发剂且含量差异较大,54种染发剂在水溶液和有机溶剂中的溶解度存在较大差异。样品前处理优化主要考虑的因素有染发组分在提取溶液中的溶解度、稳定性以及过滤的便捷性和回收率。首先,通过对照品单标储备液的配制优化,选择70%甲醇溶液提取样品,能使各染发剂具有较好的溶解度,并且较易于过滤。
实验方法:考察了50%~100%甲醇、50%~100%乙醇、50%~100%甲醇(含0.05%D-异抗坏血酸)和50%~80%甲醇(含1g/L亚硫酸氢钠)溶液提取样品基质的过滤、储存(-20℃),以及加入54种对照品溶液的稳定性情况,前述浓度范围中以10%为梯度分别设置对比。
结果显示:甲醇和乙醇的提取情况相似,但70%甲醇溶液提取样品,能使各染发剂具有较好的溶解度,并且较易于过滤。50%甲醇和50%乙醇提取的样品溶液在-20℃储存时会结冰;用含1g/L亚硫酸氢钠提取的样品溶液粘度较大,对稳定性较差的成分,没有明显提高稳定性;用含D-异抗坏血酸的溶液提取样品,虽然A14、A15和A16的室温稳定性上升,但S05、S10和S24室温稳定性明显降低。
故本发明选择70%甲醇溶液提取样品,主要考虑提取样品过滤后,立即放-20℃储存,以延长染发剂的稳定时间。
(2)滤膜的选择
以50%甲醇为初始条件,稀释混合对照品溶液,考察了不同品牌、材质的水膜(聚醚砜)和有机滤膜(尼龙膜、偏氟乙烯滤膜、聚四氟乙烯膜)对染发剂的吸附情况。
实验方法:精密量取混标储备液0.4mL,用50%、60%、70%和80%甲醇分别稀释至10mL,摇匀,即得滤膜考察对照品溶液。用不同品牌的滤膜(规格均为25mm,0.45μm),依次过滤滤膜考察对照品溶液约0.5mL(不弃初滤液),置2mL进样瓶中,摇匀,直接进样。
结果显示:水膜容易溶膜,回收率较差,故无法适用。有机膜中,尼龙膜和偏氟乙烯滤膜(PVDF)不同品牌差异较大,个别厂家的尼龙膜和偏氟乙烯滤膜对负离子监测的酚类化合物(如S08、S12、S27、S29、S30和S32)吸附严重,对回收率影响较大;A20、A21和A22极易被滤膜吸附,且滤膜吸附随溶剂中有机相比例的降低而降低;不同品牌偏氟乙烯滤膜的回收率差异较大。聚四氟乙烯膜回收率相对稳定。
(3)稀释溶剂的选择
采用LC-Orbitrap-MS测定染发剂灵敏度很高,由于这些组分在染发产品中含量较高,且浓度差异较大,需要进行适当的稀释。稀释后基质效应显著降低,但组分的稳定性也显著下降,因此需要选择合适的溶剂增强组分的稳定性。
系统考察了不同抗氧剂下各组分的稳定性,包括亚硫酸氢钠、异抗坏血酸、L-抗坏血酸、焦性没食子酸、柠檬酸等。
实验方法:精密量取混标储备液40μL,置进样瓶中,分别加入25%甲醇和25%甲醇(含1g/L亚硫酸氢钠、0.01%~0.1%异抗坏血酸、0.05%L-抗坏血酸、0.05%焦性没食子酸、0.005mol/L柠檬酸)各960μL,摇匀,即得不同溶剂的稳定性考察溶液。置于4℃进样盘中,于0、2、6、12、24、48、72h进样,考察稳定性。
结果发现D-异抗坏血酸与L-抗坏血酸的抗氧效果最好,且效果相似,对大部分染发剂的稳定性提高效果显著,尤其是A14、A15和A16;但是一些染发剂在抗氧剂的存在下稳定性反而降低,如A02、S03、S06在亚硫酸氢钠溶液中稳定性较差,含有邻苯二胺结构的组分(S05、S10和S24)会与D-异抗坏血酸(L-抗坏血酸)发生化学反应从而稳定性显著降低。S21、S25、A07、A08、A09、A11、A13、A21和A22的在各种溶剂中稳定均较好。不同氧化剂除会影响染发剂的稳定性外,对于保留较弱的组分还会产生基质效应,如亚硫酸氢钠溶液会产生基质抑制效应,而抗坏血酸类会产生较强烈的基质增强效应,其效应的强度与抗氧剂的浓度存在一定正相关关系。此外,D-异抗坏血酸、L-抗坏血酸或焦性没食子酸的存在会显著改善A02、S03、S14、S15、S22和S26等物质,尤其是S30的峰形。
进样溶液中,高比例的有机溶剂会引起溶剂效应,导致色谱峰前沿。因此,最终选择25%甲醇和25%甲醇(含0.05%D-异抗坏血酸)溶液稀释样品储备液,同时用相应溶剂配制标准曲线等对照品溶液。54种染发剂中,S05、S10和S24采用25%甲醇溶液稀释的对照品和样品溶液定性和定量;其他51种组分采用含D-异抗坏血酸的对照品和样品溶液定性和定量,以确保定性定量准确性。
实施例7方法学考察
1对照品溶液的配制
同“实施例1”
2样品溶液的配制
同“实施例1”
3色谱-质谱条件
同“实施例1”
4方法学考察
4.1线性范围、检出限和定量限
按照“实施例1,1.3系列混合标准曲线的制备”所述方法配制2条标准曲线,54种染发剂标准品的浓度均为8.00、20.0、40.0、80.0、200、400、800、2000ng/mL,按照“3”色谱-质谱条件进行测定。以浓度(x,ng/mL)为横坐标,以提取离子流图(提取离子m/z见表2,,Masstolerance:5.0ppm)的峰面积(y)为纵坐标进行线性回归。以色谱峰信噪比(S/N)≥3和10时目标物的含量为方法的检出限和定量限,以样品溶液Ⅰ-1和样品溶液Ⅱ-1的稀释倍数(0.2g样品稀释至500mL)计算检出浓度(LOD,ng/g)和定量浓度(LOQ,ng/g)。
结果表明,54种染发剂在表3所示范围内线性关系良好,相关系数(r)均大于0.995,该方法具有较高的灵敏度,可以满足实际测定的要求,线性范围、LOD和LOQ等相关数据见表3。
表3 54种染发剂的线性范围、线性方程、相关系数、检出限和定量限
/>
/>
/>
y:峰面积;x:质量浓度(ng/mL)
*:计算基于样品溶液Ⅰ的稀释倍数.LOD/LOQ(μg/g)=LOD/LOQ(ng/mL)×500/0.2(g)
4.2回收率、重复性和进样精密度
筛选出一批54种染发剂含量均较低样品(按照“实施例1,2”制备样品溶液Ⅰ-1和样品溶液Ⅱ-1,含有少量S03、S17和A14,浓度均小于50ng/mL)作为加标回收率基质,进行方法学验证。
称取混匀的11份基质样品,分别添加表4所示的低、中、高3个浓度水平的混合标准溶液,按“实施例1,2样品溶液Ⅰ-1和样品溶液Ⅱ-1”进行前处理,每个水平3份,计算加标回收率和重复性;每个水平其中一份重复测定6次,计算相对标准偏差(RSD),获得进样精密度,结果见表4。54个染发剂的平均回收率为60.0%~118.4%,重复性4.0%~14.9%,RSD为0.6%~10.0%。
表4 54种染发剂的样品本底浓度、加入浓度、回收率、重复性(n=9)和进样相对标准偏差(RSD,n=6)
/>
/>
*回收率=(测得浓度-本底浓度)/加标浓度×100%.
4.3稳定性考察
取实施例1,1.1配制的“混标储备液”,用25%甲醇和25%甲醇(含0.05%D-异抗坏血酸)分别稀释成400ng/mL的混合标准定性溶液Ⅰ、混合标准定性溶液Ⅱ,放置于4℃进样器中,于0、6、12、24和48h进行测定,以0h峰面积的85%判定稳定性。
结果表明,在25%甲醇(含0.05%D-异抗坏血酸)中,A03稳定时间达12h,A14稳定时间达24h,其余49种染发剂(除S05、S10和S24)稳定时间达48h;在25%的甲醇中,S05、S10和S24稳定时间达48h。
实施例8 20批测定结果
1对照品溶液的配制
同“实施例1”
2样品溶液的配制
同“实施例1”
3色谱-质谱条件
同“实施例1”
4实际样品的检测
操作同“实施例1”,定性结果统计如表5所示。
采用本发明建立的方法对市售135批染发产品进行测定,共检出27种染发剂(表5),其中9种为《规范》“7.2对苯二胺等32种组分”外的染发剂。共131批检出有以S编号的染发剂,占总批数的97.0%;有40批检出以A编号的染发剂,占总批数的29.6%,其中2批仅含有以A编号的染发剂。有23批检出了标签或批件以外的染发剂,为问题样品:其中10批检出了标签或批件以外的以A编号的染发剂;15批检出了标签或批件以外的以S编号的染发剂。以A编号的染发剂中,A01、A04、A10和A11检出率最高,也是问题样品中常检出的标签或批件以外的染发剂,需要特别关注。另外,A02的保留时间应为1.52min,在一些样品的色谱图中,在1.65~1.70min附近有干扰色谱峰,但是其二级质谱图不同,故判定为未检出A02;说明当保留时间接近时,二级质谱协助判定的重要性。
表5 135批染发产品中目标染发剂成分的检出率
/>
