尿液中DNA的提取方法、试剂盒及基因标志物在制备诊断膀胱癌的试剂盒中的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物样品中DNA提取领域,具体而言,涉及一种尿液中DNA的提取方法、试剂盒及基因标志物在制备诊断膀胱癌的试剂盒中的应用。
背景技术
尿液可以作为癌症早期发现、复发监测效果的非侵入性方法,对于泌尿系肿瘤,尿液在很多情况下是首选的“液体活检”来源。尿液及膀胱在过去被认为是无菌的,但通过细胞培养或16S rDNA测序发现,尿液中有细菌存在,微生物群在泌尿生殖系统肿瘤中的作用是一个新兴的研究领域,值得进一步的研究。然而尿液中微生物的含量较少以及PCR抑制剂的存在会阻碍DNA的有效PCR扩增,用普通的微生物提取试剂盒很难提取足够的细菌DNA用于后续实验。另外基于多组学的研究,需要基于同一份尿液样本同时提取宿主基因组DNA和微生物DNA。
目前膀胱癌的诊断和监测方法主要是膀胱镜检查和尿脱落细胞学检查。膀胱镜检查具有侵入性;脱落细胞学检查取材繁琐,不易获得满意的标本,临床应用少。若有方便准确的生物标记方法,能够最大程度的推动膀胱癌诊断和复发进展的监测过程。
发明内容
本发明的主要目的在于提供一种尿液中DNA的提取方法、试剂盒及基因标志物在制备诊断膀胱癌的试剂盒中的应用,以解决现有技术中难以从尿液中提取大量DNA的问题。
为了实现上述目的,根据本发明的第一个方面,提供了一种尿液中DNA的提取方法,该提取方法包括:a)将尿液离心后获得尿沉渣,b)利用TE缓冲液洗涤尿沉渣,c)提取尿沉渣中DNA。
进一步地,c)包括:在利用TE缓冲液洗涤尿沉渣后,向尿沉渣中加入溶菌酶,孵育,以破坏细菌细胞壁;或向尿沉渣中加入玻璃砂,震荡,以破坏细菌细胞壁;优选地,TE缓冲液与尿液的体积比为1:10~30,更优选为1:20;优选地,对洗涤后的尿沉渣进行重悬,得到重悬液,将溶菌酶与重悬液按体积比1~2:3的比例混合,优选为体积比7:11,混合后置于35~37℃下处理30min~120min,优选45~60min。
进一步地,破坏细菌细胞壁后,使用DNA提取试剂盒,提取尿液中DNA;优选地,DNA提取试剂盒包括吸附柱、蛋白酶K、GB缓冲液、乙醇、GD缓冲液、PW漂洗液;优选地,尿液中DNA包括尿液微生物DNA和宿主DNA。
进一步地,提取方法还包括:设置空白对照的步骤;优选地,按如下方法设置空白对照:向空白对照管中加入含有核酸助沉剂或糖原的无菌水;更优选地,无菌水中核酸助沉剂或糖原的体积含量为0.5~1.5%。
为了实现上述目的,根据本发明的第二个方面,提供了一种检测试剂盒,检测试剂盒包括检测尿沉渣中DNA含量的试剂。
进一步地,检测尿沉渣中DNA含量的试剂为检测尿沉渣中微生物DNA含量的试剂;优选地,检测尿沉渣中微生物DNA含量的试剂为检测尿沉渣中微生物DNA含量的特异性序列拷贝数的试剂;更优选地,特异性序列选自SEQ ID NO:1。
进一步地,检测拷贝数的检测试剂包括构建测序文库的相关试剂或PCR扩增检测相关试剂;优选地,构建测序文库的相关试剂包括构建二代测序文库的相关试剂,更优选为构建宏基因组测序文库的相关试剂;优选地,PCR扩增检测相关试剂包括实时荧光定量PCR的相关试剂;优选地,试剂包括SEQ ID NO:2和/或SEQ ID NO:3所示的核苷酸序列。
为了实现上述目的,根据本发明的第三个方面,提供了一种检测尿液DNA的方法,该方法包括:利用上述提取方法提取尿液DNA,对尿液DNA中的靶标基因进行检测;优选地,采用上述检测试剂盒进行检测;更优选地,采用SEQ ID NO:2和SEQ ID NO:3所示的核苷酸序列对SEQ ID NO:1的靶标基因进行实时荧光定量PCR检测。
为了实现上述目的,根据本发明的第四个方面,提供了一种基因标志物在制备诊断膀胱癌的试剂盒中的应用,其中,基因标志物为具有SEQ ID NO:1所示的核苷酸序列的基因。
进一步地,应用包括对尿液DNA中的基因标志物进行定性和/或定量检测;利用上述提取方法提取尿液DNA;优选地,采用构建测序文库或实时荧光定量PCR的方法,对基因标志物进行定性和/或定量检测;更优选地,采用SEQ ID NO:2和SEQ ID NO:3所示的核苷酸序列,对基因标志物进行定性和/或定量检测。
应用本发明的技术方案,将尿液离心后获得尿沉渣,利用TE缓冲液洗涤尿沉渣,从而大量提取其中的DNA,提高了DNA的提取效率,减少后续PCR扩增抑制。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1示出了根据本发明的实施例2的病人和正常人两组数据的分散情况示意图;
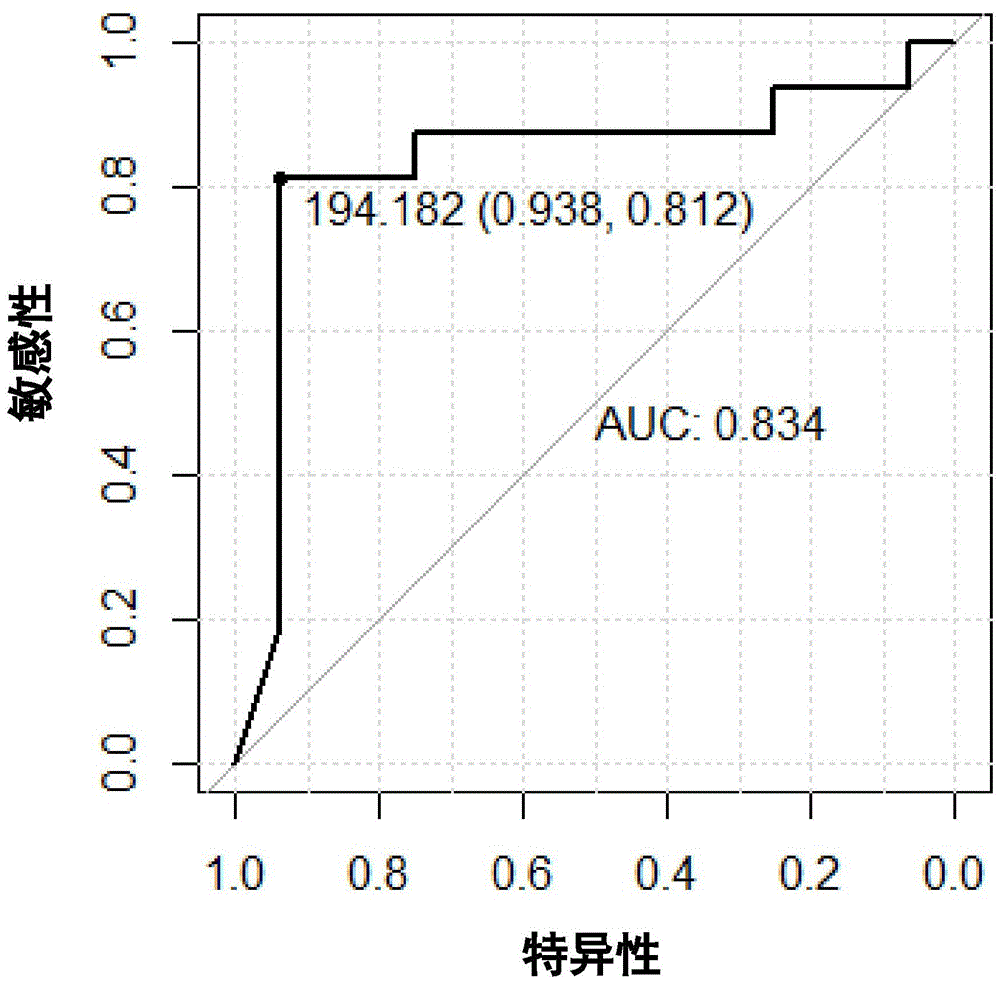
图2示出了根据本发明的实施例2的ROC曲线示意图。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
如背景技术所提到的,尿液中微生物的含量较少以及PCR抑制剂的存在会阻碍DNA的有效PCR扩增,用普通的微生物提取试剂盒很难提取足够的细菌DNA用于后续实验。另外基于多组学的研究,需要基于同一份尿液样本同时提取宿主基因组DNA和微生物DNA。而利用现有技术对于尿液样本中的DNA进行提取,提取的DNA中多为宿主基因组DNA,而微生物DNA较少,难以满足多组学研究的需求。
因而,在本申请中发明人尝试利用TE缓冲液洗涤尿沉渣后提取其中的DNA,经试验验证发现该方法能够大量提取尿液中的DNA,提出了本申请的一系列保护方案。
在本申请第一种典型的实施方式中,提供了一种尿液中DNA的提取方法,该提取方法包括:a)将尿液离心后获得尿沉渣,b)利用TE缓冲液洗涤尿沉渣,c)提取尿沉渣中DNA。
尿沉渣是尿液中的有形状成分,是尿液经过离心后形成的沉渣,包括细胞、细菌、结晶等有形成分。通过离心尿液获得尿沉渣后,在提取尿沉渣中DNA前,先利用TE缓冲液对尿沉渣进行洗涤,能够去除尿沉渣中的结晶等杂质。在本申请中,发明人发现尿中结晶多为盐结晶,结晶越多越干扰DNA的提取,导致提取的量越少。减少杂质成分对DNA提取和后续检测的影响,提高DNA提取效率。
在一种优选的实施例中,c)包括:在利用TE缓冲液洗涤尿沉渣后,向尿沉渣中加入溶菌酶,孵育,以破坏细菌细胞壁;或向尿沉渣中加入玻璃砂,震荡,以破坏细菌细胞壁;优选地,TE缓冲液与尿液的体积比为1:10~30,更优选为1:20;优选地,对洗涤后的尿沉渣进行重悬,得到重悬液,将溶菌酶与重悬液按体积比1~2:3的比例混合,优选为体积比7:11,混合后置于35~37℃下处理30min~120min,优选45~60min。
利用TE缓冲液洗涤尿沉渣,TE缓冲液与尿沉渣来源的尿液的体积比可以为1~2:3。若TE缓冲液过多,会影响尿沉渣中待提取DNA的回收,降低提取效率;若TE缓冲液过少,难以将尿沉渣中的杂质去除干净,达不到洗涤的目的和效果。向TE缓冲液洗涤后的尿沉渣中加入溶菌酶或玻璃砂或其他常用方法,能够通过化学或物理的方法破坏细菌的细胞壁,使细菌的DNA暴露出来,能够增加对于尿沉渣中DNA的提取量。将溶菌酶与重悬的尿沉渣在35~37℃下孵育,在此温度下,样品中的DNA能够保持稳定,溶菌酶也能发挥活性,破坏细菌细胞壁。
在一种优选的实施例中,破坏细菌细胞壁后,使用DNA提取试剂盒,提取尿液中DNA;优选地,DNA提取试剂盒包括但不限于吸附柱、蛋白酶K、GB缓冲液、乙醇、GD缓冲液、PW漂洗液;优选地,尿液中DNA包括尿液微生物DNA和宿主DNA。
在利用溶菌酶、玻璃砂或其他方法破坏细菌细胞壁后,使用市售的DNA提取试剂盒,或自行配置、与DNA提取试剂盒功能相同的试剂和材料,或其他能够完成DNA提取的试剂和材料(如利用磁珠提取DNA),对尿液中的DNA进行提取。尿液中DNA包括尿液微生物的DNA和尿液样品来源的宿主的DNA。上述DNA提取试剂盒包括但不限于吸附柱、蛋白酶K、GB缓冲液、乙醇、GD缓冲液、PW漂洗液。蛋白酶K能够分解细菌和细胞中的蛋白质,防止由于细胞结构破碎后,细胞中的DNA酶释放出来,降解待提取的DNA,降低DNA提取量和完整性。吸附柱能够使DNA吸附在其上,便于对其他杂质进行洗脱。GB缓冲液能够使核酸和蛋白质分离,乙醇能够沉淀蛋白质,GD缓冲液能够去除残留的蛋白质杂质,PW漂洗液能够去除样品中残留的盐分。
在一种优选的实施例中,提取方法还包括:设置空白对照的步骤;优选地,按如下方法设置空白对照:向空白对照管中加入含有核酸助沉剂(载体RNA,Carrier RNA)或糖原的无菌水;更优选地,无菌水中Carrier RNA或糖原的体积含量为0.5~1.5%。
因尿液中的微生物较少,提取过程引入微量的污染对后续qPCR、16s扩增建库、分析或其他操作影响较大,因而需要设置空白对照。若空白对照只加水,污染的痕量微生物在提取过程中可能由于管壁的静电作用而无法吸附到纯化柱上,则此处的空白对照没有起到检验提取过程中的微量污染的效果。在空白对照水中加入核酸助沉剂(Carrier RNA)或糖原,能够帮助痕量DNA去除静电效应,从而很好被吸附到纯化柱上,提高洗脱效率。
在本申请第二种典型的实施方式中,提供了一种检测试剂盒,检测试剂盒包括检测尿沉渣中DNA含量的试剂。
进一步地,检测尿沉渣中DNA含量的试剂为检测尿沉渣中微生物DNA含量的试剂;优选地,检测尿沉渣中微生物DNA含量的试剂为检测尿沉渣中微生物DNA含量的特异性序列拷贝数的试剂;更优选地,特异性序列选自SEQ ID NO:1。
该检测试剂盒包括能够检测尿沉渣中DNA含量、乃至微生物DNA含量的试剂。通过检测特异性序列如SEQ ID NO:1的拷贝数,能够检测微生物DNA含量。
SEQ ID NO:1:tacgtaggtcccgagcgttgtccggatttattgggcgtaaagcgagcgcaggcggttagataagtctgaagttaaaggctgtggcttaaccatagtacgctttggaaactgtttaacttgagtgcaagaggggagagtggaattccatgtgtagcggtgaaatgcgtagatatatggaggaacaccggtggcgaaagcggctctctggcttgtaactgacgctgaggctcgaaagcgtggggagcaaacaggattagaaaccccagtagtccaagtcggaggccaagcgtaggaagacaagactcactgacaactccttg。
进一步地,检测拷贝数的检测试剂包括构建测序文库的相关试剂或PCR扩增检测相关试剂;优选地,构建测序文库的相关试剂包括构建二代测序文库的相关试剂,更优选为构建宏基因组测序文库的相关试剂;优选地,PCR扩增检测相关试剂包括实时荧光定量PCR的相关试剂;优选地,试剂包括SEQ ID NO:2(SEQ ID NO:2:gctctctggcttgtaactgac)和/或SEQ ID NO:3(SEQ ID NO:3:agtcttgtcttcctacgcttg)所示的核苷酸序列。
上述检测试剂能够检测上述靶标基因的相对丰富。靶标基因的相对丰度可以通过构建测序文库、PCR扩增或其他现有技术进行检测,因此检测相对丰度的检测试剂包括但不限于构建测序文库的相关试剂,或PCR扩增检测相关试剂。测序方法包括但不限于二代测序,或进一步的宏基因组测序。因此,测序文库包括但不限于构建二代测序文库的相关试剂,更优选为构建宏基因组测序文库的相关试剂。对于利用PCR扩增检测靶标基因的相对丰度的方法,此方法包括但不限于实时荧光定量PCR,因此PCR扩增检测相关试剂包括但不限于实时荧光定量PCR的相关试剂。在检测试剂中也可以包括PCR或测序所用的引物,引物可以根据检测方法的需求、靶标基因的实际序列等因素进行灵活调整。
在本申请第三种典型的实施方式中,提供了一种检测尿液DNA的方法,方法包括:利用上述提取方法提取尿液DNA,对尿液DNA中的靶标基因进行检测;优选地,采用上述检测试剂盒进行检测;更优选地,采用SEQ ID NO:2和SEQ ID NO:3所示的核苷酸序列对SEQ IDNO:1的靶标基因进行实时荧光定量PCR检测。
利用上述提取方法提取尿液DNA后,对尿液DNA中的靶标基因进行检测,从而检测尿液DNA。本方法能够基于同一份尿液样本,同时提取宿主基因组DNA和尿液微生物DNA,DNA提取效率高,便于多组学等研究的进行。利用上述检测试剂盒对尿液DNA中的靶标基因进行检测,结果可靠。在本申请中,采用SEQ ID NO:2和SEQ ID NO:3所示的核苷酸序列对SEQ IDNO:1的靶标基因进行实时荧光定量PCR检测,能够准确检测样品尿液DNA中靶标基因的含量。
在本申请第四种典型的实施方式中,提供了一种基因标志物在制备诊断膀胱癌的试剂盒中的应用,其中,基因标志物为具有SEQ ID NO:1所示的核苷酸序列的基因。
具有SEQ ID NO:1所示的核苷酸序列的基因标志物,与膀胱癌有很强的相关性。因此该基因标志物能够应用于诊断膀胱癌的试剂盒中。
在一种优选的实施例中,应用包括对尿液DNA中的基因标志物进行定性和/或定量检测;利用上述提取方法提取尿液DNA;优选地,采用构建测序文库或实时荧光定量PCR的方法,对基因标志物进行定性和/或定量检测;更优选地,采用SEQ ID NO:2和SEQ ID NO:3所示的核苷酸序列,对基因标志物进行定性和/或定量检测。
下面将结合具体的实施例来进一步详细解释本申请的有益效果。
实施例1.尿液DNA提取:
使用血液/细胞/组织基因组DNA提取试剂盒(天根,货号:DP304)进行尿液DNA提取。实验步骤:
使用前先在缓冲液GD和漂洗液PW中加入无水乙醇,加入体积参照瓶上的标签。
缓冲液A配制:20mM Tris,pH 8.0;2mM Na2-EDTA;1.2%Triton;
1.空白管对照:取1.5mL离心管,加入100μL的无菌水和1μL Carrier RNA,后续步骤同临床正式样本提取方法。
2.将50mL的离心管中尿沉渣转管至1.5mL离心管中(尽量吸干净,避免浪费),向1.5mL离心管中加入500μL TE buffer洗涤尿沉渣,混匀震荡,16000rpm离心1min,弃上清。
3.向上述管中加入110μL的缓冲液A,和70μL溶菌酶溶液,然后进行37℃处理45min~60min。
4.加入20μL Proteinase K溶液,涡旋混匀。在56℃孵育直到样本充分降解消化,需要时间大约30min到1h,期间每15分钟需要涡旋混匀。
5.加入200μL的缓冲液GB,充分颠倒混匀,70℃孵育10min,期间每3min涡旋混匀10sec,溶液应变清亮。简短离心以去除管盖内壁的液滴。
6.加入200μL的乙醇(96-100%)。轻轻颠倒混样品,室温放置5min,简短离心以去除管盖内壁的液滴。
7.将上一步所得溶液添加到一个吸附柱CB3中(吸附柱放入收集管中),12,000rpm(~13,400×g)离心30sec,弃废液,将吸附柱CB3放回收集管中。
8.向吸附柱CB3中加入500μL缓冲液GD,12,000rpm(~13,400×g)离心30sec,弃废液,将吸附柱CB3放回收集管中。
9.向吸附柱CB3中加入600μL漂洗液PW,12,000rpm(~13,400×g)离心30sec,弃废液,将吸附柱CB3放回收集管中。
10.重复操作步骤7。
11.12,000rpm(~13,400×g)离心2min,倒掉废液。将吸附柱CB3置于室温放置2-5min,以彻底晾干吸附材料中残余的漂洗液。
12.将吸附柱CB3转入一个干净的离心管中,向吸附膜中间位置悬空滴加30μL洗脱缓冲液TB,室温放置2-5min,12,000rpm(~13,400×g)离心2min,将溶液收集到离心管中。DNA产物保存在-20℃,以防DNA降解。
13.样品检测:通过超微量分光光度计(Qubit Fluorometer)检测浓度,检测结果如表1所示。稀释到10ng/μL用于后续qPCR检测。
表1
实施例2:实时荧光定量PCR(qPCR)检测
所使用的试剂为:Takara公司的SYBR Premix Ex Taq(TM)II(Perfect RealTime),货号:DRR081A。
对16例膀胱癌病人尿液DNA和16例正常人尿液DNA进行qPCR检测。本方法使用的是标准曲线法,本发明采用的标准品含有Streptococcus特异基因序列(SEQ ID NO:1),阳性标准品即为将上述SEQ ID NO:1序列克隆到载体上的质粒;该部分标准品为商业公司合成(南京金斯瑞公司,标准载体pUC57)。商业公司寄过来的质粒标准品为干粉,将干粉离心后稀释,测定其浓度后换算为对应的拷贝数,然后进行梯度稀释,稀释6个梯度作为标准曲线(标准曲线的横坐标为拷贝数,纵坐标为CT值)。实验具体操作步骤如下:
1.配制反应液:将引物、DNA模板、荧光定量PCR参比染料(ROX Reference Dye)、2×qPCR缓冲液(SYBR Premix Ex Taq II)配制成10μL反应液,加入到96孔反应板上,具体如下:
/>
2.qPCR扩增:将96孔板放在qPCR仪上,进行扩增检测;
3.分析数据:使用qPCR软件导出结果,根据qPCR的定量结果使用R语言对数据进行分析作图,按照病人、正常人绘制箱形图和接收者操作特征曲线(ROC曲线),参见图1、图2。
在图1中,每个箱的最下面一条线代表下四分位数;中间那条线代表中位数;最上面那条线代表上四分位数;两个人群的中位数差距越大,代表两个人群区分的越开,该肿瘤标志物的检测效率越高。图1中每个点代表qPCR检测结果经过生物信息学手段进一步计算对应的值。
在图2中,中间那条对角线代表曲线下面积(AUC)=0.5的情况,图2中得到的AUC为0.834,说明该靶标基因检测效果较好。图2中ROC曲线上最左上的点即为灵敏度和特异性最佳的点,分别为81.2%和93.8%,对应的qPCR的临界值(cut off值)为194.182。qPCR得到的拷贝数(quantity值)小于等于该值即可判断为膀胱癌病人,大于该值可判断为正常,此处qPCR所得的quantity值,即为标准曲线得出的绝对值。
qPCR具体数据见下表2:
表2 16例正常人和16例病人的qPCR检测结果
注:表中“-”代表检测结果高于cut off值,判断结果为正常;“+”代表检测结果低于cut off值,判断结果为膀胱癌肿瘤患者。
对比例1:
未用TE洗涤尿沉渣所提取的尿液DNA,为同批样本(上述16个健康人和癌症患者同体积的尿液提取),其他操作同实施例1。检测结果如表3所示。
表3
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本发明将尿液离心后获得尿沉渣,利用TE缓冲液洗涤尿沉渣,从而大量提取其中的DNA。并发现与膀胱癌相关的基因标志物和相应的检测方法。上述基因标志物和尿液中DNA的提取方法或提取试剂盒能够应用于制备诊断膀胱癌的试剂盒。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
