用于预测肿瘤免疫治疗效果的生物标志物及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物技术领域,具体而言,本发明涉及一种可用于预测肿瘤免疫治疗效果的生物标志物以及相应的所述生物标志物在预测肿瘤免疫治疗效果中的应用。
背景技术
肿瘤免疫治疗是肿瘤治疗领域中最具前景的研究方向之一,其中采用免疫检查点抑制剂(immune checkpoint inhibitor,ICI)的疗法取得了历史性的进展,在一部分患者中达到了抑制肿瘤生长和清除肿瘤的显著作用。这种疗法基于阻断抗程序性死亡生长因子-1(programmed death-1,PD-1)/程序性死亡配体-1(programmed death ligand-1,PD-L1)免疫检查点通路的原理,通过将抗PD-1或PD-L1的特异性抗体注射入肿瘤患者体内,使得肿瘤不再具备逃避免疫系统攻击的能力,从而促进机体清除肿瘤细胞。近年来,涉及PD-1/PD-L1通路的ICI是抗肿瘤治疗的研究热点。从全球范围看,至少已有黑色素瘤、霍奇金淋巴瘤、肺癌、头颈部鳞癌、肝癌、食管癌、乳腺癌、胃癌、鼻咽癌、淋巴瘤等多种适应症获批。
虽然免疫检查点抑制剂(例如抗PD-1/PD-L1抗体)在肿瘤治疗中取得了令人瞩目的成就,但是有数据表明,大多数接受ICI的患者并没有从中获益。例如,相当比例的肿瘤患者对抗PD-1/PD-L1抗体无反应。数据表明,即使是PD-L1高表达(PD-L1的表达量为50%或更高)患者,其对ICI药物的应答率也仅在30%至40%之间。而另一方面,免疫检查点抑制剂是一种非常昂贵的药物,对患者来说是一种较大经济负担;同时,免疫检查点抑制剂类药物也可能导致严重的不良反应,特别是系统性自身免疫疾病的发展。因此,如果能够从普通肿瘤患者中预先识别出对免疫检查点抑制剂有响应的患者,即,在治疗之前精准发现ICI获益患者,将有助于提高治疗效率、降低治疗成本,并且降低治疗风险。
人体在肿瘤免疫监视过程中产生的自身抗体已经被应用于肿瘤的早期诊断,而且被认为是预测肿瘤治疗疗效的一个极具潜力的生物标志物。例如,有研究提出抗p53自身抗体、抗PGP9.5自身抗体水平等可以作为预测肺癌复发的工具。但是,就针对肿瘤相关抗原的自身抗体表达和ICI响应之间的关系而言,相关生物标志物的报道仍然是非常有限的。
本领域仍然需要提供新的可用于预测ICI疗法治疗效果的自身抗体生物标志物,以及开发针对该自身抗体生物标志物的检测用抗原,以提供针对肿瘤免疫治疗效果的新的预测手段。
发明内容
为了解决上述技术问题,本发明通过检测肺癌患者血液中针对不同抗原靶点的自身抗体,最终鉴定了一组可用于预测或判断肿瘤、特别是肺癌的免疫检查点抑制剂(ICI)治疗效果的自身抗体生物标志物。
因此,本发明的一个目的是提供用于预测或判断肿瘤免疫治疗效果的自身抗体生物标志物组合。
基于自身抗体生物标志物的鉴别,本发明的另一个目的是提供用于检测该自身抗体生物标志物的试剂,例如抗原蛋白组合,该抗原蛋白组合可用于检测肿瘤患者样本(例如血液)中该自身抗体生物标志物;以及提供包含该检测试剂的试剂盒,其可用于相应的检测。
本发明的再一个目的是提供该自身抗体生物标志物组合或抗原蛋白组合在制备用于预测或判断肿瘤免疫治疗效果的产品中的用途。
本发明的还一个目的是提供一种预测或判断患者的肿瘤免疫治疗效果的方法。
本发明的技术方案如下。
一方面,本发明提供一种用于预测或判断受试者的肿瘤免疫治疗效果的生物标志物,所述生物标志物为自身抗体(TAAb)组合,所述自身抗体组合包括抗以下肿瘤相关抗原(TAA)的自身抗体:Trim21、BRCA2、P53、IMP2、MAGE-A4、TXNDC2。换言之,所述生物标志物为自身抗体组合,所述自身抗体组合包括抗Trim21自身抗体、抗BRCA2自身抗体、抗P53自身抗体、抗IMP2自身抗体、抗MAGE-A4自身抗体和抗TXNDC2自身抗体。
根据本发明,将所述每种自身抗体在受试者样本中的浓度进行逐一评分并计算得到所述生物标志物即自身抗体组合的评分,根据该自身抗体组合的评分结果,可以预测或判断:(i)受试者易于从肿瘤免疫治疗中获益(或获得好的肿瘤免疫治疗效果),(ii)受试者不易于从肿瘤免疫治疗中获益(或获得差的肿瘤免疫治疗效果),或(iii)受试者的肿瘤免疫治疗效果更差,即弊大于利。
在本发明的上下文中,所述自身抗体为受试者接受肿瘤免疫治疗之前的样本例如血清、血浆、组织间隙液、脑脊液或尿液中的自身抗体;优选地,所述自身抗体为IgA(例如IgA1、IgA2)、IgM或IgG(例如IgG1、IgG2、IgG3、IgG4)。
在本发明的上下文中,所述受试者为哺乳动物,优选为灵长类哺乳动物,更优选为人。并且,优选地,所述肿瘤为肾癌、肝癌、卵巢癌、宫颈癌、头颈部鳞状细胞癌、鼻咽癌、尿路上皮癌、喉癌、胃癌、黑色素瘤、前列腺癌、霍奇金氏淋巴瘤、膀胱癌、结直肠癌、肺癌,特别是肺癌,例如小细胞肺癌、非小细胞肺癌、肺鳞癌、肺腺癌和其他亚型肺癌。
在本发明的上下文中,所述肿瘤免疫治疗包括采用免疫检查点抑制剂治疗;优选地,所述肿瘤免疫治疗为单独施用免疫检查点抑制剂治疗或免疫检查点抑制剂与化疗、放疗、抗血管治疗、靶向治疗或其他肿瘤治疗手段的联合治疗,其中所述免疫检查点抑制剂为针对PD-1、PD-L1、CTLA-4、BTLA、TIM-3、LAG-3、TIGIT、LAIR1、2B4和/或CD160的免疫检查点抑制剂,优选为抗PD-1抗体或抗PD-L1抗体。根据本发明的具体实施方式,所述抗体为纳武单抗、帕姆单抗、信迪利单抗、特瑞普利单抗或其他免疫检查点抑制剂,特别是抗PD-1抗体或抗PD-L1抗体。
在本发明的上下文中,“肿瘤相关抗原”在UniProt数据库的登记号如下:
Trim21:P19474;
BRCA2:P51587;
P53:P04637;
IMP2:O14732;
MAGE-A4:P43358;
TXNDC2:Q86VQ3。
根据本发明,该生物标志物即自身抗体组合可以在受试者、例如肿瘤患者的样本(例如血浆或血清)中进行检测,例如检测其浓度,以预测或判断该受试者进行肿瘤免疫治疗的疗效。
根据本发明的具体实施方式,本发明提供的生物标志物即自身抗体组合以及基于该生物标志物的以下各个技术方案可以基于以下方式来实现肿瘤免疫治疗效果的预测与判断:
(1)设立每一种自身抗体的检测值的低参考阈值和高参考阈值。其中,可将低参考阈值设立为健康对照人群样本(例如血清或血浆)中自身抗体测量值的中位数加上2倍的SD值;高参考阈值设立为治疗后实现PR或SD(见下文)的患病人群治疗前样本(例如血清或血浆)中自身抗体测量值的中位数加上2倍的SD值。
根据本发明的具体实施方式,本发明采用的低参考阈值和高参考阈值分别如下:IMP2(10,96)、P53(9,58)、MAGE-A4(9,40)、Trim21(12,72)、CM406(7,35)、BRCA2(9,38),表示为肿瘤自身抗原名称(低参考阈值,高参考阈值)。
(2)对每种自身抗体来说,当检测值小于或等于低参考阈值时,打0分;当TXNDC2、Trim21、BRCA2、IMP2的检测值大于低参考阈值且小于高参考阈值时,打1分;当MAGE-A4、P53的检测值大于低参考阈值且小于高参考阈值时,打0.1分;对每种自身抗体来说,当检测值大于或等于高参考阈值时,打2分。
就得到的评分结果,定义“异常情况”:1)TXNDC2、Trim21、BRCA2、IMP2中的TXNDC2或者IMP2为2分,其余为0分;2)TXNDC2、Trim21、BRCA2、IMP2中任何两种是2分,其余为0分;3)BRCA2和TXNDC2同时为1分,其余为0分;4)MAGE-A4为0.1分,其余为0分;5)P53为0.1分,Trim21和BRCA2中的一个为2分,其余为0分;6)MAGE-A4和P53中的一个或两个为0.1分,同时TXNDC2和Trim21中的一个为1分,其余为0分。当自身抗体组合属于“异常情况”时,打分规则发生变化如下:每一种抗体的打分需要分别乘以-1。
(3)根据每一种自身抗体的评分,计算自身抗体组合的分数,计算规则如下:自身抗体组合的分数为每一种自身抗体评分之和。
本发明已证明,当受试者的样本中这些自身抗体生物标志物组合评分≥1时(定义为“”、“阳性6-TAAb”或“阳性”),其易于从免疫治疗例如ICI治疗中获益或获得好的治疗效果;当此评分≥0并且<1时(定义为“”、“阴性6-TAAb”或“阴性”),其不易于从免疫治疗例如ICI治疗中获益或获得差的治疗效果;当此评分≤-0.1时(定义为“”、“异常6-TAAb”或“异常”),其免疫治疗例如ICI治疗效果更差,即弊大于利。
因此,本发明提供的自身抗体生物标志物可用于预测或判断受试者、例如肿瘤患者能否从免疫治疗中获益,至少可用于相应的辅助判断。可以通过参照标准曲线对样本中自身抗体的浓度进行定量,进而参照参考阈值进行自身抗体生物标志物的浓度水平的判断。
本发明提供的每种自身抗体可以通过多种方法进行检测,例如可以通过导致该自身抗体出现的肿瘤相关抗原与其之间的抗原-抗体特异性反应进行检测。因此相应地,本发明还提供一种用于检测该自身抗体生物标志物的试剂。
取决于具体技术手段,所述试剂可以是用于酶联免疫吸附法(ELISA)、蛋白/肽段芯片检测、免疫印迹、微珠免疫检测、微流控免疫检测等检测方法的试剂。优选地,所述试剂用于通过抗原抗体反应对本发明的自身抗体生物标志物进行检测,例如通过ELISA。
在这一方面,所述试剂可以是用于检测所述自身抗体组合的抗原蛋白组合,所述抗原蛋白组合包括以下抗原蛋白:Trim21、BRCA2、P53、IMP2、MAGE-A4、TXNDC2。
该试剂可用于检测受试者、例如肿瘤患者的样本(例如血浆或血清)中相应自身抗体生物标志物,进而实现上文所述的对施用肿瘤免疫治疗效果的预测或判断。
另一方面,本发明提供所述生物标志物或试剂在制备用于预测或判断受试者的肿瘤免疫治疗效果的产品中的用途。如上文所述,所述肿瘤免疫治疗效果包括:(i)受试者易于从肿瘤免疫治疗中获益(或获得好的肿瘤免疫治疗效果),(ii)受试者不易于从肿瘤免疫治疗中获益(或获得差的肿瘤免疫治疗效果),或(iii)受试者的肿瘤免疫治疗效果更差,即弊大于利。
又一方面,本发明提供一种试剂盒,所述试剂盒包含本发明所述的试剂。
取决于具体技术手段,所述试剂盒可以是用于酶联免疫吸附法(ELISA)、蛋白/肽段芯片检测、免疫印迹、微珠免疫检测、微流控免疫检测等对该自身抗体生物标志物进行检测的试剂盒。优选地,所述试剂盒用于通过抗原抗体反应对本发明的自身抗体生物标志物进行检测,例如通过ELISA。
因此,优选地,试剂盒为酶联免疫吸附法(ELISA)检测试剂盒。即,采用该试剂盒,通过酶联免疫吸附法来检测受试者的样本中自身抗体生物标志物,例如检测其浓度。相应地,所述试剂盒还可包括用于对自身抗体生物标志物进行ELISA检测的所需其他组分,这些均是本领域公知的。出于检测目的,例如,试剂盒中的抗原蛋白可连接有标签肽,例如His标签、链霉亲和素标签、Myc标签;又如,该试剂盒可以包括固相载体,如具有可固定抗原蛋白的微孔的载体,如酶标板;还可以包括用于将抗原蛋白固定于固相载体上的吸附蛋白、血液如血清的稀释液、洗涤液、带有酶标记的二抗、显色液、终止液等。
根据本发明的具体实施方式,在这一方面,所述试剂盒包括分别检测抗以下肿瘤相关抗原的自身抗体的试剂:Trim21、BRCA2、P53、IMP2、MAGE-A4、TXNDC2。所述试剂作为抗原蛋白,其序列参见上文肿瘤相关抗原的序列。
还一方面,本发明提供一种用于预测或判断受试者的肿瘤免疫治疗效果的方法,所述方法包括检测来自受试者的样本中的生物标志物,所述生物标志物为自身抗体组合,所述自身抗体组合包括抗以下肿瘤相关抗原的自身抗体:Trim21、BRCA2、P53、IMP2、MAGE-A4、TXNDC2。
根据本发明,进一步地,所述方法包括,将所述每种自身抗体在受试者样本中的浓度进行逐一评分并计算得到所述生物标志物即自身抗体组合的评分,根据该自身抗体组合的评分结果,预测或判断:(i)受试者易于从肿瘤免疫治疗中获益(或获得好的肿瘤免疫治疗效果),(ii)受试者不易于从肿瘤免疫治疗中获益(或获得差的肿瘤免疫治疗效果),或(iii)受试者的肿瘤免疫治疗效果更差,即弊大于利。
其中,所述检测可采用本发明的试剂、例如抗原蛋白组合或包含该试剂的试剂盒进行。
例如,所述方法包括以下步骤:
(1)从所述受试者获得样本;
(2)检测所述样本中每种自身抗体的浓度;
(3)将所述每种自身抗体的浓度进行逐一评分并计算得到所述生物标志物即自身抗体组合的评分,根据该自身抗体组合的评分结果,预测或判断:(i)受试者易于从肿瘤免疫治疗中获益(或获得好的肿瘤免疫治疗效果),(ii)受试者不易于从肿瘤免疫治疗中获益(或获得差的肿瘤免疫治疗效果),或(iii)受试者的肿瘤免疫治疗效果更差,即弊大于利。
其中,步骤(3)包括:
(3-1):设立每一种自身抗体的检测值的低参考阈值和高参考阈值。其中,可将低参考阈值设立为健康对照人群样本(例如血清或血浆)中自身抗体测量值的中位数加上2倍的SD值;高参考阈值设立为治疗后实现PR或SD(见下文)的患病人群治疗前样本(例如血清或血浆)中自身抗体测量值的中位数加上2倍的SD值。
(3-2):对每种自身抗体来说,当检测值小于或等于低参考阈值时,打0分;当TXNDC2、Trim21、BRCA2、IMP2的检测值大于低参考阈值且小于高参考阈值时,打1分;当MAGE-A4、P53的检测值大于低参考阈值且小于高参考阈值时,打0.1分;对每种自身抗体来说,当检测值大于或等于高参考阈值时,打2分。
就得到的评分结果,定义“异常情况”:1)TXNDC2、Trim21、BRCA2、IMP2中的TXNDC2或者IMP2为2分,其余为0分;2)TXNDC2、Trim21、BRCA2、IMP2中任何两种是2分,其余为0分;3)BRCA2和TXNDC2同时为1分,其余为0分;4)MAGE-A4为0.1分,其余为0分;5)P53为0.1分,Trim21和BRCA2中的一个为2分,其余为0分;6)MAGE-A4和P53中的一个或两个为0.1分,同时TXNDC2和Trim21中的一个为1分,其余为0分。当自身抗体组合评分属于“异常情况”时,打分规则发生变化如下:每一种抗体的打分需要分别乘以-1。
(3-3):根据每一种自身抗体的评分,计算自身抗体组合的分数,计算规则如下:自身抗体组合的分数为每一种自身抗体评分之和。
当受试者的样本中这些自身抗体生物标志物组合评分≥1时,预测或判断其易于从免疫治疗例如ICI治疗中获益或获得好的治疗效果;当此评分≥0并且<1时,其不易于从免疫治疗例如ICI治疗中获益或获得差的治疗效果;当此评分≤-0.1时,其免疫治疗例如ICI治疗效果更差,即弊大于利。
与现有技术相比,本发明提供了一种用于预测或判断肿瘤免疫治疗效果的生物标志物,所述生物标志物为自身抗体组合。采用本发明的自身抗体组合,根据检测结果的评分能够预测或判断受试者将受益或不受益于肿瘤免疫治疗。
实验表明,不论PD-L1表达水平与TMB水平,无论是免疫一线治疗还是后线治疗,无论肺癌亚型,无论是免疫单药治疗还是免疫联合化疗,此自身抗体组合评分≥1的肿瘤患者的免疫检查点阻断治疗的有效率要显著高于该自身抗体组合评分≥0并且<1或者该评分≤-0.1的肿瘤患者。
因此,就肿瘤患者能否从免疫治疗、特别是免疫检查点抑制剂治疗中获益,本发明提供的自身抗体生物标志物能够提供准确的预测或判断结果。基于该预测或判断结果,患者或临床医生可以更好地决定患者是否要进行免疫治疗,从而避免过度医疗,降低治疗成本,减少或避免不良反应产生。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
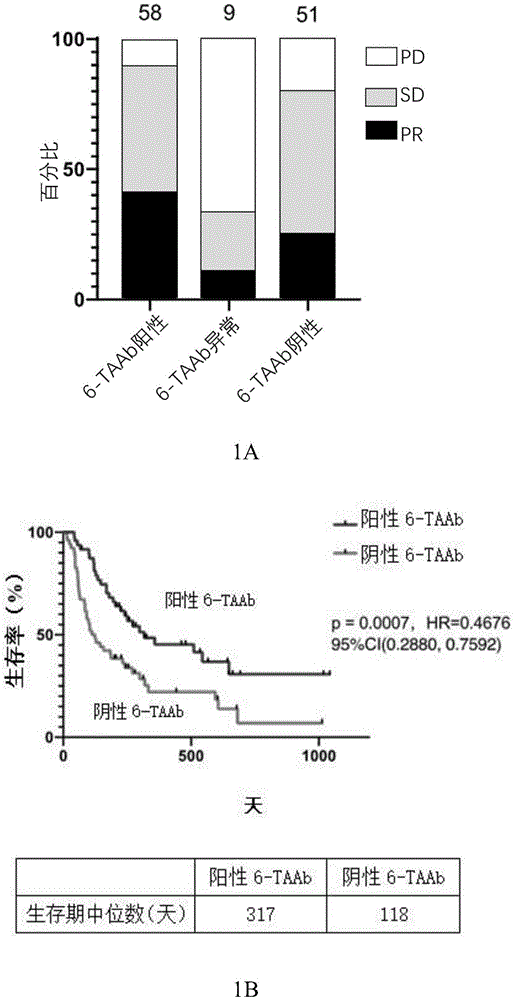
图1.6-TAAb自身抗体组合对训练队列人群的ICI治疗效果预测情况。(1A)治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。(1B)自身抗体组合阳性或阴性的患者在治疗后的生存曲线。(1C)“异常TAAb”自身抗体组合的患者与其他患者在治疗后的生存曲线。
图2.6-TAAb自身抗体组合对验证队列人群的ICI治疗效果预测情况。(2A)治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。(2B)自身抗体组合阳性或阴性的患者在治疗后的生存曲线。(2C)“异常TAAb”自身抗体组合的患者与其他患者在治疗后的生存曲线。
图3.6-TAAb自身抗体组合对不同肺癌亚型人群的ICI治疗效果预测情况。(3A)鳞癌患者中自身抗体组合阳性、阴性或异常的患者在治疗后的生存曲线。(3B)非鳞癌患者中自身抗体组合阳性、阴性或异常的患者在治疗后的生存曲线。(3C)鳞癌患者治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。(3D)非鳞癌患者治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。
图4.6-TAAb自身抗体组合对不同治疗线肺癌人群的ICI治疗效果预测情况。(4A)一线治疗患者中自身抗体组合阳性、阴性或异常的患者在治疗后的生存曲线。(4B)后线治疗患者中自身抗体组合阳性、阴性或异常的患者在治疗后的生存曲线。(4C)一线治疗患者治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。(4D)后线治疗患者治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。
图5.6-TAAb自身抗体组合对不同药物组合肺癌人群的ICI治疗效果预测情况。(5A)单药治疗患者中自身抗体组合阳性、阴性或异常的患者在治疗后的生存曲线。(5B)联合治疗患者中自身抗体组合阳性、阴性或异常的患者在治疗后的生存曲线。(5C)单药治疗患者治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。(5D)联合治疗患者治疗前自身抗体组合检测结果与患者在接受ICI治疗后的疗效评价的关系。
具体实施方式
在本发明中,术语“抗原”或术语“抗原蛋白”可互换使用。此外,本发明中涉及以下实验操作或定义。应注意,本发明还可采用本领域其他常规技术进行实施,并不仅限于以下实验操作。
(一)抗原蛋白的制备与固定
将肿瘤相关抗原(TAA)的cDNA克隆到含6XHis标记的PET28(a)表达载体上。在抗原的N端或C端,引入链霉亲和素蛋白或类似物(结合生物素的标签蛋白)。获得的重组表达载体转化大肠杆菌进行表达,当蛋白在包涵体表达后,用6M盐酸胍对蛋白进行变性处理,并在体外按照标准方法进行复性折叠,然后通过6XHis标签进行Ni-NTA亲和柱纯化,获得抗原蛋白。
(二)血浆的制备
在免疫治疗前一周至1天内取静脉血在EDTA处理过或柠檬酸处理过的采血管中。然后室温1000-2000RCF离心15min;离心后,在室温下轻轻地把上清转移到另一个干净的离心管中,置于-80℃冰箱中长期保存。
(三)自身抗体的ELISA检测与定量
将制得的抗原蛋白包被到96孔固相板的微孔表面。采用间接包被:96-孔固相板过夜包被5-10ug/ml的生物素标记的牛血清白蛋白;第2天,洗去固相板微孔中未包被的牛血清白蛋白,加入300uL含有BSA的封闭液室温封闭1h;加入抗原蛋白孵育1.5h,然后洗去未吸附的抗原蛋白。包被抗原蛋白后,微孔中加入300ul的含有BSA的稳定液,孵育1h后现用或真空干燥备用。
如上,纯化的抗原蛋白通过生物素与链霉亲和素之间的特异反应间接包被到固相板表面。往包被抗原蛋白的微孔中加入稀释好的血浆样本,经孵育使血浆样本中的自身抗体与固相板表面上的抗原蛋白发生特异性结合。洗掉没有结合的自身抗体,加入辣根过氧化物酶标记抗人IgG抗体,第二次孵育使该酶标记抗人IgG抗体与吸附到固相板表面上的自身抗体结合,形成抗原-抗体-酶标记抗体的复合物,继而洗掉没有结合的酶标记抗人IgG抗体,加入显色剂底物反应后用酶标仪在450nm波长下测定吸光度。检测步骤如下:
一、准备步骤
1.将检测用试剂放置室温至少30min使试剂恢复到室温。
2.稀释待测血浆样本:在1.5ml EP管内加入545ul的样本稀释液(PBS,含1%BSA),再将5ul待测血浆样本加入到样本稀释液中(可根据所需量自行调整样本量,血浆样本与样本稀释液的体积比为1:109),上下颠倒5-6次轻轻混匀。
3.将各待测血浆样本稀释混匀后,转移530ul到干净的深孔槽。
4.制备洗液工作液:将10倍PBST洗液,用纯化水或蒸馏水稀释10倍,配成原倍洗液,备用。
5.PBS缓冲液:自备,pH值为7.6。
二、检测步骤
1.加一抗:用PBS缓冲液270ul/孔洗酶标板1次后,向酶标板加入50ul/孔已经稀释好的待测血浆,室温在微孔振荡器上反应1h。
2.加二抗:使用前配制二抗(恢复到室温的辣根过氧化物酶标记抗人IgG抗体浓缩液:酶结合物稀释液=1:19,该稀释液为含1%BSA的PBS)。用1*PBST洗液270ul/孔洗板3次,每次均拍干,然后以50ul/孔加入二抗稀释液,贴膜,室温在微孔振荡器上反应0.5h。
3.加显色剂:使用前配制显色剂(显色剂A液:显色剂B液=1:19)。用1*洗液270ul/孔洗板3次,每次均拍干,然后以100ul/孔加入显色剂,加第一行开始计时,贴膜,室温在微孔振荡器上反应15min。
4.终止并读数:按照加入显色剂的顺序,加入终止液50ul/孔,在酶标仪450nm下读数。
5.参照标准曲线,对样本中自身抗体的水平进行定量。
(四)临床疗效评估指标
根据实体肿瘤的疗效评价标准1.1版(Response Evaluation Criteria in SolidTumors RECIST Version 1.1,RECIST v1.1)评估基线(治疗前)时的目标病灶,记录目标病灶最长直径的基线和,用于确定客观反应。
BOR:最佳疗效,是指考虑了各种因素后确认的从治疗研究开始到治疗结束的最佳疗效的记录。
PD:与治疗前所有靶病灶直径和的最小值相比,所有靶病灶直径的总和至少增加20%且直径总和增加的绝对值还必须大于5mm;或者出现新的病灶。
PR:与治疗前所有靶病灶的直径和相比,所有靶病灶直径的总和至少减小30%。
SD:与治疗前所有靶病灶直径和的最小值相比,靶病灶的缩小程度不符合部分缓解(PR),增大程度不符合疾病进展(PD),是指一种介于PR和PD之间的状态。
CR:所有靶病灶消失,任何病理性淋巴结(无论是否为靶病灶)的短轴值必须<10mm。
PFS:无进展生存时间,即从随机化开始至疾病复发或由于各种原因导致患者死亡的时间。
mPFS:中位无进展生存时间,即从随机化开始至疾病复发或由于各种原因导致患者死亡的中位时间。
PD-L1表达水平:采用免疫组化法进行,评估有任何强度PD-L1膜染色的肿瘤细胞在所有肿瘤细胞中所占的百分比,将检测结果分为四组,即阴性,<50%,≥50%,未知。
(五)设立每一种自身抗体的检测值的低参考阈值和高参考阈值
以健康对照人群(浙江大学第一附属医院体检中心242例)的血浆中自身抗体测量值的中位数加上2倍的SD值,作为低参考阈值。
以训练队列(见下文实施例1)中治疗后实现PR或SD的患者治疗前血浆中自身抗体测量值的中位数加上2倍的SD值,作为高参考阈值。
确定每种自身抗体的低参考阈值和高参考阈值为:
肿瘤自身抗原名称(低参考阈值,高参考阈值):IMP2(10,96)、P53(9,58)、MAGE-A4(9,40)、Trim21(12,72)、CM406(7,35)、BRCA2(9,38)。
(六)自身抗体组合的评分
对每种自身抗体来说,当检测值小于或等于低参考阈值时,打0分;当TXNDC2、Trim21、BRCA2、IMP2的检测值大于低参考阈值且小于高参考阈值时,打1分;当MAGE-A4、P53的检测值大于低参考阈值且小于高参考阈值时,打0.1分;对每种自身抗体来说,当检测值大于或等于高参考阈值时,打2分。
就得到的评分结果,定义“异常情况”:1)TXNDC2、Trim21、BRCA2、IMP2中的TXNDC2或者IMP2为2分,其余为0分;2)TXNDC2、Trim21、BRCA2、IMP2中任何两种是2分,其余为0分;3)BRCA2和TXNDC2同时为1分,其余为0分;4)MAGE-A4为0.1分,其余为0分;5)P53为0.1分,Trim21和BRCA2中的一个为2分,其余为0分;6)MAGE-A4和P53中的一个或两个为0.1分,同时TXNDC2和Trim21中的一个为1分,其余为0分。当自身抗体组合评分属于“异常情况”时,打分规则发生变化如下:每一种抗体的打分需要分别乘以-1。
根据每一种自身抗体的评分,计算自身抗体组合的分数,计算规则如下:自身抗体组合的分数为每一种自身抗体评分之和。
当受试者的样本中这些自身抗体生物标志物组合评分≥1时(定义为“6-TAAb阳性”、“阳性6-TAAb”或“阳性”),预测或判断其易于从免疫治疗例如ICI治疗中获益或获得好的治疗效果;当此评分≥0并且<1时(定义为“6-TAAb阴性”、“阴性6-TAAb”或“阴性”),其不易于从免疫治疗例如ICI治疗中获益或获得差的治疗效果;当此评分≤-0.1时(定义为“6-TAAb异常”、“异常6-TAAb”或“异常”),其免疫治疗例如ICI治疗效果更差,即弊大于利。
(七)统计分析方法
使用GraphPad Prism v.6(Graphpad Prism软件,加利福尼亚州圣地亚哥)和针对Windows的IBM SPSS Statistics 23(IBM,纽约,纽约),使用Mann–Whitney U检验对两组进行统计学分析。在分析每个参数之间的关系时,执行了Spearman的相关分析。通过Kaplan-Meier方法分析了中位无进展生存(median Progression Free Survival,mPFS)。使用对数秩检验分析患者亚组之间的mPFS差异。
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。样本采集已经患者知情同意,且获得监管部门的批准。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。
实施例1
为了建立能指示免疫治疗效果的自身抗体组合,本研究首先招募了124例诊断为晚期肺癌的患者,他们的血浆在接受ICI治疗前进行采集,检测肺癌患者是否存在针对纯化的抗原蛋白的自身抗体。这一组人群称为训练队列。此实验人群的具体信息见表1。
表1.训练队列人群信息。
/>
*:不同于本发明其他地方提及的阳性患者,此处的阳性是指患者血浆中检测到6个自身抗体中任一个的表达,即为阳性;
**:不同于本发明其他地方提及的阳性患者,此处的阴性是指患者血浆中未检测到全部6个自身抗体的表达,即为阴性。
以下实验结果分析中出现的“阳性率”为相应群体中出现自身抗体组合阳性结果(见上文的*)的百分比。
结果表明,自身抗体组合在训练队列中的阳性率为46.8%。同时数据显示,IV期病人比III期病人有更高的阳性率(50%vs.21.4%,P=0.0436)。此外,接受一线ICI治疗患者比后线治疗患者的阳性率高(57.8%vs.40.5%,P=0.0638)。其他的临床特征,比如年龄、性别、吸烟史、病理亚型、PD-L1表达情况等未被发现与自身抗体组合的检测结果有显著的相关性。
为了验证在训练队列中建立的自身抗体组合对ICI治疗的预测能力,在另一家治疗中心独立地招募了118例肺癌晚期患者,他们的血浆在接受ICI治疗前进行采集,将被用来验证是否可以利用6-TAAb自身抗体组合在不同人群中,具备相似的预测ICI治疗效果的能力。这一组人群称为验证队列。此实验人群的具体信息见表2。
表2.验证队列人群信息。
/>
*:不同于本发明其他地方提及的阳性患者,此处的阳性是指患者血浆中检测到6个自身抗体中任一个的表达,即为阳性;
**:不同于本发明其他地方提及的阳性患者,此处的阴性是指患者血浆中未检测到全部6个自身抗体的表达,即为阴性。
6-TAAb自身抗体组合在验证队列中的阳性率为56%。接受一线ICI治疗患者也比后线治疗患者倾向于更高的阳性率。其他的临床特征,比如年龄、性别、吸烟史、病理亚型、PD-L1表达情况等未被发现与自身抗体组合的检测结果有显著的相关性。
实施例2
对来自上海肺科医院的124例晚期肺癌患者(训练队列)进行6-TAAb自身抗体组合检测,应用检测结果对这些患者接受ICI治疗后的疗效进行预测。
数据结果显示,阳性6-TAAb患者的无进展生存期中位数为317天,阴性患者的为118天,“异常”患者的仅为55天。客观缓解率方面,阳性患者为41%、阴性患者为25%、“异常”患者仅为11%。与此同时,6-TAAb阳性患者中有41%在ICI治疗后得到部分缓解(PR)的评价,10%得到了疾病进展(PD)的评价;相反,阴性6-TAAb患者只有25%得到部分缓解(PR)的评价,而20%的患者得到了疾病进展(PD)的评价。所以,对于这一组人群来说,阳性6-TAAb检测结果预测着患者将易于从免疫治疗例如ICI治疗中获益或好的治疗效果;阴性6-TAAb自身抗体组合检测结果,预测不易于从免疫治疗例如ICI治疗中获益;当6-TAAb自身抗体组合检测结果为“异常”时,预测从免疫治疗例如ICI治疗中获得更差的治疗效果。
结果见图1。
实施例3
对来自北京协和医院的118例晚期肺癌患者(验证队列)进行6-TAAb自身抗体组合检测,应用检测结果对这些患者接受ICI治疗后的疗效进行预测。
数据结果显示,阳性6-TAAb患者的无进展生存期中位数为8.8个月,阴性患者的为3.9个月,“异常”患者的仅为2.05个月。客观缓解率方面,阳性患者为48.8%,阴性患者为20.9%,“异常”患者仅为14.3%。所以,对于这一组人群来说,阳性6-TAAb检测结果预测着患者将易于从免疫治疗例如ICI治疗中获益或好的治疗效果;阴性6-TAAb自身抗体组合检测结果,预测不易于从免疫治疗例如ICI治疗中获益;当6-TAAb自身抗体组合检测结果为“异常”时,预测从免疫治疗例如ICI治疗中获得更差的治疗效果。
结果见图2。
实施例4
为了能筛选到适合临床应用的免疫治疗预测标志物,本研究的验证队列中尽量入组肺癌患者免疫治疗的各种场景。首先就根据病理特征,选择了肺癌晚期患者中不同亚型的患者人群。在鳞癌患者中,6-TAAb检测结果为阳性的患者经过ICI治疗后的无进展生存期中位数显著长于6-TAAb检测结果为阴性的患者,并且收到的治疗效果也要显著好于阴性患者,以客观缓解率(ORR)为评定指标,6-TAAb阳性患者为33.3%,而阴性患者为22.2%。在非鳞癌患者中,6-TAAb阳性患者的无进展生存期中位数为8.8个月,而阴性患者的为7个月;同样地,客观缓解率方面,阳性患者的为54.8%,这显著高于阴性患者的20.4%。
无论是在鳞癌还是在非鳞癌患者中,“异常”的6-TAAb检测结果都预示着较差的ICI治疗效果。鳞癌患者中,“异常6-TAAb”患者的无进展生存期中位数为3.2个月,而阳性患者为5.7个月;非鳞癌患者中,“异常6-TAAb”患者的无进展生存期仅为1.5个月,而阳性患者的为8.8个月。
所以,6-TAAb对于不同亚型的晚期肺癌患者没有预测性能方面的偏好,均可适用6-TAAb自身抗体组合检测。并且,在不同亚型肺癌中,阳性6-TAAb检测结果预测着患者将易于从免疫治疗例如ICI治疗中获益或好的治疗效果;阴性6-TAAb自身抗体组合检测结果,预测不易于从免疫治疗例如ICI治疗中获益;当6-TAAb自身抗体组合检测结果为“异常”时,预测从免疫治疗例如ICI治疗中获得更差的治疗效果,即弊大于利。
结果见图3。
实施例5
根据验证队列患者的治疗线数,将接受ICI治疗的患者分为一线治疗患者和后线治疗患者。一线治疗患者中,阳性6-TAAb的患者无进展期中位数显著长于阴性患者;客观缓解率方面,阳性患者为52.4%,这显著高于阴性患者的29.4%。在后线治疗患者中,阳性TAAb的患者无进展生存期中位数为8.8个月,阴性患者的为3.71个月;阳性6-TAAb患者客观缓解率为50%,阴性患者为16%。
当患者的6-TAAb检测结果为“异常”时,在一线治疗患者中,这样的患者在疗效方面没有表现出与阴性患者的显著差异;而在后线治疗患者中,“异常6-TAAb”患者的客观缓解率为0%,显著低于阴性患者的16%。不论治疗线数如何,“异常6-TAAb”患者的无进展生存期中位数都要显著短于阳性患者的。一线治疗中,“异常6-TAAb”患者的无进展生存期中位数为6.54个月,阳性患者的为10.48个月;后线治疗中,“异常6-TAAb”患者的为1.66个月,阳性患者的为4.67个月。
所以,6-TAAb对于不同治疗线数的晚期肺癌患者没有预测性能方面的偏好,均可适用6-TAAb自身抗体组合检测。并且,在不同治疗线数肺癌中,阳性6-TAAb检测结果预测着患者将易于从免疫治疗例如ICI治疗中获益或好的治疗效果;阴性6-TAAb自身抗体组合检测结果,预测不易于从免疫治疗例如ICI治疗中获益;当6-TAAb自身抗体组合检测结果为“异常”时,预测从免疫治疗例如ICI治疗中获得更差的治疗效果,即弊大于利。
结果见图4。
实施例6
根据验证队列患者的用药情况,将患者分为ICI单药治疗患者和化疗/ICI联合治疗患者。在单药治疗患者组,6-TAAb阳性患者的无进展生存期中位数显著长于阴性患者,并且客观缓解率为40%,这显著高于阴性患者的28.6%。相似地,在化疗/ICI联合治疗患者中,6-TAAb阳性患者的无进展生存期中位数为7.2个月,阴性患者的为4.3个月;在客观缓解率方面,6-TAAb阳性患者为40.6%,略好于阴性患者的39.1%。
当患者的6-TAAb检测结果为“异常”时,在单药治疗患者中,客观缓解率为0%,远低于阴性患者的28.6%,预示着ICI治疗没有带来任何积极效果;同时无进展生存期中位数仅为1.28个月,而阴性患者的为3.25个月。在化疗/ICI联合治疗患者中,6-TAAb异常患者的客观缓解率为17.3%,略低于阴性患者的20%;无进展存期中位数在6-TAAb异常的患者中为2.48个月,远远短于阳性患者的7.2个月。
所以,6-TAAb对于不同用药情况的晚期肺癌患者没有预测性能方面的偏好,均可适用6-TAAb自身抗体组合检测。并且,在不同用药情况的肺癌中,阳性6-TAAb检测结果预测着患者将易于从免疫治疗例如ICI治疗中获益或好的治疗效果;阴性6-TAAb自身抗体组合检测结果,预测不易于从免疫治疗例如ICI治疗中获益;当6-TAAb自身抗体组合检测结果为“异常”时,预测从免疫治疗例如ICI治疗中获得更差的治疗效果,即弊大于利。
结果见图5。
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
- 一种用于预测或判断受试者的肿瘤免疫治疗效果的生物标志物及其应用
- 用于预测肿瘤免疫治疗效果的生物标志物检测方法及系统
