一种sgRNA组合及其应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明属于基因敲除技术领域,具体涉及一种sgRNA组合及其应用。
背景技术
Atp7b蛋白属P型ATP酶超家族,由位于第13号染色体长臂(13q14.3~q21.1),全长约85kb的atp7b基因编码,Atp7b蛋白对调控和调节细胞内铜离子的代谢和平衡至关重要。现已证明,突变或缺失的atp7b基因会导致威尔逊病(Wilsondisease,WD)(The Wilsondisease gene is a putative copper transporting P-type ATPase similar to theMenkes gene.PMID:8298639)(TheWilsondisease gene is acoppertransportingATPasewithhomology to the Menkes disease gene.PMID:8298641),这是一种常染色体隐性遗传的铜代谢紊乱疾病。atp7b基因突变或缺失引起Atp7b蛋白质功能异常,使得机体内的游离铜排泄减少,大量铜蓄积于肝、脑、肾、骨关节、角膜等组织和脏器,因而WD患者在临床上会表现出神经系统症状、急性或慢性肝衰竭和/或精神症状。目前,有学者利用Exon1中缺失5bp的atp7b
现阶段,对atp7b基因在斑马鱼中作用的主要研究方法是吗啉代修饰的反义寡核苷酸技术(Morpholino)介导的基因敲降方法。该技术方法虽然可快速研究目的基因功能,但也存在缺点:1.敲降效果可能在不同细胞类型和不同目标基因之间变化较大。2.可能存在非特异性影响其他非目标RNA或蛋白质的副作用。3.在mRNA水平减低基因表达,仍有基因表达产物发挥作用,某些特殊的表型不易被观察。4.只能短期降低斑马鱼体内目的基因的表达,无法实现长期观察由于基因表达缺失造成的功能障碍。5.Morpholino在一些情况下可能会对细胞或生物体产生毒性效应,高浓度或长期的Morpholino暴露可能导致不良的细胞反应或影响胚胎发育。
发明内容
本发明的目的在于弥补现有技术的不足,提高斑马鱼atp7b基因的敲除效果,选育出atp7b基因缺失型斑马鱼,构建威尔逊病斑马鱼模型。
为了解决上述问题,本发明提供了一种sgRNA组合,包括sgRNA1、sgRNA2、sgRNA3和sgRNA4;所述sgRNA1、sgRNA2、sgRNA3和sgRNA4的核苷酸序列分别如SEQ ID NO.1至SEQ IDNO.4所示。
本发明还提供了上述技术方案所述的sgRNA组合在构建威尔逊病斑马鱼模型中的应用。
本发明还提供了一种构建威尔逊病斑马鱼模型的试剂盒,包括上述技术方案所述的sgRNA组合。
优选的,所述试剂盒还包括Cas9蛋白。
本发明还提供了一种威尔逊病斑马鱼模型的构建方法,包括如下步骤:
将上述技术方案所述的sgRNA组合和Cas9蛋白的混合物注射到斑马鱼的受精卵中,选出有效敲除的胚胎,培养至成鱼,获得F0代突变斑马鱼;
将所述F0代突变斑马鱼与野生型斑马鱼杂交得到F1代胚胎,筛选所述F1代胚胎中存在突变的胚胎,培养至成鱼,得到可遗传的斑马鱼突变体。
优选的,所述sgRNA组合和Cas9蛋白混合物中sgRNA组合的浓度为300ng/μL,Cas9蛋白的浓度为400ng/μL。
优选的,所述sgRNA组合和Cas9蛋白混合物中sgRNA1、sgRNA2、sgRNA3和sgRNA4的质量比为1:1:1:1。
优选的,选出有效敲除的胚胎的方法包括如下步骤:
取发育至24hpf的受精卵,制备基因组DNA;
以所述基因组DNA为模板,利用上游扩增引物和下游扩增引物进行PCR扩增,得到PCR扩增产物;
将所述PCR扩增产物与野生型atp7b基因比对,若扩增结果不同,则发育至24hpf的受精卵为有效敲除的胚胎;
所述上游扩增引物包括如SEQ ID NO.5所示的核苷酸序列;所述下游扩增引物包括如SEQ ID NO.6所示的核苷酸序列。
优选的,所述PCR扩增的程序为:96℃预变性3min;96℃变性30s,56℃退火30s,72℃延伸30s,35个循环;72℃终延伸10min。
有益效果:
本发明提供了一种sgRNA组合,所述sgRNA组合包括sgRNA1、sgRNA2、sgRNA3和sgRNA4。本发明的sgRNA组合能够用于Crispant特异性敲除斑马鱼atp7b基因,构建斑马鱼突变体模型,通过Crispant技术,敲除斑马鱼atp7b基因第8号外显子上的基因片段,选育出atp7b基因缺失型斑马鱼,从而构建斑马鱼突变体模型。本发明使用多个sgRNA靶向同一基因,可以最大限度地提高编辑效率,更有效进行基因编辑,可以在目标基因DNA水平的插入或缺失多种核酸序列,产生的每个个体中存在不同基因型的细胞,揭示基因功能;基因敲除的DNA位点能在斑马鱼稳定遗传,表型观察不受时间限制,可快速大批量进行基因筛选。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
图1为实施例1步骤二体外合成制备的sgRNA质量电泳鉴定结果图;
图2为实施例1步骤三体外合成制备的sgRNA质量测序鉴定结果图;
图3为携带(+13bp-7bp)缺失突变的F1斑马鱼测序峰图;
图4为携带(-14bp-22bp)移码突变的F1斑马鱼测序峰图;
图5为携带(-12bp+9bp-5bp+36bp)移码突变的F1斑马鱼测序峰图;
图6为携带(-1bp+7bp-21bp)移码突变的F1斑马鱼测序峰图。
具体实施方式
本发明提供了一种sgRNA组合,包括sgRNA1、sgRNA2、sgRNA3和sgRNA4;所述sgRNA1、sgRNA2、sgRNA3和sgRNA4的核苷酸序列分别如SEQ ID NO.1至SEQ ID NO.4所示。
本发明在NCBI数据库上查询斑马鱼atp7b基因的基因组DNA序列(登录号:556499),并分析功能结构域,针对斑马鱼atp7b基因第8号外显子,选择4个sgRNA结合位点并设计相应的sgRNA引物,可以对斑马鱼atp7b基因进行编辑。
鉴于本发明提供的sgRNA组合的作用,并且已知突变或缺失的atp7b基因会导致威尔逊病,所述sgRNA组合在构建威尔逊病斑马鱼模型中的应用,利用上述技术方案所述的sgRNA组合构建得到的威尔逊病斑马鱼模型同样属于本发明的保护范围。
本发明还提供了一种构建威尔逊病斑马鱼模型的试剂盒,包括上述技术方案所述的sgRNA组合,优选还包括Cas9蛋白。
本发明还提供了一种威尔逊病斑马鱼模型的构建方法,包括如下步骤:
将上述技术方案所述的sgRNA组合和Cas9蛋白混合物注射到斑马鱼的受精卵中,选出有效敲除的胚胎,培养至成鱼,获得F0代突变斑马鱼;
将所述F0代突变斑马鱼与野生型斑马鱼杂交得到F1代胚胎,筛选所述F1代胚胎存在突变的胚胎,培养至成鱼,得到可遗传的斑马鱼突变体的F1代。
本发明将上述技术方案所述的sgRNA组合和Cas9蛋白的混合物注射到斑马鱼的受精卵中。在本发明中,所述sgRNA组合和Cas9蛋白混合物中sgRNA组合的浓度优选为300ng/μL,Cas9蛋白的浓度优选为400ng/μL;所述sgRNA组合和Cas9蛋白混合物中sgRNA1、sgRNA2、sgRNA3和sgRNA4的质量比优选为1:1:1:1。
注射结束后,本发明选出有效敲除的胚胎。在本发明中,所述选出有效敲除的胚胎的方法优选包括如下步骤:取发育至24hpf的受精卵,制备基因组DNA;以所述基因组DNA为模板,利用上游扩增引物和下游扩增引物进行PCR扩增,得到PCR扩增产物;将所述PCR扩增产物与野生型atp7b基因比对,若扩增结果不同,则发育至24hpf的受精卵为有效敲除的胚胎。
本发明优选使用斑马鱼基因型鉴定试剂盒制备基因组DNA,进一步优选为将发育至24hpf的受精卵与马鱼基因型鉴定试剂盒中buffer混合,反应,得到所述基因组DNA。在本发明中,所述反应的条件优选为65℃30min,95℃5min,16℃1min,4℃保存;所述发育至24hpf的受精卵与buffer的比例优选为2枚:20μl。本发明所述斑马鱼基因型鉴定试剂盒优选购买自南京尧顺禹生物科技有限公司。
得到所述基因组DNA后,本发明优选以所述基因组DNA为模板,利用上游扩增引物和下游扩增引物进行PCR扩增,得到PCR扩增产物。在本发明中,所述上游扩增引物优选包括如SEQ ID NO.5所示的核苷酸序列;所述下游扩增引物优选包括如SEQ ID NO.6所示的核苷酸序列。
在本发明中,所述PCR扩增的程序优选为:95℃预变性3min;95℃变性30s,56℃退火30s,72℃延伸30s,35个循环;72℃终延伸10min;所述PCR扩增的体系优选以25μl计,优选包括1μl上游引物、1μl下游引物、15μl 2×Mastermix、2μl的基因组DNA和余量的超纯水。本发明所述上游引物和下游引物中引物的浓度均优选为5μM。
得到所述PCR扩增产物后,本发明将所述PCR扩增产物与野生型atp7b基因比对,若扩增结果不同,则发育至24hpf的受精卵为有效敲除的胚胎。
得到所述有效敲除的胚胎后,本发明将所述有效敲除的胚胎培养至成鱼,获得F0代突变斑马鱼;将F0代突变斑马鱼与野生型斑马鱼杂交得到F1代胚胎,筛选存在突变的胚胎,培养至成鱼,得到威尔逊病斑马鱼模型,记为F1代。本发明实施例中,所述筛选存在突变的胚胎的方式优选与筛选有效敲除的胚胎的方式相同,在此不做赘述。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种sgRNA组合及其应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
步骤一:Crispant策略敲降靶位点设计和PCR检测引物
在NCBI数据库上查询斑马鱼atp7b基因的基因组DNA序列(登录号为556499),并分析功能结构域,设计斑马鱼atp7b基因的靶位点,最后确定敲除基因的靶位点位于斑马鱼atp7b基因的第8号外显子上;根据atp7b基因的第8号外显子设计PCR扩增引物和测序引物,具体如表1所示。
表1设计的sgRNA和引物序列
步骤二:目标基因的基因型确认
(1)基因组DNA模板制备
取8枚24hpf时期的野生型斑马鱼胚胎于200ml PCR管内,吸净水分,向PCR管中加入buffer 10μl(南京尧顺禹生物科技有限公司);反应条件:65℃30min,95℃5min,16℃1min,4℃保存。
(2)PCR扩增及检测
PCR反应体系(30μl):2×Mastermix 15μl、12μl的超纯水、1μl atp7b-E8-F(5μM)、1μl atp7b-E8-R(5μM)和1μl步骤(1)获得的基因组DNA模板。
PCR反应条件为:96℃预变性3min;96℃变性30s,56℃退火30s,68℃延伸30s,35个循环;72℃终延伸10min,4℃保存。
取1μl PCR扩增的产物进行琼脂糖凝胶电泳(1%),结果如图1所示。其中,自左向右左图第1泳道为DNAMarker:从下向上依次为100bp、250bp、500bp、750bp、1000bp、2000bp、3000bp、5000bp;第2泳道为atp7b-E8-F/R扩增产物。根据图1可以看出,本发明表1中的序列能够扩增出完整的基因组DNA序列,并且条带单一,无杂带产生。
步骤三、sgRNA体外合成及质检
(1)sgRNA表达构件体外合成引物
根据表1设计的sgRNA序列,设计合成sgRNA的正向引物,具体序列如表2。
表2合成sgRNA的正向引物
注:加粗部分为T7启动子部分,下划线部分为CRISPR序列,小写字母为部分sgRNA骨架模板序列。
合成sgRNA1~sgRNA4的反向引物均为通用引物R-Common,核苷酸序列具体为:5’-AAAAAAAGCACCGACTCGGTGCCAC-3’(SEQ ID NO.11)
(2)PCR扩增合成sgRNA
配置4个PCR反应体系(80μL):
PCR反应体系1:40μl 2×Mastermix、35μl超纯水、2μl atp7b-sgRNA1-F(5μM)、2μl反向引物R-Common(5μM)和1μl pYSY-sgRNA质粒(10ng/μl);
PCR反应体系2:40μl 2×Mastermix、35μl超纯水、2μl atp7b-sgRNA2-F(5μM)、2μl反向引物R-Common(5μM)和1μl pYSY-sgRNA质粒(10ng/μl);
PCR反应体系3:40μl 2×Mastermix、35μl超纯水、2μl atp7b-sgRNA3-F(5μM)、2μl反向引物R-Common(5μM)和1μl pYSY-sgRNA质粒(10ng/μl);
PCR反应体系4:40μl 2×Mastermix、35μl超纯水、2μl atp7b-sgRNA4-F(5μM)、2μl反向引物R-Common(5μM)和1μl pYSY-sgRNA质粒(10ng/μl);
其中,pYSY-sgRNA质粒为pYSY-T7-Cas9-T7-sgRNA,购自南京尧顺禹生物科技有限公司;
反应体系1~4的PCR反应程序均为:95℃3min,35×(95℃30s,56℃30s,72℃30s),72℃10min,4℃。
(3)PCR产物纯化(无核酸酶污染处理)
将步骤(2)得到的PCR产物分别利用无核酸酶污染的PCR clean up试剂盒收集(购买自Axygen),回收溶剂为无核酸酶污染的超纯水。
利用反应体系1进行PCR扩增并纯化后的产物记为样品1,利用反应体系2进行PCR扩增并纯化后的产物记为样品2,利用反应体系3进行PCR扩增并纯化后的产物记为样品3,利用反应体系4进行PCR扩增并纯化后的产物记为样品4。
(4)sgRNA的体外转录
将步骤(3)得到的样品1~4分别用T7 RNA聚合酶进行体外转录。使用RNA体外转录试剂盒(MAXIscript T7,Ambion,USA),按试剂盒说明书要求依次加入10×TranscriptionBuffer 4μl、10mM ATP 2μl、10mM CTP 2μl、10mM GTP 2μl、10mM UTP 2μl、T7 RNApolymerase mix 4μl、模板DNA 24μl,轻弹混匀离心后,37℃水浴2h;
加入DNase I(Ambion,USA)2μl,37℃水浴15min,以去除模板。
之后加入160μl DEPC水扩大体积至200μl,同时加入20μl无核酸酶3M醋酸钠(pH5.2)和3倍体积的无水乙醇(生工),-80℃沉淀过夜。4℃12,000g离心20min,去除上清后,加入无核酸酶75%乙醇,4℃12,000g离心20min,去除上清后,沉淀在通风橱晾干,然后以10μl无核酸酶超纯水重悬,得到sgRNA1、sgRNA2、sgRNA3和sgRNA4,储存于-80℃冰箱备用。
(5)sgRNA质量鉴定
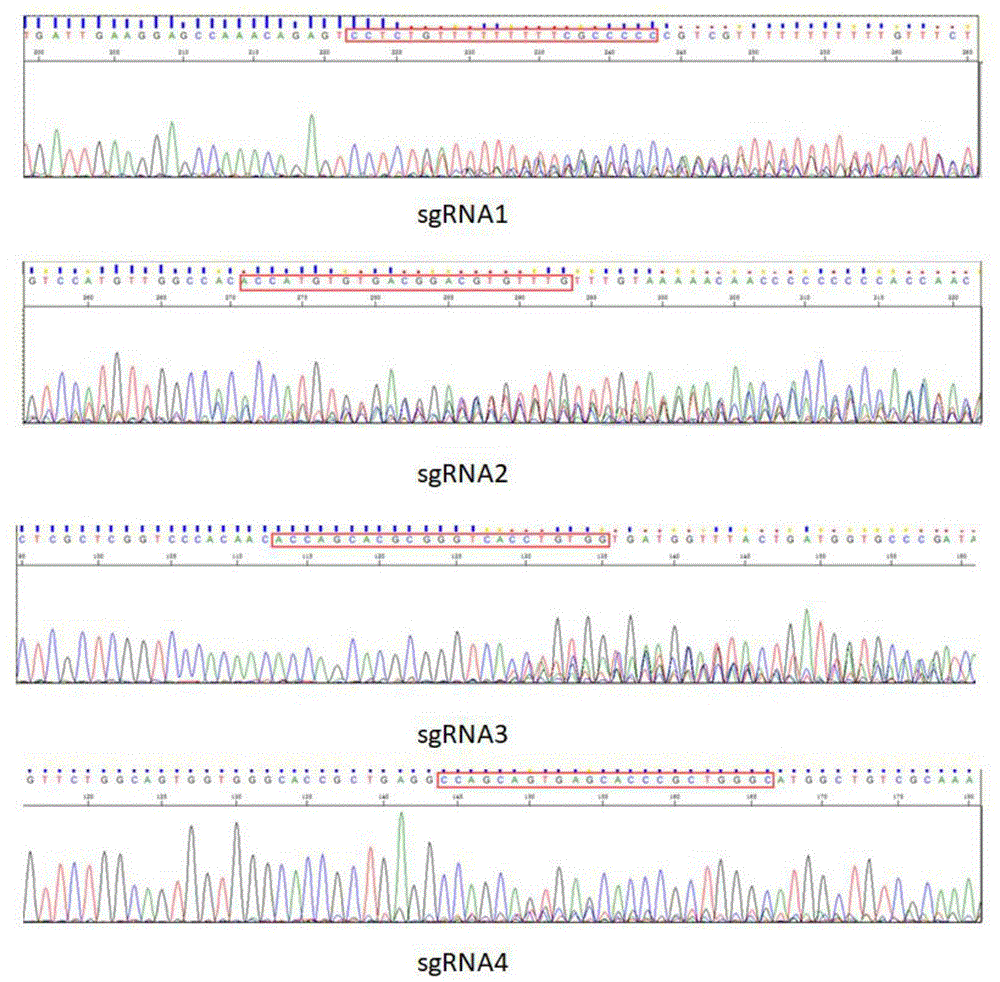
分别取1μl PCR步骤(4)得到的sgRNA1、sgRNA2、sgRNA3和sgRNA4进行琼脂糖凝胶电泳(1%)鉴定其完整性,经过电泳确认条带大小后,将阳性扩增产物全部送商业公司测序,测序引物atp7b-E8-F/R,测序结果如图2所示,红色框内指示CRISPR附近Indel突变,从上到下依次是sgRNA1~sgRNA4。将验证的sgRNA对应的测序结果与野生型序列进行相互比较后(https://tide.nki.nl/),得到相对的活性数值。其中,设计的sgRNA突变效率总为50%。
实施例2
步骤一、斑马鱼受精卵的显微注射
按常规方法收取纯品系野生型(TU品系)斑马鱼受精卵,将实施例1得到的sgRNA1、sgRNA2、sgRNA3和sgRNA4等浓度混合,得到sgRNA组合;将sgRNA组合混合,得到混合物后显微注入斑马鱼受精卵,注射量为1nl每胚胎;
其中,混合物中sgRNA组合浓度为300ng/μl,Cas蛋白浓度为400ng/μl。
步骤二、sgRNA引导Cas9靶向切割目标基因组DNA序列效率的确认
(1)目标基因组DNA模板的制备
待步骤一注射胚胎发育至24hpf时,取16枚单胚胎制备基因组DNA模板,使用斑马鱼基因型鉴定试剂盒(购买自南京尧顺禹生物科技有限公司)制备基因组DNA;
具体反应条件为:65℃30min,95℃5min,16℃1min,4℃保存。
(2)PCR检测
利用表1中的引物对atp7b-E8-F/R,以步骤(1)得到的基因组DNA为模板,进行PCR扩增,具体的反应体系和反应程序同实施例1步骤二中的步骤(2)。
(3)扩增产物的检测和测序
取步骤(2)中2μl PCR扩增的产物进行琼脂糖凝胶电泳(1%),电泳确认条带大小后,将阳性扩增产物(即单一条带)全部送商业公司测序。
步骤三、Crispant策略敲降斑马鱼atp7b基因F0代的可遗传鉴定
步骤二得到的阳性胚胎性成熟后,获得靶向敲除atp7b基因的F0代斑马鱼,将F0代斑马鱼雌雄分开,等待1周后,分别与纯品系野生型(TU品系)斑马鱼进行1对1交配,参照步骤二中的步骤(2)~(3)对后代的基因组DNA进行PCR扩增和测序,通过对F0与TU品系斑马鱼的后代胚胎进行基因型鉴定,筛选出atp7b基因组编辑突变体阳性可遗传F0。
步骤四、候选F1突变体斑马鱼的繁育与饲养
将步骤三筛选出的阳性可遗传F0胚胎饲养至性成熟,然后分别与纯品系野生型(AB品系)斑马鱼1比1交配,获得F1胚胎,通过对F1胚胎进行基因型鉴定,确定携带可种系遗传突变等位基因的阳性F0。将筛选出的阳性F0斑马鱼雌雄交配,然后将F1胚胎按常规饲养至2月龄以上,进行基因型鉴定,以筛选基因编辑突变体,具体步骤如下:
(1)候选F1突变体基因组DNA模板制备
a.组织取材
取3月龄的F1成鱼,剪取部分尾鳍组织,按顺序分别放入200μl PCR管中,迅速置于冰上存放。
b.基因组模板DNA制备
向含有尾鳍组织的200μl PCR管中加入的YSY buffer 10μl(南京尧顺禹生物科技有限公司)。快速离心后,将PCR管放入PCR仪中,进行如下反应:65℃30min,95℃5min,16℃1min,4℃。
(2)基因组DNA片段PCR扩增
以atp7b-E8-F和atp7b-E8-R为扩增引物,以步骤b得到的基因组DNA为模板,进行PCR扩增,具体反应体系和反应程序如下:
PCR反应体系(20μl):10μl 2×Mastermix、7μl的超纯水、1μl atp7b-E8-F(5μM)、1μl atp7b-E8-R(5μM)和1μl的由(1)步骤获得的基因组DNA模板。
PCR反应条件为:95℃预变性3min;95℃变性30s,56℃退火30s,72℃延伸30s,35个循环;72℃终延伸10min,4℃保存。
(3)携带atp7b突变等位基因的F1突变体的筛选鉴定
选取16尾F1代斑马鱼的基因组DNA的PCR产物分别送至商业公司(北京睿博兴科生物技术有限公司)直接进行Sanger测序,结果筛选到atp7b移码杂合突变斑马鱼(F1)12尾,4种突变体,斑马鱼编号与突变类型如表3,4种突变类型具体的序列测序结果如图3~6和表4。
表3突变体的突变类型
表4部分基因组序列及预测编码的蛋白质序列
注:加粗部分为相比野生型,突变体缺失的碱基序列,下划线部分为相比野生型,突变体插入的碱基序列,斜体部分为改变的氨基酸序列。
根据图3~6和表4可以看出,1、5、10、14的F1代斑马鱼相比野生型,自斑马鱼atp7b基因第8号外显子177bp开始出现+13bp、302bp开始出现-7bp移码杂合缺失突变;编号为2和4的F1代斑马鱼相比野生型,自斑马鱼atp7b基因第8号外显子151bp开始出现-14bp、266bp开始出现-22bp移码杂合缺失突变;编号为3和15的F1代斑马鱼相比野生型,自斑马鱼atp7b基因第8号外显子163bp开始出现-12bp+9bp、283bp开始出现-5bp+36bp移码杂合缺失突变;编号为6、8、13和16的F1代斑马鱼相比野生型,自斑马鱼atp7b基因第8号外显子158bp开始出现-1bp+7bp、295bp开始出现-21bp非移码杂合缺失突变,以上4种突变方式均可构建斑马鱼WD模型。
根据上述内容可以看出,本发明设计的sgRNA组合能够特异性敲除斑马鱼atp7b基因,选育出atp7b基因缺失型斑马鱼,构建威尔逊病斑马鱼模型。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
