制备癌症干细胞球状体的方法或试剂盒和筛选药物的方法
文献发布时间:2023-06-19 09:36:59
技术领域
本发明涉及一种用于癌症干细胞球状体的制备方法或用于制备癌症干细胞球状体的试剂盒。另外,本发明涉及一种使用通过该制备方法或试剂盒制备的癌症干细胞球状体筛选用于治疗癌细胞抗性的药物的方法。
背景技术
癌症干细胞(CSC或肿瘤起始细胞:TIC)具有许多与正常干细胞相似的特征,诸如自再生能力、内源性抗药性和分化等。自从已经在急性髓性白血病中发现了与干细胞相似的癌细胞以后,越来越多的证据表明,少量的癌症干细胞存在于主要造成肿瘤复发和抗药性的肿瘤聚集体中。因此,癌症干细胞在癌症研究和抗药性领域中引起了相当大的关注。
通常基于癌症干细胞表面标记物从患者来源的肿瘤组织分离癌症干细胞。然而,患者来源的肿瘤组织的供应有限,仅可以分离出少量的癌症干细胞,这使得癌症干细胞难以获得。可选地,已经尝试从现有的癌细胞系分离癌症干细胞,但是由于癌细胞系中包含少于1%至2%的癌症干细胞,因此确保足够量的癌症干细胞(Cell 144,646-674(2011))是不实际的。另外,由于癌细胞的三维结构可以比二维单层结构好地代表肿瘤环境,因此目前对开发用于促进癌细胞的形成的方法显示出了相当大的兴趣。用于药物筛选或功效测试的球状体目前是通过用于将细胞插入到亲水性ULA(超低附着)表面的孔、凹琼脂糖凝胶(U-底,U-bottom)或悬滴细胞基底等中的方法产生的。然而,即使通过该方法产生的球状体也不能充分地包含癌症干细胞。在这种情况下,需要开发用于在人癌细胞系中产生具有癌症形成能力的癌症干细胞球状体的简单方法。
因此,本发明人已经尝试开发用于产生癌症干细胞球状体的方法,结果,他们已经建立了用于使用包括硅氧烷聚合物的细胞培养基底和包括白蛋白的培养基产生癌症干细胞球状体的方法,从而完成了本发明。
发明内容
【技术问题】
本发明的一个实施例在于提供一种用于从癌细胞制备干细胞球状体的方法,该方法包括使用包括白蛋白的用于细胞培养的培养基来培养癌细胞。
白蛋白可以是用于将癌细胞诱导为癌症干细胞的用途、用于将癌细胞诱导为球状体的用途或者是用于将癌细胞诱导为癌症干细胞球状体的用途。
可以将癌细胞在包括硅氧烷聚合物的细胞培养基底上培养。
包括硅氧烷聚合物的细胞培养基底可以是用于将癌细胞诱导为癌症干细胞的用途、用于将癌细胞诱导为球状体的用途或者用于将癌细胞诱导为癌症干细胞球状体的用途。
本发明的另一实施例在于提供一种用于制备癌症干细胞球状体的试剂盒,试剂盒包括细胞培养基底和用于细胞培养的培养基。
细胞培养基底可以包括硅氧烷聚合物,用于细胞培养的培养基可以包括白蛋白,硅氧烷聚合物或白蛋白可以是用于将癌细胞诱导为癌症干细胞的用途、用于将癌细胞诱导为球状体的用途或者用于将癌细胞诱导为癌症干细胞球状体的用途。
本发明的另一实施例在于提供用于用于治疗癌细胞抗性的药物的筛选的方法,该方法包括:(a)通过用于制备癌症干细胞球状体的方法制备癌症干细胞球状体;(b)使用于治疗癌细胞抗性的候选物质对(a)步骤的癌症干细胞球状体进行治疗;以及(c)将其中用(b)步骤的用于治疗癌细胞抗性的候选物质治疗的癌症干细胞球状体组与其中未被用于治疗癌细胞抗性的候选物质治疗的对照组比较。
【技术方案】
具体地描述如下。同时,本申请中公开的每个描述和实施例可以应用于每个其它的描述和实施例。换句话说,本申请中公开的各种元素的所有组合落入本申请的范围内。另外,本申请的范围不被认为由下面公开的具体描述限制。
作为实现本发明的目的的一个方面,提供了一种用于从癌细胞诱导癌症干细胞的组合物,该组合物包括包含白蛋白的用于细胞培养的培养基。
白蛋白可以是(1)用于将癌细胞诱导为癌症干细胞的用途、(2)用于将癌细胞诱导为球状体的用途或者(3)用于将癌细胞诱导为癌症干细胞球状体的用途。
作为实现本发明的目的的另一方面,提供了一种用于从癌细胞制备癌症干细胞的方法,该方法包括使用用于从癌细胞诱导癌症干细胞的组合物培养癌细胞,该组合物包括包含白蛋白的用于细胞培养的培养基。
可以在细胞培养基底上培养癌细胞,细胞培养基底可以包括硅氧烷聚合物。
包括硅氧烷聚合物的细胞培养基底可以是(1)用于将癌细胞诱导为癌症干细胞的用途、(2)用于将癌细胞诱导为球状体的用途或者(3)用于将癌细胞诱导为癌症干细胞球状体的用途。
作为实现本发明的目的的其它方面,提供了一种用于制备癌症干细胞球状体的试剂盒,包括细胞培养基底以及用于从癌细胞诱导癌症干细胞的组合物,组合物包括包含白蛋白的用于细胞培养的培养基,其中,细胞培养基底包括硅氧烷聚合物,培养基包括白蛋白。
作为实现本发明的目的的其它方面,提供了一种筛选用于治疗癌细胞抗性的药物的方法,该方法包括:制备癌症干细胞球状体;使用于治疗癌细胞抗性的候选物质对癌症干细胞球状体进行治疗;以及将其中被用于治疗癌细胞抗性的候选物质治疗的癌症干细胞球状体组与其中未被用于治疗癌细胞抗性的候选物质治疗的对照组比较。
本发明人已经发现,当在包括由硅氧烷化合物形成的聚合物的细胞培养基底上在包括白蛋白的培养基中培养癌细胞时,可以以高产率制备完全地具有癌症干细胞的特性的三维癌症干细胞球状体样体内环境,从而提供本发明。
在下文中,将更详细地描述本发明。
根据本发明的一个实施例,涉及一种用于制备癌症干细胞的方法,该方法包括在包括硅氧烷聚合物的细胞培养基底上培养癌细胞。培养癌细胞的步骤可以是使用包括白蛋白的用于细胞培养的培养基来培养癌细胞。癌细胞是不具有癌症干细胞的特性的普通的癌细胞,在培养之后,其具有癌症干细胞的特性(例如,癌症干细胞标记基因的表达、体内癌症形成能力、抗药性、细胞迁移或细胞穿透等)。因此,培养癌细胞的步骤可以是使用用于从癌细胞诱导癌症干细胞的组合物来培养癌细胞,用于从癌细胞诱导癌症干细胞的组合物可以包括包含白蛋白的用于细胞培养的培养基。
用于细胞培养的培养基还可以包括氨基酸、维生素、抗氧化剂、痕量元素、蛋白质、胶原前体(collagen precursor)等。氨基酸可以包括甘氨酸、组氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、羟脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸等,但不限于此,氨基酸可以是L型氨基酸或D型氨基酸。维生素可以包括硫胺素、抗坏血酸等,但不限于此。抗氧化剂可以包括谷胱甘肽,但不限于此。痕量元素可以包括Ag
作为实现本发明的目的的一个方面,提供了一种用于从癌细胞产生癌症干细胞的方法,该方法包括使用用于从癌细胞诱导癌症干细胞的组合物培养癌细胞,组合物包括包含白蛋白的用于细胞培养的培养基。
使用包括包含白蛋白的用于细胞培养的培养基的用于从癌细胞诱导癌症干细胞的组合物培养癌细胞是使用包括包含白蛋白的用于细胞培养的培养基的组合物来培养分离的癌细胞,可以在包括环硅氧烷聚合物的细胞培养基底上执行该培养。
当细胞培养基底是线性硅氧烷基底时,由于当使用包括白蛋白的用于细胞培养的培养基(FBS)来培养癌细胞时不会形成球状体(示例7-3),因此推断当使用线性硅氧烷基底从癌细胞制备癌症干细胞球状体时,除了基底的表面功能刺激之外,培养基也影响球状体形成。
癌症干细胞球状体可以在开始培养癌细胞之后240小时内、200小时内、180小时内、150小时内、120小时内、110小时内、100小时内、96小时内、90小时内、84小时内、80小时内、72小时内、70小时内、60小时内、50小时内、40小时内、30小时内、24小时内、20小时内、12小时内、10小时内或5小时内形成。
本发明的术语“癌细胞”或“分离的癌细胞”可以是来源于人体的细胞或来源于除了人体之外的各种个体的细胞,但不限于此。另外,分离的癌细胞可以包括所有体内或体外细胞,但不限于此。具体地,分离的癌细胞可以具体地是来源于人体的各种组织的细胞,并且可以是来源于卵巢癌、乳腺癌、肝癌、脑癌、结直肠癌(colorectal cancer)、前列腺癌、宫颈癌、肺癌、胃癌、皮肤癌、胰腺癌、口腔癌、直肠癌、喉癌、甲状腺癌、甲状旁腺癌、结肠癌、膀胱癌、腹膜癌、肾上腺癌、舌癌、小肠癌、食道癌、肾盂癌、肾癌、心脏癌、十二指肠癌、输尿管癌、尿道癌、咽癌、阴道癌、扁桃体癌、肛门癌、胸膜癌、胸腺癌或鼻咽癌的癌细胞,但不限于此,其包括可以用于本发明的目的的所有癌细胞,并且包括通过活检从癌症组织或建立的细胞系分离的所有原代培养细胞,但不限于此。
另外,为了确认癌细胞,可以使用癌细胞标记物。具体地,作为标记物,可以使用AFP(甲胎蛋白)、CA15-3、CA27-29、CA19-9、CA-125、降钙素、钙网膜蛋白、CD34、CD117、结蛋白、抑制素、Myo D1、NSE(神经元特异性烯醇化酶)、PLAP(胎盘碱性磷酸酶)或PSA(前列腺特异性抗原)等,但不限于此。
本发明的术语“硅氧烷化合物”是包括硅氧烷基团(Si-O键)的化合物,并且旨在包括所有硅氧烷单体或硅氧烷聚合物。“硅氧烷聚合物”是指包括作为重复单元的硅氧烷基团的聚合物,例如,其可以包括线性硅氧烷聚合物或环状硅氧烷聚合物。硅氧烷单体或硅氧烷聚合物可以是具有化学式1的化合物,并且可以包括具有环状硅氧烷的化学式2的聚合物等。
【化学式1】
在化学式1中,
R1至R8可以彼此独立地是氢、C1-10烷基、C2-10烯基、C5-14杂环、C3-10环烷基或C3-10环烯基,并且n为0至100000的整数。例如,R1至R8可以彼此独立地是氢、甲基、乙基、丙基、亚乙基、亚丙基、乙烯基等,但不限于此。
根据本发明的一个实施例,线性硅氧烷化合物可以是选自于由二甲基硅氧烷(DMS)、四甲基二硅氧烷(TMDS)、六乙烯基二硅氧烷、六甲基二硅氧烷、八甲基三硅氧烷、十二甲基五硅氧烷、十四甲基六硅氧烷、甲基苯基硅氧烷、二苯基硅氧烷和苯基三甲基硅油组成的组中的至少一种,并且线性硅氧烷聚合物可以随着线性硅氧烷化合物的聚合形成。
根据本发明的一个实施例,硅氧烷聚合物可以是通过使用固化剂使基材化合物聚合形成的聚合物,并且基材化合物和固化剂可以以100:1至1:100、100:1至1:80、100:1至1:50、100:1至1:30、100:1至1:20、100:1至1:15、100:1至1:10、80:1至1:100、80:1至1:80、80:1至1:50、80:1至1:30、80:1至1:20、80:1至1:15、80:1至1:10、60:1至1:100、60:1至1:90、60:1至1:80、60:1至1:70、60:1至1:60、60:1至1:50、60:1至1:40、60:1至1:30、60:1至1:20、60:1至1:15、60:1至1:10、50:1至1:100、50:1至1:90、50:1至1:80、50:1至1:70、50:1至1:60、50:1至1:50、50:1至1:40、50:1至1:30、50:1至1:20、50:1至1:15或50:1至1:10的比例聚合,但不限于此。
根据本发明的一个实施例的硅氧烷聚合物可以是交联的硅氧烷化合物,并且可以是至少1%或更多、5%或更多、10%或更多、20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多或者90%或更多的交联的单体,但不限于此,具体地,由于至少1%或更多的硅氧烷化合物聚合物是交联的,因此硅氧烷聚合物可以是水不溶性的。例如,在化学式1中,R1至R8可以彼此独立地是线性硅氧烷化合物或硅氧烷聚合物,因此,化学式1的化合物可以是形成为交联的硅氧烷聚合物。
用于制备硅氧烷聚合物的基材化合物可以是由化学式1表示的硅氧烷化合物,例如,硅氧烷低聚物、二甲基硅氧烷、四甲基二硅氧烷、六乙烯基二硅氧烷、六甲基二硅氧烷、八甲基三硅氧烷、三烷氧基硅氧烷或四烷氧基硅氧烷等,并且固化剂可以是硅氧烷交联剂、金属催化剂(铂催化剂、钌催化剂等)、六亚甲基四胺、氨(NH
根据本发明的一个实施例的硅氧烷化合物可以是环状硅氧烷化合物或环硅氧烷聚合物,并且用于包括具有环硅氧烷结构作为基本结构且在其硅原子的位置处具有官能团(例如烷基、烯基等)的化合物。根据本发明的一个实施例,环硅氧烷化合物由以下化学式2表示。
【化学式2】
在该式中,A是
R1和R2彼此独立地是氢或C2-10烯基,前提条件是R1的至少两个位置是C2-10烯基;并且
R2彼此独立地是氢、C1-10烷基、C2-10烯基、卤素基团、金属元素、C5-14杂环、C3-10环烷基或C3-10环烯基。
本发明的术语“烷基”是指直链或支链、未取代或取代的饱和烃基,例如包括甲基、乙基、丙基、异丁基、戊基或己基等。C1-C10烷基是指具有1个至10个碳原子的烷基单元的烷基,当C1-C10烷基被取代时,不包括取代基的碳原子数。在此,C1-C10烷基可以是C1-C8烷基、C1-C7烷基或C1-C6烷基。
本发明的术语“烯基”表示具有指定碳原子的直链或支链、未取代或取代的不饱和烃基,例如包括乙烯基、丙烯基、烯丙基、异丙烯基、丁烯基、异丁烯基、叔丁烯基、正戊烯基和正己烯基。C2-C10烯基是指具有1个至10个碳原子的烯基单元的烯基,当C2-C10烯基被取代时,不包括取代基的碳原子数。
根据本发明的一个实施例,在此,C2-10烯基是C2-8烯基、C2-6烯基、C2-5烯基、C2-4烯基或C2-3烯基。根据本发明的一个实施例,R1的至少三个部分是C2-10烯基。根据本发明的一个实施例,环硅氧烷在R1的位置处具有n+1或n+2个C2-10烯基。例如,当n是2时,化学式1的化合物变为在R1的位置处具有3或4个C2-10烯基的环四硅氧烷。该烯基参与聚合。
本发明的术语“卤素”表示卤素元素,例如包括氟、氯、溴和碘。本发明的术语“金属元素”是指使金属单质化的元素,诸如碱金属元素(Li、Na、K、Rb、Cs、Fr)、碱土金属元素(Ca、Sr、Ba、Ra)、铝族元素(Al、Ga、In、Tl)、锡族元素(Sn、Pb)、铸币金属元素(Cu、Ag、Au)、锌族元素(Zn、Cd、Hg)、稀土元素(Sc、Y、57-71)、钛族元素(Ti、Zr、Hf)、钒族元素(V、Nb、Ta)、铬族元素(Cr、Mo、W)、锰族元素(Mn、Tc、Re)、铁族元素(Fe、Co、Ni)、铂族元素(Ru、Rh、Pd、Os、Ir、Pt)和锕系元素(89-103)等。
本发明的术语“杂环”是指部分或完全饱和的5至14元杂环环的单环类型或双环类型。N、O和S是杂原子的示例。吡咯、呋喃、噻吩、咪唑、吡唑、噁唑、异噁唑、噻唑、异噻唑、四唑、1,2,3,5-噁二唑-2-氧化物、三唑酮、噁二唑酮、异噁唑酮、噁二唑烷二酮、3-羟基吡咯-2,4-二酮、5-氧代-1,2,4-噻二唑、吡啶、吡嗪、嘧啶、吲哚、异吲哚、吲唑、酞嗪、喹啉、异喹啉、喹喔啉、喹唑啉、噌啉和咔啉是C5-14杂环的示例。
本发明的术语“环烷基”是指环烃基,这包括环丙基、环丁基和环戊基。C3-10环烷基是指具有3-10个形成环结构的碳原子的环烷基,当C3-10环烷基被取代时,不包括取代基的碳原子数。
根据本发明的一个实施例,在此,C1-C10环烷基是C1-C8环烷基、C1-C7环烷基或C1-C6环烷基。
本发明的术语“环烯基”是指具有至少一个双键的环烃基,例如包括环戊烯、环己烯和环己二烯。C3-10环烯基是指具有3-10个形成环结构的碳原子的环烯基,当C3-10环烯基被取代时,不包括取代基的碳原子数。
根据本发明的一个实施例,C2-10环烯基为C2-8环烯基、C2-6环烯基、C2-5环烯基、C2-4环烯基或C2-3环烯基。
根据本发明的一个实施例,R2彼此独立地是氢、C1-10烷基或C2-10烯基。根据一个具体示例,R2的至少两个部分或至少三个部分可以是C1-10烷基或C2-10烯基。根据一个具体示例,环硅氧烷可以在R2的位置处具有n+1或n+2个C1-10烷基或C2-10烯基。
根据本发明的一个实施例,n是1-7的整数、1-6的整数、1-5的整数、1-4的整数或1-3的整数。
根据本发明的一个实施例,环硅氧烷化合物选自于由2,4,6,8-四(C2-10)烯基-2,4,6,8-四(C1-10)烷基环四硅氧烷、1,3,5-三(C1-10)烷基-1,3,5-三(C2-10)烯基环三硅氧烷、1,3,5,7-四(C1-10)烷基-1,3,5,7-四(C2-10)烯基环四硅氧烷、1,3,5,7,9-五(C1-10)烷基-1,3,5,7,9-五(C2-10)烯基环五硅氧烷、1,3,5-三(C1-10)烷基-1,3,5-三(C2-10)烯基环三硅氧烷、1,3,5,7-四(C1-10)烷基-1,3,5,7-四(C2-10)烯基环四硅氧烷、1,3,5,7,9-五(C1-10)烷基-1,3,5,7,9-五(C2-10)烯基环五硅氧烷、1,3,5-三(C1-10)烷基-1,3,5-三(C2-10)烯基环三硅氧烷、1,3,5,7-四(C1-10)烷基-1,3,5,7-四(C2-10)烯基环四硅氧烷、1,3,5,7,9-五(C1-10)烷基-1,3,5,7,9-五(C2-10)烯基环五硅氧烷、六(C2-10)烯基环三硅氧烷、八(C2-10)烯基环四硅氧烷、十(C2-10)烯基环五硅氧烷、2,4,6,8-四乙烯基-2,4,6,8-四甲基环四硅氧烷和它们的组合组成的组。
根据一个具体示例,环硅氧烷化合物选自于由1,3,5-三乙烯基-1,3,5-三甲基环三硅氧烷、2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)、2,4,6,8,10-五甲基-2,4,6,8,10-五乙烯基环五硅氧烷、2,4,6,8,10,12-六甲基-2,4,6,8,10,12-六乙烯基环六硅氧烷、八(乙烯基倍半硅氧烷)、2,2,4,4,6,6,8,8,10,10,12,12-十二甲基环六硅氧烷、2,4,6,8-四(C2-4)烯基-2,4,6,8-四(C1-6)烷基环四硅氧烷(作为一个示例,2,4,6,8-四乙烯基-2,4,6,8-四甲基环四硅氧烷)、1,3,5-三(C1-6)烷基-1,3,5-三(C2-4)烯基环三硅氧烷(作为一个示例,1,3,5-三异丙基-1,3,5-三乙烯基环三硅氧烷)、1,3,5,7-四(C1-6)烷基-1,3,5,7-四(C2-4)烯基环四硅氧烷(作为一个示例,1,3,5,7-四异丙基-1,3,5,7-四乙烯基环四硅氧烷)、1,3,5,7,9-五(C1-6)烷基-1,3,5,7,9-五(C2-4)烯基环五硅氧烷(作为一个示例,1,3,5,7,9-五异丙基-1,3,5,7,9-五乙烯基环五硅氧烷)、1,3,5-三(C1-6)烷基-1,3,5-三(C2-4)烯基环三硅氧烷(作为一个示例,1,3,5-三仲丁基-1,3,5-三乙烯基环三硅氧烷)、1,3,5,7-四(C1-6)烷基-1,3,5,7-四(C2-4)烯基环四硅氧烷(作为一个示例,1,3,5,7-四仲丁基-1,3,5,7-四乙烯基环四硅氧烷)、1,3,5,7,9-五(C1-6)烷基-1,3,5,7,9-五(C2-4)烯基环五硅氧烷(作为一个示例,1,3,5,7,9-五仲丁基-1,3,5,7,9-五乙烯基环五硅氧烷)、1,3,5-三(C1-6)烷基-1,3,5-三(C2-4)烯基环三硅氧烷(作为一个示例,1,3,5-三乙基-1,3,5-三乙烯基环三硅氧烷)、1,3,5,7-四(C1-6)烷基-1,3,5,7-四(C2-4)烯基环四硅氧烷(作为一个示例,1,3,5,7-四乙基-1,3,5,7-四乙烯基环四硅氧烷)、1,3,5,7,9-五(C1-6)烷基-1,3,5,7,9-五(C2-4)烯基环五硅氧烷(作为一个示例,1,3,5,7,9-五乙基-1,3,5,7,9-五乙烯基环五硅氧烷)、六(C2-4)烯基环三硅氧烷(作为一个示例,六乙烯基环三硅氧烷)、八(C2-4)烯基环四硅氧烷(作为一个示例,八乙烯基环四硅氧烷)、十(C2-4)烯基环五硅氧烷(作为一个示例,十乙烯基环五硅氧烷)和它们的组合组成的组。
本发明的术语“包括硅氧烷化合物的细胞培养基底”可以是指由硅氧烷形成的聚合物是细胞培养基底(例如,其表面涂覆有聚合物的细胞培养基底)的一部分,也可以是指由硅氧烷形成的固体聚合物自身可以用作细胞培养基底,但不限于此。
细胞培养基底足以提供能够培养细胞的任何空间,并且其形状不受限制。例如,细胞培养基底可以是皿(培养皿)、小屋或板(例如,6孔、24孔、48孔、96孔、384孔或9600孔微量滴定板、微量板、浸渍孔板等)、烧瓶、室载玻片、试管、细胞工厂、滚瓶、旋转瓶、中空纤维、微载体、珠粒等,但不限于此,具有支撑性质的任何材料可以不受限制地用作细胞培养基底,例如,塑料(例如,聚苯乙烯、聚乙烯、聚丙烯等)、金属、硅和玻璃等可以用作细胞培养基底。
另外,由硅氧烷化合物形成的聚合物用作包括以下全部的意义:(1)通过使均相的硅氧烷化合物聚合形成的均聚物;(2)通过使非均相的硅氧烷化合物聚合形成的共聚物;以及(3)通过使均相的或非均相的硅氧烷化合物与其它单体化合物聚合形成的共聚物。在此,共聚物可以是无规共聚物、嵌段共聚物、交替共聚物或接枝共聚物,但不限于此。
因此,根据本发明的一个实施例,由硅氧烷化合物形成的聚合物是通过使均相的硅氧烷化合物聚合形成的均相聚合物,例如,可以是通过使均相的线性硅氧烷化合物聚合形成的均相聚合物,或者通过使均相的环硅氧烷化合物聚合形成的均相聚合物。
根据本发明的另一个实施例,由硅氧烷化合物形成的聚合物是由作为硅氧烷化合物的第一单体和可以与其聚合的第二单体形成的共聚物,例如,可以是由作为线性硅氧烷化合物的第一单体和可以与其聚合的第二单体形成的共聚物,或者是由作为环硅氧烷化合物的第一单体和可以与其聚合的第二单体形成的共聚物。
根据一个具体示例,第二单体是与第一单体不同的硅氧烷化合物(由非均相的硅氧烷化合物形成的共聚物,例如,由非均相的线性硅氧烷化合物形成的共聚物、由非均相的环硅氧烷化合物形成的共聚物或者由非均相的线性硅氧烷化合物和环硅氧烷化合物形成的共聚物)。
根据另一具体示例,第二单体是具有用于与第一单体聚合的碳双键的化合物。然后,第一单体也可以具有用于与第二单体聚合的碳双键。这样的第二单体化合物可以是例如选自于由具有乙烯基的硅氧烷(例如,六乙烯基二硅氧烷、四甲基二硅氧烷等)、甲基丙烯酸酯类单体、丙烯酸酯类单体、芳香族乙烯基类单体(例如,二乙烯基苯、苯甲酸乙烯酯、苯乙烯等)、丙烯酰胺类单体(例如,N-异丙基丙烯酰胺、N,N-二甲基丙烯酰胺等)、马来酸酐、具有乙烯基的硅氮烷或环硅氮烷(例如,2,4,6-三甲基-2,4,6-三乙烯基环硅氮烷等)、具有乙烯基的C3-10环烷烃(例如,1,2,4-三乙烯基环己烷等)、乙烯基吡咯烷酮、乙酰乙酸2-(甲基丙烯酰氧基)乙酯、1-(3-氨基丙基)咪唑、乙烯基咪唑、乙烯基吡啶、具有乙烯基的硅烷(例如,烯丙基三氯硅烷、丙烯酰氧基甲基三甲氧基硅烷等)和它们的组合组成的组。
根据其它具体示例,第二单体可以是选自于由1,3,5-三乙烯基-1,3,5-三甲基环三硅氧烷、2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)、2,4,6,8,10-五甲基-2,4,6,8,10-五乙烯基环五硅氧烷、2,4,6,8,10,12-六甲基-2,4,6,8,10,12-六乙烯基环六硅氧烷、八(乙烯基倍半硅氧烷)和2,2,4,4,6,6,8,8,10,10,12,12-十二甲基环六硅氧烷组成的组中的至少一种。
甲基丙烯酸酯类单体包括例如甲基丙烯酸酯、甲基丙烯酸、甲基丙烯酸缩水甘油酯、全氟甲基丙烯酸酯、甲基丙烯酸苄酯、甲基丙烯酸2-(二甲基氨基)乙酯、甲基丙烯酸四氢糠酯(perfurilmethacrylate)、3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟癸基甲基丙烯酸酯、甲基丙烯酸己酯、甲基丙烯酸酐、甲基丙烯酸五氟苯酯、甲基丙烯酸炔丙酯、四氢过环丙基甲基丙烯酸酯(tetrahydroperperillmethacrylate)、甲基丙烯酸丁酯、甲基丙烯酰氯和甲基丙烯酸二(乙二醇)甲酯等。
丙烯酸酯类单体包括例如丙烯酸酯、丙烯酸-2-(二甲基氨基)乙酯、乙二醇丙烯酸酯、1H,1H,7H-十二氟庚基丙烯酸酯、1H,1H,7H-十二氟庚基丙烯酸酯、丙烯酸异冰片酯、1H,1H,2H,2H-全氟癸基丙烯酸酯、丙烯酸四氢过糠酯(tetrahydroperfurilacrylate)、聚(乙二醇)二丙烯酸酯、1H,1H,7H-十二氟庚基丙烯酸酯和丙烯酸炔丙酯等。
本发明的共聚物还可以包括除了在此提及的单体之外的单体作为共聚单体。
根据本发明的一个实施例,共聚物包含至少50%或更多的硅氧烷化合物。根据一个具体示例,共聚物包含至少60%或更多、70%或更多、80%或更多或者90%或更多的硅氧烷化合物。该含量基于流速(单位:sccm),90%是指包含在通过以9:1(硅氧烷化合物:其它单体)的流速流动(滴加)每种单体形成的共聚物中的硅氧烷化合物的含量,80%、70%和60%是指包括在通过以8:1、7:1和6:1的流速流动形成的共聚物中的硅氧烷化合物的含量。
另外,包括聚合物的细胞培养基底可以是包括具有各种厚度的聚合物的细胞培养基底。聚合物的厚度可以是例如约10nm、11nm、12nm、13nm、14、15nm、16nm、17nm、18nm、19nm、20nm、21nm、22nm、23nm、24nm、25nm、26nm、27nm、28nm、29nm、30nm、31nm、32nm、33nm、34nm、35nm、36nm、37nm、38nm、39nm、40nm、41nm、42nm、43nm、44nm、45nm、46nm、47nm、48nm、49nm、50nm、60nm、70nm、80nm、90nm、100nm、200nm、300nm或更大,或者约10000nm、5000nm、1000nm、900nm、800nm、700nm、600nm、500nm、400nm、300nm或更小,或者约10nm至300nm、10nm至500nm、10nm至1000nm、50nm至300nm、50nm至500nm、50nm-1000nm,但不限于此。
根据本发明的一个实施例的包括硅氧烷聚合物的细胞培养基底可以具有160°或更大、150°或更大、140°或更大、130°或更大、120°或更大、110°或更大、100°或更大、90°或更大、80°或更大、70°或更大、60°或更大、50°或更大、40°或更大、30°或更大、20°或更大或者10°或更大的水接触角。
在用于从癌细胞制备癌症干细胞的方法中,包括使用包含白蛋白的用于细胞培养的培养基培养癌细胞,癌症干细胞可以呈球状体形式。该方法的特征在于可以不包括已知用于附加的基因操纵或干细胞增殖或者已知将干细胞与成体细胞区分开的任何其它化合物。用于细胞培养的培养基可以不包括除了白蛋白之外的其它生长因子。
术语“球状体”是指通过聚集1000个或更多个单细胞形成三维球状体形式的细胞聚集体,由于它可以更准确地复制人体中围绕细胞的三维组织的结构和物理性质,因此其有效地用在治疗和研究领域中,出于本发明的目的,球状体的特征在于癌症干细胞球状体。
另外,本发明的术语“癌症干细胞(或肿瘤起始细胞)”是指具有产生肿瘤的能力的细胞,癌症干细胞具有与正常干细胞相似的特性。癌症干细胞通过作为干细胞在各种细胞类型中的特性的自再生和分化引起肿瘤,因此它具有癌症形成能力。通过使新的肿瘤因癌症形成能力区别于肿瘤中的其它群组,成为复发和转移的原因。另外,作为癌症干细胞的另一特性,它具有抗药性,因此它对诸如抗癌剂的使用等的化学疗法具有抗性,因此仅去除普通的癌细胞,癌症干细胞残留而不死亡,癌症会再次复发。因此,为了彻底地治愈癌症,研究癌症干细胞是重要的。
此外,为了确认癌症干细胞,可以使用癌症干细胞标记物。癌症干细胞标记物可以是CD47、BMI-1、CD24、CXCR4、DLD4、GLI-1、GLI-2、PTEN、CD166、ABCG2、CD171、CD34、CD96、TIM-3、CD38、STRO-1和CD19,具体地,它可以是CD44、CD133、ALDH1A1、ALDH1A2、EpCAM、CD90和LGR5,但不限于此。
由于制备球状体不需要人工基因操作,因此本发明的用于制备癌症干细胞球状体的制备方法和试剂盒具有能够更简单地和快速地制备癌症干细胞的优点。
另外,已经确认通过该方法和试剂盒制备的癌症干细胞(CSC)标记基因被表达(示例6),具有通过药物释放的抗药性质,并且具有体内癌症形成能力(示例12),因此通过本发明的方法和试剂盒制备的癌症干细胞球状体可以用于研究癌症干细胞且通过具有癌症干细胞的性质来筛选其治疗剂。
本发明的癌症干细胞球状体可以以三维、立体培养形式培养,并且可以是具有抗药性的特性或是癌细胞来源的患者特异性的癌症干细胞球状体,但不限于此。
本发明的术语“白蛋白”由具有球蛋白的细胞的基本物质组成,它包括在本发明的细胞培养基底中铺平的癌细胞的培养基中,并且包括但不限于能够从癌细胞形成癌症干细胞球状体的物质。本发明的白蛋白可以选自于由血清白蛋白、卵白蛋白(ovalbumin,或卵清蛋白)、乳白蛋白(lactalbumin,乳清蛋白)和它们的组合组成的组,但不限于此。作为示例,也包括商业可得的血清替代物(SR),但不限于此。大多数细胞需要血清以增殖,并且可以使用可以执行与天然血清相同或相似功能的人工血清或血清替代物。人工血清或血清替代物可以在细胞培养中用作用于天然血清的替代物,并且它通常包含白蛋白。本发明的白蛋白可以作为白蛋白的单一组分添加,或者作为包括在血清替代物中的制剂、通过将白蛋白进一步添加到血清替代物中制备的制剂或通过将白蛋白另外添加到FBS中制备的制剂提供,更优选地,它可以作为其中将白蛋白进一步添加到血清替代物中的制剂提供,但不限于此。另外,血清白蛋白可以根据其来源选自于由牛血清白蛋白、人血清白蛋白和它们的组合组成的组,但不限于此。在此,已经确认使用牛血清白蛋白制备的球状体使癌症干细胞相关的标记物表达(示例6),因此可以看出白蛋白可以诱导癌症干细胞。
白蛋白浓度可以以0.1mg/mL至500mg/mL的浓度包括在培养基中。具体地,白蛋白浓度可以以约0.1mg/mL、0.2mg/mL、0.5mg/mL、0.6mg/mL、1mg/mL、1.1mg/mL、2mg/mL、3mg/mL、4mg/mL、5mg/mL、6mg/mL、11mg/mL、16mg/mL、21mg/mL、26mg/mL、31mg/mL、36mg/mL、41mg/mL、46mg/mL、51mg/mL、56mg/mL、61mg/mL、66mg/mL、71mg/mL、76mg/mL、81mg/mL、86mg/mL、91mg/mL、96mg/mL、100mg/mL、101mg/mL、106mg/mL、111mg/mL、116mg/mL、121mg/mL、126mg/mL、131mg/mL、136mg/mL、141mg/mL、146mg/mL或更高,或者约500mg/mL、450mg/mL、400mg/mL、350mg/mL、300mg/mL、250mg/mL、200mg/mL、199mg/mL、195mg/mL、190mg/mL、175mg/mL、170mg/mL、150mg/mL、149mg/mL、144mg/mL、139mg/mL、134mg/mL、129mg/mL、124mg/mL、119mg/mL、114mg/mL、109mg/mL、104mg/mL、99mg/mL、94mg/mL、89mg/mL、84mg/mL、79mg/mL、74mg/mL、69mg/mL、64mg/mL、59mg/mL、54mg/mL、49mg/mL、44mg/mL、39mg/mL、34mg/mL、29mg/mL、24mg/mL、19mg/mL、14mg/mL、9mg/mL、4mg/mL、1.4mg/mL、0.9mg/mL、0.4mg/mL或更低,更具体地,约0.1mg/mL至约500mg/mL、约0.5mg/mL至约500mg/mL、约1mg/mL至约500mg/mL、约5mg/mL至约500mg/mL、约10mg/mL至约500mg/mL、约20mg/mL至约500mg/mL、约40mg/mL至约500mg/mL、约0.1mg/mL至约400mg/mL、约0.5mg/mL至约400mg/mL、约1mg/mL至约400mg/mL、约5mg/mL至约400mg/mL、约10mg/mL至约400mg/mL、约20mg/mL至约400mg/mL、约40mg/mL至约400mg/mL、约0.1mg/mL至约300mg/mL、约0.5mg/mL至约300mg/mL、约1mg/mL至约300mg/mL、约5mg/mL至约300mg/mL、约10mg/mL至约300mg/mL、约20mg/mL至约300mg/mL、约40mg/mL至约300mg/mL、约0.1mg/mL至约200mg/mL、约0.5mg/mL至约200mg/mL、约1mg/mL至约200mg/mL、约5mg/mL至约200mg/mL、约10mg/mL至约200mg/mL、约20mg/mL至约200mg/mL、约40mg/mL至约200mg/mL、约0.1mg/mL至约150mg/mL、约0.5mg/mL至约150mg/mL、约1mg/mL至约150mg/mL、约5mg/mL至约150mg/mL、约10mg/mL至约150mg/mL、约20mg/mL至约150mg/mL、约40mg/mL至约150mg/mL、约0.1mg/mL至约100mg/mL、约0.5mg/mL至约100mg/mL、约1mg/mL至约100mg/mL、约5mg/mL至约100mg/mL、约10mg/mL至约100mg/mL、约20mg/mL至约100mg/mL、约40mg/mL至约100mg/mL、约0.1mg/mL至约80mg/mL、约0.5mg/mL至约80mg/mL、约1mg/mL至约80mg/mL、约5mg/mL至约80mg/mL、约10mg/mL至约80mg/mL、约20mg/mL至约80mg/mL、约40mg/mL至约80mg/mL、约0.1mg/mL至约70mg/mL、约0.5mg/mL至约70mg/mL、约1mg/mL至约70mg/mL、约5mg/mL至约70mg/mL、约10mg/mL至约70mg/mL、约20mg/mL至约70mg/mL、约40mg/mL至约70mg/mL、约0.1mg/mL至约60mg/mL、约0.5mg/mL至约60mg/mL、约1mg/mL至约60mg/mL、约5g/mL至约60mg/mL、约10mg/mL至约60mg/mL、约20mg/mL至约60mg/mL、约40mg/mL至约60mg/mL、约0.1mg/mL至约50mg/mL、约0.5mg/mL至约50mg/mL、约1mg/mL至约50mg/mL、约5mg/mL至约50mg/mL、约10mg/mL至约50mg/mL、约20mg/mL至约50mg/mL、约40mg/mL至约50mg/mL、约0.1mg/mL至约40mg/mL、约0.5mg/mL至约40mg/mL、约1mg/mL至约40mg/mL、约5mg/mL至约40mg/mL、约10mg/mL至约40mg/mL、约20mg/mL至约40mg/mL或约40mg/mL的浓度包括在培养基中,并且可以以包括在血清替代物中的白蛋白的浓度包括在培养基中,但不限于此。更优选地,白蛋白浓度可以以0.1mg/mL至400mg/mL或0.1mg/mL至200mg/mL的浓度包括在培养基中。进一步优选地,白蛋白浓度可以以0.1mg/mL至400mg/mL、0.1mg/mL至300mg/mL、0.5mg/mL至400mg/mL、0.5mg/mL至200mg/mL或0.5mg/mL至100mg/mL的浓度包括在培养基中。
在此,术语“约”包括±0.5、±0.4、±0.3、±0.2、±0.1等的全部,并且约包括与该术语后面的数值相等或相似的全部数值,但不限于此。
在此,术语“培养”是指在适当地控制的环境条件下使细胞生长,本发明的培养过程可以根据本领域已知的合适培养基和培养条件引导。本领域技术人员可以根据所选择的细胞调整和使用该培养过程。具体地,在此,为了制备癌症干细胞球状体,可以在包含白蛋白的培养基中对其培养,作为示例,可以在包含血清替代物(SR)的培养基中对其培养,但不限于此。
本发明的另一方面提供了通过制备的方法制备的癌症干细胞球状体。“癌症干细胞”和“球状体”如上所述。
本发明的另一方面涉及一种用于制备癌症干细胞球状体的试剂盒,试剂盒包括包含硅氧烷聚合物的细胞培养基底和包含白蛋白的用于细胞培养的培养基。用于细胞培养的培养基可以将癌细胞诱导为癌症干细胞球状体,因此本发明的一个示例涉及一种用于制备癌症干细胞球状体的试剂盒,试剂盒包括包含硅氧烷聚合物的细胞培养基底以及用于从癌细胞诱导癌症干细胞球状体的组合物,并且用于从癌细胞诱导癌症干细胞的组合物可以包括包含白蛋白的用于细胞培养的培养基。
“包括硅氧烷聚合物的细胞培养基底”、“白蛋白”、“癌症干细胞”和“球状体”如上所述。
本发明的试剂盒可以制备癌症干细胞球状体。试剂盒可以包括细胞培养基底和培养基作为基本组成,具体地,细胞培养基底可以是包括由硅氧烷化合物形成的聚合物的基底,但是包括但不限于可以制备或培养癌症干细胞球状体的任何基底。另外,培养基可以具体地是包含白蛋白的培养基或包含血清替代物的培养基,但是包括但不限于可以制备或培养癌症干细胞球状体的任何培养基。在试剂盒中,还可以包括针对用于制备癌症干细胞球状体的方法的说明。
本发明的另一方面提供了一种筛选用于治疗癌细胞抗性的药物的方法,包括(a)通过制备的方法制备癌症干细胞球状体;(b)使用于治疗癌细胞抗性的候选物质对(a)步骤的癌症干细胞球状体进行治疗;以及(c)将其中被(b)步骤的用于治疗癌细胞抗性的候选物质治疗的癌症干细胞球状体组与其中未被用于治疗癌细胞抗性的候选物质治疗的对照组比较。“癌症干细胞”和“球状体”如上所述。
(c)步骤的将其中被用于治疗癌细胞抗性的候选物质治疗的癌症干细胞球状体组与其中未被用于治疗癌细胞抗性的候选物质治疗的对照组比较可以包括测量和比较癌症干细胞标记物的表达水平,测量癌症干细胞标记物的表达水平可以不受限制地使用本领域中使用的用于测量表达水平的常用方法,作为示例,有蛋白质印迹法、ELISA、放射免疫检定法、放射免疫扩散、子宫免疫扩散、火箭免疫电泳、免疫组织染色、免疫沉淀测定、补体固定测定、FACS或蛋白质芯片法等。
本发明的术语“候选物质”是预期治疗癌症的物质或预期改善其预后的物质,具体地,“候选物质”可以是能够通过去除癌症干细胞且抑制癌细胞抗性来治疗癌症或改善预后的物质,并且包括但不限于预期直接地或间接地增强或改善癌症或癌症干细胞的任何物质。候选物质的示例包括所有预测的治疗物质,诸如化合物、基因或蛋白质等。本发明的筛选方法可以确认在候选物质的施用之前和之后的癌症干细胞标记物的表达水平,并且,当与候选物质的施用之前相比表达水平降低时,还将相应的候选物质确定为用于癌症干细胞或癌细胞抗性的预测的治疗剂。
另外,(b)步骤还可以包括用具有抗性的药物治疗,但不限于此。
【有益效果】
本发明的用于产生癌症干细胞球状体的产生方法和试剂盒可以便利地产生癌症干细胞球状体,通过该方法和试剂盒制备的癌症干细胞球状体可以有效地用于筛选用于治疗癌细胞抗性的药物。
附图说明
图1a至图1f示出了用于PTF制造的化合物的结构,图1g至图1l示出了各种环硅氧烷化合物的结构,图1m是示出了在特定PTF表面上形成具有癌症形成能力的球状体的过程的图,图1n是确认在各种功能性PTF上形成具有癌症形成能力的球状体的图,图1o至图1t是示出了在包括各种环硅氧烷化合物的基底上形成球状体的图。
图1u是示出了根据通过铂基催化剂的交联聚合反应的硅氧烷低聚物和硅氧烷交联剂的结构及其通用聚合物(PDMS)的结构的反应式。
图1v是示出了根据通过铂基催化剂的交联聚合反应的环硅氧烷和二甲基硅氧烷的结构及其共聚物的结构的反应式。
图1w是确认球状体是否形成在常规TCP和包括各种硅氧烷化合物的基底上的图。
图1x是示出了不同比例的二甲基硅氧烷低聚物与交联剂之间的混合溶液的交联聚合和固化反应的结果的图。
图1y是示出了在24小时内在包括以各种比例(50:1、100:1和1:10)的二甲基硅氧烷化合物的基底的表面上形成球状体的图。
图1z是示出了在包括2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)和1,1,3,3-四甲基二硅氧烷(TMDS)类化合物的细胞培养基底上形成球状体的图。
图2a是确认各种人癌细胞系是否在pV4D4 PTF的表面上形成球状体的图。
图2b是确认各种人癌细胞系是否在pV4D4 PTF的表面上形成任何类型的球状体的图。
图2c是确认各种人癌细胞系的PDMS PF表面上的球状体形成和形貌的图。
图3a是示出了V4D4单体和pV4D4 PTF的FT-IR光谱的图,图3b是示出了pV4D4 PTF的XPS测量扫描的结果的图,图3c是示出了未涂覆的Si晶圆、pV4D4涂覆的Si晶圆、未涂覆的细胞培养基底和pV4D4涂覆的细胞培养基底的水接触角的图,图3d是示出了未涂覆的TCP和pV4D4涂覆的TCP的AFM图像的图。
图4是确认在具有10nm、50nm、100nm、200nm和300nm的PTF厚度的pV4D4涂覆的TCP上形成球状体的图。
图5a是示出了在包含FBS和SR的各种培养基中培养的细胞的CD133和CD44的表达水平的图,图5b是通过蛋白质印迹法确认FBS和SR的白蛋白含量的图。
图6a是示出了根据包括在无血清培养基(SFM)中的BSA的浓度的球状体形成的图像,图6b是示出了根据BSA的浓度的CD133表达水平的图。
图7a是示出了在TCP或pV4D4中在包含40mg/mL的FBS、SR或BSA的无血清培养基(SFM)中培养的细胞的CD133表达水平的图。
图7b是示出了在pV4D4中在包含BSA的无血清培养基(SFM)中培养的三种癌细胞的球状体形成的图。
图7c是示出了CD133的表达水平的图,CD133是在包括各种环硅氧烷化合物的基底中产生的球状体的癌症干细胞标记基因,在图7c的x轴中,1g示出了在其中pV4D4和图1g的环硅氧烷化合物共聚的基底中产生的癌症干细胞球状体的CD133表达,1h示出了在其中pV4D4和图1h的环硅氧烷化合物共聚的基底中产生的癌症干细胞球状体的CD133表达,1i示出了在其中pV4D4和图1i的环硅氧烷化合物共聚的基底中产生的癌症干细胞球状体的CD133表达,1j示出了其中pV4D4和图1j的环硅氧烷化合物共聚的基底中产生的癌症干细胞球状体的CD133表达,1k示出了在其中pV4D4和图1k的环硅氧烷化合物共聚的基底中产生的癌症干细胞球状体的CD133表达,1l示出了在其中pV4D4和图1l的环硅氧烷化合物共聚的基底中产生的癌症干细胞球状体的CD133表达。
图7d是示出了根据各种白蛋白浓度在包括环硅氧烷聚合物的基底中培养SKOV3之后测量CD133表达水平的图。
图7e是示出了根据白蛋白的浓度,在包括环硅氧烷化合物的基底中,通过在添加BSA以使在SFM培养基中的白蛋白的浓度是0、0.01mg/mL、0.1mg/mL、1mg/mL、10mg/mL、100mg/mL、200mg/mL和400mg/mL的培养基中培养癌细胞来形成的球状体的CD133的表达水平的图。
图7f是确认通过使用FBS或SR作为培养基在PDMS基底上培养卵巢癌细胞系(SKOV3)形成球状体的图。
图7g是示出了在常规TCP和包括二甲基硅氧烷化合物(10:1)的基底上通过在其中添加了各种浓度(0mg/mL、5mg/mL、10mg/mL、20mg/mL和40mg/mL)的白蛋白(BSA)的SR培养基和FBS培养基上培养癌细胞形成的球状体的图。
图7h是示出了基于GAPDH(持家基因),在PDMS表面上培养8天的T47D-ssiCSC球状体的CSC相关的标记物的mRNA表达水平的图。
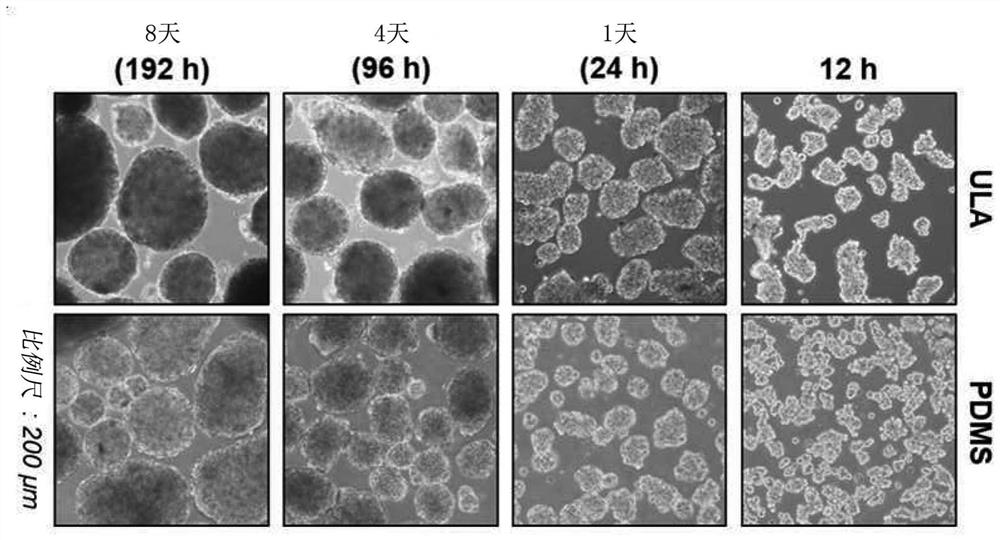
图8a是示出了使用悬滴、U-底、ULA和pV4D4产生的SKOV3球状体的形状的图。
图8b是示出了在ULA表面或pV4D4表面上产生的SKOV3球状体中的层粘连蛋白表达模式的图,红色表示层粘连蛋白,蓝色表示核。
图8c是示出了使用悬滴、U-底、ULA和pV4D4产生的SKOV3球状体的ALDH1A1 mRNA表达水平的图。
图8d是示出了pV4D4表面上的SKOV3-ssiCSC(4天和8天)中的Oct3/4、Sox2和NanogmRNA表达水平的图。
图8e是示出了使用ULA和PDMS制备的SKOV3球状体的形成的形貌的图。
图8f是通过定量实时PCR分析对通过在PDMS上培养制备的SKOV3球状体确认已知作为CSC标记物的CD133的表达显著地增加的图。
图8g是通过定量实时PCR分析对通过在PDMS上培养制备的SKOV3球状体确认已知作为CSC标记物的ALDH1A1的表达显著地增加的图。
图8h是确认作为Wnt/β-联蛋白信号传导途径的主要抑制因子的Dickkopf相关蛋白和已知通常在癌症干细胞中激活的CSC标记物的表达在通过在PDMS上培养制备的SKOV3球状体中显著地降低的图。
图8i是确认与在TCP上生长的2D培养的SKOV3对照组相比,在通过在PDMS上培养制备的SKOV3球状体中,作为典型的自再生基因的Oct3/4、Sox2和Nanog的表达显著地增加的图。
图9是示出了在pV4D4表面上产生的SKOV3-ssiCSC的伤口愈合测定(a)和侵袭测定(b)的结果的图。
图10是确认通过SKOV3-ssiCSC和U87MG-ssiCSC的球状体形成的图。
图11a至图11c是示出了在pV4D4表面上培养4天和8天的SKOV3-ssiCSC球状体、MCF-7-ssiCSC球状体、Hep3B-ssiCSC球状体和SW480-ssiCSC球状体中的CSC相关的标记物mRNA表达水平(图11a和图11b)和流式细胞术结果(图11c)的图。
图12a和图12b是示出了在pV4D4表面上培养4天和8天的SKOV3-ssiCSC球状体、MCF-7-ssiCSC球状体、Hep3B-ssiCSC球状体和SW480-ssiCSC球状体的侧群测定结果(图12a)和对阿霉素的细胞活力(图12b)的图,图12c是示出了在其中SW480-ssiCSC传代一次或两次的细胞中对阿霉素的细胞活力的图,图12d是示出了通过培养8天产生的SKOV3-ssiCSC的药物释放ABC转运蛋白相关的基因的mRNA表达水平的图。
图13a是示出了通过将SKOV3-ssiCSC球状体来源的细胞施用到BABL/c裸鼠形成肿瘤的过程的图,图13b是示出了肿瘤转移的肝脏的图,图13c是对肿瘤转移的肝脏进行H&E染色且观察它的图,图13d是示出了在其中注射了SKOV3-ssiCSC球状体来源的细胞的BABL/c裸鼠的肝脏中转移的病变的图,图13e是对肿瘤转移的肝脏进行TNC染色且观察它的图。
图14a示出了SKOV3-ssiCSC球状体(n=46)的Wnt靶基因的热图,图14b示出了SKOV3-ssiCSC中DKK1的表达(1天、4天和8天)水平以及SKOV3-ssiCSC中AXIN2和MMP-2mRNA的表达(4天和8天)水平,图14c示出了SKOV3-ssiCSC的磷酸化β-联蛋白和整个β-联蛋白的蛋白质印迹结果(4天和8天),图14d是示出了SKOV3-ssiCSC的细胞中β-联蛋白的位置的图,图14e是示出了SKOV3-ssiCSC中TNC表达的图。
图15a是示出了MCF-7-ssiCSC球状体、Hep3B-ssiCSC球状体和SW480-ssiCSC球状体中的TNC表达水平的图,图15b是示出了DKK1 mRNA表达水平的图。
图16a是示出了用显微镜观察通过在包括环硅氧烷化合物的基底上在添加BSA的FBS培养基中培养癌细胞形成的球状体的图。
图16b是示出了基于β-肌动蛋白(持家基因),通过在包括环硅氧烷化合物的基底上在添加BSA的FBS培养基中培养癌细胞形成的球状体的DKK-1基因表达水平的图。
图16c是示出了基于GAPDH(持家基因),通过在包括环硅氧烷化合物的基底上在添加BSA的FBS培养基中培养癌细胞形成的球状体的DKK-1基因表达水平的图。
具体实施方式
在下文中,将通过参考示例、对比示例和示例更详细地描述本发明。然而,这些参考示例、对比示例和示例旨在示例性地说明本发明,但本发明的范围不限于这些参考示例、对比示例和示例。
参考示例1:异源肿瘤形成分析
雌性BALB/c裸鼠(6周)从东方生物工程有限公司(Orient Bio Inc.)获得,并且在无菌条件下储存在韩国高级科学技术研究所(Korea Advanced Institute of Scienceand Technology)的动物实验室中。将小鼠随机地分配在随机实验组中。所有操作在异氟醚麻醉下进行,为了伦理程序和科学管理,所有动物相关的程序由韩国高级科学技术研究所、机构动物护理和使用委员会(KAIST-IACUC)审查和批准(批准号:KA2014-21)。
另外,为了制备人卵巢癌异源模型,将不同系列浓度(10
参考示例2:细胞活力分析
使用胰蛋白酶(TrypLE Express,Gibco)分离由不同种类的癌细胞(SKOV3、MCF-7、Hep3B和SW480)制备的ssiCSC球状体,用D-PBS洗涤分离的细胞两次。将ssiCSC铺在96孔板(1×10
参考示例3:组织学分析和免疫组化
将从接种了2D对照组或SKOV3-ssiCSC癌细胞的BALB/c裸鼠获得的肝活检样品用10%福尔马林固定、脱水且用石蜡包埋,切成5μm厚度的样品,并放置在载玻片上。使样品脱蜡且用苏木精%伊红(H&E)染色,用于用标准光学显微镜(Eclipse 80i,Nickon)进行组织学评价。
用石蜡包埋组织且使其破碎(5μm)之后,通过免疫组化法确认肝转移。将破碎的肝组织用10mM的柠檬酸钠缓冲液(pH 6.0)灭菌用于抗原恢复,用包含5%的牛血清白蛋白(BSA)和1%的山羊血清的PBS封闭,然后与兔抗人TNC一抗(20μg/mL;目录号AB19011;Millipore)在室温(RT)下孵育1小时。孵育后,用D-PBS洗涤载玻片,与生物素附着的抗兔二抗(1:200;Vector Laboratories)在室温下孵育30分钟,然后与HRP(辣根过氧化物酶,1:500,Vector)在室温下孵育30分钟。使用底物(3,3-二氨基联苯胺(Vector Laboratories))使免疫反应性蛋白可视化,然后使用苏木精复染。
参考示例4:蛋白质印迹分析
将2D对照SKOV3细胞和SKOV3-ssiCSC球状体用包含蛋白酶抑制混合物的RIPA溶解缓冲液(ThermoFisher Scientific)在冰上溶解30分钟。使用Bradford蛋白质分析试剂盒(Bio-Rad),使溶解产物的蛋白质定量,使用Bolt4-12%Bis-Tris Plus聚丙烯酰胺凝胶(ThermoFisher Scientific)通过电泳分离等量的蛋白质(50μg)。根据制造商的说明,使用iBlot2转移系统(ThermoFisher Scientific)将凝胶干印迹在PVDF(聚偏二氟乙烯)膜上。
PVDF膜通过与兔抗磷酸-β-联蛋白一抗(1:1000,目录号9561;Cell SignalingTechnology)、鼠抗β-联蛋白抗体(1:1000,目录号13-8400;Invitrogen)和兔抗GAPDH抗体(1:1000,目录号25778;Santa Cruz Biotechnology)孵育进行蛋白质印迹,然后使用标准程序,将其与HRP结合的抗兔IgG二抗(1:5000,目录号31460;Invitrogen)或抗鼠IgG二抗(1:5000,目录号31430;Invitrogen)适当地孵育。使用SuperSignal West Pico化学发光底物(ThermoFisher Scientific)和ChemiDoc MP系统(Bio-Rad)使蛋白质可视化。
参考示例5:流式细胞术
如下进行流式细胞术。具体地,在用胰蛋白酶处理作为单层培养(培养8天)的2D对照癌细胞和与其对应的ssiCSC球状体之后,分别用缓冲液[包含1%FBS(胎牛血清)的D-PBS]分离细胞。用APC(别藻蓝蛋白)偶联的抗CD133一抗(1:100;eBioScience)、FITC偶联的抗CD44一抗(1:200;BD Biosciences)、PE(藻红蛋白)偶联的抗CD90一抗(1:100,MACS;Miltenyi Biotec)和FITC偶联的抗CD133一抗(1:100;Miltenyi Biotec)使SKOV3癌细胞、MCF-7癌细胞、Hep3B癌细胞和SW480癌细胞染色,并且使用流式细胞术系统(BD Calibur和BD LSR Fortessa)进行分析。
另外,对于侧群测定,使用胰蛋白酶分离2D对照癌细胞和ssiCSC,在包含2%FBS和10mM HEPES缓冲液的DMEM中用Hoechst 33342(ThermoFisher Scientific)在37℃下进行染色90分钟。然后,用包含2%FBS的HBSS洗涤细胞且使用流式细胞术系统(BD LSRFortessa)分析。使用FlowJo软件(Tree Star Inc.)分析流式细胞术数据直方图和图。
参考示例6:活细胞成像
使用LumaScope 620系统(Etaluma)对ssiCSC球状体成像从而在标准培养箱(加湿5%二氧化碳,37℃)中进行实时成像。使用10x物镜每2.5分钟观察相位差图像持续24小时。
参考示例7:RNA提取和mRNA测序
根据制造商的协议,使用磁性mRNA分离试剂盒(NEB)从SKOV3球状体和2D对照SKOV3细胞提取mRNA,SKOV3球状体和2D对照SKOV3细胞在pV4D4涂覆的板上培养8天。如制造商的协议中所描述的,使用DNA酶处理的mRNA和NEXTflex快速定向mRNA-Seq试剂盒(BIOO),制造文库。在HiSeq2500系统中使用单端法(50-bp读段)对每个文库进行测序。使用STAR校准器(v.2.4.0)61将测序的结果与人类基因组(Hg19版本)进行比较。
另外,为了研究DEG,使用HOMER软件算法和DESeq R软件包。分别使用R统计编程语言v.3.3.0(http://www.r-project.org/)的谱图函数和plotMA函数使热图和MA图可视化。
参考示例8:免疫细胞化学的免疫染色法
将SKOV3球状体从ULA板和pV4D4板转移到1.5-mL试管中,在4%多聚甲醛溶液(Sigma)中在室温下孵育30分钟以固定球状体。将固定的球状体在包含0.25%(w/v)TritonX-100(Sigma)的D-PBS(杜氏磷酸盐缓冲盐水(Dulbecco's phosphate-buffered saline))溶液中在室温下孵育10分钟,用D-PBS洗涤,然后为了封闭,用包含3%的BSA的D-PBS孵育。
为了用层粘连蛋白使球状体染色,将固定的球状体与抗人层粘连蛋白兔一抗(1:100,目录号11575;Abcam)在4℃下孵育12小时。然后,用D-PBS洗涤之后,将获得的球状体与罗丹明红-X-偶联的抗兔二抗(1:500,目录号R6394;Invitrogen)在室温下孵育1小时,然后与Hoechst 33342孵育10分钟。
另外,对于TNC染色,将SKOV3 2D对照组或SKOV3球状体与抗人TNC兔一抗(20μg/mL,目录号AB19011;Millipore)在4℃下孵育12小时。然后,用D-PBS洗涤之后,将细胞和球状体与FITC偶联的抗兔二抗(1:500,目录号sc-2012;Santa Cruz)在室温下孵育1小时。然后,将它们与Hoechst33342孵育10分钟。
对于β-联蛋白染色,将SKOV3 2D对照组和SKOV3-ssiCSC与鼠抗人β-联蛋白一抗(1:100,目录号13-8400;Invitrogen)在室温下孵育1小时。然后,用D-PBS洗涤之后,将细胞与TRITC偶联的抗鼠二抗(1:1000,目录号ab6786;Abcam)在室温下孵育1小时,然后与Hoechst 33342孵育10分钟。使用共聚焦激光扫描显微镜(LSM 780,Carl Zeiss)使所有荧光图像可视化。
参考示例9:统计分析和数据参考
数据由平均值±标准偏差(s.d.)表示。使用GraphPad Prism软件(La Jolla)的未配对的学生t检验,进行统计分析。P值<0.05被认为具有统计学意义。
另外,使用NCBI的基因表达综合数据存储(Gene Expression Omnibus datastorage)的GSE106848RNA测序数据。
示例1:包括硅氧烷聚合物的细胞培养基底或盖玻片的制造
(1)制造包括硅氧烷聚合物的细胞培养基底
通过以下方法制备包括环硅氧烷聚合物的聚合物薄膜(PTF)。
首先,制备pV4D4[聚(2,4,6,8-四乙烯基-2,4,6,8-四甲基环四硅氧烷)]聚合物薄膜(PTF)。具体地,为了单体的蒸发,将V4D4[2,4,6,8-四乙烯基-2,4,6,8-四甲基环四硅氧烷](99%;Gelest)和叔丁基过氧化物(TBPO,98%;Aldrich)分别加热到70℃和30℃。将蒸发的V4D4和TBPO以1.5和1标准cm
为了制造包括各种环硅氧烷化合物的细胞培养基底,使用1,3,5-三乙烯基-1,3,5-三甲基环三硅氧烷、2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)、2,4,6,8,10-五甲基-2,4,6,8,10-五乙烯基环五硅氧烷、2,4,6,8,10,12-六甲基-2,4,6,8,10,12-六乙烯基环六硅氧烷、八(乙烯基倍半硅氧烷)和2,2,4,4,6,6,8,8,10,10,12,12-十二甲基环六硅氧烷,分别与pV4D4以1:9的比例形成共聚物基底。各种环硅氧烷化合物的化学结构示出在图1g至图1l中。
图1g至图1l示出了各种环硅氧烷化合物的结构,图1g示出了1,3,5-三乙烯基-1,3,5-三甲基环三硅氧烷的结构,图1h示出了2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)的结构,图1i示出了2,4,6,8,10-五甲基-2,4,6,8,10-五乙烯基环五硅氧烷的结构,图1j示出了2,4,6,8,10,12-六甲基-2,4,6,8,10,12-六乙烯基环六硅氧烷的结构,图1k示出了八(乙烯基倍半硅氧烷)的结构,图1l示出了2,2,4,4,6,6,8,8,10,10,12,12-十二甲基环六硅氧烷的结构。
使用ALPHA FTIR光谱仪(Bruker Optics,USA)在常规吸光度模式下使用64次平均扫描和0.085cm
通过X射线光电子能谱(XPS;K-alpha,Thermo VG Scientific Inc.)在2.0×10
通过原子力显微镜(AFM;PSIA XE-100,Park Systems)以0.5Hz的扫描速率在非接触模式下分析45μm×45μm区域中的表面形貌。
使用接触角分析仪(Phoenix 150;Surface Electro Optics,Inc.)通过将10μL去离子水滴在相应的表面上来测量Si晶圆、pV4D4涂覆的Si晶圆、组织培养基底和pV4D4涂覆的基底的水接触角。
(2)制造包括线性硅氧烷聚合物的细胞培养基底
通过以下方法制备包括线性硅氧烷聚合物的聚合物膜(PF)。
首先,制备PDMS(聚二甲基硅氧烷)聚合物膜(PF)。具体地,为了使单体和低聚物交联聚合和固化,根据制造商的说明和协议,将
使用真空干燥器在减压条件下在室温下持续20分钟或更长时间去除反应物中形成的所有气泡。
在具有用于细胞培养的各种尺寸的普通的组织培养板(TCP)(96孔、35Φ或6孔、100Φ)上,使用直接置换移液管将粘性反应物分别分装为10uL(96孔)、500uL(35Φ或6孔)和4mL(100Φ),然后均匀地涂布以施用于基底的整个底部。将基底放置在60℃烘箱中,盖子打开一点,然后固化12小时或更长时间。在此,上述低聚物与催化剂和交联剂的混合不限于特定比例,并且可以应用于各种细胞培养平台,而不限于具有上述尺寸的基底,对于每个基底的上述分装量也是足够的,只要其可以覆盖基底的所有底部即可,上述固化时间不限于12小时。
为了制造包括各种比例的硅氧烷化合物的细胞培养基底,以各种重量比使用二甲基硅氧烷的单体和低聚物与固化品来形成聚合物基底。形成普通的二甲基硅氧烷化合物的化学结构和反应式示出在图1u中。
图1u是示出了根据通过铂基催化剂的交联聚合反应的硅氧烷低聚物和硅氧烷交联剂的结构及其通用聚合物(PDMS)的结构的反应式。
为了制造包括各种硅氧烷化合物的细胞培养基底,如下使用摩尔比为1:4的2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(2,4,6,8-四甲基-2,4,6,8-四乙烯基-1,3,5,7,2,4,6,8-四氧杂四硅氧烷,V4D4)和1,1,3,3-四甲基二硅氧烷(TMDS)形成共聚物基底。
具体地,将TMDS和甲苯以及Karstedt铂催化剂放入双颈反应烧瓶中,将与TMDS的0.25倍对应的一样多的比例的V4D4填充到滴液漏斗中。在升温55℃之后,将V4D4缓慢地滴加到反应混合物中。在加入V4D4之后,在氮气条件下,在65℃的温度下搅拌约2小时,V4D4与TMDS之间发生硅氢加成反应。在100℃下蒸馏1小时去除甲苯,在120℃下对其加热2小时以获得无色透明产物。
在具有用于细胞培养的各种尺寸的普通的塑料基底(TCP)(96孔、35Φ或6孔、100Φ)上,将产物分别分装为10μL(96孔)和500μL(35Φ或6孔)、4mL(100Φ),然后均匀地涂布以施用于基底的整个底部。将基底放置在真空烘箱中,在40MPa的压力和120℃的温度下进行固化反应达24小时。形成的硅氧烷化合物的化学结构和反应式示出在图1v中。图1v是示出了根据通过铂基催化剂的交联聚合反应的环硅氧烷和二甲基硅氧烷的结构及其共聚物的结构的反应式。
示例2:使用各种聚合物薄膜(PTF)形成癌细胞来源的球状体
从韩国细胞系库(KCLB)购买人卵巢癌细胞系(SKOV3、OVCAR3)、人乳腺癌细胞系(MCF-7、T47D、BT-474)、人肝癌细胞系(Hep3B、HepG2)、人胶质母细胞瘤细胞系(U87MG、U251)、人结直肠癌细胞系(SW480、HT-29、HCT116、Caco-2)、人肺癌细胞系(A549、NCIH358、NCI-H460)和人前列腺癌细胞系(22RV1)、人宫颈癌细胞系(HeLa)、人黑色素瘤细胞系(A375)和人胃癌细胞系(NCI-N87)。使用e-Myco支原体PCR检测试剂盒(iNtRONBiotechnology)确认所有癌细胞不具有支原体。本领域技术人员可以清楚地知道,本发明的内容不限于诸如细胞系的根源的特定类型。
将癌细胞(1×10
具体地,在包括10%(v/v)SR、1%(v/v)P/S和25mM HEPES(Gibco)的RPMI-1640培养基(Gibco)中培养SKOV3细胞系、T47D细胞系、BT-474细胞系、SW480细胞系、HT29细胞系、22RV1细胞系、A549细胞系、NCI-H358细胞系、NCI-N87细胞系、OVCAR3细胞系、NCI-H460细胞系和HCT116细胞系。在包括10%(v/v)SR和1%(v/v)P/S(Gibco)的DMEM培养基中培养MCF-7细胞系、Hep3B细胞系、HeLa细胞系、U251细胞系和A375细胞系。在包括10%(v/v)SR和1%(v/v)P/S(Gibco)的MEM培养基中培养HepG2细胞系、U87MG细胞系和Caco-2细胞系。另外,为了球状体的最佳生长,每2-3天更换培养基。
为了在细胞培养基底上引入各种表面功能,使用iCVD(起始化学气相沉积)工艺在常规组织培养板(TCP)上从各种单体构建聚合物薄膜(PTF)的库,确认每个PTF的癌症形成球状体的制造能力(图1m)。为此,在各种PTF中培养人卵巢癌细胞系SKOV3。化学结构组成测试的PTF示出在图1a至图1f中。图1a示出了EGDMA(乙二醇二甲基丙烯酸酯)和它的聚合物(pEGDMA)的结构,图1b示出了1-VIDZ(1-乙烯基咪唑)和它的聚合物(pVIDZ)的结构,图1c示出了IBA(丙烯酸异冰片酯)和它的聚合物(pIBA)的结构,图1d示出了PFDA(1H,1H,2H,2H-全氟癸基丙烯酸酯)和它的聚合物(pPFDA)的结构,图1e示出了GMA(甲基丙烯酸缩水甘油酯)和它的聚合物(pGMA)的结构,图1f示出了V4D4(2,4,6,8-四乙烯基-2,4,6,8-四甲基环四硅氧烷)和它的聚合物(pV4D4)的结构。
结果,确认仅在通过环硅氧烷化合物聚合物制备的pV4D4[聚(2,4,6,8-四乙烯基-2,4,6,8-四甲基环四硅氧烷)]PTF上在24小时内形成了非常大量的多细胞球状体。与此相反,在其它PTF上生长的SKOV3通过与在TCP上生长的细胞类似地附着显示出铺展的形式(图1n)。图1n是确认在常规TCP和各种功能的PTF上形成癌症形成球状体的图。
为了确认硅氧烷聚合物薄膜的球状体形成的特异性,使用硅氧烷聚合物(PDMS)薄膜作为聚合物薄膜(PTF)培养人卵巢癌细胞系SKOV3,但是其通过与示例2-3的方法基本上相同的方法进行。作为培养基,使用FBS培养基或SR培养基。
具体地,将癌细胞(3.3×10
结果示出在图7f中。图7f是确认通过使用FBS或SR作为培养基在PDMS基底上培养卵巢癌细胞系(SKOV3)形成球状体的图。结果,确认当在PDMS上培养癌细胞时形成球状体,并且可以确认球状体的形成是由硅氧烷聚合物薄膜诱导的。与此相反,在TCP上培养的SKOV3的情况下没有形成球状体。因此,确认硅氧烷聚合物基底具有癌细胞球状体形成的特异性。
然而,在作为二甲基硅氧烷化合物的PDMS基底上,球状体形式仅在SR培养基中显示,在FBS培养基上,每个癌细胞似乎在24小时内彼此聚集并形成集落,但是它没有生长成球状体并很快扩散,因此球状体不是很好地形成。基于该结果,可以看出SR比FBS具有高的白蛋白含量且促进球状体的诱导。另外,这表明球状体的形成是由不包括在FBS中但包括在SR中的未知物质促进的。
为了确认在包括不同比例的二甲基硅氧烷化合物的细胞培养基底上是否形成球状体,将SKOV3细胞接种在示例1-5中制备的细胞培养基底上,以确认分别在6小时、24小时、48小时和72小时内形成球状体。
结果示出在图1w中。作为确认在包括不同比例的二甲基硅氧烷化合物的细胞培养基底上确认球状体的结果,确认在24小时内在包括所有比例(1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1)的二甲基硅氧烷的PDMS PF细胞基底上形成非常多的多细胞球状体,并且显示出高效率和再现性,球状体大部分示出为致密的球体形式。与此相反,在常规TCP上生长的SKOV3显示出附着和铺展的形式(图1w)。图1w是确认在常规TCP和包括各种硅氧烷化合物的基底上是否形成球状体的图。
通常,已知根据二甲基硅氧烷低聚物和固化剂的反应比,合成的二甲基硅氧烷化合物的强度和弹性根据交联聚合的程度而不同,交联剂的混合量和交联的程度越多,弹性体的强度和弹性越高。通过对应的示例的结果,可以看出,当癌细胞分装在PDMS基底表面上时,在24小时内以高效率制造高质量的球状体,PDMS基底表面示出根据不同比例的二甲基硅氧烷化合物的广泛强度和弹性。
此外,为了详细地彻底地确认形成球状体的二甲基硅氧烷化合物的比例的范围,根据弹性体低聚物和固化剂(交联剂)之间改变的各种比例(1000:1、500:1、100:1、50:1、1:10、1:20、1:50、1:100、1:200、1:500、1:1000),通过在60℃烘箱中反应10天或更长,从而充分地发生交联聚合和固化,确认并选择是否通过固化作用形成适合于细胞培养的PDMS弹性体表面。结果示出在图1x中。图1x是示出了不同比例的二甲基硅氧烷低聚物和交联剂的混合溶液的交联聚合和固化反应的结果的图。
结果,除了低聚物与交联剂之间的50:1、100:1和1:10之外,在其它比(1000:1、500:1、1:20、1:50、1:100、1:200、1:500和1:1000)下,其不固化且保持流体状态,具体地,包括高浓度低聚物的比(1000:1和500:1)示出高粘度(图1x)。推测反应所需的各个组分存在太少而不能引起充分的交联聚合和固化作用,因此两种组分未适当地混合,因此反应未发生。
在其中固化反应在能够形成球状体诱导表面的低聚物和固化剂的混合比内进行的基底上接种癌细胞(5×10
具体地,作为选择适合于细胞培养的交联和固化比例(50:1、100:1和1:10)并将SKOV3细胞分装在每个基底表面上的结果,确认在24小时内在包括二甲基硅氧烷的所有PDMS基底中形成显著数量的球状体,并且显示出高效率和再现性(图1y)。与此相反,在SKOV3生长在TCP上的情况下,没有形成球状体。因此,确认硅氧烷聚合物基底具有癌细胞球状体形成的特异性。图1y是示出了在24小时内在包括各种比例(50:1、100:1和1:10)的二甲基硅氧烷化合物的基底的表面上形成球状体的图。
因此,可以看出,当二甲基硅氧烷低聚物和固化剂以与100:1至1:10的范围对应的比混合时,形成了其中构成能够形成癌症干细胞球状体的适当PDMS弹性体表面的功能性PF细胞培养基底。
示例3:包括各种硅氧烷化合物的基底的球状体形成的可能性的确认
(1)在包括各种环硅氧烷化合物的基底中形成球状体
为了确认在包括各种环硅氧烷化合物的细胞培养基底上是否形成球状体,将SKOV3细胞接种在示例1-2中制造的细胞培养基底上,并且在24小时内确认是否形成球状体。
具体地,作为确认在包括图1g至图1l的各种环硅氧烷化合物的细胞培养基底上是否形成球状体的结果,确认即使在包括1,3,5-三乙烯基-1,3,5-三甲基环三硅氧烷(图1g)、2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)(图1h)、2,4,6,8,10-五甲基-2,4,6,8,10-五乙烯基环五硅氧烷(图1i)、2,4,6,8,10,12-六甲基-2,4,6,8,10,12-六乙烯基环六硅氧烷(图1j)、八(乙烯基倍半硅氧烷)(图1k)和2,2,4,4,6,6,8,8,10,10,12,12-十二甲基环六硅氧烷(图1l)的细胞基底上也形成球状体(图1o至图1t)。
图1o至图1t示出了在包括各种环硅氧烷化合物的基底上形成的球状体,图1o示出了在包括1,3,5-三乙烯基-1,3,5-三甲基环三硅氧烷的细胞培养基底上形成的球状体,图1p示出了在包括2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)的细胞培养基底上形成的球状体,图1q示出了在包括2,4,6,8,10-五甲基-2,4,6,8,10-五乙烯基环五硅氧烷的细胞培养基底上形成的球状体,图1r示出了在包括2,4,6,8,10,12-六甲基-2,4,6,8,10,12-六乙烯基环六硅氧烷的细胞培养基底上形成的球状体,图1s示出了在包括八(乙烯基倍半硅氧烷)的细胞培养基底上形成的球状体,图1t示出了在包括2,2,4,4,6,6,8,8,10,10,12,12-十二甲基环六硅氧烷的细胞培养基底上形成的球状体。
(2)在包括各种线性硅氧烷化合物的基底上形成球状体
为了确认在包括各种二甲基硅氧烷化合物的细胞培养基底上是否形成球状体,将SKOV3细胞接种在示例1-6中制造的基底上,在24小时内,确认球状体形成。
具体地,作为观察在包括图1v的硅氧烷化合物的细胞培养基底上是否形成球状体的结果,确认即使在包括硅氧烷共聚物的基底上也产生球状体(图1z)。这样的结果表明,在包括基于线性二甲基硅氧烷的各种硅氧烷聚合物(共聚物)的表面上诱导癌症干细胞球状体的形成。图1z是示出了在包括2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4)和1,1,3,3-四甲基二硅氧烷(TMDS)类化合物的细胞培养基底上形成球状体的图。
示例4:使用各种癌细胞系的球状体形成的可能性的形成
(1)环硅氧烷聚合物基底
确认即使在除了人卵巢癌细胞系SKOV3之外的其它癌细胞系中,包括环硅氧烷化合物聚合物的PTF是否也具有球状体形成增强能力。
结果,在大多数人癌细胞系中在24小时内形成了多细胞球状体(约50μm-300μm直径)而与根源无关,并且多细胞球状体显示出高效率和再现性(图2a)。每个球状体的形状从“葡萄簇”的形状变化到致密球体(图2b),该结果表明PTF平台的多样性。
(2)线性硅氧烷聚合物基底
确定包括二甲基硅氧烷化合物聚合物的PF对于除了人卵巢癌细胞系SKOV3之外的其它癌细胞系是否显示出球状体形成增强能力。
结果,无论根源,在24小时内在人卵巢细胞系中形成多细胞球状体(直径在100μm以内或不在100μm以内),并且显示出高效率和再现性(图2c)。每个球状体的形式大多为致密球体,但是当在应用于本示例中提出的细胞系以外的其它细胞系时,其不限于致密球状体,可以衍生出诸如“葡萄簇”形状等的各种多细胞聚集体形式。另外,在培养之后8天,与第1天相比,更多的细胞聚集,确认了大得多、更成熟和更致密的球形球状体(图2c)。这样的结果表明PF平台的多样性和通用性。
对比示例1:用于形成球状体的常规方法
为了通过常规方法形成球状体,其如下进行。
具体地,使用悬滴96孔板(3D Biomatrix)、U-底96孔板(SBio)和超低附着(ULA)6孔板(Corning)。将细胞以1×10
示例5:制备的癌症干细胞球状体的特性的分析
(1)环硅氧烷聚合物基底
在示例2-3的球状体形成的过程中,每个癌细胞首先附着在pV4D4表面上,但是立即地通过细胞间相互作用同时地形成多细胞球状体。在pV4D4上活化的细胞间相互作用是在其它球状体形成技术中未观察到的现象,其依赖于基于简单的物理或机械接触的结合。
与常规亲水性ULA(超低附着)表面不同,通过FT-IR(傅里叶变换红外)光谱和XPS(X射线光电子光谱)表征的pV4D4 PTF表面(图3a和图3b、表1)是具有约90°的水接触角的相对疏水的(图3c),并且具有与常规TCP相似的粗糙度的光滑表面(图3d)。
【表1】
另外,使用He-Ne激光(JDS Uniphase)干涉仪系统将pV4D4以10nm、50nm、100nm、200nm和300nm的厚度沉积在TCP上以制造具有各种厚度的pV4D4 PTF,确认厚度与球状体形成能力的相关性,pV4D4 PTF的厚度在50nm至300nm范围内的改变完全不影响球状体形成能力(图4)。综合这些结果,可以看出,在pV4D4的情况下,pV4D4中存在的特定表面功能(化学或生物刺激物)而不是机械信号诱导球状体形成。
这些结果表明,包括由环硅氧烷化合物形成的聚合物的细胞培养基底可以形成具有来自癌细胞的特定性质的3D球状体。
首先,将通过在pV4D4 PTF中培养4天到8天制备的癌细胞球状体的特性与通过在对比示例1中制备的常规球状体形成方法制备的球状体的特性进行比较。
结果,SKOV3癌细胞通过悬滴法和U-底法形成一个大的聚集的球状体,但是在ULA表面和pV4D4表面上形成若干个小的球状体,而在pV4D4上形成的球状体比在ULA上形成的球状体更均匀且略小(图8a)。另外,作为通过免疫细胞化学分析比较在ULA表面或pV4D4表面上培养8天的SKOV3球状体的结果,在pV4D4表面上培养的球状体的情况下,作为细胞外基质(ECM)的主要成分的层粘连蛋白存在于球状体的内部,但是在ULA表面上培养的球状体的情况下,层粘连蛋白仅存在于球状体周围(图8b)。
基于该结果,表明通过在本发明的pV4D4中培养制备的球状体不是诸如使用常规方法制备的球状体的癌细胞聚集体,并且在体内重复ECM介导的肿瘤组织的多细胞结构。表明ECM在肿瘤微环境中的抗药性、自再生和癌症形成能力的开发中起着至关重要的作用。
(2)线性硅氧烷聚合物基底
在示例2-5的球状体形成过程中,每个癌细胞首先附着在PDMS表面上,不限于特定的聚合比,立即,自发地通过细胞间相互作用形成多细胞球状体。在PDMS上活化的细胞间相互作用是依赖于简单的物理或机械的基于接触的结合的现象的,并且在其它球状体形成技术中未观察到。与常规亲水ULA(超低附着)表面不同,PDMS PF表面是通常已知的相对疏水的,并且具有显示与常规TCP类似的粗糙度的表面。
另外,作为固化和制造具有各种厚度的PDMS PF并确认厚度与球状体形成能力之间的相关性的结果,PDMS PF的厚度在各种范围内的改变完全不影响球状体形成能力。综合这些结果,可以看出,在PDMS的情况下,PDMS中存在的特定表面功能性(化学或生物刺激)而不是机械信号诱导球状体形成。
这样的结果表明,包括由硅氧烷化合物形成的聚合物的细胞培养基底可以形成具有来自癌细胞的特定性质的3D球状体。
将通过在当天和1天、4天到8天在PDMS中培养制备的癌细胞球状体的特性与通过在对比示例1中制备的常规球状体形成方法制备的球状体的特性进行比较。
结果,SKOV3癌细胞在ULA表面和PDMS表面中形成几个小的球状体,但是在ULA中形成的球状体不是均匀的且大部分具有大的尺寸,并且部分地形成一个大的多细胞聚集体形式,而在PDMS(10:1)中形成的球状体比基于ULA的球状体均匀得多且略小(图8e)。
(1)在环硅氧烷聚合物基底中制备癌症干细胞球状体
为了形成癌症干细胞球状体,将SKOV3细胞(1×10
为了确认示例6-1中制备的球状体是否具有癌症干细胞的性质,使用qRT-PCR和RT-PCR确认CSC相关的基因的表达。作为对照组,使用通过对比示例1的常规方法形成的球状体。
具体地,为了进行qRT-PCR,根据制造商的说明,从2D培养的对照癌细胞和ssiCSC球状体分离总RNA。将分离的总RNA与AccuPower RT PreMix(Bioneer)混合,使用Rotor-Gene Q热循环仪(Qiagen)将其逆转录为cDNA。根据制造商的说明,使用Rotor-Gene Q热循环仪(Qiagen)和KAPA SYBR FAST Universal qPCR试剂盒(Kapa Biosystems)对50ng RNA进行qRT-PCR实验。
另外,为了使用RT-PCR分析作为癌症干细胞标记基因的CD44、CD133、ALDH1A1、ALDH1A2和EpCAM的表达水平,根据制造商的说明,使用HyperScript One-step RT-PCR试剂盒(GeneAll Biotechnology Co.Ltd.)进行30个循环的程序。β-肌动蛋白用作内部对照。
用于进行qRT-PCR和RT-PCR的引物的序列示出在下表2中。
【表2】
结果,通过定量实时PCR(定量实时PCR聚合酶链反应;qRT-PCR)分析确认,在各种球状体形成方法中,作为CSC标记物的ALDH1A1(醛脱氢酶1家族成员A1)的表达仅在通过在pV4D4中培养制备的SKOV3球状体中大量地增加(图8c)。另外,确认与在TCP上生长的2D培养的SKOV3对照组相比,在通过在pV4D4中培养制备的SKOV3球状体中,作为典型的自再生基因的Oct3/4、Sox2和Nanog的表达显著地增加(图8d)。通过该结果,可以看出球状体中的癌细胞具有干细胞特性。
为了确认球状体的癌症干细胞(CSC)特性由白蛋白诱导,进行以下实验。
首先,当使用各种FBS和血清替代物(SR)以确认CSC标记基因的表达水平时,进行以下实验。具体地,在将铺在pV4D4 PTF上的U87MG在3种(Welgene、Hyclone、GIBCO)FBS和SR中培养6天之后,通过流式细胞术确认CSC标记物CD133和CD44的表达水平。结果,确认在添加SR的情况下,CD133和CD44的表达水平比3种FBS优异(图5a)。另外,作为使用天然凝胶比较FBS和SR的白蛋白含量的结果,确认SR包括比FBS多量的白蛋白(图5b)。基于该结果,可以看出因为SR具有比FBS高的白蛋白含量,因此SR促进球状体的CSC诱导。然后,将铺在pV4D4PTF上的5×10
结果,确认在包括BSA的培养基中形成球状体,并且确认表达CSC标记物CD133(图6a和图6b)。另外,确认CD133的表达水平随着BSA浓度的升高而增加。此外,确认当使用包括在普通细胞生长培养基中的FBS时,形成球状体,但是不表达CSC标记物CD133。换句话说,可以看出,由于CSC标记物在包括特定浓度或更高浓度的白蛋白的培养基下表达,所以显示出癌症干细胞的特性,但是在包括低浓度的白蛋白的情况下,不表达CSC标记物,因此它们不具有癌症干细胞的特性,由此确认癌症干细胞由特定浓度或更高浓度的白蛋白诱导。
另外,当将U87MG、SKOV3和MCF7在TCP和pV4D4 PTF中在包括FBS、SR或40mg/mL BSA的无血清培养基(SFM)中培养时,通过流式细胞术确认CSC标记物CD133的表达水平,并且CSC标记物CD133的表达水平由图表(图7a和图7b)表示。
基于该结果,可以看出白蛋白可以诱导癌症干细胞,当在pV4D4 PTF上培养时,通过在无血清培养基(SFM)中包括特定浓度或更高浓度的白蛋白的培养可以有效地诱导癌症干细胞。因此,可以看出,由于比FBS高的白蛋白含量,因此SR促进球状体的癌症干细胞(CSC)诱导。另外,确认在包括特定浓度的白蛋白的培养基中形成了具有表达CSC标记物的癌症干细胞特性的球状体,并且癌细胞被特定浓度或更高浓度的白蛋白诱导为癌症干细胞。
为了确认在包括各种环硅氧烷化合物的基底中制备的球状体是否具有癌症干细胞特性,测量癌症干细胞标记基因CD133的表达水平,结果示出在图7c中。
具体地,使用pV4D4和图1g至图1l的6种环硅氧烷化合物,分别以9:1的比例形成共聚物基底。图1g示出了1,3,5-三乙烯基-1,3,5-三甲基环三硅氧烷,图1h示出了2,4,6,8-四甲基-2,4,6,8-四乙烯基环四硅氧烷(V4D4),图1i示出了2,4,6,8,10-五甲基-2,4,6,8,10-五乙烯基环五硅氧烷,图1j示出了2,4,6,8,10,12-六甲基-2,4,6,8,10,12-六乙烯基环六硅氧烷,图1k示出了八(乙烯基倍半硅氧烷),图1l示出了2,2,4,4,6,6,8,8,10,10,12,12-十二甲基环六硅氧烷。将SKOV3细胞处理到每个基底,并且在24小时内,确认形成球状体,在8天内,通过流式细胞术确认表达CD133的细胞数量增加。
在图7c的轴中,1g示出了在其中pV4D4和图1g的环硅氧烷化合物共聚的基底中制备的癌症干细胞球状体的CD133表达,1h示出了在其中pV4D4和图1h的环硅氧烷化合物共聚的基底中制备的癌症干细胞球状体的CD133表达,1i示出了在其中pV4D4和图1i的环硅氧烷化合物共聚的基底中制备的癌症干细胞球状体的CD133表达,1j显示pV4D4与图1j的环硅氧烷化合物共聚的基底中制备的癌症干细胞球状体的CD133表达,1k示出了pV4D4与图1k的环硅氧烷化合物共聚的基底中制备的癌症干细胞球状体的CD133表达,1l示出了pV4D4与图1l的环硅氧烷化合物共聚的基底中制备的癌症干细胞球状体的CD133表达。
因此,可以确认,即使当使用除了pV4D4之外的其它环硅氧烷化合物时,也可以诱导癌症干细胞特性。
(2)在线性硅氧烷聚合物基底中制备癌症干细胞球状体
确认在示例2-4中通过在硅氧烷聚合物基底中培养癌细胞形成了球状体,并且为了确认当包括白蛋白的培养基作为培养基时诱导癌症干细胞特性,进行以下操作。
为了形成癌症干细胞球状体,将SKOV3细胞(3.3-5×10
为了确认实施例6-5中制备的球状体是否具有癌症干细胞的特性,使用qRT-PCR确认CSC相关基因的表达。
具体地,为了进行qRT-PCR,根据制造商的说明,从2D单层培养的对照癌细胞和ssiCSC球状体分离总RNA。为了定量地分析CD133、ALDH1A1、DKK1、Oct3/4、SOX2和NANOG的表达水平(CD133、ALDH1A1、DKK1、Oct3/4、SOX2和NANOG是包括癌症干细胞特异性表面标记物和干细胞自再生基因的癌症干细胞标记基因),根据制造商的说明,对于分离的总RNA,使用Rotor-Gene Q热循环仪(Qiagen)和LeGene SB-Green一步qRT-PCR试剂盒(LeGeneBiosciences),通过35-40个循环程序对100ng RNA进行qRT-PCR实验。持家基因GAPDH用作内部对照。
用于进行qRT-PCR的引物序列示于下表3中。
【表3】
结果,确认通过定量实时聚合酶链反应(qRT-PCR)分析,在通过在PDMS中培养制备的SKOV3球状体中,已知为CSC标记物的CD133(prominin-1,分化簇133)和ALDH1A1(醛脱氢酶1家族成员A1)的表达显著地增加(图8f和图8g)。另外,确认Dickkopf相关蛋白1(DKK1)(已知通常在癌症干细胞中激活的Wnt/β-联蛋白信号传导途径的主要抑制因子)和CSC标记物的表达显著地降低(图8h)。另外,确认与在TCP上生长的2D培养的SKOV3对照组相比,在通过在PDMS中培养制备的SKOV3球状体中Oct3/4、Sox2和Nanog(典型的自再生基因)的表达显著地增加(图8i)。然而,尽管通过添加包括一些白蛋白的培养基培养在未涂覆有硅氧烷聚合物的TCP基底中培养的癌细胞(2D-单层培养的对照-SKOV3),但是未诱导癌症干细胞特性(图8i)。通过该结果,可以看出,通过在涂覆有硅氧烷聚合物的基底中添加包括白蛋白的培养基培养的球状体中的癌细胞具有干细胞特性。对于本领域技术人员来说清楚的是,该结果不限于特定比例(10:1)。
示例7:各种白蛋白浓度下的癌症干细胞球状体
通过向SFM培养基中添加BSA以使白蛋白的浓度是0、0.01mg/mL、0.1mg/mL、1mg/mL、2mg/mL、5mg/mL和10mg/mL来组成培养基,并且通过在包括环硅氧烷化合物的基底和TCP基底中培养癌细胞,确认是否形成球状体。
结果,如图7d中可见,在环硅氧烷化合物pV4D4基底中显示出球状体形状,但是在TCP基底中未形成球状体。
通过向SFM培养基中添加BSA以使白蛋白的浓度是0、0.01mg/mL、0.1mg/mL、1mg/mL、10mg/mL、100mg/mL、200mg/mL、400mg/mL来组成培养基,并且通过在包括环硅氧烷化合物的基底中培养癌细胞,确认是否形成球状体。
结果,如图7e中可见,可以确认CD133的表达水平根据白蛋白浓度改变。
综合这些结果,可以看出,由环硅氧烷化合物形成的聚合物的一个示例(pV4D4表面)提供活化和修饰SKOV3癌细胞的特异性刺激并且诱导癌细胞的球状体的形成,白蛋白诱导它们的癌症干细胞特性,从而形成包括显著地大量的CSC样细胞的球状体。因此,CSC样细胞被命名为表面刺激诱导的癌症干细胞(ssiCSC)。
通过在包括二甲基硅氧烷化合物(10:1)的基底和TCP基底上在包含不同浓度的白蛋白(牛血清白蛋白:BSA)的SR培养基和FBS培养基中培养癌细胞,确认是否形成球状体(图7f)。
结果,如图7f中可见,仅在SR培养基中在二甲基硅氧烷化合物(PDMS)基底中显示球状体形式,在FBS培养基中,每个癌细胞似乎在FBS培养基上在24小时内彼此聚集并形成集落,但是它没有生长为球状体并很快扩散,因此球状体没有很好地形成。另一方面,在TCP基底中,在任何情况下,都不形成球状体。
然后,通过组成其中添加了不同浓度(5mg/mL、10mg/mL、20mg/mL、40mg/mL)的牛血清白蛋白(BSA)的SR培养基和FBS培养基,将5×10
结果,确认在TCP基底中,在任何情况下,不形成球状体,在PDMS PF基底中,在包括高浓度BSA的SR培养基而不是FBS培养基中形成球状体(图7g)。
这意味着在线性硅氧烷基底的情况下,与环硅氧烷基底不同,存在当使用FBS作为培养基时不形成球状体的情况,并且由于当使用SR作为培养基时球状体很好地形成,因此可以推测SR由于其比FBS高的白蛋白含量影响球状体形成,或者SR中包括的未知物质影响球状体形成。因此,可以确认当在线性硅氧烷基底中制备球状体时,球状体的形成不仅受到基底的表面功能刺激的影响,而且受到培养基的影响。
为了确认使用PDMS制备球状体的方法的通用化可能性和通用性,制备源自于诸如人乳腺癌细胞系(T47D和BT474)等的各种细胞系的ssiCSC球状体,并且确认CSC相关特性。为此,选择来源于乳腺癌组织的人癌细胞系(T47D)。另外,使用诸如乳腺癌细胞系的特异性表面标记物等的癌症干细胞标记物:CD44(分化簇44)、CD24(分化簇24)和ALDH1A1,确认推定的T47D的CSC特性。为了确认CSC标记基因的表达,通过qRT-PCR比较并分析在TCP上培养的对应的2D对照组和在PDMS表面上培养8天的ssiCSC球状体。
结果,虽然细胞类特异性CSC标记基因的CD24在ssiCSC球状体中减少,但是CD44表达显著地上调,共同标记物ALDH1A1增加(图7h)。该结果表明使用PDMS制备的ssiCSC球状体具有与CSC相似的特性。
示例8:使用各种癌细胞系确认癌症干细胞球状体形成能力
为了确认制备癌症干细胞球状体的方法的普遍的可能性,制备来源于各种癌细胞系的ssiCSC球状体,并且确认CSC相关的特性。为此,选择来源于各种组织的4种人癌细胞系:SKOV3、MCF-7(人乳腺癌)、Hep3B(人肝癌)和SW480(人结直肠癌)。另外,使用由每种细胞系的特异性表面标记物确认每种细胞系的预估的CSC特性:SKOV331-ALDH1A1;MCF-7-CD44(分化簇44);Hep3B36-CD90;以及SW48037-LGR5(包含富含亮氨酸的重复序列的G蛋白偶联受体5)。此外,CD133用作用于所有细胞系的一般预估的CSC标记物。通过qRT-PCR确认在pV4D4表面上培养4天和8天的ssiCSC球状体来确认CSC标记基因的表达,并且比较用TCP培养的对应的2D对照组和CSC标记基因的表达。
结果,每个细胞类特异性CSC标记基因在每个球状体中显著地上调,并且共同标记物CD133的表达在所有ssiCSC球状体中增加(图11a)。另外,由于标记基因的表达水平随着培养时间增加,因此这表明CSC样性质随着其被培养而加强。此外,RTPCR(逆转录-PCR)分析显示,与2D培养对照癌细胞相比,各种CSC相关的基因的表达在所有ssiCSC球状体中增加(图11b)。
然后,通过流式细胞术定量在通过在pV4D4表面上培养8天制备的球状体中预估的CSC-标记物-阳性癌细胞的分数。结果,显示与2D培养的对照组相比,在SKOV3、Hep3B和SW480的ssiCSC球状体中,细胞类特异性CSC相关的表面标记物(由基因计数表示)的表达增加约10倍,在MCF-7细胞的CD44的情况下,其增加小于10倍(图11c)。
这样的结果表明,使用pV4D4制备的ssiCSC球状体具有与CSC相似的性质。
示例9:制备的癌症干细胞球状体的伤口愈合测定、侵袭测定和球状体形成分析
将SKOV3细胞在pV4D4涂覆的基底中培养8天。在确认SKOV3-球状体形成之后,用胰蛋白酶(TrypLE Express;Gibco)分离ssiCSC球状体,并且用D-PBS洗涤分离的细胞两次。
通过在6孔板中以单层密集地培养SKOV3细胞和SKOV3-ssiCSC,然后将细胞在包含1%FBS的培养基中同步化24小时来进行伤口愈合测定。然后,通过用标准的200μL移液管尖端均匀地刮擦细胞单层来制作“伤口”。通过用D-PBS洗涤两次去除掉落的细胞,然后加入无血清培养基。在创口制作之后,在伤口制作即刻(0h)、12小时(12h)和24小时(24h)之后,使用相位差显微镜(LumaScope 620,Etaluma)观察到细胞向创口区域移动。
通过首先在无血清培养基中培养SKOV3细胞和SKOV3-ssiCSC细胞达24小时,然后在Transwell室(Corning)中培养来进行侵袭测定。将细胞(1×10
对于球状体形成测定,在包括B27(Invitrogen)、20ng/mL EGF(表皮生长因子,Gibco)、10ng/mL LIF(白血病抑制因子,Invitrogen)和20ng/mL bFGF(碱性成纤维细胞生长因子,Invitrogen)的DMEM/F12(1:1,Gibco)中培养SKOV3细胞和SKOV3-ssiCSC。使用相位差显微镜(LumaScope 620;Etaluma)在1小时和24小时内通过图像观察球状体的形成。
在伤口愈合测定中,确认从通过在pV4D4中培养8天制备的SKOV3球状体分离的癌细胞比2D培养的对照细胞迁移快且填充缺口(图9a),在基于transwell的侵袭测定中,从球状体分离的癌细胞可以比对照细胞多地(约4倍)穿透凝胶基底(图9b),由此,可以看出,通过在pV4D4中培养制备的球状体具有增强的细胞流动性和穿透性。
示例10:制备的癌症干细胞球状体的CSC特性的保持的确认
通过在常规TCP中培养癌细胞,评价“球状体形成能力”,癌细胞从通过在pV4D4中培养8天制备的SKOV3癌症干细胞球状体分离为单细胞。确认通过SKOV3-ssiCSC和U87MG-ssiCSC的球状体的形成的图示出在图10中。
如图10中可见,显示出同时地形成球状体,因此这显示球状体保持CSC样特性。
示例11:ssiCSC的抗药性的确认
CSC的其它重要特性之一是由于将药物推出的能力而对化疗药物具有内在或获得的抗药性。在这方面,通过基于Hoechst-染料的侧群测定确认从通过在pV4D4表面上培养8天制备的球状体中分离的每个癌细胞的药物释放能力。结果,确认与2D培养的对照组相比,在由4种癌细胞系制备的ssiCSC中药物释放阳性细胞的分数显著地增加。具体地,药物释放阳性分数在SKOV3细胞中增加0%至13.8%,在MCF-7细胞中增加0.59%至9.6%,在Hep3B细胞中增加0.58%至9.2%,在Hep3B细胞中增加0.1%至10%(图12a)。
另外,确认ssiCSC对已知作为抗癌剂的阿霉素(DOX)的抗药性。具体地,将通过在pV4D4表面上培养8天制备的ssiCSC球状体分离为单细胞,并且将细胞在常规TCP表面上培养为2D单层,然后以各种浓度的DOX治疗24小时。作为使用WST-1分析法测量细胞活力的结果,与2D对照组相比,ssiCSC甚至对50μM的DOX具有更高的抗药性(图12b)。此外,SKOV3-ssiCSC和SW480-ssiCSC具有对DOX的完全抗药性,并且SW480-ssiCSC显示出比其中未被DOX治疗的对照组的癌细胞高的细胞活力。当在TCP表面上传代培养两次时,SW480-ssiCSC保持抗药性,由此,可以看出,原代癌细胞转化为CSC样细胞(图12c)。
已知药物释放能力是由ATP结合盒(ABC)蛋白家族介导的。因此,使用qRT-PCR,在SKOV3-ssiCSC中,分析多药抗药性(MDR)基因ABCB1、ABCB2、ABCB5、ABCC1和ABCG2的表达。确认在所有5个MDR相关的基因中,与2D培养的对照组相比,ssiCSC高度地上调。具体地,在ABCB1和ABCB5基因的情况下,上调的水平是显著的(图12d)。MDR基因在ssiCSC中显著地上调的结果显示与侧群测定结果(图12a)和DOX抗性测试结果(图12b)相关。
作为合成4种类型细胞的ssiCSC球状体的分子或功能分析的结果,确认当暴露于存在于pV4D4表面上的特异性刺激时,癌细胞转化为强烈地表达CSC相关的基因且具有加强的抗药性的CSC样细胞。
示例12:ssiCSC球状体的体内癌症形成能力的确认
确认ssiCSC的体内癌症形成能力。具体地,将SKOV3来源的ssiCSC球状体分离为单细胞,并且将一系列不同浓度(10
【表4】
结果,确认2D对照组在10
另外,在接种ssiCSC的小鼠的肝脏中发现明显地异常的转移性结节,而接种2DSKOV3对照组的小鼠的肝脏看起来正常(图13b)。通过组织学分析,虽然确认在接种ssiCSC的异常肝脏中,在整个组织中出现许多转移性病变,清楚地区分正常区域与肿瘤区域,但是在接种2D对照癌细胞的小鼠的肝脏中没有转移的证据(图13c)。具体地,其中以10
然后,确认来源于各种癌细胞系的ssiCSC的癌症形成能力。结果,与2D培养的对照细胞相比,来源于荧光素酶导入的MCF-7(MCF7-Luc)细胞和U87MG人胶质母细胞瘤细胞的ssiCSC具有显著地增加的癌症形成能力(表5和表6)。
【表5】
【表6】
具体地,即使以每只小鼠10
综合这些结果,可以看出,基于pV4D4的PTF可以用作能够制备癌症形成球状体的平台,并且可以用于制备难以在无胸腺裸鼠中制备的各种人异源肿瘤模型。
示例13:ssiCSC球状体的癌症形成能力和Wnt/β-联蛋白信号传导的确认
为了确认与ssiCSC的干细胞样特性相关的细胞和分子机制,确认与如Notch、Hedgehog和Wnt/β-联蛋白的CSC的癌症形成能力和干细胞相关的一些重要的信号传导途径。
首先,进行确认在SKOV3-ssiCSC中Wnt/β-联蛋白信号传导途径是否被激活以及Wnt靶基因(n=46)的表达是否增加的实验。结果,确认在SKOV3-ssiCSC中46个Wnt/β-联蛋白靶基因中的30个基因的表达增加1.5倍,并且Wnt信号传导途径的核心抑制因子(Dickkopf相关蛋白1(DKK1))的表达显著地降低(图14a)。另外,作为在培养1天、4天和8天的SKOV3-ssiCSC球状体中的qRT-PCR分析的结果,确认DKK1 mRNA的表达显著地降低(图14b),这显示Wnt/β-联蛋白信号传导从球状体形成的初始步骤被激活。另外,qRT-PCR结果显示,DKK1表达的减少与作为Wnt/β-联蛋白信号传导的下游靶基因的AXIN2(轴抑制蛋白2)和MMP2(基质金属蛋白酶-2)的表达的增加直接地相关(图14b)。此外,qRT-PCR显示在ssiCSC球状体中β-联蛋白mRNA的水平没有变化的结果,但是蛋白质印迹分析结果显示磷酸化的β-联蛋白显著地减少(图14c)。此外,免疫染色的结果显示β-联蛋白几乎不存在于2D培养的SKOV3细胞的核中,但是β-联蛋白移动到ssiCSC中的核(图14d)。
然后,确认导致ssiCSC球状体中DKK1显著地减少的上游信号。结果,确认与肝转移相关的TNC(图13e)使DKK1下调,从而使SKOV3-ssiCSC中的Wnt/β-联蛋白信号传导途径激活。因此,为了确认TNC与DKK1之间的关联,对培养8天的SKOV3-ssiCSC球状体进行免疫染色。结果,由于TNC充分地存在于整个球状体中,因此确认TNC使靶DKK1下调,从而使Wnt/β-联蛋白信号传导途径激活(图14e)。
另外,从MCF-7球状体、Hep3B球状体和SW480球状体获得的ssiCSC显示TNC的显著表达(图15a)以及DKK1基因表达的显著降低(图15b),这显示在其它癌细胞中制备ssiCSC的过程中涉及相同的Wnt/β-联蛋白信号传导。
综合这些结果,由TNC-DKK1介导的Wnt/β-联蛋白信号传导途径的激活显示,由于pV4D4表面,癌细胞可以转化为癌症形成CSC样表型。
示例14:在具有增加的白蛋白浓度的FBS培养基中癌症干细胞球状体的形成
在添加BSA的培养基中培养癌细胞,使得FBS培养基中的白蛋白浓度高于一定水平,以确认是否形成癌症干细胞球状体。
具体地,在将BSA添加到FBS培养基中以使白蛋白浓度是5mg/mL、10mg/mL之后,在pV4D4基底上培养SKOV3细胞。作为对照组,使用未添加BSA的FBS培养基。
结果,如图16a中可见,确认当白蛋白浓度不是一定水平或更高时,由于未添加BSA而不能很好地形成球状体,但是当白蛋白浓度增加到一定水平或更高时,由于添加BSA而形成球状体。
另外,作为测量像这样培养的癌细胞的DKK1的表达水平且基于β-肌动蛋白(图16b)和GAPDH(图16c)显示的结果,确认当在未添加BSA的FBS培养基中培养时未显示癌症干细胞特性,但是仅当通过添加BSA使白蛋白浓度增加到一定水平或更高时诱导了癌症干细胞。
<110> 韩国科学技术研究院
<120> 制备癌症干细胞球状体的方法或试剂盒和筛选药物的方法
<130> OPP20202004CN
<150> KR 10-2019-0087134
<151> 2019-07-18
<160> 54
<170> KoPatentIn 3.0
<210> 1
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 β-肌动蛋白_F
<400> 1
gtcttcccct ccatcgtg 18
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 β-肌动蛋白_R
<400> 2
aggtgtggtg ccagattttc 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ALDH1A1_F
<400> 3
cgccagactt acctgtccta 20
<210> 4
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ALDH1A1_R
<400> 4
gtcaacatcc tccttatctc ct 22
<210> 5
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ALDH1A2_F
<400> 5
cagctttgtg ctgtggcaat 20
<210> 6
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ALDH1A2_R
<400> 6
ggaaagccag cctccttgat 20
<210> 7
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 EpCAM_F
<400> 7
agttggtgca caaaatactg tcat 24
<210> 8
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 EpCAM_R
<400> 8
tcccaagttt tgagccattc 20
<210> 9
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD44_F
<400> 9
tccaacacct cccagtatga 20
<210> 10
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD44_R
<400> 10
ggcaggtctg tgactgatgt 20
<210> 11
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD90_F
<400> 11
agagacttgg atgaggag 18
<210> 12
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD90_R
<400> 12
ctgagaatgc tggagatg 18
<210> 13
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD133_F
<400> 13
accaggtaag aacccggatc aa 22
<210> 14
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD133_R
<400> 14
caagaattcc gcctcctagc act 23
<210> 15
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 LGR5_F
<400> 15
cctgcttgac tttgaggaag acc 23
<210> 16
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 LGR5_R
<400> 16
ccagccatca agcaggtgtt ca 22
<210> 17
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Oct3/4_F
<400> 17
cttgctgcag aagtgggtgg aggaa 25
<210> 18
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Oct3/4_R
<400> 18
ctgcagtgtg ggtttcgggc a 21
<210> 19
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Sox2_F
<400> 19
catcacccac agcaaatgac a 21
<210> 20
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Sox2_R
<400> 20
gctcctaccg taccactaga actt 24
<210> 21
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Nanog_F
<400> 21
aatacctcag cctccagcag atg 23
<210> 22
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Nanog_R
<400> 22
tgcgtcacac cattgctatt cttc 24
<210> 23
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCB1_F
<400> 23
tgacatttat tcaaagttaa aagca 25
<210> 24
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCB1_R
<400> 24
tagacacttt atgcaaacat ttcaa 25
<210> 25
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCB2_F
<400> 25
cgttgtcagt tatgcagcgg 20
<210> 26
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCB2_R
<400> 26
atagatcccg tcacccacga 20
<210> 27
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCB5_F
<400> 27
cacaaaaggc cattcaggct 20
<210> 28
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCB5_R
<400> 28
gctgaggaat ccacccaatc t 21
<210> 29
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCC1_F
<400> 29
ggaataccag caaccccgac tt 22
<210> 30
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCC1_R
<400> 30
ttttggtttt gttgagaggt gtc 23
<210> 31
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCG2_F
<400> 31
tcatgttagg attgaagcca aaggc 25
<210> 32
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ABCG2_R
<400> 32
tgtgagattg accaacagac ctga 24
<210> 33
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 DKK1_F
<400> 33
tcccctgtga ttgcagtaaa 20
<210> 34
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 DKK1_R
<400> 34
tccaagagat ccttgcgttc 20
<210> 35
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 β-联蛋白_F
<400> 35
acagctcgtt gtaccgctgg 20
<210> 36
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 β-联蛋白_R
<400> 36
agcttggggt ccaccactag 20
<210> 37
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 AXIN2_F
<400> 37
agtgtgaggt ccacggaaac 20
<210> 38
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 AXIN2_R
<400> 38
cttcacactg cgatgcattt 20
<210> 39
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 MMP-2_F
<400> 39
tctcctgaca ttgaccttgg c 21
<210> 40
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 MMP-2_R
<400> 40
caaggtgctg gctgagtaga tc 22
<210> 41
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 GAPDH (M33197.1) FWD
<400> 41
caaggtgctg gctgagtaga tc 22
<210> 42
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 GAPDH (M33197.1) REV
<400> 42
tagccaaatt cgttgtcata cc 22
<210> 43
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ALDH1A1 (NM_000689.4) FWD
<400> 43
cgccagactt acctgtccta 20
<210> 44
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 ALDH1A1 (NM_000689.4) RVS
<400> 44
gtcaacatcc tccttatctc ct 22
<210> 45
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD133 (XM_006713974.3) FWD
<400> 45
accaggtaag aacccggatc aa 22
<210> 46
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 CD133 (XM_006713974.3) RVS
<400> 46
caagaattcc gcctcctagc act 23
<210> 47
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Oct3/4 (NM_001285987.1) FWD
<400> 47
aagcgaacca gtatcgagaa cc 22
<210> 48
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Oct3/4 (NM_001285987.1) RVS
<400> 48
ctgatctgct gcagtgtggg t 21
<210> 49
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Sox2 (NM_003106.3) FWD
<400> 49
ggcaatagca tggcgagc 18
<210> 50
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Sox2 (NM_003106.3) RVS
<400> 50
ttcatgtgcg cgtaactgtc 20
<210> 51
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Nanog (XM_011520852.1) FWD
<400> 51
aatacctcag cctccagcag atg 23
<210> 52
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 Nanog (XM_011520852.1) RVS
<400> 52
tgcgtcacac cattgctatt cttc 24
<210> 53
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 DKK1 (NM_012242.2) FWD
<400> 53
tcccctgtga ttgcagtaaa 20
<210> 54
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<220>
<223> 人 DKK1 (NM_012242.2) RVS
<400> 54
tccaagagat ccttgcgttc 20
- 制备癌症干细胞球状体的方法或试剂盒和筛选药物的方法
- 癌症干细胞敏感剂在制备抗癌症干细胞试剂盒中的应用
