一种以CD3为靶点的抗体药物对T细胞激活程度的检测方法
文献发布时间:2023-06-19 10:10:17
技术领域
本发明涉及生物医药技术领域,特别涉及一种专门针对以CD3为靶点的抗体药物对T细胞激活程度的检测方法。
背景技术
细胞免疫是指由免疫细胞参与并发挥效应以清除抗原异物的作用,其分为非特异性免疫及特异性免疫。非特异性免疫是指物种长期进化发育而形成的一系列防御机制,主要参与其中的有上皮细胞(Epithelial Cell)、巨噬细胞(Macrophages,缩写为
T细胞激活活化进而增殖分化的过程,需要依靠“双信号”系统精密细致的调控,同时T细胞的活化需要有抗原提呈细胞(antigen presenting cell,APC)的参与。巨噬细胞或树突状细胞通过吞噬等作用,将外源性蛋白摄入体内,经加工处理与自身的主要组织相容性复合物(major histocompatibility complex,MHC)Ⅱ类分子形成复合物,运送至T细胞表面,与T细胞表面的CD3/TCR复合物相互作用,形成第一信号;其次,T细胞上其他辅助分子如CD2、CD28、OX40及4-1BB等,可与APC上相应的配体分子如LF3、B7、TNFSF4及相关配体等结合,增强了T细胞与APC之间的连接,向T细胞传递协同刺激信号,使之活化。与此同时,T细胞上还有一些配体分子,如PD-1、CTLA-4,可与APC上相应的配体结合,抑制T细胞的活化。无论是刺激激活信号,还是结合抑制信号,均可统称为第二信号。两种信号分子相互配合,发挥增强或抑制T细胞的活性。
目前,针对CD3靶点的抗体药物在体外实验中均需要检测其对T细胞的激活程度,T细胞受体(T cell receptor,简称TCR)激活可促进许多信号转导并产生级联反应,进而调控细胞因子产物、细胞生存、增殖和分化等。首先TCR/CD3复合体胞膜内侧的免疫受体酪氨酸依赖性活化基序-(Immunoreceptor tyrosine-based activation motif,简称ITAM)磷酸化,随后启动并募集一系列不同家族酪氨酸激酶至TCR/CD3复合物处,进行磷酸化和激活,从而启动对下游接头蛋白或骨架蛋白的招募和磷酸化,促进招募一种可诱导T细胞的激酶(Itk)。磷脂酶Cγ1被Itk磷酸化后导致磷脂酰肌醇-4,5二磷酸的水解,产生第二信使甘油二酯(DAG)和三磷酸肌醇(IP3)。DAG激活PKCθ和MAPK/Erk两条信号通路,二者均可促进转录因子NF-κB活性。IP3触发Ca
目前以CD3为靶点的抗体药物在检测T细胞激活程度的实验中,最终检测对象为白介素2(IL-2)或者干扰素γ(IFN-γ)来判断激活程度,具体的测定方法是采集人外周血,利用Ficoll密度梯度离心法分选获得人外周血单个核细胞(peripheral blood mononuclearcell,PBMC),再利用CD3+T细胞分选试剂盒富集T细胞,铺板,将以CD3为靶点的抗体药物按一定浓度梯度稀释后加入板中,与T细胞相互作用约2-4天,随后利用商业化细胞因子ELISA试剂盒进行白介素2(IL-2)或者干扰素γ(IFN-γ)的检测,进而用于T细胞激活程度的检测。针对这种通用检测方法,首先人外周血单个核细胞的获得比较困难,每次实验均需要抽取新鲜人血,同时要对人血进行PBMC的分离以及T细胞的分选或者直接购买商品化的细胞,这种方法不仅实验操作过程复杂而且实验成本较高,对于实验人员的技术要求较高,细胞分离分选以及加药铺板,药物孵育至少需要1天时间,其次,孵育结束后的细胞因子检测,需要购买相应的细胞因子检测试剂盒才能检测,检测仍需要5-6h才能获得结果,所以这种检测方法大大延长了检测周期,无法满足快速检测的需求,同时这种方法还会受到不同PBMC供体间差异的影响,结果变异性较大,检测结果不准确,因此,急需开发一种能够快速、准确检测专门针对以CD3为靶点的抗体药物对T细胞激活程度的方法。
发明内容
为了解决现有的以CD3为靶点的抗体药物对T细胞激活程度的检测方法中以检测白介素2(IL-2)或者干扰素γ(IFN-γ)为主,每次检测均需要抽取新鲜人血进行PBMC分离T细胞,或者直接购买商品化的细胞,这种方法不仅实验成本较高,而且实验操作复杂,检测周期较长,同时这种方法还会受到不同PBMC供体间差异的影响,检测结果不准确等问题,本发明公开了一种能够快速、准确的专门针对以CD3为靶点的抗体药物对T细胞激活程度的检测方法。
本发明具体技术方案如下:
本发明提供了一种以CD3为靶点的抗体药物对T细胞激活程度的检测方法,所述检测方法包括以下步骤:
S1、构建并筛选稳定表达的工程细胞株Jurkat-NFAT-Luc;
S2、调整所述工程细胞株Jurkat-NFAT-Luc的细胞密度,并在U底板中进行细胞铺板,细胞铺板的密度为5x10
S3、将以CD3为靶点的抗体药物进行浓度梯度稀释,起始浓度为0.5-500μg/ml,梯度稀释后,每孔50μL加入板中,同时在37℃温箱内孵育4-5小时后取出,备用;
S4、将孵育后的溶液进行离心并收集细胞沉淀,加入裂解液充分裂解后,与等体积的萤光素酶底物混合均匀,室温反应3-7min后,酶标仪在492nm波长下读取荧光值,间接检测NFAT活化因子诱导表达的萤光酶浓度,同时绘制荧光值-药物浓度曲线,并用于评价T细胞激活程度。
进一步的,步骤S1中,构建稳定表达的工程细胞株Jurkat-NFAT-Luc具体包括以下方法:
S11、构建NFAT活化因子的NFAT响应元件驱动的萤光素酶基因载体,所述NFAT响应元件的核苷酸序列如SEQ ID No.1所示;
S12、在所述萤光素酶基因载体两端插入睡美人转座子末端反向重复序列,并构建转座酶的表达载体,所述睡美人转座子末端反向重复序列的左臂序列如SEQ ID NO:2所示,所述睡美人转座子末端反向重复序列的右臂序列如SEQ ID NO:3所示;
S13、所述转座酶的表达载体电转Jurkat细胞,筛选所述NFAT响应元件驱动的所述萤光素酶基因的稳定细胞株Jurkat-NFAT-Luc。
进一步的,所述转座酶为SB11,所述转座酶的核苷酸序列如SEQ ID NO:4所示。
进一步的,所述检测方法还包括对步骤S1中构建的所述工程细胞株Jurkat-NFAT-Luc的检测,具体包括以下方法:
(1)对所述工程细胞株Jurkat-NFAT-Luc细胞铺板,1x10
(2)在所述细胞沉淀中加入裂解液室温反应10min,加入萤光素酶底物,酶标仪在492nm波长下读取荧光值,利用所述实验组除以所述空白对照组,计算荧光比值,选取荧光比值较高的克隆株扩增培养,即为阳性克隆株,所述荧光比值为所述实验组与所述空白对照组读取的荧光值的比值。
优选的,步骤S2中,细胞铺板的密度为1x10
优选的,步骤S3中,起始浓度为300μg/ml。
优选的,所述裂解液为SDS裂解液。
优选的,步骤S3中,所述以CD3为靶点的抗体药物的氨基酸序列如SEQ ID NO:5所示。
本发明还提供了所述的检测方法在含有抗CD3靶点的单克隆抗体、双特异抗体对T细胞激活程度检测中的应用。
本发明的有益效果如下:本发明提供的方法通过检测NFAT诱导表达的萤光素酶表达水平替换现有方法中检测白介素2(IL-2)或者干扰素γ(IFN-γ)来评价以CD3为靶点的抗体药物对T细胞激活程度,将现有的检测周期至少24小时缩短到4-5小时,大大缩短了检测周期,同时该方法中无需使用新鲜人血和细胞因子检测试剂盒,不仅节省了经济成本,而且操作方法更加简单,检测结果更加准确,此外,本方法中引入睡美人转座子系统,将NFAT响应元件驱动的萤光素酶基因稳定转染Jurkat细胞,筛选出稳定表达NFAT驱动的萤光素酶的工程细胞株Jurkat-NFAT-Luc,建立成熟而稳定的功能性检测方法,为以后以CD3为靶点的抗体药物对T细胞激活检测提供了便利,为此,本发明实现了引入NFAT报告基因可以实现快速检测T细胞激活的目标,可以广泛用于抗CD3单克隆抗体或双特异抗体对T细胞激活程度检测中的应用。
附图说明
图1为本发明实施例2中pGL4.15-NFAT载体图谱;
图2为本发明实施例2中插入SB11转座酶序列的PTSE-SB11载体图谱;
图3为本发明实验例1中药物激活细胞株Jurkat与天然CD3+T细胞分泌IL-2细胞因子的检测;
图4为本发明实验例2中药物激活细胞株Jurkat与天然CD3+T细胞分泌IFN-γ细胞因子的检测;
图5为本发明实验例3中药物激活工程细胞株Jurkat-NFAT-Luc诱导表达NFAT报告基因的检测;
图6为本发明实验例3中药物激活工程细胞株Jurkat-NFAT-Luc分泌IL-2细胞因子的检测;
图7为本发明实验例4中药物激活工程细胞株Jurkat-NFAT-Luc诱导表达NFAT报告基因的检测;
图8为本发明实验例4中药物激活工程细胞株Jurkat-NFAT-Luc分泌IFN-γ细胞因子的检测;
图9为本发明实验例5中不同以CD3为靶点的抗体药物激活工程细胞株Jurkat-NFAT-Luc诱导表达NFAT报告基因的检测;
图10为本发明实验例6中工程细胞株Jurkat-NFAT-Luc多次传代后用于T细胞激活程度的检测;
图11为本发明实验例6中对本发明提供的检测方法的验证。
具体实施方式
下面结合以下实施例对本发明作进一步详细说明。
实施例1
本发明实施例1提供了一种以CD3为靶点的抗体药物对T细胞激活程度的检测方法,检测方法包括以下步骤:
S1、构建并筛选稳定表达的工程细胞株Jurkat-NFAT-Luc;
S2、调整工程细胞株Jurkat-NFAT-Luc的细胞密度,并在U底板中进行细胞铺板,细胞铺板的密度为5x10
S3、将以CD3为靶点的抗体药物进行浓度梯度稀释,起始浓度为0.5-500μg/ml,梯度稀释后,每孔50μL加入板中,同时在37℃温箱内孵育4-5小时后取出,备用;
S4、将孵育后的溶液进行离心并收集细胞沉淀,加入裂解液充分裂解后,与等体积的萤光素酶底物混合均匀,室温反应3-7min后,酶标仪在492nm波长下读取荧光值,间接检测NFAT活化因子诱导表达的萤光酶浓度,同时绘制荧光值-药物浓度曲线,并用于评价T细胞激活程度。
实施例2
本发明实施例2在实施例1的基础上进一步限定了步骤S1中,构建稳定表达的工程细胞株Jurkat-NFAT-Luc具体包括以下方法:
S11、构建NFAT活化因子的NFAT响应元件驱动的萤光素酶基因载体,NFAT响应元件的核苷酸序列如SEQ ID No.1所示;
全基因合成3X NFAT响应元件,其中上游带有KpnI酶切位点GGTACC,下游带HindIII酶切位点AAGCTT,3X NFAT响应元件全序列SEQ ID No.1如下:
ggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtggaggaaaaactgtttcatacagaaggcgtagatctagactctagagggtatataatggaagctcgaattccagcttggcattccggtactgttggtaaa;
全基因合成产物与pGL4.15质粒经KpnI和HindIII酶切后,将NFAT响应元件插入到pGL4.15载体上,构建pGL4.15-NFAT质粒载体,进行测序,结果完全正确。
S12、在萤光素酶基因载体两端插入睡美人转座子末端反向重复序列(Invertedrepeat sequence,ITR),并构建转座酶的表达载体,睡美人转座子末端反向重复序列的左臂序列ITR(L)如SEQ ID NO:2所示,睡美人转座子末端反向重复序列的右臂序列ITR(R)如SEQ ID NO:3所示,转座酶为SB11,转座酶的核苷酸序列如SEQ ID NO:4所示。
全基因合成ITR(L)和ITR(R)末端反向重复序列,其中ITR(L)序列经kpnI单酶切,ITR(R)经SalI单酶切,插入至测序正确的pGL4.15-NFAT质粒载体上;
睡美人转座子末端反向重复序列的左臂序列(SEQ ID NO:2)如下:
ggtacccagttgaagtcggaagtttacatacacttaagttggagtcattaaaactcgtttttcaactactccacaaatttcttgttaacaaacaatagttttggcaagtcagttaggacatctactttgtgcatgacacaagtcatttttccaacaattgtttacagacagattatttcacttataattcactgtatcacaattccagtgggtcagaagtttacatacactaaggtacc;
睡美人转座子末端反向重复序列的右臂序列(SEQ ID NO:3)如下:
gtcgacttgagtgtatgtaaacttctgacccactgggaatgtgatgaaagaaataaaagctgaaatgaatcattctctctactattattctgatatttcacattcttaaaataaagtggtgatcctaactgacctaagacagggaatttttactaggattaaatgtcaggaattgtgaaaaagtgagtttaaatgtatttggctaaggtgtatgtaaacttccgacttcaactggtcgac;
正确插入末端反向重复序列的pGL4.15-NFAT载体图谱如图1所示。
全基因合成SB11转座酶基因,上游携带酶切位点EcoR I,下游携带有BamH I酶切位点,合成序列如下;将序列经EcoR I和BamH I双酶切后,插入到PTSE真核表达载体上,构建的载体图谱见图2。
SB11转座酶核苷酸序列(SEQ ID NO:4)如下:
gaattcgccgccaccatgggcaagagcaaggagatctctcaggacctgcgcaagaagatcgtggatctgcacaagtccggctccagcctgggagctatcagcaagcgcctgaaggtgcctaggtcttccgtgcagaccatcgtgcgcaagtacaagcaccatggcaccacacagccttcttataggtccggcaggcggagagtgctgtccccaagggacgagagaacactggtgcgcaaggtgcagatcaaccccaggaccacagctaaggatctggtgaagatgctggaggagaccggcacaaaggtgagcatctctaccgtgaagcgggtgctgtacagacacaacctgaagggccgcagcgccaggaagaagcctctgctgcagaatcggcacaagaaggctcggctgagattcgccagagctcatggcgacaaggatcgcaccttttggaggaacgtgctgtggtctgacgagacaaagatcgagctgttcggccacaatgatcatagatacgtgtggagaaagaagggcgaggcctgcaagcccaagaacaccatccctacagtgaagcatggcggcggcagcatcatgctgtggggatgttttgctgctggaggaacaggcgctctgcacaagatcgacggcatcatgcggaaggagaattatgtggatatcctgaagcagcatctgaagacctctgtgcggaagctgaagctgggcagaaagtgggtgttccagcaggacaacgatccaaagcacacatccaagcatgtgagaaagtggctgaaggacaataaggtgaaggtgctggagtggccctcccagagccctgatctgaacccaatcgagaatctgtgggccgagctgaagaagcgcgtgagggctcgcaggcccaccaacctgacacagctgcaccagctgtgccaggaggagtgggccaagatccatccaacctactgtggcaagctggtggagggctatcccaagagactgacccaggtgaagcagtttaagggcaatgctacaaagtattgaggatcc。
S13、转座酶的表达载体电转Jurkat细胞,筛选NFAT响应元件驱动的萤光素酶基因的稳定细胞株Jurkat-NFAT-Luc。
1.睡美人转座子系统整合报告基因到Jurkat宿主细胞;
(1)提前1天传代Jurkat细胞;
(2)取RPMI1640生长培养基+10%牛血清+1%双抗加入6孔板的两孔中,2ml/孔,在培养箱中预热;另取220ul Cell line Nucleofector Solution V在培养箱中预热10min;
(3)取5μg pGL4.15-NFAT质粒于EP管中,然后再加入2μg pcDNA3.1-SB11质粒混合备用;
(4)Nucleofector电转仪开机,选择程序X-001;
(5)Jurkat细胞计数,分取100万个细胞于1支离心管中,共两支,1500rpm离心5min,弃尽上清;
(6)将预热的Cell line Nucleofector Solution V取100ul加入细胞沉淀中,后轻吹混匀,将细胞悬液加入放有质粒的EP管中,再轻吹转至电转杯中;
(7)将电转杯放入电转仪,按‘X’键,完成电转后,用试剂盒提供的吸管取500ul预热的培养基加入电转杯底部略吹吸后吸出细胞,加至已加入2ml预热培养基的6孔板中,继续培养24h。
2.加压筛选及稳定单克隆细胞株分离培养
(1)转染后24h,加入潮霉素选择培养基,筛选3周,每3-4天更换一次选择培养基;
(2)待对照组细胞全死,实验组细胞活率恢复至80%,筛选完成。计数,选择培养基稀释至50个细胞/20ml,200μL/孔铺至U-96孔板;
(3)用选择培养基培养2周,显微镜下观察,挑选有单克隆生长的细胞孔,并转移至24孔板,1周后再传至6孔板扩大培养,即得到稳定细胞株Jurkat-NFAT-Luc。
进一步的,检测方法还包括对步骤S1中构建的工程细胞株Jurkat-NFAT-Luc的检测,具体包括以下方法:
(1)对工程细胞株Jurkat-NFAT-Luc细胞铺板,1x10
(2)在细胞沉淀中加入裂解液室温反应10min,加入萤光素酶底物,酶标仪在492nm波长下读取荧光值,利用实验组除以空白对照组,计算荧光比值,选取荧光比值较高的克隆株扩增培养,即为阳性克隆株,荧光比值为实验组与空白对照组读取的荧光值的比值。
实施例3
本发明实施例3在实施例1的基础上优选的限定了步骤S2中,细胞铺板的密度为1x10
优选的,裂解液为SDS裂解液。
实施例4
本发明实施例4在实施例1的基础上优选的限定了步骤S3中,以CD3为靶点的抗体药物的氨基酸序列(SEQ ID NO:5)如下所示:
DIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSSGGGGSGGGGSGGGGSDIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELK。
本发明还提供了检测方法在含有抗CD3靶点的单克隆抗体、双特异抗体对T细胞激活程度检测中的应用。
实验例1、药物激活细胞株Jurkat与天然CD3+T细胞分泌IL-2细胞因子的情况
①PBMC分离
在50ml的SepMate分离管中加入15ml人单个核细胞分离液,将采集的新鲜人血按1:1稀释后,加入分离管中,两两配平,转移至离心机中,水平转子,1200g离心10min,离心结束后,收集管内托架上方的所有液体,转移至新的50ml普通离心管内,磷酸缓冲液(简称PBS)补足体积至50ml,依次处理完所有的离心管,两两配平后转移至离心机内,300g离心10min,清洗两次后,用分选缓冲液(分选缓冲液为含1%FBS的PBS缓冲液,PH 7.2,自行配制)重悬,计数待用。
②CD3+T细胞的分选
转移PBMC至新的无菌流式管中,并调整密度至1x10
②anti-CD3抗体激活效应检测
细胞株Jurkat和上述分选得到的CD3+T细胞参与T细胞激活程度检测实验。首先调整细胞株Jurkat和CD3+T两种细胞的密度,分别在U底板中进行细胞铺板,细胞铺板的密度为1x10
④结果
由图3可知,细胞株Jurkat与天然CD3+T细胞在抗CD3单克隆抗体药物的24h刺激下均可分泌IL-2,随着药物剂量的变化,IL-2水平呈现明显剂量梯度效应,且两种细胞呈现出较为一致细胞因子分泌趋势,由此可知,细胞株Jurkat与天然CD3+T细胞具备相同或相似的IL-2分泌的信号通路,具备构建并筛选出稳定表达NFAT驱动的萤光素酶的工程细胞株Jurkat-NFAT-Luc的细胞学基础。
实验例2、药物激活细胞株Jurkat与天然CD3+T细胞分泌IFN-γ细胞因子的情况
①PBMC分离
在50ml的SepMate分离管中加入15ml人单个核细胞分离液,将采集的新鲜人血按1:1稀释后,加入分离管中,两两配平,转移至离心机中,水平转子,1200g离心10min。离心结束后,收集管内托架上方的所有液体,转移至新的50ml普通离心管内,磷酸缓冲液(简称PBS)补足体积至50ml,依次处理完所有的离心管,两两配平后转移至离心机内,300g离心10min。清洗两次后,用分选缓冲液(分选缓冲液为含1%FBS的PBS缓冲液,PH 7.2,自行配制)重悬,计数待用。
②CD3+T细胞的分选
转移PBMC至新的无菌流式管中,并调整密度至1x10
③anti-CD3抗体激活效应检测
细胞株Jurkat和上述分选得到的天然CD3+T细胞参与T细胞激活程度检测实验。首先调整工程细胞株Jurkat和CD3+T两种细胞的密度,分别在U底板中进行细胞铺板,细胞铺板的密度为1x10
④结果
由图4可知,在抗CD3抗体药物和抗CD28抗体的共同作用下,细胞株Jurkat与天然CD3+T均可在24h检测到IFN-γ的分泌,随着药物的浓度变化,IFN-γ水平也呈现明显剂量梯度效应,且两种细胞呈现出较为一致的细胞因子分泌趋势,由此可知,细胞株Jurkat与天然CD3+T细胞具备相同或相似的IFN-γ分泌的信号通路,具备构建并筛选出稳定表达NFAT驱动的萤光素酶的工程细胞株Jurkat-NFAT-Luc的细胞学基础。
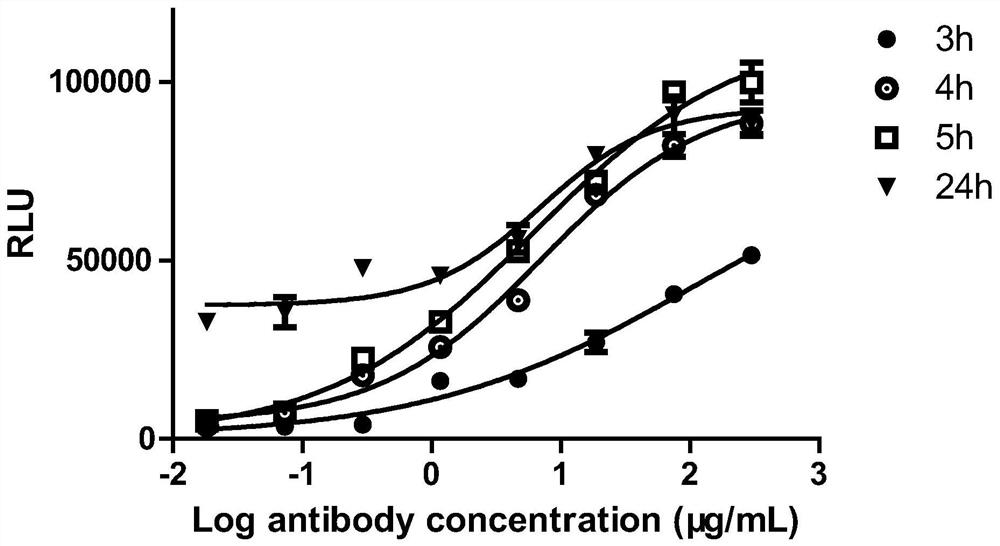
实验例3、药物激活工程细胞株Jurkat-NFAT-Luc分泌IL-2细胞因子及NFAT报告基因检测的情况
通过本发明实施例1提供的检测方法,调整实施例2构建并筛选得到的工程细胞株Jurkat-NFAT-Luc的细胞密度,在U底板中进行细胞铺板,细胞铺板的密度为1x10
由图5可知,随着作用时间的变化,荧光素酶报告基因的结果呈现出较大的变化趋势,相比孵育3h时,孵育时间4-5h左右,检测的NFAT报告基因趋于稳定,孵育24h后,进行药物激活工程细胞株Jurkat-NFAT-Luc分泌IL-2细胞因子的检测,通过图5和图6可知,其检测结果与孵育时间4-5h左右检测的NFAT报告基因无显著差异性,所以通过检测NFAT报告基因和检测IL-2细胞因子对于指征T细胞激活程度的评价较为一致,但是本发明通过检测NFAT报告基因大大缩短了检测时间。
实验例4、药物激活工程细胞株Jurkat-NFAT-Luc分泌IFN-γ细胞因子及NFAT报告基因检测的情况
通过本发明实施例1提供的检测方法,调整实施例2构建并筛选得到的工程细胞株Jurkat-NFAT-Luc的细胞密度,在U底板中进行细胞铺板,细胞铺板的密度为1x10
由图7可知,加入抗CD28抗体协同作用后,随着孵育时间的变化,荧光素酶报告基因的结果呈现出较大的变化趋势,相比孵育3h时,孵育时间约4-5h左右检测的NFAT报告基因趋于稳定,孵育24h后,进行药物激活工程细胞株Jurkat-NFAT-Luc分泌IFN-γ细胞因子的检测,通过图7和图8可知,其检测结果与孵育时间4-5h左右检测的NFAT报告基因无显著差异性,所以通过检测NFAT报告基因和检测IFN-γ细胞因子对于指征T细胞激活程度的评价较为一致,但是本发明通过检测NFAT报告基因大大缩短了检测时间。
实验例5、不同以CD3为靶点的抗体药物激活工程细胞株Jurkat-NFAT-Luc分泌NFAT报告基因的检测情况
实验产品:选择现有专利(专利号:201610886938.7,专利名称为抗EGFR和抗CD3双特异抗体及其应用,抗CD3抗体序列为SEQ ID NO:5)为实验产品一;选择现有专利(专利申请号为:201910752838.9,专利名称为:一种抗CD3和抗CD19双特异性抗体,抗CD3抗体序列为SEQ ID NO:5)为实验产品二;选择一种商业化的抗CD3和CD19双特异性抗体(购买自Invivogen,货号:bimab-hcd19cd3),抗CD3抗体克隆号为L2K-07,为实验产品三;选择现有专利(专利号:US2017/0210819A1,专利名称为BISPECIFIC HER2 AND CD3BINDINGMOLECULES,抗CD3抗体序列为SEQ ID NO:6)为实验产品四,抗CD3抗体序列为SEQ ID NO:6序列如下:
QVQLVQSGGGVVQPGRSLRLSCKASGYTFTRYTMHWVRQAPGKGLEWIGYINPSRGYTNYNQKFKDRFTISRDNSKNTAFLQMDSLRPEDTGVYFCARYYDDHYSLDYWGQGTPVTVSSGGGGSGGGGSGGGGSDIQMTQSPSSLSASVGDRVTITCSASSSVSYMNWYQQTPGKAPKRWIYDTSKLASGVPSRFSGSGSGTDYTFTISSLQPEDIATYYCQQWSSNPFTFGQGTKLQITR;
选择一种商业化的抗CD3单克隆抗体(购买自BD pharmingen,货号:555337),抗CD3抗体克隆号为HIT3a,为实验产品五;选择现有专利(专利号为:201310170001.6,专利名称为:一种新型的人源化抗CD22抗体,该抗体靶点为CD22)为实验产品六;
具体方法:通过本发明实施例1提供的检测方法,调整实施例2构建并筛选得到的工程细胞株Jurkat-NFAT-Luc的细胞密度,在U底板中进行细胞铺板,细胞铺板的密度为1x10
如图9所示,与实验产品六相比,其余五种以CD3为靶点的抗体药物均可通过工程细胞株Jurkat-NFAT-Luc诱导表达NFAT报告基因的检测来评价对T细胞的激活程度,由此可以说明,本发明提供的方法能够用于以CD3为靶点的抗体药物对T细胞激活程度的评价,应用范围广,可作为多种以CD3为靶点的抗体药物的质量放行标准方法。
实验例6、方法学验证——稳定性及准确性
将实施例2中获得的工程细胞株Jurkat-NFAT-Luc传代培养,在第10代、17代、25代、30代时冻存,然后同一时间同时复苏上述细胞,通过实施例1中提供的检测方法进行T细胞激活程度的检测,结果如图10所示。
通过图10显示,该工程细胞株Jurkat-NFAT-Luc多次传代后,用于T细胞激活程度的检测,实验结果稳定,为此,本发明构建并筛选得到的工程细胞株Jurkat-NFAT-Luc可以建立成熟而稳定的功能性检测方法,可以做到随时检测随时复苏后即可使用,无需抽新鲜人血再用于实验,大大节省了经济成本,缩短了实验时间。
选择现有专利(专利号:201610886938.7,专利名称为抗EGFR和抗CD3双特异抗体及其应用,抗CD3抗体序列为SEQ ID NO:5)为工作参考品,按照实验例1中提供的现有方法检测分泌IFN-γ细胞因子得出的EC50值作为参考标准;
选择现有专利(专利号:201610886938.7,专利名称为抗EGFR和抗CD3双特异抗体及其应用,抗CD3抗体序列为SEQ ID NO:5)在中试生产与工作参考品不同批次的产品作为实验样品,参考以下数据表设置1-5组以不同作用浓度起始,4x梯度对样品进行稀释,按照本发明实施例1提供的检测方法进行T细胞激活程度的检测,计算EC50值,参照以下公式计算各浓度点准确度,并计算准确度的相对标准偏差,具体数据参考下表及图11所示。
准确度计算公式:准确度(%)=(实测值÷真实值)x100%
通过上表数据和图11所示,不同批次的以CD3为靶点的抗体药物通过使用本发明提供的方法与现有方法建立的参考标准相比,本发明提供的方法在设置不同的药物浓度的前提下,准确度均在83%-110%范围内,符合药典要求,所以本实验例再次验证了本发明提供的方法能够用于以CD3为靶点的抗体药物对T细胞激活程度的检测方法。
本发明不局限于上述最佳实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是具有与本申请相同或相近似的技术方案,均落在本发明的保护范围之内。
序列表
<110> 北京东方百泰生物科技股份有限公司
<120> 一种以CD3为靶点的抗体药物对T细胞激活程度的检测方法
<160> 6
<170> SIPOSequenceListing 1.0
<210> 1
<211> 160
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 1
ggaggaaaaa ctgtttcata cagaaggcgt ggaggaaaaa ctgtttcata cagaaggcgt 60
ggaggaaaaa ctgtttcata cagaaggcgt agatctagac tctagagggt atataatgga 120
agctcgaatt ccagcttggc attccggtac tgttggtaaa 160
<210> 2
<211> 239
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 2
ggtacccagt tgaagtcgga agtttacata cacttaagtt ggagtcatta aaactcgttt 60
ttcaactact ccacaaattt cttgttaaca aacaatagtt ttggcaagtc agttaggaca 120
tctactttgt gcatgacaca agtcattttt ccaacaattg tttacagaca gattatttca 180
cttataattc actgtatcac aattccagtg ggtcagaagt ttacatacac taaggtacc 239
<210> 3
<211> 240
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 3
gtcgacttga gtgtatgtaa acttctgacc cactgggaat gtgatgaaag aaataaaagc 60
tgaaatgaat cattctctct actattattc tgatatttca cattcttaaa ataaagtggt 120
gatcctaact gacctaagac agggaatttt tactaggatt aaatgtcagg aattgtgaaa 180
aagtgagttt aaatgtattt ggctaaggtg tatgtaaact tccgacttca actggtcgac 240
<210> 4
<211> 1044
<212> DNA
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 4
gaattcgccg ccaccatggg caagagcaag gagatctctc aggacctgcg caagaagatc 60
gtggatctgc acaagtccgg ctccagcctg ggagctatca gcaagcgcct gaaggtgcct 120
aggtcttccg tgcagaccat cgtgcgcaag tacaagcacc atggcaccac acagccttct 180
tataggtccg gcaggcggag agtgctgtcc ccaagggacg agagaacact ggtgcgcaag 240
gtgcagatca accccaggac cacagctaag gatctggtga agatgctgga ggagaccggc 300
acaaaggtga gcatctctac cgtgaagcgg gtgctgtaca gacacaacct gaagggccgc 360
agcgccagga agaagcctct gctgcagaat cggcacaaga aggctcggct gagattcgcc 420
agagctcatg gcgacaagga tcgcaccttt tggaggaacg tgctgtggtc tgacgagaca 480
aagatcgagc tgttcggcca caatgatcat agatacgtgt ggagaaagaa gggcgaggcc 540
tgcaagccca agaacaccat ccctacagtg aagcatggcg gcggcagcat catgctgtgg 600
ggatgttttg ctgctggagg aacaggcgct ctgcacaaga tcgacggcat catgcggaag 660
gagaattatg tggatatcct gaagcagcat ctgaagacct ctgtgcggaa gctgaagctg 720
ggcagaaagt gggtgttcca gcaggacaac gatccaaagc acacatccaa gcatgtgaga 780
aagtggctga aggacaataa ggtgaaggtg ctggagtggc cctcccagag ccctgatctg 840
aacccaatcg agaatctgtg ggccgagctg aagaagcgcg tgagggctcg caggcccacc 900
aacctgacac agctgcacca gctgtgccag gaggagtggg ccaagatcca tccaacctac 960
tgtggcaagc tggtggaggg ctatcccaag agactgaccc aggtgaagca gtttaagggc 1020
aatgctacaa agtattgagg atcc 1044
<210> 5
<211> 240
<212> PRT
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 5
Asp Ile Lys Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Thr Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser Pro Ala Ile
130 135 140
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser
145 150 155 160
Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser
165 170 175
Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Val Ala Ser Gly Val Pro
180 185 190
Tyr Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
195 200 205
Ser Ser Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp
210 215 220
Ser Ser Asn Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
225 230 235 240
<210> 6
<211> 241
<212> PRT
<213> 2 Ambystoma laterale x Ambystoma jeffersonianum
<400> 6
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Ala Phe
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly Val Tyr Phe Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Ser Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
130 135 140
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser
145 150 155 160
Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr Pro Gly Lys Ala
165 170 175
Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro
180 185 190
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile
195 200 205
Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp
210 215 220
Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Gln Ile Thr
225 230 235 240
Arg
- 一种以CD3为靶点的抗体药物对T细胞激活程度的检测方法
- 一种以CD3为靶点的抗体药物对T细胞激活程度的检测方法
