变体腺伴随病毒及使用方法
文献发布时间:2023-06-19 19:30:30
本申请是基于申请日为2017年6月15日,优先权日为2016年6月15日,申请号为201780044853.7,发明名称为:“变体腺伴随病毒及使用方法”的专利申请的分案申请。
联邦资助的研究或开发
本发明是在国立卫生研究院授予的EY022975的政府支持下完成的。政府拥有本发明的某些权利。
对相关申请的交叉引用
本申请要求2016年6月15日提交的美国申请No.62/350,361和2016年10月5日提交的美国申请No.62/404,585的35U.S.C.§119(e)下的优先权权益。
技术领域
本公开一般涉及变体腺伴随病毒及其制备和使用方法。
背景技术
脑功能诸如感知、认知和运动控制依赖于大规模神经网络的协调作用,所述大规模神经网络由进行特定计算并通过分配这些计算的结果的长距离连接而连接在一起的局部回路模块组成。此类长距离连接由专用的投射神经元形成,所述投射神经元通常包括几个混合类别,每个类别投射到网络内的不同下游靶标。也已经在几种神经变性疾病从空间定位的发作部位的扩散中牵涉投射神经元。因此,选择性靶向投射神经元的特定类别以用于转基因递送(例如用于活性监测/操作或基因组编辑以用于靶向基因敲除或修复病理突变)的能力对于了解大规模网络如何促成脑功能以及从长远来看对于神经变性疾病中的治疗干预两者会是重要的。
病毒载体构成将转基因引入特定神经元群体的一类重要工具,并且是迄今为止经由轴突末端处的进入以及将其有效负载(payload)逆行(retrograde)转运至细胞核的对靶标投射神经元的遗传接近(genetic access)的最佳选择。许多自然进化的亲神经病毒表现出逆行扩散作为其生命周期中的部分,特别包括狂犬病、脊髓灰质炎病毒和单纯疱疹病毒(HSV)。在这些中,狂犬病病毒特别是神经侵入性的,并通过跨细胞转移迅速通过神经系统扩散。然而,尽管在降低其毒性方面正在取得进展,但它在生物调查和基因疗法两者方面的潜力受到过度毒力的阻碍。在天然亲神经毒株外,许多其他病毒在直接施用于神经系统时可感染神经元,其中“假狂犬病(pseudorabies)”(SuHV1,实际上是疱疹病毒)、腺病毒和慢病毒在动物研究中最常用。犬腺病毒-2(CAV-2)在这类病毒中表现出最佳的感染性和逆行转运,并且越来越成为接近投射神经元的选择试剂。然而,CAV-2仅介导适度水平的转基因表达,表现出毒性的潜力,并且目前不易与用于产生临床级或者甚至大型动物研究的可扩展的稳健(robust)生产相容。因此,仍然迫切需要开发无毒性、易于制造的病毒载体,其提供不同转基因的灵活包装,被轴突稳健内化和逆向转运,并且支持长期高水平的有效负载表达。
发明内容
有效逆行接近投射神经元以递送传感器和效应器构成了回路切割(circuitdissection)的重要且成为可能的能力。此类方法也可用于基因疗法,包括治疗以通过功能连接和高度分布的网络病理扩散为特征的神经变性病症。特别地,病毒载体是用于神经系统的强大的基因递送载体,但是所有可用的工具都遭受低效的逆行转运或有限的临床潜力。为了满足此需求,应用体内定向进化以将有力的逆行功能性工程化改造成腺伴随病毒(AAV)的壳体(已经在神经科学研究和临床中显示前景的载体)中。本文所述的变体(称为rAAV2-retro)允许以与经典的合成逆行标记试剂相当的效率稳健逆行接近投射神经元,并且实现足以在靶向的神经元群体中进行功能性回路询问和使用CRISPR/Cas9进行的体内基因组编辑的高表达水平。
在一方面,提供了病毒壳体蛋白,其包含选自下组的序列:xxDxTKx(SEQ ID NO:1)和xDxTKxx(SEQ ID NO:2)。在一个实施方案中,病毒壳体蛋白与SEQ ID NO:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76或78具有至少95%的序列同一性。在一个实施方案中,病毒壳体蛋白具有SEQ ID NO:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、或78中显示的序列。在一个实施方案中,病毒壳体蛋白由与SEQ ID NO:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、或77具有至少95%序列同一性的核酸编码。在一个实施方案中,病毒壳体蛋白由具有SEQ ID NO:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、和77中显示的序列的核酸编码。
在另一方面,提供了病毒颗粒,其包含如本文所述的病毒壳体蛋白。在一些实施方案中,病毒颗粒表现出对逆行运动的偏爱。在一些实施方案中,病毒颗粒拥有逆行转运能力。
在一些实施方案中,如本文所述的病毒颗粒还包含编码有效负载的核酸。在一些实施方案中,编码有效负载的核酸包括与编码有效负载的编码序列可操作连接的启动子序列。代表性的启动子序列包括但不限于突触蛋白-1、CMV、GFAP、CAG、CaMKII、MBP、EF1alpha、TRE和mD1x。在一些实施方案中,编码有效负载的编码序列选自下组:蛋白质编码基因和抑制性RNA核酸。在一些实施方案中,抑制性RNA核酸是反义寡核苷酸、siRNA或RNAi。
在一些实施方案中,有效负载是效应蛋白。代表性的效应蛋白包括但不限于重组酶(例如,Cre或Flp)、基因编辑系统(例如,CRISPR/Cas9、TALEN、锌指核酸酶)、光遗传学试剂(激活剂(例如,通道视紫红质(channelrhodopsin)或其变体)或抑制剂(例如,盐细菌视紫红质(halorhodopsin)或Arch))、化学遗传学试剂(chemogenetic reagent)(例如,DREADD或PSAM/PSEM系统的激活剂/抑制剂形式)、细胞系统途径的激活剂和/或抑制剂和用于控制表观遗传学(epigenetics)的酶。
在一些实施方案中,有效负载是光学报告物构建体。代表性的光学报告物构建体包括但不限于GCaMP6(s、m或f)、荧光团(例如绿色荧光蛋白(GFP)、增强型GFP(EGFP)、红色荧光蛋白(RFP)、黄色荧光蛋白(YFP),tdTomato)、颜色翻转构建体(color-flippingconstruct)(例如,在一种细胞群体中表达一种报告物并在另一种群体中表达不同报告物的有效负载)、葡萄糖传感器、jRCaMP、jRGECO、和CaMPARI、电压指示器、第二信使、受体信号物(receptor signaler)、转录报告物、表观遗传报告物和神经调节剂报告物。
在一些实施方案中,有效负载是病毒蛋白。代表性的病毒蛋白是狂犬病病毒G蛋白。在一些实施方案中,病毒蛋白是互补除AAV之外的病毒或与细胞和跨细胞转运有关的蛋白质的功能的蛋白质。
在一些实施方案中,编码有效负载的编码序列是治疗基因。在一些实施方案中,治疗基因用于治疗神经变性疾病。在一些实施方案中,治疗基因是用于治疗阿尔茨海默氏病或具有毒性蛋白质聚集体的其他疾病的HSP104。在一些实施方案中,治疗基因是用于治疗弗里德赖希氏共济失调(Friedreich’sataxia)的frataxin。在一些实施方案中,治疗基因是用于治疗帕金森氏病的溶酶体葡糖脑苷脂酶(glucocerebrosidase)(GBA)。在一些实施方案中,治疗基因是用于治疗亨廷顿氏病的polyQ结合蛋白。在一些实施方案中,治疗基因是用于治疗脊髓性肌萎缩(Spinal muscular atrophy)、肌萎缩侧索硬化(amyotrophiclateral sclerosis)(ALS)、自闭症、痴呆、周围神经病、精神分裂症或视网膜变性的存活运动神经元1。
在一些实施方案中,有效负载是治疗部分。代表性治疗部分是抗体或其片段。代表性治疗部分是免疫调节蛋白。代表性治疗部分是RNA干扰分子。
在一些实施方案中,所述病毒颗粒比犬腺病毒-2(CAV-2)表现出大高达两个数目级的逆行接近皮质-脑桥投射神经元(retrograde access to cortico-pontineprojection neuron)。在一些实施方案中,所述逆行接近皮质-脑桥投射神经元或对背内侧纹状体(dorsomedial striatum)(DMS)的传入与合成示踪剂Fluoro-Gold荧光珠相当。
在另一方面,提供了对一个或多个神经元递送有效负载的方法。此类方法包括使一个或多个神经元与包含包装于其中的有效负载的变体腺伴随病毒(AAV)接触,其中所述变体AAV包含壳体蛋白,所述壳体蛋白包含选自下组的序列:xxDxTKx(SEQ ID NO:1)和xDxTKxx(SEQ ID NO:2)。在一些实施方案中,变体AAV在神经元中表现出逆行运动。
在一些实施方案中,神经元是投射神经元。在一些实施方案中,神经元在受试者中(例如,在受试者的中枢神经系统(CNS)中)。在一些实施方案中,受试者是人。在一些实施方案中,受试者是非人类(例如,灵长类、啮齿类、爬行动物或禽类)。在一些实施方案中,接触步骤是在细胞培养中。在一些实施方案中,接触步骤通过颅内、脊柱内或肌内注射而在体内。
本发明进一步涉及以下实施方案:
1.病毒壳体蛋白,其包含选自下组的序列:xxDxTKx(SEQ ID NO:1)和xDxTKxx(SEQID NO:2)。
2.实施方案1的病毒壳体蛋白,其中所述病毒壳体蛋白与选自下组的氨基酸序列具有至少95%的序列同一性:SEQ ID NO:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76和78。
3.实施方案1的病毒壳体蛋白,其中所述病毒壳体蛋白具有选自下组的氨基酸序列:SEQ ID NO:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76和78。
4.实施方案1的病毒壳体蛋白,其中所述病毒壳体蛋白由与选自下组的核酸序列具有至少95%序列同一性的核酸编码:SEQ ID NO:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75和77。
5.实施方案1的病毒壳体蛋白,其中所述病毒壳体蛋白由具有选自下组的序列的核酸编码:SEQ ID NO:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75和77。
6.病毒颗粒,其包含实施方案1-5中任一项的病毒壳体蛋白。
7.实施方案6的病毒颗粒,其中所述病毒颗粒表现出对逆行运动的偏爱。
8.实施方案6的病毒颗粒,其中所述病毒颗粒拥有逆行转运能力。
9.实施方案6-8中任一项的病毒颗粒,其还包含编码有效负载(payload)的核酸。
10.实施方案9的病毒颗粒,其中所述编码有效负载的核酸包含与编码所述有效负载的编码序列可操作连接的启动子序列。
11.实施方案10的病毒颗粒,其中所述启动子选自下组:突触蛋白-1、CMV、GFAP、CAG、CaMKII、MBP、EF1alpha、TRE和mDlx。
12.实施方案10或11的病毒颗粒,其中所述编码有效负载的编码序列选自下组:蛋白质编码基因和抑制性RNA核酸。
13.实施方案12的病毒颗粒,其中所述抑制性RNA核酸是反义寡核苷酸、siRNA或RNAi。
14.实施方案9的病毒颗粒,其中所述有效负载是效应蛋白。
15.实施方案14的病毒颗粒,其中所述效应蛋白选自下组:重组酶(例如,Cre或Flp)、基因编辑系统(例如,CRISPR/Cas9、TALEN、锌指核酸酶)、光遗传学试剂(激活剂(例如,通道视紫红质(channelrhodopsin)或其变体)或抑制剂(例如,盐细菌视紫红质(halorhodopsin)或Arch))、化学遗传学试剂(例如,DREADD或PSAM/PSEM系统的激活剂/抑制剂形式)、细胞系统途径的激活剂和/或抑制剂和用于控制表观遗传学(epigenetics)的酶。
16.实施方案9的病毒颗粒,其中所述有效负载是光学报告物构建体。
17.实施方案16的病毒颗粒,其中所述光学报告物构建体选自下组:GCaMP6(s、m或f)、荧光团(例如绿色荧光蛋白(GFP)、增强型GFP(EGFP)、红色荧光蛋白(RFP)、黄色荧光蛋白(YFP),tdTomato)、颜色翻转构建体(color-flipping construct)(例如,在一种细胞群体中表达一种报告物并在另一种群体中表达不同报告物的有效负载)、葡萄糖传感器、jRCaMP、jRGECO、和CaMPARI、电压指示器、第二信使、受体信号物(receptor signaler)、转录报告物、表观遗传报告物和神经调节剂报告物。
18.实施方案9的病毒颗粒,其中所述有效负载是病毒蛋白。
19.实施方案18的病毒颗粒,其中所述病毒蛋白是狂犬病G蛋白。
20.实施方案18的病毒颗粒,其中所述病毒蛋白是互补除AAV以外的病毒的功能的蛋白质或与细胞和跨细胞转运相关的蛋白质。
21.实施方案9的病毒颗粒,其中所述编码有效负载的编码序列是治疗基因。
22.实施方案21的病毒颗粒,其中所述治疗基因用于治疗神经变性病症。
23.实施方案22的病毒颗粒,其中所述治疗基因是用于治疗阿尔茨海默氏病或具有毒性蛋白质聚集体的其他疾病的HSP104。
24.实施方案22的病毒颗粒,其中所述治疗基因是用于治疗弗里德赖希氏共济失调(Friedreich’s ataxia)的frataxin。
25.实施方案22的病毒颗粒,其中所述治疗基因是用于治疗帕金森氏病的溶酶体葡糖脑苷脂酶(glucocerebrosidase)(GBA)。
26.实施方案22的病毒颗粒,其中所述治疗基因是用于治疗亨廷顿氏病的polyQ结合蛋白。
27.实施方案22的病毒颗粒,其中所述治疗基因是用于治疗脊髓性肌萎缩(Spinalmuscular atrophy)、肌萎缩侧索硬化(amyotrophic lateral sclerosis)(ALS)、自闭症、痴呆、周围神经病、精神分裂症或视网膜变性的存活运动神经元1。
28.实施方案9的病毒颗粒,其中所述有效负载是治疗部分。
29.实施方案28的病毒颗粒,其中所述治疗部分是抗体或其片段。
30.实施方案28的病毒颗粒,其中所述治疗部分是免疫调节蛋白。
31.实施方案28的病毒颗粒,其中所述治疗部分是RNA干扰分子。
32.实施方案6-28中任一项的病毒颗粒,其中所述病毒颗粒比犬腺病毒-2(CAV-2)表现出大高达两个数目级的逆行接近皮质-脑桥投射神经元(retrograde access tocortico-pontine projection neuron)。
33.实施方案6-28中任一项的病毒颗粒,其中所述逆行接近皮质-脑桥投射神经元或对背内侧纹状体(dorsomedial striatum)(DMS)的传入与合成示踪剂Fluoro-Gold荧光珠相当。
34.对一个或多个神经元递送有效负载的方法,所述方法包括:
使一个或多个神经元与包含包装于其中的有效负载的变体腺伴随病毒(AAV)接触,其中所述变体AAV包含壳体蛋白,所述壳体蛋白包含选自下组的序列:xxDxTKx(SEQ IDNO:1)和xDxTKxx(SEQ ID NO:2)。
35.实施方案34的方法,其中所述变体AAV在神经元中表现出逆行运动。
36.实施方案34的方法,其中所述神经元是投射神经元。
37.实施方案34-36中任一项的方法,其中所述神经元在受试者中。
38.实施方案34-37中任一项的方法,其中所述神经元位于受试者中的中枢神经系统(CNS)中。
39.实施方案34-38中任一项的方法,其中所述受试者是人。
40.实施方案34-38中任一项所述的方法,其中所述受试者是非人类。
41.实施方案40所述的方法,其中所述非人类受试者是灵长类、啮齿类、爬行动物和禽类。
42.实施方案34-36中任一项的方法,其中所述接触步骤是在细胞培养中。
43.实施方案34-41中任一项的方法,其中所述接触步骤是经由颅内、脊柱内或肌内注射而在体内。
除非另外定义,否则本文中使用的所有技术和科学术语具有与方法和物质组合物所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文所述的那些方法和材料类似或等同的方法和材料可用于实践或测试方法和物质组合物,但下文描述了合适的方法和材料。另外,材料、方法和实例仅是示例性的而不是限制性的。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入。
附图说明
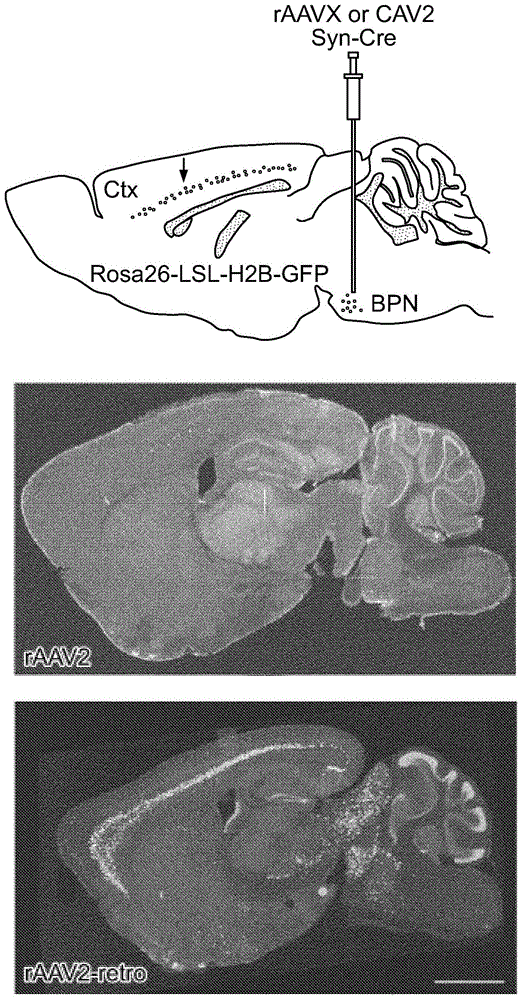
图1A-图1B显示了rAAV2-retro的定向进化。图1A是定向进化程序的示意图。将先前通过易错PCR、肽插入、环区域随机化和DNA改组产生的含有变体AAV cap基因的质粒文库包装并注射到黑质或深小脑核中。3周后,分别取出纹状体或后脑组织,分离病毒基因组,并且将选择的cap基因扩增并包装以用于接着的选择轮次。图1B显示通过在相应的轴突场(axonal field)中注射携带不同荧光蛋白的rAAV2-retro逆行标记的投射到纹状体(CP:尾状壳核)、丘脑和上丘(SC)的皮质神经元的混合亚群。
图2A-图2D显示了来自实验的结果以量化逆行转运效率。图2A显示通过基底脑桥注射rAAV2-retro标记的皮质-脑桥束[图2A的上图显示了实验的示意图;通过共注射AAV1-CAG-EGFP监测靶向和注射质量的一致性。图2A的下图显示注射后3周的表达水平。比例尺:1mm]。图2B显示了量化测定法设计[图2B的上图显示了实验的示意图;箭头指示在皮质-脑桥束的皮层神经元中预期的核GFP标记。图2B的中间图显示注射有AAV2的脑的代表性图像。图2B的底部图显示注射有rAAV2retro的脑的代表性图像。比例尺:1mm]。图2C显示了半自动量化程序的示意图。自动检测荧光核(绿色)并沿着追踪皮质层V(黑色)长度的手动绘制线计数。图2D显示了不同AAV血清型和犬腺病毒-2(CAV-2)的逆行转运效率。误差棒代表SEM。还见图8。
图3A-图3C显示了来自实验的结果以证明由rAAV2-retro提供的逆行转运的一般性。图3A是代表性图像,其显示在对背侧纹状体的主要输入结构中的广泛标记,包括皮质(图像#1)、杏仁核(图像#3)和丘脑(图像#4)。图3B显示了逆行标记的自动化全脑量化的示意图。对用rAAV2-retro hSyn1-Cre注射的Rosa26-LSL-H2B-GFP的脑成像以显现经DAPI染色的核和来自表达H2B-GFP的核的绿色荧光。使用绿色通道来检测经标记的神经元;将蓝色通道与艾伦脑研究所(Allen Brain Institute)标准鼠脑的Nissl图像比对。比对允许使用由脑图册提供的注释将检测到的神经元分配到不同区域。比例尺:1.25mm。图3C显示了背侧-内侧纹状体的小区域中的逆行标记的全脑量化。根据艾伦脑图册给出不同脑区的缩写。箭头突出显示了SNc。误差棒代表SEM。
图4A-图4B是来自实验的数据,其中将rAAV2-retro系统与Cre驱动系组合。图4A显示了实验的示意图。将携带Cre依赖性颜色翻转荧光报告物的rAAV2-retro注射到皮质层V特异性Cre系的纹状体中。图4B显示了两条皮质-纹状体途径经由一条途径中而非另一条中的报告物的Cre依赖性转化进行差异标记。
图5A-图5F是来自实验的数据,显示rAAV2-retro支持用于功能性回路询问的足够的转基因表达。图5A是实验的示意图。使用将rAAV2-retro局部注射入基底脑桥中,将钙指示剂GCaMP6f的表达限于皮质-脑桥神经元。图5B是脑的横截面,显示整个皮质-脑桥束中的GCaMP6f表达。图5C显示双光子钙图像的最大投射,显示层V锥体束体和顶端树突。图5D显示了在单次手触及重复(single hand reach repetition)期间89个ROI的活动(虚线表示音调(tone)“去”信号)。图5E和5F是在40次连续试验期间的单一皮质-脑桥神经元的两个实例(与图5B和图5D中相同的动物)。
图6A-图6C是显示rAAV2-retro系统使用CRISPR/Cas9实现体内基因组编辑的数据。图6A是实验的示意图[图6A的上图显示使用rAAV2-retro系统递送金黄色葡萄球菌Cas9(SaCas9)——单一引导RNA组合,其工程化改造为消除tdTomato的表达。图6A的下图显示将携带SaCas9-anti-tdTomato有效负载的rAAV2-retro注射到自V层神经元中单个基因组基因座表达tdTomato的小鼠的基础脑桥中。图6B显示了接受靶向tdTomato或携带非靶向指导的CRISPR/Cas9系统的动物的脑切片的代表性图像。将SaCas9进行表位标记,允许鉴定逆行标记的神经元(绿色通道)。向上箭头显示成功消融tdTomato后的预期标记;若tdTomato表达不受影响,则向下箭头显示预期的标记。图6C显示了消融效率。误差棒代表SEM。
图7A-图7E的数据显示rAAV2-retro介导对大鼠中投射神经元的有效接近(图7中所示的数据与图1中所示的数据相关)。图7A是注射的示意图。分别在纹状体或上丘中注射表达EGFP或tdTomato的分开的rAAV2-retro批次。图7B-7E显示通过这些局部注射接近并且在病毒递送后3周成像的各种脑区中的投射神经元。
图8是来自在基底脑桥中注射各种AAV血清型的动物的脑的代表性图像,显示无天然存在的AAV血清型与皮质-脑桥回路中的rAAV2-retro性能相匹配(图8中所示的数据与图2中所示的数据相关)。
图9A-图9B的数据显示与其亲本血清型AAV2相比rAAV2-retro的肝素亲和力降低(图9中所示的数据与图1中所示的数据相关)。图9A是肝素结合测定法的示意图。图9B显示在150mM NaCl中加载后用增加浓度的NaCl洗脱的病毒的分数。载荷分数表示在150mM NaCl中加载样品后在柱流动(column flow-throw)中回收的病毒。误差棒表示SD。
发明详述
重组腺伴随病毒(rAAV)已经成为体内基因疗法的有效平台,因为它们介导高水平的转基因表达,是无毒的,并且引起最小的免疫应答。这些特性是决定授予rAAV介导的脂蛋白脂肪酶缺乏症恢复的任何基因疗法治疗的首次完全监管批准的核心(参见例如Gaudetet al.,2010,Atherosclerosis Supplem.,11:55-60)。rAAV在一系列神经系统病症的临床试验中具有很大的前景,并且它们构成了神经科学研究中最广泛的载体之一。自从最初发现AAV可以进行逆行运输(Kaspar et al.,2002,Mol.Ther.,5:50-56)以来,rAAV对选择回路中的投射神经元提供了一定程度的逆行接近,但它们的逆行转运的自然倾向很低,阻碍了解决投射神经元在回路计算或疾病进展中的作用的努力。
本公开内容描述了新的rAAV变体(rAAV2-retro),所述rAAV变体除了其在暴露部位感染神经元细胞体的常规能力之外,还被轴突强有力地内化并且以与经典逆行标记试剂诸如合成染料相当的效率介导对投射神经元的逆行接近。本文所述的rAAV2-retro基因递送系统可以单独使用或与Cre重组酶驱动系结合使用,以实现长期、高水平转基因表达,以足以有效功能性询问神经回路功能以及靶向神经元群体中的基因组编辑。
逆行转运使分子和/或细胞器远离轴突末端朝向细胞体穿梭。逆行轴突转运由胞质动力蛋白介导,并且例如用于将去往内溶酶体(endolysosomes)的化学信息和胞吞产物从轴突发送回细胞。以约2μm/sec的平均速度在体内操作,快速逆行转运可以每天覆盖10-20厘米。快速逆行转运使用过的突触囊泡和其他材料返回到体细胞,并对体细胞通知轴突末端的条件。因此,如本文所用,“逆行”转运是指轴突中向其细胞体的运动。
腺伴随病毒(AAV)核酸和多肽序列
如本文所述,鉴定了共有序列,所述共有序列当存在于AAV壳体蛋白中时,导致逆行转运功效的明显增强。那些共有序列是xxDxTKx(SEQ ID NO:1)或xDxTKxx(SEQ ID NO:2)。为了证明本文所述的共有序列用于赋予逆行转运能力的效率,产生了17种不同的壳体序列,每种壳体序列含有如本文所述的共有序列,并表现出对神经元中逆行运动的偏爱。那40种壳体序列的核酸序列示于SEQ ID NO:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75和77,并且编码的壳体多肽(每种壳体多肽含有本文所述共有序列之一)分别示于SEQ ID NO:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76和78。
除了具有SEQ ID NOs:SEQ ID NO:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76和78中所示的序列的壳体多肽外,提供了多肽,其与具有SEQ ID NOs:SEQ ID NO:4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76和78中所示的序列的壳体多肽具有至少95%的序列同一性(例如,至少96%,至少97%,至少98%,至少99%或100%序列同一性)。类似地,除了具有SEQ ID NO:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75和77中所示的序列的核酸分子外,提供了与具有SEQ IDNOs:SEQ IDNO:3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75和77中所示的序列的核酸分子具有至少95%序列同一性(例如,至少96%,至少97%,至少98%,至少99%或100%序列同一性)的核酸分子。
在计算百分比序列同一性时,比对两个序列,并确定两个序列之间核苷酸或氨基酸残基的相同匹配数目。将相同匹配的数目除以比对区域的长度(即,比对的核苷酸或氨基酸残基的数目)并乘以100以得到百分比序列同一性值。应当理解,比对区域的长度可以是一个或这两个序列的一部分,直到最短序列的全长大小。还应当理解,单一序列可以与超过一个其他序列比对,因此,可以在每个比对区域内具有不同的百分比序列同一性值。
可以使用Altschul等人(1997,Nucleic Acids Res.,25:3389 3402)描述的算法进行两个或更多个序列的比对以确定百分比序列同一性,如掺入可在万维网上的ncbi.nlm.nih.gov获得的BLAST(基本局部比对搜索工具)程序的。可以进行BLAST搜索以确定序列(核酸或氨基酸)与使用Altschul等人算法比对的任何其他序列或其部分之间的百分比序列同一性。BLASTN是用于比对和比较核酸序列之间的同一性的程序,而BLASTP是用于比对和比较氨基酸序列之间的同一性的程序。当利用BLAST程序计算序列与另一序列之间的百分比同一性时,通常使用相应程序的默认参数。
还提供了含有编码多肽的核酸分子的载体。包括表达载体的载体是商品化的或者可以通过重组技术产生。含有核酸分子的载体可以具有一个或多个与此类核酸分子可操作连接的用于表达的元件,并且还可以包括诸如编码选择标志物(例如抗生素抗性基因)的序列,和/或可以用于纯化多肽的序列(例如,6xHis标签)等的序列。用于表达的元件包括指导和调节核酸编码序列表达的核酸序列。表达元件的一个实例是启动子序列。表达元件还可包括内含子、增强子序列、响应元件或调节核酸分子表达的可诱导元件中的一种或多种。表达元件可以是细菌、酵母、昆虫、哺乳动物或病毒起源的,并且载体可以包含来自不同起源的表达元件的组合。如本文所用,可操作连接指用于表达的元件以指导或调节编码序列的表达的方式相对于编码序列位于载体中。
可以将核酸分子,例如载体(例如,表达载体,病毒载体)中的核酸分子导入宿主细胞中。术语“宿主细胞”不仅指已经导入有核酸分子的特定细胞,而且还指此类细胞的后代或潜在后代。许多合适的宿主细胞是本领域技术人员已知的;宿主细胞可以是原核细胞(例如大肠杆菌)或真核细胞(例如酵母细胞、昆虫细胞、植物细胞、哺乳动物细胞)。代表性的宿主细胞可以包括但不限于A549,WEHI,3T3,10T1/2,BHK,MDCK,COS 1,COS 7,BSC 1,BSC40,BMT 10,VERO,WI38,HeLa,293cells,Saos,C2C12,L细胞,HT1080,HepG2和源自哺乳动物,包括人,猴,小鼠,大鼠,兔和仓鼠的原代成纤维细胞,肝细胞和成肌细胞。用于将核酸分子导入宿主细胞中的方法是本领域中公知的,包括但不限于磷酸钙沉淀,电穿孔,热休克,脂转染,显微注射和病毒介导的核酸转移(例如转导)。
就多肽而言,“纯化的”是指已经从其天然伴随的细胞组分中分离或纯化的多肽(即肽或多肽)。通常,当多肽以干重计至少70%(例如,至少75%,80%,85%,90%,95%或99%)不含其天然相关的多肽和天然存在的分子时,认为它是“纯化的”。由于化学合成的多肽本质上与其天然伴随的组分分离,因此认为合成多肽是“纯化的”,但是可以从用于合成多肽的组分(例如,氨基酸残基)中进一步取出。就核酸分子而言,“分离的”是指与基因组中通常与其相关的其他核酸分子分离的核酸分子。另外,分离的核酸分子可以包括工程化核酸分子,如重组或合成核酸分子。
可以通过已知方法如DEAE离子交换,凝胶过滤和/或羟基磷灰石层析从天然来源(例如,生物样品)获得(例如纯化)多肽。纯化的多肽也可以例如通过在表达载体中表达核酸分子或通过化学合成来获得。多肽的纯度可以使用任何合适的方法测量,例如柱色谱,聚丙烯酰胺凝胶电泳或HPLC分析。类似地,可以使用常规方法获得(例如,分离)核酸分子,例如但不限于重组核酸技术(例如,限制酶消化和连接)或聚合酶链式反应(PCR;参见例如PCRPrimer:A Laboratory Manual,Dieffenbach&Dveksler编,Cold Spring HarborLaboratory Press,1995)。另外,可以化学合成分离的核酸分子。
制备表现出神经元中的逆行运动的偏爱的病毒颗粒的方法
一旦产生了壳体多肽,或者一旦产生了核酸分子并表达以产生壳体多肽,就可以使用例如包装宿主细胞将多肽组装成病毒颗粒。可以使用一种或多种载体将病毒颗粒的组分(例如,rep序列,cap序列,反向末端重复(ITR)序列)瞬时或稳定导入包装宿主细胞中。虽然病毒颗粒的壳体多肽可以含有如本文所述的共有序列,但是剩余的组分可以来自一种或多种已知的AAV血清型(例如,AAV2,AAV8等)。
可以使用常规方法纯化此类病毒颗粒。如本文所用,“纯化的”病毒颗粒是指从制备它们的混合物中的组分,例如但不限于病毒组分(例如,rep序列,cap序列),包装宿主细胞,和部分或不完全组装的病毒颗粒中取出的病毒颗粒。
组装后,可以对病毒颗粒筛选例如复制能力;基因转移特性;受体结合能力;和/或群体(例如人群)中的血清阳性率(seroprevalence)。确定病毒颗粒是否可以复制是本领域常规的,并且通常包括用一定量的病毒颗粒感染宿主细胞并确定病毒颗粒的数目是否随时间增加。确定病毒颗粒是否能够进行基因转移也是本领域常规的,并且通常包括用含有转基因(例如,可检测的转基因,例如报告物基因)的病毒颗粒感染宿主细胞。病毒感染和清除后,可以对宿主细胞评估转基因的存在或缺乏。确定病毒颗粒是否结合其受体是本领域常规的,并且此类方法可以在体外或体内进行。
确定病毒颗粒的血清阳性率在本领域中常规进行,并且通常包括使用免疫测定法来测定来自特定个体群体的样品(例如血液样品)中一种或多种抗体的流行(prevalence)。血清阳性率在本领域中理解为指血清阳性(即,已暴露于特定病原体或免疫原)的群体中受试者的比例,并且如下计算:在产生针对特定病原体或免疫原的抗体的群体中的受试者数目除以检查的群体中的个体总数。免疫测定法是本领域中公知的,并且包括但不限于免疫点(immunodot),Western印迹,酶免疫测定法(EIA),酶联免疫吸附测定法(ELISA)或放射免疫测定法(RIA)。类似地,测定血清样品中的中和性抗体的程度的几种方法是可用的。例如,中和性抗体测定法测量与不含抗体的对照样品相比,实验样品含有中和感染达50%或更多的抗体浓度的滴度。还见Fisher et al.(1997,Nature Med.,3:306-12);和Manning etal.(1998,Human Gene Ther.,9:477-85)。
使用表现出神经元中的逆行运动的偏爱的病毒的方法
如本文所述的病毒或其部分可以用于许多研究和/或治疗应用。例如,如本文所述的病毒或其部分可以在人或动物医学中用于基因疗法(例如,在用于基因转移的载体或载体系统中)或用于疫苗接种(例如用于抗原呈递)。更具体地,如本文所述的病毒或其部分可以用于基因添加,基因提升,多肽治疗剂的遗传递送,基因疫苗接种,基因沉默,基因组编辑,基因疗法,RNAi递送,cDNA递送,mRNA递送,miRNA传递,miRNA海绵法(sponging),遗传免疫,光遗传学(optogenetic)基因疗法,转基因作用(transgenesis),DNA疫苗接种或DNA免疫。
宿主细胞可以在体外(例如,在培养物中生长)或体内(例如在受试者,例如人或非人)中用病毒或其部分转导或感染。本文描述了可以在体外用病毒或其部分转导或感染的宿主细胞;可以在体内用病毒或其部分转导或感染的宿主细胞包括但不限于投射神经元(例如,皮质-脑桥投射神经元,交感神经投射神经元,中枢神经系统投射神经元),对背内侧纹状体(DMS)的传入,脊髓皮质/真菌神经元(fungal neuron),小脑前神经元,对基底神经节的输入,丘脑前神经元,运动神经元,感觉神经元或中枢神经系统的其他神经元或细胞。
可以修改如本文所述的病毒或其部分以包含有效负载。有效负载通常包含至少一种核酸(例如,与编码有效负载的编码序列可操作连接的启动子序列)。在某些情况下,有效负载可以是抑制性核酸。抑制性核酸是本领域已知的,包括例如反义寡核苷酸,短干扰RNA(siRNA)和RNA干扰(RNAi)分子。在某些情况下,有效负载可以是一种或多种蛋白质编码基因。非限制性地,蛋白质编码基因包括光学报告物构建体,治疗基因或效应器蛋白。
许多类型的光学报告物构建体在本领域中是已知的,并且以下一批意图是代表性而非穷举性的。例如,光学报告物构建体包括但不限于GCaMP6(GCaMP6s,GCaMP6m或GCaMP6f;见WO 2014/059154),荧光团(例如,绿色荧光蛋白(GFP),增强型GFP(EGFP),红色荧光蛋白(RFP),黄色荧光蛋白(YFP),tdTomato),颜色翻转构建体(color-flippingconstruct)(例如,在一种细胞群体中表达一种报告物并且在另一种群体中表达不同报告物的有效负载),葡萄糖传感器(例如,US 2015/0111222),iRCaMP(美国专利号9,644,007),iRGECO(例如,美国专利号9,644,007),CaMPARI(例如,美国专利号9,518,996),电压指示剂,第二信使,受体信号传导物(receptor signaler),转录报告物,表观遗传报告物和神经调节剂报告物。
治疗基因也是本领域已知的,并且将取决于所治疗的特定疾病或病症。例如,治疗基因可以用于治疗神经变性病症。代表性治疗基因(或编码的多肽)及其相关的神经变性病症包括但不限于用于治疗阿尔茨海默氏病的HSP104,用于治疗弗里德赖希氏共济失调的Ataxis(例如,frataxin),用于治疗帕金森病的溶酶体葡糖脑苷脂酶(GBA),用于治疗亨廷顿病的polyQ结合蛋白,用于治疗脊髓性肌萎缩,肌萎缩侧索硬化(ALS),自闭症,痴呆,周围神经病变,精神分裂症和视网膜变性的存活运动神经元1。在一些情况下,有效负载可以是治疗部分(与基因形成对比)。治疗部分包括例如抗体或其片段,免疫调节性蛋白或RNA干扰(RNAi)分子。
如本文所用,“效应”蛋白质指赋予对细胞或其内容物(例如,核酸,蛋白质,细胞器或涉及任何上述物质的过程)的作用的任何类型的蛋白质。例如,效应蛋白包括但不限于重组酶(例如,Cre或Flp)、基因编辑系统(例如,CRISPR/Cas9、TALEN、锌指核酸酶)、光遗传学试剂(激活剂(例如,通道视紫红质或其变体)或抑制剂(例如,盐细菌视紫红质(halorhodopsin)或Arch))、化学遗传学试剂(例如,DREADD或PSAM/PSEM系统的激活剂/抑制剂形式)、细胞系统途径的激活剂和/或抑制剂和用于控制表观遗传学(epigenetics)的酶
应当理解,可以期望递送补充或抑制病毒(例如,除AAV之外的病毒)功能的病毒蛋白。例如,作为进入受体的病毒蛋白(例如狂犬病G蛋白,涉及细胞和/或跨细胞转运的蛋白质)。
可以使用任何数目的启动子来驱动编码有效负载的序列。组成型启动子是本领域已知的,组织特异性启动子也是已知的(例如,神经元特异性启动子)。仅举例来说,启动子可以是突触蛋白-1,CMV,GFAP,CAG,CaMKII,MBP,EF1alpha,mD1x或TRE启动子。
通常悬浮在生理学上相容的载体中的病毒或其部分可以施用于受试者(例如,人或非人受试者(例如灵长类,啮齿类,爬行动物或鸟))。合适的载体包括盐水,其可以用多种缓冲溶液(例如磷酸盐缓冲盐水),乳糖,蔗糖,磷酸钙,明胶,葡聚糖,琼脂,果胶和水配制。以足够的量施用病毒或其部分以转导或感染细胞并提供足够水平的基因转移和表达,从而提供治疗益处而没有过度的副作用。常规和药学上可接受的施用途径包括但不限于颅内,脊柱内或肌内注射。另外的施用途径包括例如口服,鼻内,气管内,通过吸入,静脉内,眼内,皮下,皮内,透粘膜或通过其它施用途径。若期望的话,可以组合施用途径。
对受试者施用的病毒或其部分的剂量主要取决于诸如所治疗的病况和受试者的年龄,体重和健康等因素。例如,待施用于人受试者的病毒或其部分的治疗有效剂量通常在约0.1ml至约10ml的含有约1x 10
显著地,本文所述的AAV-retro颗粒比例如犬腺病毒-2(CAV-2)表现出大多达两个数量级的对皮质-脑桥投射神经元的逆行接近,并且对某些神经元(例如,皮质-脑桥投射神经元或对背内侧纹状体(DMS)的传入)的逆行接近与用合成示踪剂如Fluoro-Gold
根据本发明,可以使用本领域技术范围内的常规分子生物学,微生物学,生物化学和重组DNA技术。此类技术在文献中充分说明。在以下实施例中将进一步描述本发明,这些实施例不限制权利要求书中描述的方法和物质组合物的范围。
实施例
实施例1-实验程序
所有程序均按照Janelia Research Campus和加州大学伯克利分校(Universityof California Berkeley)机构动物护理和使用委员会批准的方案进行。
实施例2-文库生成和病毒生产
在定向进化程序开始时使用4个先前产生的病毒文库:1)通过使AAV2cap基因(编码病毒蛋白VP1-3和装配激活蛋白(AAP))经历易错PCR而产生的随机诱变文库(Maheshriet al.,2006,Nat.Biotechnol.,24:198-204);2)在N587和R588之间含有7聚体肽插入物的AAV2 cap基因变体文库(Müller et al.,2003,Nat.Biotechnol.,21:1040-6);3)含有随机化环区的AAV2 cap基因变体文库(Koerber et al.,2009,Mol.Ther.,17:2088-95);4)从野生型AAV1、AAV2、AAV4、AAV5、AAV6、AAV8和AAV9 cap基因序列产生的DNA改组文库(Koerberet al.,2008,Mol.Ther.,16:1703-9)。最初,将突变体DNA的每种合并物亚克隆到具有复制能力的AAV包装质粒中以创建病毒质粒文库,所述病毒质粒文库当包装到AAV病毒体中时可以针对任何新的特性或功能选择。具有复制能力的AAV系统将突变体cap基因掺入病毒有效负载中,因此,每个变体的基因型与其表型相关。然后,可以通过包囊的AAV基因组的DNA序列分析回收期望特性的壳体序列。
通过磷酸钙瞬时转染HEK293-T细胞包装四个具有复制能力的AAV文库,然后进行病毒收获,碘克沙醇梯度离心和Amicon过滤(Maheshri et al.,2006,Nat.Biotechnol.,24:198-204)。
实施例3-体内病毒或示踪剂注射
对于局部体内病毒递送,用异氟烷(在O
柱塞的回缩用于给移液管加载病毒。用Sutter MP-285操纵器定位注射移液管。
表1.本研究中使用的坐标
*所有A/P坐标相对于前囟点给予。
实施例4-文库选择和演变
将4个突变体病毒文库合并,并且注射到SNr或成体(6-8周龄)野生型C57/Bl6J小鼠(任意性别;Charles River)的小脑中。注射后3周,相应地除去纹状体或后脑组织,提取DNA,并且将成功到达了远端逆行靶组织的病毒体进行PCR扩增,并再克隆到rcAAV包装质粒中以创建新的有复制能力的AAV文库,用于接着的选择轮次。在三个选择步骤后,通过分别使用5’-ACG CGG AAG CTT CGA TCA ACT ACG CAG-3’(SEQ ID NO:79)和5’-AGA CCA AAGTTC AAC TGA AAC GAA TTA AAC GG-3’(SEQ ID NO:80)作为正向和反向引物的易错PCR随机突变拯救的cap基因。
然后,再进行两次体内选择轮次。在第4轮和第5轮后对个别的分离物进行测序以评估文库富集的程度(表2)。
/>
/>
/>
在第5轮结束时选择17个变体进行二次筛选,并将相应的cap基因序列再克隆到rAAV辅助质粒中。然后,由Vector BioLabs,Inc(Philadelphia,PA)进行亲本野生型AAV2和携带CMV-EGFP有效负载的选择的17个突变体变体中每个的个别高滴度制备。CMV启动子通常在神经元中较弱,因此,此二次筛选提供逆行转运效率的严格测试。将个别的AAV变体注射到小脑或苍白球中。3周后,若逆行转运是有效的,则内源的未扩增的EGFP荧光在预期标记的区域中是可见的。突变体5R-Hind6(编码SEQ ID NO:44的SEQ ID NO:43)在这两个回路中表现出最强的逆行转运,因此被选择用于进一步分析并称为rAAV2-retro。
实施例5-肝素结合测定法
如前所述(Jang et al.,2011,Mol.Ther.,19:667-75)分析AAV2-retro和野生型AAV2的肝素亲和力。简言之,将约10
实施例6-研究中使用的有效负载
对于所有后续实验,用已知在成年神经元中更稳健的启动子替换CMV启动子。Cre重组酶和GCaMP6f钙传感器由人突触蛋白-1(hSyn1)启动子驱动。所有荧光团均由CAG启动子驱动,并且颜色翻转构建体由EF1-alpha启动子驱动。
实施例7-用于量化逆行效率的病毒生产
在Janelia Viral Shared Resource使用AAV1、AAV2、AAV5、AAV8、AAV9、DJ和AAV2-retro壳体包装hSyn-Cre有效负载。将所有7种病毒制备物平行处理,并且在体内注射前进行滴度匹配。将所有批次稀释至最低测量滴度(1.3E12 GC/ml),并将每种病毒注射到三只成年Rosa26Lox-STOP-LoxH2B-GFP小鼠的右脑桥核中(He et al.,2012,Neuron,73:35-48)。
实施例8-组织学
在病毒注射后三周处死动物,此时收获脑并且右半球以50μm的厚度进行径向切割。将切片安装在含有DAPI的VECTASHIELD防褪色封固培养基(Antifade MountingMedium)(Vector Laboratories)中,并使用20x物镜和FITC和DAPI滤器使用P-EPannoramic载玻片扫描仪(3D Histech)成像。
实施例9-逆行转运量化
将使用Pannoramic载玻片扫描仪获得的图像缝合,然后使用Matlab(Mathworks)编写的定制软件进行分析,以在皮质间检测经GFP标记的核。在皮质周围手动绘制感兴趣的区域(ROI)以隔离图像中的区域以进行自动细胞计数。为了增强核的检测,然后将图像与“Mexican Hat”核心卷积,所述核心包括两个高斯(Gaussians)的差(26.00μm方差和3.25μm方差)。使用中值滤器降低图像噪声,然后进行基本峰值检测。
实施例10-逆行转运的一般性(generality)的分析
给Rosa26-LSL-H2B-GFP小鼠在背侧纹状体中注射25nl rAAV2-retro hSyn1-Cre。注射后三周,使用Pannoramic扫描仪对冠状切片的脑成像,以显现经DAPI染色的核和来自表达H2B-GFP的核的绿色荧光。绿色通道以两个高斯的差卷积,然后使用Matlab中编写的定制函数在这些阈值图像上作为局部最大值检测。使用借助于Matlab图像处理工具箱编写的定制分析例程,将每个切片的蓝色通道与艾伦脑研究所的标准化鼠脑图册(atlas)中的Nissl图像比对。然后,使用来自ABI小鼠脑图册的注释区域将比对切片中检测到的神经元分配到特定的脑区域。
值得注意的是,参考图册的有限精度以及个别脑的解剖变化性将此半自动化过程的稳健性限于突出的传入输入。
实施例11-在GCaMP6f的逆行递送后体内神经元群体活性的成像
用异氟烷(2%)麻醉7只成年小鼠,并置于37℃加热垫上的立体定位框(KopfInstruments;Tujunga,CA)中。除去头骨上的头皮和骨膜,应用一层紫外线固化的OptiBond粘合剂(Kerr;Orange,CA)和定制的头柱(headpost)(Osborne and Dudman,2014,PLoSOne,9(2):e89007)用牙科粘固剂粘贴。使用Nanoliter2010注射器(WPI)将携带hSynGCaMP6f有效负载的AAV2-retro注射到BPN(前囟点后3.9mm,前囟点侧面0.4mm,深度5.8、5.6和5.4mm,每个深度100nl)中。将颅窗(一个170μm厚的激光切割窗玻璃,直径2mm)放置在初级运动皮质上(以前囟点前0.7mm和前囟点侧面1.6mm为中心)。
手术后,皮下实施酮洛芬(5mg/kg)和丁丙诺啡(0.1mg/kg;Henry Schein AnimalHealth;Melville,NY)的注射。手术后使小鼠恢复1周,然后在2光子显微镜下短暂成像以评估病毒表达。所有动物在注射后一周在视觉上鉴定在M1的V层中表达GCaMP6f的细胞。然后,使动物适应定制装置中的头部固定并训练以取回食物团粒,如前所述(Guo et al.,2014,Nat.Med.,20:130-8)。
用Ti:Sapphire激光(Chameleon,Coherent)在920nm(在后孔径处通常为20-40mW)激发GCaMP6f,并通过Nikon 16x,0.8-N.A.物镜成像。发射光通过565DCXR二色性滤器(Chroma Technology)和ET525/70m-2p滤器(Chroma Technology),并通过GaAsP光电倍增管(10770PB-40,Hamamatsu)检测。使用ScanImage软件使用共振扫描仪以约30Hz获得图像(512×512像素)。
实施例12-CRISPR/Cas9基因组编辑
用hSyn1替换pAAV-CMV-SaCas9-empty(Slaymaker et al.,2016,Science,351:84-8)中的CMV启动子以产生pAAV-hSyn1-SaCas9-empty。订购编码sgRNA原间隔区序列的寡核苷酸,磷酸化,杂交并连接到pAAV-hSyn1-SaCas9-emtpy的BsaI限制性位点以产生pAAV-hSyn1-SaCas9-tdTomato-1至-10。使用的寡核苷酸序列是:
tdTomato sgRNA 1Fwd:CAC CGC AAG GGC GAG GAG GTC ATC A(SEQ ID NO:86)
tdTomato sgRNA 1Rev:AAA CTG ATG ACC TCC TCG CCC TTG C(SEQ ID NO:87)
tdTomato sgRNA 2Fwd:CAC CGT GGA GGG CTC CAT GAA CGG CC(SEQ ID NO:88)
tdTomato sgRNA 2Rev:AAA CGG CCG TTC ATG GAG CCC TCC AC(SEQ ID NO:89)
tdTomato sgRNA 3Fwd:CAC CGA GGA CGG CGG CCA CTA CCT GG(SEQ ID NO:90)
tdTomato sgRNA 3Rev:AAA CCC AGG TAG TGG CCG CCG TCC TC(SEQ ID NO:91)
tdTomato sgRNA 4Fwd:CAC CGA CAA CAA CAT GGC CGT CAT CA(SEQ ID NO:92)
tdTomato sgRNA 4Rev:AAA CTG ATG ACG GCC ATG TTG TTG TC(SEQ ID NO:93)
tdTomato sgRNA 5Fwd:CAC CGA AGG ACG GCG GCC ACT ACC TGG(SEQ ID NO:94)
tdTomato sgRNA 5Rev:AAA CCC AGG TAG TGG CCG CCG TCC TTC(SEQ ID NO:95)
tdTomato sgRNA 6Fwd:CAC CGA CAA CAA CAT GGC CGT CAT CA(SEQ ID NO:96)
tdTomato sgRNA 6Rev:AAA CTG ATG ACG GCC ATG TTG TTG TC(SEQ ID NO:97)
tdTomato sgRNA 7Fwd:CAC CGG TCA CCT TCA GCT TGG CGG T(SEQ ID NO:98)
tdTomato sgRNA 7Rev:AAA CAC CGC CAA GCT GAA GGT GAC C(SEQ ID NO:99)
tdTomato sgRNA 8Fwd:CAC CGC CGT ACA TGA ACT GGG GGG A(SEQ ID NO:100)
tdTomato sgRNA 8Rev:AAA CTC CCC CCA GTT CAT GTA CGG(SEQ ID NO:101)
tdTomato sgRNA 9Fwd:CAC CGT CTT GTA ATC GGG GAT GTC GG(SEQ ID NO:102)
tdTomato sgRNA 9Rev:AAA CCC GAC ATC CCC GAT TAC AAG AC(SEQ ID NO:103)
tdTomato sgRNA 10Fwd:CAC CGC CGT CCT GCA GGG AGG AGT C(SEQ ID NO:104)
tdTomato sgRNA 10Rev:AAA CGA CTC CTC CCT GCA GGA CGG C(SEQ ID NO:105)
首先,在体外评估每种寡聚物指导基因组编辑的能力。使用聚乙烯亚胺,用800ngpAAV-hSyn1-SaCas9-tdTomato-1至-10、100ng pAAV-FLEX-CAGtdTomato和100ng pAAV-CAG-EGFP转染Neuro2A细胞。在转染后72小时,收获细胞并使用BD Influx分选仪(BDBiosciences)通过荧光激活细胞分选(FACS)分离约70,000个EGFP阳性Neuro2A细胞。然后,提取基因组DNA,并如先前所述(Cong et al.,2013,Science,339:819-23)通过Surveyor核酸酶测定法(Integrated DNA Technologies)评估tdTomato基因修饰的频率。将sgRNA 7(似乎指导tdTomato序列内的两个切割事件的两种之一)包装到retro-AAV2中并用于体内基因组编辑。
然后,如上所述将约100nl(5x10
实施例13-rAAV2-retro的定向进化
为了工程化改造具有增强的逆行转运的新型rAAV,设计富集rAAV壳体变体的体内定向进化方法,所述rAAV壳体变体被有效转运至向小鼠脑中的病毒注射部位发送长程投射的神经元的细胞体(图1A)。为了最大化回收具有期望特性的变体的可能性,先前描述的rAAV cap变体文库的多种多样的混合物(Koerber et al.,2008,Mol.Ther.,16:1703-9;Koerber et al.,2009,Mol.Ther.,17:2088-95;Koerber et al.,2006,Nat.Protocols,1:701-6;Müller et al.,2003,Nat.Biotechnol.,21:1040-6)用作起始材料。以将每个变体壳体联系到含有相应cap基因的AAV基因组的方式包装病毒颗粒,并且壳体变体的最终合并物包括点突变体、具有对AAV2用于结合其共受体硫酸乙酰肝素的区域中的随机7聚体肽插入的变体和来自7种亲本血清型的壳体基因序列的随机嵌合体(图1A)。为了鉴定具有宽逆行向性的变体,靶向两个独立的投射神经元群体:投射到黑质下网状部分(substantianigra pars reticulate,SNr)的纹状体GABA能神经元和投射到小脑皮质的谷氨酸能后脑神经元。在将整个rAAV变体合并物注射到SNr或小脑(每只动物一次注射)后三周,分别除去纹状体或后脑组织,通过PCR回收cap序列,并再包装病毒(图1B)。在再两个选择步骤之后,进行易错PCR以进一步使文库多样化,然后进行两个最终的体内选择步骤。
在第4轮进化后对30个cap变体进行测序,并且大多数源自插入文库并且在野生型AAV2 VP1壳体基因的N587和R588之间含有外源7聚体肽。有趣的是,所有回收的插入物的形式为LAxxDxTKxA(SEQ ID NO:106)或LAxDxTKxxA(SEQ ID NO:107)(其中粗体,斜体残基来自插入物);序列中别处的突变也得到富集(表2)。在第5轮进化后对另外的22个克隆进行测序,并且通过此另外的进化轮次,所有序列都是具有LAxxDxTKxA(SEQ IDNO:106)/LAxDxTKxxA(SEQ ID NO:107)插入的AAV2突变体(表2),证明明显的进一步趋同(convergence)程度。此类趋同提示对肝素结合环的特定肽插入在很大程度上造成逆向功能性,其他位点具有潜在的次要贡献。
接下来,检查对在壳体序列中拥有肽插入和点突变的不同组合的17种分离的变体的二次筛选。为了应用高水平的严格性,将所选择的变体与由CMV启动子驱动的增强型绿色荧光蛋白(EGFP)转基因一起包装,所述CMV启动子通常在神经元中较弱。对于每种壳体变体,评估其对关键的传入区域中的细胞体递送足够有效负荷以允许在注射后三周检测非抗体放大的EGFP信号的能力。选择克隆(插入物LADQDYTKTA(SEQ ID NO:85)+V708I+N382D)以进一步分析并称为rAAV2-retro,所述克隆在此二次筛选中在两个独立回路中显示最强的逆行转运(皮质至苍白球和下橄榄体/基底脑桥核至小脑)。当评估更常用于啮齿类体内研究的两种另外的启动子(CAG-图1B,或人突触蛋白-1,数据未显示)时,在小鼠和大鼠中的一批不同回路中用此rAAV变体观察到明显的逆行标记效率(图1B和图7)。将7聚体插入交换到其他回收序列之一或添加筛选中鉴定的额外点突变不导致逆行转运的进一步增加。
实施例14-对投射神经元的有效逆行接近
在下行运动途径(descending motor pathway)中,皮质-脑桥束(cortico-pontine tract)是明显会聚的,并且已知对脑桥基底核(BPN)贡献超过95%的传入。因此,此途径代表了用于量化由投射神经元的轴突末端进行的病毒摄取和逆行转运效率的特别有利的系统。实际上,将rAAV2-retro注射到BPN中导致V层神经元的密集标记(图2A),与过去的追踪研究一致(Legg et al.,1989,J.Comp.Neurol.,286(4):427-41)。
接下来,在相同的感染和加工条件下比较rAAV2-retro与几种常用AAV血清型在皮质-脑桥回路中逆行转运的功效(图2B-D)。为了确保量化准确性,并消除转基因表达水平中细胞与细胞变化性的可能混淆,使用AAV在Rosa26-Lox-STOP-Lox-H2B-GFP转基因小鼠中递送Cre重组酶(He et al.,2012,Neuron,73:35-48)。已经显示了即使低浓度的Cre酶也足以开启此类Cre依赖性盒的表达,并且融合有组蛋白的报告物的严格核定位提供感染细胞的明确鉴定,而不混淆神经毡信号。
使用半自动分析程序计算在BPN中局部病毒注射后三周收获的小鼠脑的成像矢状切片中感染的皮质投射神经元的线性密度(图2C)。对于用rAAV2感染的动物,观察到最小的皮质GFP表达(线性密度0.98±0.20个神经元/mm,平均值±sem,n=5;图2B,中图)。相比之下,并且与较早的观察结果一致(图2A),可以在经rAAV2-retro注射的动物中在整个皮层的吻-尾轴上观察到致密的GFP阳性V层投射神经元层(线性密度130.11±11.08个神经元/mm,n=4;图2B,下图)。其他常用的AAV血清型和犬腺病毒-2均未与工程化rAAV2-retro变体的逆行效率相匹配(线性密度AAV1:0.05±0.04,AAV2:0.98±0.2,AAV5:2.38±1.24,AAV8:1.43±1.43,AAV9:1.98±0.86,DJ:24.82±14.32,CAV-2:5.56±4.13,各为n=3至5;图2D,图8)。此外,通过rAAV2-retro标记的皮质投射神经元的密度与用Fluoro-Gold(Schmuedand Fallon,1986,Brain Res.,377:147-54)(一种强力的合成逆行示踪剂)获得的密度相当(线性密度81.03±11.08个神经元/mm,n=3)。因此,rAAV2-retro在逆行接近皮质-脑桥投射神经元方面比现有血清型表现出高达两个数目级的增强,并且与合成逆行示踪剂的功效相媲美。
实施例15-逆行功能性的一般性
接下来,检查是否将rAAV2-retro的逆行功能性扩展到其他回路,特别是通过表征其标记到到背内侧纹状体(DMS)(基底神经节中接收来自多种皮质和皮质下区域的远程输入的部分)的各种传入的程度。发现rAAV2-retro介导的逆行接近对DMS的最强传入输入(皮质、丘脑和杏仁核)的功效与经典用于逆行追踪的荧光珠的功效相当(图3A)。为了对已知提供对DMS的显著远程输入的所有脑区域中逆行标记的神经元的数目提供无偏估计,开发了算法,其通过将切片与注释的艾伦脑图册(Allen Brain Atlas)比对将小鼠脑的成像切片中的任何检测到的荧光标记物分配给特定的脑区域(图3B-C)。定量分析(图3C)揭示了,在先前已报告对纹状体发送明显投射的绝大多数区域中发现了强烈的逆行标记(Pan etal.,2010,Front Neuroanat.,4:147)。在一个明显的例外中,仅在黑质致密部中观察到适度的标记,尽管它是对DMS的强多巴胺能输入的来源(图3C,SNc的细胞计数的箭头)。发现投射神经元类别的小子集类似地难以在一些测试的其它回路中被rAAV2-retro逆行接近(表3;注意所有其他测试的AAV血清型也未能标记这些投射)。尽管这些例外,但rAAV2-retro在中枢神经系统中广泛适用。
表3.各种回路中的rAAV2-retro效率。通过将Cre依赖性有效负载局部递送至投射神经元细胞体后的投射神经元的有效标记提示在皮质-丘脑和皮质-小丘(collicular)投射中的低效率而不是逆行转运的缺乏。
/>
/>
实施例16-逆转接近遗传限定的神经元群体
还测定rAAV2-retro的逆行功能性是否可以与Cre转基因系的特异性结合以使得能够询问特定类别的投射神经元。具体地,进行实验以测定是否可以组合rAAV2-retro和Cre转基因系以分离在两个脑区间平行运行的两个功能独特的长程连接。从脑皮层到纹状体的投射主要源自V层中的神经元,但是II和III层中的一些神经元也提供纹状体输入。已经提示了来自不同皮质层的对纹状体的输入构成分开的途径,V层中的神经元投射到纹状体的斑(patch)区室,并且II和III层中的神经元投射到基质。斑和基质微区室的交错性质使得难以选择性靶向这些途径以仅用rAAV2-retro系统进行功能性询问。因此,通过将rAAV2-retro与在所有V层神经元中(Gerfen et al.,2013,Neuron,80:1368-83),但不在II和III层中的神经元中表达Cre重组酶的转基因系组合来探讨两种输入是否可以分离(图4A)。
为了突出显示同一实验中的这两种途径,选择Cre依赖性颜色翻转(color-flipping)有效负载,其在没有Cre的情况下表达tdTomato,但反转以驱动Cre阳性细胞中EGFP的表达(Saunders et al.,2012,Front Neural Circuits,6:47)。当将携带此种有效负载的rAAV2-retro注射到V层特异性Cre驱动系Rbp4_KL100 Cre(Gerfen et al.,2013,Neuron,80:1368-83)的背内侧纹状体中时,仅对纹状体投射的那些V层神经元表达EGFP。此外,II和III层皮质纹状体途径可通过tdTomato的表达清楚区分(图4B)。根据皮质-纹状体投射的地形学特征,将病毒高度局部注射到背内侧纹状体中导致皮质的相应小切片的标记。然而,V层和II层和III层皮质-纹状体群体总是共标记的(图4B,下图),提示来自相同皮质区域的两条途径穿过纹状体内相邻的基质和斑块微区室。
虽然此实验突出显示了这两种途径,但是选择“Cre-on”或“Cre-off”有效负载将允许选择性接近一种,而排除另一种。因此,本实施例突出显示了可以通过将高度有效的逆行病毒与可用Cre(或Flp)驱动系组合实现回路询问的添加的特异性。
实施例17-使用rAAV2-retro进行回路询问和基因操作
rAAV2-retro用于回路询问的效用将取决于其介导遗传编码指示物和效应器的高水平表达的能力。首先,通过rAAV2-retro介导的GCaMP6f表达来评估监测限定的投射神经元类别中的神经活性的能力(Chen et al.,2013,Nature,499:295-300)(图5A-C)。使用体内两光子Ca
最后,评估rAAV2-retro将效应器,如CRISPR/Cas9基因编辑系统递送至投射神经元的效用(图6)。具体地,将金黄色葡萄球菌Cas9(SaCas9(Slaymaker et al.,2016,Science,351:84-8))和设计用于消除tdTomato表达的单一指导RNA包装到rAAv2-retro中。将rAAV2-retro-SaCas9-antitdTomato递送至皮质V层激动神经元中表达tdTomato的动物的BPN导致88.6±0.7%的表达SaCas9的V层神经元中的tdTomato表达的抑制(图6B,下图和图6C,n=3)。相反,非靶向性SaCas9的递送未导致任何可辨别的变化,仅4.4±3.2%的细胞表现出tdTomato表达的潜在降低(图6B,上图和图6C,n=3)。此外,tdTomato表达在经由脑桥注射无法接近的V层神经元中仍不受影响。因此,rAAV2-retro系统允许在投射到特定感兴趣区域的神经元中选择性允许有效的基因修饰。
这些观察结果共同建立rAAV2-retro作为有效试剂以遗传接近投射神经元,用于神经回路的功能性询问,并且从长远来看用于可能的治疗剂。
实施例18-讨论
重组腺伴随病毒可以极大地促进哺乳动物神经回路的功能性解剖,并且有望用于神经系统病症的治疗干预。已经使用定向进化对AAV壳体赋予有效逆行接近许多回路中的投射神经元的额外能力。与常用的AAV血清型相比,新工程化的rAAV2-retro提供高达两个数目级的逆行转运增强,与许多回路中合成逆行示踪剂的功效相匹配。经由逆行接近用rAAV2-retro实现的转基因表达水平足以用于询问神经回路功能,以及用于神经元基因组的靶向操作。因此,通过实现选择性监测和操作连接不同脑区的投射神经元,基于rAAV2-retro的工具可以了解大规模网络如何实现脑功能,并且有望用于以进行性大规模网络功能障碍为特征的疾病中的治疗干预。
与其亲本血清型AAV2相比由rAAV2-retro提供的逆行接近的显著增加的功效可以已经经由插入介导的对硫酸乙酰肝素的天然结合位点的破坏和/或经由创建掺入插入肽的新结合表面实现。此变体确实具有降低的肝素亲和力(图9),其可以减少突触间隙的胞外基质中的病毒隔离并增强局部载体扩散,如已经用AAV1和AAV6观察到的。然而,所得的单独的载体扩散增加不能解释逆行转运的功效,因为其他插入的7聚体序列类似地破坏肝素结合但不影响逆行转运。此外,AAV5和AAV9不结合肝素,但它们的逆行转运效率类似于AAV2的。为了支持替代解释,在原始选择中选择的肽插入(LAxxDxTKxA(SEQ ID NO:106)/LAxDxTKxxA(SEQ ID NO:107))共享相同的总体组成,仅仅在保守基序的登记中不同。工程化肽插入可以支持与AAV途径中现有细胞辅因子(例如,最近鉴定的常见AAV受体)的增强的结合,或者它可以创建与细胞机器-细胞表面受体和/或囊泡运输或核进入途径的组分的新相互作用。
尽管rAAV2-retro相对于现有血清型提供的逆行运输的多个数目级的改善,但是一小组投射神经元类别似乎难以通过此新进化的rAAV变体进行有效的逆行感染(表3)。然而,应当注意的是,其他AAV血清型也未能标记这些投射。在这些神经元中与此种新型AAV变体交互(interface)的关键细胞因子的表达水平是否刚好非常低——在皮质-丘脑和皮质-小丘投射方面得到支持的结论,例如通过rAAV2-retro仍然可以对细胞体递送足够的Cre重组酶,以指导局部递送的Cre依赖性有效负载的高水平表达的观察结果(表3,突出显示的条目)支持——或者因子是否完全缺少,在每种情况下仍有待确定。对此变体或其他变体的其他未来壳体修饰可以实现这些神经元类别的增强的逆向转导。
rAAV2-retro载体系统为解剖神经回路功能的遗传工具包提供了重要的补充,因为接近个别类别的投射神经元将是阐明如何协调局部回路动力学和大规模网络功能的关键启用(enabling)步骤。越来越多地认为局部回路计算取决于特定局部回路模块内的整个神经元群体的动力学。这些动力学如何定位到不同类别的投射神经元——以及因此将何种信息传递给不同下游靶标——对于大多数回路仍然没有得到解决。单独或与特定Cre转基因系组合的基于rAAV2-retro的载体允许遗传接近特定的投射神经元群体。继而,可以使用携带狂犬病G糖蛋白的rAAV2-retro来反式补充新开发的无毒条件性狂犬病载体,以接近影响特定类别的投射神经元的突触前微回路。选择性监测和操作个别投射神经元类别活性及其局部微回路的所得能力应当了解投射神经元如何为其相应的大规模网络转换局部回路动力学。
rAAV2-retro还具有治疗干预的前景,有几种可能的应用。例如,在病理学影响较大的神经组织体积——例如阿尔茨海默氏症或溶酶体贮积病——的情况下,多次注射造成安全性风险,并且可能不足以达到需要的转导水平。然而,在策略性的位置中的少量注射可以实现大体积(例如,从BPN中的收敛点(point of convergence)的皮质-脑桥束),或难以接近的组织(例如,来自肌肉的脊髓运动神经元)里的载体扩散。此外,大规模功能网络已经涉及许多神经变性病症从其空间局部发作的传播。一个突出的新兴观点认为,脆弱的神经元群体中异常蛋白质组装的沉积触发大规模功能网络内的异常神经元活动的病理级联和大规模功能网络的崩解,最终导致神经功能的失败。有趣的是,受影响的神经网络似乎能够在疾病早期瞬时克服异常动力学,因为患有许多神经变性疾病的患者通常表现出明显改善的时段。因此,旨在减缓来自病理学皮质起源的聚集体扩散的早期干预可以足以稳定或甚至恢复认知功能。从此角度来看,在阿尔茨海默氏病症和帕金森病症两者中,病理性蛋白质聚集体首次出现的中皮质区域中的皮质下投射神经元构成有吸引力的干预靶标。用例如设计为引入能够以顺式阻滞进一步聚集的突变或者递送能够掩饰聚集体的侣伴蛋白的基于rAAV2retro的工具接近那些投射神经元具有减缓最令人衰弱的认知症状的进展的潜力。评估非人灵长类中rAAV2-retro试剂的效率和长期安全性将为其用于这些和其他基因治疗方法的最终考虑铺平道路。
应当理解,虽然本文已经结合许多不同方面描述了方法和物质组合物,但是各个方面的前述描述旨在说明而不是限制方法和物质组合物的范围。其他方面、优点和修改在以下权利要求书的范围内。
公开了可以用于公开的方法和组合物,可以与公开的方法和组合物一起使用,可以用于制备公开的方法和组合物,或者是公开的方法和组合物的产物的方法和组合物。本文公开了这些和其他材料,并且应当理解,公开了这些方法和组合物的组合、子集、相互作用、组等。也就是说,虽然可能未明确公开对这些组合物和方法的每种各种个别和集体组合和排列的具体提及,但是本文中具体考虑和描述了每种。例如,若公开和讨论特定的物质组合物或特定方法并且讨论许多组合物或方法,则除非特别相反指示,否则特别考虑组合物和方法的每种组合和排列。同样地,还特别考虑和公开了这些的任何子集或组合。
