南林895杨PdMYB2R032基因在提高植物抗旱性中的应用
文献发布时间:2024-04-18 19:44:28
技术领域
本发明属于植物分子生物学领域,更具体地说,涉及南林895杨PdMYB2R032基因在提高植物抗旱性中的应用。
背景技术
南林895杨(P.deltoides×P.euramericana cv.‘Nanlin895’)是美洲黑杨与欧美杨杂交后代群体中选育出来的杨树单板用材和纸浆用材造林品种。喜光、喜水、喜肥,在光照水肥比较充足的情况下,生长十分迅速,适宜在黄河以南地区推广造林。但干旱严重影响了农业和林业的发展。
R2R3-MYB不仅是植物MYB(v-myb avian myeloblastosis viral oncogenehomolog)家族中拥有最多成员的亚家族,而且包含了大部分的干旱胁迫响应相关基因。R2R3-MYB基因在干旱条件下参与ABA信号介导的气孔关闭过程,还参与水杨酸、脱落酸、赤霉素和茉莉酸的信号转导途径,在植物适应非生物逆境胁迫方面发挥重要作用。但是,有关R2R3-MYB基因调节干旱胁迫反应的报道大多集中在以拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)为代表的草本植物中,而杨树作为林木模式物种,仅有少数干旱胁迫相关的R2R3-MYB基因被报道。因此,研究R2R3-MYB基因在杨树耐旱反应中的作用机制,将为杨树耐旱性状的遗传改良提供一些理论线索,有助于促进干旱、半干旱地区生产的持续稳定发展。
发明内容
针对现有技术存在的上述问题,本发明所要解决的技术问题在于提供南林895杨PdMYB2R032基因在提高植物抗旱性中的应用,用于植物分子改良育种。
为了解决上述技术问题,本发明所采用的技术方案如下:
南林895杨PdMYB032基因在提高植物抗旱性中的应用,所述PdMYB2R032基因的核苷酸序列如SEQ ID NO.1所示。
南林895杨PdMYB2R032基因在提高植物抗旱性中的应用,包括以下步骤:
(1)构建PdMYB032基因的载体;
(2)将所构建的PdMYB2R032基因的载体转化到植物中;
(3)培育筛选得到抗旱性得到增强的转基因植物。
所述的植物为拟南芥。
所述的载体是植物表达载体。
所述的植物表达载体是pBI121-3HA-PdMYB2R032。
相比于现有技术,本发明的有益效果为:
本发明以南林895杨组培苗为材料,通过克隆得到南林895杨PdMYB2R032基因,在此基础上构建其过量表达载体pBI121-3HA-PdMYB2R032,转入拟南芥中,得到转基因植株,并进行迭代筛选获得了纯合体株系并进行表型观测,基因功能鉴定结果表明在三种干旱处理梯度下,转基因植株与野生型相比,地上部分长势均高于野生型,根系更长、密度更大,鲜重增加量明显,种子萌发率更高
附图说明
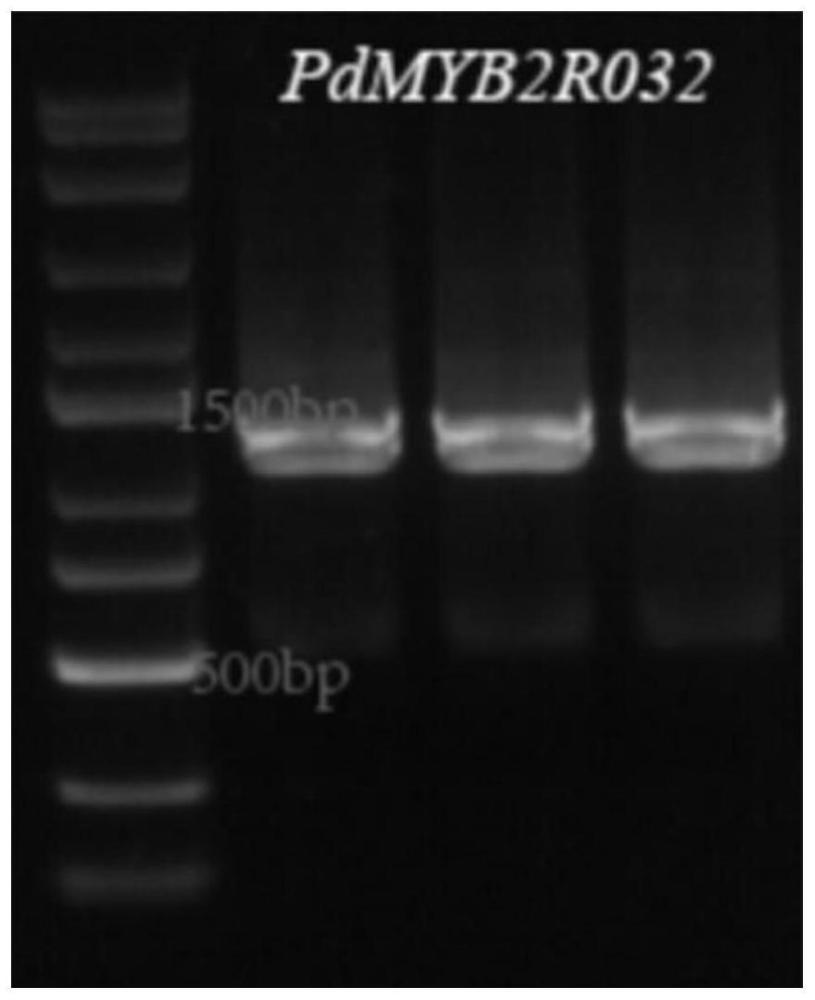
图1为PdMYB2R032转基因植株检测结果图;
图2为PdMYB2R032拟南芥转基因纯合体子代的迭代抗性筛选结果图;
图3为PdMYB2R032-OV植株地上部生长表型以及植株鲜重的统计结果图(A为不同浓度PEG6000处理下植株的地上部生长表型图(6株);B为不同PEG6000浓度处理下植株的鲜重统计图(6株);C为不同PEG6000浓度处理下植株的鲜重的变化趋势图(6株));
图4为PdMYB2R032-OV转基因植株根系生长表型以及根系鲜重的统计结果图(A为不同浓度PEG6000处理下植株的根系生长表型图(6株);B为不同PEG6000浓度处理下植株的根系鲜重统计图(6株);C为不同PEG6000浓度处理下植株的根系鲜重的变化趋势图(6株));
图5为不同PEG6000浓度处理下种子的萌发差异结果图(A为不同条件下种子的萌发表型图;B为不同条件下植株的种子萌发率统计图)。
具体实施方式
下面结合具体实施例对本发明进一步进行描述。以下实施例中,未详细叙述的操作均为常规生物学实验操作,可参照分子生物学实验手册以及现有公开的期刊文献等进行,或者按照试剂盒和产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明采用的植物材料为拟南芥(A.thaliana)和南林895杨组培苗,培养条件为25℃,光照16h。
本发明采用的载体为pTOPO001 Blunt Simple Cloning Kit购自北京金沙(Genesand)生物技术有限公司;
本发明采用的表达载体为pBI121-3HA-des由南京林业大学林学院保存;
本发明采用的大肠杆菌菌株Trelief
实施例1:南林895杨PdMYB2R032基因克隆
1、引物设计
以毛果杨基因组数据库筛选出的PtrMYB2R032(Potri.002G173900.1)基因序列为参照,利用在线序列Primer3进行引物设计,引物序列如下:
PdMYB2R032-F:5’-TAGTCCCTTCCCAGCTTTGT-3’;
PdMYB2R032-R:5’-TAATTCCCTCGCATACGCAC-3’。
2、基因克隆与目的片段回收
采用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根)提取‘南林895’杨的总RNA,具体方法参照说明书。
准备反转录反应液1:Total RNA 1μg(x μL)、Random 6mer 1.5μL、Oligo(dT)1.5μL、RNase-Free dH
以反转录合成的cDNA为模板,使用KOD高保真酶进行基因的克隆。
PCR反应体系为:cDNA 2μL、pBI121-3HA-PdMYB2R032-F Primer(10μM)1.5μL、pBI121-3HA-PdMYB2R032-RPrimer(10μM)1.5μL、10×KOD Buffer 5μL、MgSO
PCR反应程序为:94℃3min;94℃30s、58-62℃30s、68℃2min,共38个循环;68℃20min;4℃保存。
反应完成后,扩增产物用1%琼脂糖凝胶进行电泳分离;将大小正确的条带切下,并回收纯化。
3、构建克隆载体并转化大肠杆菌
室温(20~30℃)下配置反应体系,详见pTOPO001 Blunt Simple Cloning Kit说明书。将连接体系置于PCR仪或金属浴中(20~30℃)反应5min,反应完成后立即转化大肠杆菌(Trelief
实施例2:南林895杨PdMYB2R032基因表达载体的构建与功能验证
1、植物表达载体的构建:
按照说明书使用限制性内切酶KpnI和SacI对PBI121-3HA-des载体进行双酶切处理,分别在目的基因的CDS序列两端加一段18bp的与载体同源的序列,利用同源重组的方法将目的基因构建到载体pBI121-3HA-des中,得到植物表达载体pBI121-3HA-PdMYB2R032。加同源臂的引物序列为:
pBI121-3HA-PdMYB2R032-F:
5’-CCAGATTATGCTAGTCTTATGGGAAGGGCTCCTTGTTGC-3’
pBI121-3HA-PdMYB2R032-R:
5’-GAACGATCGGGGAAATTCTCATACCAGCAGTGACTCGGCG-3’
重组反应体系如下:线性化载体XμL、目的片段YμL、5×CEII缓冲液4μL、Exnase 2μL,补充ddH
2、农杆菌介导的花序侵染法转化拟南芥
取150-200ng待转化质粒,加入100μL农杆菌GV3101感受态细胞,混匀之后于冰上放置20-30min。之后液氮速冻60s,37℃热激4min,迅速冰浴2min。加入800μLLB液体培养基,28℃100rpm摇菌3h,之后4000rpm离心3min,留少许上清,吹打混匀,涂布于平板,28℃培养48h。第三日挑选单克隆,进行菌液PCR检测,正确的菌置于4℃冰箱保存备用。
将检测正确的阳性农杆菌活化,之后挑取单克隆于5mLLB液体培养基(含有Km和Cef)中,28℃培养16-24h。1∶100的比例扩大培养,28℃培养16-24h,待OD600为1.6-2.0时即可。室温4000rpm离心10min,收集菌体于管底,并用等量5%(w/v)蔗糖溶液重悬菌体,按20μL/100mL的比例加入SilwetL-77,立即混匀。将所有花序浸泡在菌液里面1min,之后用保鲜膜包裹花序,侧倒放置于托盘中,于室温下黑暗放置一天。去掉保鲜膜,放回培养箱生长,待长角果成熟,收集种子,晾干后4℃存放。
3、纯合体的获得
使用35S启动子通用上游引物(35S-universal-F:5’-AGGAAGGTGGCTCCTACAAATGCCATC-3’)和PdMYB2R032基因的下游特异性引物(pBI121-3HA-PdMYB2R032-R:5’-GAACGATCGGGGAAATTCTCATACCAGCAGTGACTCGGCG-3’)进行PCR检测(PCR反应体系:植物叶片/粗提样本1μL、2×Plant Direct Master Mix 10μL、35S-universal-F(10μM)1μL、pBI121-3HA-PdMYB2R032-R(10μM)1μL、ddH2O 7μL,总体系为20μL。PCR反应程序为:98℃5min;95℃10s、58-72℃15s、72℃1min/kb,共35个循环;72℃5min;4℃保存。),1%凝胶电泳检测结果如图1所示,其条带长度与目的片段长度相符,初步证明PdMYB2R032基因已转到拟南芥中。
通过抗生素Km的筛选压力筛选出拟南芥阳性小苗,移栽后再进行迭代筛选,最终获得后代不发生性状分离的纯合体转基因纯合体株系,命名为PdMYB2R032-OV,并进行下一步的表型观测(如图2所示)。
4、转基因植株检测
使用诺唯赞生物科技股份有限公司的Plant Direct PCR Kit试剂盒进行检测,方法如下:
样品处理:取一小块嫩叶片(直径约1-3mm),将其置于20μL Plant Direct LysisBufferA中,并将其尽量磨碎;95℃加热5-10min,加热结束后短暂离心,取1μL上清液作为PCR反应体系的模板。
PCR反应体系:植物叶片/粗提样本1μL、2×Plant Direct Master Mix 10μL、35S-universal-F(10μM)1μL、pBI121-3HA-PdMYB2R032-R(10μM)1μL、ddH
PCR反应程序为:98℃5min;95℃10s、58-72℃15s、72℃1min/kb,共35个循环;72℃5min;4℃保存。
凝胶电泳检测:PCR产物加溴酚蓝混匀,在1%琼脂糖凝胶点样,电泳检测。
5、纯合体筛选
为了获得可以稳定遗传的转基因后代,通过抗生素Km的筛选压力筛选阳性纯合子植株,方法如下:
配制拟南芥1/2MS培养基,灭菌后放置50℃左右添加Km(50mg/L)和Cef(400mg/L),混匀后倒平板;取种子放入到管底接合部1/4-1/6处,1mL无菌水清洗,去除漂浮的种子;加入1mL75%酒精,混匀30s,静置15s,用枪将乙醇吸去;加入1mL 10%84涡旋3min,静置15s,用枪吸去上清,使用灭菌水,清洗4次,每次静置,吸走上清;1mL 0.05%agarose(琼脂糖)溶液悬浮种子;将种子打到培养基平板上(每个板子500μL),用剪头枪头吹打,使种子尽量分散;静置40分钟,等待水分蒸发;封好培养皿,报纸包裹,放入冰箱4℃黑暗培养3天(诱导种子萌发);在光照培养箱中16h光照培养,注意观察污染情况。
约10天后观察结果,阳性种子应该明显比非转化植株大而绿(非转基因植株较小且叶片颜色相对发白);培养基平板发芽生长至4片叶(一周至两周)后,选择大而绿的植株移栽至小花盆;待叶片较多时,取叶片进行转基因检测;收取种子,进行重复操作,直到培养基里均为大而绿的小苗,即筛选出的种子不发生性状分离,即为纯合子。
5、转基因拟南芥干旱胁迫处理
转基因拟南芥干旱处理主要在添加有PEG6000的固体1/2MS培养基上进行,采取van der Weele等人的处理方式,在没有PEG的固体培养基上覆盖含有PEG的液体培养基(含有MES buffer),从而配置本实验所需的含有5%和10%PEG6000的固体培养基。
1)为观测野生型和转基因拟南芥的表型差异,将播种在1/2MS上10天左右的野生型和转基因拟南芥幼苗移到三种干旱浓度(0%、5%、10%)的培养基中,每两天记录一次生长状况,对PdMYB2R032-OV植株地上部生长表型以及植株鲜重进行统计分析,结果如图3A所示,无胁迫条件下,转基因拟南芥的地上部分长势优于野生型;在5%的干旱胁迫下,野生型拟南芥的地上部分长势与无胁迫条件下的差不多,而过表达PdMYB2R032转基因拟南芥的长势显著优于无胁迫条件;在更为严重的10%PEG胁迫下,野生型拟南芥地上部分受到明显的抑制,转基因拟南芥却未受到明显抑制。
此外在胁迫第6天称取不同胁迫条件下的野生型和转基因拟南芥的鲜重,通过统计分析,结果如图3B和3C所示,野生型拟南芥植株的鲜重随着PEG6000浓度的增加呈现下降趋势,且在10%PEG6000胁迫浓度下显著下降(P<0.05)。而过表达PdMYB2R032转基因植株的鲜重随着干旱胁迫浓度的变化并无明显的变化,且在5%PEG6000胁迫浓度下有轻微的上调。
2)对PdMYB2R032-OV转基因植株根系生长表型以及根系鲜重进行统计分析,结果如图4所示,在萌发初期转基因植株的根系略长于野生型;无干旱胁迫条件下,转基因拟南芥的根系长势和根系长度与野生型拟南芥较为一致;在5%和10%PEG干旱胁迫下,野生型拟南芥的根系长度和侧根发育受到明显的抑制,根鲜重随着PEG浓度的增加呈直线下降趋势;相比之下,干旱处理下转基因拟南芥拥有更多的侧根数目,根系长度未受到抑制,且根系鲜重显著高于野生型。这些表型结果表明,PdMYB2R032过表达可以促进植株生长,在干旱胁迫下使转基因植株具有更多的侧根数目,从而促进株系的吸水,赋予转基因拟南芥更强的抗旱能力。
3)将野生型和转基因种子播种到不同干旱浓度梯度处理的培养基上,置于相同的培养环境中进行培养,3天后对不同PEG6000浓度处理下PdMYB2R032-OV转基因种子萌发情况进行观察和统计,结果如图5所示,无胁迫条件下转基因拟南芥种子萌发率大于野生型,同样在5%和10%浓度的干旱胁迫下转基因拟南芥种子萌发率也大于野生型;干旱胁迫尤其是10%浓度的干旱胁迫抑制了野生型种子的萌发,但未抑制转基因种子的萌发率。表明过表达PdMYB2R032使得植株能从培养基中获取更多的水分,促进正常条件和干旱胁迫下种子的萌发。
- TPPI基因在调控植物气孔开度和提高植物抗旱性中的应用
- TPPI基因在调控植物气孔开度和提高植物抗旱性中的应用
