一种用于检测基质金属蛋白酶-2的磁性荧光复合探针及其制备方法和应用
文献发布时间:2023-06-19 11:40:48
技术领域
本发明属于分析检测技术领域,具体涉及一种用于检测基质金属蛋白酶-2的磁性荧光复合探针及其制备方法和应用。
背景技术
基质金属蛋白酶-2(MMP-2)又称明胶酶A或Ⅳ型胶原酶,其广泛存在于细胞和组织中,参与多种生理和病理过程,如血管生成、组织修复和形态变化等。MMP-2在细胞增殖、凋亡和免疫监视方面也发挥着重要作用,在多种恶性肿瘤(如结肠癌、胃癌、乳腺癌、卵巢癌、子宫内膜癌等)中,MMP-2会均有异常表达,是重要的癌症标志物,因此监测MMP-2含量变化对癌症的早期诊断与治疗具有重要的意义。
目前检测MMP-2的方法主要包括荧光明胶酶检测法、明胶酶谱法、高效液相色谱法、荧光法以及电化学法。然而,这些方法往往需要昂贵的仪器、复杂的操作和熟练的操作人员,而且检测的灵敏度和选择性也需提高,这极大地限制了这些方法的实际应用。因此,急需发展简单快速、准确、选择性好、低成本的基质金属蛋白酶检测新技术,从而为了解癌症早期诊断和治疗提供新手段,也为治疗相关疾病药物的研发提供方向。
近年来研究者们基于石墨烯、量子点、贵金属纳米颗粒和上转换纳米材料等新型纳米材料构建了纳米探针用于MMP-2的检测,由于纳米材料的引入,使得MMP-2检测方法的灵敏度、特异性、响应速度、响应时间以及响应范围等性能指标又提高到一个新的水平。但上述纳米探针仍然存在一些缺点,如制备过程复杂、成本高昂,不能重复利用,有些还有毒性。因此,探索新型复合探针,并基于其性能建立检测MMP-2的新方法具有重要意义。
针对现有技术存在的问题,发明人意外发现,采用磁性材料、功能多肽和荧光探针制备获得的磁性荧光复合探针具有可操控、可通过磁性分离实现重复利用、灵敏度高、抗干扰能力强、背景信号小等优点,并建立了简单、快速、灵敏的MMP-2的检测方法。
发明内容
针对上述技术问题,本发明的目的在于提供一种用于检测基质金属蛋白酶-2的磁性荧光复合探针,所述的复合探针由金属螯合配基修饰的纳米磁珠和荧光素标记的功能多肽构成。
优选的,所述的功能多肽的氨基酸序列为:
①Cys-Leu-(Aib)-Glu-Glu-Lys-Ser-Gly-Pro-Leu-Gly-Val-Arg-Gly-Ser-Lys-Glu-Glu-(Aib)-Leu-His-His-His-His-His-His,
②Ser-Gly-Pro-Leu-Gly-Val-Arg-Gly-Ser-His-His-His-His-His-His,
③Phe-Try-Leu-Pro-Leu-Gly-Val-Arg-Phe-Try-Leu-His-His-His-His-His-His,
④Asp-Thr-Asp-Lys-Pro-Leu-Gly-Val-Arg-Phe-Try-Leu-His-His-His-His-His-His,
⑤Cys-Pro-(Aib)-Trp-Leu-Try-Pro-Leu-Gly-Val-Arg-Try-Leu-Trp-(Aib)-Pro-Cys-His-His-His-His-His-His中的任一种。
优选的,所述的荧光素为异硫氰酸荧光素(FITC)、羧基荧光素(FAM)、罗丹明类(TAMRA、ROX等)中的任一种;
优选的,所述的金属螯合配基修饰的纳米磁珠为钴离子螯合配基修饰的纳米磁珠、镍离子螯合配基修饰的纳米磁珠、铜离子螯合配基修饰的纳米磁珠中的任一种。
本发明还提供了所述磁性荧光复合探针的制备方法,包括以下步骤:
(1)合成功能多肽并制成溶液备用;
(2)将金属螯合配基修饰的纳米磁珠分散在PBS溶液中,再加入步骤(1)所述的功能多肽溶液,37℃下孵育反应后磁分离,得到负载功能功能多肽的纳米磁珠;
(3)用HEPES缓冲溶液将步骤(2)得到的纳米磁珠洗涤,至洗涤液的荧光强度趋于零,即得磁性荧光复合探针。
优选的,所述的功能多肽溶液浓度为5.0-10.0μM,所述的金属螯合配基修饰的纳米磁珠浓度为0.5-2.0mg/mL,反应时间为20-60min。
本发明还提供了所述的磁性荧光复合探针在检测基质金属蛋白酶-2中的应用,包括如下步骤:
(1)在HEPES缓冲溶液中加入磁性荧光复合探针和待测样品MMP-2,室温下振荡反应,磁分离,收集上清夜;
(2)将收集的上清夜转移至石英比色皿中,检测荧光素的发光强度;
(3)与MMP-2浓度的标准曲线进行对比,计算待测样品中基质金属蛋白酶-2的浓度。
优选的,所述步骤(1)中HEPES缓冲溶液的pH=7.4,包括为10mM HEPES、150mMNaCl和5mM CaCl
优选的,检测基质金属蛋白酶-2的线性范围为1.2ng/mL-120ng/mL,检测限可达0.3ng/mL。
本发明还提供了所述磁性荧光复合探针在检测胃癌细胞中基质金属蛋白酶-2的应用。
本发明的有益效果是:
(1)本发明提供的磁性荧光复合探针可磁操控、可磁分离,也可重复利用,相较于已报道的纳米探针在检测基质金属蛋白酶-2过程中具有独特的优势,显著提高了纳米探针的实用性,而且该复合探针同时具备了荧光和磁性,可用作生物体内靶向定位和生物荧光成像方面,因此在癌症早期诊断、治疗以及药物研发方面具有重要应用价值;
(2)本发明提供的磁性荧光复合探针结构设计巧妙,改变功能功能多肽序列即可设计其他蛋白酶的纳米探针,具有一定的通用性,而且其制备过程简单,对设备要求低,便于推广;
(3)本发明提供的磁性荧光复合探针用于基质金属蛋白酶-2的检测具有灵敏度高、抗干扰能力强、背景信号小的优点,可用于样品的分析检测,其检测基质金属蛋白酶-2的线性范围为1.2ng/mL-120ng/mL,检测限为0.3ng/mL。
附图说明
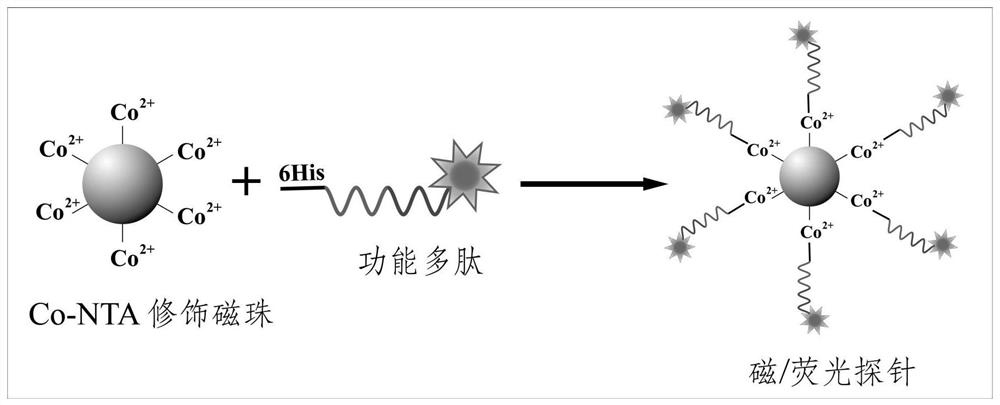
图1制备用于检测基质金属蛋白酶-2的磁性荧光复合探针的流程图;
图2 Co-NTA修饰磁珠的透射电镜图;
图3 Co-NTA修饰磁珠的X-射线光电子能谱图;
图4磁性荧光复合探针的荧光显微镜照片;
图5磁性荧光复合探针在溶液中的分散及磁分离过程图;
图6磁性荧光复合探针的荧光显微镜照片;
图7具体反应条件下溶液荧光光谱变化图;
图8加入不同浓度基质金属蛋白酶-2后检测体系荧光光谱变化图;
图9为基质金属蛋白酶-2响应的线性曲线;
图10为检测基质金属蛋白酶-2的选择性。
具体实施方式
为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明。以下实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
本发明所述的金属螯合配基修饰的纳米磁珠是指纳米磁珠先与螯合配基通过羧基和氨基间的共价作用将螯合配基连接在磁珠表面,再将金属离子通过配位螯合的作用结合在螯合配基上,最终形成金属螯合配基修饰的纳米磁珠,其中螯合配基是次氨基三乙酸(NTA)、亚氨基二乙酸(lDA)和羧甲基化天冬氨酸中的任一种,金属离子为钴离子(Co
实施例1一种用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备方法1
(1)设计荧光素标记的功能多肽并联系生物公司合成,具体氨基酸序列如下5-FITC-(Acp)-Cys-Leu-(Aib)-Glu-Glu-Lys-Ser-Gly-Pro-Leu-Gly-Val-Arg-Gly-Ser-Lys-Glu-Glu-(A ib)-Leu-His-His-His-His-His-His,其纯度大于95%,将合成好的功能多肽溶解在水中形成100μM功能多肽溶液待用;
(2)吸取45μL 20mg/mLCo-NTA修饰磁珠分散液,进行磁分离后用pH=8.0的PBS溶液(包含100mM Na
(3)用pH=7.4HEPES缓冲溶液将(2)步得到的磁珠反复洗涤,直至洗涤液的荧光强度趋于零,洗涤后磁分离所得纳米磁珠,即为用于检测基质金属蛋白酶-2的磁性荧光复合探针。
实施例1中用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备流程图如图1所示,从图1中可以详细的看到磁性荧光复合探针的制备流程。
实施例中使用的Co-NTA修饰磁珠的透射电镜图(TEM)如图2所示,X-射线光电子能谱(XPS)如图3所示。从图2可以看出,该磁珠具有良好的分散性和均一性,其平均粒径约为1μm。X-射线光电子能谱(XPS)对磁珠的表面状态进行了表征,所有峰的位置均通过C1s峰(284.6eV)进行了校正,图3(A)表明磁珠含有C,N,O,Fe和Co元素,Co 2p的高分辨率XPS精细光谱(图3(B))进一步表明,Co元素存在于磁珠的表面,为6His标记功能多肽的修饰提供了良好的螯合位点。
利用荧光显微镜我们对制备的磁性荧光复合探针进行了表征,荧光照片如图4所示,从图4可以看出,纳米复合探针呈球形,与TEM表征的磁珠形貌基本一致,但其表面发绿色荧光,这说明FITC荧光素标记的功能功能多肽已包覆到Co-NTA修饰磁珠表面,才使纳米复合探发出荧光,这也说明成功制备了磁性荧光复合探针。
对制备的磁性荧光复合探针的磁响应能力及分散性我们也进行了考察,结果如图5所示,从图中可看到磁性荧光复合探针在水相中具有良好的分散性,当外加磁场时35sec内迅速分离,轻轻摇晃后又可重新均匀分散在水相中,其水相良好的分散性和磁响应能力为其下一步应用提供了基础。
由于实施例1制备得到的磁性荧光复合探针表征出了良好的性能,发明人在实施例1的基础上,改变各原料的浓度以及反应时间,进而观察制备得到的磁性荧光复合探针的性能,并得到以下实施例:
实施例2一种用于检测基质金属蛋白酶-2的磁性荧光复合探针的的制备方法2
本实施例涉及的用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备步骤同实施例1,区别在于:Co-NTA修饰磁珠分散液终浓度为0.5mg/mL,功能多肽溶液浓度5.0μM,磁珠与功能多肽孵育反应时间为20min。
实施例3一种用于检测基质金属蛋白酶-2的磁性荧光复合探针的的制备方法3
本实施例涉及的用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备步骤同实施例1,区别在于:Co-NTA修饰磁珠的浓度为0.5mg/mL,功能多肽溶液浓度为10.0μM,磁珠与功能多肽孵育反应时间为20min。
实施例4一种用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备方法4
本实施例涉及的用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备步骤同实施例1,区别在于:Co-NTA修饰磁珠的浓度为2.0mg/mL,功能多肽溶液浓度为10.0μM,磁珠与功能多肽孵育反应时间为60min。
实施例5一种用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备方法5
本实施例涉及的用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备步骤同实施例1,区别在于:Co-NTA修饰磁珠的浓度为0.5mg/mL,功能多肽溶液浓度为5.0μM,磁珠与功能多肽孵育反应时间为20min。
实施例6一种用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备方法6
本实施例涉及的用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备步骤同实施例1,区别在于:Co-NTA修饰磁珠的浓度为0.5mg/mL,功能多肽溶液浓度为5.0μM,磁珠与功能多肽孵育反应时间为60min。
通过表征实施例2-6所制备的磁性荧光复合探针,可以发现,在上述原料浓度和反应时间下,均可以制得磁性荧光复合探针。
实施例7一种用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备方法7
本实施例涉及的用于检测基质金属蛋白酶-2的磁性荧光复合探针的制备步骤同实施例1,区别在于:功能多肽的氨基酸序列为5-TAMRA-Cys-Leu-(Aib)-Glu-Glu-Lys-Ser-Gly-Pro-Leu-Gly-Val-Arg-Gly-Ser-Lys-Glu-Glu-(Aib)-Leu--His-His-His-His-His-His,其中标记的荧光素为:四甲基罗丹明(TAMRA),Co-NTA修饰磁珠的浓度为1.5mg/mL,功能多肽溶液浓度为6.8μM,磁珠与功能多肽孵育反应时间为60min。
利用荧光显微镜我们对本实施例中制备的磁性荧光复合探针进行了表征,荧光照片如图6所示,从图6可以看出,该复合探针与实施例1制备的探针形貌基本一致,但其表面发红色荧光,这说明TAMRA标记的功能功能多肽已包覆到Co-NTA修饰磁珠表面,才使纳米复合探发出发红色荧光,这也说明成功制备了磁性荧光复合探针。
实施例8应用制备的磁性荧光复合探针检测MMP-2
为了验证制备的磁性荧光复合探针可实现MMP-2的检测,本实施例先用抑制剂(1,10-菲罗啉)对MMP-2活性进行抑制,再与实施例1制备的磁性荧光复合探针进行作用,最后观察反应体系荧光光谱变化,具体实验步骤如下:
(1)首先将MMP-2(120ng/mL)与不同浓度抑制剂(100μM,50μM)混合并孵育反应,然后将得到的溶液加入pH=7.4的HEPES缓冲溶液(包含10mM HEPES、150mM NaCl、5mM CaCl
(2)将收集的清夜转移至石英比色皿中,检测其在520nm处的荧光强度。
实验中反应体系荧光光谱变化结果如图7所示,图中a线为未加入MMP-2时,磁分离后检测体系上清液体系的荧光强度,b线为加入120ng/mLMMP-2时检测体系上清液体系的荧光强度,c线为120ng/mLMMP-2与50μM抑制剂孵育后加入检测体系与复合探针反应后,上清液体系的荧光强度,d线为120ng/mLMMP-2与100μM抑制剂孵育后加入检测体系与复合探针反应后,上清液体系的荧光强度。从图7可以看出,当MMP-2活性未被抑制时,加入MMP-2后上清液的荧光强度发生了明显的变化,证明复合探针与MMP-2发生了特异性酶切反应。但当MMP-2与抑制剂作用后,其加入检测体系与复合探针反应后,检测体系上清液的荧光强度并未增强,这一实验结果充分说明,本发明专利制备的磁/荧光纳米复合探针确实与MMP-2发生了反应。
实施例9磁性荧光复合探针检测基质金属蛋白酶-2的应用
利用实施例1制备的磁性荧光复合探针检测基质金属蛋白酶-2(MMP-2)的应用,其特征在于,它包括如下步骤:
(1)在pH=7.4的HEPES缓冲溶液(包含10mM HEPES、150mM NaCl和5mM CaCl
(2)将收集的清夜转移至石英比色皿中,检测其在520nm处的荧光强度;
(3)与MMP-2浓度的标准曲线进行对比,计算待测样品中MMP-2的浓度。
图8为加入不同浓度基质金属蛋白酶-2后检测体系荧光光谱变化图,图9为基质金属蛋白酶-2响应的标准曲线。
从图8数据可以看到,当基质金属蛋白酶-2(MMP-2)的浓度在0-120ng/mL范围内逐渐增大时,检测体系的荧光强度也随之增强,这表明该探针对MMP-2浓度变化具有很好的响应。
从图9数据可以看到,基质金属蛋白酶-2的浓度变化与检测体系荧光强度变化值呈良好的线性关系,基质金属蛋白酶-2(MMP-2)检测的线性范围为1.2ng/mL-120ng/mL,检测限为0.3ng/mL,其线性方程为y=0.0271x+0.5455,相关系数R
实施例10所述磁性荧光复合探针检测基质金属蛋白酶-2的抗干扰能力
本实施例是为了验证实施例1制备的磁性荧光复合探针检测基质金属蛋白酶-2的抗干扰能力,检测步骤与实施例9相同,区别在于:检测体系中待测目标物MMP-2分别依次用实际样品中可能存在的干扰物葡萄糖(Glucose)、溶菌酶(Lysozyme)、牛血清白蛋白(BSA)、氯化镁(MgCl
从图10可以看出,检测体系中存在与基质金属蛋白酶-2可能共存的抗干扰物时,只有MMP-2能明显地引起荧光响应的变化,其他的干扰物没有明显的变化,这表明本发明所述磁性荧光复合探针具有很强的抗干扰能力,适合于复杂环境中MMP-2的检测。
实施例11所述磁性荧光复合探针检测细胞裂解液中的基质金属蛋白酶-2
将胃黏膜上皮细胞GES以及胃癌细胞HGC-27和SGC-7901用Ripa裂解液充分裂解后,12000转离心10分钟,收集上清液,备用。
取3份上述胃癌细胞裂解液各5μL,稀释10倍,分别加入pH=7.4的HEPES缓冲溶液与1.0mg/mL磁性荧光复合探针在室温下于涡旋振荡器中反应90min后,进行磁分离,并收集反应体系的上清夜检测,其检测过程和操作方法与实施例9在缓冲溶液中测定MMP-2时完全相同,检测结果如表1所示。另外,采用标准加入法对该磁性荧光复合探针的可靠性进行了考察,每个样本分别加入500ng/mL的MMP-2,检测结果如表1所示,测得回收率在96.9%到103.8%之间,说明该磁性荧光复合探针可以用于实际样品检测。
表1细胞裂解液中基质金属蛋白酶-2的测定
综上所述,本发明所制备的磁性荧光复合探针结构设计巧妙,制备方法简单,制备得到的探针对基质金属蛋白酶-2(MMP-2)具有很好的响应,能够用于基质金属蛋白酶-2的检测,具有灵敏度高、抗干扰能力强、背景信号小的优点,可用于样品的分析检测,其检测基质金属蛋白酶-2的线性范围为1.2ng/mL-120ng/mL,检测限为0.3ng/mL,在癌症早期诊断、治疗以及药物研发方面有重要应用价值。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改,等同替换,改进等,均应包含在本发明保护范围内。
- 一种用于检测基质金属蛋白酶-2的磁性荧光复合探针及其制备方法和应用
- 一种用于检测基质金属蛋白酶-2的磁性荧光复合探针及其制备方法和应用
