FGFR3抑制剂在制备治疗椎弓峡部裂药物中的应用
文献发布时间:2023-06-19 12:04:09
技术领域
本发明属于生物医疗领域,具体地说,涉及一种FGFR3抑制剂在制备治疗椎弓峡部裂药物中的应用。
背景技术
椎弓峡部是椎体上下关节突之间、椎弓与椎板交界处的骨性结构,峡部骨质的缺损、连续性中断统称为椎弓峡部裂,脊柱外伤、退变、发育异常等因素均可引起此病。虽然发育不良性椎弓峡部裂从定义上以“椎弓发育异常”区别于其他类型的峡部裂,但该病具体的发育异常环节尚不清楚,且追溯患者病史时常有疑似外伤等峡部裂力学诱发因素,从而造成了疾病分类及临床诊疗中的诸多困难。
目前对于发育不良性椎弓峡部裂这种病还没有相关的药物治疗报道的,这也是一个亟待解决的问题。
发明内容
本发明的目的是提供一种FGFR3抑制剂在制备治疗椎弓峡部裂药物中的应用,以FGFR3抑制剂为靶点治疗发育不良性椎弓峡部裂不仅突破了SLC26A2突变相关疾病药物匮乏的限制,还具有良好的转化前景。
为了解决上述技术问题,本发明公开了一种FGFR3抑制剂在制备治疗椎弓峡部裂药物中的应用。
进一步地,椎弓峡部裂为SLC26A2相关发育不良性椎弓峡部裂。
进一步地,FGFR3抑制剂为NVP-BGJ398。
进一步地,NVP-BGJ398对FGFR3信号通路过度激活具有抑制作用。
进一步地,NVP-BGJ398显著改善SLC26A2功能缺失诱发的NCS发育异常。
进一步地,NVP-BGJ398显著改善SLC26A2突变诱发的椎弓峡部发育不良。
本发明还公开了一种制备治疗及预防椎弓峡部裂的药物,包括FGFR3抑制剂。
进一步地,FGFR3抑制剂为NVP-BGJ398。
进一步地,椎弓峡部裂为SLC26A2相关发育不良性椎弓峡部裂。
进一步地,该药物为粉剂、胶囊剂、注射剂或片剂。
本发明可以获得包括以下技术效果:
本发明FGFR3抑制剂在制备治疗椎弓峡部裂药物中的应用,NVP-BGJ398对FGFR3信号通路过度激活具有抑制作用、显著改善SLC26A2功能缺失诱发的NCS发育异常和SLC26A2突变诱发的椎弓峡部发育不良,以FGFR3抑制剂为靶点治疗发育不良性椎弓峡部裂不仅突破了SLC26A2突变相关疾病药物匮乏的限制,还具有良好的转化前景。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是椎体发育时骨化的顺序示意图;
图2是小鼠细胞的NVP-BGJ398细胞毒性实验结果图;
图3是人软骨细胞的NVP-BGJ398细胞毒性实验结果图;
图4是NVP-BGJ398对FGFR3信号通路过度激活的抑制作用的结果图;
图5是NVP-BGJ398在体显著改善SLC26A2功能缺失诱发的NCS发育异常的实验结果图;
图6是NVP-BGJ398在体显著改善SLC26A2突变诱发的椎弓峡部发育不良的实验结果图,其中,(A)3月龄小鼠microCT分析及重建策略,α平面为通过椎弓根中点的横断面,用于观察药物对椎弓后份面积的改善;β平面为通过椎弓峡部的截面,用于观察药物对椎弓峡部面积的改善,以椎弓根上下沿对椎体进行三维重建,以排除临位椎体对目标椎体骨容积测量的影响,通过β界面将椎体分为前、后份测量骨容量;(B)治疗组和对照组小鼠椎体后份面积及椎体峡部截面积;(C)治疗组和对照组小鼠椎体后份面积、椎体峡部截面积和椎体前、后份骨容积统计。
具体实施方式
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
前期研究发现发育不良性椎弓峡部裂具有显著的家族遗传倾向,并于疾病家系中首次鉴定出骨畸形发育不良硫酸根离子转运体(SLC26A2)的新型突变(c.2286A>T;p.D673V)是发育不良性椎弓峡部裂的致病突变。随后,发明人成功构建Slc26a2点突变小鼠,初步表型分析结果显示:Slc26a2D673V/D673V小鼠发育早期并未出现先天性椎弓峡部连续性中断,但成年纯合突变小鼠出现典型的椎弓发育不良,且椎体有限元分析结果表明椎弓结构异常导致应力向椎弓峡部异常地集中分布。以上研究结果提示,SLC26A2点突变导致的椎弓发育异常是诱发椎弓峡部裂产生的结构基础,因此明确椎弓发育的异常环节是揭示该病确切发病机制的重要突破口。
椎体-神经弓软骨结合(neuro-central synchondrosis,NCS)是调控椎弓发育的重要软骨结构,有研究证实NCS的提前骨化、闭合会导致椎弓发育畸形。发明人研究发现Slc26a2全身敲除小鼠(Slc26a2-/-)出现了NCS提前骨化的异常表型,且成纤维细胞生长因子受体3(FGFR3抑制剂)信号通路在SLC26A2敲除软骨细胞中存在异常激活。值得注意的是,FGFR3增强型突变所致的软骨发育不全患者及小鼠模型,均出现了与Slc26a2D673V/D673V小鼠相似的椎弓骨性结构异常。因此,猜测SLC26A2 D673V突变可能通过异常激活FGFR3信号通路进而诱发NCS的提前骨化,最终导致椎弓发育不良。据此进一步推测,在NCS骨化时间窗内靶向FGFR3信号通路,可延缓SLC26A2突变导致的NCS提前骨化、防治椎弓发育异常,或将成为首个发育不良性椎弓峡部裂的药物干预策略。
以FGFR3为靶点治疗发育不良性椎弓峡部裂不仅突破了SLC26A2突变相关疾病药物匮乏的限制,还具有良好的转化前景。值得注意的是,SLC26A2点突变如果导致软骨源性的NCS提前骨化,药物干预必须在NCS组织完全骨化、闭合前进行才具有疗效,因此利用发明人近期构建的点突变小鼠明确以上科学问题,对创新药物的研发及药物干预策略的制定均具有十分重要的指导意义。预实验结果也初步表明,在体给予Col2.3kb-Cre;Slc26a2fl/fl小鼠FGFR3抑制剂,可以显著改善其NCS提前骨化、椎体软骨增殖及成熟分化阻滞等异常表型,从而初步证实了上述药物干预策略的有效性。
目前FGFR3抑制剂主要包括三类:1)直接抑制FGFR3受体磷酸化,如酪氨酸激酶抑制剂NVP-BGJ398、ASP5878、Dovitinib;2)抑制FGFR3下游效应分子,如ERK1/2磷酸化抑制剂Meclozine;3)FGFR3拮抗信号通路的配体,如甲状旁腺激素PTH和C型利钠肽CNP。
下面通过具体的试验来对本发明技术方案进行进一步的说明和解释。
本发明中试验部分所用仪器、设备和药物均匀市面上常规药物,均可购买到。
图1是椎体发育时骨化的顺序示意图,椎体在人类正常胚胎发育时,顺序历经软骨雏形的形态发生及融合、软骨细胞的增殖和成熟分化,以及位于椎体中心和两侧椎板-神经弓初级骨化中心的发生,并随着椎体软骨内化骨的演进,椎体软骨逐渐减少、形成位于椎体与神经弓交界处的椎体-神经弓软骨结合(NCS),随着该NCS结构的自然骨化、闭合,形成成熟的椎弓骨性结构。研究表明,SLC26A2突变通过引起该NCS结构发育异常,即NCS提前骨化、闭合,从而诱发SLC26A2相关的发育不良性椎弓峡部裂。
前期研究发现提示过度激活的FGFR3信号通路在SLC26A2功能缺失导致的骨软骨发育不良疾病中具有关键作用,是导致NCS提前骨化闭合、诱发发育不良性椎弓峡部裂的重要原因,因此采用药物抑制过度激活的FGFR3信号通路将是首个发育不良性椎弓峡部裂的药物干预策略。
一、小鼠和人软骨细胞的NVP-BGJ398细胞毒性实验
小鼠原代软骨细胞分离及培养:取P0-P7小鼠胚胎,沿腹部至胸骨剪开小鼠表皮,剪开胸腔隔膜去除多余软组织,取出小鼠完整胸廓;胸廓肋骨上钙化骨组织颜色较深、透明度较低,软骨组织颜色较浅、透明度较高,沿软骨与钙化骨间分界线剪开胸廓肋骨,并去除钙化骨组织,保留软骨组织;剥离的肋软骨组织使用PBS清洗2次,放置于PBS中备用。配制消化液:30mg胶原蛋白酶D溶于10ml DMEM低糖培养液中;取5ml消化液放入上述肋软骨,置于培养箱中37℃消化45分钟;取出肋软骨,体视镜下再次剥离肋骨条上多余软组织和钙化骨组织;更换新鲜消化液5ml,放入肋骨条,置于培养箱中37℃消化4h;使用巴氏管反复吹打吹散细胞,去除杂质,并用40μm细胞筛过滤液体。将上述滤后液体400g离心10分钟后,弃上清;加入新鲜培养液重悬细胞,细胞悬液均匀滴加至6孔板中,加入2ml添加10%FBS以及1%双抗的DMEM培养液,每隔一天更换新鲜培养液。
人原代软骨细胞分离及培养:根据空军军医大学第一附属医院伦理委员会批准的方案,经患者知情同意后,从接受髋关节置换术的患者股骨头样本中获取关节软骨细胞。将软骨组织切成1mm3的小块,用PBS洗涤3次,高葡萄糖DMEM配制0.17%(w/v)II型胶原酶消化液,并在定轨振荡器上于37℃消化16小时。消化完成后,将滤液通过70μm过滤器,并用含有1%双抗和10%FBS的DMEM洗涤细胞2次,将细胞接种与培养皿,使用含有1%双抗,10%FBS,1%非必需氨基酸(NEAA),1M HEPES,100mM丙酮酸钠,0.2M脯氨酸和25mg/ml抗坏血酸的高葡萄糖DMEM进行培养。
CCK8药物毒性检测:使用CCK-8试剂盒来检测药物对人和小鼠软骨细胞活力的影响。制备细胞悬液并进行计数,按0.1μM、1μM、10μM、100μM、1000μM、2000μM浓度加入药物,调整细胞数量为10000个/mL后,对96孔板进行细胞接种,每孔加入100μl细胞悬液,使每孔细胞数量为1000个,设置阴性及空白对照,每组设置5个复孔,边缘孔用培养基填充。将CCK-8试剂(10μL)添加到90μL DMEM培养基中以制备成工作溶液,每孔添加100μL,并孵育1小时。使用酶标仪测定450nm光吸收值,按照细胞活力=(实验组OD值-空白对照OD值)/(阴性对照OD值-空白对照OD值)×100%,以计算细胞活力。结果如图2和图3所示。
二、NVP-BGJ398对FGFR3信号通路过度激活的抑制作用
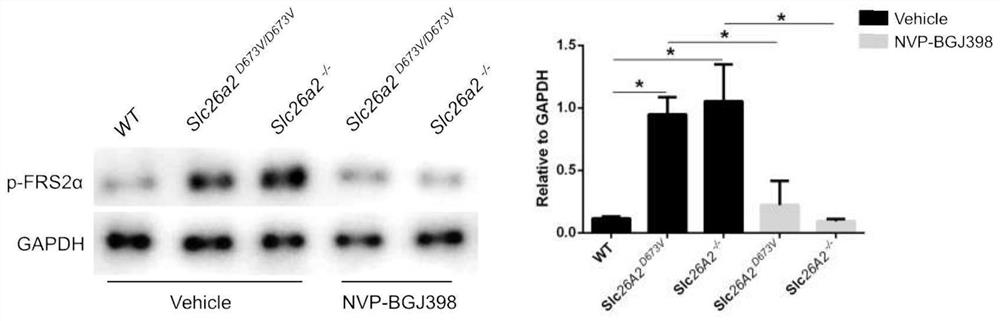
按照前述方法获取野生型、SLC26A2点突变小鼠和SLC26A2敲除小鼠原代软骨细胞、进行培养,当细胞达到70%汇聚度时,分别加入500nM NVP-BGJ398及DMSO溶剂对照培养12小时,用FGF-2(50ng/ml)处理原代软骨细胞5分钟,随即弃去细胞培养基,并加入含有PhosSTOP磷酸酶抑制剂混合物和蛋白酶抑制剂的RIPA进行冰上细胞裂解5分钟。将裂解液吸出至1.5ml离心管中;将样品和上样缓冲液混合并煮沸10分钟,于4℃以13000rpm离心10分钟;使用BCA蛋白质测定试剂盒,使用分光光度计在570nm处测量吸光,并制作BSA标准品蛋白浓度标准曲线,从而确定样品中总蛋白质的浓度。采用NuPAGE 4-12%Bis-Tris预制胶,组装至电泳槽中,并向电泳槽中加入1x NuPAGE电泳缓冲液,每孔上样10-15ul,约20-40μg蛋白质,并加入5μl预染蛋白标准品,在100V下使蛋白质样品进入分离凝胶,在150V下完成蛋白分离。使用甲醇活化PVDF膜15分钟,之后将其与滤纸和海绵垫在蛋白质转移前5分钟浸泡在冰冷的转移缓冲液中;使用经典的“三明治”式组装转膜夹,即海绵垫-滤纸-凝胶-PVDF膜-滤纸-海绵垫,将转膜夹放入转膜槽中于380A转膜30-40分钟,结束取出PVDF膜,并使用5%1xTBST配制的脱脂牛奶对PVDF膜进行封闭,室温摇床上放置40分钟。将目的条带浸泡在1:1000稀释的pFRS2Y436和GAPDH一抗溶液中,4℃过夜;使用1xTBST洗涤PVDF膜3次,每次10分钟;使用对应二抗进行37℃孵育1小时后,使用1xTBST洗涤PVDF膜3次,每次10分钟;将超敏ECL发光液均匀地淋在膜上,使用发光仪进行自动曝光,并使用ImageJ软件计算条带灰度值,采用GraphPad Prism 6软件进行统计学分析以及制图。
结果如图4所示,表明:体外给予NVP-BGJ398,可以显著抑制SLC26A2点突变小鼠和SLC26A2敲除小鼠原代软骨细胞FGFR3信号通路的过度激活。
三、NVP-BGJ398在体显著改善SLC26A2功能缺失诱发的NCS发育异常P7小鼠给药策略:将NVP-BGJ398粉末溶解于含有5%DMSO的3.5mM HCl溶中,按照2mg/kg计量对出生后7天的目的基因型小鼠每日进行腹腔注射(n=4),另取相同基因型小鼠(n=4)每日腹腔注射相同体积的溶剂(3.5mM HCl,5%DMSO)。经过7次注射后,于第十四天对上述分组小鼠进行腰椎取材,观察药物对NCS提前骨化、早闭病理表型的改善作用。
P14 NCS软骨形态学分析:收集给药后的目的基因型小鼠腰椎段椎体标本,固定于4%PFA溶液并于4℃过夜;使用PBS摇床洗涤标本,10%EDTA脱钙、30%蔗糖脱水,OCT包埋并以轴位、矢状面切片;采用番红O-速绿染色,观察小鼠椎体软骨组织番红O着色情况、NCS软骨细胞排列、形态以及骨化程度。
软骨细胞分化及增殖检测:采取肥大软骨细胞的标志物ColX和增殖软骨细胞标志物Ki67进行免疫荧光检测,以评价药物对软骨细胞分化及增殖的改善。取出冰冻切片使其恢复室温,使用PBS洗去包埋剂。使用免疫组化笔勾画出组织轮廓,并向组织上滴加免疫荧光穿透液,室温孵育10分钟后使用PBS洗涤3次,每次5分钟。对ColX进行抗原修复,使用PBS配制2mg/ml透明质酸酶,将其覆盖在组织上于37℃消化20分钟,使用PBS洗涤3次,每次5分钟,之后使用免疫荧光封闭液处理切片,室温孵育10分钟。使用免疫荧光一抗稀释液按1:100比例稀释anti-ColX和anti-Ki67一抗,并在4℃过夜孵育。使用PBS洗涤3次,每次5分钟,之后使用免疫荧光二抗稀释液按1:500比例稀释二抗,并于37℃孵育一小时。使用PBS充分洗涤,所有切片均使用含有DAPI的封片液进行封片,并使用荧光显微镜进行观察以及采集图像,统计Ki67阳性细胞的占比。
结果如图5所示,表明:1周龄小鼠连续7天接受腹腔注射NVP-BGJ398(2mg/kg)或溶剂(3.5mM HCl,5%DMSO),于2周龄对药物治疗组和对照组SLC26A2椎体软骨嵌合体小鼠第5腰椎进行表型分析,可见和溶剂注射组相比,NCS早闭的病理征象被显著减轻(图A),且给药后NCS内软骨细胞成熟分化、增殖被显著改善(图B)。
四、NVP-BGJ398在体显著改善SLC26A2突变诱发的椎弓峡部发育不良NCS骨化窗口给药及骨性结构分析策略:基于NVP-BGJ398能延缓NCS异常提前骨化、闭合,申请人拟进一步验证在NCS骨化窗口期(P7-P13)给药,对成年小鼠椎弓峡部骨性结构异常的治疗有效性。将NVP-BGJ398粉末溶解于含有5%DMSO的3.5mM HCl溶中,按照2mg/kg计量对出生后7天的目的基因型小鼠每日进行腹腔注射(n=5),另取相同基因型小鼠(n=5)每日腹腔注射相同体积的溶剂(3.5mM HCl,5%DMSO)。经过7次注射后停止用药,并于3月龄对上述分组小鼠进行腰椎取材,观察药物对椎弓峡部骨性病理表型的改善作用。
MicroCT扫描与图像重建:使用美国GE公司eXplore Locus SP型显微CT对固定后的小鼠腰椎进行扫描,扫描分辨率21μm,旋转角度360°,旋转角度增量0.4°,电压80kV,电流80μA,曝光时间3000ms,帧平均数为4,像素组合为1×1;使用Micview V2.1.2三维重建处理软件进行目标区域的三维图像重建,并测量感兴趣区域的骨容量。并使用ImageJ软件计算面积,采用GraphPad Prism 6软件进行统计学分析以及制图。
结果如图6所示,1周龄小鼠连续7天接受腹腔注射NVP-BGJ398(2mg/kg)或溶剂(3.5mM HCl,5%DMSO),于3月龄对药物治疗组和对照组SLC26A2点突变小鼠第5腰椎进行表型分析,可见和溶剂注射组相比,椎弓峡部发育不良的病理征象被显著减轻。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- FGFR3抑制剂在制备治疗椎弓峡部裂药物中的应用
- 化合物在制备小分子抑制剂或治疗癌症的药物中的应用及小分子抑制剂和治疗癌症的药物
