一种编码阿魏酸酯酶的基因FAEs、重组载体、重组菌株及应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于基因工程技术领域,尤其涉及一种编码阿魏酸酯酶的基因FAEs、重组载体、重组菌株及应用。
背景技术
被誉为“地球第三极”的青藏高原,由于其地理位置和气候环境特殊,孕育了特有且丰富的生物种质资源,研究表明,由于青藏高原高寒、低氧和强紫外线等极端气候环境影响,使得青藏高原牧草青贮中存在一些特殊益生菌菌种,具有极其特殊的生物学功能益生菌,它是这块宝地馈赠给人类宝贵而特有的乳酸菌种质资源,菌种资源开发和产业化利用价值极大。
木质纤维素一般指的是包括以木质素和纤维素以及半纤维素组成的生物质,主要是组成木本、草本植物的难以利用的细胞壁成分。木质纤维素中含量仅次于纤维素的半纤维素中存在很多木糖、阿拉伯糖类的五碳糖,这些五碳糖很难被大多数微生物所利用,如何有效利用纤维原料中的碳源是提高纤维原料有效利用首先要解决的问题。高纤维原料中富含纤维素,半纤维素和木质素,半纤维素和木质素之间的交联及结晶严重限制了纤维素酶对纤维素的水解,为木质纤维素预处理带来了很大的难题。
阿魏酸酯酶(FAE)是碳水化合物酯酶亚家族的一种,能够水解植物细胞壁中阿魏酸与多糖间的酯键,研究表明,阿魏酸酯酶是释放植物细胞壁中阿魏酸的关键作用酶,在内切型木聚糖酶等的协同作用下,能够有效释放小麦麸皮、玉米秸秆等基质中的阿魏酸或阿魏酸二聚体,从而提高木质纤维素转化率。
目前关于阿魏酸酯酶的研究主要集中在菌株的筛选与应用方面;目前报道的关于阿魏酸酯酶基因的克隆也主要是从真菌或者酵母中获得。然而来自真菌及酵母中的基因往往含有内含子,使其在后续基因表达时需要进行修饰以去除内含子,使细菌高表达载体构建过程更加繁琐。因此选择细菌源的阿魏酸酯酶基因往往更适合细菌高表达载体构建。但目前关于细菌源阿魏酸酯酶基因分子克隆方面的报道少之又少。对来自罗伊氏乳杆菌阿魏酸酯酶基因的克隆的研究更是未见报道。
发明内容
有鉴于此,本发明的目的在于提供一种编码阿魏酸酯酶的基因FAEs、重组载体、重组菌株及应用,本发明从所述罗伊氏乳杆菌A4-2中克隆得到阿魏酸酯酶FAE1的编码基因,并通过大肠杆菌对其重组载体进行表达,获得纯阿魏酸酯酶;解决了现有技术中产阿魏酸酯酶菌株匮乏,无细菌源阿魏酸酯酶基因克隆的技术问题。
本发明提供了一种编码阿魏酸酯酶的基因FAEs,所述阿魏酸酯酶的基因FAEs的核苷酸序列如SEQ ID No.1所示。
本发明提供了一种表达所述的基因FAEs的重组载体,包括初始载体和所述的基因FAEs。
本发明提供了所述的重组载体的制备方法,包括以下步骤:
1)提取罗伊氏乳杆菌A4-2的基因组DNA;
2)以步骤1)获得的基因组DNA为模板,进行PCR扩增获得扩增产物;
3)将所述扩增产物与初始载体连接获得重组载体;
步骤2)所述PCR扩增所用引物对包括上游引物和下游引物;所述上游引物的核苷酸的序列如SEQ ID No.2所示,所述下游引物的核苷酸序列如SEQ ID No.3所示;
所述罗伊氏乳杆菌(Lactobacillus reuteri)A4-2,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCCNo.24966。
优选的,步骤2)所述的PCR扩增的扩增体系以50μL计,包括以下组分:
步骤2)所述的PCR扩增的扩增程序如下:94℃预变性5min;94℃变性1min,58℃退火1min,72℃延伸1.5min,变性、退火、延伸30个循环;最后72℃延伸10min。
本发明提供了一种表达所述基因FAEs的重组菌株,所述重组菌株以大肠杆菌DH5α为宿主菌株,转化有所述的重组载体。
本发明提供了编码阿魏酸酯酶的基因FAEs、所述的重组载体或所述的重组菌株在制备阿魏酸酯酶中的应用。
与现有技术相比,本发明具有如下有益效果:
本发明从所述罗伊氏乳杆菌A4-2中克隆得到阿魏酸酯酶FAE1的编码基因,并通过大肠杆菌对其重组载体进行表达,获得纯酶;通过试验证实,来自本发明所述罗伊氏乳杆菌A4-2的阿魏酸酯酶FAE1具有高比活性、高的酶解效率、高稳定性等优势,在医药保健、食品、饲料以及生物能源等领域具有重要应用前景。
生物保藏说明
本发明提供的罗伊氏乳杆菌(Lactobacillus reuteri)A4-2,保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏编号为CGMCCNo.24966,保藏日期为2022年5月26日;保藏地址为中国北京市朝阳区北辰西路1号院3号。
附图说明
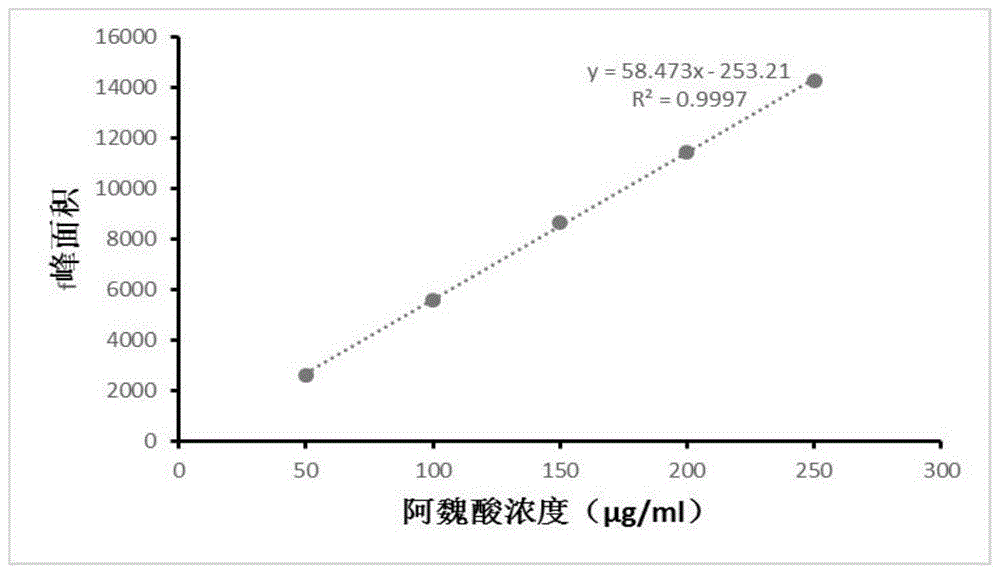
图1为不同阿魏酸浓度条件下对应的阿魏酸峰面积的变化标准曲线;
图2为罗伊氏乳杆菌A4-2粗酶液的最适反应pH(a)及pH稳定性(b);
图3为罗伊氏乳杆菌A4-2粗酶液的最适反应温度(a)及温度稳定性(b);
图4为目的基因FAEs的凝胶电泳图,泳道M是Takara 2000bp DNA marker,泳道1、2、3均是目的基因;
图5为菌液PCR电泳图。
具体实施方式
本发明提供了一种编码阿魏酸酯酶的基因FAEs,所述阿魏酸酯酶的基因FAEs的核苷酸序列如SEQ ID No.1所示,具体如下:
GCCGTTGAAAACGCCGCCCAGGAATTGTAATCGGCTCCCTATAGG CGAATTGGCCCGACGTCGCATGCTCCCGGCCGCCATGGCGGCCGCGGGAATTCGATTTAAGAAGGAGATATACATATGGAAATAACAATCAAACGAGATGGTCTAAAACTATATGGCCTTCTTGAAGGAACAACGACGATTAAAAACGATACGGTTGCAATTCTGATGCATGGCTTTAAGGGCAATCTGGGATATGATGATTCTAAAATTCTATATGCTCTTTCGCACTATTTAAACCAACAAGGAATTCCAACGTTACGCTTTGACTTTGATGGAACTGGCCATAGTGATGGTGAATTCAAGAATATGACAGTTTTCAGTGAAATCCTGGATGGAATGAAAATCATTGACTATGCTCATACCACTATGCAAGCAAAGAAGATTTACCTTATTGGTCATTCGCAAGGTGGGGTAGTTGCTTCGATGCTGGCGGCTTATTATCGCGATATTATTACAAAACTGGTACTGCTGGCATCTGCTGCAACCTTGAAAGATGATGCGCTAAAAGGAGTTTGTCAGGGAAGCCAATATGACCCTAACCATATACCAGAAACGGTTGATGTGCATGGCTTTACCGTTGGTGGCGACTACTTTCGAACGGCGCAGCTTTTACCAATTTACGAAACAGCACAGCATTATAGTGGACCGACACTGCTAATTCATGGGTTAGGTGATAATGTAGTTTCCTCGGAAGCTTCAAAGAAATATAATGTGATCATGCCTAACAGTGAGTTGCATTTAATTCCGGAAGAAGGGCATATGTTTAATGGCTCACAACGCCAAGAAATTTTGGAACTGGTAGCTAACTTTTTAAAAAATCTCGAGCACCACCACCACCACAATCACTAGTGAATTCGCGGCCGCCTGCAGGTCGACCATATGGGAGAGCTCCCAACGCGTTGGATGCATAGCTTGAGTATTCTATAGTGGCACCTAAATAGCTTGGCGGAATCATGGGCATAGCTGGTTCCTGGGGGAAATGGTATCC。
本发明还提供了一种表达所述的基因FAEs的重组载体,包括初始载体和所述的基因FAEs。
在本发明中,所述初始载体优选为pGEM-T Easy或pET-22b;在本发明中,所述基因FAEs优选的克隆于初始载体的pGEM-T Easy上lacZ的多克隆位点。
本发明还提供了所述的重组载体的制备方法,包括以下步骤:1)提取所述的罗伊氏乳杆菌A4-2的基因组DNA;2)以步骤1)获得的基因组DNA为模板,进行PCR扩增获得扩增产物;3)将所述扩增产物与初始载体连接获得重组载体。
本发明首先提取所述的罗伊氏乳杆菌A4-2的基因组DNA,本发明对所述基因组DNA的提取方法没有特殊限定,采用本领域常规的基因组DNA提取方法即可。在本发明中,所述基因组DNA的浓度优选为80~120ng/μL,进一步优选为90~110ng/μL,更进一步优选为ng/μL。
本发明在提取获得所述基因组DNA后,以获得的基因组DNA为模板,进行PCR扩增获得扩增产物;在本发明中,所述PCR扩增所用引物对包括上游引物和下游引物;所述上游引物的核苷酸的序列如SEQ ID No.2所示,所述下游引物的核苷酸序列如SEQ ID No.3所示;具体如下:
上游引物:
TAAGAAGGAGATATACATATGGAAATAACAATCAAACG(SEQ ID No.2);
下游引物:
GTGGTGGTGGTGGTGCTCGAGATTTTTTAAAAAGTTAGCTAC(SEQ ID No.3)。
在本发明中,所述的PCR扩增的扩增体系以50μL计,优选的包括以下组分:
所述PCR扩增的扩增程序优选的如下:94℃预变性5min;94℃变性1min,58℃退火1min,72℃延伸1.5min,变性、退火、延伸30个循环;最后72℃延伸10min。
本发明在获得所述扩增产物后,优选的还包括对所述扩增产物的鉴定、回收步骤。在本发明中,所述鉴定优选的采用琼脂糖凝胶电泳进行,然后将电泳条带切胶回收,将所述回收产物进行测序获得如SEQ ID No.1所示的基因序列。
在本发明中,优选的将所述电泳条带切胶回收后,与初始载体连接获得重组载体。
在本发明中,所述连接体系以10μL计,包括以下组分:
在本发明中,所述连接的温度优选为4℃,所述连接的时间优选为12h。
本发明提供了一种表达所述的基因FAEs的重组菌株,所述重组菌株以大肠杆菌DH5α为宿主菌株,转化有所述的重组载体。
在本发明中,所述重组菌株的制备方法包括以下步骤:将所述连接产物即重组载体与大肠杆菌DH5α的感受态细胞混合,热激后,经培养获得重组菌株。在本发明中,所述重组载体与大肠杆菌DH5α的感受态细胞混合的体积比优选为1:(5~10);本发明在所述混合后,将混合后的体系在冰上放置25~35min,优选为28~32min,更优选为30min。在本发明中,所述热激的温度优选为42℃,所述热激的时间优选为90s。本发明在所述热激后,立即置于冰上冷却1~2min。在本发明中,所述培养优选的采用SOB或LB培养基,所述培养的温度优选为37℃,所述培养的时间优选为45~60min。本发明在所述培养后,优选的还包括对重组菌株验证的步骤,所述验证的步骤优选的包括将所述培养后的重组菌株涂布于含抗生素的LB平板上培养后,挑取单菌落进行液体培养,获得的培养液进行菌落PCR。本发明对所述菌落PCR的步骤没有特殊限定,采用本领域常规的菌落PCR步骤即可。
本发明提供了编码阿魏酸酯酶的基因FAEs、所述的重组载体、所述的重组菌株在制备阿魏酸酯酶中的应用。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
一种产阿魏酸酯酶菌株,该菌株为罗伊氏乳杆菌A4-2,保藏编号为CGMCCNo.24966,于2022年5月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),地址,中国北京市朝阳区北辰西路1号院3号。
所述罗伊氏乳杆菌A4-2菌株分离自牧草青贮,筛选步骤主要分为初筛和复筛两个流程,初筛:通过将采集的样品置于含有生理盐水的锥形瓶中,之后通过MRS平皿分离乳酸菌,最终筛选获得了罗伊氏乳杆菌A4-2菌株。
选取罗伊氏乳杆菌A4-2,检测其阿魏酸酯酶活性,具体为:将所选菌株过夜培养后收集菌体,经生理盐水重悬后接种至发酵培养基中,接种量为2%,37℃发酵培养两天,离心后取上清即为粗酶液,而后通过高效液相色谱法进行检测粗酶液降解阿魏酸甲酯释放阿魏酸的含量来间接测试酶活。
具体检测步骤如下:
精密称取0.1000g反式阿魏酸,溶于无水乙醇,定容到100ml,得到浓度为1.00mg/ml的反式阿魏酸标准液,作为母液,再从中分别取5ml、10ml、15ml、20ml、25ml定容到100ml,得到浓度为50、100、150、200、250μg/ml的反式阿魏酸标准液。过0.22μm滤膜,进行液相色谱测量。以阿魏酸的浓度(μg/ml)为横坐标,峰面积为纵坐标,制作标准曲线,得到线性回归方程。
取2.5ml粗酶液,与等量的MFA溶液在30℃水浴反应30min,沸水浴10min终止反应。8000rpm离心10min,取上清,得到酶解液。空白对照为煮沸失活的酶液。酶解液中的阿魏酸含量通过高效液相色谱(HPLC)测定,色谱条件:C18色谱柱(Synergi 4μm Hydro-RP 80;250×4.6mm);流动相:A甲醇—B 1%冰乙酸(28:72);柱温40℃,检测波长320nm,进样量10μl,流速0.6ml/min。
结果如表1所示。
表1阿魏酸酯酶相对酶活
实施例2
1、阿魏酸标准曲线的测定
精密称取0.1000g反式阿魏酸,溶于无水乙醇,定容到100ml,得到浓度为1.00mg/ml的反式阿魏酸标准液,作为母液,再从中分别取5ml、10ml、15ml、20ml、25ml定容到100ml,得到浓度为50、100、150、200、250μg/ml的反式阿魏酸标准液。过0.22μm滤膜,进行液相色谱测量。以阿魏酸的浓度μg/ml为横坐标,峰面积为纵坐标,制作标准曲线,得到线性回归方程。
2、酶活的测定
FAE的活性通过粗酶液降解MFA释放的FA含量来计算。取2.5ml粗酶液,与等量的MFA溶液在30℃水浴反应30分钟,沸水浴10分钟终止反应。8000转/分钟离心10分钟,取上清,得到酶解液。空白对照为煮沸失活的酶液。酶解液中的阿魏酸含量通过高效液相色谱(HPLC)测定,色谱条件:C18色谱柱(Synergi 4μm Hydro-RP 80;250×4.6mm);流动相:A甲醇—B 1%冰乙酸(28:72);柱温40℃,检测波长320nm,进样量10μl,流速0.6ml/min。
酶活定义:在30℃反应条件下,每分钟降解MFA,生成1μmol FA所需的酶量为一个酶活单位(U)。
蛋白含量测定选用考马斯亮蓝法,牛血清蛋白配制标准蛋白溶液。
阿魏酸酯酶比酶活(U/mg)=1个酶活单位(U)/1mg酶蛋白。
3、最适pH及pH稳定性
以MFA为底物研究pH对FAE酶活的影响。最适pH值的测定:将粗酶液与不同pH(3.6~8)缓冲液等量混合,在30℃下放置0.5h,其他条件不变测定FAE酶活,以所测的最高酶活为100%,计算相对酶活。
pH值稳定性的测定:配制的不同pH(3.6~8)缓冲液,与粗酶液等量混合,在4℃冰箱中放置0、0.5、1、2、3、4、6、8、20h,测定剩余酶活,以各pH值的初始酶活为100%,计算相对酶活。缓冲液是pH3.6、pH4.0、pH4.6的乙酸-乙酸钠缓冲液,pH5.0、pH5.6、pH6.0、pH6.4、pH7.0的Na
4、最适温度及温度稳定性
以MFA为底物测定温度对菌FAE酶活的影响。
最适反应温度的测定:取含MFA的酶液2.5ml,与最适pH缓冲液等量混合,在25~65℃(25、30、37、40、45、50、55、65℃)保温0.5h后,测定剩余酶活。以最高酶活定义为100%,并计算其余温度下的相对酶活。温度稳定性的测定:在最适缓冲溶液中,分别将酶液置于25~65℃保温0、0.5、1、2、3、4、6、8、20h,测定剩余酶活,以初始酶活为100%,计算相对酶活。
结果如图1~图3所示,本发明所述罗伊氏乳杆菌A4-2的阿魏酸酯酶FAE1具有高比活性、高的酶解效率、高稳定性等优势,在医药保健、食品、饲料以及生物能源等领域具有重要应用前景。
实施例3
产阿魏酸酯酶菌株罗伊氏乳杆菌A4-2中提取阿魏酸酯酶基因FAEs的方法,步骤如下:
1)目的基因筛选:对产阿魏酸酯酶的罗伊氏乳杆菌A4-2全基因组的进行分析研究,通过BLAST比对蛋白的保守结构域,筛选酯酶基因序列;
2)目的基因验证:根据1)中筛选酯酶基因序列分别设计引物,通过测序结果验证所扩增的片段。
基因表达载体构建通过分子克隆技术,构建阿魏酸酯酶基因的表达载体,步骤如下:
1)采用基因组DNA提取试剂盒的提取基因组DNA;
2)对提取好的基因组DNA做PCR扩增(50μl体系),
PCR体系:
PCR程序:
94℃预变性5min,(94℃变性1min,58℃退火1min;72℃延伸1.5min)×30cycles,最后72℃延伸10min。
所述PCR产物鉴定:
1)PCR产物采用琼脂糖凝胶电泳进行鉴定,结果如图1所示,泳道M是Takara2000bp DNAmarker,泳道1、2、3均是目的基因;
2)本步骤所得PCR产物使用sanger法测序(测序引物为本发明提供的“上游引物”和“下游引物”,由北京睿博兴科生物技术有限公司完成),得到本发明所述阿魏酸酯酶基因的核酸序列,如SEQ ID NO.1所示;
3)根据三联密码子,将该核酸序列翻译成蛋白序列,该蛋白序列进行NCBI Blast比对搜索,得到的具有最高同源性的序列是Genbank WP_047822973.1记录下的蛋白序列,具有82.71%的氨基酸同源性。
4)胶回收:
使用Omega公司胶回收试剂盒,货号D2500-01,对步骤1的PCR产物中的目的条带,进行割胶回收。将胶回收后的该基因的PCR产物的浓度调整为50ng/μl,作为后续与T载体连接反应的底物。
5)连接体系:
6)连接产物转化:
a.吸取连接产物(体积10μL)于100μL感受态细胞中,轻轻混合均匀,在冰上放置30min;
b.将离心管放到42℃水浴中,热激90s(严格控制热击时间),取出后迅速放于冰上,冷却2min;
c.向离心管中加入5倍体积的SOB(或LB)液体培养基,37℃震荡培养60min;
d.8000rpm离心30s,去部分上清,留100μL培养液,移液枪吹打混匀后,用三角涂布棒涂布于含抗生素抗性LB平板上,倒置培养皿于37℃培养14h菌落培养;
e.挑取单菌落接种至抗性LB液体培养基中,37℃震荡过夜培养,菌落PCR验证。
菌落PCR验证结果如图5所示,其中孔1~12均为同一平皿上所挑取的单克隆,其中8号泳道为假阳性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
