含氮三环化合物的盐及其用途
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于药物技术领域,涉及含氮三环化合物的盐及其用途,具体涉及2-((5-环丙基-3-(2,6-二氯苯基)异恶唑-4-基)甲氧基)-10H-螺[苯并[6,7]氧杂卓[3,2-b]吡啶-11,1'-环丙烷]-7-甲酸的盐及其药物组合物,进一步涉及所述盐或所述药物组合物在制备药物中的用途,如所述的盐或所述药物组合物在制备用于预防、治疗或减轻患者由FXR介导的疾病的药物中的用途。
背景技术
专利申请WO 2018024224A1和CN 107686486A公开了可以用作FXR活性调节剂的含氮三环化合物及其制备方法和应用,其中,具体公开了化合物7,即,化合物2-((5-环丙基-3-(2,6-二氯苯基)异恶唑-4-基)甲氧基)-10H-螺[苯并[6,7]氧杂卓[3,2-b]吡啶-11,1'-环丙烷]-7-甲酸(式(I)所示化合物)。
专利申请CN112876493A公开了式(I)所示化合物的盐,但仅具体公开了其钾盐、乙醇胺盐、二甲基乙醇胺盐、三乙醇胺盐和氨基丁三醇盐,并未公开其他盐,更未公开其他盐的微观结构及其制备方法。
本领域公知,药物游离碱或游离酸通常具有溶解度差进而生物利用度低的问题,通常可通过将其转化为盐来解决这一问题,然而,药物游离碱或游离酸的不同盐和固体形态可能具有不同的性质。不同盐或固体形态所导致的性质改变也可以改进最终的剂型,例如,如果这种改变可以提高生物利用度。因此,在药物研发中,寻找一种合适的盐被药物利用的研究有着非常重要的作用。
发明内容
本发明提供了式(I)所示化合物的新的碱加成盐及其药物组合物,所述碱加成盐或药物组合物具有较好的药理性质(例如,良好的药代动力学性质),并且其稳定性等性质也得到了明显改善,从而具有更优良的成药性。
具体而言,本发明涉及式(I)所示化合物的碱加成盐及其药物组合物,以及所述碱加成盐或所述药物组合物在制备用于预防、治疗或减轻患者由FXR介导的疾病的药物中的用途。本发明所述的碱加成盐还可以为溶剂化物形式,例如水合物形式。
一方面,本发明提供了式(I)所示化合物的药学上可接受的碱加成盐,
在一些实施方案中,本发明所示的碱加成盐为无机碱盐或有机碱盐。
在另一些实施方案中,本发明所述的无机碱盐为锂盐、钠盐、钙盐或它们的任意组合。
在另一些实施方案中,本发明所述的有机碱盐为L-赖氨酸盐、L-精氨酸盐、二乙胺基乙醇盐、二乙胺盐、二乙醇胺盐、乙二胺盐或它们的任意组合。
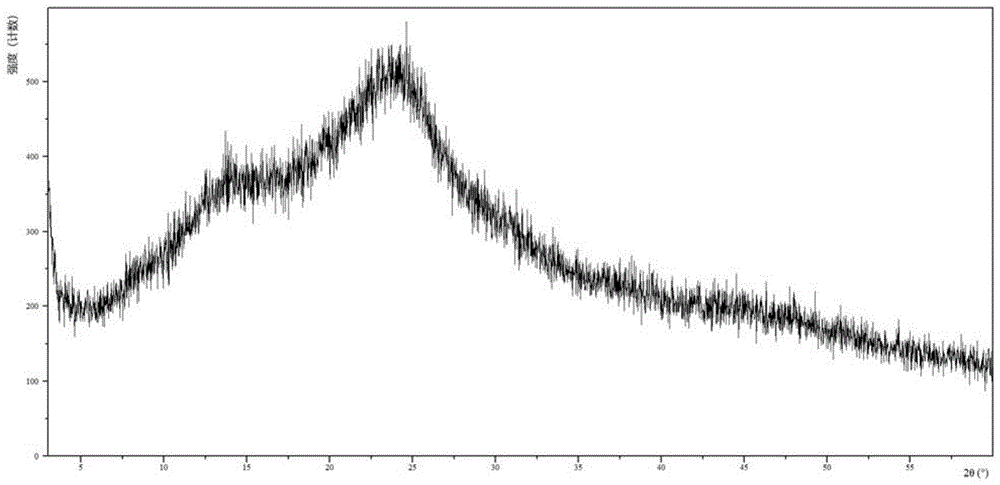
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的钠盐,其中,所述钠盐为式(I)所示化合物的钠盐无定形,其特征在于,所述钠盐无定形具有基本上如图1所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的锂盐,其中,所述锂盐为式(I)所示化合物的锂盐无定形,其特征在于,所述锂盐无定形具有基本上如图2所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的钙盐,其中,所述钙盐为式(I)所示化合物的钙盐无定形,其特征在于,所述钙盐无定形具有基本上如图3所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的二乙胺盐,其中,所述二乙胺盐为式(I)所示的化合物的二乙胺盐无定形,其特征在于,所述二乙胺盐无定形具有基本上如图4所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的二乙胺基乙醇盐,其中,所述二乙胺基乙醇盐为式(I)所示的化合物的二乙胺基乙醇盐无定形,其特征在于,所述二乙胺基乙醇盐无定形具有基本上如图5所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的二乙醇胺盐,其中,所述二乙醇胺盐为式(I)所示的化合物的二乙醇胺盐无定形,其特征在于,所述二乙醇胺盐无定形具有基本上如图6所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的乙二胺盐,其中,所述乙二胺盐为式(I)所示的化合物的乙二胺盐无定形,其特征在于,所述乙二胺盐无定形具有基本上如图7所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的L-精氨酸盐,其中,所述L-精氨酸盐为式(I)所示的化合物的L-精氨酸盐无定形,其特征在于,所述L-精氨酸盐无定形具有基本上如图8所示的X射线粉末衍射图。
在一些实施方案中,本发明所述的碱加成盐为式(I)所示化合物的L-赖氨酸盐,其中,所述L-赖氨酸盐为式(I)所示的化合物的L-赖氨酸盐无定形,其特征在于,所述L-赖氨酸盐无定形具有基本上如图9所示的X射线粉末衍射图。
一方面,本发明还提供一种药物组合物,其包含本发明所述的任一碱加成盐或其组合,和药学上可接受的载体、赋形剂、稀释剂、辅剂或它们的组合。
另一方面,本发明还涉及所述式(I)化合物的碱加成盐或所述药物组合物在制备药物中的用途,其中,所述药物用于预防、治疗或减轻患者由FXR介导的疾病;进一步地,所述用途包括给予人或动物本发明所述的碱加成盐或所述的药物组合物的有效治疗剂量。
在一些实施方案中,本发明所述的由FXR介导的疾病为心脑血管疾病、与血脂异常相关的疾病、代谢综合征、过度增殖性疾病、纤维化、炎性疾病或与肝胆相关的疾病。
在另一些实施方案中,本发明所述的心脑血管疾病为动脉粥样硬化、急性心肌梗死、静脉闭塞性疾病、门静脉高血压、肺动脉高血压、心力衰竭、周围组织动脉阻塞性疾病、性功能障碍、中风或血栓形成。
在另一些实施方案中,本发明所述的代谢综合征为胰岛素抗性、高血糖、高胰岛素血症、血液中脂肪酸或甘油三酯水平的升高、高脂血症、肥胖症、高甘油三酯血症、高胆固醇血症、X综合症、糖尿病并发症、动脉粥样硬化、高血压、急性贫血、中性粒细胞减少、血脂异常、II型糖尿病、糖尿病性肾病、糖尿病性神经病变、糖尿病视网膜病变、血脂障碍或糖尿病和体重指数异常高的合并病症。
在另一些实施方案中,本发明所述的过度增殖性疾病为肝细胞癌、结肠腺瘤、息肉病、结肠腺癌、乳腺癌、膜腺癌、巴特氏食管癌和其它形式的胃肠道或肝脏肿瘤性疾病。
在另一些实施方案中,本发明所述的纤维化、炎性疾病或与肝胆相关的疾病为非酒精性脂肪肝、非酒精性脂肪性肝炎、胆汁淤积、肝纤维化、原发性胆汁性肝硬化、原发性硬化性胆管炎、进行性家族性胆汁淤积、囊性纤维化、药物引起的胆管损伤、胆结石、肝硬化、乙型肝炎、皮脂腺病、酒精导致的肝硬化、胆道阻塞、胆石病、结肠炎、新生儿黄症、核黄症或肠道细菌过度生长。
一方面,本发明涉及预防、治疗或减轻患者由FXR介导的疾病的方法,包括使用本发明所述的碱加成盐或所述的药物组合物药学上可接受的有效剂量对患者进行给药。
另一方面,本发明涉及使用所述式(I)化合物的碱加成盐或所述药物组合物来预防、治疗或减轻患者由FXR介导的疾病。
另一方面,本发明还涉及式(I)所示化合物的碱加成盐的制备方法。
本发明所述的碱加成盐的制备方法中所使用的溶剂没有特别限制,任何在程度上能溶解起始原料并且不影响其性质的溶剂均包含在本发明中。另外,本领域的许多类似改动,等同替换,或等同于本发明所描述的溶剂,溶剂组合,及溶剂组合的不同比例,均视为本发明的包含范围。本发明给出了各反应步骤所使用的较佳的溶剂。
本发明所述的碱加成盐的制备实验将在实施例部分进行详细描述。本发明所述的式(I)所示化合物的碱加成盐具有较好的生物活性,且稳定性高,适合制药用途。具体地,本发明所述的碱加成盐具有更优异的药代性质,例如,具有更高的暴露量。且本发明所述的碱加成盐不易受高湿度影响而潮解,方便药物的长期贮存放置。
其中,关于引湿性特征描述与引湿性增重的界定(中国药典2015年版附录9103药物引湿性试验指导原则,实验条件:25℃±1℃,80%±2%相对湿度)如下表所述:
引湿性特征描述与引湿性增重的界定
相对于现有技术,本发明所述无定形具有更优的技术效果,如具有更优药代动力学性质(例如更高的暴露量和/或更高的Cmax值)、和/或更高的稳定性。例如,相对现有技术CN112876490A公开的所有晶型,本发明所述无定形各方面的效果更佳;发明人经研究发现,CN112876490A公开的晶型中,晶型E是最稳定的晶型,但其在高温60℃条件下放置5天后晶体结构即发生变化,而本发明所述的无定形在高温条件下非常稳定。
定义和一般术语
除非另有说明,本发明使用的所有技术和科学术语与本发明所属领域的普通技术人员所通常理解的具有相同含义。本发明涉及的所有专利和公开出版物通过引用方式整体并入本发明。尽管在本发明的实践或者测试中可以使用与本发明所述相似或者相同的任何方法和物质,但是本发明中描述的是优选的方法、设备和物质。
“无定形”或“无定形形式”是指物质的质点(分子、原子、离子)在三维空间排列无周期性时形成的物质,其特征是具有漫射的不具尖峰的X射线粉末衍射图。无定形是固体物质的一种特殊的物理形式,其局部有序的结构特征,提示其与晶型物质有着千丝万缕的联系。物质的无定形形式可通过本领域已知的许多方法得到。这种方法包括,但不限于,骤冷法、反溶剂絮凝法、球磨法、喷雾干燥法、冷冻干燥法、湿法制粒法和固体分散体技术等等。
“溶剂”是指一种物质(典型地是一种液体),该物质能够完全地或部分地溶解另一种物质(典型地是一种固体)。用于本发明实施的溶剂包括但并不限于,水、乙酸、丙酮、乙腈、苯、氯仿、四氯化碳、二氯甲烷、二甲基亚砜、1,4-二氧六环、乙醇、乙酸乙酯、丁醇、叔丁醇、N,N-二甲基乙酰胺、N,N-二甲基甲酰胺、甲酰胺、蚁酸、庚烷、己烷、异丙醇、甲醇、甲基乙基酮、均三甲苯、硝基甲烷、聚乙二醇、丙醇、吡啶、四氢呋喃、甲苯、二甲苯、它们的混合物等等。
“溶剂化物”是指在表面上、在晶格中或者在表面上和在晶格中具有溶剂的化合物,所述溶剂可以是水、乙酸、丙酮、乙腈、苯、氯仿、四氯化碳、二氯甲烷、二甲基亚砜、1,4-二氧六环、乙醇、乙酸乙酯、丁醇、叔丁醇、N,N-二甲基乙酰胺、N,N-二甲基甲酰胺、甲酰胺、蚁酸、庚烷、己烷、异丙醇、甲醇、甲基乙基酮、甲基吡咯烷酮、均三甲苯、硝基甲烷、聚乙二醇、丙醇、吡啶、四氢呋喃、甲苯、二甲苯以及它们的混合物等等。溶剂化物的一个具体例子是水合物,其中在表面上、在晶格中或者在表面上和在晶格中的溶剂是水。在物质的表面上、在晶格中或者在表面上和在晶格中,水合物可以具有或者不具有除了水以外的其它溶剂。
无定形可以通过多种技术手段进行鉴别,例如X射线粉末衍射(XRPD)、红外吸收光谱法(IR)、熔点法、差示扫描量热法(DSC)、热重分析法(TGA)、核磁共振法、拉曼光谱、X射线单晶衍射、溶解量热法、扫描电子显微镜(SEM)、定量分析、溶解度和溶解速度等等。
本发明涉及所述的2-((5-环丙基-3-(2,6-二氯苯基)异恶唑-4-基)甲氧基)-10H-螺[苯并[6,7]氧杂卓[3,2-b]吡啶-11,1'-环丙烷]-7-甲酸(式(I)所示化合物)的各种碱加成盐,它们以基本上纯净的形态存在。
在本发明的上下文中,当使用或者无论是否使用“大约”或“约”等字眼时,表示在给定的值或范围的10%以内,适当地在5%以内,特别是在1%以内。或者,对于本领域普通技术人员而言,术语“大约”或“约”表示在平均值的可接受的标准误差范围内。每当公开一个具有N值的数字时,任何具有N+/-1%,N+/-2%,N+/-3%,N+/-5%,N+/-7%,N+/-8%或N+/-10%值以内的数字会被明确地公开,其中“+/-”是指加或减。
本发明中“室温”指的是温度由大约10℃到大约40℃。在一些实施例中,“室温”指的是温度由大约20℃到大约30℃;在另外一些实施例中,“室温”指的是20℃,22.5℃,25℃,27.5℃等等。
本发明所述碱加成盐的药物组合物,制剂,给药和用途
本发明的药物组合物的特点包括式(I)所示化合物的任一碱加成盐或其任意组合和药学上可接受的载体,辅剂,或赋形剂。本发明的药物组合物中化合物的碱加成盐的量能有效地可探测地治疗或减轻患者由FXR介导的疾病。
像本发明所描述的,本发明药学上可接受的组合物进一步包含药学上可接受的载体,辅剂,或赋形剂,这些像本发明所应用的,包括任何溶剂,稀释剂,或其他液体赋形剂,分散剂或悬浮剂,表面活性剂,等渗剂,增稠剂,乳化剂,防腐剂,固体粘合剂或润滑剂,等等,适合于特有的目标剂型。如以下文献所描述的:In Remington:The Science and Practiceof Pharmacy,21st edition,2005,ed.D.B.Troy,Lippincott Williams&Wilkins,Philadelphia,and Encyclopedia of Pharmaceutical Technology,eds.J.Swarbrickand J.C.Boylan,1988-1999,Marcel Dekker,New York,综合此处文献的内容,表明不同的载体可应用于药学上可接受的组合物的制剂和它们公知的制备方法。除了任何常规的载体媒介与本发明的化合物或其碱加成盐不相容的范围,例如所产生的任何不良的生物效应或与药学上可接受的组合物的任何其他组分以有害的方式产生的相互作用,它们的用途也是本发明所考虑的范围。
本发明所述的碱加成盐可以作为活性成分与根据常规药物复合技术的药物载体一起均匀结合在混合物中。根据给药所要求的制剂形式,例如口服或者胃肠外的(包括静脉内的),载体可以为各式各样的形式。当制备用于口服剂型的组合物时,可以使用任何常规的药物介质,例如,在制备口服液体药剂例如悬浮液、酏剂和溶液时使用水、乙二醇、油、醇、芳香剂、防腐剂、着色剂等等;或者在制备口服固体制剂例如粉末、硬胶囊、软胶囊和片剂时使用例如淀粉、糖、微晶纤维素、稀释剂、成粒剂、滑润剂、粘合剂、崩解剂等等,其中固体口服制剂是比液体药剂更优选的。
因为片剂和胶囊剂容易服用,所以它们代表了最有利的口服剂量单位形式,在这种情况下明显使用固体药物载体。如果需要的话,可以用标准水溶液或者非水溶液技术将片剂包衣。
所述片剂、药丸、胶囊剂等也可以包含:粘合剂(比如黄蓍树胶、阿拉伯胶、玉米淀粉或者明胶);赋形剂(比如磷酸二钙);崩解剂(比如玉米淀粉、马铃薯淀粉、藻酸);滑润剂(比如硬脂酸镁);和甜味剂(比如蔗糖、乳糖或者糖精)。当剂量单位形式是胶囊时,除了上述类型的材料以外,它可以包含液体载体(比如脂肪油)。
可以存在各种各样的其它材料作为包衣或者来改变所述剂量单位的外形。例如,片剂可以用虫胶、糖或者两者进行包衣。除了所述活性成分以外,糖浆剂或者酏剂可以包含作为甜味剂的蔗糖、作为防腐剂的对羟基苯甲酸甲酯或丙酯、染料和调味剂(例如樱桃味或者橙味的)。
本发明所述的碱加成盐也可以经胃肠外给药。可以在水中与表面活性剂(比如羟丙基纤维素)适当地混合来制备这些活性物质的溶液或者悬浮液。在甘油、液体聚乙二醇及其混合物中,和在油中,也可以制备分散剂。在贮存和使用的常规条件下,这些制剂含有防腐剂以防止微生物的生长。
适于注射用途的药品形式包括无菌水溶液或者分散剂和用于即时制备无菌可注射溶液或者分散剂的无菌粉末。在所有的情况下,所述药品形式都必须是无菌的并且必须是以容易注射的形式存在的流体。它在制造和贮存的条件下必须是稳定的并且必须在抗微生物比如细菌和真菌的污染作用的条件下保存。载体可以是溶剂或者分散介质,其含有,例如:水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)、它们适合的混合物和植物油。
可以使用任何适合的给药方法来向哺乳动物,尤其是人提供有效剂量的本发明所述的碱加成盐。例如,可以使用经口、经直肠、经局部、经胃肠外、经眼、经肺、经鼻等给药方法。剂型包括片剂、锭剂、分散剂、悬浮剂、溶液剂、胶囊剂、乳剂、软膏剂、气溶胶等。优选本发明的碱加成盐经口服给药。
本发明的碱加成盐、药物组合物或其组合的治疗有效剂量取决于个体的种属、体重、年龄和个体情况、待治疗的障碍或疾病或其严重程度。普通技术的医师、临床医师或兽医能容易地确定每种活性成分预防、治疗所述障碍或疾病或抑制所述障碍或疾病进展所需的有效量。
本发明涉及的碱加成盐或其药物组合物能有效用于预防、处理、治疗或减轻患者由FXR介导的疾病,特别是能有效治疗非酒精性脂肪肝(NAFLD)、非酒精性脂肪性肝炎(NASH)、肥胖症、高甘油三酯血症、动脉粥样硬化、慢性肝内胆汁淤积症、原发性胆汁性肝硬化(PBC)、原发性硬化性胆管炎(PSC)、进行性家族性胆汁淤积(PFIC)、药物引起的胆管损伤、胆结石、肝硬化、乙型肝炎、皮脂腺病、酒精导致的肝硬化、囊性纤维化、胆道阻塞、胆石病、肝纤维化、血脂异常、动脉粥样硬化症、II型糖尿病、糖尿病性肾病、糖尿病性神经病变、糖尿病视网膜病变、周围组织动脉阻塞性疾病(PAOD)、结肠炎、新生儿黄症、核黄症、静脉闭塞性疾病、门静脉高血压、代谢综合征、急性心肌梗塞、急性中风、血栓形成、高胆固醇血症、肠道细菌过度生长、勃起功能障碍、胃肠道肿瘤性疾病和肝脏肿瘤性疾病等。
附图说明
图1为本发明所述的式(I)所示化合物的钠盐无定形的X射线粉末衍射(XRPD)图。
图2为本发明所述的式(I)所示化合物的锂盐无定形的X射线粉末衍射(XRPD)图。
图3为本发明所述的式(I)所示化合物的钙盐无定形的X射线粉末衍射(XRPD)图。
图4为本发明所述的式(I)所示化合物的二乙胺盐无定形的X射线粉末衍射(XRPD)图。
图5为本发明所述的式(I)所示化合物的二乙胺基乙醇盐无定形的X射线粉末衍射(XRPD)图。
图6为本发明所述的式(I)所示化合物的二乙醇胺盐无定形的X射线粉末衍射(XRPD)图。
图7为本发明所述的式(I)所示化合物的乙二胺盐无定形的X射线粉末衍射(XRPD)图。
图8为本发明所述的式(I)所示化合物的L-精氨酸盐无定形的X射线粉末衍射(XRPD)图。
图9为本发明所述的式(I)所示化合物的L-赖氨酸盐无定形的X射线粉末衍射(XRPD)图。
具体实施方式
下面通过实施例的方式进一步说明本发明,并不因此将本发明限制在所述的实施例范围之中。
本发明所用X射线粉末衍射分析方法为:Empyrean衍射仪,使用Cu-Kα辐射(45KV,40mA)获得X射线粉末衍射图。在单晶硅样品架上将粉末状样品制备成薄层,放在旋转样品台上,在3°-60°的范围内以0.0167°步长进行分析。使用Data Collector软件收集数据,High Score Plus软件处理数据,Data Viewer软件读取数据。
具体实施方法
式(I)所示化合物(2-((5-环丙基-3-(2,6-二氯苯基)异恶唑-4-基)甲氧基)-10H-螺[苯并[6,7]氧杂卓[3,2-b]吡啶-11,1'-环丙烷]-7-甲酸)的具体合成方法参照专利申请CN 107686486A中的实施例9。
实施例
实施例1式(I)化合物的钠盐无定形
1.钠盐无定形的制备
将式(I)所示化合物(3.01g)溶于丙酮(60.0mL)中,室温搅拌,滴加氢氧化钠(233.0mg)的水(4.0mL)溶液,滴毕,继续室温搅拌,体系略变浑浊,加入甲醇(5.2mL),体系澄清后搅拌2小时,减压蒸除溶剂,残留物60℃真空干燥过夜,得到白色固体(2.92g,93.3%)。
2.钠盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述钠盐无定形的X射线粉末衍射(XRPD)图基本上如图1所示。
实施例2式(I)化合物的锂盐无定形
1.锂盐无定形的制备
将式(I)所示化合物溶于丙酮(15.0mL)中,室温搅拌,滴加一水合氢氧化锂(53.3mg)的水(1.0mL)溶液,滴毕,室温搅拌1小时,减压蒸除溶剂,残留物60℃真空干燥过夜,得到白色固体(631.8mg,92.2%)。
2.锂盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述锂盐无定形的X射线粉末衍射(XRPD)图基本上如图2所示。
实施例3式(I)化合物的钙盐无定形
1.钙盐无定形的制备
将式(I)所示化合物(282.8mg)悬浮于水(4.6mL)中,滴加氢氧化钠(22.4mg)的水(0.5mL)溶液,加毕,加热至80℃,体系澄清,然后加入氯化钙(31.1mg)的水(0.5mL)溶液,保温0.5小时,停止加热,自然冷却至室温,搅拌过夜,抽滤,滤饼用水(2.0mL×2)洗涤,60℃真空干燥4小时,得到白色固体(223.5mg,76.4%)。
2.钙盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述钙盐无定形的X射线粉末衍射(XRPD)图基本上如图3所示。
实施例4式(I)化合物的二乙胺盐无定形
1.二乙胺盐无定形的制备
将式(I)所示化合物(663.6mg)溶于丙酮(13.0mL)中,室温搅拌,滴加二乙胺(87.5mg)的丙酮(2.0mL)溶液,室温搅拌过夜,减压蒸除溶剂,残留物室温真空干燥过夜,得到类白色固体(731.5mg,97.3%)。
2.二乙胺盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述二乙胺盐无定形的X射线粉末衍射(XRPD)图基本上如图4所示。
实施例5式(I)化合物的二乙胺基乙醇盐无定形
1.二乙胺基乙醇盐无定形的制备
将式(I)所示化合物(632.2mg)、二乙胺基乙醇(133.0mg)的丙酮(15.0mL)溶液加入到50mL单口瓶中,室温搅拌过夜,减压蒸除溶剂,残留物60℃真空干燥过夜,得到白色固体(720.5mg,93.9%)。
2.二乙胺基乙醇盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述二乙胺基乙醇盐无定形的X射线粉末衍射(XRPD)图基本上如图5所示。
实施例6式(I)化合物的二乙醇胺盐无定形
1.二乙醇胺盐无定形的制备
将式(I)所示化合物(637.0mg)、二乙醇胺(119.6mg)和乙酸乙酯(15.0mL)加入到50mL单口瓶中,加热至60℃,固体缓慢溶解,停止加热,自然冷却至室温,搅拌过夜,减压蒸除溶剂,室温真空干燥过夜,得到白色固体(668.7mg,88.1%)。
2.二乙醇胺盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述二乙醇胺盐无定形的X射线粉末衍射(XRPD)图基本上如图6所示。
实施例7式(I)化合物的乙二胺盐无定形
1.乙二胺盐无定形的制备
将式(I)所示化合物(605.4mg)加入到丙酮(10.0mL)中,室温搅拌溶解,然后滴加乙二胺(66.3mg)的丙酮(2.0mL)溶液,室温搅拌过夜,减压蒸除溶剂,残留物室温真空干燥过夜,得到淡黄色固体(622.8mg,92.7%)。
2.乙二胺盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述乙二胺盐无定形的X射线粉末衍射(XRPD)图基本上如图7所示。
实施例8式(I)化合物的L-精氨酸盐无定形
1.L-精氨酸盐无定形的制备
将式(I)所示化合物(597.1mg)加入到丙酮(12.0mL)中,室温搅拌溶解,然后滴加L-精氨酸(189.5mg)的水(2.0mL)溶液,滴毕,室温搅拌,加入丙酮(10.0mL),搅拌1小时,减压蒸除溶剂,得到白色固体(742.1mg,94.4%)。
2.L-精氨酸盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述L-精氨酸盐无定形的X射线粉末衍射(XRPD)图基本上如图8所示。
实施例9式(I)化合物的L-赖氨酸盐无定形
1.L-赖氨酸盐无定形的制备
将式(I)所示化合物(582.3mg)、L-赖氨酸(155.2mg)和甲醇(12.1mL)加入到50mL单口瓶中,加热至60℃,固体溶解,停止加热,将体系冷却至室温,搅拌过夜,减压蒸除溶剂,残留物室温真空干燥过夜,得到白色固体(712.1mg,96.6%)。
2.L-赖氨酸盐无定形的鉴定
通过Empyrean X射线粉末衍射(XRPD)分析鉴定:使用Cu-Kα辐射,所述L-赖氨酸盐无定形的X射线粉末衍射(XRPD)图基本上如图9所示。
实施例10本发明所述碱加成盐的药代动力学实验
将本发明所述的式(I)所示化合物的碱加成盐灌装胶囊,用于口服给药。
口服给予8-12kg雄性Beagle犬5mg/kg供试样品,每组3只动物。给药后按时间点0.25,0.5,1.0,2.0,4.0,6.0,8.0和24h采血。根据样品浓度建立合适范围的标准曲线,使用AB SCIEX API4000型LC-MS/MS,在MRM模式下测定血浆样品中供试样品的浓度,并进行定量分析。根据药物浓度-时间曲线,采用WinNonLin 6.3软件非房室模型计算药动学参数。实验结果如表1所示。
表1本发明所示碱加成盐的PK实验数据
实验证明,本发明所述的碱加成盐在Beagle体内的暴露量较大,具有良好的药代动力学性质。
实施例11本发明所述碱加成盐的稳定性实验
(1)
(2)
(3)
实验证明,在高温、高湿和/或光照条件下,本发明所述碱加成盐的外观、纯度和/或无定形形式均无明显变化,稳定性效果好,适合制药用途。
实施例12本发明所述碱加成盐的引湿性实验
取供试品适量,采用动态水分吸附仪测试其引湿性。实验证明,本发明所述的碱加成盐不易受高湿度影响而潮解。
以上所述内容仅为本发明构思下的基本说明,而依据本发明的技术方案所作的任何等效变换,均应属于本发明的保护范围。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
