转基因大豆MON87712品系实时荧光定量检测引物、检测方法和试剂盒
文献发布时间:2023-06-19 19:30:30
技术领域:
本发明属于转基因产品检测领域,具体涉及一种转基因大豆MON87712品系特异性定量检测引物探针、检测方法和试剂盒。
背景技术:
MON87712孟山由孟山都公司研发转基因大豆品系,通过农杆菌介导含有bbx32基因的质粒载体PV-GMAP5779插入到常规大豆A3525研发而成。bbx32基因可表达相应的蛋白,它可与内源性转录因子作用,从而促进植株的生长和生殖发育。2013在美国获得批准上市。
目前对转基因产品多数国家均采用相应的标识管理制度,品系特异性PCR(转化事件特异性)(Event-specific PCR)检测的目标序列是外源插入序列与植物基因组间连接区,相较于筛选PCR(Screening PCR)、基因特异性PCR(Gene-specific PCR)、构建特异性PCR(Construct-specific PCR)具有更加高的具有高特异性,能用于检测鉴定相同质粒转化的转基因具体品系,是目前转基因品系鉴定检测技术研究和实际检测工作中的重要方法。
目前大豆转基因转基因检测中,特别是定量检测中,不管是基于标准曲线的定量检测方法,还是基于拷贝数百分比的数字PCR定量检测方法,在进行转基因品系检测时,需要同时测定转基因大豆品系的外源基因和内源基因,目前采用的PCR检测时,大豆内源基因lectin的退火温度为60℃,现有MON87712品系特异性测试方法的退火温度设置在54℃及以下,相差较大,采用60℃温度时,大豆内源基因lectin能正常扩增,但MON87712品系特异性方法不能正常扩增,而采用54℃及以下的退火温度进行PCR反应时内源基因lectin难以获得准确的Ct值或数字PCR测试的基因拷贝数的结果,无法进行定量检测或造成结果不准确;如果分别进行单独的两次PCR测定(一次为60℃退火,一次为54℃退火),加大了检测工作量,增长了检测周期,也增加了检测人力和试剂成本。
发明内容:
本发明的目的是提供一种特异性好、灵敏度高、稳定性强,快速准确鉴别转基因大豆MON87712品系特异性检测引物。
本发明通过分析比对MON87712特异性片段,设计引物和探针,可以使MON88712品系扩增在60℃完成退火,在同一反应中可以完成内源基因lectiin和MON87712品系特异性检测,可实现MON87712的定量检测并且更加方便和高效,可应用于实时荧光PCR和数字PCR定量检测MON87712品系。
本方法的建立可完善和我国转基因产品定量检测技术体系,保护消费者对转基因产品的知情权和选择权,为进出境口岸监管部门提供转基因品系标识检测鉴定的方法,适用于转基因大豆MON87712品系特异性定量PCR精准检测。
本发明的转基因大豆MON87712品系特异性实时荧光PCR检测引物,其特征在于,所述的检测引物如下所示:
MON87712-F:5’-GGCCGCAGGAGAAGTTATCA-3’(如SEQ ID NO.1所示);
MON87712-R:5’-TTTCTTTTTCTCCATATTGACCATCA-3’(如SEQ ID NO.2所示)。
本发明还提供了一种转基因大豆MON87712品系特异性实时荧光PCR检测探针,其特征在于,所述的检测探针为MON87712-P:5’-FAM-ATGAGTTTCGCGCCCC–MGB-3’(如SEQ IDNO.3所示),5’端标记有荧光报告基团,3'端标记有荧光淬灭基团。
本发明的转基因大豆MON87712品系特异性实时荧光PCR检测试剂盒,包括实时荧光定量PCR反应液、耐热DNA聚合酶、检测引物和检测探针,其特征在于,所述的检测引物如下所示:
MON87712-F:5’-GGCCGCAGGAGAAGTTATCA-3’;
MON87712-R:5’-TTTCTTTTTCTCCATATTGACCATCA-3’;
所述的检测探针为MON87712-P:5’-FAM-ATGAGTTTCGCGCCCC–MGB-3’(如SEQ IDNO.3所示),5’端标记有荧光报告基团,3'端标记有荧光淬灭基团。
本发明的转基因大豆MON87712品系特异性实时荧光PCR检测方法,其特征在于,包括以下步骤:
(1)提取样品DNA的作为模板;
(2)加入上述的检测引物和检测探针,与实时荧光定量PCR反应液及耐热DNA聚合酶混合形成扩增反应体系;
(3)将扩增反应体系在荧光PCP仪上进行实时荧光PCR反应,反应结束后,根据扩增曲线判断样品中是否含有转基因大豆MON87712品系。
优选,所述的步骤(2)的扩增反应扩增反应25μL体系为:Premix Ex TaqTM 12.5μL,ROX Reference Dye II 0.2μL,10μmol/L MON87712-F和MON87712-R各0.4μL,10μmol/L探针MON87712-P 0.8μL,DNA模板2μL和ddH2O 8.7μL;反应程序为95℃30s;95℃5s、60℃34s,40个循环,于60℃收集荧光信号。
所述的步骤(3)的根据扩增曲线判断样品中是否为转基因大豆MON87712品系的标准为:40个循环内,如果扩增曲线有典型荧光扩增曲线,则说明样品为转基因大豆MON87712品系;40个循环内,如果扩增曲线无典型荧光扩增曲线,则说明样品不为转基因大豆MON87712品系。
本发明还提供转基因大豆MON87712品系特异性实时荧光PCR定量检测方法,其特征在于,包括以下步骤:
(1)提取转基因大豆MON87712品系的基因组DNA进行梯度稀释以用作不同起始浓度的模板,分别加入上述的检测引物、检测探针,与实时荧光定量PCR反应液及耐热DNA聚合酶混合形成扩增反应体系,在荧光PCP仪上进行实时荧光PCR反应;
(2)反应后得到各起始浓度模板对应的Ct值,该Ct值与起始浓度的对数(lg)呈线性关系,据此得到转基因大豆MON87712品系的标准曲线;
(3)提取待测样品的DNA,加入与步骤(1)中相同体系的上述的检测引物、检测探针,与实时荧光定量PCR反应液及耐热DNA聚合酶混合形成扩增反应体系,在荧光PCP仪上进行实时荧光PCR反应,反应后得到Ct值,将其代入转基因大豆MON87712品系的标准曲线,计算得到待检样品中转基因大豆MON87712品系的量。
本发明具有以下优点及有益效果:
1.本发明打破国外其他国家和地区设置的转基因产品贸易技术壁垒。
2.本发明弥补和完善了我国转基因产品定量检测技术体系。提供的技术用于转基因产品的检测可更加好的保护消费者的知情权和选择权,满足国家监管部门对转基因产品的鉴定和标识需求。
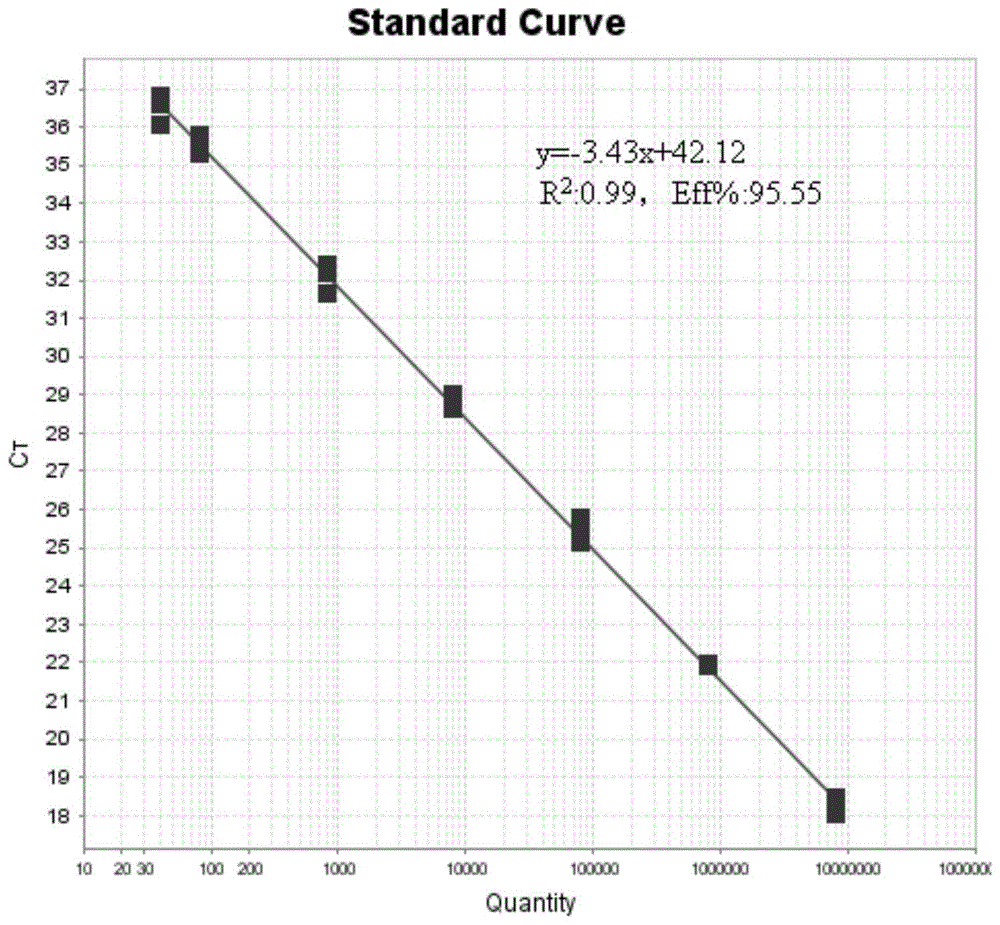
3.本发明针对转基因大豆MON87712品系特异性序列设计引物和TaqMan探针,建立转基因大豆MON87712实时荧光聚合酶链式反应(polymerase chain reaction,PCR)检测方法。利用该检测引物和检测探针及建立的实时荧光PCR体系,本发明的方法定量下限为40拷贝,建立的Ct值与起始浓度的标准曲线方程为:y=-3.43x+42.12,R2:0.99,扩增效率:95.55%(介于90%~110%),表明本发明的MON87712检测方法在模板量40-8000000copies重复性实验显示本发明的方法的标准偏差(SD)及相对标准偏差(RSD)都在可接受范围内(<25%),特异性良好、灵敏度高、稳定性强。
4.本发明的经分析比对选择的特异性序列,使检测体系的退火温度为60度,可以实现MON87712外源基因和内源lectin基因一起扩增,解决现有技术中MON87712退火温度过低(58度以下),不能在同一反应程序中实现内源基因lectin的扩增,需进行两次扩增反应,使检测成本增加,检测周期较长的问题。不但可以使之后续方便应用于双重实时荧光PCR反应,也可以平移到数字PCR平台中,方便快捷的进行数字PCR的精准定量检测中。
附图说明:
图1为体系退火温度为58℃时扩增图:从左到右分别为时引物探针配比B(MON87712-F/R/P:0.4μL/0.4μL/0.8μL)、A(MON87712-F/R/P:0.5μL/0.5μL/1μL)和C(MON87712-F/R/P:0.2μL/0.2μL/4μL)。
图2为体系退火温度为60℃时扩增图:从左到右分别为引物探针配比B(MON87712-F/R/P:0.4μL/0.4μL/0.8μL)、A(MON87712-F/R/P:0.5μL/0.5μL/1μL)和C(MON87712-F/R/P:0.2μL/0.2μL/4μL)。
图3为转基因大豆MON8775品系特异性检测方法特异性实验结果,阳性扩增曲线为MON87712;阴性信号分别为:转基因油菜MON88302、转基因油菜DP-073496-4、转基因棉花MON88913、转基因大豆A2704-12、转基因大豆GTS 40-30-2、转基因玉米MON810、转基因玉米BT11、转基因玉米MIR162、转基因玉米NK603、转基因甜菜H7-1、非转基因大豆、阴性对照和空白对照;
图4为MON87712品系特异性检测灵敏度试验扩增图:阳性信号从左到右分别为:8000000、800000、80000、8000、800、80和40copies/μL质粒DNA,阴性信号为阴性对照和空白对照;
图5是实时荧光PCR检测MON87712品系的标准曲线。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
主要材料:转基因油菜MON88302、转基因油菜DP-073496-4、转基因棉花MON88913、转基因大豆A2704-12、转基因大豆GTS 40-30-2、转基因玉米MON810、转基因玉米BT11、转基因玉米MIR162、转基因玉米NK603、转基因甜菜H7-1、非转基因大豆为本实验室购置及保存,大豆内源基因选用lectin基因(GenBank:K00821.1)和转基因大豆MON87712品系特异性双基因阳性质粒(将内源基因Lectin基因片段160bp序列和MON87712的3’边界序列品系特异性片段200bp序列构建到AmpR抗性的PUC57载体上,构建得到的质粒转入受体菌DH5a后-70℃保存。以下称Lectin-MON87712质粒,含酶切位点BahmHI)为本实验室构建。Lectin基因片段序列:
MON87712品系特异性片段序列(5’端):
大豆内源基因选用lectin基因引物和探针Lectin-F/R/P用于检测大豆样品基因组DNA是否成功提取以及是否适于进行实时荧光PCR扩增;其序列信息详见表1。
主要试剂:Primex Ex Taq(2×)for qPCR,大连宝生物;DNA提取试剂盒,北京天根公司;引物和探针由闪晶生物公司合成,稀释为终浓度为10uM的工作液使用。
主要仪器与设备
ABI7500,ABI7500FAST实时荧光定量PCR仪,美国应用生物系统公司;QX 200微滴式数字PCR系统美国伯乐公司;nanodrop2000c微量分光光度计,美国Thermo公司;研磨机,德国IKA。
农作物材料样品基因组DNA采用常规方法提取与纯化。
实施例1实时荧光PCR检测方法的建立与优化
根据MON87712品系转入的基因盒5’端与大豆基因组邻接区序列(品系特异性片段),应用Primer Primer 5.0软件设计引物和探针。将设计的引物、探针经NCBI网站上使用BLAST数据库比对确定引物和探针的理论特异性;大豆内源基因Lectin用于大豆来源样品DNA的检测及转基因成分的相对定量。具体引物探针信息见表1GGCCGCAGGAGAAGTTATCA
表1实时荧光PCR的引物、探针
B组:扩增反应25μL体系为:Premix Ex TaqTM 12.5μL,ROX Reference Dye II0.2μL,10μmol/L MON87712-F和MON87712-R各0.4μL,10μmol/L探针MON87712-P 0.8μL,DNA模板2μL和ddH
A组,引物配比是MON87712-F/R/P:0.5μL/0.5μL/1μL,其他与B组相同。
C组,引物配比是MON87712-F/R/P:0.2μL/0.2μL/4μL,其他与B组相同。
结果显示:在扩增体系的退火温度为58℃时(图1),从左到右分别为时不同引物探针组B(MON87712-F/R/P:0.4μL/0.4μL/0.8μL)、A(MON87712-F/R/P:0.5μL/0.5μL/1μL)和C(MON87712-F/R/P:0.2μL/0.2μL/4μL),B组Ct值最小;
在退火温度为60℃时(图2),从左到右分别为时不同引物探针配比B(MON87712-F/R/P:0.4μL/0.4μL/0.8μL)、A(MON87712-F/R/P:0.5μL/0.5μL/1μL)和C(MON87712-F/R/P:0.2μL/0.2μL/4μL),A和B组Ct值接近,C组Ct稍高,但三组引物探针Ct值较退火温度为58℃时Ct值差异小,说明该退火温度下,对不同引物探针的浓度具有良好的适应性。
综合以上考虑,基于扩增方法的通用性,扩增方法对内源基因lectin扩增退火温度的一致性,选择考虑选择60℃作为退火温度、B组为本实验的引物探针配比,可使检测的于同一反应条件进行,同一反应程序进行多个其他品系的反应(根本转基因应用最广的行业标准SN/T 1204-2016、SN/T 1201-2014、GB/T 19495-2018或SN/T 1202-2010等相关标准,其检测的方法的退火温度均为60℃),使检测成本有效降低,不用单独采用58℃的温度再进行一次单独的实时荧光PCR反应,很大程度上减少了检测的周期,于一个反应程序(条件)中即可完成检测。,以下实施例用此条件进行。
实施例2实时荧光PCR方法特异性测试
提取转基因油菜MON88302、转基因油菜DP-073496-4、转基因棉花MON88913、转基因大豆A2704-12、转基因大豆GTS 40-30-2、转基因玉米MON810、转基因玉米BT11、转基因玉米MIR162、转基因玉米NK603、转基因甜菜H7-1、非转基因大豆的DNA为模板,阳性对照为Lectin-MON87712质粒,阴性对照为非转基因大米DNA。对建立的实时荧光PCR检测方法的特异性进行测试。实时荧光PCR检测反应体系和反应程序同实施例1
结果显示(图3),采用MON87712品系特异性MON87712-F/R/P引物和探针进行实时荧光PCR时,只有阳性样品MON87712的DNA模板有典型荧光扩增曲线,以其他农作物材料DNA为模板的反应均无典型荧光扩增曲线。表明本发明的检测方法特异性良好。
实施例3灵敏度测试、可重复性测试及标准曲线建立
将提取的Lectin-MON87712DNA溶液加TE缓冲液稀释至缓冲液稀释至8000000、800000、80000、8000、800、80和40copies/μL进行转基因大豆MON87712实时荧光PCR检测,实时荧光PCR检测反应体系和反应程序同实施例1,进行灵敏度测试:
测试结果显示(图4),8000000-40copies/μL范围内7个浓度梯度均能有典型扩增曲线,其最低检测浓度为40copies/μL.扩增图从左至右分别为缓冲液稀释至8000000、800000、80000、8000、800、80和40copies/μL扩增曲线。
将提取的Lectin-MON87712质粒DNA溶液加TE缓冲液稀释至8000000、800000、80000、8000、800、80和40copies/μL,进行转基因大豆MON87712品系实时荧光PCR检测线性范围测试及可重复性,每个样品进行3次重复实验,水为空白对照,实时荧光PCR检测反应体系和反应程序同实施例1:
测试结果的Ct值如表2所示;根据表2中Ct值数据与在40-8000000copies范围内7个浓度的对数值建立标准曲线(图5),线性回归方程为:y=-3.43x+42.12,R
表2实时荧光PCR方法的灵敏度及可重复性测试
本发明针对转基因大豆MON87712品系转入的基因盒5’端与大豆基因组邻接区序列建立的转基因大豆MON87712品系特异性实时荧光PCR方法,可对转基因大豆MON87712进行品系特异性快速、高通量的定性及精准定量检测,满足检测、监管部门对其进行标识的需求。
序列表
SEQ ID NO.1
GGCCGCAGGAGAAGTTATCA 19
SEQ ID NO.2
TTTCTTTTTCTCCATATTGACCATCA 26
SEQ ID NO.3
ATGAGTTTCGCGCCCC 28
