用于制造DNA测序阵列的方法和系统
文献发布时间:2023-06-19 09:29:07
本申请要求于2018年3月21日提交的美国临时专利申请号62/646,279的权益,该临时申请通过引用以其全文并入本文。
背景技术
高密度DNA微阵列已被广泛应用于一系列基因组序列分析,包括突变和多态性(SNP基因分型)、细胞遗传学(拷贝数)、核蛋白质组学、基因表达谱的检测和分析和转录组分析。尽管许多此类应用可以采用基于直接杂交的方法进行读出,但是酶促读出的使用可能会提供某些明显的优势。例如,与仅通过杂交检测相比,聚合酶延伸或阵列序列的连接可能提供更高水平的区分。
一种用于制造超高密度DNA微阵列的方法将原位合成与光刻半导体制造方法相结合,以在基底上提供具有高密度DNA序列的阵列。光刻方法可产生不完整或截短的探针序列的群体,这伴随着合成完整的期望或预期长度的探针序列(“全长”探针)。此类截短的探针序列的存在会对阵列性能产生不利影响,例如,在杂交反应中导致不良的信噪比。然而,光刻方法允许在3’至5’方向进行有效的寡核苷酸合成,合成探针的3’末端与固体支持体结合(5’向上的微阵列)。在某些要求对游离探针末端进行酶促寻址的酶促反应中,如在聚合酶延伸反应或连接反应中,需要游离的3’-羟基来进行酶促反应。通过光刻方法合成的序列的朝向通常为3’→5’方向。这使合成序列的3’末端附接在表面,无法参与需要游离的3’-羟基末端的酶促反应。
相反,固定在微珠阵列(例如,Illumina)和其他点样阵列上的寡核苷酸探针通常通过胺或其他官能团附接至其基底,所述胺或其他官能团合成地附接至先前已合成并纯化的全长探针的5’末端。但是,以这种方式难以合成复杂度增加的阵列。迄今为止,3’向上的微阵列几乎完全是通过“自上而下”的微制造策略分两个步骤制造的:首先按照常规方式以5’向上的朝向合成分子,合成序列的5’末端带有一个接头。然后将合成序列从其3’末端切割下来,随后使5’末端连接全体与基底反应,并通过点样产生3’向上的序列。
发明内容
期望将探针在原位合成阵列(如用光刻法制造的阵列)上的朝向反转,以使探针在5’→3’方向上带有游离的3’-羟基末端,并且处于“全长”。本公开内容提供了用于完成探针序列的朝向的分子反转的方法,使得最初在供体基底上从3’末端合成的探针序列被转化为通过它们的5’末端附接至受体基底上的探针序列,以暴露游离的3’-羟基,同时在所得受体基底上保持供体基底上序列的最初图案。另外,本公开内容还可以减少或消除受体基底中的截短的寡核苷酸探针。
目前用于制造高分辨率光刻DNA微阵列的技术可能会受到以下限制:每个序列的3’末端均锚定在硬质基底上,并且因此无法进行许多潜在的酶促反应。本公开内容提供了可以将整个微阵列反转至水凝胶中的技术。该方法可以保留微阵列最初图案的空间保真度,同时去除所有其他微阵列制造策略固有的错误合成的低聚物。首先,可合成供体晶片上的标准5’向上的微阵列,其中每个寡核苷酸均在附接至微阵列表面的寡核苷酸的3’末端处通过可切割的接头锚定,并在5’末端具有丙烯酸亚磷酰胺(以下称为“Acrydite”)。
Acrydite或丙烯酸亚磷酰胺是一种亚磷酰胺,它可以合成在5’末端具有甲基丙烯酸基团的寡核苷酸,即7-甲基丙烯酰胺基庚基膦酸,在寡核苷酸的5’末端的单酯:
在完成阵列的合成之后,可以将丙烯酰胺单体溶液施加于供体晶片,并且可以将丙烯酰胺硅烷化的受体晶片放置在丙烯酰胺单体溶液的顶部。当聚丙烯酰胺水凝胶在两个晶片之间形成时,它将以Acrydite为末端的序列共价掺入到水凝胶基质中。最后,可以通过浸入氨溶液中将寡核苷酸从供体晶片上释放出来,该氨溶液切割已插入供体晶片和寡核苷酸之间的3’可切割的接头,从而释放3’末端的寡核苷酸。现在阵列可以以3’向上呈现在涂有凝胶的受体晶片的表面上。延伸反应、限制性酶切消化以及使用标记的可逆终止子进行的凝胶微型测序可展示一个多功能且强大的平台,该平台可以通过向系统赋予多种酶促基底,用比传统微阵列高得多的分子复杂度来轻松构建。这一代微阵列当中,高度有序的纯化寡核苷酸可以在可生物相容的软水凝胶中被反转为3’向上,并且可以对于多种可编程酶促反应具有功能。
本公开内容提出了合成高密度、反转的、酶相容的微阵列的问题的解决方案。首先,对供体晶片进行3’→5’合成(“自下而上”的方法);然后将合成寡核苷酸共价锚定在聚丙烯酰胺水凝胶中,用于未加帽的序列,并且未加帽的序列因此可以接受Acrydite亚磷酰胺(“自上而下”的方法)。在3’末端切割以分离两个晶片后,可以将所得的纯化的寡核苷酸阵列反转为在水凝胶表面上3’向上,同时保留来自“自下而上”途径方法中的最初图案的序列的空间显示。除了相对便宜、可扩展且与当前用于合成微阵列的机器和方法兼容的优点外,此性能还可以实现具有可利用核酸酶的多种生物化学的独特应用的新一代高密度光刻阵列。
在一方面,本公开内容提供了一种在表面上反转寡核苷酸的方法,该方法包括:(a)提供在供体基底的第一表面上与多个链偶联的供体基底,所述多个链的链包含3’至5’朝向的寡核苷酸和附接至该寡核苷酸的5’末端的第一反应性基团;(b)提供在受体基底的第二表面上包含多个第二反应性基团的受体基底;(c)将供体基底、反应混合物和受体基底以夹心结构构造布置,使得第一表面面对第二表面,反应混合物位于第一表面和第二表面之间;(d)使夹心结构构造经受固定条件,以在第一反应性基团与反应混合物之间形成第一共价键,并在所述多个第二反应性基团的第二反应性基团与反应混合物之间形成第二共价键,从而产生转化的夹心结构构造;和(e)从转化的夹心结构构造中释放供体基底,从而在受体基底上提供5’至3’朝向的寡核苷酸。
在另一方面,本公开内容提供了一种在表面上反转寡核苷酸的方法,该方法包括:(A)提供在供体基底的第一表面上与多个分子偶联的供体基底,多个分子的成员包含(i)固定在供体基底的第一表面上的3’至5’朝向的第一寡核苷酸和(ii)附接至第一寡核苷酸的5’末端的第一反应性基团;(b)提供包含固定在受体基底的表面上的多个第二反应性基团的受体基底;(c)将供体基底、反应混合物和受体基底以夹心结构构造布置,使得供体基底的第一表面面对受体基底的表面,并且反应混合物位于供体基底的第一表面和受体基底的表面之间;(d)使夹心结构构造经受固定条件,以在第一反应性基团与反应混合物或其衍生物之间形成第一共价键,并在多个第二反应性基团的成员与反应混合物或其衍生物之间形成第二共价键,从而产生转化的夹心结构构造;(e)从第一寡核苷酸释放供体基底;和(f)提供通过反应混合物或其衍生物固定在受体基底上的5’至3’朝向的第一寡核苷酸。
在本文提供的方面的一些实施方案中,(f)中第一寡核苷酸包含游离的3’羟基。在本文提供的方面的一些实施方案中,所述多个分子的成员进一步在供体基底的第一表面和3’至5’朝向的第一寡核苷酸之间包含通用可切割的接头。在本文提供的方面的一些实施方案中,通用可切割的接头通过试剂
与第一表面偶联。
在本文提供的方面的一些实施方案中,(e)中的释放包括用碱处理。在本文提供的方面的一些实施方案中,碱包含选自NH
在另一方面,本公开内容提供了一种制备固定在受体基底的受体表面上的5’至3’朝向的寡核苷酸阵列的方法,该方法包括:(a)提供夹心结构构造,该夹心结构构造包含:(i)包含供体表面的供体基底;(ii)多个寡核苷酸,所述多个寡核苷酸的每个成员的3’末端与供体表面共价键合;(iii)与所述多个寡核苷酸的成员的5’末端共价键合的中间层;和(iv)包括受体表面的受体基底,中间层与受体表面共价键合;(b)从多个寡核苷酸中去除供体基底;和(c)提供在受体基底的受体表面上的5’至3’朝向的寡核苷酸阵列。
在本文提供的方面的一些实施方案中,该方法进一步包括:在(a)之前,由在与多个寡核苷酸键合的供体表面和受体表面之间的试剂混合物形成中间层。在本文提供的方面的一些实施方案中,形成中间层包括进行聚合反应。在本文提供的方面的一些实施方案中,聚合反应聚合丙烯酰胺试剂。在本文提供的方面的一些实施方案中,所述多个寡核苷酸的成员的3’末端在成员的3’末端与通用可切割的接头共价键合,通用可切割的接头与供体表面共价键合。在本文提供的方面的一些实施方案中,(b)中去除包括破坏通用可切割的接头与所述多个寡核苷酸的成员之间的键。在本文提供的方面的一些实施方式中,(b)中去除进一步包括在破坏键之前在供体基底的另一个表面上执行机械切割过程或激光穿孔过程。在本文提供的方面的一些实施方案中,破坏键包括用碱性试剂处理通用可切割的接头。在本文提供的方面的一些实施方案中,碱性试剂包含选自NH
在另一方面,本公开内容提供了一种组合物,该组合物包含:(a)包含供体表面的供体基底;(b)多个寡核苷酸,所述多个寡核苷酸的每个成员在所述多个寡核苷酸的成员的3’末端与供体表面共价键合;(c)与所述多个寡核苷酸的成员的5’末端共价键合的中间层;和(d)包含受体表面的受体基底,中间层与受体表面共价键合。
在本文提供的方面的一些实施方案中,所述多个寡核苷酸的成员通过所述多个寡核苷酸的成员的3’末端与通用可切割的接头共价键合。在本文提供的方面的一些实施方案中,通用可切割的接头与供体表面共价键合。在本文提供的方面的一些实施方案中,供体基底被配置为被机械切割或激光穿孔成多块。在本文提供的方面的一些实施方案中,中间层包含聚丙烯酰胺。在本文提供的方面的一些实施方式中,供体基底是硅晶片。在本文提供的方面的一些实施方式中,受体基底是石英晶片。在本文提供的方面的一些实施方案中,所述多个寡核苷酸的每个成员均包含游离的3’羟基。在本文提供的方面的一些实施方案中,组合物的特征在于选自以下的任何两种或更多种的组合:(i)所述多个寡核苷酸的成员通过所述多个寡核苷酸的成员的3’末端与通用可切割的接头共价键合;(ii)供体基底被配置为被机械切割或激光穿孔成多块;(iii)中间层包含聚丙烯酰胺;(iv)供体基底是硅晶片;(v)受体基底是石英晶片;和(vi)所述多个寡核苷酸的每个成员均包含游离的3’羟基。在本文提供的方面的一些实施方式中,中间层的厚度为约10μm、15μm、20μm、25μm或30μm。
在另一方面,本公开内容提供了一种组合物,该组合物包含:(a)包含表面的基底;(b)包含第一表面和第二表面的中间层,第一表面靠近基底的表面,并且第二表面远离基底的表面,第一表面与基底的表面共价键合;和(c)通过多个寡核苷酸的5’末端与中间层的第二表面共价键合的多个寡核苷酸。
在本文提供的方面的一些实施方案中,所述多个寡核苷酸的5’末端通过碳-碳键键合至第二表面。在本文提供的方面的一些实施方式中,基底是石英。在本文提供的方面的一些实施方案中,中间层包含聚丙烯酰胺。在本文提供的方面的一些实施方案中,基底的表面通过碳-碳键键合至第一表面。在本文提供的方面的一些实施方案中,所述多个寡核苷酸的每个成员均包含游离的3’羟基。在本文提供的方面的一些实施方案中,组合物的特征在于选自以下的任何两种或更多种的组合:(i)所述多个寡核苷酸的5’末端通过碳-碳键键合至第二表面;(ii)基底是石英;(iii)中间层包含聚丙烯酰胺;(iv)基底的表面通过碳-碳键键合至第一表面;和(v)所述多个寡核苷酸的每个成员均包含游离的3’羟基。在本文提供的方面的一些实施方式中,中间层的厚度为约10μm、15μm、20μm、25μm或30μm。
通过下文的详细描述,本发明的其他方面和优点对于本领域的技术人员来说将变得显而易见,其中仅示出和描述了本发明的示例性实施方案。技术人员将会认识到,本公开内容能够实现其他不同的实施方案,并且其能够修改各个明显方面的若干细节,所有这些都不偏离本发明内容。因此,附图和说明应被视为是示例性的,而非限制性的。
援引并入
本说明书中提及的全部出版物、专利和专利申请均通过引用并入本文,其程度如同特别且单独地指出每个单独的出版物、专利或专利申请通过引用并入本文。
附图说明
本发明的新特征在随附的权利要求中具体阐述。通过参考以下对利用了本发明原理的说明性实施方案进行阐述的详细描述和附图,将会获得对本发明特征和优点的更好的理解,附图中:
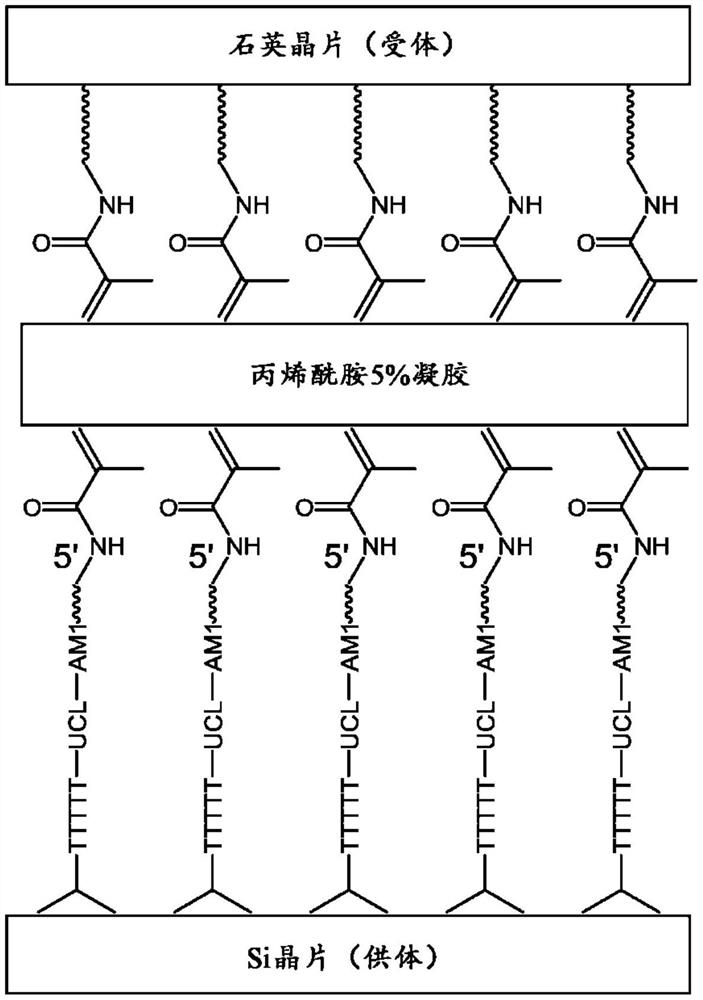
图1A-1F示出了通过公开的微阵列反转方法将探针反转至水凝胶中的示意性过程。图1A描述了可以在由包含通用可切割的接头(UCL)和5’Acrydite的寡核苷酸序列修饰的供体基底上制备5’向上的寡核苷酸。图1B示出了可以制备丙烯酰胺涂覆的受体基底。图1C描述了可以将丙烯酰胺溶液倾倒在供体基底上,同时可以将受体反转并放置在倾倒的丙烯酰胺溶液的顶部。图1D示出了受体晶片可以被机械切割或被激光穿孔。图1E描述了在暴露于浓氨(例如,28-33%氨在水中,也称为氢氧化铵)之后,例如搅拌约18小时,晶片可以分离。图1F示出了转移的阵列在受体晶片上可以是3’向上的。
图2A-2C展示了图案化的AM1 DNA并将其转移到聚丙烯酰胺水凝胶中。图2A示出了在2in×3in的基底上使用分辨率测试图案并使用DMT化学法后,荧光标记的探针与受体基底的凝胶上的合成寡核苷酸杂交。
图2B示出了图2A所示的与凝胶上的合成寡核苷酸杂交的荧光标记的探针的荧光成像的一部分(插图)的放大图像。该来自图2A的放大插图可展示图案的转移保真度和高分辨率。
图2C示出了与受体基底的凝胶上的合成寡核苷酸杂交的荧光标记的探针的荧光成像。使用photoamidite法合成6英寸晶片的供体基底上的寡核苷酸。图2C显示了在6英寸受体基底(晶片)上的3μm(左侧)和8μm(右侧)正方形特征,其可表明该过程的可扩展性。
图3A示出了在所有4种碱基、3μm正方形特征的存在下,来自仅使用标记的T的Taq聚合酶催化的延伸反应的Cy3标记的延伸的核苷酸的荧光图像。
图3B示出了在所有4种碱基的存在下,来自标记的A的Hero聚合酶延伸的Cy3标记的延伸的核苷酸的荧光图像。
图4示出了转移的寡核苷酸的荧光图像,其分辨率由光刻胶过程确定,显示了1μm的线和间隔图案,大约是所用成像设备的光刻极限。
图5A示出了对通过使用公开的方法及可逆终止子制备的反转的3’向上的寡核苷酸阵列上的第一碱基通过合成进行测序的荧光显微术。图5B示出了使得第一碱基(在固定的寡核苷酸的3’末端的胞嘧啶)存在直接匹配的模板和生长链的序列。
图5C示出了另一种对通过使用公开的方法及可逆终止子制备的反转的3’向上的寡核苷酸阵列上的第二碱基通过合成进行测序的荧光显微术。图5D示出了使得在第一次添加的可逆终止子上的封闭基团被切割和第二轮延伸后第二碱基(在固定的寡核苷酸的3’末端的腺嘌呤)存在直接匹配的模板和生长链的序列。
图6A示出了制备通用可切割的接头的示例亚磷酰胺试剂。图6B示出了制备通用可切割的接头的另一种示例亚磷酰胺试剂。图6C仍示出了制备通用可切割的接头的另一种示例亚磷酰胺试剂。
图7A-7D示出了转移的寡核苷酸在受体水凝胶表面上3’向上并且具有酶促功能的示意图。图7A示出了将反转的3’向上的寡核苷酸阵列与模板寡核苷酸杂交并通过KlenowDNA聚合酶及所有4种未标记的碱基延伸后的荧光成像。图7B示出了在图7A的延伸反应之后,当用0.2M NaOH剥离模板寡核苷酸,并添加靶向新合成的镶嵌末端序列的Cy3标记的探针时的荧光成像。图7C示出了在将图7B的阵列上的3’向上的寡核苷酸暴露于限制性内切酶Ecor1以消化在阵列上的部分延伸的寡核苷酸之后的荧光成像。图7D示出了当添加具有AM1的互补体的标记的探针时,图7C的阵列上的3’向上的寡核苷酸的荧光成像,表明在图7C中的限制性内切酶处理之后,来自图7B中的最初阵列的图案化的DNA是完整的。
具体实施方式
本公开内容提供了用于原位合成寡核苷酸探针的反转的方法。本文公开的方法还可以减少或消除不含有全长的合成寡核苷酸序列的截短的寡核苷酸探针,同时保留全长的寡核苷酸探针。例如,全长寡核苷酸可以在从供体基底释放3’末端之前被固定到受体基底上,而非全长寡核苷酸不能被固定到受体基底上,因此可以在固定步骤之后释放3’末端时被去除。
如本文所用,术语“寡核苷酸”通常是指核苷酸链。在一些情况下,寡核苷酸的长度小于200个残基,例如,在15至100个核苷酸之间。寡核苷酸可以包含至少或大约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45或50个碱基。寡核苷酸可以为约3至约5个碱基、约1至约50个碱基、约8至约12个碱基、约15至约25个碱基、约25至约35个碱基、约35至约45个碱基或约45至约55个碱基。寡核苷酸(也被称为“寡核苷酸(oligo)”)可以是任何类型的寡核苷酸(例如,引物)。寡核苷酸可包含天然核苷酸、非天然核苷酸或其组合。
如本文所用,术语“约”通常是指指定量的+/-10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。
如本文所用,术语“3’→5’朝向”或“3’至5’朝向”通常是指核酸序列的朝向使其核酸序列的3’端附接/固定在基底的表面上。如本文所用,另一术语“5’向上”通常也描述3’-5’朝向。
如本文所用,术语“5’→3’朝向”或“5’至3’朝向”通常是指核酸序列的朝向使其核酸序列的5’端附接/固定在基底的表面上。如本文所用,另一术语“3’向上”通常也描述5’-3’朝向。
如本文所用,术语“固定”通常是指在两个反应性基团之间形成共价键。例如,反应性基团的聚合是固定的一种形式。碳与碳共价键的形成是固定的一个实例。
随着快速基因组测序和大型基因组数据库的出现,可以以多种方式利用遗传信息。这种应用之一是寡核苷酸阵列。寡核苷酸阵列(或通常称为DNA微阵列或DNA阵列或DNA芯片)的一般结构是表面上斑点或可寻址位置的明确定义的阵列。每个斑点可以包含称为“探针”或“捕获探针”的相对短链的DNA的层(例如,Schena主编,“DNA Microarrays APractical Approach”,Oxford University Press;Marshall等人,(1998)Nat.Biotechnol.16:27-31;各自通过引用并入本文)。至少有两种生成阵列的技术。一种基于光刻技术(例如Affymetrix),另一种基于机器人控制的喷墨(spotbot)技术(例如,Arrayit.com)。生成微阵列的其他方法是已知的,并且本文可使用任何这样的已知方法。
通常,可以选择置于阵列中给定斑点内的寡核苷酸(探针或捕获探针)以结合核酸或靶核酸的互补核酸的至少一部分。可以将水性样品在适当的杂交条件下与阵列接触。然后可以彻底清洗阵列以去除所有非特异性吸附物质。为了确定是否已经捕获了靶序列,可以通过添加例如与靶序列的未占部分互补的荧光标记的寡核苷酸序列来“开发”阵列。然后可以使用输出阵列的图像的微阵列读取器或扫描仪“读取”微阵列。表现出强荧光的斑点对于该特定靶序列可以是阳性的。
探针可包含沉积的生物材料以产生点样阵列。探针可以包含根据其他技术合成、沉积或定位以形成阵列的材料。因此,为方便起见,根据这些技术中的任何一种形成的微阵列在下文中可以统称为“探针阵列”。术语“探针”不限于以阵列形式固定的探针。相反,本文所述的功能和方法也可对于其他平行测定装置采用。例如,当将探针固定在珠子、光纤或其他基底或介质之上或之中时,可以应用这些功能和方法。
在本公开内容的方法和系统中,可以将探针附接到固体基底上。探针可以直接或通过接头与基底结合。接头可包含例如不干扰探针功能的氨基酸、多肽、核苷酸、寡核苷酸或其他有机分子。
固体基底可以是生物的、非生物的、有机的、无机的或其任何组合。基底可以例如以一种或多种颗粒、股线、沉淀物、凝胶、片、管、球、容器、毛细管、垫、切片、膜、板、载玻片或半导体集成芯片的形式存在。固体基底可以是平坦的或者可以具有另外的表面构造。例如,固体基底可以包含在其上发生合成或沉积的凸起或凹陷区域。在一些实例中,可以选择固体基底以提供适当的光吸收特性。例如,基底可以是聚合的Langmuir Blodgett膜、功能化玻璃(例如,受控孔玻璃)、二氧化硅、氧化钛、氧化铝、氧化铟锡(ITO)、Si、Ge、GaAs、GaP、SiO
固体基底可以包含聚合物涂层或凝胶,如聚丙烯酰胺凝胶或PDMS凝胶。凝胶和涂层可以另外包含用于改变其物理化学性质例如疏水性的组分。例如,聚丙烯酰胺凝胶或涂层可以在其聚合物结构中包含修饰的丙烯酰胺单体,如乙氧基化的丙烯酰胺单体、磷酰胆碱丙烯酰胺单体、甜菜碱丙烯酰胺单体和其任何组合。
如本文所用,术语“中间层”通常是指水凝胶或凝胶或聚合层,其在其表面之一上与基底(例如,受体基底)键合并在其另一表面上与多个寡核苷酸的5’末端键合。中间层位于两个基底之间。在去除基底之一例如供体基底之后,中间层保持完整。在去除基底之一例如供体基底之后,多个寡核苷酸的5’末端保持与中间层共价键合。
如本文所用,术语“水凝胶”通常是指其中溶胀剂为水的凝胶。术语“凝胶”是指由流体通过其体积而膨胀的非流体的胶体网络或聚合物网络。术语“溶胀剂”是用于溶胀凝胶或网络的流体。例如,水可以是水凝胶的溶胀剂。本公开内容的水凝胶可以通过一种或多种丙烯酰胺官能化的单体的聚合来制备。例如,可以将丙烯酰胺尾键合到多个寡核苷酸的5’末端。丙烯酰胺尾也可以键合到基底例如受体基底的表面上。然后,当将含有丙烯酰胺单体的溶液倾倒在与丙烯酰胺尾键合的基底的一个表面上时,可以将与丙烯酰胺尾结合的另一表面堆叠在倾倒的溶液的顶部。然后,可以使倾倒的溶液进行丙烯酰胺单体和丙烯酰胺尾的聚合,从而可以形成中间层。在一些情况下,本公开内容的水凝胶包含聚丙烯酰胺。在一些情况下,本公开内容的水凝胶包含交叉内衬(crossed lined)的聚丙烯酰胺。在一些情况下,本公开内容的水凝胶包含重量约占0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%的聚丙烯酰胺。在一些情况下,可通过将丙烯酰胺和亚甲基双丙烯酰胺结合而获得水凝胶。聚合反应可以由引发剂自由基引发。水凝胶可通过在自由基引发剂的存在下,将丙烯酰胺和亚甲基双丙烯酰胺以150:1至1000:1的摩尔比结合而获得。亚甲基双丙烯酰胺可以提供聚合物链之间的交联,并且可以改变摩尔比以提供水凝胶的各种交联密度。可以改变获得水凝胶的条件。过硫酸铵(AMPS)可以用作聚合反应的引发剂。
可以使用空间定向的原位合成或预先合成的寡核苷酸的固定来制造DNA微阵列。在这两种情况下,寡核苷酸的合成通常可以通过沿3’至5’方向添加单体,使用标准的3’-亚磷酰胺试剂和固相合成方案进行(例如,M.Egli等人编辑,“Current Protocols inNucleic Acid Chemistry”John Wiley&Sons)。主要杂质是由不完整的单体偶联以及其次脱嘌呤反应产生的截短的部分长度序列。
一方面,制备预先合成的寡核苷酸探针的阵列通常可涉及当在高通量合成器上合成寡核苷酸时将反应性修饰剂添加到末端,通过该反应性修饰剂将寡核苷酸通过5’末端共价附接于基底(参见S.J.Beaucage等人,Curr.Med.Chem.2001,8,1213-44)。这确保了附接在支持体上的探针可以主要是全长序列,因为截短的序列可以在合成过程中加帽并使之无反应性(Brown T和Brown T,Jr.(2005-2015)Solid-phase oligonucleotide synthesis.[在线]Southampton,UK,ATDBio.
本公开内容的优点可以是寡核苷酸探针的3’-羟基“远离”基底,并且可以自由地用于酶促反应,例如模板指导的聚合酶催化的链延伸和连接;并且可以利用此特征进行非常灵敏和特异性的测定以检测和定量遗传多态性(K.Lindroos等人,Nucleic AcidsRes.2001,29,e69;Gunderson KL等人,Nature Genetics 2005,37,549-54)。
另一方面,也可以使用直接在支持体上原位合成序列来制造DNA微阵列。在这种情况下,可以通过使用喷墨(T.R.Hughes等人,Nature Biotechnol 2001,19,342-7;C.Lausted等人,Genome Biol 2004,5,R58)、光刻技术(A.C.Pease等人,Proc Natl AcadSci USA 1994,91,5022-6;G.McGall等人,Proc Natl Acad Sci USA 1996;93:13555-60;S.Singh-Gasson等人,Nature Biotechnol 1999,17,974-8;)或电化学技术(PLoS ONE2006,1,e34;B.Y.Chow等人,Proc Natl Acad Sci USA 2009,106,15219-24)空间定向合成以高度平行的方式“打印”序列。同样,合成也在3’至5’方向进行(固相寡核苷酸在5’到3’方向合成虽然可行,但效率和经济性要低得多,从而降低了产量和产品纯度)。但是,所得探针可以在3’末端连接到基底,并且在合成过程中出现的任何截短的序列杂质都会保留在支持体上,这在光刻合成的情况下可能是一个特殊的问题(J.Forman等人,Molecular Modelingof Nucleic Acids,第13章,第221页,American Chemical Society(1998)和G.McGall等人,J.Am.Chem.Soc.119:5081-5090(1997))。结果,在使用这种方式和该方向(5’至3’)制作的阵列时基于聚合酶的延伸测定通常是不可行的。
尽管有上述限制,但光刻合成是制造超高密度DNA阵列的极具吸引力的方法,因为它能够实现每cm
例如,现代的高密度DNA微阵列可以将原位合成与光刻半导体制造方法相结合,以提供密度数量级为每cm
以前报道的微阵列可能在结构上存在固有的局限性,可能会大大限制其与酶的使用。首先,阵列基底可以是坚硬的表面,例如石英或硅,它们可能会对酶与表面附近的寡核苷酸的活性产生负面影响;即使亲水性连接基团被包括“在列”以将寡核苷酸提升到更加酶促协作的环境中。参见Shchepinov,M.S.等人,Steric Factors InfluencingHybridisation of Nucleic Acids to Oligonucleotide Arrays.Nucleic AcidsRes.1997,25(6),1155–1161。其次,由于亚磷酰胺化学法偶联产量的低效,可以通过顺序碱基添加来制造的微阵列上的寡核苷酸的长度可能受到限制。即使可能已经确定了较长的纯序列的值,但合成过程中的偶联低效导致许多截短的寡聚物产物与全长序列混合在一起,并且尚无直接方法可选择性地除去它们。参见LeProust,E.M.等人;Synthesis of High-Quality Libraries of Long(150mer)Oligonucleotides by a Novel DepurinationControlled Process.Nucleic Acids Res.2010,38(8),2522-2540。
如上所述,以前报道的光刻微阵列的一个限制是序列的方向性朝向,可以使用亚磷酰胺化学法以3’→5’方向合成该序列。这可能使阵列序列的3’末端附接在表面(3’向下),并且无法参与需要游离的3’-羟基的酶促反应。迄今为止,已经使用“自上而下”的方法制备了3’向上的微阵列,其中分子可以以5’向上的朝向合成,并在5’末端具有接头,然后切割并使用切割的寡核苷酸与基底反应以通过点样或在珠子上产生3’向上的寡聚产物。但是,以这种方式制造的阵列可能会失去由光刻——一种“自下而上”的制造策略所能达到的规模和精度。人们可能会考虑使用直接5’→3’合成的photoamidite法来实现3’向上的阵列。参见Albert,T.J.;Norton,J.等人;Light-Directed 5’-->3’Synthesis of ComplexOligonucleotide Microarrays.Nucleic Acids Res.2003,31(7),e35。但是,相对于DMT化学方法,photoamidite的较低产量可能使得通过这种方法无法实现合成具有正确序列的长的纯寡核苷酸序列。
多个探针可以位于固体基底上的一个或多个可寻址区域(斑点、位置等)中,在本文中通常称为“像素”。在一些情况下,固体基底包含至少约2、3、4、5、6或7-10、10-50、50-100、100-500、500-1,000、1,000-5,000、5,000-10,000、10,000-50,000、50,000-100,000、100,000-500,000、500,000-1,000,000或超过1,000,000具有探针的像素。在一些情况下,固体基底包含至多约2、3、4、5、6或7-10、10-50、50-100、100-500、500-1,000、1,000-5,000、5,000-10,000,10,000-50,000、50,000-100,000、100,000-500,000、500,000-1,000,000或超过1,000,000具有探针的像素。在一些情况下,固体基底包含约2、3、4、5、6或7-10、10-50、50-100、100-500、500-1,000、1,000-5,000、5,000-10,000,10,000-50,000、50,000-100,000、100,000-500,000、500,000-1,000,000或超过1,000,000具有探针的像素。
在一些情况下,具有不包含探针的像素会很有用。此类像素可以充当控制点,以提高测量质量,例如,通过使用与斑点的结合来估计和校正非特异性结合。在一些情况下,可以控制探针的密度以促进探针的附接或增强探针的随后检测。
在一些实例中,具有冗余像素是有用的,该冗余像素具有与另一像素相同的探针序列,但是在物理上可能与该其他像素不相邻或不邻近。由这样的探针阵列获取的数据可能不太容易受到非理想状态的制造和测量误差的影响。
在一些情况下,除了掺入到靶标中的标记外,标记还附接在像素内的探针上。在这样的系统中,捕获的靶标可能会导致两个标签在像素中彼此紧密邻近。如前所述,特定标记之间的相互作用可以产生独特的可检测信号。例如,当靶标和探针上的标记分别是可以参与荧光共振能量转移(FRET)现象的荧光供体和受体部分时,可以检测到FRET信号增强或信号猝灭。
在一些情况下,可以在本文公开的方法中制造高密度寡核苷酸特征和阵列。例如,可以利用3’→5’方向方案(例如亚磷酰胺化学)中的寡核苷酸合成来在供体基底上产生3’→5’方向上的序列,其中“全长”序列最终的5’末端单元可包含用于进一步化学反应的反应性基团。然后,仅将供体基底上的“全长”序列整体转移到聚丙烯酰胺水凝胶涂层的受体基底上,导致“全长”序列固定在聚丙烯酰胺水凝胶上,探针朝向反转(5’附接)并完全保留了来自供体基底上的最初阵列的序列的空间排列。这种DNA测序阵列的可能应用可以用作基于延伸的基因分型阵列和通过合成的最小测序。产生这种高密度DNA测序阵列的能力将使具有独特功能的新一代高密度光刻阵列成为可能,从而可以开发新的应用来利用DNA酶的高度特异性生物化学。
图1A-1F示出了该方法的示例方案。首先(图1A),可将可切割的硅烷,例如3-(甲基(3-(三甲氧基甲硅烷基)丙基)氨基)丙酸2-羟基乙酯施加到硅基底(显示为Si晶片(供体))上,并且可以使用并入了通用可切割的接头(例如,图6A、6B或6C所示的亚磷酰胺)的DMT阻断化学法合成多聚胸苷酸(poly-(T))序列。这种通用的亚磷酰胺试剂可在AMChemicals,Oceanside,CA购买。可变区域寡核苷酸可以使用光解阻断化学以3’→5’的方式应用于微阵列,且如其他地方所描述,以创建在特定位置具有已知DNA序列的图案化结构(GlennMcGall,“The Efficiency of Light-Directed Synthesis of DNA Arrays on GlassSubstrates,”JACS,119(22):5081-5090,(1997))以产生探针序列(在图1中表示为AM1)。在一些情况下,可以用photoamidite然后加入Acrydite部分将合成的最后一个亚酰胺(amidite)图案化(图1A)。在一些情况下,合成中在AM1序列的5’末端添加到亚酰胺图案中的最后一个亚酰胺可以是Acrydite。在一些情况下,为了证明高分辨率的效果,在添加丙烯酰胺基之前可以使用光刻胶图案化DMT。
对于受体晶片(图1B),可以通过硅烷化将受体晶片的表面修饰为包括丙烯酰胺基团。在一些情况下,可以在水中制备丙烯酰胺预凝胶聚合溶液,并将其快速施加到第一基底(受体晶片或供体晶片)上,然后立即将第二基底反转到第一基底上的溶液之上。在一些情况下,可以将在水中制备的丙烯酰胺单体溶液施加到供体晶片上,同时可以立即反转受体晶片并置于顶部以形成夹心结构(图1C)。不受本文公开的任何工作原理的限制,毛细作用力可以使聚合溶液(即单体溶液)均匀分布以覆盖单个模具或晶片(例如,直径为6英寸的晶片),从而形成如图1C所示的“夹心结构”。在一些情况下,聚合可以持续60分钟以上,从而通过如此形成的水凝胶共价连接两个晶片。在一些情况下,可以允许结合两个基底(例如,图1C中的供体和受体晶片)的聚合条件持续约20至约60分钟。
在小块(约1厘米的块)的情况下,可以将基底浸入浓氨水中以切割UCL,其中两个晶片块可能需要10到18个小时才能分开。对于较大的基底(例如,六英寸晶片),可以任选地加入或需要另一步骤,例如,沿着切割道使夹心结构基底经历机械切割过程或激光穿孔过程(图1D、图1E)以通过用碱(例如氨水)处理分离两个基底。例如,激光穿孔方法可以在非常短的时间内将激光能量聚焦到基底的微小区域上,从而升华和蒸发固体。图1D示出了受体晶片可以被机械切割或被激光穿孔。切割或穿孔的块的长度或直径的尺寸可以是约5mm、6mm、7mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm或15mm。图1E描述了例如在暴露于浓氨(例如,水中28-33%的氨,也称为氢氧化铵)之后,例如在搅拌下约18小时,可以去除和从受体基底(例如,石英晶片)释放切割或穿孔的供体基底(例如,硅晶片)。对于尚未切割或穿孔的较小的供体基底,用浓氨水进行类似处理也可以通过UCL部分的碱性水解来去除和释放受体基底。
在一些情况下,当进行机械切割时,可将夹心结构晶片安装在切割胶带(来自Nitto,Teaneck,NJ的DU-300)上,并可将顶部晶片(供体晶片)切割成7.5mm×7.5mm平方(芯片)。使用的工具是DISCO 2H6T划片机,主轴速度约26,000rpm,进料速度约1mm/s,使用约0.3mm宽度的树脂粘结金刚石刀片(Thermocarbon,Casselberry,FL)。切割深度约为0.715mm,可以切穿顶部晶片(供体晶片)并刚好接触底部晶片(受体晶片)。
在一些情况下,可以通过或使用Potomac Photonics,Inc.(Baltimore MD)的方案进行激光穿孔。可以以1.75mm的间隔对顶部晶片(供体晶片、硅晶片)面向激光的6英寸夹心结构晶片穿孔,从而定义7.5mm×7.5mm芯片。估计的孔直径可以为约0.2mm。该方法中底部晶片(受体晶片)可以是对激光(Nd:YAG,波长1064nm)透明的石英材料,从而使穿孔过程在石英晶片界面处停止(在穿过供体硅晶片钻孔之后)。该过程可能花费约45分钟来制作约6000个覆盖整个晶片表面的孔。
释放供体基底后,可随之将供体晶片浸入氨水中至少3小时和/或浸入1:1乙二胺(EDA):水混合物中约1至约3个小时,以完成脱保护并确保将通用可切割的接头(UCL)切割以露出3’羟基(即,将UCL切割以露出DNA序列上的3’羟基基团)。然后可以用水然后是4×盐水-柠檬酸钠(SSC)缓冲液漂洗晶片,以备进一步分析和/或反应(图1F)。
以下测试可以表明,所合成的寡核苷酸以高保真度转移至涂有凝胶的受体晶片上。当一个实例表明使用上述方法可以将供体基底上的寡核苷酸或DNA序列以良好的保真度转移到受体基底上的凝胶中,可以使用DMT化学法在2英寸×3英寸供体基底上合成20-聚体(5’TACGATTCAGCCGATACAGC3’,AM1)。接下来,可以将四个DMT-胸腺嘧啶残基添加到20-聚体的5’末端,然后可以添加具有光活化阻断基团(光T)的胸腺嘧啶亚磷酰胺。最后,可以通过分辨率测试图案掩模(例如,Centrillion分辨率测试图案或RTP)通过UV曝光选择性地使光-T反应,然后通过暴露的羟基可以将丙烯酰胺基亚磷酰胺(ACRYDITE
如本文所用,光核苷亚磷酰胺或photoamidite,包括光-T,可以是核苷类似物/试剂,其包含(i)核苷上例如5’羟基上的光敏保护基团,和(ii)3’羟基上的亚磷酰胺部分,如下所示:
其中:
R
R
m为0或1;
n为0或1;
B为受保护的核酸杂环碱基:A
A为腺嘌呤;
C为胞嘧啶;
G为鸟嘌呤;
T为胸腺嘧啶;
U为尿嘧啶;和
pg独立地为杂环碱基A、C、G、T或U的环外氮原子上的一个或多个保护基团。
UCL可以是在寡核苷酸合成过程中不具有反应性的分子,但在寡核苷酸合成完成后可以具有反应性以释放游离的3’-OH末端。通用可切割的接头(UCL)的选择可以包括但不限于图6A、图6B和图6C所示的分子。可以在多聚胸苷酸序列与合成的3’至5’朝向的寡核苷酸之间插入多个UCL。
为了验证寡核苷酸是否成功转移到凝胶中,将荧光标记的AM1序列互补体杂交并以10×放大倍率成像(图2A)。分辨率测试图案掩模的视场为5.5mm,视场之间为500μm。如图所示,在7.5mm块上保持了特征保真度和杂交信号强度。图2B示出了图2A的插图,表明转移后实现的空间分辨率很高,具有如图所示的3-4μm线和间隔图案。最后,为了证明该过程与所有微阵列制造要求均兼容,通过photoamidite法使用可切割的硅烷、两个UCL和AM1序列合成了的完整的6英寸晶片(图2C)。沿着供体晶片的切割道的激光穿孔可以促进氨水向被可切割的硅烷修饰的晶片区域的质量转移。凝胶转移后,很容易识别3微米和8微米的特征,这表明整个过程可以扩大规模。这些结果表明,可以将高度有序的寡核苷酸阵列以相关的模具几何形状转移到涂有水凝胶的受体晶片中,同时保持高空间图案保真度。氨水通过聚合水凝胶的扩散显然足以使在光定义序列以下合成的部分发生化学切割,并且所用的化学法与商业微阵列制造技术兼容。
凝胶上的探针可以与在5’末端标记有Cy3(QCAM1、IDT、Coralville、IA)的所合成的AM1的互补体杂交,并以10×放大倍率成像,如图2A所示。Centrillion RTP的视场为5.5mm,视场之间为0.5mm。如图2A所示,在所示的约7.5mm块上可以保持特征保真度和信号。
在一些情况下,DMT化学法可能与基于光刻的微阵列探针合成不兼容,因为如果没有特殊的光刻胶过程或其他空间受限的去阻断过程,则可能无法光解定义每个碱基。在另一个实例中,可以用上述的AM1合成和RTP制备供体基底/晶片,但是这次是在具有可切割的硅烷的石英基底上,并且可以通过photoamidite法将所有活性碱基添加到生长的DNA序列中。在凝胶转移并与荧光标记的互补体杂交后,本实验的结果可以与使用DMT化学法时的结果相似或基本相同。空间分辨率可以很高,约为3-4μm线和间隔(L/S)图案。
在一些情况下,为了完全确保该过程与所有微阵列制造要求兼容,可以使用photoamidite法使用可切割的硅烷、UCL和AM1序列合成来自Centrillion试点产品线(PaloAlto,CA)的完整6英寸晶片。杂交结果可以与使用AMT化学法时的结果相似或基本相同。晶片规模转移的可行性研究可以表明晶片规模转移是可行的。结果可以证明,寡核苷酸可以从固体供体晶片转移到受体晶片上,并使用上述过程放置到相关的模具几何形状的各种尺寸的晶片块上的丙烯酰胺凝胶上。可以证明氨水通过聚合夹心结构的扩散足以支持在光定义序列以下合成的部分的化学切割,并且所用的化学法与用于微阵列制造的必需亚磷酰胺化学法相容,如通过互补序列杂交所检测到的。
由于转移的寡核苷酸是3’向上的,具有可用的羟基,因此它们可以响应各种聚合酶延伸反应。例如,可以在使用上述方法合成的6英寸晶片的部分上使用
为了进一步证实反转寡核苷酸的存在,并展示3’向上的探对于多种聚合酶将是成功的,进行了Centrillion Hero2延伸测定(图3B)。在这种情况下,所有4种碱基都可标记,并可以基于杂交的模板寡核苷酸(图3B中所示的序列)用于酶催化的延伸反应,并且双脱氧核苷酸的存在确保了本实验仅添加单个碱基。图3B示出了在所有4种碱基的存在下,来自标记的A的Hero聚合酶延伸的Cy3标记的延伸的核苷酸的荧光图像。高“A”强度和清晰的阴性对照(除了由于过滤器组而导致的少量C渗出,其他碱基均未插入)可证明该方法按预期工作,并提供了在凝胶反转的寡核苷酸上的3’羟基的可用性的证据,因为在不匹配碱基的情况下没有发现延伸。图3A和3B的这些结果可以证明,最初合成为5’向上朝向的寡核苷酸可以以3’向上朝向反转在丙烯酰胺凝胶上,并且可用于多种酶促反应。
最近,已提出将阵列制造与商业测序读出结合使用的阵列。在这些情况和其他潜在的应用中,可能需要高分辨率打印。例如,通过将在阵列上图案化的独特寡核苷酸原位附接在感兴趣的样品上,可以使用阵列来阐明生物分子的位置信息;然后使用商业测序读出分析结果。在这些情况下,生物分子的空间分辨率自然地受限于可以被图案化到给定区域中的独特特征的数量。因此,光刻图案化特征的亚微米分辨率对于阵列制造可能是重要的。但是,DMT化学法与基于光刻的微阵列探针合成不直接兼容,因为没有特殊的光刻胶过程或其他空间受限的去阻断过程,无法光解定义每个碱基。
为了测试上述凝胶反转过程的分辨率,可以像之前一样将Centrillion光刻胶涂覆到具有AM1探针第二晶片上,但是这次是在具有可切割的硅烷的石英基底上,以便展现高空间分辨率。通过photoamidite法曝光所有活性碱基。在该实验中,DMT化学法可用于合成20-聚体序列,并可以添加在列荧光素标记(6-FAM,Glen Research)。所合成的5’末端的最后一个T上可以保留DMT基团,并且可以使用Centrillion光刻胶成像,该光刻胶在聚合物基底中使用光致酸产生剂化学法在空间上对保护基团进行去阻断。凝胶转移可以如前所述进行,其中供体基底块在约18小时内浮起并在碱性溶液中与受体基底分离。图4显示了该实验结果的荧光图像。1.0μm线和间隔图案可以解析到成像工具(Keyence显微镜,40x,NA0.6)的极限,表明来自凝胶反转过程的横向“模糊”可能或主要与合成的寡核苷酸的分子长度相关。
3’向上的微阵列可以成为酶促测定的多功能工具。照此,以上所示的两个聚合酶催化的反应(图3A和3B)可以表明3’羟基可用于标记的碱基延伸测定。其他酶促反应可以通过使用芯片上的可逆终止子进行测序,进一步表明3’向上的羟基形式的效用,并且可以表明芯片在酶活性、选择性和未来潜在测定开发方面的多功能性。图5A-图5D示出了根据美国专利申请号2016/0355541A1和国际专利申请号WO 2016/182984使用Centrillion的可逆终止子化学法进行两碱基延伸的结果,所有这些申请都通过引用并入本文,用于所有目的。在图5A和图5B中,可以在其他标记的碱基存在下添加正确的碱基(胞嘧啶)。3’羟基上的标记和终止子(阻断基团)切割后,在第二轮延伸中可以用具有标记的可逆终止子添加第二碱基(如图5C和图5D所示)。在第二轮延伸中,第二碱基(腺苷)的正确掺入可以在图5C和图5D中示出。该芯片可用于核酸的芯片上测序。
成功制造和转移产生的3’向上的寡核苷酸可以产生可用于聚合酶催化的延伸反应的寡核苷酸,并且上述结果可以证明良好的延伸效率和探针保真度。在所使用的检测方法的极限内,似乎可以发现,只要可以从产品晶片(受体基底)上化学切割牺牲晶片(供体基底),就不会发现来自凝胶反转过程的横向位移模糊。
使用在受体基底上的凝胶进行自由基聚合后控制从供体基底释放结合的寡核苷酸的能力可能是有利的。在凝胶形成之前释放可能会导致探针和/或位置保真度丢失。在一些情况下,如果在从受体基底上完全化学释放之前尝试物理去除供体晶片,则可以在边缘发现高特征保真度,但是可以在中心发现保真度和信号差,表明在凝胶中或者可能在合成的DNA中途可能发生物理断裂。相反,在凝胶形成后可切割部分的完全释放可以在整个芯片/晶片上提供良好的信号和特征保真度。聚合后的化学释放可能会带来实质性的质量转移问题,即如何使化学试剂到达界面进行释放。
认识到与供体基底从受体基底释放的时间有关的问题,在一些情况下,可以在将“夹心结构”浸入氨水或其他切割试剂之前引入沿切割道的激光穿孔。不受本文公开的任何理论的束缚,在基底之间的水凝胶的存在可以引起菲克扩散,这是使得用于切割的浓缩的碱基从芯片/晶片/模具的边缘到达芯片/晶片/模具的内部部分(例如中心)的主要机制之一。在水中D=1.64x10
根据反转的3’向上的寡核苷酸(在受体晶片上)与所合成的5’向上的寡核苷酸(在供体晶片上)的荧光杂交信号的比较,可以估计可以转移超过50%的全长合成寡核苷酸。这可以与选择在聚合过程中使一些、大多数或所有单体反应的聚合条件相一致。尽管在使用杂交方法确认5’向上的转移寡核苷酸的存在时可能不知道转移寡核苷酸的确切数量,即使与类似处理的晶片上的5’向上的寡核苷酸相比,检测到的杂交信号在凝胶上的范围可能在60-100%之间。杂交方法可能并不精确,因为来自非一体合成层产量的许多短的加帽序列没有转移到凝胶中,因为它们没有获得丙烯酰胺单体部分,因此降低了转移的寡核苷酸的总电荷场。同样,在此范围内,杂交产量可能与表面寡核苷酸浓度成反比。即使转移了50%的寡核苷酸,由于杂交效率的提高,也有可能检测到类似的杂交计量学信号。然而,由于杂交可能是许多下游测定中的起始步骤,因此信号与类似合成的5’向上一样高或更高的事实对于本发明是有利的。
总而言之,可以使用本文所述的方法获得转移的寡核苷酸的反转,并且可以从3种不同的聚合酶催化的反转寡核苷酸的延伸测定中获得优异的结果。可以实现这种反转,同时保留微阵列工作所需的高空间分辨率(photoamidite合成需要约3μm),甚至还可以展示使用商业测序仪的潜在读出所需的1um横向分辨率。这种用于制造DNA测序阵列的反转方法是扩展DNA阵列的适用性并为其提供新应用的强大工具,并且具有实现诸如DNA存储等未来应用的潜力。
这种可将阵列图案化到水凝胶中并具有3’向上构型的寡核苷酸的新型光刻DNA微阵列可以具有许多优势。例如,该阵列可以具有更少的测序错误,并且可以通过聚合酶添加更多的寡核苷酸,从而有效地允许将各种各样的基底序列编程到系统中,以用于将来的应用开发。该制造策略可以与用于合成微阵列的现有机器和工具兼容,制造起来相对便宜,并且可扩展至六英寸晶片加工。凝胶中阵列的位置保真度可以很高,并且合成可以与光致酸产生剂化学法整合以产生亚微米范围内的特征。聚合酶和限制性核酸内切酶测定可以显示,图案化的寡核苷酸可以充当不同酶的基底,并且通过合成测序证明了该阵列具有更多异源基底(如荧光可逆终止子)的实用性。该制造过程可以成为扩展DNA微阵列适用性的强大工具,从而有可能实现诸如通过基于芯片的条形码构建基因组测序文库和基于索引DNA的数据存储之类的应用。
在一些实施方案中,基底的表面处理可包括将寡胸苷基团共价结合至基底。在一些实施方案中,由此连接至表面的寡胸苷基团可包含2、3、4、5、6、7、8、9、10、11、12、13、14、15或更多个胸苷核苷酸。在一些实施方案中,寡胸苷基团可包含5个胸苷核苷酸。在一些实施方案中,寡胸苷基团的游离5’羟基可与支链接头亚磷酰胺反应并可以共价附接于其上。
表面清洁和处理后,试剂可与表面羟基或氨基反应。例如,该表面可以通过反应性基团例如羟基基团与可切割的接头(CL)亚磷酰胺反应。可切割的接头(CL)亚磷酰胺包括例如作为通用可切割的接头(UCL)亚磷酰胺。可切割的接头亚磷酰胺的选择可包括但不限于图6所示的分子。如本文所用,术语可切割的接头或CL(包括UCL)通常是指以下任一种:可切割的接头亚磷酰胺试剂,在添加核苷酸之前与表面结合的可切割的接头和在添加核苷酸之后与表面结合的支链接头。可切割的接头亚磷酰胺可以使用具有一些修饰的标准DNA合成方案与基底反应,包括例如向DNA合成基底中添加可切割的接头试剂,增加偶联时间(例如,3分钟)等。在一些实施方案中,可切割的接头亚磷酰胺可与游离的羟基反应。在一些实施方案中,可切割的接头可以包含被DMT保护的羟基基团。在一些实施方案中,可切割的接头可以包含被DMT保护的伯羟基基团。
然后可以根据标准DNA合成仪方案在基底上合成DNA序列,在核酸添加的每个步骤之后都安装一个加帽步骤,以阻断未反应的游离3’羟基,使截短的序列不会继续DNA链伸长。加帽可以通过用乙酰化试剂处理来实现。
在最终加帽步骤之后,带有亚磷酰胺的反应性基团可以与全长DNA序列反应,但不能与5’末端截短的DNA序列反应。反应性基团可与凝胶固定在如前所述的供体和受体基底的夹心结构中。
在一些实施方案中,可切割的接头(或UCL)可例如通过与NH
在一些实施方案中,可切割的接头可以在碱性条件下进行切割以从其3’末端切割全长和截短的探针序列。由于事先固定(或与凝胶聚合)在全长探针序列的5’末端与受体基底上的凝胶之间提供了共价键,因此这些探针可以在受体基底的表面上反转为5’至3’方向。同时,可以从受体表面清除截短的探针序列,并且可以切断它们与供体基底的唯一附接,从而在洗涤后从两个基底中除去截短的探针序列。因此,在一些实施方案中,留在受体基底上的探针序列可以包含大部分具有5’至3’取向的全长探针序列。在一些实施方案中,当与探针反转步骤之前(即在供体基底上)的探针相比时,探针反转步骤可以增加所有探针序列中全长探针序列的百分比。
在本公开内容中公开的原位探针反转可以具有几个优点。在某些化学反应中,可以避免使用有毒试剂。另外,在DNA阵列合成后避免单独的切割步骤可以节省时间并在大规模应用时降低成本。去除合成步骤可以减少在DNA阵列制备过程中可能发生的操作错误。
当将合成探针(全长探针和截短探针)用碱性试剂(如NH
在一个实例中,受控的孔玻璃(CPG)珠可以用作合成基底,其与支化的接头和可切割的接头反应。然后可以在附接于基底的可切割接头上合成寡核苷酸探针,该接头在全长探针序列的5’末端包括一个反应性基团。
本文讨论的探针反转技术可以在水性介质中进行。避免使用有机溶剂可使这种技术对环境更加友好,并增加化学处理和废物处置的便利性。
本文讨论的探针反转技术可以在至少约0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0或13.5的pH下进行。本文讨论的探针反转技术可以在至多约14.0、13.5、13.0、12.5、12.0、11.5、11.0、10.5、10.0、9.5、9.0、8.5、8.0、7.5、7.0、6.5、6.0、5.5、5.0、4.5、4.0、3.5、3.0、2.5、2.0、1.5、1.0或0.5的pH下进行。本文讨论的探针反转技术可以在约0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0或13.5的pH下进行。在一些情况下,本文讨论的探针反转技术可以在或约生理pH,例如约7.365或约7.5下进行。在生理pH下进行反应可以减少或消除处理苛刻物质或反应条件的需要,并且可以使用水性介质。
本文讨论的探针反转技术可以在约15℃、20℃、25℃、30℃或35℃的温度下进行。本文讨论的探针反转技术可以在至多约15℃、20℃、25℃、30℃或35℃的温度下进行。本文讨论的探针反转技术可以在至少约15℃、20℃、25℃、30℃或35℃的温度下进行。在一些情况下,本文讨论的探针反转技术可以在或约室温下进行,例如约20℃、约21℃、约22℃、约23℃、约24℃、约25℃、约26℃、约20℃至约26℃或约20℃至约22℃。在室温下进行反应可以减少或消除处理苛刻物质或反应条件的需要。
释放截短的探针序列可以增加阵列中存在的全长序列的百分比。在一些情况下,在探针反转过程后仍与阵列基底结合的探针中至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%、99.9%、99.99%或99.999%是全长序列。在一些情况下,探针反转过程可以释放至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%、99.9%、99.99%或99.999%的在探针反转过程之前与阵列基底结合的截短的探针。
合成基底可以包括不同的形式或形状,例如珠子或平面阵列。合成基底可以包括任何合适的材料,包括但不限于玻璃(例如,受控的孔玻璃)、硅或塑料。基底可包含聚合物涂层或凝胶,例如聚丙烯酰胺凝胶或PDMS凝胶。凝胶和涂层可以另外包含用于改变其物理化学性质例如疏水性的组分。例如,聚丙烯酰胺凝胶或涂层可以在其聚合物结构中包含修饰的丙烯酰胺单体,如乙氧基化的丙烯酰胺单体、磷酰胆碱丙烯酰胺单体、甜菜碱丙烯酰胺单体和其任何组合。
对于各种应用,与标准的非反转探针相比,反转探针可以提供许多优势。例如,如上所述,探针反转可以去除大部分或全部不希望的截短的探针序列,从而提供了包含高达100%全长探针序列的反转探针群体。另外,反转探针可以具有游离的3’OH基团,这对进行酶促反应(例如,单个或多个碱基延伸、连接酶反应等)有利。反转探针还可用于合成测序(SBS)过程及其他应用。
实施例
可切割的硅烷合成
3-(甲基(3-(三甲氧基甲硅烷基)丙基)氨基)丙酸2-羟基乙酯的合成如下。将N-甲基-3-(三甲氧基甲硅烷基)丙-1-胺在氮气下在冰浴中搅拌下冷却。在搅拌下在30分钟内滴加丙烯酸2-羟基乙酯(HEA),并将反应在室温(RT)下在氮气下搅拌24小时,并且不稀释地保存。
用
如文献所述利用photoamidite(即光-T)并曝光。参见McGall G.H.,ChristiansF.C.(2002)High-Density Gene Chip Oligonucleotide Probe Arrays.In:Hoheisel J.等人(编辑)Chip Technology.Advances in Biochemical Engineering/Biotechnology,第77卷,21-42.Springer,Berlin,Heidelberg。晶片具有5个二甲氧基三苯甲基阻断的胸腺嘧啶(DMT-T’s),其被放置在底部或靠近或位于基底的表面,并在加入一个或两个通用可切割的接头(UCL,AM Chemicals,P/N 02120,Oceanside,CA)的可切割部分之前均匀地横跨晶片。然后按照3’->5’的方向合成感兴趣的序列。完成感兴趣的序列后,再放置4个DMT-T,然后对最后一个感兴趣的T(或为光-T,或在高分辨率展示的情况下为具有光刻胶的DMT-T)图案化,然后添加ACRYDITE
除非另有说明,否则将具有交联块的晶片“夹心结构”置于浓氨水中18小时。对于完整的6英寸晶片凝胶转移,将约300μl的聚合混合物施加到合成后的5’向上的牺牲晶片上,并将石英基底放在顶部,因此可以观察到聚合混合物的芯吸作用。在一些情况下,当将2英寸×3英寸基底切成8-10mm的块并反转时,牺牲晶片可能会由于来自轨道振荡器的溶液运动而从凝胶上浮起来。如果没有使用完整的释放化学物质,要么是由于生产晶片的兼容性问题,要么是由于尚不清楚所需的可切割部分的水平的早期实验,则可能需要轻轻地轻推。将晶片夹心结构放在氨水中,直到释放出来,然后再施加乙二胺:水(50:50,AldrichMilwaukee,WI)溶液1-3小时,以完成脱保护并确保将UCL完全还原为3’OH。
然后用水洗涤凝胶晶片,随后用4×SSC缓冲液(Aldrich)洗涤,并准备进行杂交。用25nM的互补序列进行杂交,在5’末端用Cy3(IDT,Coralville,IA)标记,在45℃下过夜,然后冷却1小时以上。将凝胶晶片在4×SSC中洗涤3次,最后一次在洗涤溶液中保持至少5分钟,然后在荧光显微镜(Keyence BZ-X710 Itasca,IL)上成像。
从IDT订购84个碱基的模板寡核苷酸5’CTGTCTCTTATACACATCTGAGCTGAATTCATAACTTCGTATAGCATACATTATACGAAGTTATGCTGTATCGGCTGAATCGTA,并在45℃的2×SSC缓冲液中与反转阵列杂交2小时。然后将阵列在1×SSC缓冲液中于RT洗涤15分钟,然后再于0.5×SSC中各自在RT下两次洗涤15分钟。使用DNA聚合酶Klenow Large Fragment(New EnglandBiolabs,Ipswitch,MA)在标准条件下于37℃延伸1小时。然后将阵列在1×SSC中洗涤,并在振摇下浸入0.2N NaOH溶液中10分钟,以去除模板寡核苷酸,最后用5ml的1×SSC平衡。然后将靶向镶嵌末端序列的Cy3标记探针与阵列杂交,并像以前一样洗涤,然后在Keyence BZ-X710上成像。
为了展示高分辨率,在2英寸×3英寸的基底上制备了AM1寡核苷酸(5’TACGATTCAGCCGATACAGC3’),不同之处在于线上添加6-荧光素亚磷酰胺(6-FAM,GlenResearch),并且光-T被DMT-T取代,而DMT基团组保持完整。将晶片用Centrillion光刻胶(Centrillion Technologies,Inc.,Palo Alto,CA)以2500rpm旋涂1分钟,在对流烘箱中于50℃烘烤5分钟,以36mJ/cm
AM1序列(5’TACGATTCAGCCGATACAGC3’)在芯片上用ABI 394DNA合成仪5’向上用图案化的Acrydite合成,然后像之前一样反转到凝胶上,最后在8×SSC中进行30分钟的RT洗涤。序列GAAGAGAGGTAGTAATCATGGCTCTATCGGCTGAATCGTA/3ddC/1μm在35℃下于8×SSC中杂交,在30分钟内移至RT并洗涤。延伸发生在所有四种碱基存在、3种荧光标记且带有可逆终止子的情况下。第一碱基加入了荧光预混液(FLMM),并在3个通道中成像以表明正确的碱基加入。用未标记的可逆终止子完成延伸,切割并成像以验证荧光的损失。然后,使用带有FLMM的第二碱基重复该过程并成像。
由于转移寡核苷酸是3’向上的并具有反应性羟基,因此它们可以响应聚合酶延伸反应。为了展示将含有AM1反向互补体的84个碱基的模板寡核苷酸5’CTGTCTCTTATACACATCTGAGCTGAATTCATAACTTCGTATAGCATACATTATACGAAGTTATGCTGTATCGGCTGAATCGT与阵列杂交,并用Klenow DNA聚合酶进行延伸(图7A)。延伸后,将模板寡核苷酸用NaOH剥离,将阵列在SSC缓冲液中洗涤,最后将阵列与新延伸的分子3’末端的最后20个碱基互补的探针杂交。图7B示出了荧光探针与阵列的新合成区域杂交的结果。可以很容易地观察到分辨率测试图案,表明通过酶催化的延伸反应可将64个碱基有效地添加到阵列上的寡核苷酸的3’末端
将长模板DNA序列复制到密集图案化阵列3’末端的能力是所公开平台的另一个优势和出乎意料的结果。这种能力可以同时使分子复杂度大量添加到阵列上的所有特征上。作为示例,在图7A-图7D中使用的模板寡核苷酸经设计编码:1)用于阵列和任何floxed DNA靶标之间Cre介导重组的经典LoxP序列;2)EcorI限制序列;3)AluI限制序列;4)被Tn5转座酶识别的19个碱基的镶嵌末端序列。由于聚合酶反应在该系统中起作用,因此可以以单链或双链构型构建阵列。已显示EcorI和AluI均可切割单链和双链DNA,在此示例中,研究人员可以根据需要选择生成粘性或平阵列末端。同时,Tn5转座酶已用于在水凝胶表面上构建基因组DNA测序文库,其中镶嵌末端寡核苷酸随机分布在凝胶中。在给定最终分子的长度的情况下,使用标准的亚磷酰胺化学法可能无法用光刻技术合成具有这么多序列基序的阵列。相反,通过仅使用本公开内容的来自转移的3’向上的寡核苷酸,然后通过聚合酶延伸3’寡核苷酸,可以产生所述寡核苷酸的无错误或基本上无错误的微阵列。
为了证明反转并延伸的阵列可以用作聚合酶以外的酶的底物,将从图7B得到的阵列(图7B中使用的荧光探针仍然与3’向上的寡核苷酸杂交)在37℃下暴露于限制性酶EcorI中1小时。然后成像时,几乎无法检测到模板图案(如图3C中所示),说明添加的酶在识别序列上进行了内部切割,将3’Alu1和镶嵌末端序列与杂交的荧光探针一起释放出来(图7C)。
为了确保切割是选择性的,而不是不是凝胶中阵列非特异性降解的结果,添加了第二个Cy3标记的探针,发现与原始AM1序列杂交(图7D)。由于在图7D中再次容易地观察到分辨率测试图案,可以得出结论,用EcorI消化对内部限制序列是特异性的,保留了切段的Acrydite注册序列5’完整。
虽然本文已经显示和描述了本发明优选的实施方案,但是对于本领域技术人员而言显然这些实施方案仅仅是作为示例提供的。本领域技术人员在不偏离本发明的前提下将会想到大量的变化、改变和替换。应当理解,在本发明的实践中可以使用本文描述的本发明实施方案的各种替代方案。以下权利要求旨在限定本发明的范围,由此覆盖在这些权利要求的范围内的方法和结构及其等同物。
