RNA、DNA共建库测序方法及建库仪器
文献发布时间:2023-06-19 10:05:17
【技术领域】
本发明涉及基因测序文库技术领域,具体涉及一种RNA、DNA共建库测序方法及建库仪器。
【背景技术】
二代测序(NGS)、三代测序甚至是四代测序技术已经应用于检测诊断、科技研究等领域,但如何针对总核酸(DNA及RNA)建库测序也是目前的一大挑战。由于DNA和RNA的理化性质方面的差异,常规的基因测序技术只能针对单一核酸DNA或者RNA。相对而言,单一的DNA测序技术发展较为成熟,而RNA测序技术则相对复杂。DNA建库常见方法是双链建库,DNA经过末端补平,加A尾后通过连接的方法加上测序接头完成建库。RNA则是在测序前需要经过逆转录,形成一链cDNA,二链后类似双链DNA后再建库。如果需要对DNA及RNA同时进行检测,一般需要对DNA、RNA分别提取后,分别建库。
而DNA、RNA共同建库具有重要的诊断价值以及科研价值。通过DAN、RNA共同检测,可以节约样本,单一样本通过总核酸提取后,可以同时对DNA、RNA建库并获得两者遗传信息,因此可以达到节约样本的目的。另一方面,总核酸共同建库可以更加灵敏地获得遗传信息。例如在宏基因组(mNGS)检测中,可以同时检测DNA病毒及RNA病毒,提高了检测效率。在肿瘤检测中,如果同时检测DNA及RNA,不仅可以有效检测突变,插入/缺失突变(Indel)更可以在RNA水平检测出融合和基因跳跃,RNA表达差异等,临床意义巨大。虽然目前条件下,可以通过DNA测序技术,检测样本的融合状态,但存在检出率低下,探针消耗大成本较高等问题。在RNA水平检测融合,相对而言结果更准确直观,因此RNA测序技术以及DNA、RNA共测序成为目前技术攻坚对象。
【发明内容】
本发明的目的在于提出一种RNA、DNA共建库测序方法,以解决RNA和DNA混合物同时进行建库的问题。
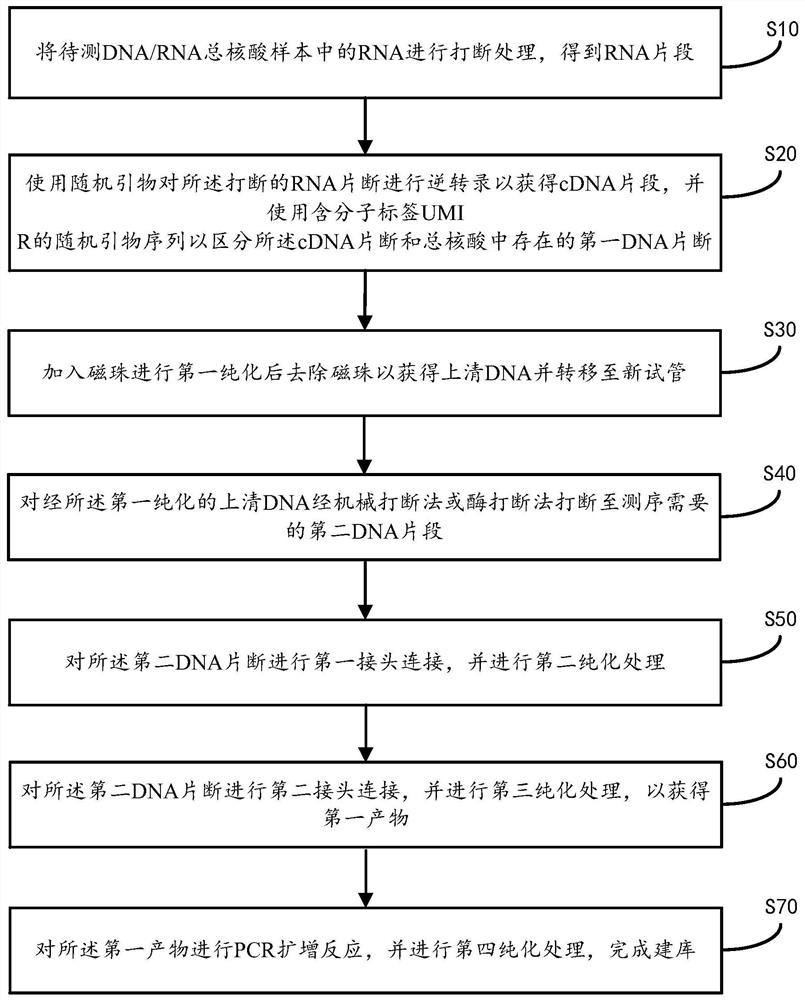
为实现上述目的,本发明提供一种RNA、DNA共建库测序方法,包括:
将待测DNA/RNA总核酸样本中的RNA进行打断处理,得到RNA片断;
使用随机引物对所述RNA片断进行逆转录以获得cDNA片段,优选的,可以使用含分子标签UMI R的随机引物序列标记RNA逆转录形成的cDNA片段,用以区分所述cDNA片断和总核酸中存在的第一DNA片断;
加入磁珠进行第一纯化后去除磁珠以获得上清DNA并转移至新试管;
对经所述第一纯化的上清DNA经机械打断法或酶打断法打断至测序需要的第二DNA片段;
对所述第二DNA片断进行第一接头连接,并进行第二纯化处理;
对所述第二DNA片断进行第二接头连接,并进行第三纯化处理,以获得第一产物;
对所述第一产物进行PCR扩增反应,并进行第四纯化处理,完成建库。
进一步地,所述打断处理包括酶法打断、机械打断和化学离子打断法中任意一种或多种。
进一步地,所述含UMI R的随机引物序列结构为:
5’-NNNNNN’R6’-3’
其中,N是随机碱基,R6为固定分子标签。
进一步地,所述第一纯化处理为按照1:0.8-1:2.5比例加入纯化磁珠进行洗涤纯化,在80%乙醇洗涤之后晾干直接加入去离子水,去除磁珠获得上清DNA转移至新试管中。
进一步地,所述第二DNA片段长度为100-400bp。
进一步地,所述第一接头连接是在同一反应管的DNA混合物中加入T4 DNA连接酶和第一接头,加入连接缓冲液,加水补足体积后反应完成。
进一步地,所述第二接头连接是在同一反应管的DNA混合物中加入T4 DNA连接酶和第二接头,加入连接缓冲液,加水补足体积后反应完成。
进一步地,所述第二纯化处理和第三纯化处理均为按照1:0.8-1:2.5比例加入纯化磁珠进行洗涤纯化,在80%乙醇洗涤之后晾干直接加入去离子水,去除磁珠获得上清DNA转移至新试管中。
进一步地,所述第四纯化处理为按照1:0.8-1:2.5比例加入纯化磁珠进行洗涤纯化,在80%乙醇洗涤之后晾干直接加入去离子水,经进一步纯化后去除磁珠。
同时,本发明还提供一种建库仪器,所述建库仪器包括如上所述的RNA、DNA共建库测序方法。
与现有技术相比,本发明提供的RNA、DNA共建库测序方法及建库仪器,实现同时对DNA、RNA进行建库,提高了样本使用效率以及建库效率;避免了对DNA、RNA分别建库,进而避免了耗材浪费,降低了成本,节约了时间;同时,提供的RNA、DNA共建库测序方法及建库仪器,应用于宏基因组学测序、肿瘤突变基因、融合基因等异常突变检测时,可以获得更全面的遗传信息。
【附图说明】
图1为本发明实施例一提供的RNA、DNA共建库测序方法的流程示意图;
图2为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及30ng Tru-Q 7(1.3%Tier)Reference Standard DNA共同建库文库的检测效果图;
图3为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及30ng Tru-Q 7(1.3%Tier)Reference Standard DNA共同建库中RNA融合基因检测结果;
图4为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及30ng Tru-Q 7(1.3%Tier)Reference Standard DNA共同建库DNA突变基因检测结果;
图5为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及40ng 0.1%cfDNA reference Standard(HD780)共同建库的检测效果图;
图6为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及40ng 0.1%cfDNA reference Standard(HD780)共同建库RNA融合检测结果;
图7为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及40ng 0.1%cfDNA reference Standard(HD780)共同建库DNA突变检测结果。
【具体实施方式】
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
需要理解的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。
本发明实施例是基于illumina平台以及平台设计,但不限于illumina平台,其余测序平台,方法通用。
本发明实施例中提供的基于illumina平台的接头序列如表1所示:
表1:
其中,X6/Y6分别是I5端I7端Index。
本发明实施例中提供的基于MGI平台的接头序列如表2所示:
表2:
N是随机碱基,N个数为2-25之间,可选的带分子标签的接头以区分模板。A1-2、A2-1序列也可以进行优化缩短。对应的A1-1及A2-2也缩短对应长度。其中,表2中“#”代表一种修饰,可以阻止进一步延伸或者连接,可以是SpacerC3,FAM,HEX,AMN等修饰中的一种或多种。
以上A1-1与A1-2退火配对,形成接头A1 adaptor。A2-1与A2-2退火配对,形成接头A2 adaptor。两种接头浓度均为1μM-100μM,存储于-20℃冰箱。
实施例一:
请参阅图1,本发明实施例一提供一种RNA、DNA共建库测序方法,所述方法包括:
步骤S10:将待测DNA/RNA总核酸样本中的RNA进行打断处理,得到RNA片段;具体地,所述随机打断包括酶法打断、机械打断和化学离子打断法中任意一种或多种。具体在本实施例一中,使用Mg
步骤S20:使用随机引物对所述RNA片断进行逆转录以获得cDNA片段,并使用含分子标签UMI R的随机引物序列以区分所述cDNA片断和总核酸中存在的第一DNA片断;由于打断法已经破坏了RNA的完整结构,无法特异性针对mRNA进行转录,本实施例中使用随机引物进行逆转录,具体的反应体系包括:1-500ng RNA,50-250U Reverse Transcriptase,BSA0.05-0.5μg,Tris-SO
为了区分逆转录形成的cDNA和总核酸中存在的DNA,优选地加入分子标签。在逆转录过程中可以使用含分子标签R(UMI R)的随机引物序列,其中,UMI R表示分子标签(Unique Molecular Identifier,UMI)。含UMI R的随机引物序列结构为:
5’-NNNNNN’R6’-3’
其中,N是随机碱基,R6为固定序列充当分子标签。碱基数量可以根据具体实验要求进行调整。
具体地,实施例一中使用到的部分分子标签如表3所示:
表3:
并按照表4的反应温度和反应时间进行:
表4:
步骤S30:加入磁珠进行第一纯化后去除磁珠以获得上清DNA并转移至新试管;在同一反应管中按照1:0.8-1:2.5比例加入AMPure XP(Beckman Coulter)磁珠或同等纯化磁珠进行纯化。在80%乙醇洗涤之后晾干直接加入去离子水,去除磁珠获得上清DNA转移至新试管中。优选的可以95℃反应5分钟。
步骤S40:对经所述第一纯化的上清DNA经机械打断法或酶打断法或离子打断法打断至测序需要的第二DNA片段;将经过第一纯化的上清DNA经机械打断法或酶打断法打断至测序需要的片段,对于二代测序平台,DNA片段为100-400bp。针对液态活检,肿瘤循环DNA的长度在167bp左右,无需额外打断处理。
步骤S50:对所述第二DNA片断进行第一接头连接,并进行第二纯化处理;具体地,第二DNA片断经过多聚核苷酸激酶(Polynucleotide Kinase,PNK)于37℃反应15分钟,再加热到95℃反应5分钟。反应完成的DNA混合物立刻插入冰中孵育5分钟。
进行第一接头连接,在同一反应管的DNA混合物中加入T4 DNA连接酶和第一接头(终浓度:1-10uM);加入连接缓冲液,加水补足体积后反应,反应时间和温度根据连接酶反应条件设定。
并进行第二纯化处理,所述第二纯化处理为按照1:1-1:2.5比例加入纯化磁珠进行洗涤纯化,在80%乙醇洗涤之后晾干直接加入去离子水,去除磁珠获得上清DNA转移至新试管中。优选的也可保留磁珠进入下一个反应。具体在本实施例一中,在同一反应管中按照1:1-1:2.5比例加入AMPure XP(Beckman Coulter)磁珠或同等纯化磁珠进行纯化。在80%乙醇洗涤之后晾干直接加入去离子水,去除磁珠获得上清DNA转移至新试管中。优选的,在95℃反应5分钟。
步骤S60:对所述第二DNA片断进行第二接头连接,并进行第三纯化处理,以获得第一产物;具体地,在第二DNA片断中加入T4 DNA连接酶并加入第二接头(终浓度:1-10uM),加入连接缓冲液,加水补足体积后反应,反应时间和温度根据连接酶反应条件设定。
第三纯化处理为在同一反应管中按照1:1-1:2.5比例加入AMPure XP(BeckmanCoulter)磁珠或同等纯化磁珠进行纯化。在80%乙醇洗涤之后晾干直接加入去离子水,去除磁珠获得上清DNA转移至新试管中。优选的也可保留磁珠进入下一个反应。
步骤S70:对所述第一产物进行PCR扩增反应,并进行第四纯化处理,完成建库。具体地,在新试管中,按照PCR反应体系进行扩增,本环节中会引入illumina Index(I5/I7index)或者华大智造MGI Index(Ad153_PCR2_1/Ad153_PCR2_2)。
其反应阶段、温度、时间和循环数如下表5所示:
表5:
并进行第四纯化处理,所述第四纯化处理为按照1:0.8-1:2.5比例加入AMPure XP(BeckmanCoulter)磁珠或同等纯化磁珠进行纯化,在80%乙醇洗涤之后晾干直接加入去离子水,经进一步纯化后去除磁珠,得到产物可以进入下一步测序或捕获阶段。
实施例二:
本发明实施例二针对肺癌相关基因进行检测,其中ALK、NTRK、RET、ROS1等基因检测RNA融合以及突变检测,对BRAF、EGFR、ERBB2、KRAS、MET、NRAS等基因进行突变检测。使用illumina Novaseq平台测序。探针池(Panel)设计是针对以上基因的全外显子设计,采用美国Integrated DNA Technologies合成探针(其他等同探针也可),具体采用的IDT探针如下表6所示:
表6:
具体地,使用50ng ALK-RET-ROS1 Fusion FFPE RNA reference Standard(Horizon HD784)以及30ng Tru-Q 7(1.3%Tier)Reference Standard DNA(HorizonHD734)混合后进行建库。其中ALK-RET-ROS1Fusion FFPE RNA reference Standard是从FFPE样本中提取的RNA,是经人工修饰后形成的ALK-RET-ROS1融合,FFPE是福尔马林固定和石蜡包埋样本。Tru-Q 7(1.3%Tier)Reference Standard DNA是人工修饰的具有特定突变频率的基因组DNA。以上HD784及HD734两种标准品均来自于英国Horizon discovery公司。以上DNA、RNA混合后,先使用化学离子(Mg
打断完成的RNA直接添加逆转录酶及逆转录试剂,使用随机引物进行逆转录,按如下表7的反应程序进行逆转录反应:
表7:
逆转录完成生成的cDNA经1.8倍比例的AMPure XP磁珠纯化后,通过超声波DNA破碎仪(Covaris s220)机械打断DNA混合物。
经过PNK处理,加入PNK缓冲试剂。37℃处理15分钟,再加热到95℃反应5分钟。反应完成的DNA混合物立刻插入冰中孵育5分钟。
进行3’端接头连接,在同一反应管的DNA混合物中加入T4 DNA连接酶和A1接头,并加入快速连接缓冲液,加水补足后于20℃反应15分钟。
按照1:2比例加入AMPure XP磁珠进行纯化。加入去离子水溶解洗涤完的磁珠。在同一反应管的DNA混合物中加入T4 DNA连接酶和A2接头,并加入快速连接缓冲液,加水补足后于20℃反应15分钟。
使用1.2X Beckman Agencourt AMPure XP beads进行纯化,20μL ddH
表8:
使用1.2X Beckman Agencourt AMPure XP beads进行纯化,22μL ddH
根据IDT探针使用方法对完成建库的文库进行富集,再次经过扩增后进行质检。
质检及测序分析,使用安捷伦2100生物分析仪进行分析质控并测序,生信分析。
本发明也对RNA和循环肿瘤DNA混合物进行测试,50ng ALK-RET-ROS1 FusionFFPE RNA reference Standard(Horizon HD784)以及40ng 0.1%cfDNA referenceStandard(HD780)混合后进行建库。其中HD780模拟的是循环肿瘤DNA,长度集中在167bp左右,因此不需要打断。HD780也同样来自于Horizon Discovery公司。本次测试中使用的HD780系列中突变频率在0.1%的样本进行测试。本次测试基本步骤同以上HD 734与HD784混合物。因不需要另外打断处理DNA,因此在逆转录完成后,经纯化,直接PNK处理,其余步骤相同,在此不再赘述。
请一并参阅图2和图3,图4:
图2为本发明一实施例提供的ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及30ng Tru-Q 7(1.3%Tier)Reference Standard DNA共同建库文库大小分布图谱。经安捷伦2100生物分析仪1000芯片分析可知平均片段长度为324bp,产物分布范围较广,其中,bp是base pair的简称,即碱基对。
图3为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及30ng Tru-Q 7(1.3%Tier)Reference Standard DNA共同建库中RNA融合基因检测结果;用本发明建库方法结合探针捕获法得到的测序结果表明,该方法可以有效检出Horizon HD784的融合基因。
图4为本发明一实施例提供的ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及30ng Tru-Q 7(1.3%Tier)Reference Standard DNA共同建库DNA突变基因检测结果,用本发明建库方法结合探针捕获法得到的测序结果表明该方法可以有效检出Horizon HD734的突变。
请一并参阅图5,图6,图7:
图5为本发明一实施例提供的50ng ALK-RET-ROS1 Fusion FFPE RNA referenceStandard(Horizon HD784)以及40ng 0.1%cfDNA reference Standard(HD780)共同建库的检测效果图。经安捷伦2100生物分析仪1000芯片分析可知平均建库片段在284bp。
请参阅图6,图6为本发明一实施例提供的50ng ALK-RET-ROS1Fusion FFPE RNAreference Standard(Horizon HD784)以及40ng 0.1%cfDNA reference Standard(HD780)共同建库RNA融合检测结果。本方案可以有效检出与循环肿瘤DNA混合的RNA融合突变。
请参阅图7,图7为本发明一实施例提供的50ng ALK-RET-ROS1Fusion FFPE RNAreference Standard(Horizon HD784)以及40ng 0.1%cfDNA reference Standard(HD780)共同建库DNA突变检测结果。本方案可以有效检出与RNA混合的DNA突变情况。
同时,本发明还提供一种建库仪器,所述建库仪器包括如上所述的RNA、DNA共建库测序方法,所述建库仪器可自动化完成上述的RNA、DNA共建库测序方法。
与现有技术相比,本发明提供的RNA、DNA共建库测序方法及建库仪器,实现同时对DNA、RNA进行建库,提高了样本使用效率以及建库效率;避免了对DNA、RNA分别建库,进而避免了耗材浪费,降低了成本,节约了时间;同时,提供的RNA、DNA共建库测序方法及建库仪器,应用于宏基因组学测序、肿瘤突变基因、融合基因等异常突变检测时,可以获得更全面的遗传信息。
以上所述的仅是本发明的实施方式,在此应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出改进,但这些均属于本发明的保护范围。
