用于捕获DNA分子的DNA桥方法
文献发布时间:2023-06-19 10:08:35
本申请要求2018年4月14日提交的第62/657,732号美国临时专利申请的权益,该申请的内容通过引用全部纳入本文。
背景技术
生物体内的遗传信息包含在称为核酸如脱氧核糖核酸(DNA)和核糖核酸(RNA)的多聚分子中。基因组是细胞染色体中的遗传材料。基因组的DNA序列信息可用于确定个体特征以及对许多常见疾病如癌症和一些代谢性疾病易感性的存在。此外,由于一些药物对具有某些遗传标记的个体更有效,因此个体基因组的知识可提供个体化医学治疗的机会。已开发了工具以允许更快和更可靠地确定序列。此外,微型化且可大批量制备的分子检测平台如DNA微阵列为可被更多人能够承受的疾病检测提供了可能性。
DNA微阵列已被广泛应用于一系列基因组序列分析,包括突变和多态性(SNP基因分型)、细胞遗传学(拷贝数)、核蛋白质组学、基因表达谱的检测和分析和转录组分析。尽管许多此类应用可以采用基于直接杂交的方法进行读出,但是酶促读出的使用可能会提供某些明显的优势。例如,与仅通过杂交检测相比,聚合酶延伸或阵列序列的连接可能提供更高水平的区分。
发明内容
在表面上拉伸核酸分子并使所述核酸分子具有酶反应活性是可取的。本文给出了解决目前拉伸核酸的方法中问题的方案:将拉伸的核酸置于表面后,一些酶反应可能不在拉伸基底上进行,或相比溶液中悬浮的核酸一些酶反应可能更低效地进行。
一方面,本文提供一种在基底表面处理至少一个核酸分子的方法,其包括:(a)在所述基底的所述表面拉伸核酸分子;和(b)通过从所述基底的所述表面移除多个亚部分在所述基底的所述表面形成多个离散特征;其中所述核酸分子与所述多个离散特征的两个成员接触,由此使所述核酸的一部分悬浮在所述多个离散特征的所述两个成员间。
在本文所提供方面的一些实施方案中,所述多个离散特征形成拓扑图案。在本文所提供方面的一些实施方案中,所述核酸分子与两个其他所述多个离散特征的两个其他成员接触。在本文所提供方面的一些实施方案中,所述核酸分子的额外部分悬浮于所述多个离散特征的所述两个其他成员之间。在本文所提供方面的一些实施方案中,所述方法进一步包括:(c)在所述基底的所述表面形成水凝胶,所述水凝胶与所述多个离散特征的一些或全部成员接触。在本文所提供方面的一些实施方案中,在(c)中所述核酸分子的至少一部分封闭在水凝胶中。在本文所提供方面的一些实施方案中,所述方法进一步包括:(d)从所述基底的所述表面移除所述水凝胶。
在本文所提供方面的一些实施方案中,述方法进一步包括在(a)中,在所述基底的所述表面拉伸额外核酸分子。在本文所提供方面的一些实施方案中,所述额外的核酸分子与所述多个离散特征的另两个成员接触,由此使所述额外的核酸分子悬浮于所述多个离散特征的所述另两个成员之间。在本文所提供方面的一些实施方案中,所述多个离散特征的每一个独立地为坑、孔(pore)、槽、通道、孔(well)、柱、凸块、突起、脊或棒。在本文所提供方面的一些实施方案中,所述多个离散特征的两个成员的每一个独立地为柱、凸块、突起、脊或棒。在本文所提供方面的一些实施方案中,所述多个离散特征的两个其他成员的每一个独立地为柱、凸块、突起、脊或棒。在本文所提供方面的一些实施方案中,所述核酸分子的至少一部分封闭在所述水凝胶中。
在本文所提供方面的一些实施方案中,所述多个离散特征的两个其他成员每一个独立地为柱、凸块、突起、脊或棒。在本文所提供方面的一些实施方案中,所述核酸分子是脱氧核糖核酸(DNA)。在本文所提供方面的一些实施方案中,所述DNA是双链的或单链的。在本文所提供方面的一些实施方案中,所述核酸分子在酶反应中是有活性的。在本文所提供方面的一些实施方案中,所述方法进一步包括:对所述核酸分子实施酶反应。在本文所提供方面的一些实施方案中,所述方法其进一步包括:对所述额外核酸分子实施酶反应。在本文所提供方面的一些实施方案中,所述方法进一步包括:对所述核酸分子实施蛋白结合反应、杂交反应、由聚合酶催化的引物延伸反应、切口翻译反应或切口延伸反应。在本文所提供方面的一些实施方案中,所述方法进一步包括对所述额外核酸分子实施蛋白结合反应、杂交反应、由聚合酶催化的引物延伸反应、切口翻译反应或切口延伸反应。在本文所提供方面的一些实施方案中,所述多个离散特征的两个成员的每一个包括光致抗蚀剂。
在本文所提供方面的一些实施方案中,所述方法进一步包括:在(a)前,将光致抗蚀剂层涂在所述基底顶部。在本文所提供方面的一些实施方案中,所述方法进一步包括:在(a)前,通过掩膜将紫外光照射在所述光致抗蚀剂层上。在本文所提供方面的一些实施方案中,(b)中的所述移除包括显影所述光致抗蚀剂层。在本文所提供方面的一些实施方案中,所述多个离散特征的两个成员的每一个包含所述光致抗蚀剂。在本文所提供方面的一些实施方案中,所述多个离散特征的两个其他成员的每一个包含所述光致抗蚀剂。在本文所提供方面的一些实施方案中,所述光致抗蚀剂是正光致抗蚀剂或负光致抗蚀剂。在本文所提供方面的一些实施方案中,在(a)之前,所述表面包含含有所述多个特征和多个腔的拓扑图案,其中所述多个特征的每一个独立地为柱、凸块、突起、脊或棒。在本文所提供方面的一些实施方案中,所述多个腔的每一个独立地为坑、孔、槽、通道或孔。在本文所提供一些方面的一些实施方案中,所述方法进一步包括:在(a)之前,使用所述光致抗蚀剂填充所述多个腔的每一个。在本文所提供方面的一些实施方案中,(b)中的所述移除包括显影所述光致抗蚀剂层,其中所述光致抗蚀剂是负光致抗蚀剂。在本文所提供方面的一些实施方案中,所述方法进一步包括:在(a)之前,将紫外光照射至所述光致抗蚀剂的表面,其中所述光致抗蚀剂是正光致抗蚀剂。在本文所提供方面的一些实施方案中,(b)中的所述移除包括显影所述正光致抗蚀剂层。
另一方面,本文提供一种系统,其包含:(a)含有表面的基底,所述表面包含多个离散特征;和(b)核酸分子,其与所述多个离散特征的两个成员接触。
在本文所提供的一些方面的一些实施方案中,所述核酸分子的一部分悬浮于所述多个离散特征的两个成员之间。在本文所提供方面的一些实施方案中,所述核酸分子与所述多个离散特征的两个其他成员接触。在本文所提供方面的一些实施方案中,所述核酸分子的额外部分悬浮于所述多个离散特征的所述两个其他成员之间。在本文所提供的一些方面的一些实施方案中,所述多个离散特征形成拓扑图案。
在本文所提供的一些方面的一些实施方案中,所述系统进一步在表面上包含水凝胶,所述水凝胶与所述多个离散特征的一些或全部成员接触。在本文所提供方面的一些实施方案中,使所述核酸分子的至少一部分封闭在所述水凝胶中。在本文所提供方面的一些实施方案中,所述核酸分子是拉伸的。在本文所提供方面的一些实施方案中,所述多个离散特征的每一个独立地为坑、孔、槽、通道、孔、柱、凸块、突起、脊或棒。在本文所提供方面的一些实施方案中,所述多个离散特征的两个成员的每一个独立地为柱、凸块、突起、脊或棒。在本文所提供方面的一些实施方案中,所述多个离散特征的两个其他成员的每一个独立地为柱、凸块、突起、脊或棒。
在本文所提供方面的一些实施方案中,所述核酸分子是脱氧核糖核酸(DNA)。在本文所提供方面的一些实施方案中,所述DNA是双链的或单链的。在本文所提供方面的一些实施方案中,所述核酸分子在酶反应中是有活性的。在本文所提供方面的一些实施方案中,所述核酸分子在蛋白结合反应、杂交反应、由聚合酶催化的引物延伸反应、切口翻译反应或切口延伸反应中是有活性的。在本文所提供方面的一些实施方案中,所述多个离散特征的两个成员的每一个包含光致抗蚀剂。在本文所提供方面的一些实施方案中,所述光致抗蚀剂是正光致抗蚀剂或负光致抗蚀剂。在本文所提供方面的一些实施方案中,所述多个离散特征的两个其他成员的每一个包含光致抗蚀剂。在本文所提供方面的一些实施方案中,所述光致抗蚀剂是正光致抗蚀剂或负光致抗蚀剂。在本文所提供方面的一些实施方案中,所述系统进一步包含与所述多个离散特征的两个其他成员接触的额外的核酸。在本文所提供方面的一些实施方案中,所述多个离散特征的所述两个成员的每一个不包含光致抗蚀剂。
基于仅示出和描述了本公开内容的说明性实施方案的以下详细描述,本公开内容的其他方面和优势对本领域技术人员而言将变得十分明显。应当意识到,本公开内容适用于其他的和不同的实施方案,并且其若干个细节能够在多个明显的方面进行修改,所有这些都不背离本公开内容。因此,附图及描述应被视为本质上是说明性而非限制性的。
本说明书中提及的全部出版物、专利和专利申请均通过引用并入本文,其程度如同特别且单独地指出每个单独的出版物、专利或专利申请通过引用并入本文。
附图说明
本发明的新特征在随附的权利要求中具体阐述。通过参考以下对利用了本发明原理的说明性实施方案进行阐述的详细描述和附图,将会获得对本发明特征和优点的更好的理解,附图中:
图1显示了具有贯穿表面特征拉伸的DNA分子的SU-8柱的图片(SU-8棒)。
图2A-2D显示了使用DNA交联方法生成悬浮在表面特征上的DNA分子的示意图。
图3A-3D显示了生成悬浮在表面特征上的DNA分子的示意图,其将DNA置于光致抗蚀剂暴露表面。
图4A-4D显示了通过将第二材料填充在图案化表面的缝隙生成悬浮在表面特征上的DNA分子的示意图。
图5显示了另一SU-8棒的图片,其中拉伸的DNA分子贯穿柱。
图6显示了另一SU-8棒的图片,其中拉伸的DNA分子贯穿柱。
图7显示了棋盘构象中具有悬浮的DNA分子的柱/捕获棒的图片。
图8显示了延伸产物和模板DNA分子二者的图片。延伸反应前模板DNA分子悬浮贯穿SU-8线。
图9显示了悬浮贯穿SU-8图案化的棒的基因组DNA。
图10显示了转移至水凝胶的基因组DNA片段。
图11A-11F显示了在水凝胶中生成拉伸的DNA分子的示意图。
图12显示了垂直悬浮贯穿SU-8水平线的DNA在水性缓冲液中通过并入标记和未标记的核苷酸延伸。标记的核苷酸是沿染色DNA(红线或多条红线)出现的绿点(或多个绿点)。
图13显示了捕获于水凝胶中的DNA分子与标记的可逆终止子使用DNA聚合酶在测序反应中延伸。标记的核苷酸是贯穿表面特征(棒)出现的红、绿和蓝点(多个点)。
具体实施方式
捕获和比对具有酶反应性的DNA分子是非常有价值的。例如,捕获的DNA分子可作为模板用于DNA聚合酶。这样的捕获方法可以是多种研究和诊断方法的基础,包括DNA测序。尽管已公开了多种用于组合和拉伸DNA分子的方法,但总得来说,这些方法使捕获的DNA分子对于进一步的酶反应具有较少的可操作性。贯穿表面拉伸DNA可以是研究基因组的有效方法。例如,位于固体表面的DNA分子可将与接近的酶的可解除相互作用限制至仅DNA分子的一侧,这是由于另一侧已由所述表面阻断。
本发明提供通过间断的“柱”或捕获棒悬浮DNA分子的方法,进而所述DNA分子可悬浮于多个柱或捕获棒上。悬浮的DNA分子的区段,例如未置于柱或捕获棒上的DNA分子区段可浸入缓冲液中,水凝胶内亦或是可用于酶反应。因此,与处于固体表面的DNA分子相比,酶可从DNA分子的两端都能够接近这些区段。在一个实施方案中,DNA可贯穿光致抗蚀剂表面被拉伸。在一定的空间间隔内,如例如约1μM至约200μM,可应用UV光以在交联的DNA分子下构建捕获棒或“柱”。组合结果可使得一些DNA分子区段悬浮在捕获棒或柱上。在另一个实施方案中,光致抗蚀剂(如基于SU-8或聚甲基丙烯酸甲酯(PMMA)的光致抗蚀剂)可暴露至特定图案的光中。随后DNA可在暴露的光致抗蚀剂上拉伸。光致抗蚀剂随后显影进而所暴露的部分和未暴露的部分可在处理如化学处理中发生不同反应,以使得具有DNA分子的捕获棒或柱悬浮在多个捕获棒或柱上。在另一个实施方案中,可使用具有柱的图案化的表面如基于PMMA或SU-8的表面。柱之间的间隙可使用第二种材料填充。DNA可在表面且随后在第二材料上拉伸,如例如可移除水凝胶以悬浮DNA片段。该平台可用于DNA测序、映射和其他应用。在一个实施方案中,可悬浮DNA分子且随后悬浮的DNA分子可转移至水凝胶并与引物杂交。单分子测序可从多重延伸位点通过引物延伸使用如例如可逆终止子进行。
如本文使用的术语“寡核苷酸”通常是指核苷酸链。在一些情况下,寡核苷酸的长度小于200残基,例如长度为15-100核苷酸。寡核苷酸可包含至少或约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45或50个碱基。寡核苷酸可为约3至约5个碱基、约1至约50个碱基、约8至约12个碱基、约15至约25个碱基、约25至约35个碱基、约35至约45个碱基、或约45至约55个碱基。寡核苷酸(也成为“寡聚体”)可以是任何类型的寡核苷酸(例如引物)。寡核苷酸可包含天然核苷酸、非天然核苷酸或其组合。
如本文使用的术语“约”通常是指指定量的+/-10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。
如本文使用的术语“基本上”,当描述两个个体的相对值、相对量或相对程度时,通常是指在值、量或程度中彼此在80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%、101%、102%、103%、104%、105%、106%、107%、108%、109%或110%内。
如本文使用的开放性术语例如“包含”、“含有”、“包括(include)”、“包括(including)”、“具有(have)”、“具有(having)”等指包含,除非另外表明。
如本文使用的术语“固定”通常是指在两个反应性基团间形成共价键。例如,反应性基团的多聚化是一种形成的固定。当两原子分别来自两个反应性基团时,两原子间的共价键的形成,如例如碳原子和碳原子、碳原子和杂原子,以及杂原子和杂原子是固定的实例。
如本文使用的术语“基底”或“固体基底”通常是指物质、结构、表面、材料、方式或组合物,其包含非生物、合成、非生命、平面、球形或平面。基底可包括例如且不限于半导体、合成金属、合成半导体、绝缘体和掺杂剂;金属、合金、元素、化合物和矿物质;合成、切割、蚀刻、光刻、印刷、机械化和微加工的玻片、设备、结构和表面;工业聚合物、塑料、膜;硅、硅酸盐、玻璃、金属和陶瓷;木材、纸张、纸板、棉花、羊毛、布、编织和非编织纤维、材料和织物;纳米结构和微结构。基底可以包含固定基底,例如但不限于不溶物、固相、表面、层、涂层、编织或非编织纤维、基底、晶体、膜、不溶性聚合物、塑料、玻璃、生物或生物相容性或生物蚀解性或可生物降解的聚合物或基底,微粒或纳米颗粒。其他实例可包括,例如但不限于,单层、双层、商业膜、树脂、基底、纤维、分离介质、色谱支持物、聚合物、塑料、玻璃、云母、金、珠、微球、纳米球、硅、砷化镓、有机和无机金属、半导体、绝缘体、微结构和纳米结构。微结构和纳米结构可以包括但不限于微型化、纳米级和超分子探针、尖、棒、钉、栓、棍、套筒、线、细丝和管。基底可以例如以一种或多种颗粒、股线、沉淀物、凝胶、片、管、球、容器、毛细管、垫、切片、薄膜、板、玻片或半导体集成芯片的形式存在。基底可以是平坦的,也可以采用其他表面构造。例如,基底可以包含在其上发生合成或沉积的凸起或凹陷区域。在一些实例中,基底可包含包含具有不同3-D形状和/或高度的凸起或凹陷区域。在一些实例中,基底可包含多个特征。在一些实例中,基底可包含拓扑图案且拓扑图案可包含一组槽、一组棒、一组柱、一组孔或其组合。在一些实例中,拓扑图案通过至少两种不同材料形成,例如覆盖有一层光致抗蚀剂的硅芯片,或覆盖有水凝胶的石英片等。在一些实例中,基底可以包含基本相同的3D形状和/或高度的凸起或凹陷区域。在一些实例中,可选择基底以提供适当的光吸收特性。例如,基底可以是聚合的Langmuir Blodgett薄膜、功能化玻璃(例如受控的孔玻璃)、二氧化硅、氧化钛、氧化铝、氧化铟锡(ITO)、Si、Ge、GaAs、GaP、SiO2、SiN4、修饰硅、半导体集成电路(IC)芯片的顶部介电层或多种凝胶或聚合物中的任何一种,例如(聚)四氟乙烯、(聚)偏二氟乙烯、聚苯乙烯、聚碳酸酯、聚二甲基硅氧烷(PDMS)、聚(甲基丙烯酸甲酯)(PMMA)、多环烯烃,或其组合。
基底可包含聚合物涂层或凝胶,例如聚丙烯酰胺凝胶或PDMS凝胶。凝胶和涂层可以另外包含改变其理化性质,例如疏水性的组分。例如,聚丙烯酰胺凝胶或涂层可以在其聚合物结构中包含修饰的丙烯酰胺单体,例如乙氧基化的丙烯酰胺单体、磷酰胆碱丙烯酰胺单体、甜菜碱丙烯酰胺单体及其组合。
如本文使用的术语“核酸”通常是指包含一个或多个核酸亚基或核苷酸的聚合物。核酸可包含一个或多个选自腺苷(A)、胞嘧啶(C)、鸟嘌呤(G)、胸腺嘧啶(T)和尿嘧啶(U)或其变体的亚基。核苷酸可以包括A、C、G、T或U,或其变体。核苷酸可以包括可掺入正在生长的核酸链中的任何亚基。此类亚基可以是A、C、G、T或U,或对一个或多个互补A、C、G、T或U或与嘌呤(即,A或G,或其变体)或嘧啶(即C、T或U或其变体)互补的任何其他亚基。亚基可以使单个核酸碱基或碱基组(例如,AA、TA、AT、GC、CG、CT、TC、GT、TG、AC、CA或其尿嘧啶对应物)解析。在一些实例中,核酸是脱氧核糖核酸(DNA)或核糖核酸(RNA),或其衍生物。核酸可以是单链或双链的。
如本文使用的术语“邻近”或“邻近于”包括“邻近于(next to)”,“邻近于(adjoining)”和“邻接(abutting)”。在一个实例中,当第一位置直接接触并且与第二位置共享公共边界并且两个位置之间没有空间时,第一位置与第二位置相邻。在某些情况下,邻近不是对角邻近。
如本文使用的术语“测序”通常是指用于确定一种或多种多核苷酸中核苷酸碱基的序列的方法和技术。多核苷酸可以是例如核酸分子,例如脱氧核糖核酸(DNA)或核糖核酸(RNA),包括其变体或衍生物(例如单链DNA)。测序可以通过当前可用的各种系统进行,例如但不限于
如本文使用的术语“样品”通常是指受试者的生物样品。生物样品可以包含任何数量的大分子,例如细胞大分子。样品可以是细胞样品。样品可以是细胞系或细胞培养物样品。样品可以包括一个或多个细胞。样品可以包括一种或多种微生物。生物样品可以是核酸样品或蛋白质样品。生物样品也可以是碳水化合物样品或脂质样品。所述生物样品可以源自另一样品。样品可以是组织样品,例如活检、核心活检、针抽吸或细针抽吸样品。样品可以是流体样品,例如血液样品、尿液样品或唾液样品。样品可以是皮肤样品。样品可能是脸颊拭子。样品可以是血浆或血清样品。样品可以是无细胞(cell-free)或无细胞(cell free)的样品。无细胞样品可以包括细胞外多核苷酸。可以从机体样品中分离细胞外多核苷酸,所述机体样品可以选自血液、血浆、血清、尿液、唾液、粘膜分泌物、痰、粪便和眼泪。
如本文使用的术语“核酸序列”或“核苷酸序列”通常是指具有给定核苷酸序列的核酸分子,可能希望知道其核苷酸存在或数量。核苷酸序列可以包含核糖核酸(RNA)或DNA,或衍生自RNA或DNA的序列。核苷酸序列的实例是对应于天然或合成RNA或DNA的序列,包括基因组DNA和信使RNA。序列的长度可以是可以扩增为核酸扩增产物或扩增子的任何长度,例如,长度至多约20、50、100、200、300、400、500、600、700、800、1,000、1,200、1,500、2,000、5,000、10,000或超过10,000个核苷酸,或至少约20、50、100、200、300、400、500、600、700、800、1,000、1,200、1,500、2,000、5,000,10,000或10,000个核苷酸。
如本文使用的术语“模板”通常是指单个多核苷酸分子,可以通过核酸聚合酶从中合成包括互补核酸链的另一核酸。另外,模板可以是多核苷酸的一条或两条链,其能够充当由核酸聚合酶催化的模板依赖性核酸聚合的模板。该术语的使用不应被视为将本公开的范围限制于实际上在随后的酶催化的聚合反应中用作模板的多核苷酸。模板可以是RNA或DNA。模板可以是对应于RNA序列的cDNA。模板可以是DNA。
如本文所用,模板核酸的“扩增”通常是指产生(例如,体外)与模板核酸序列的至少一部分相同或互补的核酸链的过程,或用作模板核酸序列替代物的通用序列或标签序列,只有当样品中存在模板核酸时,才可以全部生成。通常,核酸扩增使用一种或多种核酸聚合酶和/或转录酶来产生模板核酸或其片段的多拷贝,或与模板核酸或其片段互补的序列的多拷贝。体外核酸扩增技术可以包括转录相关的扩增方法,例如转录介导扩增(TMA)或基于核酸序列的扩增(NASBA),以及其他方法,例如聚合酶链反应(PCR),逆转录酶-PCR(RT-PCR),复制酶介导的扩增和连接酶链反应(LCR)。
如本文使用的术语“水凝胶”通常是指其中溶胀剂为水的凝胶。术语“凝胶”是指非流体的胶体网络或聚合物网络,其通过流体在其体积中膨胀。术语“溶胀剂”是用于溶胀凝胶或网络的流体。例如,水可以是水凝胶的溶胀剂。本公开的水凝胶可以通过一种或多种丙烯酰胺官能化的单体的聚合来制备。例如,也可以将丙烯酰胺尾部键合至基底(例如石英片)的表面。然后可以使包含丙烯酰胺单体的溶液与与丙烯酰胺尾部键合的表面接触。然后,可以使倒出的溶液进行丙烯酰胺单体和丙烯酰胺尾部的聚合,从而可以形成水凝胶。在某些情况下,本发明的水凝胶包含聚丙烯酰胺。在某些情况下,本发明的水凝胶包含交联的聚丙烯酰胺。在一些情况下,本公开的水凝胶包含按重量约0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%的聚丙烯酰胺。在某些情况下,水凝胶可通过结合丙烯酰胺和亚甲基双丙烯酰胺获得。聚合反应可以由引发剂自由基引发。水凝胶可通过在自由基引发剂存在下以150:1至1000:1的摩尔比结合丙烯酰胺和亚甲基双丙烯酰胺获得。亚甲基双丙烯酰胺可以提供聚合物链之间的交联,并且可以改变摩尔比以提供水凝胶的各种交联密度。获得水凝胶的条件可以改变。过硫酸铵(AMPS)可以用作聚合反应的引发剂。
在一些情况下,DNA分子可以在表面上梳理或拉伸。但是,先前报道的表面上的梳理或拉伸DNA分子作为聚合酶反应模板的能力可能受到限制。在本发明的一个方面,提供了一种用于将拉伸的DNA分子放置在表面上并将拉伸的DNA分子放置在图案化的棒或柱上的方法。如图1所示,DNA分子可以在由光致抗蚀剂例如SU-8制成的多个图案化棒上拉伸。可以采用各种实施方式来用间歇的柱或捕获棒或由光致抗蚀剂制成的材料的图案来悬浮DNA。基底表面上的DNA分子可包含两种类型的DNA片段:第一类(以下称为“锚定片段”)与柱或捕获棒的顶部接触;第二种类型(以下称为“悬浮片段”)位于两个相邻的锚定片段之间,使得该悬浮片段的DNA悬浮在附近的两个柱或捕获棒之间。锚定片段和悬浮片段可以串联。与没有柱或捕获棒的表面上的DNA分子相比,DNA分子的悬浮片段更容易与酶和引物进行酶促反应。DNA的悬浮片段可以浸入缓冲液或水凝胶中,从而进行酶促反应。
本公开提供了数种在具有柱或捕获棒或其他特征的表面上构建悬浮DNA的方法。DNA在表面上的拉伸可以通过几种方法获得:弯月面收缩、流场、机械踩踏等。可以使用多种技术对表面进行图案化,并且可以使用多种材料。
DNA分子(例如基因组DNA分子)可以通过各种方式拉伸,包括但不限于使用交流(AC)电场(Kaji,N.,“Molecular stretching of long DNA in agarose gel usingalternating current electric fields,”Biophys.J.,82(1Pt 1):335-44,2002),在双曲线收缩微通道中使用电场梯度(Randall,G.C.,et al.,“Methods toelectrophoretically stretch DNA:microconstractions,gels,and hybrid gel-microconstraction devices,”Lab.Chip,6(4):516-25,2006),用光镊均匀流动(Smith,S.B.,et al.,“Overstretching B-DNA:the elastic response of individual double-stranded and single-stranded DNA molecules,”Science,271:795-9,1996),使用流动均匀(Perkins,T.T.,et al.,“Stretching of a single tethered polymer in auniform flow,”Science,268:83-7,1995)、使用均匀电场(Ferree,S.,et al.,“Electrokinetic stretching of tethered DNA,”Biophys.J.,85(4):2539-46,2003)、使用声力谱(AFS)(Sitters,G.,et al.,“Acoustic force spectroscopy,”Nat.Methods,12(1):47-50,2015)、迫使DNA进入纳米通道(Tegenfeldt,J.O.,et al.,“The dynamics ofgenomic-length DNA molecules in 100-nm channels,”Proc.Natl.Acad.Sci.U.S.A.,101(30):10979-83,2004)、多股水力聚焦(Wong,P.K.,et al.,“Deformation of DNAmolecules by hydrodynamic focusing,”J.Fluid.Mech.,497:55-65,2003)和动态梳理到表面(Dimalanta,E.T.,et al.,“A microfluidic system for large DNA moleculearrays,”Anal.Chem.,76(18):5293-301,2004)。
图1显示了基因组DNA可以贯穿SU-8光致抗蚀剂图案化的棒拉伸。在这种情况下,SU-8棒显示为水平棒,由槽隔开。如图1所示,棒的宽度远小于槽的宽度。可以看到拉伸的DNA悬浮在相邻的棒之间,类似于贯穿干燥架网架的织物线。因为梳理或拉伸的DNA可悬浮在基底表面上的间歇性柱或捕获棒或其他图案上,所以DNA的悬浮部分(例如,图1中槽上方的部分)更容易与酶和/或引物或其他生物分子发生反应。例如,悬浮部分可以浸入缓冲液或水凝胶中。
图2A-2D示出了所公开的DNA悬浮方法的示例方案。在该实例中,核酸通过紫外(UV)交联至柱或棒而被捕获。捕获点,例如,大约每10μM到大约每100μM,可以通过光掩膜图案来创建。图2A示出了在基底202上的光致抗蚀剂层204。图2B示出了在光致抗蚀剂层204上的拉伸的核酸206。图2C示出了具有图案的掩膜208,其可以放置在拉伸的核酸206和光致抗蚀剂层204上。然后,可以通过掩膜208将光致抗蚀剂层204暴露于紫外光210。核酸206的暴露部分可以与光致抗蚀剂的暴露部分212形成共价键。图2D示出在对曝光的光致抗蚀剂(例如,负光致抗蚀剂)进行显影之后,可以去除光致抗蚀剂的一部分,从而将拉伸的核酸206悬浮在基底202的表面上的其余光致抗蚀剂特征(例如,柱或条212)之间。
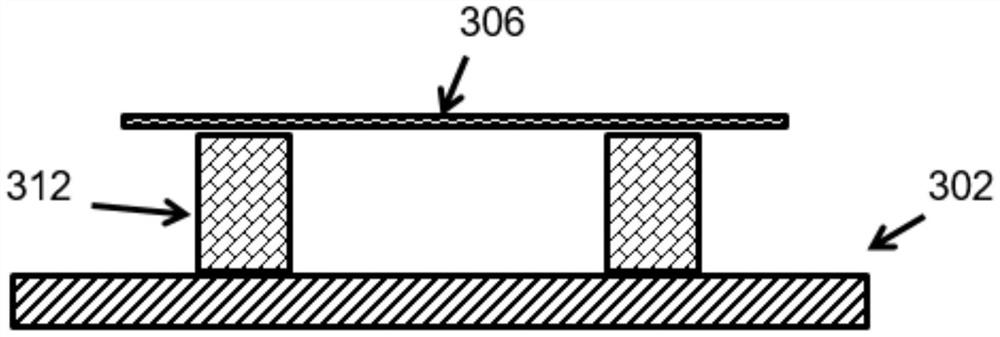
替代地,图3A-3D示出了所公开的DNA悬浮方法的另一示例方案。在该实例中,核酸在光致抗蚀剂层上被拉伸之前,光致抗蚀剂层被暴露。图3A示出了在基底302上的光致抗蚀剂层304。图3B示出了具有图案的掩膜308,其可以放置在光致抗蚀剂层304上方。然后,可以通过掩膜308将光致抗蚀剂层304暴露于紫外光310。可以在光致抗蚀剂层304内形成光致抗蚀剂的暴露部分312。图3C示出了包括暴露部分312的光致抗蚀剂层304上的拉伸核酸306。图3D示出了在对曝光的光致抗蚀剂(例如,负光致抗蚀剂)进行显影之后,可以去除光致抗蚀剂的一部分,从而将拉伸的核酸306悬浮在基底302表面上的其余光致抗蚀剂特征(例如,柱或条312)之间。
如本文所示,可以在已经暴露于UV光的光致抗蚀剂例如SU-8上拉伸核酸。将核酸在光致抗蚀剂上拉伸后,可以使光致抗蚀剂显影而不会导致核酸的过多损失。悬浮拉伸核酸的柱或捕获棒或表面特征的尺寸可能会影响捕获DNA的需求以及在基底表面上制造或产生特征的方法。例如,柱或捕获棒或表面特征的尺寸可以在纳米范围至微米范围内,并且在某些情况下,以最小化与悬浮核酸接触的捕获区域的尺寸(例如,柱、棒或表面特征上)与悬浮核酸接触。在某些情况下,捕获区上的DNA对酶促反应(例如,聚合酶催化的链延长、切口延伸、核酸内切酶反应等)或其他生物学反应(例如,杂交)的反应性较小。
图4A-4D示出了所公开的悬浮DNA的方法的另一示例方案。在该实例中,基底402的表面可以包括如图4所示的表面特征412。图4B示出了填充材料404可用于填充基底402上的表面特征412之间的腔,并被盖玻片408覆盖。根据填充材料404的性质填充材料404可被处理以形成半固体或固体形式,使得经处理的填充材料404和表面特征412一起可以形成用于放置拉伸的核酸406的基本平坦的表面。然后可以通过另一种处理去除填充材料404。例如,填充材料404可以是负光致抗蚀剂。图4D示出了悬浮在基底402上的表面特征412之间的所得拉伸核酸406。
悬浮在表面特征之间的拉伸的核酸可以用水凝胶进一步处理以封闭拉伸的核酸。例如,水凝胶(例如6%的聚丙烯酰胺凝胶)可用于覆盖表面特征(或柱或棒)212、312或412之间的图2D、3D和4D中所示的表面的腔。然后可将水凝胶与核酸一起从基底(和表面特征)分离。然后可以将核酸分子捕获在凝胶内或凝胶上。
图5显示了悬浮在表面特征(例如SU-8棒)之间的核酸分子(例如DNA分子)的另一个实例。悬浮的DNA分子可以松弛并准备与酶反应。图6显示了当悬浮在表面特征(例如SU-8棒)之间时,悬浮的DNA分子无需非常直,因为可以在显微镜或其他视觉/化学/生物学方法下追踪DNA分子的形状。可以选择表面特征的形状以促进进一步的反应。图7示出了用于表面特征的棋盘图案。本领域的技术人员将理解,可以使用许多不同的图案,只要在表面特征中存在至少两个捕获区域,它们可以悬浮至少一部分的梳理或拉伸的核酸。图8显示了核酸(例如,DNA分子,图8中显示为细线)可以被垂直拉伸并悬浮在SU-8水平棒上(在图8中从左到右显示为宽棒)。另外,通过将标记的和/或未标记的核苷酸掺入延伸产物中,可以将拉伸和悬浮的核酸用作模板以延伸引物。标记的核苷酸可以沿着悬浮的DNA(显示为附近的红线或图8中的线)以颜色出现(例如,绿点或图8中的点)。
如图9所示,将DNA悬浮在SU-8光致抗蚀剂图案化棒之上。可以采用各种实施方案来用诸如光致抗蚀剂的材料的间歇性捕获棒(或其他结构)来悬浮DNA。DNA的悬浮部分更容易与酶和引物发生反应。DNA的悬浮部分可以浸入缓冲液或水凝胶中。
图10显示了已经转移到水凝胶中的DNA片段。可以通过在试剂聚合之前将试剂倒至表面特征上悬浮DNA之上形成水凝胶,并且可以用盖玻片的处理的表面覆盖试剂。聚合完成后,可以将凝胶与基底的表面特征分离,并且DNA片段可以以基本上线性的方式保留在凝胶中,类似于形成凝胶之前的方式。在图10中,用嵌入染料染色的DNA以绿色(或细线)显示。
图11A至图11F示出了在图9和10中的表面特征上获得悬浮DNA的示意性过程。参见图9和10。在某些情况下,DNA可以在已暴露于紫外光的光致抗蚀剂(例如SU-8)上拉伸。图。图11A示出了在基底1102上的光致抗蚀剂层1104。图11B示出了具有图案的掩膜1108,其可以放置在光致抗蚀剂层1104上方。然后,光致抗蚀剂层1104可以通过掩膜1108暴露于紫外光1110。光致抗蚀剂的暴露部分1112可以在光致抗蚀剂层1104内形成。图11C示出了在包括暴露部分1112的光致抗蚀剂层1104上的拉伸核酸1106。图11D示出了在对曝光的光致抗蚀剂(例如,负光致抗蚀剂)进行显影之后,可以去除光致抗蚀剂的一部分,从而将拉伸的核酸1106保留在基底1102表面上其余光致抗蚀剂特征(例如,柱或棒1112)之间悬浮。图11E示出了可将用于水凝胶1116的试剂倒在基底1102表面上,填充表面特征(或柱或棒)1112之间的表面腔,并封闭悬浮、拉伸的DNA,然后用盖玻片1114覆盖试剂。随后聚合反应可以形成水凝胶1116,从而将悬浮、拉伸的DNA 1106捕获在水凝胶内部。图11F示出了在将基底(连同表面特征1112)与水凝胶分离之后,悬浮、拉伸的DNA 1106被捕获在水凝胶1116内。
图12显示了贯穿SU-8棒悬浮在水性缓冲液中的基因组DNA分子。DNA可以用嵌入染料染色,在这种情况下,DNA可以在图12中以红色呈现(或显示为细线)。在存在DNA聚合酶的情况下,可以使用标记的和未标记的核苷酸的混合物延伸随机引物。标记的核苷酸可以呈现为绿色,并沿着悬浮、拉伸的DNA的一条或多条红色线显示为点。
在图13中,基因组DNA的片段可以被捕获在水凝胶中。DNA可能不可见,因为它可能没有被染色。可以使用三个可逆终止的标记核苷酸和一个未标记核苷酸的混合物在DNA聚合酶存在下延伸随机引物。三种标记的核苷酸可以三种颜色呈现:图13中的红色、绿色和蓝色(或显示为点)。
可以对通过本文公开的方法获得的捕获的DNA进行许多反应,例如杂交、蛋白结合和引物或切口延伸反应。
DNA拉伸在与分子拓扑有关的全部应用中是有用的。可以使用多种方法(弯月面收缩、流场、机械踩踏等)在表面上拉伸DNA。但是,一旦分子被拉伸,表面效应可能会限制各种酶或试剂接触和操纵DNA的能力。本文公开了一种将DNA锚定在间歇性捕获棒或称为表面特征的类似结构上的新方法。与直接与表面(或表面特征)接触的DNA部分相比,悬浮在表面特征之间的DNA部分更易于进行酶促反应和其他操作方法。例如,本文公开的方法可以用于DNA测序或DNA映射。而且,它可为蛋白质-DNA结合测定提供简单的平台。
基底制造 将光致抗蚀剂聚合物SU-8(2002配方)旋涂(约1000rpm)到22×22mm的硅基底上,获得1.75μm厚的SU-8层。将涂层的基底在电热板上以约95℃的温度下烘烤1分钟。将基底置于真空中,与具有10μm宽线条的交替图案(相隔10μm)的光掩膜接触。将基底暴露于80mJ/cm2的365nm紫外光,最后在95℃下烘烤2分钟。
DNA拉伸 在94℃加热1分钟后,将DNA退火至随机引物。将未显影的基底浸入比色皿中,该比色皿包含50ng悬浮在1.2mL MES缓冲液(pH 5.5)中的退火DNA。温育1小时。然后将基底以67μm/sec的速度从比色杯中抽出。牵拉方向必须基本垂直于图案中线的方向。
基底显影 随后在丙二醇甲醚乙酸酯(PGMEA)中显影基底(在顶部具有拉伸的DNA)。尚未暴露在紫外光的聚合物部分在DNA下溶解,使DNA悬在锚固点之间,成为“DNA桥”。过量的PGMEA通过用异丙醇冲洗基底来去除。最后,用纯净水冲洗样品。将表面在氯化镁和吐温20的溶液中温育15分钟。
石英基底的键合硅烷涂层 将22×22mm的石英玻片浸没在含有乙醇、乙酸和键合硅烷(γ-甲基丙烯酰氧基丙基三甲氧基硅烷)的溶液中。将载玻片在溶液中搅拌1小时,随后用水和乙醇冲洗。
丙烯酰胺凝胶制剂 将6%的丙烯酰胺凝胶与叔甲基四乙二胺(TEMED)和过硫酸铵(APS)混合以开始聚合。将15μL的混合物分散到基底上,并用预先用键合硅烷溶液处理过的石英载玻片密封。一小时后,分离基底,将嵌入凝胶的DNA转移到石英载玻片上。洗涤凝胶以除去过量的未聚合单体。
第一核苷酸掺入 将包含DNA聚合酶,适当缓冲液,三种可逆终止子标记的核苷酸和一种可逆终止子但未标记的核苷酸的溶液应用于样品,并在50℃的烤箱中温育20分钟。用缓冲液洗涤基底以去除未掺入的核苷酸。可以通过将包含嵌入染料(YOYO)的溶液涂在样品表面上来对DNA染色,然后用水冲洗。
成像 样品在TIRF显微镜下在4个不同的通道中成像(3个用于标记核苷酸和1个用于DNA染色染料)。曝光时间:0.3秒,相机增益:300,光源的激光功率:100mW。
随后的掺入 将含有TCPE(用于掺入可逆终止子的裂解剂)的溶液在样品表面上于55℃温育15分钟,随后用水洗涤。将包含DNA聚合酶和三种可逆终止子标记的核苷酸和一种可逆终止子但未标记的核苷酸的溶液应用于样品,并在50℃的烘箱中温育20分钟。用缓冲液洗涤基底,然后成像。重复最后两个步骤,以获得所需的掺入数量。
虽然本文已经显示和描述了本发明优选的实施方案,但是对于本领域技术人员而言显然这些实施方案仅仅是作为示例提供的。本领域技术人员在不偏离本发明的前提下将会想到大量的变化、改变和替换。应当理解,在本发明的实践中可以使用本文描述的本发明实施方案的各种替代方案。以下权利要求旨在限定本发明的范围,由此覆盖在这些权利要求的范围内的方法和结构及其等同物。
