一种脑脊液基因测序建库、检测方法及其应用
文献发布时间:2023-06-19 10:22:47
技术领域
本发明涉及基因检测领域,具体涉及一种脑脊液基因测序建库、检测方法及其应用。
背景技术
脑脊液主要分布于脑室、蛛网膜下腔和脊椎,并在三者之间呈一定方向流动,最终被蛛网膜粒吸收入血。血液-脑脊液之间上皮细胞间的紧密结合及星形细胞形成的胶质界膜构成脑脊液与血液之间的滤过性屏障,称为血液-脑脊液屏障。大部分中枢神经系统肿瘤直接与脑脊液接触,释放ctDNA进入脑脊液,而由于血液-脑脊液屏障的滤过作用,导致ctDNA无法入血,血浆cfDNA可能出现假阴性。因此对于中枢神经系统疾病而言,对脑脊液进行ctDNA(检测cfDNA里的ctDNA(循环肿瘤DNA))的检测,能比血浆ctDNA检测更为真实的反映中枢神经系统疾病情况。
在液态活检中检测游离cfDNA时,由于有效数据比例低,因此需要提高起始DNA量和测序数据量。对于样本量稀少的脑脊液而言,分离后的上清中所提取到的核酸量大多低于检测下限,导致无法正常建库,且样本建库后出库浓度低,无法保证低频被检出。
发明内容
本发明要解决的技术问题之一是提供一种脑脊液基因测序建库方法,该方法建库时间短,成本低,可应用于液态活检。本发明要解决的技术问题之二是提供一种用上述建库方法制备的DNA测序文库对脑脊液基因进行测序检测的方法,该方法可应用于微量待测样本的液态活检。本发明要解决的技术问题之三是提供一种脑脊液基因测序检测试剂盒,该试剂盒包含有用上述建库方法制备的DNA测序文库。本发明要解决的技术问题之四是提供上述构建方法或试剂盒在脑脊液基因组液态活检中的应用。
根据第一方面,提供一种脑脊液基因测序建库方法,通过对脑脊液的待测样本进行cfDNA提取,并采用Labchip GX Touch对其进行质控,从而确定构建文库的PCR循环数,以满足扩增的需求。再采用浓度至少为20μmol/L的PCR扩增引物浓度进行富集扩增,以提高建库成功率。
具体而言,本申请所述脑脊液基因测序建库方法包括以下步骤:
A、提取、质控:对脑脊液的待测样本进行至少两次离心,从上清液中提取待测样本的cfDNA,采用Labchip GX Touch对所述cfDNA进行片段浓度检测;
B、构建文库:对所述cfDNA进行末段修复加A,接头连接及纯化,然后对纯化产物进行PCR扩增,并且,根据所述cfDNA的片段浓度检测结果确定PCR扩增的循环数,对PCR扩增产物进行纯化,即得脑脊液cfDNA的基因测序文库。
脑脊液提取浓度使用Qubit 3.0定量总是远低于检测下限,无法进行准确定量。因此本申请采用Labchip GX Touch(取2μL样本稀释至20μL)进行片段质控,检测80-400bp片段(cfDNA所在的片段区间)质量浓度。质量浓度大于0.1ng/μL,cfDNA总量大于5ng时质控结果正常,待测样本可用于后续检测。
一种实施例中,所述片段质控是指对片段为80-400bp的cfDNA的质量浓度进行检测。
根据所述cfDNA的片段浓度检测结果确定PCR扩增的循环数,具体包括:cfDNA的片段的质量浓度<0.2ng/μL为风险建库,PCR循环数为12循环;cfDNA的片段的质量浓度≥0.2ng/μL为正常建库,PCR循环数为8循环。
PCR循环数太少使样本中目标DNA的数量低于检测要求,无法准确对其进行检测;PCR循环数过多会降低扩增保真性,且产生大片段污染。现有的PCR循环数一般是依据Qubit的浓度去判断,然而对于样本起始量较低的脑脊液待测样本而言,使用Qubit 3.0定量总是远低于检测下限,无法进行准确定量。本申请根据脑脊液待测样本含量低、检测难的特点,重新制定脑脊液建库PCR循环数规则,目前所有的脑脊液待测样本中的cfDNA在文库构建环节均能满足最低杂交输入量(500ng)。
本申请通过待测样本积累,对脑脊液待测样本中的cfDNA质控浓度、PCR循环数、文库浓度进行数据统计分析,对脑脊液待测样本不同建库起始量下的PCR循环数进行的归类,制定出完整的cfDNA的片段建库PCR循环数规则:cfDNA的片段的质量浓度<0.2ng/μL为风险建库,PCR循环数为12循环;cfDNA的片段的质量浓度≥0.2ng/μL为正常建库,PCR循环数为8循环。
一种实施例中,所述PCR扩增引物浓度优选为20~40μmol/L。
构建文库时的PCR扩增引物浓度对建库浓度有重要影响,常规血浆cfDNA建库时引物浓度为10μmol/L,而脑脊液中的cfDNA建库时若也采用10μmol/L,其建库成功率低(因为样本少,cfDNA含量低),无法满足临床需求。为保障cfDNA的出库浓度在一定范围内,在升高然PCR扩增引物浓度时必须降低PCR循环数,但这又会导致低起始量的样本出库失败,样本兼容性降低。
而本申请中脑脊液的待测样本为微量样本(起始量低),其在建库时将引物浓度增加到20μmol/L以上,同时通过确定PCR循环数规则为8循环(cfDNA的质量浓度≥0.2ng/μL)或12循环(cfDNA的质量浓度<0.2ng/μL),可以在增加PCR扩增引物浓度的同时提高样本建库成功率。
由于脑脊液待测样本中一般含有有核细胞,为避免提取时有gDNA污染,到样之后需要立即进行至少两次离心再冻存或提取。离心的目的是分离出有核细胞,因此常规的离心步骤均可应用到本申请中。但本申请的一种实施方式中,优选对待测样本进行两次离心,且第一次离心时的离心力为1500~1700rcf,时间为5~30min;第二次离心时的离心力为15000~17000rcf,时间为5~30min。一种更优选地实施方式中,第一次离心时的离心力为1608rcf,时间为10min;第二次离心时的离心力为16000rcf,时间为10min。离心后提取上层清液进一步操作。若两次离心后样本冻存再解冻后出现絮状物质,无需再次离心,正常提取即可。
一种实施例中,采用游离DNA提取试剂对待测样本进行提取,所述游离DNA提取试剂包括蛋白酶K、十二烷基硫酸钠溶液、乙醇以及包含磁珠的磁珠母液;其中,所述待测样本与磁珠母液的添加比例为1mL:15μL~1mL:20μL。即每1mL待测样本中的磁珠用量为15μL~20μL,磁珠母液浓度35~45mg/mL。该添加比例范围内可以实现在避免反应不全或磁珠过剩的情况下有效增加cfDNA的提取总量。
采用Thermo MagMAX Cell-Free DNA Isolation Kit磁珠法进行cfDNA提取,适用于本发明的磁珠也称为磁球,可以是本领域中常用的磁性微球。优选的是,本发明使用的磁球是运用纳米技术制备成的超顺磁性纳米磁珠。该磁珠能在微观界面上与核酸分子特异性地识别和高效结合,在Chaotropic盐(盐酸胍、异硫氰酸胍等)和外加磁场的作用下,能从血液、动物组织、食品、病原微生物等样本中分离出DNA和RNA。
一种实施例中,由于目前杂交最高输入量的限制,在杂交时为确保片段丰富度,需保证DNA测序文库体积>50%的投入量,一般选择单杂。若能满足DNA测序文库体积>50%的投入量且多个文库杂交在一起的总量低于杂交最高输入量,也可进行多杂。
后续下机深度数据显示,同比多杂的脑脊液样本,单杂脑脊液样本去dup平均测序深度有显著提升,避免了低频突变的漏检。
在一些实施例中,所述PCR扩增引物选自Illumina测序平台引物、华大基因MGI测序平台引物、吉因加测序平台引物中的任一种。
在一些实施例中,文库扩增后,所建的文库可适用于Illumina的测序平台、深圳华大基因科技有限公司的DNBSEQ-T7、北京吉因加科技有限公司的Gene+Seq 2000、Gene+Seq200和等多家高通量测序平台。本发明所得文库所适用的测序平台不受限制,上述测序平台仅仅是示例性列举。
根据第二方面,本申请提供一种脑脊液基因测序检测方法,其使用第一方面所述建库方法制备的DNA测序文库对脑脊液中的cfDNA进行高通量测序检测。
根据第三方面,本申请提供一种脑脊液基因测序检测试剂盒,其包含有由第一方面所述建库方法制备的DNA测序文库。
根据第四方面,本申请提供一种由第一方面所述构建方法或第三方面所述试剂盒在脑脊液基因组二代测序文库构建中的应用。
本申请中所述脑脊液基因测序建库和检测方法具有以下优点和有益效果:
1.适用于血浆游离DNA(cfDNA)的检出,尤其适用于样本起始量低的脑脊液中cfDNA的片段检测(提取后低于检测下线的样本也会进行风险检测);
2.对采集后的脑脊液样本(包含有核细胞)进行两次以上离心,可以避免提取时有gDNA污染;
3.采用Labchip GX Touch进行片段质控,通过待测样本中的cfDNA质量浓度确定PCR循环数;
4.通过本申请所述建库方法,可以使文库质控合格率提升14%,DNA检测文库(建库产出的浓度>40ng/μL)占比提升29%,更多样本能够流入杂交环节;同时建库成功率(质量浓度>0.1ng/μL)为98%以上,去dup深度(≥500×)为100%,满足临床检测需求(95%以上合格率)。
附图说明
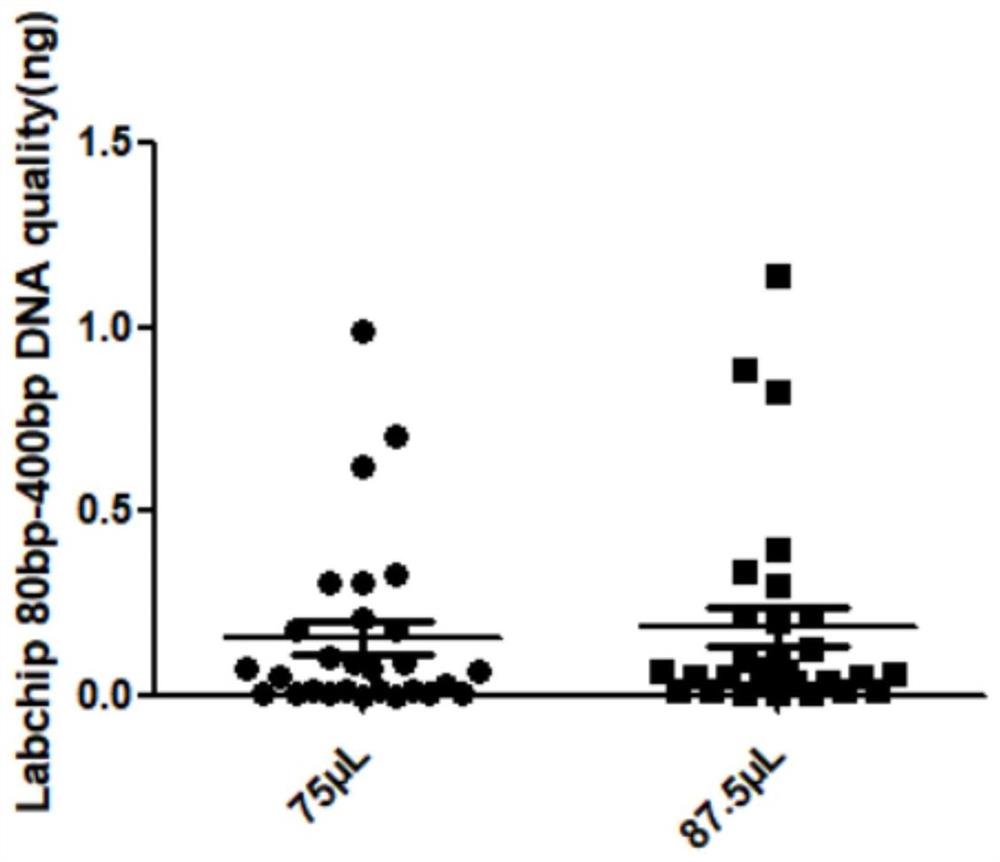
图1为实施例一中基于Labchip检测磁珠母液用量为87.5μL、75μL的DNA质量浓度对比图;
图2为实施例二中文库定量时PCR扩增引物浓度为20μmol/L、10μmol/L的出库浓度对比图;
图3为实施例三中建库时DNA测序文库的杂交基数为多杂(5杂)、单杂的去dup平均深度对比图。
具体实施方式
化学具体实施例:下面将通过具体实施例并结合附图对本发明作进一步说明。应当理解,实施例仅是示例性的,并不构成对本发明保护范围的限制。下述实施例中的实验操作,如无特殊说明,均为常规操作方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。任何与下文记载的方法和材料相似或等同的方法及材料,都可应用于本发明中。
实施例1:
本实施例提供一种脑脊液上清cfDNA的提取方法,具体步骤如下:
使用Thermo MagMAX Cell-Free DNA Isolation Kit(为游离DNA提取试剂,包括蛋白酶K、十二烷基硫酸钠溶液、乙醇以及包含磁珠的磁珠母液,为更方便表述,下文用磁珠代替磁珠母液进行描述)提取。
收集29例脑脊液待测样本,之后立即进行两次离心。第一次离心:离心力为1608rcf,时间为10min,常温离心,转移上清至新的离心管进行第二次离心;第二次离心:离心力为16000rcf,时间为10min,常温离心,转移上清至新的离心管。每例待测样本均分成两份至15mL/50mL离心管中分别进行测试,编号为1-29,30-58。均分后提取起始量为5mL,体积不足样本加入PBS(1×,pH为7.4)补充体积至5mL后再进行提取。
向待测样本中加入75μL蛋白酶K,涡旋振荡30s后,再加入250μL SDS(SDS指的是20%十二烷基硫酸钠溶液)。全部加入后,涡旋振荡30s(注:SDS会使蛋白酶K失活,因此要避免将蛋白酶K与20%SDS同时加入)。
将离心管置于60℃水浴锅中孵育20min,期间每隔5min快速上下颠倒混匀(注:颠倒混匀速度要快,避免裂解体系降温)。
准备80%乙醇(每个待测样本需要至少2mL);从水浴锅中取出离心管后,迅速放入冰中孵育5min使待测样本冷却;向离心管中加入6.25mL cfDNA Binding Solution,待测样本1-29加入
将15mL/50mL离心管置于磁力架上静置15min,吸附磁珠至液体澄清透明;吸弃上清,加入1mL DNA Wash Solution,振荡30s,瞬离,将全部液体转入对应的1.5mL离心管中;待1.5mL离心管中液体澄清后,取上清加入15mL/50mL离心管中,重悬残余磁珠并将全部液体转入1.5mL离心管中;待1.5mL离心管中液体澄清后,弃上清,再加入1mL DNA WashSolution,涡旋振荡30s,瞬离,置于1.5mL磁力架上静置1min至溶液澄清后,吸弃上清;加入1mL新鲜制备的80%乙醇,涡旋振荡30s,瞬离,1.5mL磁力架上静置1min溶液澄清后,吸弃上清;再加入1mL新鲜制备的80%乙醇,涡旋振荡30s,瞬离,1.5mL磁力架上静置1min溶液澄清后,吸弃上清。保持1.5mL离心管在磁力架上,室温干燥磁珠(磁珠呈哑光面即可,避免过度干燥);将1.5mL离心管从磁力架上取下,加入60μL Elution Solution涡旋振荡5min,重悬磁珠;将1.5mL离心管瞬离后放置在1.5mL磁力架上静置2min至液体澄清,将上清转移至对应的1.5mL cfDNA保存管中。
取2μL待测样本稀释至20μL,送检Labchip GX Touch进行片段质控,检测80-400bp片段质量浓度。剩余待测样本用于建库或置于-25~-15℃保存。
Labchip检测结果如下图1所示。由图1可知,磁珠用量为87.5μL的样本(即待测样本与磁珠的添加比例为1mL:17.5μL)与磁珠用量为75μL的样本(即待测样本与磁珠的添加比例为1mL:15μL)平均提取总量提高19%。在本申请中,优选采用磁珠用量为每1mL待测样本中的磁珠用量为15μL~20μL。
实施例2:
选取多个待测样本进行建库。使用
末端修复加A:配置如下单样本试剂反应体系(即单杂反应体系):7μL NEBNextUltra II End Prep Reaction Buffer(反应条件:20℃30min,65℃30min)。
接头连接:接头单加(为了避免接头自连,反应的mix中不能加入接头,而是单独将接头加入样本中),接头溶液为接头母液经TE缓冲液稀释至浓度为15μmol/L的溶液,本步骤所加入的接头溶液体积为2μL,接头序列以及接头母液的制备方法参见申请号为202011061421.7的中国发明专利的实施例2。配置如下单样本试剂反应体系:30μL NEBNextUltra II Ligation Master Mix、1μL NEBNext Ligation Enhancer。反应条件:20℃孵育15h。
接头连接后纯化:取一浅孔板,向每个反应孔中加入87μL Axygen磁珠,每列磁珠之间至少留一列空行用于走枪。接头连接反应产物加入相应反应孔中,吹打混匀后室温下孵育10min,使磁珠与DNA片段充分结合,孵育期间配制80%乙醇。将浅孔板置于板式磁力架上静置10min。待磁珠充分吸附后,弃去上清。向每孔加入200μL 80%乙醇,缓慢吹打3次,用300μL八孔道移液器将浅孔板板底的乙醇吸净。再向每孔加入200μL 80%乙醇重复漂洗一次,依次用300μL八孔道移液器和10μL八孔道移液器将浅孔板板底的乙醇吸净。将浅孔板置于38℃干热器上加热烘干,至磁珠表面不反光后,从干热器上取下放回板式磁力架上,向浅孔板中加入22μL TE,用移液器将磁珠吹打混匀,室温下孵育5min;孵育结束后,将浅孔板置于磁力架上至完全澄清。将上清转移20μL至八连排中。
扩增:每个样本的扩增反应体系如下:20μL样本、5μL引物、25μL 2×KAPA HiFiHotStart ReadyMix。此处5μL引物是指引物的总加入量为5μL。样本PCR扩增引物浓度为10P或20P。引物序列为申请号为202011061421.7的中国发明专利中说明书表1中的序列。
PCR循环数规则:脑脊液上清cfDNA质量浓度<0.2ng/μL为风险建库,PCR循环数为12循环;脑脊液上清cfDNA质量浓度≥0.2ng/μL为正常建库,PCR循环数为8循环。PCR反应条件如下表1所示。
表1
文库纯化:取一浅孔板,向每个反应孔中加入45μL Axygen磁珠,每列磁珠之间至少留一列空行用于走枪。接头连接反应产物加入相应反应孔中,吹打混匀后室温下孵育10min,使磁珠与DNA片段充分结合,孵育期间配制80%乙醇。将浅孔板置于板式磁力架上静置10min。待磁珠充分吸附后,弃去上清。向每孔加入200μL 80%乙醇,缓慢吹打3次,用300μL八孔道移液器将浅孔板板底的乙醇吸净。再向每孔加入200μL 80%乙醇重复漂洗一次,依次用300μL八孔道移液器和10μL八孔道移液器将浅孔板板底的乙醇吸净。将浅孔板置于38℃干热器上加热烘干,至磁珠表面不反光后,从干热器上取下放回板式磁力架上,向浅孔板中加入31μL TE,用移液器将磁珠吹打混匀,室温下孵育5min;孵育结束后,将浅孔板置于磁力架上至完全澄清。将上清转移30μL至八连排中。
文库定量结果如图2所示。由图2可知,PCR扩增引物的浓度为20P与浓度为10P的数据相比,其文库质控合格率提升14%,>40ng/μL文库占比提升29%,使更多样本能够流入杂交环节。
实施例3
选取多个样本进行单杂与多杂的数据收集,以确定建库时的DNA测序文库杂交基数采用单杂或多杂。具体步骤如下。
蒸干Mix配制:将双index接头封阻序列工作液、Cot-1 DNA和待杂交文库置于4℃解冻。融化后震荡混匀并离心,按照表2加入1.5mL离心管中,震荡混匀并离心。
表2
蒸干Mix管盖扎洞,置于真空浓缩仪中60℃浓缩蒸干,蒸干后使用封口膜封闭管盖上的孔。蒸干过程中将待杂交探针置于4℃解冻。将xGen 2X Hybridization Buffer、xGenHybridization Buffer Enhancer置于室温溶解,并振荡离心;按照表3配制变性Mix,振荡混匀后分装至蒸干的混合物中,充分振荡混匀并离心,置于恒温混匀仪上95℃变性10min。
表3
样本文库变性完成前2-3分钟,将溶解的探针分装至0.2mLPCR管中,每个反应探针用量4μL;变性完成后,将样本文库用高速离心机全速离心1min,后快速转移至PCR管中,振荡离心;将PCR管置于PCR仪上65℃杂交过夜(热盖温度75℃);过夜孵育后进行洗脱实验。洗脱实验前提前至少30分钟从-20℃冰箱中取出Wash BufferⅡ、Ⅲ、Stringent Wash Buffer和Bead Wash Buffer原液,室温解冻,按照表4中单反应用量配制浓度为1×的洗脱工作液并置于对应温度环境下提前预热。将M-270磁珠和AMPure XP磁珠置于室温平衡。
表4
平衡至室温的M-270磁珠充分振荡混匀后,吸取20μL到新的1.5mL离心管中,上磁力架吸弃上清。从磁力架上取下,使用200μL 1×Bead Wash Buffer漂洗磁珠3次,最后一次吸弃上清后加100μL 1×Bead Wash Buffer重悬磁珠并转移至新的0.2mL PCR管中备用;
将装有磁珠的PCR管上磁力架吸弃上清,将过夜孵育的杂交体系转移至磁珠管中震荡混匀并置于65℃PCR仪(热盖75℃)中孵育45分钟。孵育期间每隔15分钟取出反应管快速震荡混匀1次;按照表5试剂顺序、用量和次数进行磁珠漂洗。
表5
提前将2×KAPA HiFi HotStart ReadyMix和杂交后PCR引物(GF Primer:/5Phos/TCTCAGTACGTCAGCAGTT;以及GRPrimer:GGCATGGCGACCTTATCAG;)置于4℃解冻,并充分振荡混匀离心。按照表6配制杂交后PCR Mix备用。
表6
将20μL漂洗后重悬磁珠转移至杂交后PCR Mix中,移液器吹打混匀后置于PCR仪中,按照表7程序进行杂交后PCR。
表7
使用60μL AMPure XP磁珠对PCR产物进行纯化,最终溶解在31μL TE(pH 8.0)中(操作流程同实施例2中文库纯化)。纯化后的文库用于文库质控、测序或置于-20℃保存。
后续下机深度数据请参见图3。由图3可知,同比多杂的脑脊液样本,单杂脑脊液样本去dup平均测速深度有显著提升,避免了低频突变的漏检。因此,本申请建库时的DNA测序文库杂交基数采用单杂。
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
