一种mNGS法检测病原微生物的DNA文库构建方法
文献发布时间:2023-06-19 10:41:48
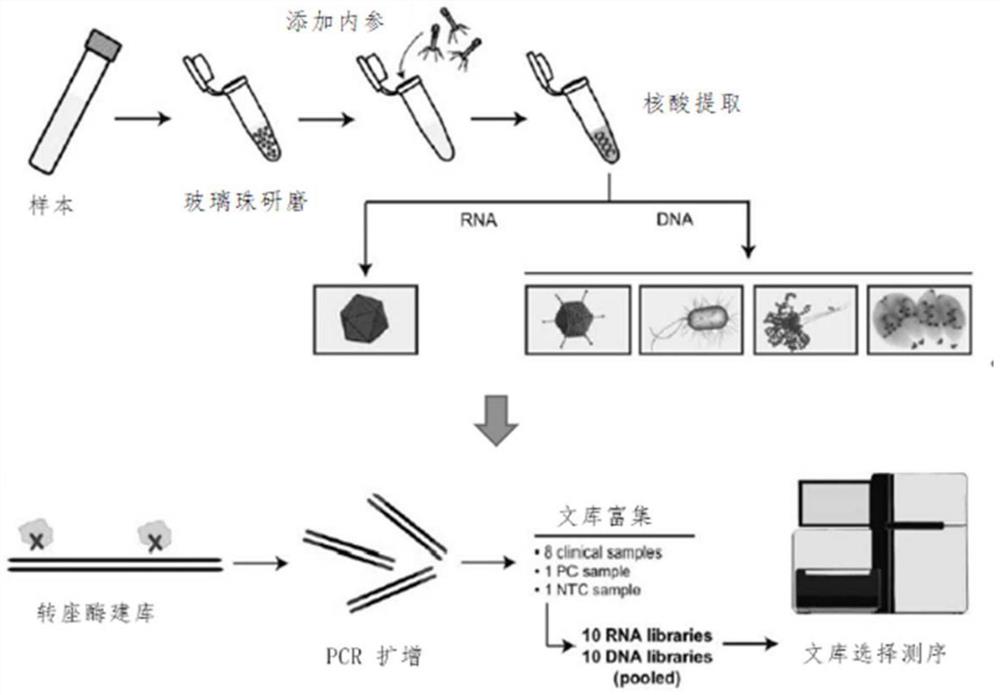
技术领域
本发明涉及生物信息技术领域,尤其涉及一种mNGS法检测病原微生物的DNA文库构建方法。
背景技术
病原微生物是指可以侵犯人体,引起感染甚至传染病的微生物,或称病原体。病原体中,以细菌和病毒的危害性最大。病原微生物指朊毒体、寄生虫(原虫、蠕虫、医学昆虫)、真菌、细菌、螺旋体、支原体、立克次体、衣原体、病毒。病原微生物感染人体后极有可能产生病症,导致感染者出现对应的感染症状。当出现感染症状时,现有技术有多种方法进行检测以判断是哪种病原微生物,进而便于疾病的治疗。
mNGS作为一种不需培养的新型技术,可以深入快速鉴定感染病原体,相比传统培养方法拥有更高敏感性的同时又与“精准诊疗”的理念相契合。Gyarmati等在2016年发表的一篇文献中指出,mNGS可以直接从血液样本中鉴定不能培养的、苛养的以及非细菌(病毒和真菌)病原体。除此之外,mNGS可以用于传染病预防,具有直接从临床样本中获的病原体传播线索的潜力。2014年,Hasman等指出mNGS可用于尿液样本中病原体以及耐药基因的检测,而且不仅耐药基因的检测结果与药敏实验一致,也与基于纯培养物的全基因组测序(WGS)的进化分析结果相匹配。
发明内容
本发明的提供一种mNGS法检测病原微生物的DNA文库构建方法。
本发明的方案是:
一种mNGS法检测病原微生物的DNA文库构建方法,包括下列步骤:
1)Tn5转座打断和产物纯化,在第一无菌PCR管配制反应体系,使用移液枪上下吸打,充分混匀,然后将所述第一无菌PCR管放入PCR仪上,设定反应程序,进行反应,反应结束后,取出所述第一无菌PCR管,往其加入6X Termination Buffer,通过涡旋或移液枪上下吸打混匀手段,充分混匀后室温下孵育3~8min,往所述第一无菌PCR管内添加DNA纯化磁珠,使用移液枪上下吸打10次,充分混匀,室温静止8~12min,将所述第一无菌PCR管置于磁力架上4~6min,待所述第一无菌PCR管内溶液澄清后,移除上清,然后进行两次漂洗处理,通过移液枪移除位于所述磁力架上的所述第一无菌PCR管管底残留乙醇,打开所述第一无菌PCR管的管盖4~6min,然后取出所述第一无菌PCR管,往里加入灭菌超纯水,充分吸打混匀,室温孵育1~3min,然后重新将所述第一无菌PCR放入所述磁力加上,待所述第一无菌PCR管内溶液澄清后,吸取所述第一无菌PCR管内上清液,用于PCR反应样本;
2)PCR文库富集,将步骤1)中PCR反应样本加入到第二无菌PCR管中,随后在所述第二无菌PCR管中配制反应体系,混匀后含有PCR反应体系的第二无菌PCR管进行离心,放入PCR仪中,设定PCR的反应程序进行反应,得到扩增好的第二无菌PCR管;
3)扩增产物片段大小分选,吸取第一轮DNA磁珠加入到扩增好的第二无菌PCR管中,充分混匀,室温孵育4~6min,将所述第二无菌PCR管置于磁力加上,待溶液澄清后,将第二无菌PCR管中的上清转移至第三无菌PCR管中,丢弃磁珠,吸取第二轮DNA磁珠加入所述第三无菌PCR管中,充分混匀,室温精致4~6min,然后将所述第三无菌PCR管放在磁力架上,待溶液澄清后,移除上清,两次漂洗处理,保持所述第三无菌PCR管在磁力架上,用移液枪移除管底残留的乙醇,并打开管盖空气干燥至管中不再有残留乙醇,取出干燥好的所述第三无菌PCR管,加入灭菌超纯水,充分混匀,室温孵育2min,重新将所述第三无菌PCR管置于磁力架上,待溶液澄清后,吸取上清液转移至新的无菌PCR管中,得到可测序文库;
4)文库选择测序,洗脱下来的文库放在-20℃冰箱长期保存,后续用Agilent 2100Bioanalyzer软件包评价文库质量,文库质控合格后,根据文库大小选择测序模式。
优选的技术方案,所述步骤1)中第一无菌PCR管配制反应体系如下:
往第一无菌PCR管中加组分时先加入ddH2O,再加入其它组分,最后统一加入Tagment Enzyme A50。
优选的技术方案,所述步骤1)中设定反应程序如下:
热盖(75℃) on;
55℃ 5min;
12℃ hold。
优选的技术方案,所述步骤1)中漂洗处理为:所述第一无菌PCR管加入80%乙醇漂洗磁珠,孵育30s后移除上清液。
优选的技术方案,所述步骤2)中第二无菌PCR管中配制反应体系如下:
优选的技术方案,所述步骤2)中设定PCR的反应程序如下:
其中,步骤S4至S6进行7次循环。
优选的技术方案,步骤3)中第一轮DNA磁珠与第二轮DNA用量筛选如下:
文库平均长度~250bp,第一轮DNA磁珠用量45μl,第二轮DNA磁珠用量10μl;文库平均长度~350bp,第一轮DNA磁珠用量45μl,第二轮DNA磁珠用量7.5μl;文库平均长度~450bp,第一轮DNA磁珠用量30μl,第二轮DNA磁珠用量7.5μl;文库平均长度~550bp,第一轮DNA磁珠用量25μl,第二轮DNA磁珠用量7.5μl。
优选的技术方案,所述步骤3)中漂洗处理为:第三无菌PCR管加入加入80%乙醇漂洗磁珠,孵育30s后移除上清。
优选的技术方案,所述步骤4)中测序模式为脑脊液20M reads;肺泡灌洗液40Mreads;血浆50M reads;痰液80M reads;胸腹水100M reads;其他20M reads。
由于采用了上述技术方案一种mNGS法检测病原微生物的DNA文库构建方法,1)Tn5转座打断和产物纯化,在第一无菌PCR管配制反应体系,使用移液枪上下吸打,充分混匀,然后将所述第一无菌PCR管放入PCR仪上,设定反应程序,进行反应,反应结束后,取出所述第一无菌PCR管,往其加入6X Termination Buffer,通过涡旋或移液枪上下吸打混匀手段,充分混匀后室温下孵育3~8min,往所述第一无菌PCR管内添加DNA纯化磁珠,使用移液枪上下吸打10次,充分混匀,室温静止8~12min,将所述第一无菌PCR管置于磁力架上4~6min,待所述第一无菌PCR管内溶液澄清后,移除上清,然后进行两次漂洗处理,通过移液枪移除位于所述磁力架上的所述第一无菌PCR管管底残留乙醇,打开所述第一无菌PCR管的管盖4~6min,然后取出所述第一无菌PCR管,往里加入灭菌超纯水,充分吸打混匀,室温孵育1~3min,然后重新将所述第一无菌PCR放入所述磁力加上,待所述第一无菌PCR管内溶液澄清后,吸取所述第一无菌PCR管内上清液,用于PCR反应样本;2)PCR文库富集,将步骤1)中PCR反应样本加入到第二无菌PCR管中,随后在所述第二无菌PCR管中配制反应体系,混匀后含有PCR反应体系的第二无菌PCR管进行离心,放入PCR仪中,设定PCR的反应程序进行反应,得到扩增好的第二无菌PCR管;3)扩增产物片段大小分选,吸取第一轮DNA磁珠加入到扩增好的第二无菌PCR管中,充分混匀,室温孵育4~6min,将所述第二无菌PCR管置于磁力加上,待溶液澄清后,将第二无菌PCR管中的上清转移至第三无菌PCR管中,丢弃磁珠,吸取第二轮DNA磁珠加入所述第三无菌PCR管中,充分混匀,室温精致4~6min,然后将所述第三无菌PCR管放在磁力架上,待溶液澄清后,移除上清,两次漂洗处理,保持所述第三无菌PCR管在磁力架上,用移液枪移除管底残留的乙醇,并打开管盖空气干燥至管中不再有残留乙醇,取出干燥好的所述第三无菌PCR管,加入灭菌超纯水,充分混匀,室温孵育2min,重新将所述第三无菌PCR管置于磁力架上,待溶液澄清后,吸取上清液转移至新的无菌PCR管中,得到可测序文库;4)文库选择测序,洗脱下来的文库放在-20℃冰箱长期保存,后续用Agilent 2100Bioanalyzer软件包评价文库质量,文库质控合格后,根据文库大小选择测序模式。
本发明的优点:
本发明将传统的耗时10-11个小时的病原微生物DNA/RNA共建库,缩短至仅需几个小时,大大缩短了建库时间,提高文库产出和下机数据质量,帮助得到更多真实信息;
本发明具有较高的cDNA杂合链打断效率,有效防止转座酶粘在DNA上,有利于文库扩增,得到高产量的文库,避免样本导致转座酶加入时间不同,引起打断片段大小有差异,精确度高,准确信强,并且提高了文库的保存时间。
附图说明
图1为本发明实施例的高通量病原微生物检测流程图;
图2为本发明实施例的文库片段大小分布图。
具体实施方式
为了弥补以上不足,本发明提供了一种mNGS法检测病原微生物的DNA文库构建方法以解决上述背景技术中的问题。
一种mNGS法检测病原微生物的DNA文库构建方法,包括下列步骤:
1)Tn5转座打断和产物纯化,在第一无菌PCR管配制反应体系,使用移液枪上下吸打,充分混匀,然后将所述第一无菌PCR管放入PCR仪上,设定反应程序,进行反应,反应结束后,取出所述第一无菌PCR管,往其加入6X Termination Buffer,通过涡旋或移液枪上下吸打混匀手段,充分混匀后室温下孵育3~8min,往所述第一无菌PCR管内添加DNA纯化磁珠,使用移液枪上下吸打10次,充分混匀,室温静止8~12min,将所述第一无菌PCR管置于磁力架上4~6min,待所述第一无菌PCR管内溶液澄清后,移除上清,然后进行两次漂洗处理,通过移液枪移除位于所述磁力架上的所述第一无菌PCR管管底残留乙醇,打开所述第一无菌PCR管的管盖4~6min,然后取出所述第一无菌PCR管,往里加入灭菌超纯水,充分吸打混匀,室温孵育1~3min,然后重新将所述第一无菌PCR放入所述磁力加上,待所述第一无菌PCR管内溶液澄清后,吸取所述第一无菌PCR管内上清液,用于PCR反应样本;
2)PCR文库富集,将步骤1)中PCR反应样本加入到第二无菌PCR管中,随后在所述第二无菌PCR管中配制反应体系,混匀后含有PCR反应体系的第二无菌PCR管进行离心,放入PCR仪中,设定PCR的反应程序进行反应,得到扩增好的第二无菌PCR管;
3)扩增产物片段大小分选,吸取第一轮DNA磁珠加入到扩增好的第二无菌PCR管中,充分混匀,室温孵育4~6min,将所述第二无菌PCR管置于磁力加上,待溶液澄清后,将第二无菌PCR管中的上清转移至第三无菌PCR管中,丢弃磁珠,吸取第二轮DNA磁珠加入所述第三无菌PCR管中,充分混匀,室温精致4~6min,然后将所述第三无菌PCR管放在磁力架上,待溶液澄清后,移除上清,两次漂洗处理,保持所述第三无菌PCR管在磁力架上,用移液枪移除管底残留的乙醇,并打开管盖空气干燥至管中不再有残留乙醇,取出干燥好的所述第三无菌PCR管,加入灭菌超纯水,充分混匀,室温孵育2min,重新将所述第三无菌PCR管置于磁力架上,待溶液澄清后,吸取上清液转移至新的无菌PCR管中,得到可测序文库;
4)文库选择测序,洗脱下来的文库放在-20℃冰箱长期保存,后续用Agilent2100Bioanalyzer软件包评价文库质量,文库质控合格后,根据文库大小选择测序模式。
所述步骤1)中第一无菌PCR管配制反应体系如下:
往第一无菌PCR管中加组分时先加入ddH2O,再加入其它组分,最后统一加入Tagment Enzyme A50。
所述步骤1)中设定反应程序如下:
热盖(75℃) on;
55℃ 5min;
12℃ hold。
所述步骤1)中漂洗处理为:所述第一无菌PCR管加入80%乙醇漂洗磁珠,孵育30s后移除上清液。
所述步骤2)中第二无菌PCR管中配制反应体系如下:
所述步骤2)中设定PCR的反应程序如下:
其中,步骤S4至S6进行7次循环。
步骤3)中第一轮DNA磁珠与第二轮DNA用量筛选如下:
文库平均长度~250bp,第一轮DNA磁珠用量45μl,第二轮DNA磁珠用量10μl;文库平均长度~350bp,第一轮DNA磁珠用量45μl,第二轮DNA磁珠用量7.5μl;文库平均长度~450bp,第一轮DNA磁珠用量30μl,第二轮DNA磁珠用量7.5μl;文库平均长度~550bp,第一轮DNA磁珠用量25μl,第二轮DNA磁珠用量7.5μl。
所述步骤3)中漂洗处理为:第三无菌PCR管加入加入80%乙醇漂洗磁珠,孵育30s后移除上清。
所述步骤4)中测序模式为脑脊液20M reads;肺泡灌洗液40M reads;血浆50Mreads;痰液80M reads;胸腹水100M reads;其他20M reads。
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐述本发明。
实施例:
自备材料:磁力架、PCR仪、PCR管、DNA纯化磁珠,无水乙醇,Dual DNA Adapter96Kit for One-step DNA Lib Prep。
操作步骤:
1.Tn5转座打断和产物纯化:
1.1在无菌PCR管中配制以下反应体系:
该步骤加组分时可以先加入ddH
1.2使用移液枪上下吸打,充分混匀。
该步骤混匀不充分,可能导致打断反应不充分,产生过大或过小的片段,影响后续的结果分析。
1.3将PCR管放到PCR仪上,进行如下的反应程序:
热盖(75℃) on
55℃ 5min
12℃ hold
1.4反应结束后,立即取出PCR管,加入10μl 6X Termination Buffer,涡旋或使用移液枪上下吸打混匀,充分混匀后室温孵育5min。
该步骤是终止打断反应,使转座酶和DNA片段相互分离,若不进行此步,会导致文库产量降低,但不影响建库。
1.5向PCR管中加入60μl DNA纯化磁珠,使用移液枪上下吸打10次,充分混匀,室温静止10min。
1.6将PCR管置于磁力架上约5min,待溶液澄清后,移除上清。
该步骤移除上清时注意不要碰到磁珠。
1.7加入200μl的80%乙醇漂洗磁珠,孵育30s后移除上清液。
1.8重复步骤1.7一次。
1.9保持PCR管在磁力架上,用10μl移液枪移除管底残留的乙醇,并打开PCR管盖空气干燥至管中不再有残留乙醇(5min左右)。
1.10取出干燥的PCR管,加入18μl灭菌超纯水,充分吸打混匀,室温孵育2min。
1.11重新将PCR管置于磁力架上,待溶液澄清后,吸取15μl上清液用于PCR反应。
2.PCR文库富集:
2.1在无菌PCR管中配制如下反应体系:
2.2将混匀的PCR反应体系离心后放入PCR仪中,设置反应程序:
2.3 PCR反应结束后,可直接进行扩增产物分选。
3.扩增产物片段大小分选:
扩增产物需要进行片段大小分选,筛选方案具体如下表所示:
具体操作步骤如下:
3.1从4℃冰箱取出DNA磁珠,平衡至室温30min,磁珠使用前混匀,按照表中需要筛选的片段轻轻吸取第一轮磁珠需要的用量(文库平均大小~250bp),加入到扩增好的PCR管中,涡旋振荡或移液枪上下吸打10次充分混匀,室温孵育5min该步骤轻轻吸取磁珠、加入PCR管中时,管壁、枪头不要残留磁珠,否则片段大小分选结果会与预期不符。
3.2将PCR管置于磁力架上,待溶液澄清后(5min),小心转移上清至新的无菌PCR管中,丢弃磁珠。
该步骤吸取上清时不要吸到磁珠。
3.3按照表中第二轮磁珠需要的用量,吸取相应体积的磁珠加入至新的PCR管中,涡旋振荡或移液枪上下吸打充分混匀,室温静置5min。
3.4将PCR管放到磁力架上,待溶液澄清(5min)后,小心移除上清。
3.5加入200μl的80%乙醇漂洗磁珠,孵育30s后移除上清。
3.6重复步骤3.5一次。
3.7保持PCR管在磁力架上,用10μl移液枪移除管底残留的乙醇,并打开管盖空气干燥至管中不再有残留乙醇(约5min左右)。
3.8取出干燥好的PCR管,加入22μl的灭菌超纯水,涡旋振荡或使用移液枪上下吸打10次充分混匀,室温孵育2min。
3.9重新将PCR管置于磁力架上,待溶液澄清后,吸取上清液20μl转移至新的无菌PCR管中。
洗脱下来的文库可以放在-20℃冰箱长期保存,后续用Agilent 2100Bioanalyzer评价文库质量,文库质控合格后,根据文库大小选择测序模式(推荐脑脊液:20M reads;肺泡灌洗液:40M reads;血浆:50M reads;痰液:80M reads;胸腹水:100Mreads;其他:20M reads;SE75,Nextseq 500)。
以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
