用于检测和分析自由硫醇的系统和方法
文献发布时间:2023-06-19 10:58:46
本申请要求于2018年8月23日提交的题为“用于检测和分析自由硫醇的系统和方法(Systems and Methods for the Detection and Analysis of Free Thiol)”的美国临时申请第62/722,012号的优先权和权益,所述美国临时申请的公开内容通过全文引用的方式并入本文。
技术领域
本文描述的一些实施例涉及用于检测和分析生物材料样品中的自由硫醇的系统、设备和方法。
背景技术
硫醇是包含碳键合的巯基(R-SH)的有机硫化合物,R为烷基或芳香族或类似取代基。硫醇(也被称为自由硫醇和/或自由硫醇基)是醇的硫类似物,其中硫代替了醇的羟基(-OH)中的氧。硫醇还可以通过还原包含一个或多个二硫桥或二硫基的化合物来产生,所述一个或多个二硫桥或二硫基在还原后变成自由硫醇并且有助于化合物的总硫醇内含物。
硫醇在若干种天然存在的和合成的生物有机分子中起重要作用。生物系统中的自由硫醇具有重要的调节作用。例如,已知半胱氨酸残基的氧化修饰的硫醇基调节越来越多的蛋白质的活性。作为另一个实例,二硫键形成是关键的翻译后修饰,其中涉及许多蛋白质的结构、功能和稳定性。虽然二硫键形成对于许多蛋白质而言是必需且必要的过程,但对其它蛋白质而言却是有害和破坏性的。细胞通过硫醇-二硫化物交换反应调节硫醇-二硫键稳态,这在细胞功能的许多方面起着至关重要的作用。自由硫醇(例如,与蛋白质上的自由半胱氨酸、谷胱甘肽和半胱氨酸残基相关的硫醇)的检测和测量是用于研究许多生物系统中生物学过程和事件的重要工具。
硫醇基可以存在于各种蛋白质上,例如作为各种蛋白质中包含的半胱氨酸残基的一部分。硫醇基也可以存在于各种蛋白质同种型上,所述蛋白质同种型是起相同或类似的生物学作用的一组高度类似的蛋白质。一组蛋白质同种型可以由单个基因的可替代的剪接或其它转录后修饰形成。硫醇基可以存在于合成衍生的产物上,如抗体-药物缀合物(ADC)、生物缀合物和免疫缀合物以及其它生物制药药物,所述合成衍生的产物被设计为用于治疗各种病状(例如,治疗各种癌症)的靶向疗法。例如,ADS将抗体的特异性、有利的药代动力学和生物分布与高效药物的破坏潜力进行组合。例如,在一些情况下,ADC可以被设计成将单克隆抗体的靶向能力与被设计成区分健康组织与患病组织的细胞毒性药物的癌症杀死能力进行组合。因此,与化学疗法不同,ADC可以靶向并杀死肿瘤细胞,同时不伤害健康细胞。ADC通过将特异性抗体与特异性治疗药物连接或缀合而形成。抗体上存在的硫醇基可以用作连接位点以缀合药物以形成ADC。在一些情况下,ADC可以包含通过硫醇基与生物活性细胞毒性(抗癌)有效负载或药物连接的抗体。
与生物系统中大多数其它常见物质相比,硫醇通常凭借其相对较高的反应性直接被检测到。然而,分析如以上所提及的样品等样品中的硫醇内含物存在重大挑战。例如,目前可用的定量自由硫醇的方法缺乏进一步的特异性,如可以包含自由硫醇基(例如包含在半胱氨酸残基中)的特异性蛋白质或蛋白质同种型。在生物治疗学的发展中,例如,知道哪些同种型具有特定特征(如自由硫醇基的存在)对于确定每种同种型的允许极限是重要的。
越来越多地开发了传统治疗性抗体的替代性形式,包含使用具有另外的二硫键的IgG2抗体。例如,此类抗体可以用于ADC(抗体药物缀合物)、双特异性抗体、多特异性抗体和其它多价和/或缀合物产物的开发中。此外,一些产物可能涉及在重新组装最终产物之前还原抗体半部。另外,ADC产物的抗体通常具有用于附接药物缀合物接头的经工程化的半胱氨酸。这些过程可能导致自由硫醇异质性增加。因此,分析此类同种型可能是有益的。然而,用于检测自由硫醇内含物的已知技术通常不足以检测此类抗体的自由硫醇内含物。例如,用于对硫醇内含物进行定量的已知技术涉及一次用一种标志物测试样品的一部分,这涉及大量的时间和费用。作为另一个实例,测量硫醇内含物的一些已知方法无法区分自由硫醇与二硫桥。
当前缺乏用于客观地鉴定和定量生物样品中自由硫醇和总硫醇内含物的方法,其中所述方法对样品的单独的部分(如蛋白质同种型)具有特异性。因此,存在对用于对含蛋白质的样品进行解卷积并且分析解卷积或分离的样品的自由硫醇和/或总硫醇内含物的方法和设备的需要。
发明内容
本文描述的一些实施例涉及用于对含有生物材料的样品进行差分分析的系统、设备和方法,所述生物材料如包含硫醇基和/或二硫桥的蛋白质同种型。
在一些实施例中,一种方法包含由含有多种蛋白质同种型的样品产生第一样品部分和第二样品部分,所述多种蛋白质同种型中的至少一些蛋白质同种型具有一个或多个自由硫醇基。所述方法包含将荧光检测结合剂施加到所述第一样品部分,所述荧光检测结合剂被配置成与自由硫醇基结合以产生缀合的硫醇,而不会还原包含在所述第一样品部分中的所述多种蛋白质同种型。所述方法包含将所述第一样品部分中的所述多种蛋白质同种型分离,以产生第一组分离的蛋白质同种型,并且将所述第二样品部分中的所述多种蛋白质同种型分离,以产生第二组分离的蛋白质同种型。所述方法包含检测与所述缀合的硫醇相关的第一荧光信号和与所述第一组分离的蛋白质同种型相关的吸光度信号。所述方法进一步包含基于所述吸光度信号,鉴定来自所述第一组分离的蛋白质同种型的每种分离的蛋白质同种型的数量或身份中的至少一个。所述方法还包含:检测与所述第二组分离的蛋白质同种型相关的第二荧光信号;以及基于所述第一荧光信号与所述第二荧光信号之间的差异,测量与来自所述第一组分离的蛋白质同种型的每种分离的蛋白质同种型相关的自由硫醇基的数量。
在一些实施例中,一种系统包含存储器和与所述存储器操作性地耦接的处理器。所述处理器被配置成接收与第一组分离的蛋白质同种型相关的荧光信号。所述第一组分离的蛋白质同种型可以从含有多种蛋白质同种型的样品的第一部分获得,来自所述多种蛋白质同种型的至少一些蛋白质同种型具有一个或多个自由硫醇基。所述荧光信号可以与施加到所述第一样品部分的荧光检测结合剂相关,所述荧光检测结合剂被配置成与自由硫醇基结合。所述处理器可被配置成接收与所述第一组分离的蛋白质同种型相关的第一吸光度信号,并且接收与所述样品的第二部分相关的第二吸光度信号。所述处理器可以被进一步配置成基于所述第一吸光度信号和所述第二吸光度信号,鉴定来自所述样品的所述蛋白质同种型的至少一个子集,并且基于所述荧光信号,计算与来自所述蛋白质同种型的所述子集的每种蛋白质同种型相关的自由硫醇基的数量。
在一些实施例中,一种方法包含将一组荧光检测结合剂施加到含有多种蛋白质同种型的样品。所述一组荧光检测结合剂可以被配置成与自由硫醇结合,而不会还原蛋白质同种型。所述方法包含通过等电聚焦分离所述样品以产生一组分离的蛋白质同种型。所述方法进一步包含:获得与所述一组分离的蛋白质同种型相关的荧光信号和吸光度信号;基于所述吸光度信号,鉴定来自所述一组分离的蛋白质同种型的每种分离的蛋白质同种型的数量或身份中的至少一个;以及基于所述荧光信号,测量与来自所述一组分离的蛋白质同种型的每种分离的蛋白质同种型相关的自由硫醇的数量。
在一些实施例中,一种方法包含处理含有蛋白质和/或蛋白质同种型的混合物的样品的至少一部分。所述方法包含:制备可能含有硫醇的样品;以及将所述样品分成第一部分和第二部分。所述方法包含将所述样品的所述第一部分与靶向自由硫醇基的一种或多种特异性检测结合剂缀合以产生缀合的硫醇。所述方法包含:分离所述样品的所述第一部分和所述第二部分中的所述蛋白质或蛋白质同种型;以及对所述样品的所述第一部分和所述第二部分的分离的内含物进行荧光发射测量。所述方法进一步包含将所述样品的所述第一部分的荧光测量结果与所述样品的所述第二部分的荧光测量结果进行比较,所述第一部分包含与检测结合剂缀合的分离的蛋白质或蛋白质同种型,所述第二部分包含与所述第一部分的分离的蛋白质或蛋白质同种型类似但与检测结合剂未缀合的分离的蛋白质或蛋白质同种型。所述方法进一步包含基于以上描述的从所述样品的所述第一部分和所述第二部分的所述分离的内含物获得的荧光测量结果的比较,对所述样品的所述分离的内含物中的自由硫醇内含物的量进行定量。
在一些情况下,除了荧光测量之外,所述方法任选地包含从所述样品的所述第一部分和所述第二部分的所述分离的内含物进行吸光度测量(例如,紫外(UV)吸光度测量),并且比较所述样品的所述第一部分和所述第二部分的所述分离的内含物的吸光度测量结果。在此类情况下,基于所述吸光度测量结果的比较,所述方法包含通过对缀合的检测结合剂进行解卷积和所述缀合的检测结合剂对吸光度的贡献(例如,来自充当检测结合剂的缀合的荧光染料或抗体的增加的UV吸光度)来对所述分离的蛋白质或蛋白质同种型的量进行定量。
在一些情况下,所述方法进一步包含评估所述样品的总硫醇内含物是否呈自由硫醇形式。例如,如果所述样品可以包含硫醇和二硫基,则所述方法包含确定所述样品中是否可能存在二硫桥。如果确定所述样品潜在地含有二硫基,则所述方法包含使用合适的方法将任何潜在的二硫基转化为硫醇基,并且按照以上描述且在本文中进一步详细描述的程序进行自由硫醇检测。
附图说明
图1是根据实施例的系统的示意图,所述系统被配置成进行差分分析以对含有蛋白质和/或蛋白质同种型的混合物的样品中的自由硫醇内含物进行定量。
图2是根据实施例的方法的流程图,所述方法用于进行差分分析以对含有蛋白质和/或蛋白质同种型的混合物的样品中的自由硫醇内含物进行定量。
图3是根据实施例的方法的流程图,所述方法用于进行差分分析以对含有蛋白质和/或蛋白质同种型的混合物的样品中的自由硫醇内含物进行定量。
图4A是示出了根据实施例的示例吸光度信号随等电点而变化所绘制的曲线图的图,所述示例吸光度信号是使用本文所述的系统从含有多种蛋白质和/或蛋白质同种型的样品中检测到的。
图4B是示出了根据实施例的示例荧光信号随等电点而变化所绘制的曲线图的图,所述示例荧光信号是使用本文所述的系统从图4A所示的含有多种蛋白质和/或蛋白质同种型的样品中检测到的。
图5是示出了根据实施例的,如使用本文所述的系统分析的图4A的吸光度信号和图4B所示的荧光信号的重叠的图,其指示在每个信号中观察到的峰与在另一个信号中观察到的峰之间的关系,所述峰与多种蛋白质和/或蛋白质同种型的一组多种蛋白质和/或蛋白质同种型相关。
具体实施方式
本公开的系统、方法和设备涉及对含有蛋白质和/或蛋白质同种型的混合物的样品中的自由硫醇内含物进行定量和差分分析。
图1示出了示例自由硫醇分析(FTA)系统100的示意图。FTA系统(在此也被称为“分析系统”或简称为“系统”)可操作以对含有蛋白质和/或蛋白质同种型的混合物的样品进行差分分析,以定量自由硫醇内含物。进行差分分析可以包含(i)使用任何合适的分离方法分离样品中的内含物,如蛋白质和/或蛋白质同种型,以及(ii)使用与样品中的蛋白质或蛋白质同种型上存在的自由硫醇基特异性结合的一种或多种类型的检测结合剂的组合来产生缀合的硫醇。
系统100包含样品操纵器102、样品探测器104、信号记录器106和信号分析器110(也被称为差分分析器或简称为分析器)。信号分析器110可以是具有处理器120和存储器140的任何合适的计算实体。例如,信号分析器可以是个人计算机、膝上型计算机、至少部分地托管在企业服务器中的企业系统,所述企业服务器例如是网络服务器、应用服务器、代理服务器、远程登录服务器、文件传输协议(FTP)服务器、邮件服务器、列表服务器、协作服务器和/或任何其它合适的计算实体。
系统100的各种组件可以以任何合适的方式(例如通过有线或无线连接方法物理地、流体地和/或电气地)互连。在一些实施例中,信号分析器110可以与样品操纵器102、样品探测器104和/或信号记录器106物理地并置(例如,安置在同一房间内或在同一壳体内)。尽管图1中未示出,但是系统100可以被配置成以任何合适的方式通过通信网络或通信信道耦接到一个或多个其它外部计算实体(例如,个人计算机、服务器、云服务器等,其可以包含处理器和存储器)。例如,可以使用外部计算实体来部分地和/或完全地实施信号分析器110。
图2是根据实施例的进行差分分析以对含有蛋白质和/或蛋白质同种型的混合物的样品中的自由硫醇和/或总硫醇进行定量的方法200的流程图。可以使用本文描述的系统(例如,参考图1描述的系统100)来执行方法200。具体地,可以分离组成蛋白质或蛋白质同种型并且单独地分析其硫醇内含物,从而允许以蛋白质特异性或同种型特异性方式同时进行蛋白质/蛋白质同种型的鉴定和自由硫醇内含物的定量。
在201处,制备含有蛋白质和/或蛋白质同种型的混合物或多种蛋白质和/或蛋白质同种型的样品。样品可以从天然存在来源如体液(如血浆、血液、尿液等)和/或组织来源的样品制备。在一些情况下,样品可以从合成产生或经工程化的来源(如合成和/或重组抗体制剂、抗体-药物缀合物(ADC)等)制备。制备样品可以包含样品的(超)离心、尺寸排阻色谱法、(超)过滤或从来源获得蛋白质级分或含有蛋白质同种型的级分的任何其它合适的手段。在一些情况下,样品制备可以包含如以下等步骤:细胞破碎、提取、溶解、去除干扰化合物、改变样品的物理/化学性质和浓度等。在一些情况下,可以遵循一系列的一个或多个步骤来基于样品的性质(如流体的类型、流体的来源、提供样品的患者的病史、样品的量或数量等)来制备样品。然后将所制备的样品被分成第一部分和第二部分。
如本文进一步详细描述的,可以使用检测结合剂对含有蛋白质和/或蛋白质同种型的混合物的样品进行差分分析以对自由硫醇内含物进行定量,所述检测结合剂被配置成与蛋白质或蛋白质同种型中的自由硫醇基结合或形成复合物以产生缀合的硫醇。在203处,可以将来自201的样品的第一部分的内含物与对硫醇基具有特异性的检测结合剂缀合,以产生缀合的硫醇。可以将含有检测结合剂的混合物与样品的第一部分合并;可以对所述混合物进行调配,使得其对样品的第一部分的内含物没有还原作用或对所述内含物的还原作用最小。
检测结合剂可以是例如被配置成与硫醇基选择性结合的荧光染料。例如,使用共价方法对蛋白质进行荧光修饰可以包含在对样品的第一部分的蛋白质内含物进行任何分离之前,用荧光染料将蛋白质或蛋白质组样品衍生化,如下文所公开的。可替代地,使用非共价方法,可以首先通过合适的分离方法(例如,通过毛细管电泳、SDS-PAGE等)分离样品的第一部分中的蛋白质或同种型,并且然后可以用与SDS-蛋白质复合物结合的染料(例如,SYPRO染料)对分离的蛋白质或同种型条带进行染色。染料可以被配置成是非还原性的,使得染料特异性地靶向样品中的自由硫醇基,而不会改变样品中存在的二硫键。
在203处用荧光染料共价标记蛋白质和蛋白质同种型混合物的硫醇基的实例是用硫醇反应性染料(如碘乙酰胺染料(例如,BODIPY TMR尸胺IA和BODIPY Fl C1-IA、-TMRIA和曙红-5-碘乙酰胺)或马来酰亚胺染料(例如,ThioGlo I和罗丹明红(Rhodamine Red)C2马来酰亚胺))对蛋白质和蛋白质同种型的半胱氨酸(Cys)残基进行标记。染料可以基于如所期望的染料浓度、预期的硫醇内含物的量、样品的第一部分中的蛋白质和/或蛋白质同种型内含物的浓度、在期望的染料浓度下与硫醇基结合的特异性等性质进行选择。
在205处,保留样品的第二部分。样品的第二部分保持未缀合到任何检测结合剂并且被保留以用作参考样品以分析第一部分的内含物,如本文中进一步详细讨论的。
在207A处,使用任何合适的分离方法分离在203处与检测结合剂(例如,荧光染料)缀合的样品的第一部分的内含物,以产生一组分离的蛋白质同种型。在一些实施例中,样品操纵器(例如,样品操纵器102)可以用于分离样品的第一部分以产生分离的蛋白质同种型。例如,可以使用如电泳(如成像的毛细管电泳、SDS-PAGE或其它合适的技术)等方法来分离具有不同的电荷、大小、迁移率和/或分子量的蛋白质。作为另一个实例,(与检测结合剂缀合的)蛋白质和/或蛋白质同种型可以基于其等电点,利用如(毛细管或基于凝胶的)等电聚焦(IEF)等方法进行分离。分离之后,样品的第一部分的内含物可以呈蛋白质和/或蛋白质同种型的分离条带的形式,任选地固定在如凝胶或毛细管等介质中。在一些情况下,如以上所公开的,可以首先分离蛋白质和/或蛋白质同种型(例如,如流程图200的207A处所述),并且可以将蛋白质和/或蛋白质同种型的分离条带与非共价染料缀合(例如,如流程图200的203处所述)。
在207B处,使样品的第二部分(与检测结合剂未缀合的部分)的内含物经历与207A处的样品的第一部分类似的分离程序。分离之后,样品第二部分的内含物可以呈蛋白质和/或蛋白质同种型的分离条带的形式,任选地固定在如凝胶或毛细管等介质中。例如,样品操纵器(例如,样品操纵器102)可以将样品的第二部分分离成分离的蛋白质同种型。在一些实施方案中,样品操纵和/或分离可以以板形式进行。在一些实施例中,样品的第一部分的内含物与样品的第二部分的内含物的分离可以同时和/或并行进行。例如,样品的第一部分和样品的第二部分可以在单次分离运行期间在样品操纵器(例如,本文所述的样品操纵器102)中限定的平行毛细管或凝胶泳道中分离。在其它实施例中,样品的第一部分和样品的第二部分的内含物可以在不同/顺序的分离运行中进行分离。
在209A处,通过荧光发射测量来检测样品的第一部分的与检测结合剂缀合的分离的蛋白质和/或蛋白质同种型的条带。在一些实施例中,样品探测器(例如,样品探测器104)可以用于诱导和/或测量来自缀合的检测结合剂的荧光发射。例如,可以使用合适的荧光成像技术,使用合适波长(例如,选择以匹配所使用的检测结合剂的激发光谱)和合适强度的光来探测含有缀合的蛋白或蛋白质同种型的分离条带的介质,持续预定时间段(在本文中也被称为“曝光”),并且激发缀合的荧光染料。可以响应于激发光探针而发射荧光信号。因为检测结合剂与硫醇基选择性地结合,所以荧光信号可以与缀合的硫醇相关。检测、记录和/或存储发射的荧光信号以进行进一步的分析,所述发射的荧光信号可以与缀合的蛋白质和同种型的分离条带中的硫醇基相关。在一些实施例中,可以使用信号记录器(例如,信号记录器106)来检测和/或定量所发射的荧光信号,以获得荧光测量结果。在一些情况下,可以对检测到的荧光信号进行分析并且将其转换为合适的表示,例如,呈信号强度随记录时间而变化的图示的形式或信号强度随扫描位置而变化的图示的形式的示例表示。在一些情况下,所记录的荧光信号可以被转换为介质在两个或三个空间维度上的空间图的形式,其中具有或不具有与信号的记录时间相对应的时间维度。换句话说,在一些情况下,介质的表示可以是图像或三维图像堆栈,每个图像对应于介质的二维或三维视图的单个实例捕获,其中像素对应于沿介质上的预定轴线的位置。在其它情况下,介质的表示可以是在一段时间内捕获的二维或三维空间区域的视频。介质的表示可以包含缀合的蛋白质和/或蛋白质同种型的分离条带,其中荧光强度根据硫醇内含物而变化。
在209B处,使用与上述参考209A处进行荧光发射测量的那些技术类似的技术,探测样品的与检测结合剂未缀合的第二部分的分离的蛋白质或蛋白质同种型的条带。在一些情况下,可以从样品的与检测结合剂未缀合的第二部分的分离的蛋白质或蛋白质同种型中捕获本体荧光(或自发荧光)信号。在一些实施例中,样品探测器(例如,样品探测器104)可以用于诱导和/或测量来自缀合的检测结合剂的本体荧光发射。例如,可以使用与209A中相同或类似的荧光成像技术,使用用于诱导荧光发射的相同的波长或频率和强度的光来探测含有未缀合的蛋白质或蛋白质同种型的分离条带的介质。可以以与在209A处执行的方式类似的方式记录和存储响应于光探针的信号。在一些实施例中,可以使用信号记录器(例如,信号记录器106)来检测和/或定量所发射的本体荧光信号,以获得本体荧光测量结果。例如,响应于激发光探针的信号可以是含有介质的空间图的图像,所述介质含有缀合的蛋白质和/或蛋白质同种型的分离条带。然而,与209A处的结果不同,在209B处获得的图可能缺少与硫醇内含物的指标相对应的任何显著的荧光强度。209A和209B处的荧光发射的测量可以顺序地或以基本上并行的方式进行。
在213处,将在209A处从第一部分(与荧光染料缀合)的分离的内含物记录的荧光测量结果与从样品的第二部分(未缀合)的分离的内含物获得的荧光测量结果(也被称为本体荧光)进行比较。基于在213处进行的比较,在217处确定样品中的自由硫醇内含物的相对量。例如,在一些情况下,样品中的自由硫醇内含物的相对量可以基于从与荧光检测结合剂缀合的第一部分的分离的内含物记录的荧光测量结果与从与检测结合剂未缀合的第二部分的分离的内含物测得的本体荧光之间的差异来确定。在一些情况下,如上所述,来自209A和209B的结果可以呈图像的形式,所述图像含有分离的蛋白质和/或蛋白质同种型的空间图,所述空间图具有209A和209B处的分别含有呈缀合形式(209A)和未缀合形式(209B)的相同蛋白质或同种型的介质的对应位置(例如,毛细管中、SDS-PAGE凝胶或IEF介质上的位置)。因此,含有来自209A和209B的介质的空间图的所得荧光图像可以含有荧光标记,所述荧光标记分别指示相同蛋白质或蛋白质同种型上存在和不存在荧光染料。在一些情况下,取决于用于结合样品的第一部分中的自由硫醇的检测结合剂,参考相同身份的未缀合的蛋白质或同种型的位置,缀合的蛋白或同种型的分离条带的相对位置可能存在偏移或差异。例如,检测结合剂可以改变蛋白质或同种型的迁移率、等电点或其它特性。在对基于蛋白质或同种型的分离条带的结果的任何分析期间(例如,在如下所述的对荧光发射或UV吸光度的分析期间),可以考虑此类偏移。
如上所述,来自209A的图像示出了荧光信号,所述荧光信号指示特异性蛋白质或蛋白质同种型所位于的位置,其中荧光强度与硫醇内含物的量相对应。而从209B采集的样品的缺少硫醇特异性荧光染料的第二部分的图像,在预期将特异性蛋白质或蛋白质同种型固定的位置处,预期示出减少的或最小的荧光信号(其中检测到的荧光是由样品或介质中的可能引起某种非零量的荧光发射的自发荧光或背景材料引起的)。因此,在来自209B的背景条件下测得的荧光可以用作用于对硫醇内含物的量进行定量的参考。在来自209B的背景条件下测得的荧光可以从来自209A的结果中的由于存在荧光染料而所占的荧光强度中减去(或者以其它方式用于校正所述荧光强度)。在其它实施例中,样品中的自由硫醇内含物的相对量可以仅基于在209A处测得的荧光来确定。
如流程图200中指示的,在一些情况下,所述方法包含测量吸光度信号(例如,与UV吸光度相关的信号)。在211A处,用如UV光等合适的刺激物探测样品的第一部分的与荧光染料缀合的分离的内含物,并且测量所得吸光度信号(在本文中也被称为“吸光度”)。在一些实施例中,样品探测器(例如,样品探测器104)可以用于用UV光探测样品的第一部分的分离的蛋白质同种型,并且信号记录器(例如,信号记录的106)可以用于测量与样品的第一部分的每种分离的蛋白质同种型相关的UV光的相对吸收。类似地,在211B处,使用类似强度下的相同光或类似刺激物,并且可以记录样品的第二部分的分离的内含物的吸光度的量。在一些实施例中,样品探测器(例如,样品探测器104)可以用于用UV光探测样品的第二部分的分离的蛋白质同种型,并且信号记录器(例如,信号记录的106)可以用于测量与样品的第二部分的每种分离的蛋白质同种型相关的UV光的相对吸收。在一些实施方案中,可以同时探测来自第一部分和第二部分的分离的蛋白质同种型,并且可以同时记录与两种药剂的每种分离的蛋白质同种型相关的相对UV吸光度。
如参考来自209A和209B的结果所描述的,来自211A和211B的结果可以呈含有与不同分离的蛋白质和/或蛋白质同种型相对应的UV吸光度的空间图的图像形式。211A和211B处的吸光度的测量可以顺序地或以基本上并行的方式进行。
在一些实施方案中,可以使用一个或多个样品探测器(例如,样品探测器104)和一个或多个信号记录器(例如,信号记录器106)同时进行在209A和209B处描述的荧光测量以及在211A和211B处描述的UB吸光度测量。例如,系统可以被配置成使得单个样品探测器(例如,UV光源)可以诱导荧光发射以及UB吸光度。作为另一个实例,信号记录器可以包含一个或多个检测臂,所述检测臂被配置成同时检测和/或记录来自样品的第一部分和/或第二部分的分离的蛋白质同种型的荧光信号和UV吸光度信号。
吸光度信号可以用于鉴定来自一组分离的蛋白质/蛋白质同种型的每种分离的蛋白质和/或蛋白质同种型的数量和/或身份。在215处,将第一部分的分离的内含物的吸光度测量结果与第二部分的分离的内含物的吸光度进行比较。在219处,基于在215处的比较,特异性蛋白质和/或蛋白质同种型的量和/或身份。例如,可以在211A处观察到增加的UV吸光度,并且增加的吸光度可以对应于缀合的染料。因此,可以解释与缀合的荧光染料相关的增加的UV吸光度,并且可以确定特定同种型的量。例如,UV吸光度可以用于确定蛋白质同种型的相对和/或绝对数量和/或浓度。与在211A和/或211B处观察到的蛋白质和/或蛋白质同种型的吸光度信号相关的峰的位置可以用于例如通过等电点、分子量等来鉴定蛋白质和/或蛋白质同种型。
在一些情况下,可以以顺序的方式进行荧光发射的测量(在209A、209B处)和UV吸光度的测量(211A、211B),其中前者紧随后者,或者反之亦然。在一些其它情况下,可以以基本上并行的方式进行荧光发射的测量(在209A、209B处)和UV吸光度的测量(211A、211B)。在一些情况下,可以基本上同时进行荧光发射的测量(在209A、209B处)和UV吸光度的测量(211A、211B)。例如,当蛋白质和/或蛋白质同种型被分离时,吸光度光源和荧光激发光源可以同时和/或顺序地实时照射样品。在一些实施方案中,吸光度光源和荧光激发光可以是发射UV范围内的光(例如,280nm)的单个光源。在其它实施方案中,吸光度光源和荧光激发光可以是不同的光源和/或以不同波长发射光。类似地,自由硫醇内含物的比较(在213处)和定量(在217处)以及蛋白质和/或蛋白质同种型的比较(215)和定量/鉴定(在219处)可以以顺序方式(其中前者紧随后者,或反之亦然)或基本上并行的方式进行。因此,在一些实施例中,可以分析含有样品的第一部分和样品的第二部分(例如,在不同泳道或毛细管中)的单次运行的荧光和吸光度。
在221处,所述方法包含询问是否指示了对样品的总硫醇内含物(和/或一个或多个分离条带的总硫醇内含物)的测试。例如,在一些情况下,用户可以指示要进行的对样品的总硫醇内含物的测试。在此类情况下,除了呈自由硫醇形式的硫醇基之外,方法200还可以用于测试和/或定量是否存在可以转化为硫醇的官能团。例如,在221处的方法可以确定将对样品中的总硫醇内含物进行定量,因为样品可以包含可以转化为硫醇的二硫基。在一些情况下,可以在已经对给定样品进行了201到219而不还原样品之后做出此类确定。在一些情况下,可以指示和进行对总硫醇内含物的测试,而无需执行步骤201到219,即不对相对自由硫醇内含物进行定量。
如果在221处对总硫醇内含物的测试和/或定量得到肯定指示,则在223处可以使用合适的程序将二硫基转化为自由硫醇基。例如,用合适浓度的合适还原剂处理样品的第一部分和第二部分可以将二硫键转化为自由硫醇基。之后,可以重复流程图200中概述的从203和205(针对样品的第一部分和第二部分中的每个部分)到217和219的过程,以确定总硫醇内含物(例如,基于每个条带/每种同种型)。还原样品之后,在对样品的第一部分和第二部分的第二次检查期间检测到的硫醇内含物的差异可以用于确定经转化的硫醇内含物的绝对和/或相对数量和/或浓度(例如,定量二硫基)。
在一些情况下,可以如上所述按照流程图200中概述的程序进行两次运行,对含有自由硫醇和可以转化为硫醇基的二硫基的样品中的总硫醇进行定量,第一运行被配置成确定样品中的自由硫醇内含物并且第二运行被配置成确定总硫醇内含物,包含经转化的硫醇基(例如,通过还原二硫基形成的硫醇基)。在一些情况下,自由硫醇和总硫醇内含物的定量可以在单次运行下通过同时检查样品的四个部分来完成。例如,部分A和B可以在不还原潜在的二硫键的情况下从蛋白质和/或蛋白质同种型的来源获得,并且部分C和D可以从蛋白质和/或蛋白质同种型的相同来源获得并且经受合适的还原剂以将二硫基转化为自由硫醇。可以使用图2的流程图200中概述的程序对四个部分A、B、C和D中的硫醇进行定量(基于每个条带和/或每种同种型),其中部分A和B分别形成第一组第一部分和第二部分,并且部分C和D分别形成第二组第一部分和第二部分。换句话说,如在步骤201-211处所描述的,部分A和C可以被视为流程图200中的第一部分,并且部分B和D可以被视为流程图200中的第二部分。因此,可以获得样品的多达全部四个部分A、B、C和D的荧光发射测量结果和/或吸光度测量结果。在213处,将部分A的荧光发射测量结果与部分B的荧光发射测量结果进行比较,并且将部分C的荧光发射测量结果与D的荧光发射测量结果进行比较。在217处,基于部分A与B之间的荧光发射测量结果比较,对未还原部分A和B中的自由硫醇的相对量进行定量。另外,在217处,基于部分C与D之间的荧光发射测量结果比较,对还原部分C和D中的硫醇的总量进行定量。然后,在225处,将来自部分A和B的自由硫醇的经定量的量与来自部分C和D的总硫醇的经定量的量进行比较,并且可以确定经转化的硫醇的量。例如,总硫醇定量与自由硫醇定量之间的差异可以用于推断还原部分C和D中存在的经转化的硫醇的量,这可能是由于从其中获得了可比较的部分A、B、C和D的原始来源中的二硫键还原所致。此外,在215处,可以将来自部分A的吸光度测量结果与来自部分B的吸光度测量结果进行比较,并且可以将来自部分C的吸光度测量结果与来自部分D的吸光度测量结果进行比较。在219处,基于部分A与B之间的吸光度测量结果比较,对未还原部分A和B中的每种分离的蛋白质和/或蛋白质同种型的相对量进行鉴定和/或定量。另外,在219处,基于部分C与D之间的吸光度测量结果比较,对还原部分C和D中的每种分离的蛋白质和/或蛋白质同种型的相对量进行鉴定和/或定量。可以比较来自各个部分的经鉴定和/或定量的蛋白质和/或蛋白质同种型,以确认和/或控制还原部分(A和B)与还原部分(C和D)基本上类似,从而考虑了还原作用和/或与结合剂缀合的作用。在一些情况下,可以比较来自各个部分的经鉴定和/或定量的蛋白质和/或蛋白质同种型,以定量还原作用(例如,二硫键的还原)或与合适的结合剂(例如,抗体)缀合的作用。
在一些情况下,通过将已经还原的样品用作流程图200中所述的第一部分和第二部分,上述过程还可以用于定量样品中的总硫醇而不定量自由硫醇。此外,在一些情况下,可以在不进行吸光度测量的情况下进行荧光测量。类似地,在一些情况下,可以在进行荧光测量的情况下进行第一部分和第二部分的吸光度测量。
如先前所描述的,可以在本文所描述的系统(如上文所描述的系统100)中进行上文所描述的过程。在一些情况下,可以以并行方式对若干个样品进行方法200中的步骤中的一个或多个步骤,例如使用多孔板固定样品部分等。在一些情况下,方法200的一个或多个步骤可以省略。在一些情况下,方法200的步骤可以以任何合适的顺序进行。在一些情况下,方法200可以包含图2中未示出的其它步骤,如方法200中所描述的,所述其它步骤用于对含有蛋白质和/或蛋白质同种型的混合物的样品中的自由硫醇和/或总硫醇进行定量。
图3是根据实施例的进行差分分析以对含有多种蛋白质和/或蛋白质同种型的样品中的自由硫醇进行定量的示例方法300的流程图。在一些情况下,方法300的各部分可以基本上类似于上文描述的方法200,并且可以使用本文所描述的系统(例如,参考图1描述的系统100)来执行。具体地,可以分离蛋白质或蛋白质同种型并分析其硫醇内含物,从而允许以蛋白质特异性或同种型特异性方式同时进行蛋白质/蛋白质同种型的鉴定和自由硫醇内含物的定量。
在301处,可以将一种或多种荧光检测结合剂施加到含有蛋白质和/或蛋白质同种型的样品。一种或多种荧光检测结合剂可以被配置成与自由硫醇结合而不会还原蛋白质和/或蛋白质同种型。如先前参考方法200所描述的,样品可以从天然存在来源如体液(如血浆、血液、尿液等)和/或组织来源的样品制备。样品可以通过任何合适的工艺,从合成产生或经工程化的来源(如合成和/或重组抗体制剂、抗体-药物缀合物(ADC)等)制备,所述任何合适的工艺包含细胞破碎、提取、溶解、去除干扰化合物、改变样品的物理/化学性质和浓度、(超)离心、尺寸排阻色谱法、(超)过滤或从来源获得蛋白质级分或含有蛋白质同种型的级分的任何其它合适的工艺。在一些情况下,如参考方法200所描述的,可以将样品分成两个或更多个部分并单独地处理。荧光检测结合剂可以基本上类似于参考方法200描述的荧光检测结合剂(例如,如在方法200的203处使用的所描述的荧光检测结合剂)。例如,荧光检测结合剂可以是荧光染料,所述荧光染料被配置成通过共价键或非共价键与自由硫醇(-SH)基团选择性地结合,被特定的预定第一波长或第一波长波段的光激发,并且以预定的第二波长或第二波段或多个波长发射光。如先前所描述的,荧光检测结合剂可以被配置成是非还原性的,使得染料特异性地靶向样品中的自由硫醇基,而不会改变样品中存在的二硫键。在一些实施方案中,荧光检测结合剂可以被配置成不改变与多种蛋白质同种型相关的电荷异质性,使得可以使用利用电荷异质性的方法来分离多种蛋白质同种型。例如,荧光检测结合剂可以被配置成不使多种蛋白质同种型的等电点偏移,使得可以基于其等电点pI来鉴定分离的蛋白质同种型。在一些实施方案中,荧光检测粘合剂可以被配置成是可UV激发的,使得暴露于UV范围内的单个波长(例如,280nm)的光可以用于获得荧光信号以及下文描述的吸光度信号。
在303处,方法300包含通过等电聚焦(或任何其它合适的技术)分离样品以产生一组分离的蛋白质同种型。在一些情况下,可以通过成像的毛细管等电聚焦(icIEF)将样品分离为一组分离的蛋白质同种型,每种分离的蛋白质同种型都包含一个或多个自由硫醇。在一些情况下,荧光检测结合剂可以被配置成不改变多种蛋白质同种型的特异性性质,使得即使与荧光结合剂缀合也可以鉴定多种蛋白质同种型中的每种蛋白质同种型。例如,在一些实施方案中,荧光结合剂可以被配置成与自由硫醇结合而不改变与多种蛋白质同种型相关的电荷分布,使得可以使用合适的方法分离和/或鉴定由荧光检测结合剂结合的多种蛋白质同种型。
作为实例,可以使用成像的毛细管等电聚焦(IEF)分离蛋白质同种型,以产生多种蛋白质同种型的一组分离的蛋白质同种型。简而言之,在一些实施方案中,IEF可以涉及将两性电解质溶液引入到一个或多个固定的pH梯度(IPG)凝胶中,所述两性电解质溶液包含与荧光检测结合剂结合的含有多种蛋白质同种型的样品。IPG可以是与pH梯度共聚合的丙烯酰胺凝胶基质,所述pH梯度可以跨pH值范围产生稳定的梯度。通过经由一组电极(例如,阳极和阴极)施加电压(例如,通过施加预定电流的DC电压),可以使IPG经受施加的电场。固定的pH梯度可以通过固定化电解质(由其pK值定义的弱酸或弱碱)的比率的连续变化来获得。在pH梯度中引入的在其等电点(pI)以下的pH区域中的蛋白质同种型可以是带正电的,并且被诱导朝阴极(带负电的电极)迁移。然而,当所述蛋白质同种型通过增加pH的梯度迁移时,蛋白质同种型的总电荷会减少,直到蛋白质同种型达到与其pI相对应的pH区域为止。此时,蛋白质同种型可能没有净电荷,并且因此迁移停止了(因为不存在朝阳极或阴极的电吸引)。因此,蛋白质同种型可以变成聚焦到锐利的固定条带中的分离的蛋白质同种型,其中每种蛋白质同种型都定位于pH梯度中与其pI相对应的点或位置处。可以基于所述蛋白质同种型的等电点(pI)鉴定每种分离的蛋白质同种型,所述等电点基于与所述分离的蛋白质同种型相关的电荷异质性或电荷分布。
在305处,方法300包含获得与一组分离的蛋白质同种型相关的荧光信号和吸光度信号。荧光信号可以与被配置成与自由硫醇结合的荧光检测结合剂相关。换句话说,荧光信号可以与通过荧光检测结合剂与分离的蛋白质同种型上的自由硫醇基结合产生的缀合的硫醇相关。如先前所描述的,可以通过利用合适的波长的光激发与分离的蛋白质同种型结合的荧光检测结合剂以诱导特定波长波段(例如,458nm)的荧光辐射发射来获得荧光信号。在一些实施方案中,系统可以包含一个或多个滤光器(例如,458nm长通滤光器,所述长通滤光器被配置成允许波长大于458nm的光通过,同时阻挡小于458nm的波长或任何其它合适的预定波长波段)用于分离并获得所关注波长波段的荧光信号。在一些情况下,方法300可以包含从样品的一部分(例如,没有与任何荧光检测结合剂缀合的样品的一部分)中获得本体荧光信号的一个或多个步骤(图3中未示出)。在一些情况下,可以将与被配置成与自由硫醇结合的荧光检测结合剂相关的荧光信号与本体荧光进行比较,以确定自由硫醇的数量,如下文所描述的。
可以通过照射通过合适的波长的光(例如,280nm的UV光)结合的分离的蛋白质同种型来获得吸光度信号,所述波长已知被分离的蛋白质同种型以不同方式吸收。在一些实施方案中,系统可以包含一个或多个滤光器(例如,短通滤光器,所述短通滤光器被配置成允许波长小于或等于280nm的光通过,同时阻挡大于280nm的波长或任何其它合适的预定波长波段)用于分离并获得所关注波长波段(例如,280nm)的吸光度信号。在一些实施方案中,可以使用单个波长的光(例如,280nm波长的UV光)来获得UV吸光度信号以及激发获得荧光信号。
在307处,方法300包含基于吸光度信号,鉴定来自一组分离的蛋白质同种型的每种分离的蛋白质同种型的数量或身份中的至少一个。吸光度信号可以包含与来自样品的每种分离的蛋白质同种型相关的差分UV吸光度,所述差分UV吸光度可以用于鉴定每种分离的蛋白质同种型。例如,与一组分离的蛋白质同种型相关的差分UV吸光度可以基于每种分离的蛋白质同种型的氨基酸组成,其中每种分离的蛋白质同种型中包含的一个或多个氨基酸对所述分离的蛋白质同种型的净UV吸光度的贡献不同。在一些实施方案中,可以基于与所述分离的蛋白同种型相关的差分UV吸光度来鉴定每种分离的蛋白质同种型。在一些实施方案中,吸光度信号的强度可以与分离的蛋白质同种型的氨基酸组成成比例。在一些实施方案中,吸光度信号的强度可以与一个或多个峰相关,每个峰对应于分离的蛋白质同种型。每个峰的强度可以与所述峰对应的分离的蛋白质同种型的身份相关。
在一些实施方案中,与每种分离的蛋白质同种型缀合的荧光检测结合剂可以有助于吸光度信号,这可能使与分离的蛋白质同种型和缀合的荧光检测结合剂的组合相关的吸光度增加。在一些此类实施方案中,可以从来自样品的第二部分(例如,样品的不与任何荧光检测结合剂缀合的部分)的第二组分离的蛋白质同种型中获得第二吸光度信号(图3中未示出)。可以将来自与荧光检测结合剂缀合的分离的蛋白质同种型的第一吸光度信号与在没有检测结合剂的贡献的情况下的第二吸光度信号进行比较以确定每种分离的蛋白质同种型的数量或身份。
在309处,方法300包含基于荧光信号测量与来自一组分离的蛋白质同种型的每种分离的蛋白质同种型相关的自由硫醇的数量。在一些实施方案中,发射的荧光辐射的强度可以与荧光结合剂的数量成比例,所述荧光结合剂的数量可以基于与每种分离的蛋白质同种型相关的自由硫醇的数量。在一些情况下,和与自由硫醇结合的荧光检测结合剂相关的荧光信号与从样品的未与任何荧光检测结合剂缀合的一部分获得的本体荧光之间的差异可以用于确定自由硫醇的数量。在一些实施方案中,荧光信号的强度可以与一个或多个峰相关,每个峰对应于分离的蛋白质同种型。每个峰的强度可以与所述峰对应的分离的蛋白质同种型的相对自由硫醇内含物相关。
在一些实施方案中,系统可以使测得的自由硫醇的数量与每种分离的蛋白质同种型的分辨的身份相关,以返回与包含在样品中含有的多种蛋白质同种型中的每种经鉴定的蛋白质同种型相关的自由硫醇的量度。在一些实施方案中,可以同时或基本上同时(例如,彼此相隔10秒内)获得吸光度信号和荧光信号。例如,系统可以包含激发源(例如,光源)和吸光度源(例如,UV光),所述激发源和吸光度源可以被同时操作以诱导荧光辐射发射和吸收(例如,UV吸收),使得发射的荧光信号和吸光度信号可以同时和/或基本上同时获得(例如,通过相同或独立的光学传感器,任选地配备有合适的滤光器组合)。
在一些实施方案中,本文描述的系统可以测量来自一组分离的蛋白质同种型的每种分离的蛋白质同种型的数量。基于每种蛋白质同种型的数量以及与所述蛋白质同种型相关的自由硫醇基的对应数量,系统可以针对每种分离的蛋白质同种型确定与所述蛋白质同种型相关的自由硫醇基的数目。
如先前所描述的,在一些实施方案中,本文所描述的系统和方法可以用于确定一组蛋白质同种型的总硫醇内含物。样品的蛋白质和/或蛋白质同种型可以被还原以从二硫基产生自由硫醇基,并且自由硫醇基的数量的确定可以如上文所描述的那样进行。例如,如上文所描述的,可以在不还原样品中的蛋白质同种型的情况下通过使用样品的第一部分来确定第一组自由硫醇基的数量。之后,样品的另一个第二部分可以用于确定总硫醇内含物。总硫醇内含物可以通过将还原剂施加到样品的第二部分来确定,所述还原剂被配置成还原二硫基以产生除第一组自由硫醇基之外的第二组自由硫醇基。
总硫醇内含物的数量可以通过按照上文参考确定自由硫醇基的数量所描述的程序来确定。例如,总硫醇的数量可以通过以下确定:将荧光检测结合剂施加到样品的经还原的第二部分;分离第二样品部分中的多种蛋白质同种型以产生第二组分离的蛋白质同种型;检测与第二组缀合的硫醇相关的荧光信号和与第二组分离的蛋白质同种型相关的第二吸光度信号。可以基于第二吸光度信号和第二荧光信号来确定来自第二组分离的蛋白质同种型的每种分离的蛋白质同种型的数量和/或身份以及相关的总硫醇内含物。如先前所描述的,在一些实施方案中,样品的经还原部分的未缀合部分可以用于获得没有来自荧光结合剂的贡献的本体荧光信号和/或吸光度信号。从来自第二样品部分的每种分离的蛋白质同种型获得的总荧光信号与从来自第二样品部分的每种分离的蛋白质同种型获得的本体荧光信号之间的差异可以用于计算与从使荧光检测结合剂与总硫醇内含物结合所产生的缀合的自由硫醇相关的荧光信号强度。没有来自荧光结合剂的贡献的吸光度信号可以用于鉴定样品的第二部分中的分离的蛋白质同种型。
在一些实施方案中,如下文(例如,参考图5)进一步详细描述的,使用本文所描述的系统和方法对含有具有自由硫醇基的蛋白质同种型的样品的检查可以包含检查处于与任何蛋白质同种型未结合或未缀合的状态的也被称为“染料空白(dye blank)”的检测结合剂(例如,荧光染料)。除了检测和测量和与蛋白质同种型缀合的检测结合剂相关的信号(例如,荧光信号和吸光度信号)外,系统还可以从与要用作参考信号(例如,图5的参考信号471和481)的任何蛋白质同种型未结合或未缀合的染料空白或检测结合剂(例如,荧光染料)中获取信号(例如,荧光信号和吸光度信号)。参考信号可以用于确定没有检测到和/或误鉴定由于伪像(例如,不与任何蛋白质同种型相关)引起的虚假峰。在一些情况下,参考信号还可以用于使用精确的基线值来对精确的荧光和/或吸光度信号进行定量。例如,从与蛋白质同种型上的自由硫醇缀合的检测结合剂获取的荧光信号与从与任何蛋白质同种型未结合的检测结合剂获取的荧光信号之间的差异可以用作精确的荧光信号。从与蛋白质同种型上的自由硫醇缀合的检测结合剂获取的吸光度信号与从与任何蛋白质同种型未结合的检测结合剂获取的吸光度信号之间的差异可以用作精确的吸光度信号。
在一些情况下,本文所描述的系统和方法可以用于计算总硫醇的数量与第一组自由硫醇基的数量之间的差,以确定由还原样品的第二部分中的二硫基产生的第二组硫醇基的数量。基于第二组硫醇基的数量和每种蛋白质同种型的数量,系统可以计算样品中包含的多种蛋白质同种型中的每种蛋白质同种型中所包含的二硫基的数量。
本文所描述的系统和方法可以用于确定蛋白质同种型中的自由硫醇的绝对数量。例如,在一些情况下,本文所描述的系统和方法可以包含将荧光检测结合剂施加到包含已知数量的自由硫醇基的标准样品以获得标准化的荧光信号。从包含与荧光检测结合剂缀合的硫醇基(例如,来自未经还原的样品或经还原的样品的自由硫醇基)的分离的蛋白质同种型中获得的荧光信号可以与标准化的荧光信号进行比较,并且基于所述比较,可以计算分离的蛋白质同种型中的硫醇基的绝对数量。例如,分离的蛋白质同种型中的硫醇基(自由硫醇基和/或总硫醇基)的绝对数量可以根据从(来自未经还原或经还原的样品部分的)分离的蛋白质同种型获得的荧光信号与和已知数量的自由硫醇基相关的标准化荧光信号的比率来计算。在一些情况下,可以基于总硫醇基的绝对数量与样品中测得的自由硫醇基的绝对数量之间的差来测量样品中的二硫基的数量。例如,总硫醇基中超过自由硫醇基的另外的硫醇基数量可以归因于通过施加还原剂还原的二硫基。
如本文所描述的,所公开的系统和方法可以用于以蛋白质同种型特异性方式确定含有蛋白质同种型的样品中的自由硫醇基的数量。进一步地,通过使用还原剂,所公开的系统和方法还可以用于以蛋白质同种型特异性方式确定样品中含有的蛋白质同种型中包含的总硫醇的数量和/或二硫基的数量。在一些情况下,经定量的硫醇基和/或二硫基可以是表面硫醇或表面二硫化物。在一些实施方案中,本文所描述的系统和方法也可以用于以蛋白质同种型特异性方式确定蛋白质同种型中的内部硫醇基和/或内部二硫基的数量。
在一些情况下,例如根据蛋白质同种型的构象状态,蛋白质同种型可以采取三维结构。基于三维结构,蛋白质同种型中包含的硫醇基和/或二硫基中的一些硫醇基和/或二硫基可以是可及的表面硫醇基和/或表面二硫基。一些其它硫醇基和/或二硫基可以是内部硫醇基和/或二硫基,其由于蛋白质同种型的三维结构或构象而对于检测结合剂而言是隐藏、未暴露和/或不可及的。在一些实施方案中,本文所描述的系统和方法可以用于通过使蛋白质同种型变性并将隐藏的内部硫醇基转化为检测结合剂可及的自由硫醇基来检测和/或定量这些内部或隐藏的硫醇基和/或二硫基。变性之后,例如通过应用尿素或任何其它合适的变性剂,本文所描述的系统和方法可以用于确定如先前所描述的自由硫醇基的数量(例如,参考上文描述的方法200和/或方法300)。
在一些实施方案中,变性之前和之后的自由硫醇基的数量的确定可以用于计算内部硫醇基的数量。例如,变性之后的自由硫醇的数量与变性之前的自由硫醇基的数量之间的差可以用于获得内部硫醇基的数量。在一些实施方案中,可以对自由硫醇基的数量和内部硫醇基的数量进行定量,并且基于对每种蛋白质同种型的数量的确定,可以确定自由硫醇基的数量和隐藏硫醇基的数量。在一些实施方案中,可以使用施加还原剂和变性剂的组合来定量自由表面硫醇基、表面二硫基、内部硫醇基和/或内部二硫基的数量。例如,可以将第一还原剂和变性剂以及第二还原剂顺序地施加到含有蛋白质同种型的样品,使得通过还原和变性步骤来递增地和/或累积地增加自由硫醇基的数量。在一些实施方案中,第一还原剂可以被配置成将表面二硫基转化为自由硫醇基。变性剂可以被配置成使内部自由硫醇基易于与检测结合剂缀合和/或使内部二硫基对于还原剂而言是可及的。第二还原剂(在一些实施方案中其可以是与第一还原剂相同的还原剂的再施加)可以被配置成将在变性之前不可及的现在可及的二硫基转化为自由硫醇基。从确定在施加还原剂之前和之后的自由硫醇基的数量,确定在施加变性剂之前和之后的自由硫醇基的数量,确定在施加第二还原剂之前和之后的自由硫醇基的数量,并且计算每个确定的自由硫醇基的数量与每次操纵之前的自由硫醇的数量之间的差,可以计算表面自由硫醇基、表面二硫基、内部硫醇基和/或内部二硫基的数量。作为实例,变性之后的自由硫醇的数量与变性之前的自由硫醇基的数量之间的差可以用于获得内部硫醇基的数量。在一些实施方案中,可以使用任何合适的方法(例如,化学变性剂、基于热的变性、基于pH的变性等)在一个或多个步骤中进行变性。
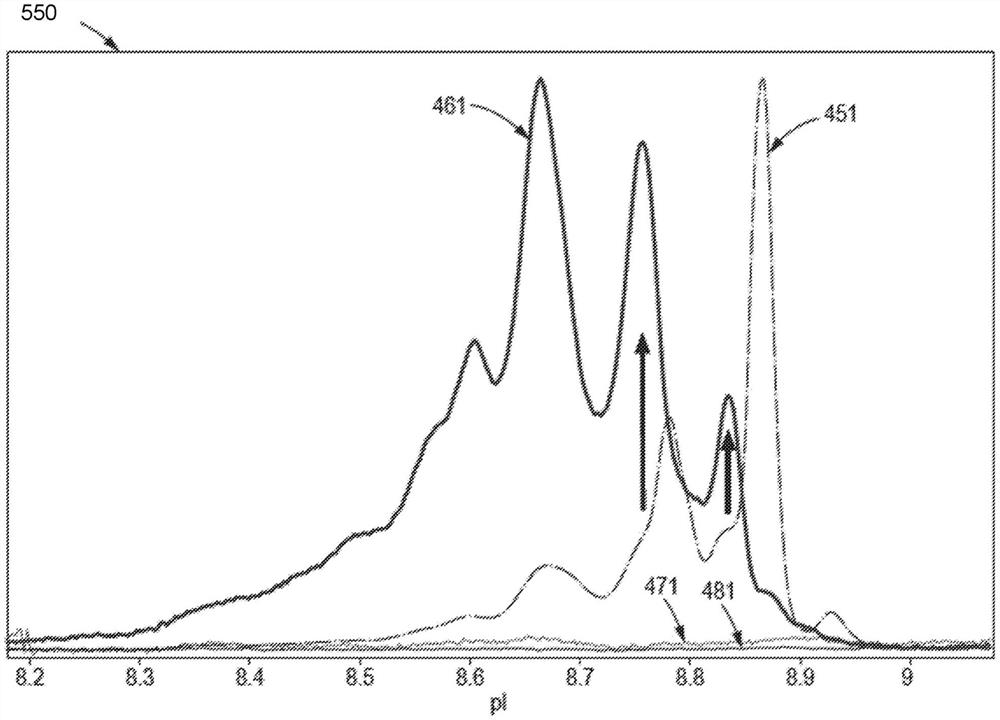
图4A和4B展示了根据实施例的示出了使用如本文所描述的系统从
如图4A所示,吸光度信号451包含峰452,其中每个峰对应于具有对应pI值的蛋白质同种型(或pI标志物,在pI 7.2下)。作为实例,相比于与在453D处pI大约为8.9的蛋白质同种型D相关的相对较小的吸光度峰452D,相对较大的吸光度峰452A与在453A处pI大约为8.65的蛋白质同种型A相关。在对应于特异性蛋白质同种型的给定pI值处的吸光度信号451的测量结果可以用于确定所述特异性蛋白质同种型的相对数量。峰452A与452D之间的差分吸光度可以指示蛋白质同种型A和蛋白质同种型D中包含的组成氨基酸的差异。例如,差分吸光度可能是由于分离的蛋白质同种型A与分离的蛋白质同种型B相比所包含的特异性氨基酸(例如,具有带电侧链和/或带电侧链的化学变化(如脱酰胺、糖基化等)的氨基酸)不同所致。
如图4B所示,荧光信号461包含峰462,其中每个峰对应于具有对应pI值的每种分离的蛋白质同种型。作为实例,相比于与在463D处pI大约为8.9的蛋白质同种型D相关的相对较小的荧光峰462D,相对较大的荧光峰462B与在463B处pI大约为8.75的蛋白质同种型B相关。峰462B与462D之间的差分荧光可以指示蛋白质同种型B和蛋白质同种型D中包含的自由硫醇基的量不同。如先前所描述的,可以通过产生在已知pI值处的峰作为真实阳性,使用对照标志物或pI标志物,例如来校准用于分离蛋白质同种型的方法。例如,吸光度信号451中的pI值7.2处的吸光度峰和荧光信号461中的pI值7.2处的荧光峰可以对应于对照标志物或pI标志物。
图5是示出了图4A的吸光度信号451与图4B所示的荧光信号461的重叠的图550。参考图4A和4B所描述的
如所示出的,参考信号471缺少可辨别的峰,这指示在荧光信号461中观察到的峰确实与检测结合剂相关并且不是假信号伪像,所述检测结合剂与蛋白质同种型结合。还示出了参考信号481缺少特异性强度峰,这指示在吸光度信号451中观察到的峰确实是与蛋白质同种型相关的吸光度并且不是假吸光度伪像。荧光信号461和吸光度信号451的曲线图展示了根据实施例的如使用本文所描述的系统分析的在每个信号中观察到的峰与在另一个信号中观察到的峰之间的关系,所述峰与多种蛋白质和/或蛋白质同种型中的一组多种蛋白质和/或蛋白质同种型相关。两个示例峰对和其对应关系通过箭头指示。
自由硫醇可以用作蛋白质(例如,治疗性蛋白)的关键质量属性,以对与蛋白质相关的质量进行分级。临床产品的关键质量属性(CQA)可以定义为“应处于适当的限制、范围或分布内以确保所期望的产品质量的物理、化学、生物学或微生物性质或特性”。换句话说,产品(例如,治疗剂、单克隆抗体(mAb)等)可以具有经鉴定的CQA(例如,作为用于开发和生产生物药物的质量设计(QbD)的实施方案的一部分),所述经鉴定的CQA可以包含对临床产品的临床功效和/或安全性具有影响的属性。产品中的自由硫醇的量可以被视为产品开发的CQA。自由硫醇可能是聚集的主要原因,所述聚集可能导致免疫原性,从而影响功效。在一些情况下,自由硫醇可以在治疗性蛋白的采集和/或纯化过程期间形成。在一些情况下,例如,自由硫醇可以在双特异性抗体和/或抗体药物缀合物(ADC)的生产期间产生。因此,通过本文所描述的方法使用本文所描述的系统确定的自由硫醇的量可以用作治疗性蛋白的CQA。
在一些情况下,本文所描述的方法还可以用于计算ADC标记效率测量结果。在一些情况下,例如在涉及巯基操纵的条件下,本文所描述的方法和系统可以用于定量双特异性和/或多特异性抗体重新组装。双特异性抗体作为单独的半抗体产生、纯化,随后暴露于温和的还原剂以还原铰链区以促进完整(或整个)双特异性抗体的组装。本文所描述的方法允许对双特异性和多特异性抗体的组装前和组装后的自由硫醇进行定量。
例如,用于与硫醇结合的荧光检测结合剂可以是第一组荧光检测结合剂。另外,可以使用第二组荧光检测结合剂,其中荧光发射的波长波段与第一组荧光检测结合剂发射的光的波长波段不同。第二组荧光检测结合剂可以被配置成与ADC中包含的药物结合,使得在被光(例如,UV范围内的单个波长(例如,280nm)的光)激发后(i)第一组荧光检测结合剂的发射可以用于定量与一组分离的蛋白质同种型中的每种分离的蛋白质同种型中包含的ADC相关的自由硫醇的量,并且(ii)来自第二组荧光检测结合剂的发射可以用于测量与一组分离的蛋白质同种型中的每种分离的蛋白质同种型中包含的ADC相关的抗体与药物比率。在一些实施方案中,除了自由硫醇定量和/或总硫醇定量之外,本文所描述的系统和/或方法还可以用于进行二次测量或评估。例如,由于荧光检测结合剂可以被配置成对样品中包含的蛋白质同种型的电荷异质性没有作用或具有受控作用,使得可以解释所述作用,因此用于定量硫醇内含物(自由和/或总硫醇基)的方法(也被称为荧光硫醇衍生化)可以不影响未衍生化的同种型的电荷。因此,可以开发另外的“偏移测定”来进一步分析蛋白质同种型。单电荷或多电荷荧光染料的衍生化可以用于从其余样品峰中分离出CQA,以进行基线积分和定量。标记试剂中包含另外的带电实体可能会诱导显著偏移,从而使所关注峰(用染料标记)与未标记的重叠蛋白质同种型峰分离。
如本说明书中所使用的,除非上下文另外明确说明,否则单数形式“一个/一种(a/an)”和“所述”包含复数指示物。因此,例如,术语“构件”旨在意指单个构件或构件的组合,“材料”旨在意指一种或多种材料,或其组合。
如本文所使用的,术语“样品”是指含有要被分析或检测或以其它方式使用的一种或多种分析物的组合物。样品可以是异质的,含有多种组分(例如,不同的蛋白质、不同类型的蛋白质同种型、不同的组分复合物或缀合物,如抗体药物缀合物或与蛋白质缀合的其它组分等),或者可以是均质的,含有一种组分。在一些情况下,样品可以是天然存在的生物材料和/或人造材料。此外,样品可以呈天然的或变性的形式。在一些情况下,样品可以是单个细胞(或单个细胞的内含物)或多个细胞(或多个细胞的内含物)、血液样品、血浆样品、组织样品、皮肤样品、尿液样品、水样品等。在一些情况下,样品可以来自活的生物,如真核生物、原核生物、哺乳动物和/或人类。
本文所公开的装置和/或系统可以包含任何合适的电子装置。例如,在一些实施例中,仪器可以包含集成计算装置和/或外围计算装置,如个人计算机(PC)、个人数字助理(PDA)、智能电话、膝上型计算机、平板PC、服务器装置、工作站等。计算装置可以至少包含存储器、处理器。在一些实施例中,计算装置可以是输出装置,所述输出装置可以是安装在电子装置上的可以提供用于软件应用(例如,移动应用、PC应用、互联网网络浏览器等)的用户接口的至少一部分的任何合适的显示器。在此类实施例中,显示器可以是例如阴极射线管(CRT)监视器、液晶显示器(LCD)监视器、发光二极管(LED)监视器等。在其它实施例中,输出装置可以是音频装置、触觉装置和/或任何其它合适的输出装置。在一些实施例中,计算装置可以包含网络接口,所述网络接口可以是例如网络接口卡和/或可以至少包含以太网端口和/或无线电(例如,
虽然本文已经描述了各个实施例,但应该理解,所述实施例仅通过举例而不是限制的方式来进行呈现。例如,尽管本文所描述的实施例涉及蛋白质和/或蛋白质同种型,但是应当理解,本文所描述的方法也适用于其它含硫醇的材料。此外,尽管已经将各种实施例描述为具有特定特征和/或组件的组合,但是具有任何特征和/或组件的组合的其它实施例也是可能的。
虽然上文已经描述了各个实施例,但应该理解,所述实施例仅通过举例而不是限制的方式来进行呈现。在上文所描述的方法和步骤指示某些事件以某种次序发生的情况下,可以修改某些步骤的次序排序。在一些情况下,可以遵循某些步骤,而可以省略某些其它步骤。例如,尽管描述了对样品的含有检测结合剂的第一部分进行荧光发射测量和/或吸光度测量并且对样品的不含有检测结合剂的第二部分进行荧光发射测量和/或吸光度测量的一些实施例,但是应理解的是,在其它实施例中,样品可以不分成两个部分,可以将检测结合剂添加到样品中,并且可以仅对含有检测结合剂的样品进行荧光发射测量和/或吸光度测量。作为另一个实例,在一些情况下,可以进行荧光发射测量,而省略UV吸光度测量,或反之亦然。另外,所述事件中的某些事件在可能的情况下可以在并行过程中同时重复地执行并且如上文所描述的那样顺序地执行。例如,在描述检测UV吸光度之前,先描述检测样品槽中的荧光。然而,应当理解,检测荧光和UV吸光度可以以任何顺序或同时发生。此外,某些实施例可以省略一个或多个所描述的事件。
在描述方法的情况下,应当理解,此类方法可以是计算机实施的方法。类似地陈述,非暂时性处理器可读介质可以存储表示指令的代码,所述指令被配置成使处理器使所描述的方法发生或被执行。例如,如以
尽管已经将各个实施例描述为具有特定特征和/或组件的组合,但是其它实施例也可以具有来自本文所描述的实施例中的任何实施例的任何特征和/或组件的任何组合或子组合。
