高通量单细胞染色质可及性的测序方法
文献发布时间:2023-06-19 11:37:30
技术领域
本发明涉及一种基因测序方法,具体涉及一种新型的高通量单细胞染色质可及性的测序方法,属于分子生物学领域。
背景技术
单细胞染色质可及性测序技术能够从表观遗传学方面检测单细胞的异质性,为疾病的诊断和治疗提供精准的信息。受制于单细胞测序技术的处理通量和成本等问题,很多大规模的单细胞表观遗传学的研究工作无法展开。例如,传统单细胞分离技术是通过毛细管实现单细胞的分离,需要在显微镜下人工操作,通量低、耗时长、过程繁琐。还有一种常见方式是利用流式细胞仪分离单细胞,该方法样本需求量大,需要精准控制,对细胞有损伤,且对于后续建库要求高。
业界认为,微流控技术和单细胞染色质测序技术相结合可以很好地解决这些问题。例如,美国Fludigm公司于2014年推出的C1单细胞全自动系统,该仪器通量已提升到一次可以分析数百个单细胞。该系统的出现使得大规模研究单细胞染色质可及性成为可能。但是,此种C1系统是使用微阀分离单细胞,通量较低,目前最多只能做938个细胞,且成本高。Microwell-split pool系统也可以实现单细胞的分离,其通量也较低,通常为1000-5000个细胞,反应体积大,试剂消耗多,成本高且对细胞损耗大。相较于C1系统、Microwell-split pool系统,基于液滴微流控原理的10X genomics和Biorad系统通量更高,可以同时对上万个细胞的染色质可及性进行分析。更详细地讲,10X genomics和Biorad系统,利用微流控芯片将带有标签的微珠和单细胞包裹在一个液滴中,实现单细胞的分离与标记。通量可以达到1万个细胞。但是,这两种技术采用的液滴生成装置需要用电力驱动,成本高,每次实验只能同时做4个或者8个样本,灵活性有限。
发明内容
本发明的主要目的在于提供一种高通量单细胞染色质可及性的测序方法,从而克服现有技术的不足。
为了达到前述发明目的,本发明采用了以下方案:
本发明实施例提供了一种高通量单细胞染色质可及性的测序方法,其包括:
以转座酶孵育处理细胞核,使其中的染色质开放区带有第一接头序列,从而获得转座后细胞核;
以微流控芯片将转座后细胞核及细胞标签包装于油包水反应液滴内,所述油包水反应液滴包括细胞核液相和包裹所述细胞核液相的油相,所述细胞核液相包含单细胞核和单个细胞标签,所述细胞标签包括可变形微珠和连接在可变形微珠上的带标签的引物;
对所述油包水反应液滴进行物理和/或化学处理,使其中带标签的引物被从可变形微珠上释放;
孵育所述油包水反应液滴,使所述带标签的引物捕获其中带有第一接头序列的DNA;
对所述油包水反应液滴进行破乳处理,再提取、扩增其中的DNA,并在DNA两端添加测序接头,构建形成测序文库,其后进行测序分析。
在一些实施方式中,所述测序方法包括:将细胞裂解获得细胞核,再以转座酶孵育所述细胞核,使得每个细胞核的染色质开放区带上第一接头序列,所述第一接头序列能够与所述带标签的引物中的第二接头序列特异性结合,从而使得所述带标签的引物能够捕捉带有第一接头序列的DNA。
在一些实施方式中,所述的测序方法具体包括:
将转座后细胞核、细胞标签分别制成细胞核悬液、细胞标签悬液;
提供微流控芯片,其包括细胞微流道、细胞隔离介质微流道、细胞标签微流道和单细胞样本收集口;
将细胞核悬液、细胞标签悬液分别注入微流控芯片,并使细胞核悬液、细胞标签悬液在分别流经细胞微流道、细胞标签微流道后相互混合形成细胞核载液;
将作为细胞隔离介质的油注入微流控芯片,且使细胞隔离介质在细胞隔离介质微流道内流动时与细胞核载液接触,并对细胞核载液进行剪切、包裹,从而形成包含单细胞核和单个细胞标签的油包水反应液滴;
以及,从单细胞样本收集口处收集所述油包水反应液滴。
在一些实施方式中,所述的测序方法包括:通过测序分析,至少确定染色质开放区的位置和核小体的位置。
本发明实施例还提供了一种高通量单细胞染色质可及性的测序文库构建方法,其包括:
以转座酶孵育处理细胞核,获得转座后细胞核;
以微流控芯片将转座后细胞核及细胞标签包装于油包水反应液滴内,所述油包水反应液滴包括细胞核液相和包裹所述细胞核液相的油相,所述细胞核液相包含单细胞核和单个细胞标签,所述细胞标签包括可变形微珠和连接在可变形微珠上的带标签的引物;
对所述油包水反应液滴进行物理和/或化学处理,使其中带标签的引物被从可变形微珠上释放;
孵育所述油包水反应液滴,使所述带标签的引物利用其带有的第二接头序列捕获带有第一接头序列的DNA,该第一接头序列与第二接头序列互补;
孵育所述油包水反应液滴,对其中的DNA进行连接,修复缺口;
对所述油包水反应液滴进行破乳处理,再提取、扩增其中的DNA,并在DNA两端添加测序接头,构建形成测序文库。
本发明实施例还提供了一种试剂盒,用于构建所述的测序文库,其包括:
微流控芯片,至少用于捕获单细胞核并进行包装,从而生成油包水反应液滴,所述油包水反应液滴包括油相和被油相包裹的细胞液相,并且所述油包水反应液滴包含单细胞核和单个细胞标签;
用于形成所述油相的油;
细胞裂解试剂;
细胞标签,包括可变形微珠和连接在可变形微珠上的带标签的引物,所述带标签的引物能够在物理作用和/或化学作用下脱离可变形微珠;以及
转座酶、核酸扩增试剂、测序接头,等等。
在一些实施方式中,所述微流控芯片包括细胞微流道、细胞隔离介质微流道、细胞标签微流道和单细胞核样本收集口,所述细胞微流道具有细胞核悬液入口和单细胞核悬液出口,所述细胞隔离介质微流道具有细胞标签悬液入口和细胞标签悬液出口,并且所述单细胞核核悬液出口与细胞标签悬液出口交会,使所述细胞微流道输出的单细胞核悬液能够与所述细胞标签微流道输出的细胞标签悬液混合形成细胞核载液,所述细胞核载液的流动路径与所述细胞隔离介质微流道交叉,从而使在所述细胞隔离介质微流道内流动的细胞隔离介质能够剪切并包裹细胞核载液,从而形成包含单细胞核和单个细胞标签的油包水反应液滴,所述油包水反应液滴由单细胞核样本收集口输出。
本发明采用水凝胶微珠等可变形微珠构建细胞标签,并在油包水反应液滴中进行末端修复和补齐,同时利用空气泵等作为动力源驱动油包水反应液滴生成,可以同时做多个样本,有效的提高细胞的捕获效率,减少了液滴破乳之后的微珠相互污染,提高的有效数据的占比,同时降低了成本,使用方式更为灵活,操作更容易,整体操作时间相比较于现有的indrop和dropseq平台大幅减少。
总而言之,较之现有技术,本发明提供的高通量单细胞染色质可及性的测序方法具有高细胞捕获效率、高细胞通量、灵活性高(可同时做1-8个样本)、低交叉污染,低双包率、高灵敏性(可检测单个细胞的染色质开放区的情况)、低成本等优点,并可以实现全自动化,可以检测微量样本,无需电力驱使,可便携式携带,应用前景广阔。
附图说明
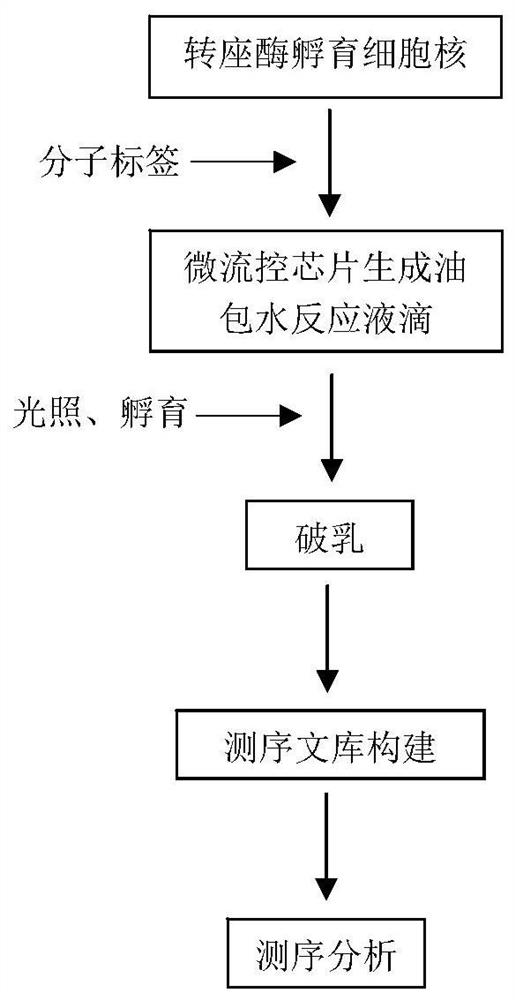
图1是本发明一典型实施方式中一种高通量单细胞染色质可及性的测序工艺流程图;
图2是本发明一典型实施方式中一种微流控芯片的结构示意图;
图3是本发明一典型实施方式中于微流控芯片中生成油包水反应液滴时的示意图;
图4是本发明一具体实施案例中生成的油包水反应液滴的光学照片;
图5是本发明一具体实施案例中提取DNA的Labchip检测图谱;
图6是本发明一具体实施案例中测序文库的Labchip检测图谱;
图7示出了本发明一具体实施案例中核小体的位置分布;
图8示出了本发明一具体实施案例中染色质开放区的信号强度;
图9示出了本发明一具体实施案例中不同染色体上染色质开放区的情况。
具体实施方式
本发明实施例的一个方面提供了一种高通量单细胞染色质可及性的测序方法。
概括的讲,所述测序方法包括将细胞裂解的步骤、对细胞核进行转座化处理的步骤、将细胞核包装于油包水微反应体系(油包水反应液滴)内的步骤,提取其中的DNA进行扩增并添加测序接头而形成测序文库的步骤,以及,进行测序分析的步骤。
进一步的,所述测序方法可以包括:
以转座酶孵育处理细胞核,使其中的染色质开放区带有第一接头序列,从而获得转座后细胞核;
以微流控芯片将转座后细胞核及细胞标签包装于油包水反应液滴内,所述油包水反应液滴包括细胞核液相和包裹所述细胞核液相的油相,所述细胞核液相包含单细胞核和单个细胞标签,所述细胞标签包括可变形微珠和连接在可变形微珠上的带标签的引物;
对所述油包水反应液滴进行物理和/或化学处理,使其中带标签的引物被从可变形微珠上释放;
孵育所述油包水反应液滴,使所述带标签的引物捕获其中带有第一接头序列的DNA;
对所述油包水反应液滴进行破乳处理,再提取、扩增其中的DNA,并在DNA两端添加测序接头,构建形成测序文库,其后进行测序分析。
在一些实施方式中,所述的测序方法包括:将细胞裂解获得细胞核,再以转座酶孵育所述细胞核,使得每个细胞核的染色质开放区带上第一接头序列,所述第一接头序列能够与所述带标签的引物中的第二接头序列特异性结合,从而使得所述带标签的引物能够捕捉带有第一接头序列的DNA。
进一步的,所述转座酶包括Tn5转座酶。
在一些实施方式中,所述的测序方法还包括:对所述油包水反应液滴进行物理和/或化学处理后,再在72℃-55℃孵育,使所述带标签的引物捕捉带有第一接头序列的DNA。
更优选地,可以对收集的油包水反应液滴进行紫外照射,使得微珠上带标签的引物(带有第二接头序列)游离下来,与带有第一接头序列的DNA结合。
以及,对收集的油包水反应液滴进行72℃-55℃孵育,使得带标签的引物可以和带有第一接头序列的DNA紧密链接。
进一步的,还可孵育收集的油包水反应液滴,以对其中的DNA进行连接,修复缺口。
在一些实施方式中,所述第一接头序列、第二接头序列分别如SEQ ID NO:1、SEQID NO:2所示。
本发明的前述实施方式中采用的是连接方式,使得微珠上的带标签引物序列可以与转座后带特异接头序列的DNA结合,连接,所用的体系简单,孵育温度低,油包水的稳定性会更高。与之相较,现有技术中(例如基于10X平台的测序技术)需要在液滴里通过扩增方式,使得目的片段带上标签序列,所需的孵育温度高,对液滴的稳定性要求高,操作难度较高。
本发明中所述破乳处理优选采用超声等物理破乳方式,避免化学破乳方式存在的化学组分如PFO对后续反应的影响。
在一些实施方式中,所述的测序方法具体包括:
将转座后细胞核、细胞标签分别制成细胞核悬液、细胞标签悬液;
提供微流控芯片,其包括细胞微流道、细胞隔离介质微流道、细胞标签微流道和单细胞样本收集口;
将细胞核悬液、细胞标签悬液分别注入微流控芯片,并使细胞核悬液、细胞标签悬液在分别流经细胞微流道、细胞标签微流道后相互混合形成细胞核载液;
将作为细胞隔离介质的油注入微流控芯片,且使细胞隔离介质在细胞隔离介质微流道内流动时与细胞核载液接触,并对细胞核载液进行剪切、包裹,从而形成包含单细胞核和单个细胞标签的油包水反应液滴;
以及,从单细胞样本收集口处收集所述油包水反应液滴。
进一步的,所述细胞微流道具有细胞核悬液入口和单细胞核悬液出口,所述细胞隔离介质微流道具有细胞标签悬液入口和细胞标签悬液出口,并且所述单细胞核悬液出口与细胞标签悬液出口交会,使所述细胞微流道输出的单细胞核悬液能够与所述细胞标签微流道输出的细胞标签悬液混合形成细胞核载液,所述细胞核载液的流动路径与所述细胞隔离介质微流道交叉,使得流经所述细胞隔离介质微流道的细胞隔离介质能够将连续的细胞核载液剪切为离散液滴状的细胞核液相并使每一细胞核液相包含单细胞核和单个细胞标签,同时使所述细胞隔离介质对所述细胞液相进行包裹,从而形成油包水反应液滴,所述油包水反应液滴由单细胞样本收集口输出。
当然,还可以在所述单细胞核悬液出口和细胞标签悬液出口的交会处与细胞隔离介质微流道之间设置供细胞核载液流动的一个过渡段,其可以命名为细胞核载液微流道(如图2中的标记13所示),该细胞核载液微流道与细胞隔离介质微流道交叉。
进一步的,所述油包水反应液滴是作为油包水微反应器,其大小可以是皮升级的。
进一步的,所述微流控芯片还包括分别与所述细胞微流道、细胞隔离介质微流道、细胞标签微流道连通的细胞悬液加样杯、细胞隔离介质加样杯、细胞标签加样杯,等等。
在一些实施方案中,所述单细胞核样本收集口处设置有负压动力生成装置。所述负压动力生成装置可以采用空气泵等,其可以在微流控芯片内产生负压,从而驱使各微流道中的流体流动。例如,可以在单细胞核样本收集口处用空气泵向外抽取空气,给微流控芯片整体施加-4K~-10K Pa的负压。通过采用此种负压方式,且设置芯片为3通道,不需要用动力驱使,相比现有技术中的正压驱动、多通道(4通道以上),操作更方便,时间也大大缩短,可以做微量样本,灵活性更高,可以同时做1到8个样本。
进一步的,前述实施方案中的一种微流控芯片的结构可以参阅图2所示,包括细胞悬液加样杯1、细胞标签加样杯2、细胞隔离介质加样杯4,该细胞悬液加样杯1、细胞标签加样杯2、细胞隔离介质加样杯4分别与细胞微流道11、细胞标签微流道12、细胞隔离介质微流道14连通,同时所述微流控芯片还设有单细胞核样本收集口3。其中,细胞微流道11、细胞标签微流道12相互交叉后,还与细胞隔离介质微流道14交叉,进而与单细胞核样本收集口3连通。
在本发明的以上实施例中,微流控芯片的细胞微流道为用于形成细胞核液相的一个组分的细胞核悬液的流动通道,细胞标签通道为用于形成细胞核液相的另一个组分的细胞标签悬液的流动通道,细胞隔离介质微流道为作为油相的组份的流动通道,所有组份均在芯片上增加压力的情况下,随其流动通道按一定速度流动,且细胞核悬液和细胞标签悬液混合形成的细胞核载液并被作为油相的细胞隔离介质切割,形成物理隔离,通过控制压力和流阻设计,实现细胞隔离介质对单个细胞核和细胞标签进行切割,实现了单个细胞和可变形微珠的分离,确保每个油包水反应液滴作为一个微反应体系且包含一个细胞和一个细胞标签。更为直观的,该形成油包水反应液滴的过程亦可参考图3,其中a、b、c、d分别示出了细胞标签悬液、细胞核悬液、细胞核液相、细胞隔离介质的流动方向,e所示为油包水反应液滴。
在一些实施方案中,所述细胞标签包括带标签的引物和可变形微珠,所述带标签的引物连接在可变形微珠上,并且所述带标签的引物能够在物理作用和/或化学作用下脱离可变形微珠。
进一步的,所述细胞标签以所述带标签的引物识别细胞。
进一步,所述物理、化学作用包括本领域技术人员熟知的各种物理、化学作用,例如可以优选采用紫外光辐照方式或者特异性酶切等,且不限于此。例如,所述带标签的引物可以标记为紫外敏感、光照敏感或者可以被特异性酶切的寡核苷酸链,且不限于此。在本发明中优选采用紫外光照等方式使带标签的引物脱离可变形微珠,其不仅非常便捷,而且还不会向微反应体系内引入其它化学物质,从而可以避免潜在的污染风险,另外,游离的带标签的引物捕获目的产物效率更高,可以消除固定在微珠上的引物捕获目的产物时因微珠的空间位阻效应而导致的捕获效率低等问题。
进一步的,所述标签包括作为条形码的长度为5-24nt的碱基序列。
更进一步的,所述条形码可以包含3段但不仅限于3段的恒定碱基序列。
更进一步的,所述带标签的引物的总长度可以为50nt-200nt不等,且不限于此。
在一些实施方案中,所述带标签的引物可以通过化学和/或物理方式与可变形微珠连接。例如,所述引物与微珠可以通过共价键、化学聚合、抗原抗体结合、酶催化的连接反应等方式进行连接,且不限于此。
在一些实施方案中,所述可变形微珠可以是有机材质或者无机-有机复合材质的,例如可以为聚丙烯酰胺凝胶微珠、琼脂糖凝胶微珠、琼脂糖包裹的磁性微珠、硅珠、惰性材料制备的微珠等,且不限于此。优选的,所述可变形微珠可以选用凝胶微珠,其有利于进一步提高所述微流控芯片进行油包水反应液滴包装的效率,以及协同微流控芯片而大幅提升细胞通量。其机理可能在于:由于采用可变形微珠,从而使得每个油包水反应液滴里均可包上带细胞标签的微珠,单包裹率可以达到100%,而若替换为硬微珠,则在液滴包裹时要遵从泊松分布规则,实际包裹效率远低于可变形微珠。进一步的,在本发明中优选采用多孔的聚丙烯酰胺微珠,因其比表面积远大于其它微珠,例如树脂或磁性微珠等硬微珠的比表面积,故所携带的引物远远多于其它微珠。合成所述聚丙烯酰胺微珠时,使用的丙烯酰胺单体浓度可以为1%-10%。
在一些实施方案中,所述微珠的直径可以为10μM-200μM。
在本发明的前述实施例中,利用所述微流控芯片,在相同细胞核浓度的情况下,单口双包率是双口的1/2,不同大小的细胞核可以通过调整压力(例如,以负压动力生成装置产生的压力作为动力)来实现包裹,特别是在利用负压动力生成装置作为动力源时,还可以快速高效地完成细胞核包裹,以及,利用凝胶微珠形成细胞标签时,其悬液流速有冲击力,流速可控,可以实现90%以上的包裹率。
在一些实施方式中,所述的测序方法还包括:基于所述提取的DNA与作为引物的测序接头(例如序列可以为SEQ ID NO:3所示,但不限于此)构建扩增反应体系进行PCR扩增,之后进行提纯,获得测序文库。
在一些实施方式中,所述的测序方法还包括:通过测序分析,至少确定染色质开放区的位置和核小体的位置。
在一些实施方式中,所述的测序方法还可以包括对“待测样本”或“待测样品”进行前处理的步骤。但是,应用本发明实施例提供的方法,对前处理的要求较低,例如,可以根据细胞的物理特性或生物特性进行初步富集,所获得的样本即可用于后续步骤。
在本说明书中,“待测样本”或“待测样品”可以来自于个体(如人的血液、生物组织等),也可以是其它来源的,例如一些经处理或未经处理的实验室材料。另外,在本说明书中,对于“样本”或“样品”的检测并非仅涉及诊断目的,还可涉及其它非诊断目的。
本发明实施例的另一个方面还提供了一种试剂盒,其用于构建所述的测序文库,并且包括:
微流控芯片,至少用于捕获单细胞核并进行包装,从而生成油包水反应液滴,所述油包水反应液滴包括油相和被油相包裹的细胞液相,并且所述油包水反应液滴包含单细胞核和单个细胞标签;
用于形成所述油相的油;
细胞裂解试剂;
细胞标签,包括可变形微珠和连接在可变形微珠上的带标签的引物,所述带标签的引物能够在物理作用和/或化学作用下脱离可变形微珠;以及
转座酶、核酸扩增试剂、测序接头,等等。
在本实施例提供的试剂盒中,所述微流控芯片的结构与工作原理如上文所述,此处不再赘述。
在本实施例提供的试剂盒中,所述细胞标签的组成可以如前文所述,此处不再赘述。
在一些实施方式中,所述的试剂盒还包括:至少对提取的DNA、测序文库中的任一者或多者进行纯化所需的试剂,例如磁珠等,且不限于此。
在本发明的前述实施例中,所采用的细胞裂解试剂可以选用本领域技术人员所熟知的类型,其可以包含本领域技术人员所熟知的任何适用于细胞裂解的蛋白酶和蛋白变性试剂以及裂解缓冲体系等。
在本发明的前述实施例中,用于对提取出的DNA进行扩增所需的试剂可以包含作为引物的测序接头和本领域技术人员所熟知的DNA聚合酶和扩增缓冲液。例如,所述扩增缓冲液的主要成分可以包括:KCl、NH
在本发明的前述实施例中,所述DNA聚合酶可以是本领域技术人员所熟知的任何热稳定的DNA聚合酶,例如:LA-Taq,rTaq,Phusion,Deep Vent,Deep Vent(exo-),Gold360,Platinum Taq,KAPA 2G Robust等,且不限于此。
在本发明的前述实施例中,所述转座化试剂可以包含本领域技术人员所熟知的转座酶、转座酶反应缓冲液和转座反应终止液等。例如,所述转座酶可以选用Tn5等,且不限于此。
在本发明的前述实施例中,所述测序分析亦可以是依照本领域技术人员熟知的方式操作,其可以包括基本分析、标准分析和高级分析。
本发明采用水凝胶微珠等可变形微珠构建细胞标签,并在油包水反应液滴中进行末端修复和补齐,同时利用空气泵等作为动力源驱动油包水反应液滴生成,具有细胞捕获效率高、细胞通量高等特点,且灵活性高,可以同时做1-8个样本,并能有效减少液滴破乳之后的微珠相互污染,低交叉污染、低双包率,不仅能显著提高有效数据的占比,还显著改善了灵敏性,可检测单个细胞的染色质开放区的情况,以及还降低了成本(是基于dropseq、10X等平台的测序方式的三分之一以下),操作更容易,可以实现全自动化,无需电力驱使,可便携式携带。
下面结合具体实施例进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。若非特别说明,则下列实施例中使用的各种试剂均是本领域技术人员熟知的,并可以通过市场购买等途径获取。而下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
若非特别说明,如下实施例所使用的试剂及耗材,例如:具有单细胞核分离和油包水反应液滴生成功能的微流控芯片;生成所述反应液滴所需的油;载有带标签引物的水凝胶微珠;无核酸酶水;Taq聚合酶反应液;PCR扩增反应缓冲液;DNA扩增酶;转座酶反应缓冲液;转座酶;转座反应终止液;用于双链DNA纯化的磁珠;用于文库扩增的测序接头,等等,均可以从市场购得。例如,如下实施例所用的纯化磁珠可以优选为Beckman公司的Ampure XPbeads、Beckman公司的SPRI beads等,且不限于此。
参阅图1所示,如下实施例的测序文库构建及测序过程可以包括如下步骤:
(1)用转座酶孵育处理好的细胞核,使得每个细胞核的染色质开放区带上接头A。
(2)利用载有带标签引物的水凝胶微珠和液滴微流控技术,将转座好的细胞核与水凝胶微珠分别包裹在液滴中,对液滴进行UV光照后,水凝胶微珠上的带标签引物释放出来。
(3)72℃-55℃孵育液滴半个小时,使得带标签的引物通过接头抓住DNA。
(4)破乳,利用磁珠提取DNA。
(5)通过PCR在提取的DNA两侧加上测序接头。
(6)将建好的文库进行二代测序,测序方案为PE150。
(7)信息数据解读,确定染色质开放区的位置和核小体的位置。
以下对该实施例的具体实施过程作更为详尽的说明。
1.实验准备
细胞裂解液配制,试剂储存要求:配制的细胞裂解液须放置于4℃冰箱密封保存,保质期30天。
表1细胞裂解液组分
2.实验操作及结果展示
2.1细胞准备
2.1.1
根据处理样本数量的需求取适量PBS溶液提前半小时放入水浴锅中预热,取适量PBS溶液提前半小时放入冰上预冷;
2.1.2
对于新鲜培养的H1975:胰酶消化获取单细胞,常温300g离心5min。
2.1.3
预冷离心机至4℃,弃去2.1.2中离心后的细胞上清液,加入1000μL的37℃预热的PBS重悬细胞,并进行计数,分装出60000个细胞(具体数目根据客户的需求决定)至1.5mL离心管中,4℃500g离心5min,弃去上清,装有细胞沉淀的离心管保持冰上放置。
2.1.4
向2.1.3的细胞沉淀中加入50μL预冷的PBS重悬细胞,4℃500g离心5min,弃去上清,装有细胞沉淀的离心管保持冰上放置。
2.1.5
将1中配制的细胞裂解液按样本量需求分装后,放置于冰上预冷,向2.1.4细胞沉淀中加入50μL预冷的细胞裂解液,用移液器轻轻吹打20次混匀,4℃500g离心10min,弃去上清,装有沉淀的离心管保持冰上放置,沉淀立即进行转座反应。
2.2转座反应
2.2.1转座反应体系配制:
2.2.2将7.2.1中50μL的转座反应体系加入到7.1.5的沉淀中重悬细胞,用移液器轻轻吹打20次混匀,此过程细胞沉淀须保持在冰上完成;
2.2.3将上述混合液放置于37℃金属浴中进行转座反应30min,设置金属浴转速300rpm震荡;
2.2.4向7.2.3的转座反应结束后的混合液中加入12.5μL的0.1%SDS溶液,室温孵育5min,终止转座反应。
通过该转座酶处理的步骤,可以在其染色质开放区带上第一接头序列(定义为接头A)。例如,所得的一种DNA可以如下所示,其中单下划线标识的部分为接头A,双下划线标识的部分为转座酶上的序列。
2.3单细胞核包裹
2.3.1DNA捕获体系配制
2.3.2上机生成油包水反应液滴(如下简称液滴)
将转座后的细胞核、水凝胶、油分别加入图2所示芯片,按空气泵,使体积由20ml拉至30ml(液滴生成过程可以参阅图3),形成的液滴尺寸及形貌可参阅图4。
其中细胞标签可以如下所示:
其中单下划线标识的部分为第二接头序列(定义为接头B),双下划线标识的部分为常规测序引物序列,含有J、N的部分为标签序列,其可以为随机序列。
2.3.4紫外照射
在收集口出紫外照射10分钟,使得微珠上的带标签的引物释放下来,捕获转座后的DNA。
2.3.3捕获DNA修复缺口
将收集管处的温控设置按下表设置:
2.3.4破乳
在收集管中加入3ml PFO,用枪头吹打15次,离心(800g,10min,4℃),取上清;
2.4提取DNA
提前半小时Ampure XP beads取出平衡到室温,将上述PCR产物使用Ampure XPbeads进行磁珠纯化1.2Xbeads纯化;Labchip质检观察,如图5所示。
2.5文库构建
2.5.1加接头
其中,ATAC-I7的序列如SEQ ID NO:3所示。
2.6产物纯化
2.6.1提前半小时Ampure XP beads取出平衡到室温,将上述PCR产物使用AmpureXP beads进行磁珠纯化(0.8×+0.7×进行纯化);
2.6.2检查PCR管中产物的总体积,加水补齐至50μL;
2.6.3向上述PCR管中加入40μL Ampure XP beads(0.8×),轻轻吹打混匀,室温孵育5min;
2.6.4将上述PCR管转移至磁力架上静置2min,待溶液澄清后,转移上清至新的PCR管中;
2.6.5向新的PCR管的溶液中加入35μL Ampure XP beads(0.7×),轻轻吹打混匀,室温孵育5min;
2.6.6将2.5.5中的PCR管置于磁力架上静置2min,待溶液澄清后,弃去含有小片段的上清液;
2.6.7PCR管保持在磁力架上,向其中加入150μL新鲜配制并预冷的80%的乙醇溶液,静置30s后弃去乙醇;
2.6.8重复2.6.7一次;
2.6.9PCR管保持在磁力架上3-5min,待磁珠晾干,不反光;
2.6.10向PCR管中加入20μL TE溶液,吹打混匀20次,室温孵育5min;
2.6.11将PCR管置于磁力架上静置2min,待溶液澄清后,将上清转移到新的PCR管中,注意此步骤不要洗到磁珠;
2.6.12取1μL Qubit dsDNA High Sensitivity Assay进行浓度测定,取1μL样本送Labchip质检,文库大小在200-800bp左右,如图6所示。
3.测序分析
该测序流程采用PE150测序方案,其可以在Illumina Nova Seq、Illumina Hiseq、Illumina Nextseq 500以及Illumina Miseq等平台上进行,相应操作方法及实验条件均是本领域技术人员熟知的。相应的测序分析可以参阅图7-图9。
其中,参阅图7所示,双末端ATAC-Seq测序reads能够体现核小体包装和定位的信息。测序reads的插入片段长度会呈现出大约200bp的周期性分布。参阅图8示出了转录起始位点(TSS)上下游3kb区域的ATAC-Seq信号强度。而图9示出了染色体上的peak的个数及分布情况。
此外,本申请的发明人还利用与本实施例相同的细胞核样本,基于现有的一些测序方案,例如:典型的高质量传统本体ATAC-seq方案;Cusanovich等,Science,2015年5月22日;348(6237):910-14;Buenrostro等,Nature,2015年7月23日;523(7561):486-90;ATAC-seq实验的理想测序度量,进行了对照试验。
通过将这些对照试验所获数据与本发明实施例所获数据进行比较,证实了本发明实施例所提供的测序方法在细胞通量、准确性、灵敏度等方面均是较为理想的。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110> 苏州绘真生物科技有限公司
<120> 高通量单细胞染色质可及性的测序方法
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 14
<212> DNA
<213> 人工序列(人工序列)
<400> 1
tcgtcggcag cgtc 14
<210> 2
<211> 14
<212> DNA
<213> 人工序列(人工序列)
<400> 2
gacgctgccg acga 14
<210> 3
<211> 60
<212> DNA
<213> 人工序列(人工序列)
<400> 3
ttactatgcc gctggtggct ctagatgtga gaaagggatg tgctgcgaga aggctagatg 60
