一种T细胞CRISPER文库筛选方法
文献发布时间:2023-06-19 18:30:43
技术领域
本发明涉及免疫治疗领域,具体涉及一种T细胞CRISPER文库筛选方法。
背景技术
近年来广受关注的以免疫细胞过继性疗法为主的肿瘤免疫疗法,为患者的治疗带来了新的希望,肿瘤免疫疗法也被美国的《Science》杂志推为2013年最大科学突破。与传统的化疗和放疗相比,免疫疗法激活宿主免疫系统来攻击肿瘤,可能提供长期保护,避免复发。T细胞是目前认为唯一能够特异性杀伤肿瘤细胞的细胞。DC细胞将抗原提呈给T细胞,诱导T细胞的活化和增殖,包括CD4辅助性T细胞和CD8杀伤性T细胞。肿瘤抗原特异性CD8
过继性细胞治疗虽然发展迅速,但往往在实体瘤治疗效果不佳。实体瘤自身独特的屏障限制了T细胞的活性,即使T细胞成功迁移进入实体瘤后,还会面临巨大的挑战,比如1)抗原丢失和突变;2)肿瘤微环境的缺氧压力,营养缺失和酸性pH环境等;3)抑制性的可溶性细胞因子或因素;4)抑制性的免疫细胞如调节性T细胞(Treg)、髓系来源的抑制细胞(MDSC)、肿瘤相关巨噬细胞(TAM);5)T细胞自身抑制性的调节原因(比如表面抑制性受体的上调表达)。
如何有效提高T细胞的杀伤效率、减少T细胞的衰竭、优化T细胞的生成、促进T细胞的浸润、避免肿瘤微环境免疫抑制等问题需要进一步深入研究。探索发现调节T细胞功能的基因是目前解决免疫疗法治疗实体瘤效果不佳的的关键问题。之前使用RNAi或shRNA(短发夹RNA)文库的研究已被用于识别CD8 T细胞的调节基因。然而RNAi通过降解mRNA或抑制其翻译来运作,具有显著的脱靶效应。
CRISPR技术的出现极大地增强了基因组编辑方面的能力。目前高通量CRISPR筛选已被开发用于发现新基因,CRISPR技术的应用使T细胞基因组的编辑成为可能。为了发现T细胞增殖和分化的调节因子,已经在体外进行了基因筛查。鉴于生理环境的复杂性,进行体内筛选以更好地识别临床相关靶点至关重要。在原代CD8 T细胞中进行高通量体内CRISPR筛选将能够快速识别T细胞抗肿瘤功能的负调节因子,从而为免疫治疗提供潜在靶点。
发明内容
为克服上述问题,本发明提供了一种T细胞CRISPER文库筛选方法,在小鼠模型的OT1 CD8
具体地,本发明第一方面提供了一种sgRNA文库,所述文库包含靶向选自表1中的1213个免疫相关基因的sgRNA。
在某些实施方式中,所述sgRNA的靶标序列选自表2。
本发明第二方面提供了本发明第一方面所述的sgRNA文库在筛选调节T细胞功能的重要基因中的应用。
本发明第三方面提供了一种小鼠T细胞CRISPER文库筛选方法,其特征在于,包括如下步骤:a)小鼠免疫相关基因的sgRNA质粒文库的构建;b)质粒文库的包装、转染;c)体内开展CRISPR-Cas9文库高通量筛选,获得调节T细胞功能的重要基因。
在某些实施方式中,所述步骤a)中质粒文库的构建使用本发明第一方面所述的sgRNA文库。
在某些实施方式中,所述步骤a)中sgRNA与MSCV质粒连接构建sgRNA质粒文库。
在某些实施方式中,所述步骤b)中采用逆转录病毒包装sgRNA质粒文库,转染表达Cas9的OT1-T细胞中获得文库感染细胞。
在某些实施方式中,所述步骤c)在MC38-OVA荷瘤Rag1-/-小鼠中输注表达了免疫基因文库的Cas9-OT1 T细胞,探索体内sgRNA的分布改变,获得调节T细胞功能的重要基因。
在某些实施方式中,分离输注后第7天小鼠肿瘤组织以及输注之前的基线细胞,提取基因组DNA,建库和二代测序,以读取sgRNA的丰度;利用MAGeCK算法将sgRNA的富集程度转化为其对应基因的富集程度,对比分析基线细胞和肿瘤组织细胞各个基因的显著性,最后赋予其P值;P值越小,提示该基因越有可能影响肿瘤免疫治疗的过程。
在某些实施方式中,所述基因包括Hmgb1、Sema3b、Stab2和Sckr3。
本发明的有益效果在于:
本发明用Cas9-OT1小鼠,提取出的T细胞既能稳定表达Cas9蛋白利于体内CRISPR高通量筛选,又能有效识别表达OVA抗原肿瘤细胞利于体内免疫治疗的开展。选择CRISPR文库筛选高效且方便,可以对不同基因高通量筛选;体内筛选模式更能有效筛选出影响肿瘤微环境的相关基因。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更显著:
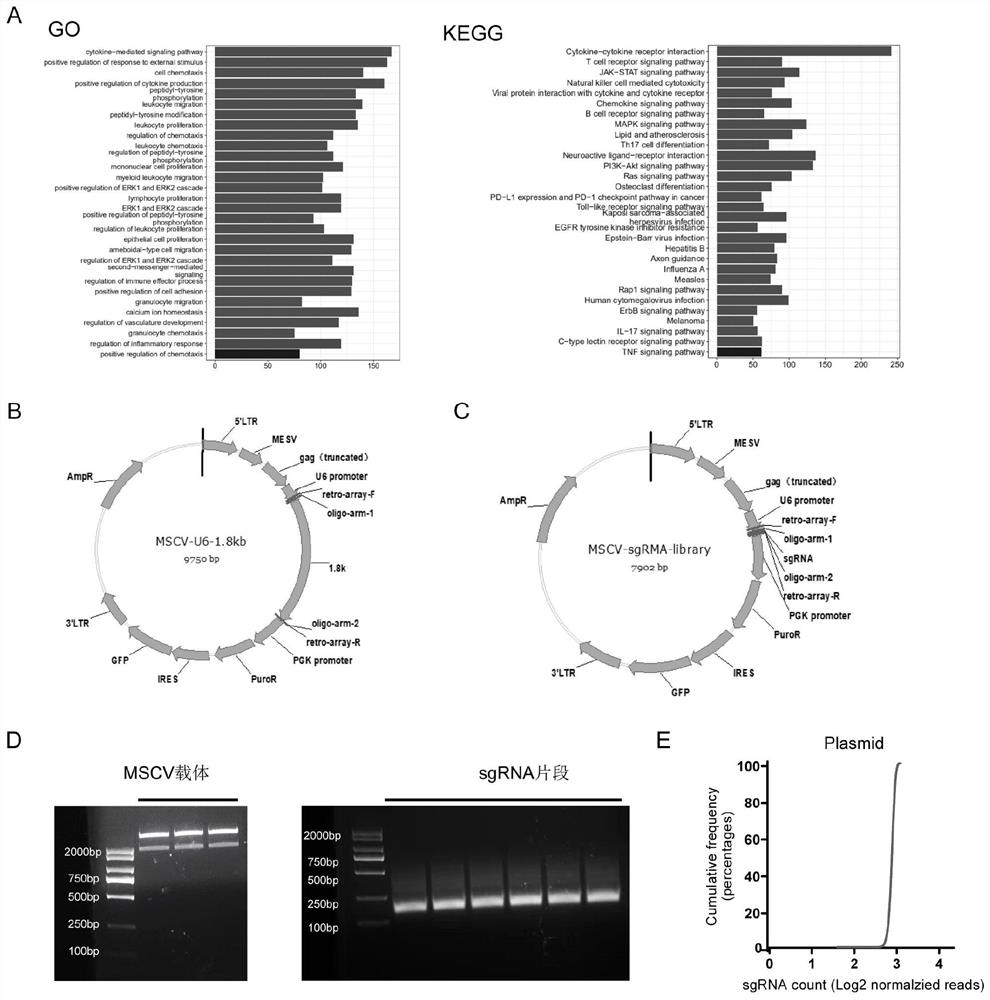
图1显示小鼠免疫基因文库构建。(A)小鼠免疫基因文库基因功能分布(KEGG和GO);(B)载体MSCV-U6-1.8kb质粒图谱;(C)MSCV-sgRNA-library质粒图谱;(D)线性化载体MSCV-BamHI&SalI琼脂糖凝胶电泳图;(E)质粒中文库sgRNA的累积分布曲线。
图2显示CRISPR文库体内筛选。(A)流式检测文库感染Cas9-OT1 T细胞的阳性率;(B)Rag1-/-小鼠输注T细胞后肿瘤生长曲线;(C)不同样本sgRNA的累积分布曲线;(E)MAGeCK算法得出的肿瘤样本中基因P值,按照正向筛选P值排名曲线;(F)肿瘤组织、脾脏和外周血筛选排名前100基因交集情况。
图3显示体内CRISPR文库筛选流程图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其它实施例,都属于本发明保护的范围。
除非另作定义,此处使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。
以下结合具体实施例对本发明的一种T细胞CRISPER文库筛选方法进行阐述。
实施例1针对小鼠免疫基因的sgRNA质粒文库的构建
首先根据小鼠基因组信息库(MGI)相关数据库以及既往文献总结小鼠免疫相关研究,挑选了1213个小鼠免疫相关基因(如表1)。随后参考John&David的小鼠sgRNA文库为本研究选定的每个基因匹配4-5条sgRNA,各基因的sgRNA靶向的基因组的区段如表1所示,同时,加入未靶向任何基因的阴性对照sgRNA共同构成小鼠免疫基因文库(如表2)。通过GO和KEGG分析发现该文库的基因功能主要分布在细胞因子、趋化因子、T细胞受体信号通路、自然杀伤细胞接到的细胞毒性反应等(图1A)。
1.1 sgRNA探针池的扩增
将sgRNA的20个核苷酸序列放在合成序列的中间,在其前后分别加上27nt的序列以提高探针池合成的正确率,前后序列见表3,随后由生工合成寡核苷酸探针池。之后使用Q5超保真DNA聚合酶(New England Biolabs,M0493S)进行扩增。扩增反应之前首先通过温度梯度PCR找到该探针池的最适退火温度,再利用不同浓度梯度的探针池模板进行定量PCR扩增,根据荧光曲线选择最适的循环数及其对应的最适模板浓度,确保循环反应处于指数扩增期且未达到平台期。根据探针池最适退火温度、浓度以及循环数进行PCR扩增sgRNA探针池(图1D)。
表3 sgRNA前序列和后序列
1.2 sgRNA质粒文库组装
使用限制性内切酶BamHI&SalI进行双酶切载体MSCV-U6-1.8kb(质粒图谱见图1B),获得线性化载体MSCV-BamHI&SalI(图1D)。之后使用Gibson重组酶(New EnglandBiolabs,E2611S)进行sgRNA文库片段和双酶切线性化载体的组装,得到sgRNA混合文库质粒,MSCV-sgRNA-library质粒图谱见图1C。
1.3 sgRNA文库质粒扩增及多样性检测
将重组产物进行电转化后涂菌大量抽提得到扩增后的小鼠免疫基因质粒文库。为了保持文库在扩增、转染过程中分布均匀,减少sgRNA的丢失,文库的扩增克隆倍数需大于300×,即在收取克隆的时候需要克隆总数大于文库中所含所有sgRNA条数的300倍。之后利用巢式PCR对sgRNA进行扩增,通过二代测序验证质粒扩增后的文库分布均匀(图1E)。
实施例2文库转染的Cas9-OT1 T细胞的获得
本发明使用逆转录病毒包装体系,利用293T细胞(ATCC)以及逆转录病毒包装质粒Pcl-Eco(Addgene,12371)和目的文库质粒进行逆转录病毒的包装,48小时后进行病毒收集。之后以低病毒滴度离心感染方式转入表达Cas9的OT1-T细胞中获得文库感染细胞,保证一个细胞至多进入一条sgRNA,流式检测感染阳性率(图2A)。
实施例3体内开展CRISPR-Cas9文库高通量筛选
在体内筛选中,选用体内不能产生T、B淋细胞的Rag1
对Rag1
探索体内sgRNA的分布改变,分离小鼠肿瘤组织(D7,第七天)以及输注之前的基线细胞(D0,第0天),进行基因组DNA的提取,之后进行建库和二代测序,以读取sgRNA的丰度。对不同样本之间总的sgRNA的分布情况进行分析,散点图显示质粒样本和基线细胞sgRNA分布较为集中,而肿瘤组织细胞sgRNA出现偏差(图2C)。利用MAGeCK算法将sgRNA的富集程度转化为其对应基因的富集程度,并对比分析了基线细胞和肿瘤组织细胞各个基因的显著性,最后赋予其P值(图2D)。P值越小,提示该基因越有可能影响肿瘤免疫治疗的过程。
除了分离肿瘤组织外,还分离了小鼠脾脏和外周血细胞,同样进行了DNA的提取以及建库测序。将肿瘤组织、脾脏和外周血sgRNA富集情况利用MAGeCK算法正向筛选得到的排名前100的基因进行交集分析,最后得出Hmgb1、Sema3b、Stab2和Sckr3四个基因(图2E)。
综上所述,本发明基于OT1小鼠模型对CD8
以上显示和描述了本发明的基本原理和主要特征和本发明的优点,对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这中叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
