一种无肌间刺银鲫的创制方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及鱼类遗传育种技术领域,尤其涉及一种无肌间刺银鲫的创制方法。
技术背景
肌间刺(intermuscular bone)是位于硬骨鱼类肌膈组织中的小针状骨,在大多数淡水鱼类中普遍存在,尤其是养殖鲤科鱼类中(Nie et al.,2019)。由于肌间刺的存在给消费者带来潜在的伤害风险,无肌间刺的产生已成为鱼类遗传育种中的一个热点问题。早期鱼类肌间刺的研究大多数主要集中在研究肌间刺的数量、形态和骨化方式(秉志,1962;万世明等,2014;Yao et al.,2015;陈琳等,2017)。近年来,关于鱼类无肌间刺的遗传育种工作已经开展一系列研究(杨建等,2019,2020;Xu et al.,2022;Nie et al.,2022)。譬如,Nie et al.(2022)通过基因组和转录组学研究揭示了斑马鱼(Danio rerio)肌间刺的分化轨迹,发现runx2b是鱼类肌间刺形成的关键基因,基因编辑后的runx2b
银鲫是我国重要的水产养殖品种之一。随着异育银鲫“中科3号”和异育银鲫“中科5号”等几个改良品种的大规模应用,它已成为我国主要的水产养殖品种。然而,银鲫含有约80根肌间刺,严重限制了其产业发展。有趣的是,银鲫能通过单性雌核生殖进行繁殖,并在其演化历程中发生了两轮多倍化事件(Gui and Zhou,2010;Li et al.,2014)。最近,银鲫被确定为双三倍体(AAABBB),即含有两套三倍体染色体(Wang et al.,2022),这意味着每个基因包括两个部分同源基因和六个等位基因。作为一种复发性多倍体鱼类,多个重复的同源基因和等位基因增加了基因编辑的难度。因此,为双三倍体银鲫建立一种利用基因编辑高效快速创制无肌间刺突变体的方法,具有重要的应用价值。
发明内容
为了解决现有技术中存在的问题,本发明提供了一种无肌间刺银鲫的创制方法。
本发明采用了以下技术方案:
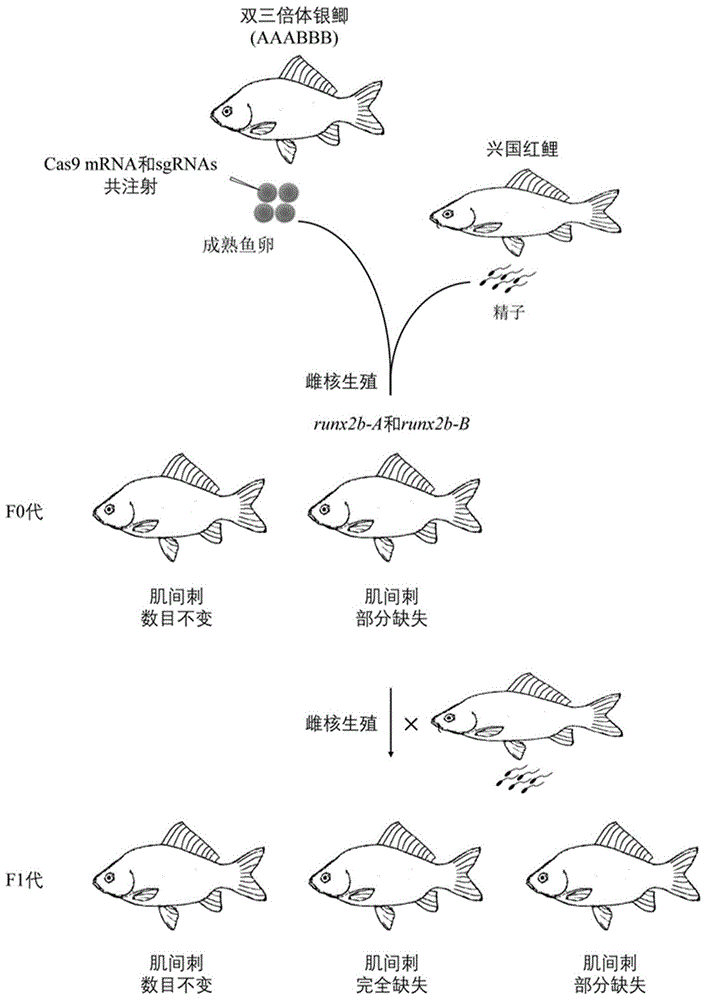
一种无肌间刺银鲫的创制方法,利用CRISPR/Cas9基因编辑技术,向银鲫鱼卵注射含有runx2b-A和runx2b-B两个特异敲除靶位点的sgRNA与Cas9mRNA混合物,注射后的银鲫鱼卵受精并孵化获得F0代,选取F0代中肌间刺数目减少表型的银鲫,通过雌核生殖获得F1代,F1代即出现所需无肌间刺银鲫;所述runx2b-A的靶位点序列如SEQ ID NO:1所示,runx2b-B的靶位点序列如SEQ ID NO:2所示。
优选的,该方法包括以下步骤:
S1.获取浓度为1000~1500ng/μL的runx2b-A和runx2b-B两个特异敲除靶位点的sgRNA,制备浓度为1500~2000ng/μL的Cas9 mRNA,备用;
S2.分别取S1中的runx2b-A sgRNA、runx2b-B sgRNA和Cas9 mRNA各1μL混合,再加入2μL无核酸酶水混合均匀,用于注射鱼卵,5μL混合物注射500~2500粒银鲫成熟鱼卵;
S3.注射后鱼卵与国兴国红鲤精子受精,雌核生殖获得F0代;
S4.取F0代中肌间刺数目减少表型的银鲫,再次通过雌核生殖方式获得F1代,F1代中即出现所需无肌间刺银鲫。
优选的,获得F0代中肌间刺数目减少表型的银鲫的方法为:在F0代银鲫孵化后210天,使用X光成像仪或活体Micro-CT影像系统进行筛选。
优选的,所述S4中雌核生殖的具体操作为:银鲫成熟的卵子与兴国红鲤雄鱼的精子混合受精,产生银鲫全雌性F1代。
优选的,所述runx2b-A sgRNA和runx2b-B sgRNA的制备方法为:分别合成runx2b-A和runx2b-B的特异靶位点引物,以所述靶位点引物和pUC19-gRNA质粒为模板,进行PCR扩增得到runx2b-A-sgRNA和runx2b-B-sgRNA片段,再对所述runx2b-A-sgRNA和runx2b-B-sgRNA片段进行纯化及回收,最终得到所需的runx2b-A sgRNA和runx2b-B sgRNA;
所述runx2b-A的特异靶位点引物的正向引物序列如SEQ ID NO:3所示,所述runx2b-B的特异靶位点引物的正向引物序列如SEQ ID NO:4所示,runx2b-A和runx2b-B的特异靶位点引物的反向引物序列如SEQ ID NO:5所示。
优选的,所处纯化及回收通过体外转录和氯化锂沉淀法进行。
本发明的有益效果在于:
相比于二倍体,银鲫是双三倍体(AAABBB),每个基因包括两个部分同源基因和六个等位基因,多倍体的基因编辑比二倍体更具挑战性。双三倍体银鲫runx2b具有两个重复的部分同源基因runx2b-A和runx2b-B,且每个部分同源基因均存在3个等位基因。
本发明优化了双三倍体银鲫在体基因功能研究的方法,根据runx2b-A和runx2b-B在第六个外显子的不同序列,分别设计runx2b-A和runx2b-B特异的敲除靶位点。利用基因编辑技术,将高浓度的两个特异靶位点sgRNA与Cas9mRNA共同注射到银鲫成熟卵中以破坏每个部分同源基因和其等位基因的功能。
一般来说,sgRNA和Cas9 mRNA被共同注射到受精卵中。相比之下,本发明将高浓度的sgRNA(400-600pg)和Cas9 mRNA(600-800pg)被共同注射到成熟卵中,将有效地编辑双三倍体银鲫runx2b-A和runx2b-B基因的所有6个等位基因,F0代中runx2b-A和runx2b-B基因的敲除效率达到100%。
注射后卵子与兴国红鲤的精子受精进行雌核生殖获得F0代,在F0代中约40%runx2b-A和runx2b-B突变体银鲫出现了肌间刺数目减少表型。通过雌核生殖进行繁殖获得F1代,即得到runx2b-A和runx2b-B基因的所有6个等位基因都被编辑的完全缺失肌间刺银鲫。本发明方法实现F1代就快速创制runx2b所有等位基因都被编辑的无肌间刺银鲫,为银鲫的基因编辑育种提供技术支撑,也为其它养殖鱼类精准设计育种提供重要参考价值。
附图说明
图1为本发明创制无肌间刺银鲫的流程示意图;
图2为银鲫runx2b-A和runx2b-B的靶位点设计示意图,外显子和内含子分别用矩形框和粗线表示,runx2b-A和runx2b-B差异序列用加粗表示;
图3为正常的肌间刺野生型银鲫(a部分)和实施例中银鲫F0代runx2b-A和runx2b-B突变体(b部分)在210dph的Micro-CT扫描示意图,图中en为髓弓小骨,ep为脉弓小骨;
图4为正常的肌间刺野生型银鲫(a部分)和部分缺失肌间刺的银鲫F1代runx2b-A和runx2b-B突变体(b部分,箭头所示为残余的肌间刺)、完全缺失肌间刺的银鲫F1代runx2b-A和runx2b-B突变体(c部分)在90dph的骨骼X光透射示意图,图中en为髓弓小骨,ep为脉弓小骨;
图5为正常的肌间刺野生型银鲫(a部分)和完全缺失肌间刺的银鲫F1代runx2b-A和runx2b-B突变体(b部分)在100dph的Micro-CT扫描示意图,图中en为髓弓小骨,ep为脉弓小骨;
图6为实施例2中野生型和试验鱼的Sanger测序峰图;图中a部分为野生型银鲫的runx2b-A靶位点检测引物的反向引物测序峰图,下划线为靶位点;b部分为runx2b-A和runx2b-B突变体银鲫的runx2b-A靶位点检测引物的反向引物测序峰图,下划线为靶位点;c部分为野生型银鲫的runx2b-B靶位点检测引物的反向引物测序峰图,下划线为靶位点;d部分为runx2b-A和runx2b-B突变体银鲫的runx2b-B靶位点检测引物的反向引物测序峰图,下划线为靶位点。
具体实施方式
为了便于理解,下面结合实施例和附图对本发明的技术方案做出更为具体的说明:
实施例1
1获得两个重复的runx2b部分同源基因(runx2b-A和runx2b-B)序列
1.1银鲫runx2b cDNA全长克隆
根据双三倍体银鲫(GCA_019843895.2)的基因组序列,通过RACE-PCR技术从异育银鲫A
1.2靶位点设计
根据runx2b-A和runx2b-B在第六外显子的不同序列,如图2所示,分别设计runx2b-A和runx2b-B特异的敲除靶位点,其中runx2b-A靶位点序列为:AAGGCCGGACTCTTCTCTGA(SEQ ID NO:1),runx2b-B靶位点序列为:AAGGCTGGACTGTTCTCGGA(SEQ ID NO:2)。
2优化双三倍体银鲫基因编辑技术,创制无肌间刺银鲫
2.1制备sgRNA
合成runx2b-A和runx2b-B特异靶位点引物如下:
runx2b-A的特异靶点引物的正向引物runx2b-A-sgRNA-F序列:
5′-GTAATACGACTCACTATAGTCAGAGAAGAGTCCGGCCTTGTTTTAG AGCTAGAAATAGC-3′(SEQ ID NO:3);
runx2b-B的特异靶点引物的正向引物runx2b-B-sgRNA-F序列:
5′-GTAATACGACTCACTATAGTCCGAGAACAGTCCAGCCTTGTTTTAGA GCTAGAAATAGC-3′(SEQ ID NO:4);
runx2b-A和runx2b-B的特异靶点引物的反向引物序列(sgRNA-R):
5′-AAAAGCACCGACTCGGTGCC-3′(SEQ ID NO:5)。
以上述靶位点引物(runx2b-A-sgRNA-F和sgRNA-R)或(runx2b-B-sgRNA-F和sgRNA-R)和pUC19-gRNA质粒为模板,用
50μL PCR扩增体系:
PCR扩增程序:95℃预变性2min;95℃变性20s,58℃退火20s,72℃延伸10s,38个循环;最后72℃延伸5min。
通过在1.2%的琼脂糖凝胶上用合适的DNA染色剂电泳分析1~2μL PCR产物,确认存在约120bp的单一PCR条带,使用Gel Extraction Kit(Omega)进行切胶纯化回收PCR产物,最后用20μL无核酸酶水洗脱于无核酸酶EP管中,从而得到纯化的runx2b-A-sgRNA片段和runx2b-B-sgRNA片段。
使用TranscriptAid T7 High Yield Transcription Kit(Thermo FishScientific)分别对runx2b-A-sgRNA片段和runx2b-B-sgRNA片段进行sgRNA的体外转录,并利用氯化锂沉淀法对sgRNA的体外转录产物纯化回收,最终得到runx2b-A-sgRNA和runx2b-B-sgRNA。
分别取1μL runx2b-A-sgRNA和runx2b-B-sgRNA用Nanodrop 2000c(Thermo FishScientific)测定其浓度,然后取100~200ng的sgRNA溶液在1.2%的琼脂糖凝胶上用合适的DNA染色剂电泳检测RNA的质量,其余runx2b-A-sgRNA和runx2b-B-sgRNA溶液分装并置于-80℃冰箱保存备用。
2.2制备Cas9 mRNA
用XbaI(NEB)单酶切zebrafish-codon-optimized Cas9质粒,通过在1.2%的琼脂糖凝胶上用合适的DNA染色剂电泳分析酶切产物,确认质粒线性化后,使用Gel ExtractionKit(Omega)进行切胶纯化回收线性化zebrafish-codon-optimized Cas9质粒,最后用20μL无核酸酶水洗脱于无核酸酶EP管中,从而得到纯化的线性化zebrafish-codon-optimizedCas9质粒。
使用Mmessage mMACHINE
取1μL Cas9 mRNA用Nanodrop 2000c(Thermo Fish Scientific)测定其浓度,然后取100~200ng的Cas9 mRNA溶液在1.2%的琼脂糖凝胶上用合适的DNA染色剂电泳检测RNA的质量,其余Cas9 mRNA溶液分装并置于-80℃冰箱保存备用。
2.3成熟鱼卵显微注射及受精孵化
将1μL runx2b-A-sgRNA(1000~1500ng/μL)、1μL runx2b-B-sgRNA(1000~1500ng/μL)、1μL Cas9 mRNA(1500~2000ng/μL)和2μL无核酸酶水在0.2mL无核酸酶EP管中进行混合均匀,将装有混合液的无核酸酶EP管放在冰上暂存,等待被转移到显微注射针头进行显微注射,5μL混合物可注射500~2500粒银鲫成熟鱼卵。
将200~500粒异育银鲫A
2.4无肌间刺银鲫的创制
将F0代个体鱼苗饲养到成年,并在210dph时使用野外便携式X光成像仪(Topbiox)和小动物活体Micro-CT影像系统(Bruker)进行活体快速扫描筛选。本实施例中,如图3所示,与正常的肌间刺野生型银鲫相比,F0代中大约40.0%(n=34/88)的runx2b-A和runx2b-B突变体银鲫表现出肌间刺部分缺失。
选择4尾有明显肌间刺缺失的F0代个体银鲫,将银鲫成熟的卵子与兴国红鲤雄鱼的精子混合受精,通过雌核生殖,产生银鲫全雌性F1代。
待F1代runx2b-A和runx2b-B基因突变体银鲫培育到90dph时,所有雌核生殖F1代突变体银鲫都用野外便携式X光成像仪进行活体快速扫描观察银鲫肌间刺表型。
本实施例中,在432尾runx2b-A和runx2b-B基因突变的雌核生殖F1代中,发现291尾突变体银鲫表现出完全缺失肌间刺,80尾突变体银鲫表现出部分缺失肌间刺;如图4所示,其中在一尾F0代亲本的雌核生殖F1代中,发现约81%(n=205/253)突变体银鲫表现出完全缺失肌间刺,19%(n=48/253)突变体银鲫表现出部分缺失肌间刺。
接着详细分析runx2b突变的雌核生殖F1代的肌间刺表型和基因型。随机选取100dph雌核生殖F1代突变体银鲫进行活体Micro-CT扫描观察,所有被分析的个体都拥有正常的脊柱。如图5所示,与正常的肌间刺野生型银鲫相比,F1代runx2b-A和runx2b-B突变体银鲫表现出完全缺失肌间刺。通过PCR和测序对其突变的基因型进行分析,发现完全缺失肌间刺突变个体都拥有runx2b-A和runx2b-B各三个突变等位基因,且都产生移码突变的基因型(runx2b-A
实施例2
在F0代,为检测每个靶位点的突变效率,对两个部分同源基因runx2b-A和runx2b-B分别设计特异的靶位点检测引物(检测引物设计在靶位点的上下游至少100bp处),其中runx2b-A靶位点检测引物为:
runx2b-A-F:5′-GCAGCCAAATTCATCAAATTGCTC-3′;
runx2b-A-R:5′-GAAATGTCATACCTGTTATCTGCG-3′;片段大小约300bp。
runx2b-B靶位点检测引物:
runx2b-B-F:5′-CCATGGATACATTTAGGGTGC-3′;
runx2b-B-R:5′-TACCTGTAATCTGAGTCTGCC-3′;片段大小约500bp。
随机选取8尾CRISPR/cas9编辑过F0代1dph银鲫鱼苗和3尾野生型1dph银鲫鱼苗,使用磁珠法动物组织基因组DNA纯化试剂盒(杭州比格飞序生物科技有限公司)分别单独提取鱼苗基因组DNA。将每尾鱼苗的基因组DNA作为模板,同时分别用runx2b-A靶位点检测引物和runx2b-B靶位点检测引物进行PCR扩增。
50μL PCR扩增体系:
PCR扩增程序:95℃预变性2min;95℃变性20s,56℃退火20s,72℃延伸20s,38个循环;最后72℃延伸5min。
通过在1.2%的琼脂糖凝胶上用合适的DNA染色剂电泳分析1~2μL PCR产物,验证PCR产物条带大小正确后,将其余未纯化PCR产物送到测序公司(武汉艾康健生物科技有限公司)进行Sanger测序。
如图6所示,野生型的Sanger测序峰图在靶位点附近上下游区域都是单峰,CRISPR/cas9编辑过实验鱼的Sanger测序峰图在靶位点附近区域出现套峰,初步判断该靶位点处发生敲除。之后将纯化PCR产物克隆并进行Sanger测序获得突变序列,通过突变序列与野生型序列进行比较,最终确定靶位点突变效率。实施例1中,8尾CRISPR/cas9编辑过的F0代1dph银鲫鱼苗,分别在runx2b-A靶位点和runx2b-B靶位点都发生了突变,runx2b突变效率为100%,即runx2b基因被成功敲除。
以上实施方式仅用以说明本发明的技术方案,而并非对本发明的限制;尽管参照前述实施方式对本发明进行了详细的说明,本领域的普通技术人员应当理解:凡在本发明创造的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明创造的保护范围之内。
