CD24作为Hippo通路失活亚型肝细胞癌生物标志物的应用
文献发布时间:2023-06-19 19:33:46
技术领域
本发明涉及生物医药领域,特别是涉及CD24作为Hippo通路失活亚型肝细胞癌生物标志物的应用。
背景技术
原发性肝癌(肝细胞癌,hepatocellular carcinoma,HCC)是全世界常见的恶性肿瘤之一。据统计,我国原发性肝癌发病率位居恶性肿瘤的第四位,几乎占全球发病人数的一半,其致死率高居恶性肿瘤第二位。肝癌病人的预后数据显示:肝癌患者五年总生存率仅为14.1%。目前处于临床试验期的HCC治疗方法,大部分是将免疫阻抑点抗体疗法与酪氨酸激酶的小分子或抗体抑制药物联合应用。然而研究表明,尽管酪氨酸激酶通路抑制剂和PD-1/PD-L1抗体药获得了喜人的效果,实际上仅对部分患者有效,大部分患者仍然面临着复发、转移的困境,提示肝细胞癌在靶向药和免疫治疗响应上存在异质性。近年的研究数据表明,临床用药时缺乏将HCC患者按照肿瘤分子分型精细化分层筛选,是影响试验药物最终进入临床应用的关键原因,同时也是部分HCC患者用药后无法获得客观缓解的根本原因。
随着多组学测序技术突飞猛进,HCC的分子分型已经取得了不少进展,包括利用代谢组学在内的多组学联合分型,将肝癌在大体上可以大致分为三种分子亚型:S-Ⅰ、S-Ⅱ和S-Ⅲ,其中Hippo通路失活的肝癌细胞亚型约占12%,包含在恶性程度较高的S-III大类中,与肝癌患者的不良预后密切相关。
CD24是一个小分子膜蛋白,常被糖基磷脂酰肌醇修饰,形成复杂的异质化蛋白,分子量在20-70kDa不等,其功能差异可能与其在不同组织器官中的糖基化水平密切相关。研究表明,分化成熟的肝脏细胞不表达CD24,而在肝细胞癌HCC中,约2/3的肿瘤标本中能检测到CD24的表达,并且患者内的肿瘤结节间的CD24表达差异明显,提示CD24在肝细胞癌中的表达异质性。CD24的异常表达与HCC患者肿瘤切除术后的复发转移正相关,提示HCC中CD24可能促进肝细胞癌的发生发展。
Hippo信号通路是近来受到广泛关注的一条信号通路,其可以参与调控多种细胞和器官的稳态。最近的研究表明,Hippo信号通路在哺乳动物肝脏发育、肝脏细胞命运和死亡,肝脏再生以及肝癌发生发展等生理和病理过程中都发挥了非常重要的调控作用。其中YAP是Hippo信号通路中重要的转录因子,而在许多肿瘤中都能发现YAP对肿瘤细胞的调控作用。但迄今仍未有CD24与Hippo信号通路调控的相关性研究,而CD24通过Hippo通路调控HCC的研究更是未见报道。
发明内容
本发明的目的是提供CD24作为Hippo通路失活亚型肝细胞癌生物标志物的应用,本发明公开的CD24可作为该类肝细胞癌预后评价的指标和治疗的药物靶点,以解决上述现有技术存在的问题。
本发明的技术方案之一,CD24作为Hippo通路失活亚型肝细胞癌生物标志物的应用,所述应用包括如下任一应用:
(1)在制备诊断Hippo通路失活亚型肝细胞癌产品中的应用;
(2)在制备预后评价Hippo通路失活亚型肝细胞癌产品中的应用;
(3)在制备防治Hippo通路失活亚型肝细胞癌产品中的应用。
进一步地,所述防治Hippo通路失活亚型肝细胞癌产品通过下调所述CD24表达,抑制Hippo下游转录因子YAP5SA激活的肝细胞癌发生,减少CD24与巨噬细胞的结合,以防治Hippo通路失活亚型肝细胞癌。
进一步地,所述下调CD24表达的方法包括使用CD24 shRNA抑制所述CD24的表达。
进一步地,所述CD24 shRNA的正义链如SEQ ID NO.1所示,反义链如SEQ ID NO.2所示。
进一步地,所述CD24包括CD24信使RNA或CD24蛋白。
进一步地,所述诊断或预后评价Hippo通路失活亚型肝细胞癌的产品包括检测CD24表达水平的试剂盒或试剂。
本发明的技术方案之二,一种检测权利要求1中所述的生物标志物的产品,所述产品包括检测CD24信使RNA或CD24蛋白表达水平的产品。
本发明的技术方案之三,一种预防或治疗Hippo通路失活亚型肝细胞癌的药物,所述药物包括抑制CD24表达的shRNA或试剂。
本发明的技术方案之四,一种根据上述的生物标志物在筛选治疗Hippo通路失活亚型肝细胞癌的候选药物中的应用。
本发明的技术方案之五,一种筛选治疗Hippo通路失活亚型肝细胞癌的候选药物的方法,用待筛选物质处理表达CD24基因的培养体系,并检测所述培养体系中CD24基因的表达水平,若所述待筛选的物质可以抑制CD24基因的表达和发挥功能,则表明所述待筛选物质是治疗肝细胞癌的候选物质。
本发明公开了以下技术效果:
本发明提供一组Hippo通路失活肝细胞癌亚型肿瘤标志物,可以应用于该型肝癌的诊断和预后评估。研究发现CD24在肝细胞癌中表达具有异质性,其主要受到Hippo下游转录因子YAP激活通路调节。当Hippo通路失活时,CD24会呈现异常高表达。CD24可通过结合巨噬细胞Siglec10,抑制其吞噬,逃避免疫。将CD24基因敲低的肝癌细胞株通过尾静脉注入小鼠体内,可发现小鼠的成瘤率降低。因此,本发明公开的所述标志物CD24检测水平可作为诊断或预后评价的指标,为临床肝癌治疗提供一定的思路,同时所述标志物CD24检测水平可以应用于Hippo通路失活肝细胞癌亚型治疗的药物靶点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为Hippo通路失活亚型与其他组生存率的比较;
图2为CD24在Hippo通路失活HCC亚型中的表达;
图3为人肝癌组织样本和相应的癌旁组织中CD24的表达情况;
图4为PB-YAP5SA基因质粒(A)和PB-YAP基因质粒(B)的质粒图谱及模拟Hippo通路失活的YAP基因活化突变体基因YAP5SA整合进入小鼠肝脏,诱发小鼠肝癌的原发型肝癌小鼠成瘤模型结果图(C),其中,CON为YAP基因质粒,HCC为YAP5SA基因质粒;
图5为Real-time PCR(B)和RNA seq检测(A)肝癌及癌旁组织中CD24的表达情况,其中**P<0.01;
图6为免疫组化检测肝癌及癌旁组织中CD24的表达情况;
图7为肝癌细胞与巨噬细胞共培养的吞噬实验结果;
图8为抑制肝癌细胞CD24表达的的裸鼠荷瘤实验;
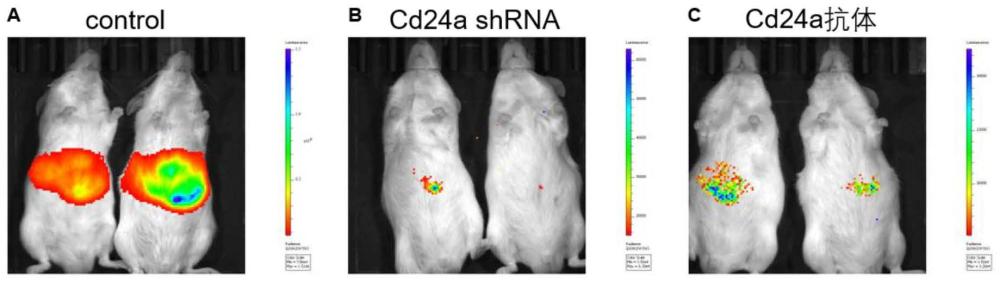
图9为Hippo通路失活原发性肝癌小鼠模型中,抑制肝细胞表达CD24或发挥正常功能的肿瘤发生情况,A:对照组,B:Cd24a shRNA组,C:Cd24a中和抗体组。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
实施例1利用贝叶斯复合协变量预测器(Bayesian compound covariatepredictor,BCCP)构建Hippo通路的失活亚型的分子分型预测模型
1.1训练集的选择
采用GEO数据库中Sav1-/-和Mst1/2-/-条件敲除鼠形成的原发性肝癌组织的cDNA表达芯片数据(GSE32510)作为训练集。
1.2测试集的选择
选用TCGA数据库终肝癌队列(LIHC cohort https://xenabrowser.net/datapages/)作为测试集。
1.3分析过程
(1)训练集和测试集的表达数据根据组织进行标准化及去除批次效应。
(2)完成人类和小鼠之间的同源基因的相互匹配。
(3)采用基于贝叶斯复合协变量预测器(BCCP)的算法进行分类。
1.4结果
(1)TCGA的HCC患者中,Hippo信号通路失活亚型(SOH)占总体的16%左右,其总体生存率显著低于其它组别(AH)。结果如图1所示。
(2)在免疫抑制因子中,CD24在Hippo失活亚型中显著高表达。结果如图2所示。
实施例2人肝癌组织样本和相应的癌旁组织中CD24的表达情况
2.1 Trizol法提取总RNA
切取100mg人肝癌组织样本与相应的癌旁组织分别超声磨碎成匀浆,在100mg匀浆组织标本中加入1ml的Trizol,将匀浆标本转移到1.5ml的EP管中,在室温放置5分钟以彻底分离核蛋白复合体,加入0.2ml的氯仿,摇匀后室温放置3分钟,4℃环境下,12000g离心15分钟,吸取上清液至干净的EP管,加入与上清液等量的异丙醇,室温静置10分钟,4℃环境下,12000g离心10分钟后弃掉上清液,开盖置空气中5-10分钟,干燥RNA沉淀,用20μl无RNase水重悬RNA沉淀,用枪头反复吹打几次,静置10分钟。测浓度后-20℃保存。
2.2 RT-PCR定量
按照艾科瑞生物公司的Evo M-MLV反转录试剂盒的方法将RNA转录出cDNA;反转录的cDNA采用艾科瑞生物公司的SYBR Green PRO Taq HS预混型qPCR试剂盒,按照其说明,配制PCR反应液,在Bio-Rad CFX Manager 3.1软件上分析;用Livak法计算基因相对表达值。
引物序列:
CD24-qRT-F:CTCCTGGGAAGATGCGGAC,
CD24-qRT-R:CCGAAGCCCTTGCTTTGTTC;
GAPDH-qRT-F:GGAGCGAGATCCCTCCAAAAT,
GAPDH-qRT-R:GGCTGTTGTCATACTTCTCATGG。
结果如图3所示,与癌旁组织相比,肝癌组织样品中的CD24表达水平明显增高。
2.3组织固定和免疫组化
取人肝癌组织样本与相应的癌旁组织浸泡于4%的多聚甲醛中,室温固定24小时后用不同梯度的乙醇对样本脱水,按照标准程序将样本包埋在石蜡中。肝组织切片用苏木精和伊红染色。为提取抗原,切片置于10mM柠檬酸钠缓冲液(pH6.0)中加热沸腾两次后取出使之降至室温。将切片用3% H
结果如图3所示,在人肝癌组织中,CD24显示出明显高表达。
实施例3Hippo通路失活小鼠原发性HCC模型的构建
3.1准备携带有YAP5SA的PB转座系统质粒
pQCXIH-Myc-YAP-5SA购自Addgene;PB转座子质粒(PiggyBac Dual promoter-CAG)和PB转座酶质粒(Super PiggyBac Transposase)购自武汉淼灵。
利用PCR技术将YAP5SA基因片段克隆至PB转座子质粒构建出PB-YAP5SA质粒,并进行了测序鉴定(图4中A);同时根据YAP1 cDNA序列(NM_001195044.2)我们做了回复突变,并克隆到PB转座子质粒构建出PB-YAP(图4中B)。将转座子质粒和转座酶质粒用无内毒素质粒试剂盒提取纯化。
3.2小鼠尾静脉高压大剂量注射PB转座系统质粒
4周龄小鼠50只,用三溴乙醇麻醉后,并将其尾静脉用温水浸泡1分钟。将小鼠随机均分为PB-YAP基因质粒(CON)和PB-YAP5SA基因质粒(HCC)。
称量小鼠体重,按小鼠重量的10%的体积在7秒内分别将携带PB-YAP基因质粒(CON)和PB-YAP5SA基因质粒(HCC)的Ringer缓冲液通过小鼠尾静脉注射到HCC小鼠体内。
24-48小时后取肝脏组织检测YAP5SA基因的瞬时表达,3个月后取出肝脏观察成瘤情况。与对照组相比,注射PB-YAP5SA质粒的小鼠形成了肝癌,结果见图4中C。
实施例4正常小鼠与Hippo通路失活的肝癌亚型小鼠的CD24表达情况
4.1 Trizol法提取总RNA
方法同2.1,分别切取100mg正常小鼠与Hippo通路失活肝癌亚型小鼠的肝脏冰冻组织提取总RNA。
4.2 RT-PCR定量
方法同2.2,采用的荧光定量PCR引物如下:
Cd24a-qRT-F:GCTCCTACCCACGCAGATTT,
Cd24a-qRT-R:CTTGTGGTTGCCATTTGGGG;
Gapdh-qRT-F:AAGGTGAAGGTCGGAGTCAACGGATTTG,
Gapdh-qRT-R:CTCGCTCCTGGAAGATGGTGATGGGATT。
YAP5SA引起的肝细胞癌的小鼠体内的Cd24a表达水平明显高于正常小鼠,结果如图5所示。
注:CD24是人源CD24基因的表述,Cd24a是鼠源CD24基因的表述。
4.3组织固定和免疫组化
方法同2.3,分别将小鼠正常肝脏组织和肝癌组织进行切片和HE染色。此外将切片与一抗CD24(华安,#0804-3)、一抗YAP(华安,#1609-30)4℃环境下孵育过夜。切片洗涤三次后,切片与特异性二抗孵育并用DAB试剂显色。
结果如图6所示,由图6可知YAP5SA引起的HCC组织显示出了高度增殖的特征(Ki67+),YAP阳性、Cd24a阳性。
实施例5CD24在Hippo通路失活肝细胞癌亚型的免疫靶点价值情况
5.1CD24敲低与感染
使用EcoR1和Age1酶切pLKO.1-TRC后,将CD24 shRNA克隆到pLKO.1载体上。
CD24的shRNA寡核苷酸正义链为5'-CCGGTGTTGCACCGTTTCCCGGTAACTCGAGTTACCGGGAAACGGTGCAACATTTTTG-3(SEQ ID NO.1);反义链为5-AATTCAAAAATGTTGCACCGTTTCCCGGTAACTCGAGTTACCGGGAAACGGTGCAACA-3(SEQ ID NO.2)。
PLKO.1-CD24 shRNA与psPAX2和pMD2G混合后共转染至HEK293T细胞,培养48h后,收集病毒用于感染细胞。
将感染48h后的细胞放入2μg/ml嘌呤霉素的中培养基中7天得到CD24敲低的稳定株。
5.2制备M2巨噬细胞
使用Ficoll和Percoll通过连续的密度梯度离心法分离纯化外周血单核细胞,将分离得到的外周血单核细胞在含10%AB型人血清的IMDM中培养7-9天可以分化为巨噬细胞,在培养巨噬细胞的第3天加入50ng/ml的人TGFβ1和50ng/ml的人IL-1刺激细胞表面Siglec-10表达,直到培养的第8天。将5000个野生型肝癌细胞和CD24敲低的肝癌细胞与10000个的巨噬细胞在24孔板内共培养,观察细胞吞噬。
结果见图7,由图7可知,CD24可与结合巨噬细胞Siglec10,抑制其吞噬,逃避免疫。
5.3免疫受损肿瘤实验
4周龄的雄性BALB/C-Nude购自中国江苏集萃药康生物科技有限公司。按照每只裸鼠100万细胞溶解在100ul DMEM和50ul Matrigel的比例将HepG2或CD24敲低的HepG2细胞通过皮下注射到小鼠的腹部两侧。在免疫受损肿瘤实验中,每只裸鼠在移植肿瘤细胞5天后,进行抗体的注射,100μg CD24抗体(实验室自备)和鼠IgG1隔天连续注射7天。在裸鼠生长过程中观察测量肿瘤大小,在裸鼠生长3周时,处死所有小鼠分离肿瘤于-80℃保存。
由图8可知,CD24敲低细胞株(CD24,KD)的克隆生长能力弱于正常HepG2(WT),实验显示HepG2的CD24敲低细胞株的无法在雄性BALB/C-Nude成瘤。
5.4 YAP5SA原发性肝癌小鼠模型中敲除CD24对肿瘤生长的影响
经shRNA功能验证后,将包含启动子和终止子的shRNA序列反向克隆至YAP5SA 启动子上游,构建成质粒(PB-YAP5SA-Cd24a shRNA)。PB-YAP5SA-Cd24a shRNA及其对照质粒利用尾静脉大剂量高压注射进入小鼠肝脏,在PB转座酶的帮助下在小鼠肝脏内成瘤。3个月后观察小鼠的HCC的形成情况。结果如图8所示,CD24基因的敲除几乎抑制了YAP5SA驱动HCC的发生。
实施例6实时荧光监测的Hippo通路失活肝细胞癌亚型小鼠模型的建立和应用
6.1 Piggybac-YAP5SA荧光素酶基因共表达质粒的构建。
通过PCR技术,将IRES元件和萤火虫荧光素酶基因(Fluc)连接在原癌基因YAP5SA后部(PB-YAP5SA-IRES-Fluc)。
6.2 Cd24a shRNA共表达质粒(PB-U6-Cd24a shRNA-YAP5SA-IRES-Fluc)的构建
首先按照方法同5.1,构建Cd24a shRNA的质粒(pLKO.1-Cd24a shRNA),Cd24ashRNA引物序列如下:正向引物5’-CCGGC CCGTA CAGTA GTCTT GATAA CTCGA GTTAT CAAGACTACT GTACG GGTTT TTG;反向引物5’-AATTC AAAAA CCCGT ACAGT AGTCTT GATAAC TCGAGTTATC AAGAC TACTGT ACGGG。
再将pLKO.1-Con shRNA和pLKO.1-Cd24a shRNA中包含U6和shRNA的序列通过PCR克隆到PB-YAP5SA-IRES-Fluc载体中,获得PB-U6-Con shRNA-YAP5SA-IRES-Fluc和PB-U6-Cd24a shRNA-YAP5SA-IRES-Fluc。
6.3小鼠尾静脉高压大剂量注射PB转座系统质粒
按照前面所述进行小鼠尾静脉注射,即按小鼠重量的10%的体积在7秒内分别将携带PB-U6-Con shRNA-YAP5SA-IRES-Fluc和PB-U6-cd24ashRNA-YAP5SA-IRES-Fluc转座系统质粒的Ringer缓冲液通过小鼠尾静脉注射到HCC小鼠体内,将原癌基因、shRNA和荧光素酶基因同时整合进入肝细胞基因组,实现原癌基因和荧光素酶基因在肝脏内的稳定共表达。
6.4荧光素酶活性的检测
尾静脉注射1个月后,可通过腹腔注射的方式,将3mg荧光素酶的底物Luciferin注射进小鼠体内,15min左右通过小动物活体成像系统进行荧光信号的采集。结果如图9中A所示,荧光素酶共表达的YAP5SA驱动可以驱动HCC的发生,而Cd24a shRNA敲低能够显著抑制HCC的发生(图9中B),同时Cd24a中和抗体的加入也可以显著抑制小鼠HCC的形成(图9中C)。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
