一种改变猫毛色的遗传修饰方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于基因工程领域,具体涉及一种改变猫毛色的遗传修饰方法。
背景技术
在改变猫的毛色领域,通常采用的是不同品种间杂交方法,该技术通常以一种猫为母本跟另外一种猫为父本进行配种获得杂交子一代,然后与母本进行多次回交固定毛色表型。然而,该技术在改变一种猫的毛色的同时也会改变其本身的外貌和体型等其他性状,表型变化结果难以控制。这可能是因为,采用传统杂交育种技术,在改变猫的毛色的同时,因引入另一种猫的基因组,会改变多数基因的表达情况,因此会改变除毛色之外的其他性状。
发明内容
本发明的目的是针对以上要解决的技术问题,提供一种能够特异性地、稳定地改变猫毛色的方法。
为了实现以上发明目的,本发明提供了一种改变猫毛色的遗传修饰方法,其包括:利用CRISPR/Cas9技术靶向猫KIT基因第17号外显子进行基因编辑。
根据本发明的方法可用于非疾病诊断治疗目的。
根据本发明的方法,优选地,所述方法的具体步骤为:
(1)构建靶向猫KIT基因第17号外显子的CRISPR/Cas9表达载体;
(2)将所述CRISPR/Cas9表达载体转染猫的皮肤成纤维细胞。
根据本发明的方法,优选地,所述步骤(1)中,所述步骤(1)中,特异性靶向猫KIT基因第17号外显子的sgRNA包括pX458-KIT-sgRNA1和pX458-KIT-sgRNA2,pX458-KIT-sgRNA1的核苷酸序列如SEQ ID NO:1所示,pX458-KIT-sgRNA2的核苷酸序列如SEQ ID NO:2所示。
根据本发明的方法,优选地,所述步骤(1)中,使用pX458构建CRISPR/Cas9表达载体。
根据本发明的方法,优选地,所述猫为狸花猫。
另一方面,本发明还提供了一种特异性靶向猫KIT基因第17号外显子的sgRNA,其中,所述sgRNA包括pX458-KIT-sgRNA1和pX458-KIT-sgRNA2,pX458-KIT-sgRNA1的核苷酸序列如SEQ ID NO:1所示,pX458-KIT-sgRNA2的核苷酸序列如SEQ ID NO:2所示。
另一方面,本发明还提供了一种CRISPR/Cas9表达载体,其包含所述特异性靶向猫KIT基因第17号外显子的sgRNA。
另一方面,本发明还提供了所述特异性靶向猫KIT基因第17号外显子的sgRNA在改变猫毛色中的用途。
另一方面,本发明还提供了含有所述特异性靶向猫KIT基因第17号外显子的sgRNA的重组表达载体在改变猫毛色中的用途。
另一方面,本发明还提供了所述特异性靶向猫KIT基因第17号外显子的sgRNA在构建猫KIT基因突变库中的用途。
本技术通过构建靶向猫KIT基因第17号外显子的CRISPR/Cas9表达载体,转染猫的皮肤成纤维细胞,通过流式分选技术富集EGFP阳性细胞,提取基因组PCR产物TA克隆测序分析,检测了CRISPR/Cas9对KIT基因的编辑活性。在验证其编辑效率达80%以上后,通过体细胞核移植技术构建基因编辑克隆胚胎,并进一步通过胚胎移手术将其植入代孕狸花猫的输卵管内,经过正常妊娠后获得带有白毛色的KIT基因编辑狸花猫。
首先,本发明应用CRISPR/Cas9技术编辑狸花猫的KIT基因第17号外显子,从而可以在狸花猫的基因组内实现精确的基因修饰,同时不引入任何外源DNA序列,有效避免了传统转基因技术可能产生的生物安全风险。其次,本发明利用基因编辑技术定向改变狸花猫的毛色性状,能够避免传统杂交育种过程中在改变毛色性状的同时,引入外来猫的血缘,影响狸花猫原有的外貌和特性。可见,本发明通过CRISPR/Cas9对猫KIT基因进行精确编辑,不引入任何外源DNA序列,特异性地改变猫的毛色,对于培育出满足消费者需求的多种颜色猫具有重要的意义。
附图说明
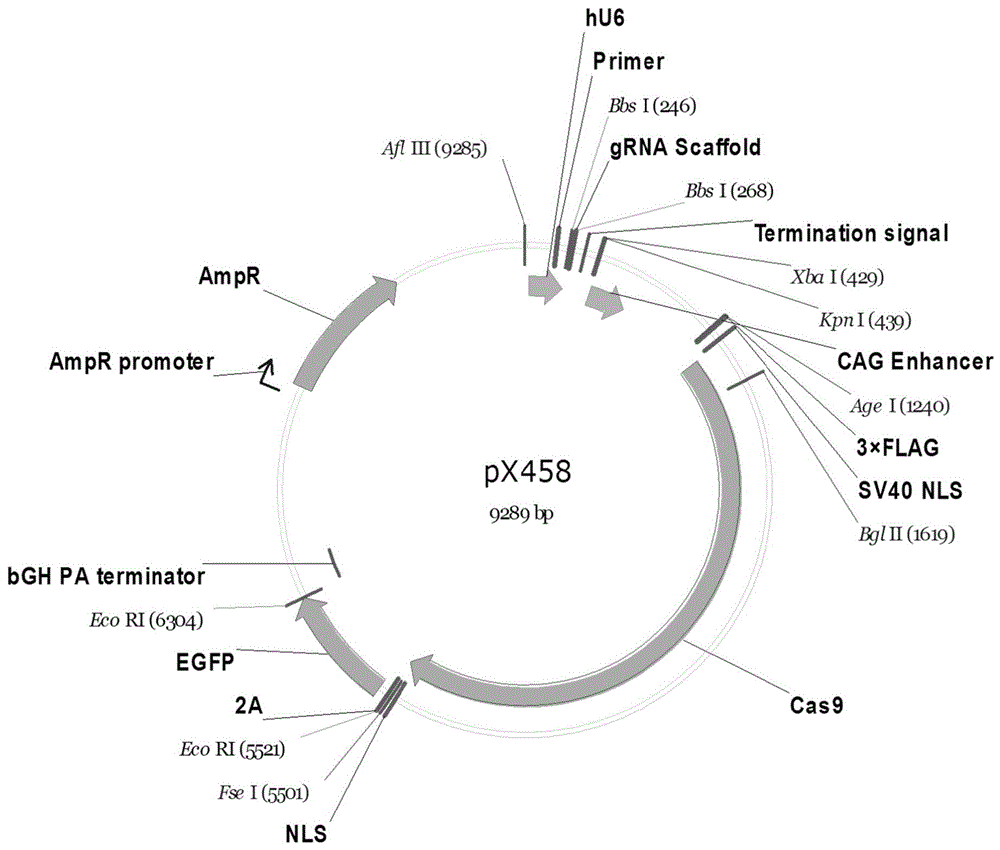
图1示出了Cas9/sgRNA共表达载体pX458图谱。
图2示出了流式分选编辑细胞和基因鉴定结果。
图3示出了TA克隆测序分析pX458-KIT-sgRNA1和pX458-KIT-sgRNA2在猫皮肤成纤维细胞中的基因编辑效率结果。
图4示出了基因型鉴定结果。
图5示出了基因编辑猫的T-A克隆测序结果。
图6示出了KIT基因编辑改变狸花猫的毛色。其中,左为基因编辑狸花猫,右为野生型狸花猫。
图7示出了KIT基因编辑改变狸花猫脚垫的颜色。
图8示出了毛囊黑色素染色结果。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明,而非用于限制本发明的范围。
1.KIT基因靶位点选择:
从NCBI下载猫的KIT基因全长序列(NC_058371),设计2条靶向猫KIT基因的sgRNA,具体序列见表1。
表1:靶向猫KIT基因sgRNA序列信息
表1中,PAM(protospacer-adjacent motif)指sgRNA结合基序。
2.靶向猫KIT基因的sgRNA/Cas9共表达载体的构建:
靶向猫KIT基因的sgRNA/Cas9共表达载体的构建方法如下:
pX458载体可同时表达sgRNA和密码子经人源性优化的Cas9蛋白、以及报告基因EGFP。Cas9/sgRNA共表达载体pX458图谱如图1所示。
根据表1中的2条sgRNA序列,合成相应的寡核苷酸正负单链,每条单链上添加有BbsⅠ相应的黏性末端。首先使用T4 PNK酶对sgRNA的正负两条寡核苷酸链进行磷酸化和退火处理,使之形成具有BbsⅠ黏性末端的双链DNA短片段,对合成的正负单链进行磷酸化反应,使用BbsⅠ酶切1μg pX458载体,线性化的质粒经电泳。同时,使用T4连接酶将上述具有BbsⅠ黏性末端的双链DNA短片段与线性化的pX458载体进行连接,然后将连接产物转化至DH5α细菌感受态细胞中,并涂布到氨苄抗性的LB平板上,最后挑选细菌单克隆,通过测序鉴定sgRNA序列是否正确插入到pX458载体中,挑选正确的克隆摇菌培养,提取靶向猫KIT基因的Cas9/sgRNA表达载体。
3.猫胎儿成纤维细胞培养与转染:
分离猫胎儿成纤维细胞(Cat fetal fibroblasts)。
从宠物医院带回难产死亡的母猫,利用子宫摘除术获猫胎儿(约40日龄),用PBS清洗子宫表面,酒精浸泡1min,之后立即用PBS清洗。小心剪开子宫,剥离出胎盘包裹的胎儿,用PBS多次清洗。随后剪开胎盘,取出胎儿,PBS多次清洗。剪下胎儿皮肤组织并剪碎,然后转移到50ml离心管,加入0.1%(w/v)I型胶原酶,放置水浴摇床,37℃消化1小时,加入细胞培养液终止消化,1500rpm/min,离心10min,弃上清,再次加入细胞培养液,吹散混匀细胞后,1500rpm/min,离心10min,弃上清。加入细胞培养液重悬细胞,接种至100mm细胞培养皿,放置CO
猫胎儿成纤维细胞在含有20%胎牛血清和双抗(100U/mL青霉素和100mg/mL链霉素)的DMEM/F12培养基中生长。细胞培养1-2天后更换一次培养基。细胞生长至80%左右的汇合度时,先用PBS洗涤两遍,然后用胰酶消化2min,随后加入血清终止消化,将消化后的细胞收集至15mL的离心管进行离心,弃上清后再用PBS洗涤,进行第二次离心。离心后弃上清,然后用适量Buffer R溶液(Thermo Fisher,货号:MPK10096)重悬细胞,使细胞密度达到5.0×10
将靶向猫KIT基因的sgRNA/Cas9表达载体通过电转染转入猫胎儿成纤维细胞。使用Neon
细胞转染后24h更换培养基,添加双抗(100U/mL青霉素和100mg/mL链霉素),在5%的CO
2天后进行流式分析、分选或者收取细胞提取DNA进行后续实验。
4.流式细胞分析与分选:
先用2%的胰蛋白酶消化贴壁的猫胎儿成纤维细胞,然后用PBS重悬成单个细胞,经孔径为40μm的尼龙膜过滤到流式管中,在流式细胞分析仪上分析细胞的荧光比例与强度。应用流式细胞分选仪器分选出EGFP阳性细胞,接种至12孔板中继续培养。图2示出了流式分选编辑细胞和基因鉴定结果。如图2所示,430bp处的条带为未编辑猫胎儿成纤维细胞的基因条带大小,144bp处的条带为编辑后的猫胎儿成纤维细胞的基因条带大小。
分选出的细胞中,部分细胞用于体细胞核移植,其余细胞提取基因组DNA。
5.测序分析:
利用高保真Taq酶扩增出包含sgRNA所识别位点的KIT基因片段,利用琼脂糖凝胶电泳分离该片段,然后用胶回试剂盒回收片段,将回收的片段克隆到pMD19-T载体中,转化后挑选若干个单菌落,进行测序分析CRISRP/Cas9在切割位点处引起突变的效率。
TA克隆评估基因编辑效率结果如图3所示。由图中可见,在获得的8个PCR克隆中,pX458-KIT-sgRNA1和pX458-KIT-sgRNA2靶位点发生突变的有7个,基因编辑效率为约80%(图3)。
综合上述结果,pX458-KIT-sgRNA1和pX458-KIT-sgRNA2在猫胎儿成纤维细胞中的基因编辑效率较高,可用于后续核移植实验。
6.卵母细胞的体外成熟培养:
采集母猫卵巢,体视镜下用刀片割取卵巢卵泡,并挑选卵丘细胞包裹较多的卵母细胞,用TALP-HEPES培养液清洗后,用基础培养基DMEM,并添加10%FBS(Fetal BovineSerum,牛胎儿血清)、1μg/ml FSH(follicle-stimulating hormone,卵泡刺激素)、1μg/mlLH(Luteinizing Hormone,黄体生成素)、20ng/ml EGF(Epidermal Growth Factor,表皮生长因子),进行体外成熟22-24h。
7.体细胞核移植操作:
先用2%的胰蛋白酶消化上述分选后的基因编辑猫胎儿成纤维细胞,然后将细胞均匀吹散加入DMEM培养液中备用。将培养22-24h成熟猫卵母细胞用玻璃吸管反复吹打,直到完全去除卵丘细胞。
体视镜下挑选含有第一极体的卵母细胞,胞质均匀,形态正常的卵母细胞进行Hochest33342染色。
清洗干净后,用NIKON显微操作仪,在200倍物镜下进行荧光完全去核。去核后卵母细胞,挑选表面光滑,均匀、透明的成纤维细胞注射到卵间隙,形成重构胚。
重构胚在融合液(0.3M甘露醇,0.1mM CaCl
8.胚胎移植:
筛选发情母猫,静脉注射多咪静(0.03ml/kg)进行麻醉。消毒腹部后,在腹中线肚脐下方依次切开皮肤、皮下组织,钝性分离肌肉层,切开腹膜,从腹腔中拿出卵巢和输卵管。用吸管吸取克隆胚胎,从输卵管伞部输入胚胎,最后缝合伤口并消毒,术后对受体猫伤口连续三天碘伏消毒以防感染,根据伤口恢复情况,7天左右拆线。
9.受体母猫孕检以及分娩:
28天B超监测母猫怀孕情况;产前一周,关注阴道是否有红色粘液排出,随时做好分娩准备工作。直至仔猫出生。
10.出生狸花猫的CRISPR/Cas9编辑效率鉴定:
采取出生的狸花猫(Feles maculosa)脐带样本提取基因组DNA进行基因型鉴定,结果如图4所示,野生型狸花猫只有430bp一条鲜明的条带,而编辑猫有430bp和144bp两条鲜明的条带,初步说明狸花猫携带的KIT基因发生了编辑。
对每个个体PCR扩增出KIT基因17号外显子片段,再进行TA克隆测序以确定基因型。结果如图5所示,在KIT基因片段部位,一条等位基因的产生了9bp缺失,而另一条等位基因产生了286bp的缺失,进一步证明狸花猫的KIT基因发生了编辑。图3为细胞水平上的基因鉴定结果,而图5为活体水平上的基因鉴定结果。说明将图3中的编辑细胞核移植至活体成功。
胚胎移植和出生仔猫编辑效率的统计结果如以下表2所示。
表2:胚胎移植和初生狸花猫编辑效率
11.编辑KIT基因17号外显子改变狸花猫的毛色及肤色:
如图6所示,新生仔猫的KIT基因17号外显子被敲除后,影响了色素相关基因的表达,使原本黑灰相间的条纹、形如“虎皮”的狸花猫的毛色变成了浅灰色。图6中,左为基因编辑狸花猫,右为野生型狸花猫。
此外,通过观察可发现,狸花猫爪子部位的皮肤原本是显黑色的(图7,左,野生型),在KIT基因17号外显子被敲除后,该部位的皮肤也变为白色皮肤(图7,右,基因编辑型)。
12.编辑KIT基因17号外显子对毛囊黑色素的影响:
通过黑色素染色观察基因编辑猫的毛囊内的黑色素分布。
选取1cm×1cm左右的野生型狸花猫和基因编辑型狸花猫的皮肤组织,用4%的多聚甲醛于4℃冰箱中固定48h,固定结束后,取出皮肤组织,用PBS冲洗三次,然后浸泡于70%v/v的酒精中,永久保存或进行下一步的实验。
选取毛囊分布较均匀的皮肤样品,用流水冲洗4h,将多聚甲醛清洗干净,然后进行脱水进蜡,程序见表3。
表3:猫皮肤组织脱水程序
程序结束后,将皮肤组织转移到组织包埋机中,用高熔点石蜡进行包埋,包埋时将纵截面朝上。包埋完成后,用石蜡切片机进行切片,切片厚度为5μm。切片结束后,放入65℃烘箱中30min。从烘箱中取出切片,转移到二甲苯溶液中脱蜡10min,重复3遍。使用梯度酒精进行复水:100%v/v乙醇,5min;100%v/v乙醇,5min;90%v/v乙醇,5min;80%v/v乙醇,5min;70%v/v乙醇,5min;50%v/v乙醇,5min;超纯水,5min;超纯水,5min。复水完成后,参照Fontana-Masson黑色素染色试剂盒的说明书进行下一步黑色素染色实验。
如图8所示,切片染色结果表明,野生型狸花猫的毛囊内充满了黑色素,而基因编辑型狸花猫的毛囊内的黑色素含量相对较少。
