一种复合微生物菌在生产2,3-丁二醇中的应用
文献发布时间:2024-01-17 01:23:59
技术领域
本发明属于微生物发酵技术领域,具体涉及一种复合微生物菌在生产2,3-丁二醇中的应用。
背景技术
2,3-丁二醇(2,3-BD),是一种重要的生物基平台化学品,一方面,2,3-丁二醇具有和乙醇相媲美的热值,可应用于航空航天等相关领域,是潜在的重要燃料和燃料添加剂,另一方面,2,3-丁二醇还可以通过脱水、脱氢、酯化等反应合成具有广泛应用的衍生产品,比如2,3-丁二醇可以转化为1,3-丁二烯,随后用作合成橡胶和塑料生产的中间化学品;另外,其脱水生成的甲乙酮(MEK)可用于涂料、橡胶、油墨等行业,因此,2,3-丁二醇在制造印刷油墨、燃料添加剂和食品添加剂等方面具有巨大的潜力。
2,3-丁二醇的合成方法包括化学合成法以及微生物发酵合成法,微生物发酵合成法由于具有原料成本低、污染小等优点,因而成为制备2,3-丁二醇的主要研究方法。
现有的微生物发酵合成2,3-丁二醇的技术中,大多采用克雷伯氏菌这一细菌菌属,主要由于其具有较强的2,3-丁二醇的生产能力,但是,由于克雷伯氏菌为一种条件致病菌,因此,不适于大规模的利用。
除了克雷伯氏菌之外,芽孢杆菌类微生物也是一种较为常用的发酵菌,但是芽孢杆菌属在发酵时会有一部分碳源因为2,3-丁二醇脱氢酶活力不足而积累过多的乙偶姻等代谢副产物,当副产物累积到一定浓度时,菌体生长会受到抑制,导致产物合成速率降低,导致产量下降,因此,单一的芽孢杆菌发酵制备2,3-丁二醇的产量是有限的,如专利CN10851598A中所披露的,采用优选的枯草芽孢杆菌发酵生产2,3-丁二醇,其5L发酵罐的初步放大实验显示,2,3-丁二醇的含量仅为61.7g/L。
因此,有些研究为了进一步提高2,3-丁二醇的产量而采用混合微生物菌进行发酵,所谓混菌发酵是指通过两种或多种微生物的共栖协同作用共同完成发酵过程的一种发酵技术,发酵过程中不同菌种有各自的代谢活动,不同的代谢活动之间具有互补性和互生关系,并且不会互相抑制生长,可以改进单一菌株发酵不足的缺点。
比如专利CN106399400A就提供了一种混菌发酵来提高乙偶姻与2,3-丁二醇的产量的方法,但是该其方法所生产的乙偶姻对于2,3-丁二醇而言本就是一种杂质,其含量是随着2,3-丁二醇含量的升高而升高的,二者的含量本就具有一致性,因此,该方法所生产的2,3-丁二醇的含量因为乙偶姻这一中间产物的产生而受到较大的影响,难以得到较大的提高。
因此,减少乙偶姻等副产物的积累对发酵法生产2,3-丁二醇以及提高2,3-丁二醇的含量具有重要意义。
发明内容
为了解决上述的技术问题,本发明提供了一种复合微生物菌在生产2,3-丁二醇中的应用。
本发明所提供的应用是通过采用特定的复合微生物菌来实现的,所述的复合微生物菌由过表达2,3-丁二醇脱氢酶的枯草芽孢杆菌和地衣芽孢杆菌两种微生物菌组成。
所述枯草芽孢杆菌的分类命名为Bacillus subtilis MW-BS1,该菌株的保藏编号为CCTCC NO:M 2022436,2022年4月20日保藏于中国武汉武汉大学中国典型培养物保藏中心;所述地衣芽孢杆菌分类命名为地衣芽孢杆菌MW-BL2 Bacillus licheniformis MW-BL2,该菌株的保藏编号为CCTCC NO:M 2023474,2023年4月6日保藏于中国武汉武汉大学中国典型培养物保藏中心。
以下为了简便起见,将枯草芽孢杆菌Bacillus subtilis MW-BS1简称为MW-BS1,地衣芽孢杆菌Bacillus licheniformis MW-BL2简称为MW-BL2。
所述的复合微生物菌中,枯草芽孢杆菌与地衣芽孢杆菌的接种体积之比为2~4:1。
优选的,所述的复合微生物菌中,枯草芽孢杆菌与地衣芽孢杆菌的接种体积之比为2:1。
所述的复合微生物菌,其发酵培养基包括:葡萄糖40~100g/L,玉米浆干粉10~20g/L,酵母浸粉5~20g/L,尿素1~9g/L,K
优选的,复合微生物菌的发酵培养基包括:葡萄糖80g/L,玉米浆干粉10g/L,酵母浸粉5g/L,尿素5g/L、K
本发明中利用复合微生物菌来生产2,3-丁二醇的方法,包括以下步骤:
(1)分别制备微生物菌枯草芽孢杆菌与地衣芽孢杆菌;
(2)将(1)中制备好的两个微生物菌种分别进行活化;
(3)复合微生物菌发酵:将(2)中经活化后的微生物菌种制备成种子液,按比例混合制成复合微生物菌,然后接种至含有发酵培养基的容器中进行发酵。
上述的步骤(1)中,微生物菌的制备方法如下:首先,构建双启动子表达载体,并连接2,3-丁二醇脱氢酶的编码基因bdhA,即GeneID:939490,然后将其导入到原始的枯草芽孢杆菌BS1和地衣芽孢杆菌BL1菌株中,以此来过表达2,3-丁二醇脱氢酶,获得能够生产2,3-丁二醇和乙偶姻的基因工程菌株MW-BS1与MW-BL2。
其中,原始的枯草芽孢杆菌BS1和地衣芽孢杆菌BL1菌株均来源于齐鲁工业大学生物工程学部微生物酶技术实验室。
上述的步骤(2)中,复合微生物菌的活化具体操作为:取(1)中制备好的菌株接种于有固体LB培养基的平板中,恒温倒置培养10~15h,分别挑取平板中的单菌落于液体LB培养基中,100~250r/min,恒温摇床培养10~15h。
所述的LB培养基,包括:3~6g/L,胰蛋白胨8~12g/L,NaCl 8~15g/L。
上述的步骤(3)中,先制备复合微生物菌的种子液,然后将种子液按照4~12%的接种量接种至发酵罐中进行发酵。
优选的,步骤(3)中,复合微生物菌的种子液接种量为10%。
步骤(3)中,复合微生物菌的发酵条件为:温度28~40℃,pH为6~7,震荡速度为100~250r/min,通气量为0.5~1.5L/min。
优选的,复合微生物菌的发酵条件为:温度37℃,PH为6.5,震荡速度为200r/min,通气量为1L/min。
优选的,(3)中复合微生物菌发酵时,先将(2)中经活化后的微生物菌按照3~6%的接种量接到液体LB培养基中,35~40℃恒温培养6~10h作为种子液,然后将枯草芽孢杆菌与地衣芽孢杆菌的种子液以2~4:1的体积比混合制备成复合微生物菌,并按照的4~12%接种量将复合微生物菌接种至含有发酵培养基的容器中进行发酵,其中,复合微生物菌的发酵条件为:温度28~40℃,pH为6~7,震荡速度为100~250r/min,通气量为0.5~1.5L/min。
本发明的有益效果在于:本发明提供了一种能够发酵生产2,3-丁二醇的特殊的复合微生物菌,即过表达2,3-丁二醇脱氢酶的枯草芽孢杆菌与地衣芽孢杆菌以2:1的比例混合。
利用本发明所提供的复合微生物菌来发酵生产2,3-丁二醇的过程中,能够较大程度地减少乙偶姻等副产物的积累,使得乙偶姻向2,3-丁二醇转化的酶促反应更为活跃,促进乙偶姻转化为2,3-丁二醇,提高了原料的利用率及2,3-丁二醇的产量,本发明的5L初步放大实验结果显示,2,3-丁二醇的浓度达到98.7g/L,且检测不到副产物乙偶姻的产生。
附图说明
图1为摇瓶培养时微生物菌发酵过程产2,3-BD的能力情况;
图2为摇瓶培养时微生物发酵过程产乙偶姻能力情况;
图3为复合微生物菌的接种比例对2,3-BD产量的影响;
图4为培养基成分的不同对2,3-BD产量的影响情况;
图5为发酵条件对2,3-BD产量的影响情况;
图6为本发明中经改造后制备的复合微生物菌在5L发酵罐中发酵过程各产物的含量变化情况;
图7为未经改造的原始复合微生物菌在5L发酵罐中发酵过程各产物的含量变化情况。
具体实施方式
为了能使本领域技术人员更好的理解本发明,现结合具体实施方式对本发明进行更进一步的阐述。
实施例1
(1)微生物菌的制备:通过构建双启动子表达载体,并连接2,3-丁二醇脱氢酶的编码基因bdhA,即Gene ID:939490,再导入到原始枯草芽孢杆菌BS1和地衣芽孢杆菌BL1菌株中,以此来过表达2,3-丁二醇脱氢酶,获得能够生产2,3-BD的基因工程菌株枯草芽孢杆菌与地衣芽孢杆菌。
其中,原始的枯草芽孢杆菌BS1和地衣芽孢杆菌BL1菌株均来源于齐鲁工业大学生物工程学部微生物酶技术实验室。
(2)微生物菌种活化:分别取(1)中制备好的枯草芽孢杆菌与地衣芽孢杆菌,接种于有固体LB培养基的平板中,恒温倒置培养12h,分别挑取平板中的单菌落于50mL液体LB培养基中,200r/min,恒温摇床培养12h。
(3)复合微生物菌发酵:将(2)中活化好的菌株按照5%的接种量接到50mL液体LB培养基中,200r/min,37℃恒温培养8h作为种子液,然后,将枯草芽孢杆菌与地衣芽孢杆菌的种子液以2:1的接种体积比混合制备成复合微生物菌,并按照10%的总接种量接种到含有发酵培养基的摇瓶中,于37℃恒温培养,震荡速度为200r/min,通气量为1L/min,发酵过程每24h补加30g/L的无菌葡萄糖溶液。
其中,LB培养基的成分为:酵母浸粉5g/L,胰蛋白胨10g/L,NaCl 10g/L。
发酵培养基的成分为:葡萄糖60g/L,玉米浆干粉15g/L,酵母浸粉10g/L,尿素5g/L,K
并且,在发酵过程中,每隔24h取一次样,处理样品,用液相色谱法测定葡萄糖量,用气相色谱法测定2,3-BD和乙偶姻。
采用液相色谱法检测发酵液中葡萄糖含量的具体检测条件如下:色谱柱的温度26℃,流动相为75%乙腈溶液,进样量10μL,分析时间10min,使用分光光度计(UV-2350,Unic)从600nm处的光密度(OD)确定生物质浓度(OD
采用气相色谱法检测产物2,3-BD和乙偶姻的含量,其中,仪器型号为:日本岛津气相色谱仪GC-2030,色谱柱规格:柱长30m,内径0.32mm,液膜厚度0.5μm。
检测条件:柱温80℃,进样器和检测器温度250℃,进样量0.1μL,使用FID检测器。
本实施例摇瓶培养过程中,复合微生物菌发酵过程生产2,3-BD及乙偶姻的能力情况分别见图1-2。
从图1-2中可以看出,采用本发明经改造后的枯草芽孢杆菌与地衣芽孢杆菌所制备出的复合微生物菌进行发酵时,2,3-BD的含量随着发酵时间的延长出现突变式上升,并且在发酵时间96h时达到顶峰,浓度为72.3g/L,最重要的是,该复合微生物菌在发酵的过程中几乎不产生副产物乙偶姻,或者说即便是其中的某一种菌能够产生乙偶姻这一副产物,而另一种菌却能够实现将其良好地代谢掉,这样既可以实现原料的充分利用,提高原料的利用率,而且在一定程度上也提高了2,3-BD的产率与纯度。
实施例2
复合微生物菌的接种比例对2,3-BD产量的影响情况探究。
步骤(1)-(2)的操作均同实施例1。
步骤(3),将(2)中活化好的菌株按照5%的接种量接到50mL液体LB培养基中,于震荡速度200r/min,37℃下恒温培养8h作为种子液,再将种子液按照如下的比例混合制备成复合微生物菌,枯草芽孢杆菌与地衣芽孢杆菌种子液的接种体积之比分别为4:1、3:1、2:1、1:1、1:2、1:3、1:4,接着将复合微生物菌以10%的接种量接到含有200mL发酵培养基的500mL的摇瓶中,在震荡速率为200r/min,37℃的条件下恒温培养,发酵过程每24h补加30g/L的无菌葡萄糖溶液。
在发酵过程中,每隔24h取一次样,处理样品,采用液相色谱法测定葡萄糖的含量,采用气相色谱法测定2,3-BD和乙偶姻的含量,检测方法及条件同实施例1。
不同接种比例的复合微生物菌发酵产生2,3-BD的含量情况见下表1及附图3。
表1不同接种比例下2,3-BD的浓度
结果显示,当枯草芽孢杆菌与地衣芽孢杆菌的接种体积之比为2:1时,产物2,3-BD的浓度达到最高,为90.2g/L。
从图表的数据中还可以看出,在几种不同的接种比例中,以枯草芽孢杆菌为主的4:1比例的发酵过程中能够产生78.6g/L的2,3-BD,随着枯草芽孢杆菌占比的降低,地衣芽孢杆菌比例的上升,复合微生物菌发酵体系呈现出2,3-BD产量上升的趋势,当接种比例为2:1时,2,3-BD浓度到达最高,为90.2g/L,此时枯草芽孢杆菌仍占主导优势,随后,继续增加地衣芽孢杆菌的接种比例,并不能继续增加2,3-BD的浓度,反而呈现出下降的趋势。
产生以上现象的主要原因,可能是:以合成2,3-BD为主的枯草芽孢杆菌为复合微生物菌的主要发酵菌株,以合成乙偶姻为主的地衣芽孢杆菌为复合微生物菌的辅助发酵菌株,两者在代谢过程中可以起到互补互助的作用,能够补充2,3-BD合成途径中的中间代谢物,优化发酵体系中酶系反应,进而在一定程度上增加2,3-BD的产量。
实施例3
发酵培养基成分的不同对2,3-BD产量的影响情况探究。
步骤(1)-(2)均同实施例1,仅改变步骤(3)中的发酵培养基的成分,其中,葡萄糖的浓度梯度为:20g/L、40g/L、60g/L、80g/L、100g/L,玉米浆干粉的浓度梯度为:0g/L、5g/L、10g/L、15g/L、20g/L,酵母粉的浓度梯度为:0g/L、5g/L、10g/L、15g/L、20g/L,尿素的浓度梯度为:1g/L、3g/L、5g/L、7g/L、9g/L,K
每隔24h取一次样,处理样品,采用液相色谱法测定葡萄糖的含量,采用气相色谱法测定2,3-BD的含量。
发酵培养基的不同成分下2,3-BD浓度情况见表2及附图4。
附图4中,a图为葡萄糖含量对2,3-BD产量的影响图,b图为玉米浆含量对2,3-BD产量的影响图,c图为酵母浸粉含量对2,3-BD产量的影响图,d图为尿素含量对2,3-BD产量的影响图,e图为K
表2不同发酵培养基条件下的产物2,3-BD浓度情况
复合微生物菌中的各菌种由于各自的生活习性存在着或多或少的差异,因而提供一种能够同时适应于两种微生物菌繁殖发酵的发酵用培养基至关重要,这直接影响着复合微生物菌中各菌种的作用效果,也直接关系着整个实验的成败。
以上的研究结果显示:较高的初始葡萄糖浓度可以有效地增加产物2,3-BD的产量,主要原因在于,葡萄糖作为一种微生物菌能够直接利用的小分子供能物质,其初始的含量相对较高时,有利于提供微生物菌生长繁殖所需要的碳源,使得菌种在短时间内迅速繁殖与发酵,
因此,葡萄糖的浓度为80g/L,此时,2,3-丁二醇的产量最高,为84g/L,但是在此基础上继续增大葡萄糖的浓度,2,3-BD的含量非但得不到提高,反而还可能会因为“葡萄糖效应”而导致产量降低,因此发酵培养基的葡萄糖浓度定为80g/L。
玉米浆干粉作为一种综合性营养物质,可为微生物提供多种营养成分,在上述的浓度梯度试验中,10g/L的玉米浆干粉对于混菌发酵有更好的效果,此浓度下,2,3-丁二醇最高产量为85g/L。
酵母提取物可为细菌提供优质的氮源,是微生物代谢过程不可缺少的营养成分,本研究证明,5g/L的酵母提取物是最佳的浓度,此浓度下,2,3-丁二醇最高产量为78.9g/L。
此外,尿素、K
因此,最佳发酵培养基的配方为:酵母浸粉5g/L,玉米浆干粉10g/L,葡萄糖80g/L,尿素5g/L,K
实施例4
不同的发酵条件对复合微生物菌发酵生成2,3-BD含量的影响。
步骤(1)-(2)均同实施例1,仅改变步骤(3)中复合微生物菌的发酵条件,其中,发酵条件中,发酵温度为28℃、31℃、34℃、37℃、40℃,发酵的pH分别为6、6.5、7、7.5、8,总接种量分别为4%、6%、8%、10%、12%,震荡速度分别为100r/min、150r/min、200r/min、250r/min、300r/min,其余操作及条件均同实施例1。
每隔24h取一次样,处理样品,采用液相色谱法测定葡萄糖的含量,采用气相色谱法测定2,3-丁二醇的含量,结果见表3及图5中a-d。
附图5中,图a为发酵温度的影响情况图,图b为发酵的pH条件影响情况图,图c为复合微生物菌的总接种量的影响情况图,图d为震荡速率的影响情况图。
表3发酵条件下2,3-BD的产量情况
以上的实验结果显示:影响复合微生物菌发酵效果的最为显著的条件是发酵温度,因为复合微生物菌只有在一定的温度条件下才能够更好的繁殖与发酵,且与微生物发酵作用相关的酶也只能在特定的温度条件下才能更好地起作用,当发酵温度为37℃时,2,3-BD的产量最高,其浓度高达87g/L,发酵的温度较低或较高时,均会影响微生物菌的细胞生长繁殖和代谢速率,继而导致产物的减少。
另外,弱酸性的环境和较低的震荡速度有利于2,3-BD的合成,当pH为6.5,震荡速率为150r/min时,2,3-丁二醇最高产量为85g/L,这可能与合成2,3-丁二醇途径中的关键酶有关,较低的震荡速度意味着更低的溶解氧,说明2,3-丁二醇的合成并不需要过多的氧气参与。
此外,从结果中可以看出,复合微生物菌的培养总接种量虽然对前期的细胞生长有一定程度的影响,但在产物水平来看并没有显著影响。
综上所述,最佳发酵条件为:发酵温度37℃,pH为6.5,总接种量为10%,震荡速度为150r/min。
实施例5
步骤(1)-(2)均同实施例1,改变步骤(3)中的发酵培养基以及发酵条件,均以最佳条件进行实验。
其中步骤(3)中,发酵培养基的配方为:葡萄糖80g/L,玉米浆干粉10g/L,酵母浸粉5g/L,尿素5g/L,K
发酵条件为:发酵温度37℃,pH为6.5,总接种量为10%,震荡速度为150r/min,通气量为1L/min。
其余均同实施例1。
每隔24h取一次样,处理样品,采用液相色谱法测定葡萄糖的含量,采用气相色谱法测定2,3-丁二醇的含量。
最终,本实施例所获得的2,3-丁二醇的浓度为:90.2g/L。
实施例6
5L发酵罐的初次放大培养
以实施例1中制备好的枯草芽孢杆菌与地衣芽孢杆菌种子液按照接种体积2:1的比例混合后作为复合微生物菌,进行5L的上罐发酵培养来制备2,3-丁二醇。
步骤(1)-(2)的操作均同实施例1,仅改变步骤(3)中的发酵培养基成分及发酵条件。本实施例的发酵培养基成分为:葡萄糖80g/L,玉米浆干粉10g/L,酵母浸粉5g/L,尿素5g/L,K
发酵条件为:发酵温度37℃,pH为6.5,总接种量为10%,震荡速度为150r/min,通气量为1L/min。
每隔24h取一次样,处理样品,采用液相色谱法测定葡萄糖的含量,采用气相色谱法测定2,3-丁二醇、乙偶姻的含量。
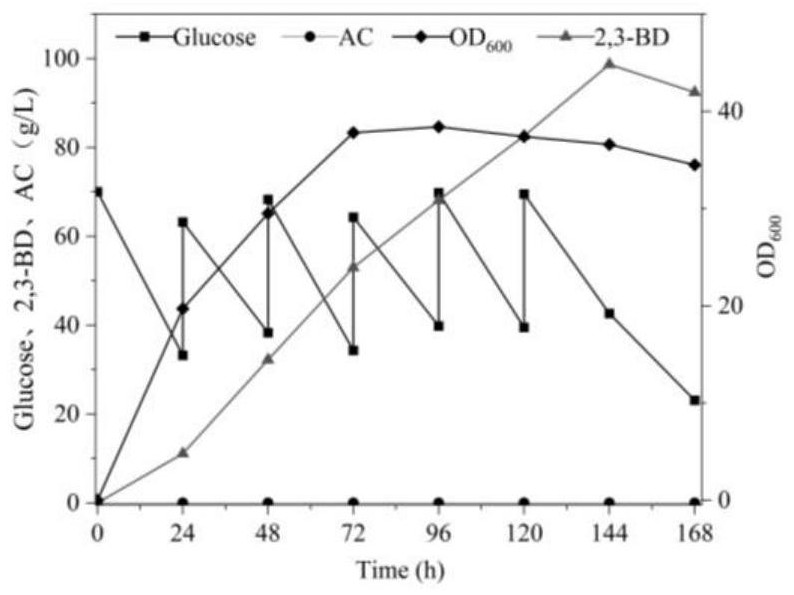
发酵过程中的2,3-丁二醇的含量、乙偶姻含量及葡萄糖的利用率情况见表4及图6。
表4发酵过程中各物质的产量及利用情况
检测结果显示:当发酵时间为144h时,2,3-丁二醇的浓度到达最大值,为98.7g/L,并且检测不到副产物乙偶姻的产生。
从图6的折线图中可以看出,枯草芽孢杆菌与地衣芽孢杆菌混合培养时,发酵体系的总菌体密度相比单菌发酵时有一定的提升,证明了混菌发酵对两者有促进生长的作用,对于产物2,3-丁二醇,从发酵至24h后能保持一种快速上升的趋势,发酵至144h时,2,3-丁二醇的浓度到达最大值,为98.7g/L,并且检测不到副产物乙偶姻的产生,相较于实施例5中的摇瓶发酵产量提升了9.4%。
对比例1
将实施例1中的复合微生物菌替换为单一的枯草芽孢杆菌(Bacillus subtilisMW-BS1),然后按照实施例1中的方法及条件进行活化并发酵制备2,3-BD。
每隔24h取一次样,处理样品,采用液相色谱法测定葡萄糖的含量,采用气相色谱法测定2,3-BD及副产物乙偶姻的含量。
发酵过程中产生的2,3-BD及乙偶姻的含量情况分别如图1-2所示,图中的结果显示:仅单一的菌种枯草芽孢杆菌发酵至72h时,2,3-BD浓度达55.5g/L,发酵120h时副产物乙偶姻的浓度达25.9g/L。
对比例2
将实施例1中的复合微生物菌替换为单一的地衣芽孢杆菌(Bacilluslicheniformis MW-BL2),然后按照实施例1中的方法及条件进行活化并发酵制备2,3-BD。
每隔24h取一次样,处理样品,采用液相色谱法测定葡萄糖的含量,采用气相色谱法测定2,3-丁二醇及乙偶姻的含量。
发酵过程中产生的2,3-BD及乙偶姻的含量情况分别如图1-2所示,图中的显示:单一的菌株地衣芽孢杆菌则更偏向于产生乙偶姻,如在发酵至96h时乙偶姻的浓度到达42.5g/L,且该菌在发酵过程中产生的2,3-BD的含量并不高,即便是随着发酵时间的延长,2,3-BD的产量也保持在较低的水平。
对比例3
采用未经改造的原始的枯草芽孢杆菌(BS1)及地衣芽孢杆菌(BL1)作为复合微生物菌的发酵菌株,按照实施例1的方法及步骤进行活化、发酵生产2,3-丁二醇。
发酵生成的2,3-丁二醇的含量及发酵过程中的葡萄糖利用情况、乙偶姻的生成情况见表5及图7。
表5发酵过程中各物质的产量及利用情况
从图7中可以看出:用未经改造的原始枯草芽孢杆菌(BS1)及地衣芽孢杆菌(BL1)作为复合微生物菌进行发酵时,2,3-丁二醇的浓度最高仅为54.6g/L,并且,在发酵过程同样会有副产物乙偶姻的生成,且乙偶姻的浓度最高时达到32g/L,其前体物质乙偶姻的过多积累,不能得到有效转化进一步限制了2,3-BD产量的提升。
因此,即便是采用混合菌种发酵能够起到一定的增大产物产量的效果,但是原始芽孢杆菌属的菌种在发酵时由于无法代谢产生的乙偶姻这一中间产物,因此其复合菌发酵对于2,3-丁二醇含量的提升是有限的。
此外,从本发明的实施例1及对比例1-2的比较中也可以看出,本发明通过对原始的枯草芽孢杆菌BS1和地衣芽孢杆菌BL1进行改造,获得的基因工程菌株枯草芽孢杆菌与地衣芽孢杆菌,虽然单一的菌株通过发酵能够产生2,3-BD与乙偶姻,但是将两种菌混合之后所获得的复合微生物菌在发酵时产生的总的乙偶姻的量几乎为零,完全可以说明,复合菌株能够实现对乙偶姻的良好代谢,最终达到提高产物2,3-BD含量的效果。
