自适应的血管分割方法及系统
文献发布时间:2024-01-17 01:24:51
技术领域
本发明涉及医疗图像处理领域技术领域,尤其涉及一种自适应的血管分割方法及系统。
背景技术
心血管相关疾病患病率逐年上升,是世界公认的最常见死因之一,其中冠心病的致死率极高,而诱发冠心病的主要因素是冠状动脉狭窄,它会严重影响心脏供血,严重威胁生命。目前冠心病诊断的金标准是数字减影血管造影DSA (Digital SubstractionAngiography)。而在进行造影图像分析之前,血管分割都是必不可少的重要步骤。目前已有多篇文献和专利在此方面进行过深入的研究。
在进行诸如造影融合等医学造影图像处理之前,通常需要医生在诸如冠脉造影影像上手动标记一组或多组远心端和近心端,以表明医生对哪条血管段感兴趣。然而现有技术中分割出的血管段精度较差,伪影较多,噪声较大,对于不同质量的造影图像(受不同品牌的造影设备,不同剂量的X射线,不同的病人体质,不同的拍摄体位,等诸多因素影响)鲁棒性较差。
例如:申请号为202110550651.8,名称为基于U-Net的血管图像分割方法、装置和设备的专利文献是根据事先分割好的血管分割数据集进行多尺度特征提取和融合,最终实现对血管造影图像的分割识别。
现有的分割方法都是基于医师在诸如冠脉造影影像上手动标记进行特征提取和分析的,一旦出现标记不清楚不准确或标记位置不当,会严重影响后续的分割结果,而且此类依靠人工分割的算法分割出的血管段精度较差,伪影较多,噪声较大,无法对医师标注情况进行判断。
因此,需要提供一种自适应的血管分割方法及系统,摒除对人工标识图像的过度依赖,能够适用不同质量造影图像的血管分割处理。
发明内容
因此,本发明的目的在于提供一种自适应的血管分割方法及系统,充分考虑了医生输入的近心端和远心端,依托此信息以及不同质量/品质的DSA造影图像自适应地调整相关参数,将医生最感兴趣的血管段充分分割出来。
为了实现上述目的,本发明的一种自适应的血管分割方法,包括以下步骤:
S1、获取血管造影图像和标注的近心端和远心端,并对血管造影图像进行滤波,对图像上的像素点/像素群/结构区进行评估,输出血管响应图;
S2、将血管响应图进行首次二值化循环检测,当循环生成的二值图中,近心端和远心端同在一个连通域内时,判断为循环检测成功,输出血管分割信息;
S3、当S2中循环检测不成功时,对S2中生成的二值图进行形态学运算后,重复S2中循环检测过程,若循环检测成功,输出血管分割信息;
S4、当S3中循环检测不成功时,对获取的血管造影图像进行造影增强,按照上述S2-S3的过程进行二次循环检测,若检测成功输出血管分割信息,若检测提示用户重新选取近心端或远心端。
进一步优选的,在S2中进行首次二值化循环检测时,包括以下过程,将血管响应图进行二值化,在二值化时,按照由高到低逐步降低二值化阈值或由低到高逐步提升二值化阈值的过程逐步改变二值化阈值,当按照当前二值化阈值生成的二值化图中,近心端和远心端同在一个连通域内时,判断为循环检测成功。
进一步优选的,还包括对标注的近心端和远心端进行校正,所述校正包括如下过程:
以近心端和远心端为中心,建立搜索框,在二值图上计算搜索框内各点距离近心端或远心端的欧式距离,取欧式距离最小的点作为校正结果。
进一步优选的,在S2中进行首次二值化循环检测和S4中造影增强后进行二次循环检测时还包括按照如下方式进行自适应调整:
判断当前血管造影图是否为造影序列的首帧,若是,则按照预设的二值化初始阈值、阈值衰减步长、二值化最小阈值,进行首次二值化循环检测;若不是,则按照如下方式调整参数:
统计当前帧的前M帧中使用造影增强帧的数量P1,则未使用造影增强帧的数量为P2=M-P1;
若P1>P2,则对M帧中使用了造影增强的帧的二值化阈值进行统计,并计算二值化阈值的平均值或中位值M1,此时,跳过首次二值化循环检测,直接进行造影增强处理,将增强图像的二值化初始阈值设置为M1;
若P1≤P2,则对M帧中未使用造影增强的帧输出的二值化阈值进行统计,并计算二值化阈值的平均值或中位值M2;再对这M帧中使用了造影增强的帧输出的二值化阈值进行统计,并计算二值化阈值的平均值或中位值M3;将首次二值化循环检测的二值化初始阈值设置为M2,将增强图像的二值化初始阈值设置为M3。
进一步优选的,在S4中,所述对获取的血管造影图像进行造影增强包括,对原造影帧图像进行以下任意一种或多种操作:
直方图均衡化、自适应直方图均衡化、限制对比度自适应直方图均衡化。
本发明还提供一种自适应的血管分割系统,用于实施上述自适应的血管分割方法,包括图像预处理模块、首次循环检测模块、造影增强模块、二次循环检测模块;
所述图像预处理模块用于获取血管造影图像和标注的近心端和远心端,并对血管造影图像进行滤波,对图像上的像素点/像素群/结构区进行评估,输出血管响应图;
首次循环检测模块,用于将血管响应图进行首次二值化循环检测,当循环生成的二值图中,近心端和远心端同在一个连通域内时,判断为循环检测成功,输出血管分割信息;首次二值化循环检测不成功时,对生成的二值图进行形态学运算;重复首次二值化循环检测过程,若循环检测成功,输出血管分割信息;
造影增强模块,对获取的血管造影图像进行造影增强;
二次循环检测模块,对造影增强后的图像,按照首次循环检测模块的循环检测过程进行二次循环检测,若检测成功输出血管分割信息,若检测提示用户重新选取近心端或远心端。
进一步优选的,所述首次循环检测模块进行首次二值化循环检测时,包括以下过程,将血管响应图进行二值化,在二值化时,按照由高到低逐步降低二值化阈值或由低到高逐步提升二值化阈值的过程逐步改变二值化阈值,当按照当前二值化阈值生成的二值化图中,近心端和远心端同在一个连通域内时,判断为循环检测成功。
进一步优选的,还包括校正模块,所述校正模块用于对标注的近心端和远心端进行校正,包括如下过程:
以近心端和远心端为中心,建立搜索框,在二值图上计算搜索框内各点距离近心端或远心端的欧式距离,取欧式距离最小的点作为校正结果。
进一步优选的,所述造影增强模块,对原造影帧图像进行以下任意一种或多种操作:
直方图均衡化、自适应直方图均衡化、限制对比度自适应直方图均衡化。
本申请还提供一种计算机存储介质,所述计算机存储介质上存储计算机程序,所述计算机程序被执行时,实现如上所述的自适应的血管分割方法。
本申请公开的自适应的血管分割方法及系统,相比于现有技术至少具有以下优点:
1、根据本申请的自适应血管分割方法,近心端、远心端所确立的感兴趣血管段被完整分割出来,且确保该血管段是连通的。
2、即使医生因各种原因所标记的近心端或远心端稍稍偏离血管段,该分割算法也可以校正偏离的近心端或远心端,且感兴趣血管段仍可以被正常分割出来。
3、可以输出血管分割的相关参数,为造影质量相似的其他造影帧提供血管分割参考,增加算法整体运行效率,应用于包括但不限于造影融合、造影血管追踪等技术需求。
附图说明
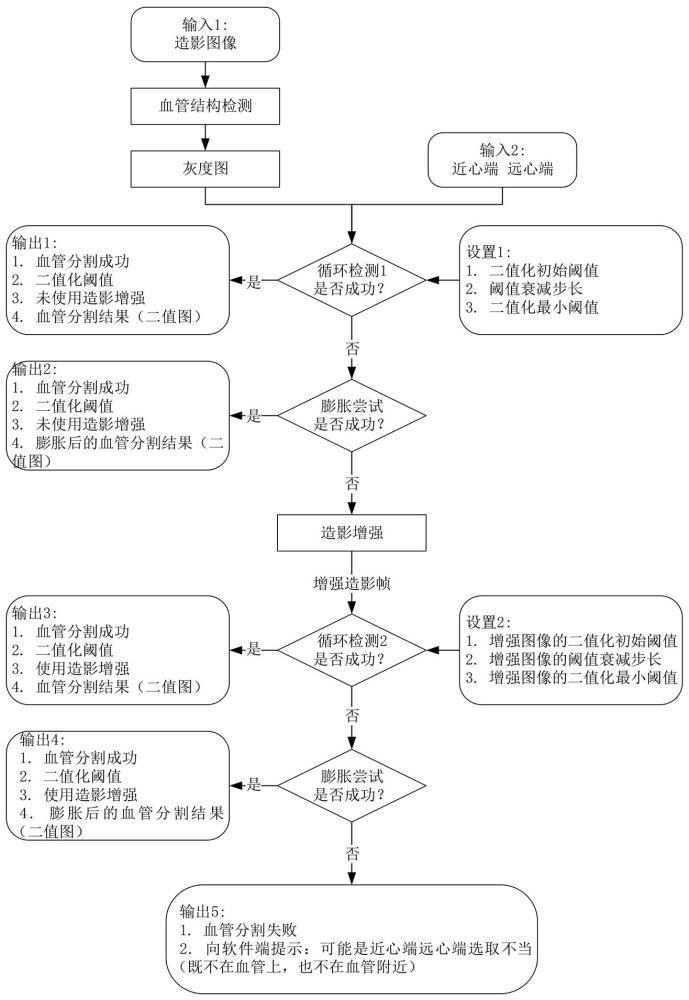
图1为本发明自适应血管分割方法的流程图。
图2为现有技术中血管响应图的生成示意图。
图3为血管结构检测模块的输入示例图。
图4为血管结构检测模块的输出示例图。
图5为对近心端和远心端校正前后对比图。
图6为血管分割参数学习方法的示意图。
图7为原血管造影图像。
图8为传统血管分割算法结果。
图9为自适应血管分割算法的分割结果图。
图10为本发明提出的自适应调整参数流程图。
具体实施方式
以下通过附图和具体实施方式对本发明作进一步的详细说明。
如图1所示,本发明一方面实施例提供的一种自适应的血管分割方法,包括以下步骤:
S1、获取血管造影图像和标注的近心端和远心端,并对血管造影图像进行滤波,对图像上的像素点/像素群/结构区进行评估,输出血管响应图;
S2、将血管响应图进行首次二值化循环检测,当循环生成的二值图中,近心端和远心端同在一个连通域内时,判断为循环检测成功,输出血管分割信息;
S3、当S2中循环检测不成功时,对S2中生成的二值图进行形态学运算后,重复S2中循环检测过程,若循环检测成功,输出血管分割信息;
S4、当S3中循环检测不成功时,对获取的血管造影图像进行造影增强,按照上述S2-S3的过程进行二次循环检测,若检测成功输出血管分割信息,若检测失败则提示用户重新选取近心端或远心端。
需要说明的是,输入的造影帧进入血管结构检测时,先进行预处理,再使用包括但不限于多尺度Hessian矩阵、Frangipani算法等技术对血管造影图像进行滤波处理,为的是对图像上的像素点/像素群/结构区进行评估,其在多大程度上是属于血管段的,并使用相应的血管响应函数/血管增强函数来计算并输出结果。图2所示的是一种通过图像上点的梯度最大最小特征值的差异来分辨该点是属于血管段上的点还是一个孤立点的方法。此模块最终会输出一个尺寸和输入造影帧相同的灰度图,称为血管响应图,来表征图像上各个位置/区域在多大程度上属于血管段,如图3和图4所示,图3为血管结构检测模块的输入造影帧,图4为该模块的输出结果。
在S2中进行首次二值化循环检测时,包括以下过程,将血管响应图进行二值化,在二值化时,按照由高到低逐步降低二值化阈值或由低到高逐步提升二值化阈值的过程逐步改变二值化阈值,当按照当前二值化阈值生成的二值化图中,近心端和远心端同在一个连通域内时,判断为循环检测成功。
如果满足上述判断条件,则视为循环检测1成功,算法进入到输出1,此时可以向外部输出包括但不限于以下信息:
-此次血管分割成功
-此次分割的二值化阈值
-此次血管分割未使用造影增强方法
-此次血管分割的结果(如一个二值图)
如果不满足上述判断条件,则视为循环检测1不成功,算法进入到下一个步骤形态运算,即膨胀尝试模块。
此外,需要说明的是,对近心端和远心端的校正是必不可少的,因为不能排除医生在标记近心端或远心端时稍稍偏离了目标血管段。实现该校正功能的方法有很多,比如,如图5所示,以近心端和远心端为中心,建立搜索框,在二值图上搜索距离近心端或远心端最近的点,以此进行校正。具体的,近心端或远心端的行列坐标为(i,j),搜索框的半径为T,则遍历二值图像,获取行坐标介于i-T和i+T之间且列坐标介于j-T和j+T之间的点(不包含行列坐标为(i,j)的点)。并计算这些点到(i,j)的欧式距离,取距离最小的点作为校正结果。
如图10所示,进一步优选的,在S2中进行首次二值化循环检测和S4中造影增强后进行二次循环检测时,相关参数可以按照如下方式进行设置或自动调整:
如果当前帧是造影序列的首帧(即没有其他可参考的帧),根据经验设置以下参数,
① 二值化初始阈值:一般尽可能设置的比较大,比如255;
② 阈值衰减步长:根据算法对速度和精度的需求进行设置,需要算法速度较快则调大该步长,需要算法精度较高则调小该步长,一般设置为5;
③ 二值化最小阈值:一般尽可能设置较小,但过小会浪费算力,一般设置为127;
如果当前帧不是造影帧序列的首帧(即在此帧之前存在若干已经被自适应分割算法处理过的帧作为参考帧),可按照如下方式调整设置参数,如图7所示:
① 统计当前帧之前的m帧(m一般取5)中最终使用了造影增强的帧的数量p1和最终未使用造影增强的帧的数量p2;
② 如果p1>p2,则对这m帧中使用了造影增强的帧输出的二值化阈值进行统计,并计算二值化阈值的平均值或中位值M1。此时,对当前帧进行自适应血管分割算法处理时,可跳过“首次二值化循环检测”,直接进行造影增强处理,且增强图像的二值化初始阈值设置为M1;
③ 如果 p1≤p2,则对这m帧中未使用造影增强的帧输出的二值化阈值进行统计,并计算二值化阈值的平均值或中位值M2;此外再对这m帧中使用了造影增强的帧输出的二值化阈值进行统计,并计算二值化阈值的平均值或中位值M3。此时,对当前帧进行自适应血管分割算法处理时,“首次二值化循环检测”的二值化初始阈值设置为M2,增强图像的二值化初始阈值设置为M3。
此外,在膨胀尝试模块内,输入的是由血管响应图生成的二值图(使用一个较大的二值化阈值),并对其进行一次或多次形态学膨胀或闭操作等类似运算,并检测此时是否满足上述判断条件:即“近心端(或对近心端的校正位置)和远心端(或对远心端的校正位置)必须同在一个连通域内”。
进行该步骤的原因是,有些病例的冠脉或血管上存在阻塞或狭窄,导致该血管轻微断开,需要将其“重新接通”后再分割出所需的连续的血管段。
如果进行形态学膨胀/闭操作运算后,上述判断条件得以满足,则视为膨胀尝试成功,算法进入到输出2,此时可以向外部输出包括但不限于以下信息:
-此次血管分割成功
-此次分割的二值化阈值
-此次血管分割未使用造影增强方法
-此次血管分割的结果(如一个二值图)
如果不满足上述判断条件,则视为膨胀尝试不成功,算法进入到下一个步骤,即造影增强模块。
在造影增强模块内,对原造影帧图像进行造影增强,以增加血管造影区和背景区的对比度,可使用包括但不限于直方图均衡化(Histogram Equalization)、自适应直方图均衡化(AHE)、限制对比度自适应直方图均衡化(CLAHE)等本专业领域常用的算法。
需要指出的是,不在一开始使用该模块的原因是,几乎所有的造影增强算法都会不同程度地放大背景上肋骨隔膜等带来的干扰伪影。
对于已经进行了造影增强的造影图像(也称为增强造影帧),对其仍然进行类似于上述步骤的处理,即对已经进行了造影增强的造影图像再次进行循环检测和膨胀尝试。此外,二次循环检测2模块和首次循环检测1模块相比,其在设置2中设置的二值化阈值的初始阈值、衰减步长、以及二值化最小(或最大)阈值可以根据需求设置为不同的值。
如果最终可以找到满足判断条件(即近心端(或对近心端的校正位置)和远心端(或对远心端的校正位置)必须同在一个连通域内)的二值化阈值,则视为血管分割成功,此时可以向外部输出包括但不限于以下信息:
-此次血管分割成功
-此次分割的二值化阈值
-此次血管分割使用了造影增强方法
-此次血管分割的结果(如一个二值图)
如果不满足上述判断条件,则视为血管分割失败,此时算法可以向外部输出/提示包括但不限于以下信息:
-此次血管分割失败
-请检查近心端或远心端是否选取不当
本发明可以根据需求,调整算法计算效率,使得算法可以适用于不同的应用场景。如下表1所示:
表一:参数调整与图像效果对照表
自适应血管分割算法在血管追踪方面的应用(血管分割参数学习方法)。
在诸如造影融合、血管追踪等医学技术需求方面,常常需要对连续多帧的造影图像进行处理。由于这些造影图像的质量是相似的(比如患者体位相同、造影设备相同等因素),因此可以基于如下理由在对第n帧造影帧进行血管分割时,考虑使用前m帧的血管分割参数(二值化阈值的大小以及是否使用造影增强等信息)进行更高效的血管分割处理。
1. 连续拍摄的造影帧其造影质量相似
2. 连续拍摄的造影帧,相近的多帧(m帧)上其血管内造影剂浓度接近
如图6所示,对连续拍摄的造影帧序列,在分割第n帧造影图像的血管网时,可以考虑使用其前5帧的血管分割参数(此时m取5,实际上可以取不多于全部造影帧数的任意值)进行综合计算,为第n帧的血管分割算法给出以下参数设置参考:
1. 是否要直接对原造影帧进行造影增强处理
2. 二值化初始阈值的大小
如图7-9所示,通过此种血管分割参数学习方法,可以为造影帧序列的后续造影帧提供更为合理的分割参数建议,以加快最佳二值化阈值的收敛速度,提高算法效率。
本发明还提供一种自适应的血管分割系统,用于实施上述自适应的血管分割方法,包括图像预处理模块、首次循环检测模块、造影增强模块、二次循环检测模块;
所述图像预处理模块用于获取血管造影图像和标注的近心端和远心端,并对血管造影图像进行滤波,对图像上的像素点/像素群/结构区进行评估,输出血管响应图;
首次循环检测模块,用于将血管响应图进行首次二值化循环检测,当循环生成的二值图中,近心端和远心端同在一个连通域内时,判断为循环检测成功,输出血管分割信息;首次二值化循环检测不成功时,对生成的二值图进行形态学运算;重复首次二值化循环检测过程,若循环检测成功,输出血管分割信息;
造影增强模块,对获取的血管造影图像进行造影增强;
二次循环检测模块,对造影增强后的图像,按照首次循环检测模块的循环检测过程进行二次循环检测,若检测成功输出血管分割信息,若检测失败则提示用户重新选取近心端或远心端。
进一步优选的,所述首次循环检测模块进行首次二值化循环检测时,包括以下过程,将血管响应图进行二值化,在二值化时,按照由高到低逐步降低二值化阈值或由低到高逐步提升二值化阈值的过程逐步改变二值化阈值,当按照当前二值化阈值生成的二值化图中,近心端和远心端同在一个连通域内时,判断为循环检测成功。
进一步优选的,还包括校正模块,所述校正模块用于对标注的近心端和远心端进行校正,包括如下过程:
以近心端和远心端为中心,建立搜索框,在二值图上计算搜索框内各点距离近心端或远心端的欧式距离,取欧式距离最小的点作为校正结果(具体过程参见上述方法实施例)。
进一步优选的,所述造影增强模块,对原造影帧图像进行以下任意一种或多种操作:
直方图均衡化、自适应直方图均衡化、限制对比度自适应直方图均衡化。
本申请还提供一种计算机存储介质,所述计算机存储介质上存储计算机程序,所述计算机程序被执行时,实现如上所述的自适应的血管分割方法。
显然,上述实施例仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
