制备D-丙氨酸烷基酯的方法、D-丙氨酸烷基酯、其衍生物和包含其的药物或农产品
文献发布时间:2024-04-18 19:44:28
技术领域
本申请要求于2021年06月29日向韩国知识产权局提交的韩国专利申请No.10-2021-0084514和No.10-2021-0084517的优先权和权益,这两项专利申请的全部内容通过引用并入本说明书中。
本说明书涉及一种制备D-丙氨酸烷基酯的方法、D-丙氨酸烷基酯、D-丙氨酸烷基酯衍生物和包含其的药物或农产品。
背景技术
N-(2,6-二甲基苯基)-D-丙氨酸甲酯作为用于制备如甲霜灵-M、苯霜灵-M和呋霜灵-M的作物保护剂所需要的合成中间体具有重要的商业价值。
作为合成N-(2,6-二甲基苯基)-D-丙氨酸甲酯的常规方法,已知的是使用(s)-2-(甲磺酰氧基)丙酸甲酯或(s)-2-(对甲苯磺酰氧基)丙酸甲酯和有机或无机碱,以及2,6-二甲胺。在这种情况下,由于过度反应而产生二取代杂质,产品的商业价值劣化,使得难以通过结晶或重结晶的常规纯化方法来去除杂质。
因此,设计一种能够降低由于过度反应产生的二取代杂质的含量的具体方法是一个亟待解决的重要问题。
发明内容
技术问题
本说明书提供了一种制备D-丙氨酸烷基酯的方法、D-丙氨酸烷基酯、D-丙氨酸烷基酯衍生物和包含其的药物或农产品。
技术方案
本说明书的一个示例性实施方案提供了一种制备D-丙氨酸烷基酯的方法,该方法包括:通过使下面化学式1的化合物与下面化学式2的化合物反应来合成下面化学式3的化合物;和
在1托至60托的压力和60℃至200℃的温度下蒸馏包含化学式3的化合物的组合物。
[化学式1]
[化学式2]
[化学式3]
在化学式1至化学式3中,
R1为甲基或被甲基取代的芳基,
R2和R3彼此相同或不同,并且各自独立地为氢;氘;或甲基,
R4为甲基。
本说明书的另一示例性实施方案提供了一种制备D-丙氨酸烷基酯衍生物的方法,该方法包括:通过使下面化学式1的化合物与下面化学式2的化合物反应来合成下面化学式3的化合物;
在1托至60托的压力和60℃至200℃的温度下蒸馏包含化学式3的化合物的组合物;和
通过向蒸馏的组合物中加入下面化学式5的化合物来合成下面化学式6的化合物。
[化学式1]
[化学式2]
[化学式3]
[化学式5]
[化学式6]
在化学式1至化学式3、化学式5和化学式6中,
R1为甲基或被甲基取代的芳基,
R2和R3彼此相同或不同,并且各自独立地为氢;氘;或甲基,
R4为甲基,
R5为被甲氧基取代的亚甲基;被苯基取代的亚甲基;或呋喃基。
本说明书的另一示例性实施方案提供了一种组合物,包含下面化学式3的化合物和下面化学式4的化合物,其中,基于所述组合物的总GC面积,下面化学式4的化合物的含量为0.1面积%以下。
[化学式3]
[化学式4]
在化学式3和化学式4中,
R2和R3彼此相同或不同,并且各自独立地为氢;氘;或甲基,
R4为甲基。
本说明书的又一示例性实施方案提供了一种D-丙氨酸烷基酯衍生物,所述D-丙氨酸烷基酯衍生物通过使化学式3的化合物与下面化学式5的化合物在上述组合物中反应来制备。
[化学式5]
在化学式5中,
R5是被甲氧基取代的亚甲基;被苯基取代的亚甲基;或呋喃基。
本说明书的再一示例性实施方案提供了一种包含上述D-丙氨酸烷基酯衍生物的药物或农产品。
有益效果
根据本说明书的一个示例性实施方案的制备方法可以制备一种D-丙氨酸烷基酯,该D-丙氨酸烷基酯的由于过度反应产生的二取代杂质的含量低。
根据本说明书的一个示例性实施方案的制备方法可以制备高纯度D-丙氨酸烷基酯。
根据本说明书的一个示例性实施方案的制备方法可以使得能够用肉眼观察来确认高纯度D-丙氨酸烷基酯。
附图说明
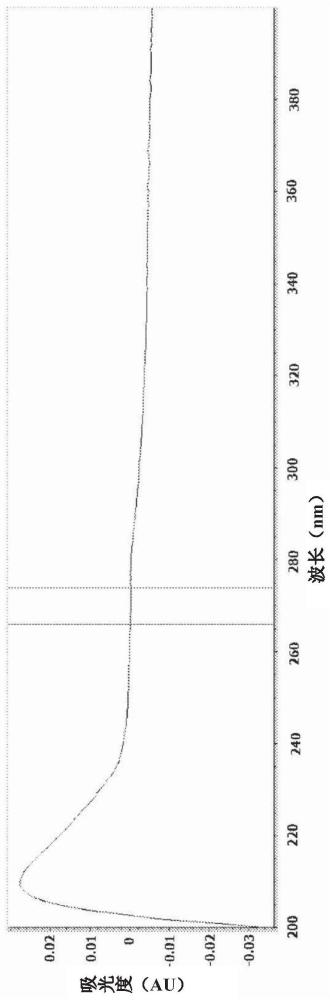
图1是甲醇(空白溶剂)的紫外-可见(UV/vis)吸收光谱。
图2是甲醇(空白溶剂)的UV/vis透射光谱。
图3是实施例2中的包含10mg/mL的化学式3-1的甲醇溶液的UV/vis吸收光谱。
图4是实施例2中的包含10mg/mL的化学式3-1的甲醇溶液的UV/vis透射光谱。
图5是实施例2中的包含10mg/mL的化学式6-1的甲醇溶液的UV/vis吸收光谱。
图6是实施例2中的包含10mg/mL的化学式6-1的甲醇溶液的UV/vis透射光谱。
具体实施方式
在下文中,将详细描述本说明书。
在本说明书中,当一个部分“包含”一个构成要素时,除非另有特别描述,否则这不是指排除另一构成要素,而是指可以进一步包含另一构成要素。
本说明书的一个示例性实施方案提供了一种制备D-丙氨酸烷基酯的方法,该方法包括:通过使下面化学式1的化合物与下面化学式2的化合物反应来合成下面化学式3的化合物;和蒸馏包含化学式3的化合物的组合物。
[化学式1]
[化学式2]
[化学式3]
在化学式1至化学式3中,
R1为甲基或被甲基取代的芳基,
R2和R3彼此相同或不同,并且各自独立地为氢;氘;或甲基,
R4为甲基。
在本说明书的一个示例性实施方案中,所述组合物的蒸馏是在1托至60托的压力和60℃至200℃的温度下蒸馏所述组合物。
化学式3的化合物和化学式4的化合物两者都是粘性液体。这是因为,不能像具有常规固体性能的材料那样采用如在溶解之后结晶或再结晶的方法,并且即使在将材料溶解于有机溶剂中的同时用水洗涤,也很难去除化学式4,并且由于化学式3在水层中损失而降低收率。具体地,当使用通过相分离用水洗涤有机层而不进行蒸馏来分离有机层的有机层洗涤方法时,作为由反应混合物产生的杂质的化学式4的含量几乎没有降低。当使用这种有机层洗涤方法时,由于用水洗涤,组合物中的化学式3反而损失,导致低收率。
本申请人设计了一种通过蒸馏化学式3的化合物来去除化学式4的方法。
当在相应的压力和温度范围之外进行蒸馏时,或者不使用它们的组合时,不能通过蒸馏从反应混合物中得到包含化学式3的组合物。
相反,当使用本说明书的一个示例性实施方案中的压力和温度范围的组合进行蒸馏时,上述缺点得到补偿,因此,可以以相对高的收率得到包含化学式3且化学式4的含量低的组合物,而没有水洗涤的损失。
由于本说明书的一个示例性实施方案中的压力和温度范围的组合不是在大规模生产工艺中难以实现的高温或真空压力条件,因此,具有压力和温度可以充分应用于工厂中的大规模生产的优势。
在本说明书的一个示例性实施方案中,所述组合物的蒸馏是在以下压力下蒸馏所述组合物:1托至50托、1托至40托、1托至30托、1托至20托、5托至20托、5托至15托、5托至10托或5托至7托。
在本说明书的一个示例性实施方案中,所述组合物的蒸馏是在以下压力下蒸馏所述组合物:1托以上、2托以上、3托以上、4托以上或5托以上,并且60托以下、55托以下、50托以下、45托以下、40托以下、35托以下、30托以下、25托以下、20托以下、15托以下、10托以下、9托以下、8托以下或7托以下。
在本说明书的一个示例性实施方案中,所述组合物的蒸馏是在以下温度下蒸馏所述组合物:70℃至200℃、80℃至200℃、90℃至200℃、100℃至200℃、110℃至200℃、110℃至150℃、110℃至130℃或118℃至130℃。
在本说明书的一个示例性实施方案中,所述组合物的蒸馏是在以下温度下蒸馏所述组合物:60℃以上、70℃以上、80℃以上、90℃以上、100℃以上、110℃以上、115℃以上或118℃以上,并且200℃以下、190℃以下、180℃以下、170℃以下、160℃以下、150℃以下、140℃以下或130℃以下。
在本说明书的一个示例性实施方案中,所述蒸馏是在5托至10托的压力和110℃至150℃的温度下蒸馏包含化学式3的化合物的组合物。
在本说明书的一个示例性实施方案中,所述蒸馏是在5托至7托的压力和118℃至130℃的温度下蒸馏包含化学式3的化合物的组合物。
在本说明书的一个示例性实施方案中,所述组合物的蒸馏是去除由于过度反应而产生的二取代杂质,具体地,去除作为二取代杂质的下面化学式4的化合物。由此,可以制备高纯度的化学式3的化合物,即,D-丙氨酸烷基酯,并且还可以提高使用D-丙氨酸烷基酯作为中间体合成的如甲霜灵-M、苯霜灵-M和呋霜灵-M的最终产物的纯度。
在本说明书的一个示例性实施方案中,所述组合物的蒸馏是制备如下组合物,其中基于所述组合物的总GC面积,下面化学式4的化合物的含量为0.1面积%以下。
[化学式4]
在化学式4中,
R2和R3彼此相同或不同,并且各自独立地为氢;氘;或甲基,
R4为甲基。
在本说明书的一个示例性实施方案中,在所述组合物的蒸馏中,蒸馏可以进行一次或多次,具体地数次,如一次或多次、两次或更多次、或三次或更多次。
在本说明书的一个示例性实施方案中,通过所述组合物的蒸馏,基于所述组合物的总GC面积,化学式4的化合物的含量可以为0.1面积%以下、0.09面积%以下或0.08面积%以下,并且化学式4的化合物的含量越低越好,因此,对其下限没有特别的限制。
在本说明书的一个示例性实施方案中,基于化学式1的化合物,化学式2的化合物的含量为2当量至10当量。在这种情况下,使用的化学式2的当量是合适的,因此,具有能够在提高反应速率的同时控制副反应的优势。
本说明书的另一示例性实施方案提供了一种制备D-丙氨酸烷基酯衍生物的方法,该方法包括:通过使下面化学式1的化合物与下面化学式2的化合物反应来合成下面化学式3的化合物;在1托至60托的压力和60℃至200℃的温度下蒸馏包含化学式3的化合物的组合物;以及通过向蒸馏的组合物中加入下面化学式5的化合物来合成下面化学式6的化合物。
[化学式1]
[化学式2]
[化学式3]
[化学式5]
[化学式6]
在化学式1至化学式3、化学式5和化学式6中,
R1为甲基或被甲基取代的芳基,
R2和R3彼此相同或不同,并且各自独立地为氢;氘;或甲基,
R4为甲基,
R5是被甲氧基取代的亚甲基;被苯基取代的亚甲基;或呋喃基。
在本说明书中,当芳基是单环芳基时,对其碳原子数没有特别的限制,但是优选地为6至25个。单环芳基的具体实例包括苯基、联苯基、三联苯基等,但不限于此。
当芳基为多环芳基时,对其碳原子数没有特别的限制,但是优选地为10至24个。多环芳基的具体实例包括萘基、蒽基、菲基、芘基、苝基、
在本说明书中,芴基可以是被取代的,并且相邻的取代基可以彼此键合形成环。
在本说明书的一个示例性实施方案中,R1为甲基;或被甲基取代的苯基。
在本说明书的一个示例性实施方案中,R1为甲基;或
在本说明书的一个示例性实施方案中,R2和R3彼此相同或不同,并且各自独立地为氢;或甲基。
在本说明书的一个示例性实施方案中,R2和R3为甲基。
在本说明书的一个示例性实施方案中,R5为被甲氧基取代的亚甲基。换言之,R5处于其中甲基的任意一个氢被甲氧基取代的状态。在这种情况下,化学式6的化合物是甲霜灵-M。
在本说明书的一个示例性实施方案中,R5为被苯基取代的亚甲基。换言之,R5处于其中甲基的任意一个氢被苯基取代的状态。在这种情况下,化学式6的化合物是苯霜灵-M。
在本说明书的一个示例性实施方案中,R5为呋喃基。在这种情况下,化学式6的化合物是呋霜灵-M。
本说明书的又一示例性实施方案提供了一种组合物,包含下面化学式3的化合物和下面化学式4的化合物,其中,基于所述组合物的总GC面积,下面化学式4的化合物的含量为0.1面积%以下。
[化学式3]
[化学式4]
在化学式3和化学式4中,
R2和R3彼此相同或不同,并且各自独立地为氢;氘;或甲基,
R4为甲基。
在本说明书中,对所述组合物的描述引用了如前所述的制备D-丙氨酸烷基酯及其衍生物的方法的描述。
本说明书的另一示例性实施方案提供了一种通过使化学式3的化合物与下面化学式5的化合物在上述组合物中反应而制备的D-丙氨酸烷基酯衍生物。
[化学式5]
在化学式5中,
R5为被甲氧基取代的亚甲基;被苯基取代的亚甲基;或呋喃基。
在本说明书中,对D-丙氨酸烷基酯衍生物的描述引用了如前所述的制备D-丙氨酸烷基酯及其衍生物的方法的描述。
本说明书的第一示例性实施方案提供了一种包含D-丙氨酸烷基酯衍生物和甲醇的D-丙氨酸烷基酯衍生物,其中,在浓度为10mg/mL的溶液的UV/vis吸收光谱中,在266nm处的吸光度为3.00以下,在274nm处的吸光度为2.60以下。
本说明书的第二示例性实施方案提供了一种包含D-丙氨酸烷基酯衍生物和甲醇的D-丙氨酸烷基酯衍生物,其中,在浓度为10mg/mL的溶液的UV/vis吸收光谱中,在266nm处的吸光度为3.00以下,在274nm处的吸光度为2.6以下;以及包含D-丙氨酸烷基酯衍生物和甲醇的D-丙氨酸烷基酯衍生物,其中,在浓度为10mg/mL的溶液的UV/vis透射率光谱中,在266nm处的透射率为0.10以上,在274nm处的透射率为0.29以上。
本说明书的第三示例性实施方案提供了一种包含D-丙氨酸烷基酯衍生物和甲醇的D-丙氨酸烷基酯衍生物,其中,在浓度为10mg/mL的溶液的UV/vis吸收光谱中,在266nm处的吸光度为3.00以下;以及包含D-丙氨酸烷基酯衍生物和甲醇的D-丙氨酸烷基酯衍生物,其中,在浓度为10mg/mL的溶液的UV/vis透射率光谱中,在266nm处的透射率为0.10以上。
本说明书的第四示例性实施方案提供了一种包含D-丙氨酸烷基酯衍生物和甲醇的D-丙氨酸烷基酯衍生物,其中,在浓度为10mg/mL的溶液的UV/vis吸收光谱中,在274nm处的吸光度为2.60以下;以及包含D-丙氨酸烷基酯衍生物和甲醇的D-丙氨酸烷基酯衍生物,其中,在浓度为10mg/mL的溶液的UV/vis透射率光谱中,在274nm处的透射率为0.29以上。
在紫外/可见光谱中,吸光度越低且透射率越高,则当材料处于溶解(溶液)状态时,用肉眼看到的材料越接近清晰且透明的类水状态。通常,处于上述状态越多,则当配制液体时,外观变得越亮且更接近白色,因此,优势在于其在商业上有利。例如,在注射溶液的情况下,可以看到内容物的状态,因为注射溶液包含在透明的小瓶中,因此,制造公司优选溶液状态看起来是无色透明的活性成分。因此,当配制液体时,黄色而不是棕色、比浑浊黄色更透明的黄色以及更接近水的状态会变得在外观上有优势。
在本说明书的一个示例性实施方案中,D-丙氨酸烷基酯衍生物是下面化学式6-1,其通过使在1托至60托的压力和60℃至200℃的温度下蒸馏的下面化学式3-1的化合物与下面化学式5-1的化合物反应而制备。换言之,所述D-丙氨酸烷基酯衍生物可以为通过使蒸馏的N-(2,6-二甲基苯基)-D-丙氨酸甲酯与下面化学式5-1的化合物反应而制备的N-(甲氧基乙酰基)-N-(2,6-二甲基苯基)-D-丙氨酸甲酯。
[化学式3-1]
[化学式5-1]
[化学式6-1]
在本说明书的一个示例性实施方案中,通过蒸馏化学式3-1来去除下面化学式4-1的杂质。
[化学式4-1]
化学式3-1的化合物和化学式4-1的化合物都是粘性液体。这是因为,不能像具有常规固体性能的材料那样采用如溶解之后结晶或再结晶的方法,并且即使材料在溶解于有机溶剂中的同时用水洗涤,也很难去除化学式4-1,并且由于化学式3-1在水层中损失而降低收率。具体地,当使用通过相分离用水洗涤有机层而不进行蒸馏来分离有机层的有机层洗涤方法时,作为由反应混合物产生的杂质的化学式4-1的含量几乎不降低。当使用这种有机层洗涤方法时,由于用水洗涤,组合物中的化学式3-1反而损失,导致低收率。
当使用本说明书的一个示例性实施方案中的压力和温度范围的组合来进行蒸馏时,可以以相对高的收率得到包含化学式3-1且化学式4-1的含量低的组合物,而没有水洗涤的损失。在这种情况下,考虑到上述状态是化学式4-1作为杂质被包含的状态,蒸馏之前或蒸馏之后的化学式3-1的状态可以表示为包含化学式3-1的组合物或包含化学式3-1和化学式4-1的组合物。
在本说明书的一个示例性实施方案中,化学式3-1的化合物的蒸馏是在以下压力下蒸馏化学式3-1:1托至50托、1托至40托、1托至30托、1托至20托或5托至20托。
在本说明的一个示例性实施方案中,化学式3-1的化合物的蒸馏是在以下温度下蒸馏化学式3-1:70℃至200℃、80℃至200℃、90℃至200℃、100℃至200℃、110℃至200℃、120℃至200℃或130℃至200℃。
在本说明书的一个示例性实施方案中,当蒸馏化学式3-1的化合物时,蒸馏可以进行一次或多次,具体地数次,如一次或多次,两次或更多次,或三次或更多次。
在本说明书的一个示例性实施方案中,通过对化学式3-1的化合物的蒸馏,基于蒸馏的化学式3-1的化合物的总GC面积,化学式4-1的化合物的含量可以为0.1面积%以下、0.09面积%以下或0.08面积%以下,并且化学式4-1的化合物的含量越低越好,因此,对其下限没有特别限制。
在本说明书的一个示例性实施方案中,D-丙氨酸烷基酯衍生物是通过使下面化学式3-1的化合物与下面化学式5-1的化合物反应而制备的下面化学式6-1,并且基于化学式3-1的化合物的总GC面积,下面化学式4-1的化合物的含量为0.1面积%以下。
[化学式3-1]
[化学式5-1]
[化学式6-1]
[化学式4-1]
在本说明书的一个示例性实施方案中,在包含10mg/mL的蒸馏的化学式3-1的化合物的甲醇溶液的UV/vis吸收光谱中,在266nm处的吸光度可为3.60以下,并且在274nm处的吸光度可为3.40以下。
在本说明书的一个示例性实施方案中,在包含10mg/mL的蒸馏的化学式3-1的化合物的甲醇溶液的UV/vis透射光谱中,在266nm处的透射率可为0.03以上,并且在274nm处的透射率可为0.04以上。
由于化学式3-1的化合物的吸光度较低且其透射率较高,因此,通过使用化学式3-1的化合物制备的化合物,即,化学式6-1的化合物也可以具有较低的吸光度和较高的透射率。由化学式3-1的化合物合成的化学式6-1的化合物具有高透明度,因此,可以制备满足本说明书的吸光度或透射率条件的D-丙氨酸烷基酯衍生物。
本说明书的又一示例性实施方案提供了一种包含上述D-丙氨酸烷基酯衍生物的药物或农产品。
在这种情况下,药物或农产品不仅包括包含D-丙氨酸烷基酯衍生物本身的状态,还包括对于各种用途而改性的状态,即,通过必要的化学反应改性的状态。
在本说明书中,所述农产品可以为各种农用化学品,如除草剂、作物保护剂和杀真菌剂。
在下文中,将通过实施例更详细地描述本说明书。然而,提供下面的实施例仅用于举例说明本说明书,而不意在限制本说明书。
[实施例]
[实施例1]
在室温下,将(s)-2-(甲磺酰氧基)丙酸甲酯(20.00g,109.78mmol)、三乙胺(12.22g,120.75mmol)和2,6-二甲基苯胺(106.43g,274.45mmol)加入到包含甲苯(20mL)的反应器中,将内部温度升高至120℃至130℃,然后搅拌混合物。
在确认残留在反应混合物中的未反应的(s)-2-(甲磺酰氧基)丙酸甲酯为1.0面积%以下(GC分析结果)之后,将反应混合物冷却至室温。之后,在室温下将内部压力降低至60托。在内部压力在1托至60托的范围内的状态下,通过将内部温度从60℃缓慢调节至200℃,将通过蒸馏得到的粗N-(2,6-二甲基苯基)-D-丙氨酸甲酯在甲苯(100mL)中稀释之后,用蒸馏水(30mL)将通过用1N的HCl水溶液(20mL)洗涤粗N-(2,6-二甲基苯基)-D-丙氨酸甲酯一次而得到的有机层洗涤一次,然后在减压下浓缩,从而以80%的收率得到纯度为98.52GC面积%的N-(2,6-二甲基苯基)-D-丙氨酸甲酯。
[实施例2]
在室温下,将(s)-2-(甲磺酰氧基)丙酸甲酯(20.00g,109.78mmol)、三乙胺(12.22g,120.75mmol)和2,6-二甲基苯胺(106.43g,274.45mmol)加入到包含甲苯(20mL)的反应器中,将内部温度升高至120℃至130℃,然后搅拌混合物。
在确认残留在反应混合物中的未反应的(s)-2-(甲磺酰氧基)丙酸甲酯为1.0面积%以下(GC分析结果)之后,将反应混合物冷却至室温。之后,在室温下将内部压力降低至50托。在内部压力在1托至50托的范围内的状态下,通过将内部温度从50℃缓慢升高并调节至150℃,通过蒸馏而得到粗化学式3-1(=N-(2,6-二甲基苯基)-D-丙氨酸甲酯)。用甲苯(100mL)稀释粗化学式3-1后,用蒸馏水(30mL)将通过用1N的HCl水溶液(20mL)洗涤一次粗化学式3-1后而得到的有机层洗涤一次,然后在减压下浓缩。由此,以80%的收率得到无色透明的化学式3-1(=N-(2,6-二甲基苯基)-D-丙氨酸甲酯),其纯度为98.5%,在波长为266nm处的吸光度为3.569(透射率为0.027),在波长为274nm处的吸光度为3.353(透射率为0.044)。
将化学式3-1(18.08g,87.24mmol)在甲苯(60mL)中稀释。向其中加入NaHCO
[比较例1]
在室温下,将(s)-2-(甲磺酰氧基)丙酸甲酯(20.00g,109.78mmol)、三乙胺(12.22g,120.75mmol)和2,6-二甲基苯胺(106.43g,274.45mmol)加入到包含甲苯(20mL)的反应器中,将内部温度升高至120℃至130℃,然后搅拌混合物。
在确认反应混合物中残留的未反应的(s)-2-(甲磺酰氧基)丙酸甲酯为1.0面积%以下(GC分析结果)之后,将反应混合物冷却至室温,然后将通过向其中加入H
[比较例2]
在室温下,将(s)-2-(甲磺酰氧基)丙酸甲酯(20.00g,109.78mmol)、三乙胺(12.22g,120.75mmol)和2,6-二甲基苯胺(106.43g,274.45mmol)加入到包含甲苯(20mL)的反应器中,将内部温度升高至120℃至130℃,然后搅拌混合物。
在确认残留在反应混合物中的未反应的(s)-2-(甲磺酰氧基)丙酸甲酯为1.0面积%以下(GC分析结果)之后,将反应混合物冷却至室温。之后,在室温下将内部压力降低至100托,并且在内部压力在61托至100托的范围内的状态下,将内部温度从60℃缓慢升高并调节至200℃,但是不能得到N-(2,6-二甲基苯基)-D-丙氨酸甲酯。
[比较例3]
在室温下,将(s)-2-(甲磺酰氧基)丙酸甲酯(20.00g,109.78mmol)、三乙胺(12.22g,120.75mmol)和2,6-二甲基苯胺(106.43g,274.45mmol)加入到包含甲苯(20mL)的反应器中,将内部温度升高至120℃至130℃,然后搅拌混合物。
在确认反应混合物中剩余的未反应的(s)-2-(甲磺酰氧基)丙酸甲酯为1.0面积%以下(GC分析结果)之后,将反应混合物冷却至室温,然后将通过向其中加入H
将化学式3-1(18.08g,87.24mmol)在甲苯(60mL)中稀释。在向其中加入NaHCO
[试验例1]
从实施例1和比较例1与比较例2的合成中取样品,并且在下面条件下使用Shimadzu GC-2030,通过带有火焰离子化检测器(GC/FID)的气相色谱法分析来测量。结果总结在下表1中。在这种情况下,各个纯度和含量是指基于通过GC/FID测量的总GC面积的GC面积%。
在这种情况下,使用Shimadzu GC-2030在下面条件下测量反应混合物的GC/FID分析。
柱:[HP-5](0.25mm ID×30mL,0.25μm d.f.毛细管)
烘箱温度
初始值和保持时间:50℃,5分钟
程序速率:10℃/min
最终值和保持时间:320℃,18分钟
注射器温度:340℃
检测器温度:340℃
气体流速:柱(N
分流比:1/20
注入量:1.0uL
[表1]
从表1可以确认,当不进行蒸馏时,由于用水洗涤而收率显著降低,同时没有很好地去除化学式4的杂质,并且在蒸馏条件不合适的比较例2的情况下,即使进行蒸馏也没有捕获目标化合物,因此,不能得到最终产物。相反,当在本说明书的条件下进行蒸馏时,可以确认,收率高,同时化学式4的杂质也被显著去除。
[试验例2]
为了确认吸光度和透射率,在实施例2和比较例3的各个步骤中取样品,并且使用UV/Vis分光光度计测量吸光度和透射率,并使用Agilent Technologies,Cary 8454 UV-Vis在下面条件下进行测量。结果总结在下表2中。
此外,在图1至图6中示出了实施例2、比较例3和作为空白溶剂的甲醇的吸光度和透射率光谱。
分析浓度:10mg/mL
稀释溶剂(或空白溶剂):MeOH
分析波长:266nm和274nm
分析池:石英池,路径长度10mm
[表2]
在紫外/可见光谱中,吸光度越低且透射率越高,则当材料处于溶解(溶液)状态时,用肉眼看到的材料越接近清晰、透明的类水状态。在表2中,可以确认,当比较作为D-丙氨酸烷基酯衍生物的化学式6-1的在266nm处的吸光度时,实施例2示出为2.974,满足3.00以下的范围,但是比较例3示出为3.211,超过3.00。另外,可以确认,化学式6-1在274nm处的吸光度在实施例2中为2.527,满足2.60以下的范围,但是在比较例3中为2.841,超过2.60。
在表2中,可以确认,当比较作为D-丙氨酸烷基酯衍生物的化学式6-1的在266nm处的透射率时,实施例2为0.106,满足0.10以上的范围,比较例3为0.062,小于0.10。此外,可以确认,化学式6-1在274nm处的透射率在实施例2中为0.297,其满足0.29以上的范围,但是在比较例3中为0.144,其小于0.29。
由此,通过肉眼观察实施例2比比较例3更清晰并且更透明,并且透明度得到改善的实施例2具有高的美学外观,因此,在商业上高度优选。
