一种具有大斯托克斯位移的β-半乳糖苷酶近红外荧光探针及其制备方法与应用
文献发布时间:2024-04-18 19:57:50
技术领域
本发明属于分析化学检测技术领域,具体涉及一种具有大斯托克斯位移的β-半乳糖苷酶近红外荧光探针CPD-gal及其制备方法与应用。
背景技术
β-半乳糖苷酶(β-gal)是一种具有糖苷外切功能的溶酶体酶,在催化水解糖苷键以及维持人体正常的生命活动等领域起着至关重要的作用。研究表明:溶酶体内源性β-gal的过度表达是人体衰老的重要原因之一。β-gal的异常表达与癌症、细胞衰老、类风湿关节炎、肾脏疾病等多种生理疾病密切相关。因此,β-gal被广泛视为人体衰老以及癌症等疾病的生物标志物。因此,开发一种选择性好、灵敏度高的β-gal实时检测技术对于β-gal表达异常导致疾病的前期诊断和治疗具有重要意义。
β-gal传统检测方法包括比色法、电化学方法、光化学法及拉曼光谱法等。传统检测方法虽可以实现对β-gal的检测,但是上述方法存在样品前处理复杂、费时费力、时空分辨率低、需要专业人员操作、抗干扰能力差等缺陷。另外,组织细胞自身的背景干扰,严重影响传统方法的灵敏度和准确性。与传统检测方法相比,分子荧光探针技术因具有高灵敏性、高选择性、抗干扰能力强、操作简便、对细胞、组织和生物体的无损检测等优点逐渐应用于β-gal的原位检测。目前,已有的应用于β-gal检测的荧光探针存在着发射波长较短、易受生物自身背景荧光干扰、斯托克斯位移小、灵敏度较低等缺点。近红外荧光探针因具有长波长发射(>700nm)、细胞穿透力强、背景荧光干扰少等优点,更加适于生物体内β-gal的检测。
因此,开发一种具有大斯托克斯位移特征的检测β-gal活性的近红外荧光探针显得尤为重要。
发明内容
本发明的一个目的是提供一种具有大斯托克斯位移特征、高灵敏度和高选择性检测β-gal活性的近红外荧光探针—CPD-gal。
本发明所提供的CPD-gal,其结构式如式I所示:
本发明的另一个目的是提供式I所示的CPD-gal的制备方法。
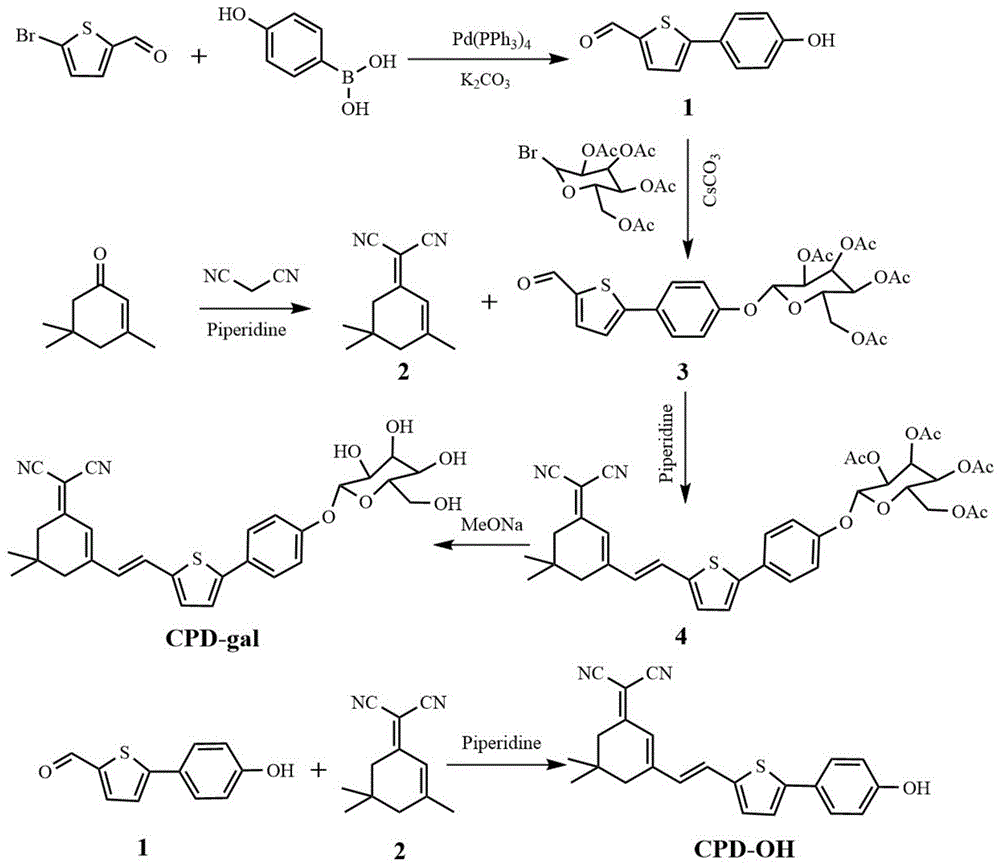
本发明所提供的CPD-gal的制备方法,包括如下步骤(制备流程图见图1):
1)使5-溴噻吩-2-甲醛与对羟基苯硼酸反应生成化合物1;
2)以异佛尔酮为原料合成化合物2(双氰基异佛尔酮);
3)使化合物1与四乙酰基-α-D-溴代半乳糖反应生成化合物3;
4)使化合物2与化合物3反应生成化合物4;
5)使化合物4反应脱去乙酰基生成CPD-gal。
上述方法步骤1)中,所述5-溴噻吩-2-甲醛与对羟基苯硼酸反应的具体方法如下:将5-溴噻吩-2-甲醛和对羟基苯硼酸溶解在四氢呋喃中,再加入四(三苯基膦)钯和质量分数22%的碳酸钾水溶液,在氮气保护下回流反应。所述反应中,5-溴噻吩-2-甲醛、对羟基苯硼酸和四(三苯基膦)钯的摩尔比为1:1:0.009。所述反应的反应温度为75℃,反应时间为3小时。
上述方法步骤2)中,所述以异佛尔酮为原料合成化合物2的具体方法如下:使异佛尔酮、丙二腈、哌啶和乙酸在氮气保护下进行反应,溶剂为无水乙醇,然后加热回流反应。所述反应中,异佛尔酮、丙二腈、哌啶和乙酸的摩尔比为1:1.1:0.09:0.09。所述反应的反应温度为90℃,反应时间为6小时。
上述方法步骤3)中,所述化合物1与四乙酰基-α-D-溴代半乳糖反应的具体方法如下:将化合物1和四乙酰基-α-D-溴代半乳糖溶解在无水乙腈中,加入碳酸铯和无水硫酸钠,氮气保护下进行反应。所述反应中,化合物1、四乙酰基-α-D-溴代半乳糖、碳酸铯、无水硫酸钠的摩尔比为1:2:2:2.5。所述反应的反应温度为25℃,反应时间为18小时。
上述方法步骤4)中,所述化合物2与化合物3反应的具体方法如下:将化合物2和化合物3溶解在无水乙醇中,加入哌啶催化,在氮气保护下回流反应。所述反应中,化合物2、化合物3和哌啶的摩尔比为1.5:1:0.08。所述反应的反应温度为80℃,反应时间为1小时;
上述方法步骤5)中,所述化合物4反应脱去乙酰基的具体方法如下:将化合物4溶解在无水甲醇中,缓慢加入甲醇钠的甲醇溶液,室温下进行反应。所述反应中,化合物4和甲醇钠的摩尔比为1:10。所述反应的反应温度为25℃,反应时间为1小时。
本发明的再一个目的是提供所述CPD-gal的用途。
本发明所提供的CPD-gal用途选自下述1)-7)中的至少一种:
1)由CPD-gal制成的荧光探针;
2)CPD-gal在作为荧光探针或作为检测β-gal的荧光探针中的应用;
3)含有CPD-gal的化学传感器;
4)CPD-gal在制备化学传感器或检测β-gal的化学传感器中的应用;
5)CPD-gal在检测β-gal中的应用;
6)上述1)的荧光探针在检测β-gal中的应用;
7)上述3)的化学传感器在检测β-gal中的应用。
其中,所述荧光探针和化学传感器均可用于β-gal的检测和荧光成像。
所述荧光探针或化学传感器应用的对象可为细胞。
具体的:所述荧光探针或化学传感器可应用于人卵巢腺癌细胞(SK-OV-3细胞)和Hela细胞中内源性β-gal的荧光成像。
本发明的发明人通过实验证实:CPD-gal可以选择性地与β-gal发生反应,以580nm作为激发波长,随着β-gal的浓度逐渐增大(0~4.0U/mL),在713nm处荧光强度逐渐增强,713nm处的荧光发射强度F
当采用荧光光谱法,以CPD-gal作为检测试剂对β-gal进行检测时,方法检出限为6.0×10
附图说明
图1为CPD-gal的制备流程图。
图2为化合物1的核磁共振氢谱。
图3为化合物1的核磁共振碳谱。
图4为化合物1的高分辨质谱。
图5为化合物2的核磁共振氢谱。
图6为化合物2的核磁共振碳谱。
图7为化合物2的高分辨质谱。
图8为化合物3的核磁共振氢谱。
图9为化合物3的核磁共振碳谱。
图10为化合物3的高分辨质谱。
图11为化合物4的核磁共振氢谱。
图12为化合物4的核磁共振碳谱。
图13为化合物4的高分辨质谱。
图14为CPD-gal的核磁共振氢谱。
图15为CPD-gal的核磁共振碳谱。
图16为CPD-gal的高分辨质谱图。
图17为CPD-OH的核磁共振氢谱。
图18为CPD-OH的核磁共振碳谱。
图19为CPD-OH的高分辨质谱。
图20为(a)和(b)CPD-gal与β-gal(4U/mL)共存体系以及CPD-gal、CPD-OH单独存在体系的紫外吸收光谱和荧光光谱图;(c)不同温度下CPD-gal与β-gal(4U/mL)共存体系荧光强度随时间变化图;(d)CPD-gal与不同浓度β-gal共存下的体系荧光强度随时间变化图;(e)CPD-gal与β-gal(4U/mL)共存体系以及CPD-gal单独存在的体系在不同pH下的荧光强度变化图;(f)CPD-gal与不同浓度β-gal共存体系荧光光谱曲线图。
图21为(a)和(b)不同浓度的CPD-gal与β-gal(2U/mL)共存体系的紫外吸收光谱和荧光光谱图;(c)不同浓度的CPD-gal与β-gal(2U/mL)共存体系下的酶促反应速率。
图22为(a)CPD-gal与不同浓度β-gal共存体系713nm处的荧光强度与β-gal浓度之间的线性关系图;(b)不同浓度的CPD-gal与β-gal(2U/mL)共存体系的米氏方程线性关系图。
图23为CPD-gal对β-gal荧光检测的选择性。
图24为(a)HeLa细胞与不同浓度CPD-gal共同孵育后的细胞存活率图;(b)HeLa细胞与CPD-gal(10μM)孵育不同时间后的细胞成像图;(c)HeLa细胞与H
图25为(a)SK-OV-3细胞与不同浓度CPD-gal共同孵育后的细胞存活率图;(b)SK-OV-3细胞的背景荧光图;(c)SKOV-3细胞与CPD-gal(10μM)孵育不同时间后的细胞成像图;(d)图(c)对应的平均荧光强度。
图26为(a)SK-OV-3细胞与CPD-gal(5μM)孵育不同时间后的细胞成像图;(b)SK-OV-3细胞与添加抑制剂(D-半乳糖,20μM)以及CPD-gal(5μM)孵育不同时间后的细胞成像图;(c)图(a)对应的平均荧光强度;(d)图(b)对应的平均荧光强度。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、化学传感器分子CPD-gal的制备
反应流程如图1所示,具体制备方法如下:
将5-溴噻吩-2-甲醛(1.188mL,10mmol)和对羟基苯硼酸(1.38g,10mmol)加入到75mL的四氢呋喃中,再加入四(三苯基膦)钯(100.0mg,0.09mmol),之后快速加入22%的碳酸钾水溶液(20mL),氮气保护下75℃回流搅拌反应3小时,反应完成后过滤,滤液用乙酸乙酯和饱和氯化钠水溶液萃取,有机相用无水硫酸钠干燥,旋蒸除去有机溶剂后得到固体,利用柱层析法提纯,以石油醚(沸程60~90℃)/乙酸乙酯(2:1,v/v)作为淋洗液,得到黄色固体化合物1,产率83%。
将丙二腈(660.6mg,10mmol)溶于20mL乙醇中,然后加入异佛尔酮(1.344mL,9.0mmol)、哌啶(80μL,0.8mmol)和乙酸(46μL,0.8mmol),在氮气保护下90℃回流反应6小时。反应完成后,冷却至室温(25℃),将溶液缓慢倒入30mL蒸馏水中,有灰色固体析出,过滤得到化合物2,产率48%。
将化合物1(204.2mg,1mmol)、四乙酰基-α-D-溴代半乳糖(822.4mg,2mmol)、碳酸铯(651.6mg,2mmol)和无水硫酸钠(355.1mg,2.5mmol)加入到15mL无水乙腈中,氮气保护下室温(25℃)搅拌反应18小时。反应结束后,过滤,旋蒸除去有机溶剂得到固体,使用柱层析法纯化,淋洗液为石油醚(沸程60~90℃)/乙酸乙酯(2:1,v/v),得到白色固体化合物3,产率76%。
将化合物2(208.6mg,1.12mmol)和化合物3(400.9mg,0.75mmol)溶解在25mL无水乙醇中,再加入哌啶(6μL,0.06mmol),氮气保护下80℃回流搅拌反应1小时,反应结束后旋蒸除去有机溶剂得到固体,使用柱层析法纯化,展开剂为二氯甲烷/甲醇(200:1,v/v),得到红色固体化合物4,产率53%。
将化合物4(77.3mg,0.11mmol)加入到8mL无水甲醇中,室温下(25℃)搅拌10分钟,然后缓慢滴加甲醇钠(59.4mg,1.1mmol)的甲醇溶液(2mL),反应体系在室温下(25℃)搅拌反应1小时。反应完成后向体系中加入阳离子交换树脂(H
化合物1的核磁和高分辨质谱鉴定结果:
化合物2的核磁和高分辨质谱鉴定结果:
化合物3的核磁和高分辨质谱鉴定结果:
化合物4的核磁和高分辨质谱鉴定结果:
CPD-gal的核磁和高分辨质谱鉴定结果:
对比例1、CPD-OH的制备
将化合物1(81.7mg,0.4mmol)和化合物2(74.5mg,0.4mmol)溶解在10mL无水乙醇中,再加入哌啶(3μL,0.03mmol),氮气保护下80℃回流搅拌反应3小时。反应完成后,过滤得到紫色固体化合物CPD-OH,产率84%。
CPD-OH的核磁和高分辨质谱鉴定结果:
实施例2、CPD-gal作为分析试剂对β-gal进行荧光检测
1、CPD-gal对β-gal进行荧光检测的灵敏度
称取适量的CPD-gal溶解在二甲亚砜(DMSO)中配制成浓度为1.0mM的储备液,标记为CPD-gal储备液。将β-gal溶解在一定量的磷酸盐缓冲溶液(PBS 10mM,pH=7.4)中配制成浓度为200U/mL的储备液,标记为β-gal储备液。
在5mL塑料EP管中,添加8μL试剂—CPD-gal储备液和适量体积的β-gal储备液,然后添加适量的磷酸盐缓冲溶液(PBS)/二甲亚砜(DMSO)的混合溶液(6:4,v/v,PBS 10.0mM,pH=7.4),使各测试体系中β-gal的浓度分别为0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.4、2.6、3.0、3.5和4.0U/mL,CPD-gal的浓度为2μM。在37℃下孵育40分钟后转移体系至1cm石英池中,测定反应体系的紫外吸收光谱和荧光光谱。
图20(a)和(b)分别为CPD-gal(2μM)与β-gal(4U/mL)共存体系以及CPD-OH(2μM)、CPD-gal(2μM)单独存在体系的紫外吸收光谱和荧光光谱图。图20(b)中,体系的激发波长为580nm。从图20(a)和(b)中可以看出:CPD-gal本身的紫外吸收较弱,当反应体系中加入β-gal后紫外吸收明显增强;CPD-gal本身在713nm处无明显荧光,当体系中加入β-gal后,体系在713nm处的荧光强度显著升高。上述现象说明CPD-gal对β-gal具有良好的紫外吸收和荧光响应。图20(c)为CPD-gal与β-gal(4U/mL)共存体系在不同温度下的荧光强度变化图。从图20(c)可以看出:在四个不同温度下(25℃、30℃、37℃和45℃),CPD-gal与β-gal(4U/mL)共存体系的荧光强度随着时间的延长逐渐升高,且同一时间下,37℃体系下的荧光强度最大,说明37℃为CPD-gal与β-gal最适反应温度。图20(d)为CPD-gal与不同浓度β-gal共存下的体系荧光强度随时间变化。不同β-gal浓度下(0U/mL、0.5U/mL、1.0U/mL、2.0U/mL和4.0U/mL),CPD-gal与β-gal共存体系的荧光强度随着时间的延长逐渐升高。当浓度为4.0U/mL时,CPD-gal与β-gal共存体系的荧光强度在40分钟基本达到稳定。上述事实说明,利用CPD-gal对β-gal进行荧光检测的最佳时间为40分钟。图20(e)为CPD-gal与β-gal(4U/mL)共存体系以及CPD-gal单独存在的体系在不同pH下的荧光强度变化趋势图。从图20(e)可以看出:当pH处于2.0~10.0范围时,CPD-gal单独存在时713nm处无明显荧光,且其荧光强度几乎不随着pH的变化而变化。当体系中加入β-gal时,体系的荧光强度在pH=7.0时最高,且在pH=7.4的体系中仍有较高的荧光强度,说明CPD-gal适用于生理条件下对β-gal的荧光识别。图20(f)为CPD-gal与不同浓度的β-gal共存体系下荧光强度变化图。如图20(f)所示,随着β-gal浓度的提高,反应体系在713nm处的荧光强度逐渐增强。
图21(a)和(b)为不同浓度的CPD-gal(1-20μM)与β-gal(2U/mL)共存体系的紫外吸收和荧光强度图;图21(c)为不同浓度的CPD-gal(1-20μM)与β-gal(2U/mL)共存体系下的酶促反应速率。从图21(a)、(b)和(c)中可以看出:紫外吸收、荧光强度和酶促反应速率随着底物(CPD-gal)浓度的不断增加而增大,当底物浓度达到20μM时,不再随着底物浓度的增加而增大,表明底物浓度达到饱和,酶促反应速率最高,处于零级反应。
图22为CPD-gal(2μM)与不同浓度β-gal共存体系713nm处的荧光强度与β-gal浓度之间的线性关系图(a)和不同浓度的CPD-gal与β-gal(2U/mL)共存体系的米氏方程线性关系图(b)。图22(a)和(b)可以看出:在0-2U/mL的范围内,β-gal浓度与体系的荧光强度呈线性关系,线性方程为Y=432.312X+242.656,方法的检出限以3倍的空白信号的标准偏差除以标准曲线的斜率计算为6.0×10
以上结果表明,分析试剂—CPD-gal具有优良的荧光性能,能够实现对β-gal的高灵敏度荧光检测。
2、CPD-gal对β-gal进行荧光检测的特异性
同时取若干个5mL的EP管,进行上面类似的操作,只是将加入β-gal变成加入各种常见干扰离子或物质,1~28号对应的样品为:K
3、CPD-gal与其他相关β-gal化学传感器的性能对比
将CPD-gal对β-gal的荧光检测性能与文献中检测β-gal的相关化学传感器的性能进行总结和对比,结果见表1。从表1中可以看出,以CPD-gal荧光检测β-gal的综合性能优于已报道的同类化学传感器。
表1CPD-gal与文献中β-gal荧光探针的性能对比
参考文献
[1]Chen S.J.,N K.,W L.,Wu Y.Y.,Hou S.C.,Ma X.D.Near-infraredfluorescent probe with a large Stokes shift for bioimaging ofβ-galactosidasein living cells and zebrafish develop at different period.Analytica ChimicaActa,2022,1232,340459.
[2]Kong X.Q.,Li M.,Dong B.L.,Yin Y.G.,Song W.H.,Lin W.Y.Anultrasensitivity fluorescent probe based on the ICT-FRET dual mechanisms forimagingβ-galactosidase in vitro and ex vivo.Analytical chemistry,2019,91,15591-15598.
[3]Li X.Q.,Pan Y.T.,Chen H.,Duan Y.K.,Zhou S.W.,Wu W.B.,Wang S.W.,LiuB.Specific near-infrared probe for ultrafast imaging of lysosomalβ-galactosidase in ovarian cancer cells.
Analytical chemistry,2020,92,5772-5779.
[4]Long R.Q.,Tang C.,Yang Z.Natural hyperoside based novel light-upfluorescent probe with AIE and ESIPT characteristics for on-site and long-term imaging ofβ-galactosidase in living cells.Journal of Materials ChemistryC,2020,8,11860-11865.
[5]Li X.K.,Qiu W.J.,Li J.W.,Chen X.,Hu Y.L.,Gao Y.,Shi D.L.First-generation species-selective chemical probes for fluorescence imaging ofhumansenescence-associatedβ-galactosidase.Chemical science,2020,11,7292-7301.
[6]Zhao X.X.,Yang W.G.,Fan S.M.,Zhou Y.,Sheng H.C.Gao Y.,Hu Y.H.,Ahemicyanine-based colorimetric turn-on fluorescent probe forβ-galactosidaseactivity detection and application in living cells.Journal of Luminescence,2019,205,310-317.
[7]Shi L.M.,Yan C.X.,Ma Y.Y.,Wang T.,Guo Z.Q.,Zhu W.H.In vivoratiometric tracking of endogenousβ-galactosidase activity using anactivatable near-infrared fluorescent probe.
Chemical Communications,2019,55,12308-12311.
[8]Wu Q.,Zhou Q.H.,Li W.,Ren T.B.,Zhang X.B.,Lin Y.Evolving an ultra-sensitive near-infraredβ-galactosidase fluorescent probe for breast cancerimaging and surgical resection navigation.ACS Sensors,2022,7,3829-3837.
实施例3、CPD-gal作为分析试剂对细胞中β-gal进行荧光成像
以HeLa细胞和人卵巢腺癌细胞(SK-OV-3细胞)为研究对象,开展CPD-gal的细胞毒性CCK-8实验。细胞以不同浓度的CPD-gal(0~50μM)处理后培养24小时进行CCK-8实验,结果见图24(a)和25(a)。从图24(a)和图25(a)中可以看出:当探针的浓度低于50μM时,细胞的存活率大于85%,说明CPD-gal的细胞毒性较低,可以应用于细胞成像研究。
使用探针CPD-gal对HeLa细胞和人卵巢腺癌细胞(SK-OV-3细胞)内源性β-gal进行荧光成像。HeLa细胞或SK-OV-3细胞培养及成像操作如下:37℃下,将HeLa细胞或SK-OV-3细胞(4×10
将CPD-gal(10μM)和HeLa细胞共同孵育60min,每隔10min进行一次拍照成像,结果如图24(b)所示。CPD-gal和HeLa细胞共同孵育60min后,无明显的荧光信号。为了使HeLa细胞产生内源性的β-gal,将H
同时,我们探讨了CPD-gal探针在SK-OV-3细胞内源性β-gal成像的可行性。SK-OV-3的细胞荧光成像的本底见图25(b)。将SK-OV-3细胞与CPD-gal(10μM)共同孵育60min,每隔10min进行一次拍照成像,结果见图25(c)和25(d)。结果显示:SK-OV-3细胞经与CPD-gal(10μM)共同孵育后,随着时间的延长,红色通道的荧光逐渐增强,这是由于内源性β-gal在人卵巢腺癌细胞(SK-OV-3细胞)中高度表达所引起。上述结果表明:探针CPD-gal是人卵巢腺癌细胞(SK-OV-3细胞)内源性β-gal成像的有效工具。
此外,我们还研究了利用探针CPD-gal监控D-半乳糖(D-Galactose)抑制SK-OV-3细胞中内源性β-gal表达过程的可行性。结果表明,SK-OV-3细胞与CPD-gal(5μM)孵育60min后,出现了明显的荧光信号(图26(a)和26(c))。然而,SK-OV-3细胞与D-半乳糖(20μM)共同孵育2h后,再与CPD-gal(5μM)孵育60min后,体系只显示微弱的荧光信号(图26(b)和图26(d))。上述实验结果表明:探针CPD-gal可以用于监控D-半乳糖(D-Galactose)抑制SK-OV-3细胞中内源性β-gal表达过程,探针CPD-gal显示出强大的活细胞中β-gal荧光成像能力。
- 一种双光子近红外双大斯托克斯位移荧光染料及其合成方法与应用
- 一种基于花菁结构测钯离子的近红外荧光探针、其制备方法及应用
- 一种近红外比率型半胱氨酸荧光探针及其制备方法和应用
- 一种具有大斯托克斯位移的过氧化氢比率型近红外荧光探针及其制备方法与应用
- 一种具有大斯托克斯位移的次氯酸根近红外荧光探针及其制备方法与应用
