改性多酚载体材料、靶向纳米递送系统及制备方法和用途
文献发布时间:2023-06-19 18:35:48
技术领域
本发明属于生物医用材料领域,涉及一种改性多酚载体材料、靶向纳米递送系统及制备方法和用途,具体涉及透明质酸修饰的茶多酚(以下简称HA-EGCG)的制备方法以及其载微管抑制剂的纳米颗粒的制备方法与应用,具体是通过透明质酸(HA)的主动靶向作用和表没食子儿茶素没食子酸酯(EGCG)的生物活性协同促进脊髓损伤修复和抗肿瘤的应用。
背景技术
脊髓损伤(SCI)是临床常见的致残性疾病,常造成损伤平面以下感觉、运动及内脏功能障碍,导致不同程度的偏瘫或截瘫,很多患者终生残疾。脊髓损伤可以分为原发性损伤和继发性损伤两个阶段。目前对继发性脊髓损伤的机制不是非常清楚,但是脊髓损伤后的活性氧生成和脂质过氧化是继发性脊髓损伤的一个重要原因[1]。缓解脊髓损伤组织的氧化应激状态是促进脊髓损伤修复得到重要途径之一。微管是细胞骨架的主要组成部分,在神经元极化、轴突分化和生长等过程中起着重要作用[2]。细胞骨架的重构,如微管的组装,是轴突受损后生长锥形成以及再生的关键步骤,维持微管系统的稳定可防止由损伤引起的轴突萎缩和轴突末端肿大,削弱鞘磷脂相关蛋白等抑制因子对轴突的生长抑制效应,并有利于生长锥形成以及轴突再生。将抗氧化活性分子与微管抑制剂联合用于脊髓损伤治疗,将更加高效地刺激神经轴突的再生,诱导新生轴突与其目标神经元的连接以及神经回路的形成。
促进轴突再生是脊髓损伤研究的热点。神经元轴突生长、延长与分枝是细胞骨架介导的生物学过程。微管是细胞骨架的主要组成部分,在神经元极化、轴突分化和生长等过程中起着重要作用[2]。微管抑制剂是维持微管稳定性的一类小分子,神经受损后,应用微管抑制剂可诱导和加强微管蛋白聚合、阻止微管解聚和断裂,进而保证神经系统的结构完整和功能正常。微管参与了细胞分裂过程,因此,微管相关蛋白已经成为研究与开发全新抗癌药物的重要靶点之一。微管抑制剂通过抑制微管蛋白的聚合或者促进微管蛋白的聚合而干扰细胞的有丝分裂过程,进而发挥抗肿瘤作用。
透明质酸,以下简称HA,是具有良好的生物相容性、生物降解性和低免疫原性的天然聚多糖,在细胞膜表面有其特异受体,包括白细胞分化抗原(CD44)、肝内皮细胞受体(LEC)和透明质酸介导细胞游走受体(RHAMM)。作为一个载体材料,透明质酸主要是通过受体介导作用进入到肿瘤细胞,增强病灶区的药物水平,从而实现靶向治疗的目的。白细胞分化抗原(CD44)是一种细胞表面的跨膜蛋白,在多种肿瘤细胞表面高表达,包括乳腺癌、结肠癌、胶质瘤等。此外,当中枢神经系统受到损伤时,CD44的表达量增加,表明CD44同时可以作为中枢神经系统损伤修复的靶向性受体。
二硫键是一种动态化学键,具有很强的氧化还原敏感性,能够同时对肿瘤细胞高表达的活性氧(ROS)和谷胱甘肽(GSH)进行响应;一般二硫键既可以被谷胱甘肽还原成巯基然后发生分子内环化断裂,也可以被活性氧氧化成硫砜,通过增强连接臂的亲水性发生水解断裂,进而被代谢。通常认为,二硫键偶联的化合物形成的纳米粒在体循环中稳定,进入高浓度谷胱甘肽条件下还原为巯基,进而增加药物体系的亲水性,促进相邻化学键的水解和药物的释放。同时,二硫键的键角可以改变化合物的空间灵活性,有利于纳米粒的形成和稳定,为纳米制剂的设计与构建提供了理论基础。
绿茶是指采取茶树的新叶或芽,未经发酵,经一系列杀青等制作工艺制备的饮品,保留了鲜叶的天然成分。茶叶中具有药理作用的主要成分包括了茶多酚、咖啡碱、脂多糖、茶氨酸等。这些天然的物质对防衰老、抗癌、杀菌、抗炎、抗氧化、抗血栓等具有特殊的效果。表没食子儿茶素没食子酸酯(EGCG)作为主要的茶多酚,约占绿茶中茶多酚的40%;近些年,大量研究证实表没食子儿茶素没食子酸酯具有多重药理活性,包括抗氧化、抗炎、抗肿瘤、抗菌等,但在机体内生物利用度低,不易被吸收,在人体内易通过肝肠首过效应进而被代谢。此外,高剂量的表没食子儿茶素没食子酸酯会导致肝毒性、肾毒性、胃肠出血、腹泻腹痛等不良反应,从而限制了它的临床应用。因此,研究者常对表没食子儿茶素没食子酸酯的结构进行修饰,进而改善上述缺点,其中包括PEG化的EGCG[3]、壳聚糖化的EGCG[4]及靶向配体修饰的EGCG[5]等。如何使表没食子儿茶素没食子酸酯发挥更有效的生物学作用,将是未来研究中亟待解决的关键问题。
目前,已有一些以茶多酚衍生物为原料制备纳米粒的报道:(1)专利申请CN201610649484.1“EGCG功能化的壳多糖衍生物、其载和厚朴酚纳米颗粒及制备方法”,报道了EGCG功能化的壳聚糖衍生物载和厚朴酚纳米粒以及二者的制备方法。通过氧化保护剂的作用,合成EGCG改性的壳聚糖衍生物。(2)专利申请CN202011018549.5“一种光稳定的改性可得然胶抗氧化剂及其制备方法和应用”,通过化学偶联法对EGCG接枝,首先将EGCG琥珀酰化,再与羧甲基可得然胶的羟基反应,制备得到了具有光稳定的改性可得然胶抗氧化剂。(3)专利申请CN202011141373.2“一种深海软毛松藻补水组合物及其制备方法和应用”通过EGCG上的羟基进攻马来酸酐上的羰基碳,接着与棕榈酰五肽的氨基反应,进而改性EGCG,提高了EGCG的稳定性。上述有关表没食子儿茶素没食子酸酯衍生物的制备工艺繁琐,而且制备衍生物需要使用有机溶剂并且其应用范围有限。
基于上述技术现状,发明人期望引入具有良好的生物相容性、生物降解性和低免疫原性的天然多糖的透明质酸对表没食子儿茶素没食子酸酯进行修饰,并基于该衍生物开发出具有主动靶向性且能够有效递送微管抑制剂的纳米粒,实现对脑胶质瘤的治疗以及脊髓损伤的修复。
发明内容
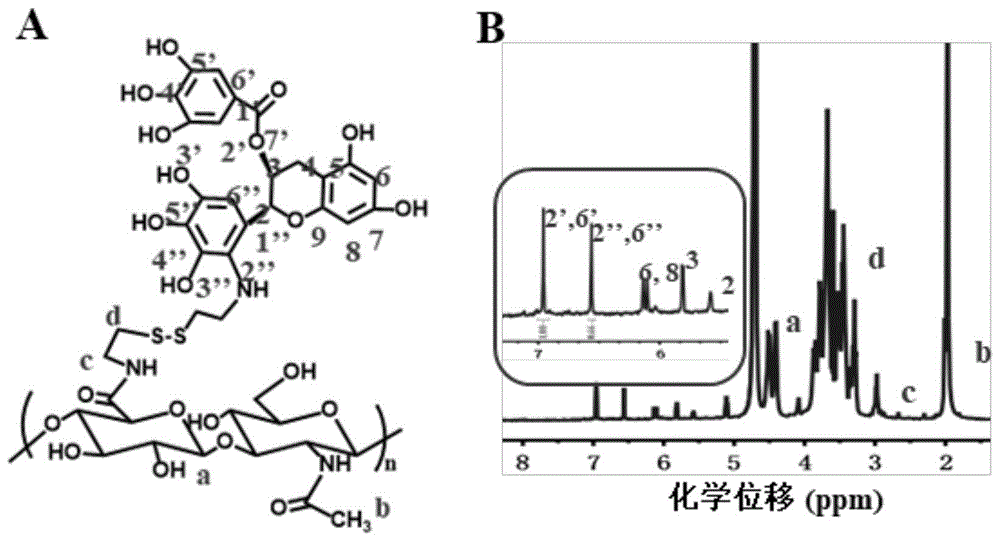
本发明所解决的第一个技术问题是提供一种改性多酚载体材料,可以用于制备递送微管抑制剂的靶向纳米递送系统,本发明改性多酚载体材料以下简称HA-EGCG载体,本发明HA-EGCG载体结构式如式Ⅰ。
式Ⅰ中;n为正整数。
其中,n的取值依赖于透明质酸的分子量。如采用透明质酸的分子量为3-100kDa,则对应的n取值范围为8 本发明所解决的第二个技术问题是提供了本发明改性多酚载体材料HA-EGCG载体的制备方法,包括以下步骤: A、合成HA-S-S-NH A1、取透明质酸粉末溶于磷酸缓冲盐溶液中,然后加入4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐,室温搅拌至透明质酸完全溶解,溶液呈无色透明状; A2、向步骤A1所得溶液加入胱胺二盐酸盐,反应; A3、将步骤A2反应所得溶液转移至透析装置中透析; A4、收集步骤A3所得透析产品,冷冻干燥,即得化合物HA-S-S-NH B、合成HA-EGCG载体: B1、将步骤A4所得HA-S-S-NH B2、将表没食子儿茶素没食子酸酯溶于磷酸缓冲盐溶液中,溶解; B3、将步骤B2所得溶液加入步骤B1所得溶液中,充分混匀; B4、将步骤B3所得溶液调节pH值至7.0-8.5,反应3-24小时; B5、将步骤B4所得溶液调节pH值至5.0-6.5,将反应所得溶液转移至透析装置中透析; B6、收集步骤B5所得透析产品,冷冻干燥,得到透明质酸修饰的表没食子儿茶素没食子酸酯,即HA-EGCG。 上述技术方案中,步骤A1中,磷酸缓冲盐溶液为pH4.5-7.4,优选pH 7.4。 上述技术方案中,步骤A1中,透明质酸粉末与磷酸缓冲盐溶液配制用量以透明质酸粉末可以溶解于磷酸缓冲盐溶液中即可。具体操作时,可以按照下述比例配制:透明质酸500mg,磷酸缓冲盐溶液50mL。 上述技术方案中,步骤A1中,为了充分活化HA结构中的-COOH,加入4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐(以下简称为DMTMM)。HA的-COOH与DMTMM的摩尔比透明质酸的-COOH 1份,DMTMM1-6份,此处优先选择透明质酸的-COOH与DMTMM的摩尔比为透明质酸的-COOH 1份,DMTMM2份。 上述技术方案中,步骤A1中,室温搅拌至透明质酸完全溶解,呈无色透明状态的条件为20-37℃搅拌1-24h;优选的,室温搅拌至透明质酸完全溶解的条件为25℃搅拌2h。 上述技术方案中,步骤A2中,透明质酸与胱胺二盐酸盐的摩尔比为透明质酸1份,胱胺二盐酸盐1-8份。 上述技术方案中,步骤A2中,优选透明质酸与胱胺二盐酸盐的摩尔比为透明质酸1份,胱胺二盐酸盐2份。 上述技术方案中,步骤A2中,反应条件为温度20-37℃,优选反应条件为室温25℃。 上述技术方案中,步骤A2中,反应时间为1-48小时,优选反应时间为24小时。 上述技术方案中,步骤A3中,所述透析装置为透析袋。进一步优选,选透析袋的截留分子量为1000-20000Da。最优选透析袋的截留分子量为3500Da。 上述技术方案中,步骤A3中,所述透析条件为:在0.1M NaCl溶液中透析12-48h,接着在25-95%v/v乙醇中透析24-48h,最后用蒸馏水透析12-48h。优选透析条件为:在0.1MNaCl溶液中透析48h,接着在25%v/v乙醇中透析24h,最后用蒸馏水透析48h。 上述技术方案中,步骤A4中,所述冷冻干燥的条件在-60度以下,真空度为10Pa以下,冻干时间为24-48h。最终优选冻干时间为36h。 上述技术方案中,步骤B1中,所述磷酸缓冲盐溶液pH 7.4。 上述技术方案中,步骤B1中,HA-S-S-NH 上述技术方案中,步骤B1中,所述溶解采用涡旋或者超声助溶。 上述技术方案中,步骤B2中,所述磷酸缓冲盐溶液为pH 7.4的磷酸缓冲液。 上述技术方案中,步骤B2中,所述表没食子儿茶素没食子酸酯与HA中-COOH的摩尔比为表没食子儿茶素没食子酸酯1-5份,HA中-COOH1份。优选摩尔比为表没食子儿茶素没食子酸酯2份,HA中-COOH1份。 上述技术方案中,步骤B2中,所述溶解采用涡旋或者超声助溶。 上述技术方案中,步骤B3中,将步骤B2所得溶液逐滴加入步骤B1所得溶液中,以便充分混合。 上述技术方案中,步骤B4中,所述调节pH值至7.4。 上述技术方案中,步骤B4中,所述调节pH值采用1M NaOH溶液。 上述技术方案中,步骤B4中,化学反应的时间为3h。 上述技术方案中,步骤B5中,所述调节pH值至6。 上述技术方案中,步骤B5中,所述调节pH值采用1M HCl溶液。 上述技术方案中,步骤B5中,所述透析装置为透析袋。进一步优选,选透析袋的截留分子量为1000-20000Da。最优选透析袋的截留分子量为3500Da。 上述技术方案中,步骤B5中,所述透析条件为依次使用无水乙醇、75%、50%、25%乙醇透析1-2天、去离子水透析1-2天。优选依次使用25%乙醇透析1天、去离子水透析两天。 本发明制备方法中,制备所得中间体化合物HA-S-S-NH
本发明所解决的第三个问题是提供一种具有主动靶向的纳米递送系统,本发明靶向纳米递送系统称为HA-EGCG空白纳米粒(Blank NP)。本发明HA-EGCG空白纳米粒的制备方法包括如下步骤: (1)取HA-EGCG用去离子水溶解,得HA-EGCG溶液作为水相; (2)取无水乙醇,加入到有机溶剂中,混匀,作为有机相; (3)将步骤(2)所得有机相中滴加步骤(1)所得HA-EGCG溶液,搅拌;将步骤1中的HA-EGCG溶液逐滴加入到上述步骤(2)中的有机相中,搅拌; (4)挥干有机溶剂; (5)过滤,得到空白纳米粒。 上述技术方案中,步骤(1)中,制备所得HA-EGCG溶液的浓度为0.5-10mg/mL;优选制备所得HA-EGCG溶液的浓度为2mg/mL。 上述技术方案中,步骤(2)中,所述乙醇为无水乙醇。 上述技术方案中,步骤(2)中,所述乙醇与有机溶剂的体积比为乙醇1-30份,有机溶剂10-500份。优选的,步骤(2)中,所述乙醇与有机溶剂的体积比为乙醇1份,有机溶剂10-300份。 上述技术方案中,步骤(2)中,所述乙醇与有机溶剂的体积比为乙醇1份,有机溶剂60-300份。 上述技术方案中,步骤(2)中,所述有机溶剂为丙酮、四氢呋喃、二氯甲烷中的至少一种。优选采用丙酮和四氢呋喃混合使用作为有机溶剂,其体积比为丙酮1-4份,四氢呋喃1-4份。最优选有机溶剂以体积比计为:丙酮1份,四氢呋喃2份。 上述技术方案中,步骤(3)中,水相与有机相的体积比为水相1-3份,有机相1-5份;优选的,水相与有机相的体积比为水相1份,有机相3份。 上述技术方案中,步骤(3)中,所述搅拌是采用室温磁力搅拌。 上述技术方案中,步骤(3)中,所述磁力搅拌的时间为1-24小时;优选采用磁力搅拌的时间为2小时。 上述技术方案中,步骤(4)中,所述挥干有机溶剂是采用旋转蒸发仪将有机溶剂旋干。 上述技术方案中,步骤(5)中,所述过滤是在4-25℃下过滤。优选采用在4℃下过滤。 上述技术方案中,步骤(5)中,所述过滤是采用离心机超滤。 上述技术方案中,步骤(5)中,所述过滤是采用截留分子量为1000-10000Da的设备过滤。优选所述过滤是采用截留分子量为3500Da的设备过滤。 本发明靶向纳米递送系统可有效装载微管抑制剂,制备具有主动靶向的纳米递送系统应用于临床。本发明靶向纳米递送系统可装载的微管抑制剂有多烯紫杉醇,紫杉醇和卡巴他赛等;可用于脊髓损伤的修复和抗肿瘤。本发明所解决的第四个技术问题是提供一种装载微管抑制剂的靶向纳米递送系统。本发明装载微管抑制剂的靶向纳米递送系统的制备方法包括如下步骤: (1)取HA-EGCG采用去离子水溶解,得HA-EGCG溶液作为水相; (2)取微管抑制剂用无水乙醇溶解,得微管抑制剂溶液,取微管抑制剂溶液加入到有机溶剂中,混匀得有机相; (3)将步骤(1)中的HA-EGCG水相溶液逐滴加入到步骤(2)中的有机相中,搅拌; (4)挥干有机溶剂; (5)过滤去除未被装载的微管抑制剂,得到装载微管抑制剂的靶向纳米递送系统。 上述技术方案中,所述微管抑制剂为多烯紫杉醇,紫杉醇和卡巴他赛。 特别的,针对脑胶质瘤的治疗,本发明以多烯紫杉醇为原料药,制备具有主动靶向的纳米递送系统,称为多烯紫杉醇/HA-EGCG(Docetaxel/HA-EGCG)纳米粒,以下简称DOC/HA-EGCG NPs。本发明多烯紫杉醇/HA-EGCG纳米粒的制备方法包括如下步骤: (1)取HA-EGCG采用去离子水溶解,得HA-EGCG溶液作为水相; (2)取多烯紫杉醇用无水乙醇溶解,得多烯紫杉醇溶液,取多烯紫杉醇溶液加入到有机溶剂中,混匀得有机相; (3)将步骤(1)中的HA-EGCG水相溶液逐滴加入到步骤(2)中的有机相中,搅拌; (4)挥干有机溶剂; (5)过滤去除未被装载的多烯紫杉醇,得到载多烯紫杉醇的多烯紫杉醇/HA-EGCG纳米粒。 上述技术方案中,步骤(1)中,制备所得HA-EGCG溶液的浓度为0.5-10mg/mL;优选制备所得HA-EGCG溶液的浓度为2mg/mL。 上述技术方案中,步骤(2)中,所述乙醇为无水乙醇。 上述技术方案中,步骤(2)中,制备所得多烯紫杉醇溶液浓度为1-10mg/mL;优选制备所得多烯紫杉醇溶液浓度为5mg/mL。 上述技术方案中,步骤(2)中,微管抑制剂溶液与有机溶剂的体积比为微管抑制剂溶液1-30份,有机溶剂10-500份。 上述技术方案中,优选的,步骤(2)中,所述微管抑制剂溶液与有机溶剂的体积比为微管抑制剂溶液1份,有机溶剂10-300份。 最优选的,步骤(2)中,所述微管抑制剂溶液与有机溶剂的体积比为微管抑制剂溶液1份,有机溶剂60-300份。 具体的,步骤(2)中,所述多烯紫杉醇溶液与有机溶剂的体积比为多烯紫杉醇溶液1份,有机溶剂300份;或体积比为多烯紫杉醇溶液2.1份,有机溶剂300份;或体积比为多烯紫杉醇溶液3.3份,有机溶剂300份;或者体积比为多烯紫杉醇溶液4.5份,有机溶剂300份。 上述技术方案中,步骤(2)中,所述有机溶剂为丙酮、四氢呋喃、二氯甲烷中的至少一种。优选采用丙酮和四氢呋喃混合使用作为有机溶剂,其体积比为丙酮1-4份,四氢呋喃1-4份。最优选有机溶剂以体积比计为丙酮1份,四氢呋喃2份。 上述技术方案中,步骤(3)中,水相与有机相的体积比为水相1-3份,有机相1-5份;优选的,水相与有机相的体积比为水相1份,有机相3份。 上述技术方案中,步骤(3)中,所述搅拌是采用室温磁力搅拌。 上述技术方案中,步骤(3)中,所述磁力搅拌的时间为1-24小时;优选采用磁力搅拌的时间为2小时。 上述技术方案中,步骤(4)中,所述挥干有机溶剂是采用旋转蒸发仪将有机溶剂旋干。 上述技术方案中,步骤(5)中,所述过滤是在25-4℃下过滤。优选采用在4℃下过滤。 上述技术方案中,步骤(5)中,所述过滤是采用离心机超滤。 上述技术方案中,步骤(5)中,所述过滤是采用截留分子量为1000-10000Da的设备过滤。优选所述过滤是采用截留分子量为3500Da的设备过滤。 在上述制备方法中,可以将多烯紫杉醇替换为紫杉醇和卡巴他赛,得到对应的载药HA-EGCG纳米粒。在此过程中,紫杉醇和卡巴他赛的配制条件同多烯紫杉醇,没有变化。 本发明中,为了使纳米粒可以更好的富集在肿瘤部位,采用了靶向材料透明质酸。为了使纳米粒在病灶部位可以选择性的释放药物,采用了响应型纳米载体,GSH响应。为了使制备的纳米粒可以用于多种疾病的治疗,采用了具有多重药理活性的化合物,例如,如茶多酚,微管抑制剂(包括多烯紫杉醇,紫杉醇和卡巴他赛)。 本发明制备方法首先使用4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐(DMTMM)活化透明质酸中的羟基,性能优于或者相当于最流行的偶联试剂如1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(简称EDC),N-羟基丁二酰亚胺(简称NHS)。然后胱胺二盐酸盐对透明质酸进行氨基化修饰,接着利用氨基与表没食子儿茶素没食子酸酯氧化的醌结构进行亲核反应,制备得到本发明载体材料HA-EGCG。 本发明所解决的第五个技术问题是提供本发明载体材料HA-EGCG的新用途。 具体是本发明载体材料HA-EGCG在制备具有抗氧化的药物中的用途;本发明载体材料HA-EGCG在制备装载微管抑制剂的药物中的用途;以及本发明载体材料HA-EGCG在制备抗肿瘤生物活性的药物中的用途。 进一步的体现在,本发明载体材料HA-EGCG在制备治疗促进脊髓损伤修复的药物中的用途;以及本发明载体材料HA-EGCG在制备治疗脑胶质瘤的药物中的用途。 本发明所解决的第六个技术问题是提供本发明装载微管抑制剂的靶向纳米递送系统的新用途。 具体是本发明装载微管抑制剂的靶向纳米递送系统在制备治疗促进脊髓损伤修复的药物中的用途;以及本发明装载微管抑制剂的靶向纳米递送系统在制备抗肿瘤生物活性的药物中的用途。尤其是,在制备治疗脑胶质瘤的药物中的用途。 本发明制备的载体材料可以通过非共价键作用力(包括疏水作用,π-π作用力将微管抑制剂成功装载,形成纳米递送系统用于促进脊髓损伤修复和治疗脑胶质瘤。本发明制备的载体材料自身具有抗氧化和抗肿瘤生物活性,以及主动靶向CD44受体的性质,用于递送药物时可以增强药物的作用。 本发明制备的载体材料还可以降低EGCG的溶血性,并保留EGCG的生物活性,具有良好的生物安全性。 本发明载体材料、空白纳米粒和载药纳米粒与现有技术相比,具有如下优势: 1、本发明制备的载体材料HA-EGCG具有主动靶向CD44受体的性质;同时还保留了EGCG的抗氧化和抗肿瘤效果。 2、本发明制备的载体材料HA-EGCG结构中具有动态二硫键,是本发明的关键技术点,通常情况下是稳定的,只有加入还原剂的时候才会断裂。如在高水平谷胱甘肽(以下简称GSH)和活性氧(以下简称ROS)下,可以断裂释放装载的药物。 3、本发明制备的载体材料HA-EGCG可有效负载微管抑制剂,具有潜在的促进脊髓损伤修复和抗肿瘤效应。 4、本发明制备的载体材料HA-EGCG负载微管抑制剂后,形成的纳米粒在冻干之后再溶解,展现出良好的复溶性。 附图说明 图1载体材料HA-EGCG的结构式(A)以及 图2载体材料HA-EGCG的XPS图。 图3空白纳米粒和DOC/HA-EGCG纳米粒的冻干粉以及复溶性。 其中,a-f分别表示a:水、b:空白纳米粒、c:DOC/HA-EGCG纳米粒(10%理论载药量)、d:空白纳米粒冻干粉、e:DOC/HA-EGCG纳米冻干粉(10%理论载药量)、f:DOC/HA-EGCG冻干粉复溶液(10%理论载药量)。 图4DOC/HA-EGCG纳米粒(10%理论载药量)的透射电镜图。 图5载体材料HA-EGCG的溶血图(A)以及EGCG和HA-EGCG的溶血率图(B)。 图6载体材料HA-EGCG的生物安全性:MTT分析HA-EGCG对L929细胞的毒性。 图7载体材料EGCG、HA-EGCG、空白纳米粒的DPPH自由基清除能力。 图8MTT分析HA-EGCG的抗肿瘤活性。 图9HA的竞争性实验。 图10原位脑胶质瘤小鼠的生存期。 图11脑胶质瘤组织切片的免疫组化图:CD31和KI67免疫组化。 其中:图11(A)为CD31和KI67免疫组化图;图11(B)为对图(A)中CD31的半定量分析统计图;图11(C)为对图(A)中KI67的半定量分析统计图; 图12各组SCI大鼠BBB评分图。 具体实施方式 本发明提供了一种茶多酚衍生物作为载体材料,以及其制备的靶向纳米递送系统,该靶向纳米递送系统可用于制备递送微管抑制剂的载药纳米粒,以及应用于抗肿瘤和促进脊髓损伤修复的技术方案。 以下实施例中出现的英文简称释义如下: 透明质酸,以下简称HA。 表没食子儿茶素没食子酸酯,以下简称EGCG。 4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐,以下简称DMTMM。 活性氧,以下简称ROS。 谷胱甘肽,以下简称GSH。 白细胞分化抗原44,以下简称CD44。 肝内皮细胞受体,以下简称LEC。 透明质酸介导细胞游走受体,以下简称RHAMM。 磷酸缓冲盐溶液,以下简称PBS。 多烯紫杉醇,以下简称DOC。 多烯紫杉醇/HA-EGCG纳米粒,以下简称DOC/HA-EGCG NPs。 光敏剂二氢卟吩,以下简称Ce6。 本发明空白纳米粒,以下简称Blank NPs。 脊髓损伤,以下简称SCI。 以下是实施例及应用例中采用的试剂或设备所属厂家及规格。 1、HA(华熙福瑞达生物医药有限公司,97%) 2、DMTMM(阿拉丁有限公司,97%) 3、胱胺二盐酸盐(阿拉丁有限公司,97%) 4、EGCG(大连美仑生物技术有限公司,95%) 5、DOC(大连美仑生物技术有限公司,99%) 6、Ce6染料(北京百灵威科技有限公司,93-98%) 7、L929细胞(美国模式培养物集存库) 8、MTT溶液(上海碧云天生物技术有限公司) 9、应用例2的培养基(Gibco) 10、DMSO(Sigma) 11、DPPH(上海碧云天生物技术有限公司) 12、GL261脑胶质瘤细胞(美国模式培养物集存库) 13、应用例4的培养基(Gibco) 14、4%多聚甲醛溶液(赛维尔生物科技有限公司) 15、DAPI(上海碧云天生物技术有限公司) 16、CLSM(共聚焦显微镜) 17、CD31(赛维尔生物科技有限公司) 18、KI67(赛维尔生物科技有限公司) 19、辣根过氧化酶标记的山羊抗兔二抗(赛维尔生物科技有限公司) 20、DAB液(赛维尔生物科技有限公司) 21、苏木素(赛维尔生物科技有限公司) 实施例1 本实施例中,合成茶多酚衍生物HA-EGCG,其制备工艺依次如下: 合成HA-S-S-NH 合成HA-EGCG化合物:室温条件下,将500mg HA-S-S-NH
式Ⅰ中,n为正整数。 本实施例所得结构式的式Ⅰ中,因采用的透明质酸HA分子量大约为9000Da(MW≈9000Da),对应的n≈24。 实施例2 本实施例中,制备DOC载药纳米体系,其制备工艺依次如下: (1)精密称取DOC粉末10.000mg,溶于2mL无水乙醇中,超声助溶,最终DOC浓度5mg/mL。 (2)精密称取HA-EGCG材料10.000mg,溶于5mL去离子水中,超声助溶,最终HA-EGCG的浓度为2mg/mL。 (3)将步骤(1)中的DOC溶液按照理论载药量(理论载药量=药物的质量/(材料的质量+药物的质量)×100%)加入到3mL丙酮与四氢呋喃体积比为1:2的混合溶剂内,搅拌混匀后,将上述步骤(2)中的1mL HA-EGCG溶液逐滴加入到丙酮中,DOC的理论载药量分别为2.5%、5%、7.5%、10%。室温搅拌2h,旋转蒸发仪将有机溶剂旋蒸除去,收集产物,4℃超滤30min(截留分子量3500Da),收集沉淀物,重悬得到DOC/HA-EGCG纳米悬浮液。将空白纳米粒和DOC/HA-EGCG(10%的理论载药量)纳米粒冻干后,得到冻干粉,然后用水将其再次溶解,如图3所示,两种纳米粒均展现出良好的复溶性。透射电镜观察DOC/HA-EGCG(10%理论载药量)纳米粒的形貌,如图4所示,纳米粒呈单一分散的类球形。 实施例3 本实施例用光敏剂二氢卟吩(简称Ce6染料)代替DOC,进而分析纳米粒在细胞中的行为;其制备工艺依次如下: (1)精密称取Ce6粉末10.000mg,溶于5mL无水乙醇中,超声助溶,最终Ce6浓度2mg/mL。 (2)精密称取HA-EGCG材料10.000mg,溶于5mL去离子水中,超声助溶,最终HA-EGCG的浓度为2mg/mL。 (3)将步骤(1)中的30μLCe6溶液加入到3mL丙酮与四氢呋喃体积比为1:2的混合溶剂内,搅拌混匀后,将上述步骤(2)中的1mL HA-EGCG溶液逐滴加入到丙酮与四氢呋喃混合溶剂中,Ce6的理论载药量分别为5%。室温搅拌2h,旋转蒸发仪将有机溶剂旋蒸除去,收集产物,4℃超滤30min(截留分子量3500Da),收集沉淀物,重悬得到Ce6/HA-EGCG纳米悬浮液。 应用例1 按照实施例1方法合成的载体材料HA-EGCG,制备形成不同的浓度,与2%兔血混合进行溶血实验分析,37℃孵育1h后,多功能酶标仪检测混合液在540nm的吸收值。其中:PBS为磷酸缓冲液(pH 7.4),作为阴性对照组,水作为阳性对照组。溶血试验见图5,从该实验结果发现当HA-EGCG的浓度达到1000μg/mL时没有溶血现象出现。说明本发明制备的材料HA-EGCG具有良好的生物安全性。 应用例2 检测按照实施例1方法合成的载体材料HA-EGCG对正常细胞L929细胞活力的影响。取对数生长期的L929细胞,胰酶消化,离心收集细胞,以3×10 应用例3 称取适量DPPH,使用乙醇溶解到250μM;将100μL上述DPPH溶液转移到96孔板,再分别加入20μL梯度浓度的EGCG、HA-EGCG溶液、Blank NP溶液,浓度设置为10、20、50、100、200、300、400μg/mL;25℃孵育15min后,使用多功能酶标仪测定517nm处的吸收值;设置单独的DPPH溶液组为阳性对照组;氧自由基清除效率用公式计算,其中A 清除率=(A 如图7所示,经过HA修饰后,HA-EGCG仍保留了EGCG的抗氧化作用,氧自由基的清除效率高。将HA-EGCG制备形成纳米粒后,仍保留了其氧自由基清除效应,说明使用HA-EGCG制备的纳米载体Blank NP具有一定的抗氧化效应。 应用例4 取对数生长期的GL261脑胶质瘤细胞,消化,离心收集细胞,以3×10 应用例5 将对数生长期的GL261细胞按1×10 应用例6 将原位接种GL261脑胶质瘤细胞的小鼠随机分为4组(n=5),在接种后10、12、14、16天分别尾静脉注射生理盐水(NS)、Blank NP、游离DOC(10mg/kg)DOC/HA-EGCG(10%的理论载药量;DOC:10mg/kg),每天观察小鼠的生长情况,记录死亡时间并用GraphPadPrism7.0绘制生存曲线图,评估各组的平均生存时间。如图10所示,生理盐水组小鼠的生存期为30天,Blank组小鼠的生存期为40天,游离DOC组的生存期为60天,DOC/HA-EGCG组小鼠的生存期为69天。与生理盐水组相比,游离DOC和DOC/HA-EGCG组明显延长了荷瘤小鼠的生存期,尤其是DOC/HA-EGCG组。 应用例7 在建模20天后,采用PBS和4%多聚甲醛溶液进行心脏灌注,取出大脑组织,4%多聚甲醛溶液中固定24h,分别转移到15%和30%蔗糖溶液中进行梯度脱水,石蜡切片(6μm)。将切片放入60℃烘2h,二甲苯脱蜡两次;乙醇进行梯度水化,各3min,自来水冲洗。3%H 应用例8 水合氯醛将大鼠麻醉,碘伏消毒,以T9为中心沿棘突做一长约3cm的切口,逐层切开,暴露T9-T10棘突及其双侧横突合椎板,使用咬骨钳咬除棘突合椎板,完全暴露该节段的脊髓;使用剪刀切断脊髓,建立全横断模型;止血清创后,大鼠随机分四组,脊髓原位给药:生理盐水组、空白纳米粒组(以下简称Blank NP组)、游离DOC组(0.4mg/kg)、DOC/HA-EGCG纳米粒组(10%的理论载药量;DOC剂量0.4mg/kg,总体积10μL,注射速度1μL/min);缝合线分别将肌肉、筋膜合皮肤缝合,碘伏消毒,术后每天腹腔注射头孢硫脒一次。大鼠运动功能修复情况采用BBB运动功能评分法来评估。一定时间点,将大鼠置于旷场,观察其髋,膝,踝,趾,前后肢协调运动等情况,观察时间为5min,两人双盲打分。如图12所示,经药物作用后,促进了脊髓损伤大鼠神经修复。如图12所示后,术后八周,生理盐水组的评分为7分,BlankNP组的评分为9,游离DOC组的评分为11,DOC/HA-EGCG组的评分为15分,经DOC和DOC/HA-EGCG作用后,大鼠的运动功能恢复明显,与生理盐水组相比,具有统计学差异(P<0.001),促进了脊髓损伤大鼠神经修复。同时,DOC/HA-EGCG组BBB评分高于DOC组,具有统计学差异(P<0.05)。因此,引入HA-EGCG后,可以促进脊髓损伤大鼠神经修复。 综上,本发明公开了一种载体材料HA-EGCG,由该载体材料制备的靶向纳米递送系统,以及利用该靶向纳米递送系统装载生物活性成分(如微管抑制剂)实现药用目的。具有抗氧化和抗肿瘤的生物活性,可应用于脊髓损伤修复及脑胶质瘤等适应症。为临床应用提供了一种全新的技术思路。 参考文献: [1]Ji RR,Xu ZZ,Gao YJ:Emerging targets in neuroinflammation-drivenchronic pain.Nat Rev Drug Discov(2014)13(7):533-548. [2]Hellal F,Hurtado A,Ruschel J,Flynn KC,Laskowski CJ,Umlauf M,Kapitein LC,Strikis D,Lemmon V,Bixby J,Hoogenraad CC et al:Microtubulestabilization reduces scarring and causes axon regeneration after spinal cordinjury.Science(2011)331(6019):928-931. [3]Chung JE,Tan S,Gao SJ,Yongvongsoontorn N,Kim SH,Lee JH,Choi HS,Yano H,Zhuo L,Kurisawa M,Ying JY:Self-assembled micellar nanocomplexescomprising green tea catechin derivatives and protein drugs for cancertherapy.Nature nanotechnology(2014)9(11):907-912 [4].Lei F,Liu F,Yuan F,Gao Y:Impact of chitosan–egcg conjugates onphysicochemical stability ofβ-carotene emulsion.Food Hydrocolloids(2014)39(163-170. [5].Lee F,Chung JE,Xu K,Kurisawa M:Injectable degradation-resistanthyaluronic acid hydrogels cross-linked via the oxidative coupling of greentea catechin.ACS Macro Letters(2015)4(9):957-960.
