类胡萝卜素和脱辅基类胡萝卜素的生产
文献发布时间:2024-04-18 19:58:26
本申请是申请日为2018年2月26的PCT国际专利申请PCT/SG2018/050087进入中国国家阶段的中国专利申请号201880026537.1、发明名称为“类胡萝卜素和脱辅基类胡萝卜素的生产”的分案申请。
相关申请的交叉引用
本申请要求2017年2月24日提交的新加坡申请第10201701500U号的优先权权益,其内容通过引用整体并入本文用于所有目的。
技术领域
本发明属于类胡萝卜素和脱辅基类胡萝卜素(apocarotenoid)领域,特别地,本发明涉及用于生产脱辅基类胡萝卜素和类胡萝卜素的改进方法。
背景技术
类胡萝卜素是在许多植物、藻类和某些细菌和真菌中合成的一类天然产物。类胡萝卜素具有许多不饱和碳结合,这些结合是共轭的,这促成不同的特征、明亮的颜色(范围从淡黄色到橙色到红色)和有效的抗UV和抗氧化作用。由于这些特征,类胡萝卜素已被广泛用作天然色素和营养制品(nutraceutical)。特别地,八氢番茄红素(phytoene)具有有效的UVB吸收能力并减少人类皮肤中的黑色素合成,因此在化妆品中具有日益增长的市场。番茄红素、β-胡萝卜素和α-胡萝卜素因其抗氧化剂作用而众所周知,并已被广泛用于食品、化妆品、营养制品和动物饲料产品中。
脱辅基类胡萝卜素是通过类胡萝卜素裂解加氧酶衍生自类胡萝卜素的一类化合物。脱辅基类胡萝卜素广泛分布于细菌、真菌、植物和动物中,作为香味(aroma)和气味(scent)化合物(α-紫罗酮和β-紫罗酮)、感光色素(胭脂树素、藏红花素)、激素(脱落酸)和信号传导化合物(独脚金内酯)起作用。在各种脱辅基类胡萝卜素中,α-紫罗酮和β-紫罗酮是两种重要的芳香族化合物。α-紫罗酮具有甜的且紫罗兰样香味,气味阈值为~0.4ppb。其异构体,β-紫罗酮具有温暖、木质且紫罗兰的香味和甚至更低的气味阈值,在空气中为~0.007ppb且在水中为1ppb。由于它们的显著低的气味阈值和令人愉快的气味,它们被广泛用于化妆品和香料工业中。除紫罗酮之外,视黄醇(或维生素A)是另一种商业上重要的脱辅基类胡萝卜素。视黄醇作为抗氧化剂在视力、骨发育和皮肤健康方面发挥至关重要的作用。作为活性化妆品成分和皮肤疾病的有效药物,视黄醇的市场规模估计为约16亿美元。
尽管它们具有高的商业价值,天然紫罗酮和类视黄醇(retinoid)的供给受到其在自然界中的极其低的丰度的严重限制。紫罗酮以亚ppm(sub-ppm)水平在许多花和果实例如玫瑰、桂花、鸢尾根和覆盆子中存在。例如,生产仅1克α-紫罗酮就需要100吨覆盆子或20公顷的农业面积。对于类视黄醇,则不存在来自植物的天然来源。一些动物来源的食物例如鸡蛋和黄油中存在极低量的类视黄醇。因此,目前通过从天然来源提取的供给不能够满足对天然紫罗酮和类视黄醇的日益增长的需求。尽管这些化合物可以进行化学合成,但是脱辅基类胡萝卜素诸如α-紫罗酮具有手性中心,而合成的化合物则通常是不同对映体的混合物。已知许多香料(fragrance)化合物的不同异构体具有不同的气味,因此合成单一异构体而不是异构体混合物是重要的。更重要的是,消费者倾向于喜欢天然香料胜过合成香料,并因此天然成分具有显著更高的价格。α-紫罗酮的生产先前在工程化的大肠杆菌(Escherichia coli)中被证明,但产率非常低。
因此,对以提高的产率提供天然地生产的化合物存在需求。
发明内容
在一方面,提供了生产类胡萝卜素或脱辅基类胡萝卜素的方法,所述方法包括在宿主细胞中表达包含表达载体的表达模块的步骤,所述表达载体具有编码至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接。
在一方面,提供了宿主细胞,所述宿主细胞包含表达载体,所述表达载体具有编码至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接。
在一方面,提供了试剂盒,所述试剂盒在如本文所描述的方法中使用时用于生产类胡萝卜素,所述试剂盒包含以下的一种或更多种:第一载体,所述第一载体编码选自atoB、hmgS、thmgR的一种或更多种优化的第一基因产物;第二载体,所述第二载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的第二基因产物;第三载体,所述第三载体编码选自ispA、crtE或crtB、任选地crtI的与启动子可操作地连接的一种或更多种优化的第三基因产物,其用于生产八氢番茄红素或番茄红素。
在一方面,提供了用于生产类胡萝卜素或脱辅基类胡萝卜素的系统,所述系统包括表达载体,所述表达载体具有编码至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接,其中所述至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶选自:a.用于生产α-紫罗酮的ΔN50-LsLcyE和TrxA-CCD1(优选TrxA-桂花(Osmanthus fragans)CCD1);或b.用于生产β-紫罗酮的crtY和CCD1(优选矮牵牛(Petunia hybrid)CCD1);或c.用于生产ε-胡萝卜素的ΔN50-LsLcyE;或d.用于生产视黄醛或视黄醇的crtY和blh。
在一方面,提供了试剂盒,所述试剂盒在如本文所描述的方法中使用时用于生产类胡萝卜素或脱辅基类胡萝卜素,所述试剂盒包含以下的一种或更多种:第一载体,所述第一载体编码选自atoB、hmgS、thmgR和任选地crtY的与启动子可操作地连接的一种或更多种优化的第一基因产物;第二载体,所述第二载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的第二基因产物;第三载体,所述第三载体编码选自ispA、crtE、crtB或crtI的与启动子可操作地连接的一种或更多种优化的第三基因产物;和第四载体,所述第四载体编码选自以下的一种或更多种优化的基因产物:a.用于生产α-紫罗酮的与启动子可操作地连接的ΔN50-LsLcyE和TrxA-桂花CCD1;或b.用于生产β-紫罗酮的与启动子可操作地连接的crtY和phCCD1;或c.用于生产ε-胡萝卜素的与启动子可操作地连接的ΔN50-LsLcyE;或d.用于生产视黄醛或视黄醇的与启动子可操作地连接的crtY和blh。
在一方面,用于生产类胡萝卜素或脱辅基类胡萝卜素的方法,所述方法包括以下步骤:a.在化学成分确定的培养基(chemically defined media)中使如本文描述的宿主细胞与用于脱辅基类胡萝卜素或类胡萝卜素生产的底物接触;b.在所述化学成分确定的培养基中孵育宿主细胞以产生一种或更多种预先选择的类胡萝卜素或脱辅基类胡萝卜素;和c.使用有机层从化学成分确定的培养基中提取一种或更多种预先选择的类胡萝卜素或脱辅基类胡萝卜素。
具体地,本发明提供了以下方案:
1.一种用于生产类胡萝卜素或脱辅基类胡萝卜素的方法,所述方法包括以下步骤:在宿主细胞中表达包含表达载体的表达模块,所述表达载体具有编码至少一种优化的脱辅基类胡萝卜素或类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接。
2.根据项目1所述的方法,其中所述类胡萝卜素选自八氢番茄红素、番茄红素、α-胡萝卜素、γ-胡萝卜素、δ-胡萝卜素、ε-胡萝卜素或β-胡萝卜素,并且其中所述脱辅基类胡萝卜素选自α-紫罗酮、β-紫罗酮、假性紫罗酮(或ψ-紫罗酮)、羟基紫罗酮、β-环柠檬醛、反式香叶基丙酮、6-甲基-5-庚烯-2-酮(MHO)、视黄醛、视黄醇、8’,10-二阿朴胡萝卜素-8’,10-二醛(C17)或10’,6-二阿朴胡萝卜素-10’,6-二醛(C19)。
3.根据项目1或2所述的方法,其中所述至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶选自crtY、CCD1、CCD2、CCD4、BCDO、LcyE、blh或ybbO。
4.根据项目3所述的方法,其中所述CCD2选自CaCCD2或CsCCD2。
5.根据项目3所述的方法,其中所述CCD4选自由以下组成的组:AtCCD4、BoCCD4b、CmCCD4、CsCCD4a、MaCCD4、MdCCD4、OfCCD4、PpCCD4、RdCCD4和VvCCD4a。
6.根据项目2或项目3所述的方法,其中所述脱辅基类胡萝卜素是α-紫罗酮,并且其中所述至少一种优化的脱辅基类胡萝卜素生成酶选自LcyE和CCD1,并形成具有以下结构的操纵子:LcyE-CCD1。
7.根据项目6所述的方法,其中所述LcyE源自莴苣(Lactuca sativa)并且是N-末端截短的(范围为LsLcyE的1至100个氨基酸,特别是ΔN50-LsLcyE)。
8.根据项目6所述的方法,其中所述CCD1被表达为选自TrxA-CCD1、SUMO-CCD1或MBP-CCD1的融合蛋白。
9.根据项目8所述的方法,其中所述融合蛋白是TrxA-CCD1。
10.根据项目9所述的方法,其中融合蛋白选自TrxA-桂花(Osmanthus fragrans)CCD1或TrxA-矮牵牛(Petunia hybrid)CCD1。
11.根据项目10所述的方法,其中所述CCD1源自或是桂花CCD1(OfCCD1)并且包含以下突变中的一种或更多种:N154Y、M152T、L151F。
12.根据项目6至11中任一项所述的方法,所述方法包括针对在24小时的时间段内达100-1000mg/L的量的α-紫罗酮表达水平进行筛选。
13.根据项目2或项目3所述的方法,其中所述脱辅基类胡萝卜素是β-紫罗酮,并且其中所述至少一种优化的脱辅基类胡萝卜素生成酶选自crtY和CCD1,并形成具有结构crtY-CCD1的操纵子。
14.根据项目13所述的方法,其中所述CCD1源自矮牵牛(PhCCD1)。
15.根据项目13所述的方法,其中所述crtY源自菠萝泛菌(Pantoea ananatis)。
16.根据项目13至15中任一项所述的方法,所述方法还包括针对在24小时的时间段内达10-1000mg/L的量的β-紫罗酮表达水平进行筛选。
17.根据项目2或项目3所述的方法,其中所述脱辅基类胡萝卜素是视黄醛,并且其中所述至少一种优化的脱辅基类胡萝卜素生成酶选自crtY和blh,并形成具有结构crtY-blh的操纵子。
18.根据项目17所述的方法,其中所述crtY源自菠萝泛菌。
19.根据项目17所述的方法,其中所述blh源自未培养海洋细菌HF10_19P19。
20.根据项目17至19所述的方法,所述方法还包括针对在24小时的时间段内达10-1000mg/L的量的视黄醛表达水平进行筛选。
21.根据项目2或项目3所述的方法,其中所述类胡萝卜素是ε-胡萝卜素,并且其中所述至少一种优化的类胡萝卜素生成酶是LcyE。
22.根据项目21所述的方法,其中所述LcyE源自莴苣并且是N-末端截短的(ΔN50-LsLcyE)。
23.根据项目21至22中任一项所述的方法,所述方法还包括针对在24小时的时间段内达10-1000mg/L的量的ε-胡萝卜素表达水平进行筛选。
24.根据项目2所述的方法,其中所述类胡萝卜素是八氢番茄红素。
25.根据项目24所述的方法,所述方法还包括针对在24小时的时间段内达10-1000mg/L的量的八氢番茄红素表达水平进行筛选。
26.根据项目1至25中任一项所述的方法,所述方法还包括在所述宿主细胞中表达:第一表达模块,所述第一表达模块包含具有第一编码区的表达载体,所述第一编码区编码选自atoB、hmgS、thmgR和任选的crtY的一种或更多种优化的第一基因产物,所述第一编码区与启动子可操作地连接;第二表达模块,所述第二表达模块包含具有第二编码区的表达载体,所述第二编码区编码选自mevK、pmk、pmd或idi的一种或更多种优化的第二基因产物,所述第二编码区与启动子可操作地连接;第三表达模块,所述第三表达模块包含具有第三编码区的表达载体,所述第三编码区编码选自ispA、crtE、crtB或crtI的一种或更多种优化的第三基因产物,所述第三编码区与启动子可操作地连接。
27.根据项目26所述的方法,其中所述一种或更多种第一基因产物形成具有以下结构的操纵子:atoB-hmgS-thmgR。
28.根据项目26所述的方法,其中所述一种或更多种第一基因产物形成具有以下结构的操纵子:crtY-atoB-hmgS-thmgR。
29.根据项目26所述的方法,其中所述一种或更多种第二基因产物形成具有以下结构的操纵子:mevK-pmk-pmd-idi。
30.根据项目26所述的方法,其中所述一种或更多种第三基因产物形成具有以下结构的操纵子:crtE-crtB-ispA。
31.根据项目26所述的方法,其中所述一种或更多种第三基因产物形成具有以下结构的操纵子:crtE-crtB-crtI-ispA。
32.根据项目1至31中任一项所述的方法,其中所述宿主细胞是选自BL21 DE3或MG1655 DE3的大肠杆菌(Escherichia coli)。
33.根据项目1至32中任一项所述的方法,其中所述启动子选自TM1、TM2或TM3、T7RNA聚合酶启动子、T5 RNA聚合酶启动子、T3 RNA聚合酶启动子、SP6 RNA聚合酶启动子或诱导型启动子中的一种或更多种。
34.根据项目1至33中任一项所述的方法,其中所述脱辅基类胡萝卜素生成酶的优化和优化的基因产物通过密码子优化或定点诱变实现。
35.一种宿主细胞,所述宿主细胞包含表达模块,所述表达模块包含表达载体,所述表达载体具有编码至少一种优化的脱辅基类胡萝卜素或类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接。
36.根据项目35所述的宿主细胞,其中所述至少一种优化的脱辅基类胡萝卜素生成酶选自crtY、CCD1、CCD2、CCD4、BCDO、LcyE、blh或ybbO。
37.根据项目36所述的宿主细胞,其中所述优化的基因产物选自由以下组成的组:ΔN50-LsLcyE和TrxA-桂花CCD1;crtY和phCCD1;ΔN50-LsLcyE;crtY和blh;以及crtY、blh和ybbO。
38.根据项目37所述的宿主细胞,其中所述桂花CCD1包含以下突变中的一种或更多种:N154Y、M152T、L151F。
39.根据项目26至38中任一项所述的宿主细胞,所述宿主细胞还包含:
第一表达模块,所述第一表达模块包含具有第一编码区的表达载体,所述第一编码区编码选自atoB、hmgS、thmgR和任选的crtY的一种或更多种优化的第一基因产物,所述第一编码区与启动子可操作地连接;
第二表达模块,所述第二表达模块包含具有第二编码区的表达载体,所述第二编码区编码选自mevK、pmk、pmd或idi的一种或更多种优化的第二基因产物,所述第二编码区与启动子可操作地连接;
第三表达模块,所述第三表达模块包含具有第三编码区的表达载体,所述第三编码区编码选自ispA、crtE、crtB或crtI的一种或更多种优化的第三基因产物,所述第三编码区与启动子可操作地连接。
40.根据项目26至39中任一项所述的宿主细胞,其中所述宿主细胞是选自BL21DE3或MG1655 DE3的大肠杆菌。
41.一种载体,所述载体编码选自atoB、hmgS、thmgR和任选的crtY的与启动子可操作地连接的一种或更多种优化的基因产物。
42.一种载体,所述载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的基因产物。
43.一种载体,所述载体编码选自ispA、crtE、crtB或crtI的与启动子可操作地连接的一种或更多种优化的基因产物。
44.一种载体,所述载体编码选自crtY、CCD1、BCDO、LcyE、blh或ybbO的与启动子可操作地连接的一种或更多种优化的基因产物。
45.根据项目44所述的载体,其中所述优化的基因产物选自由以下组成的组:ΔN50-LsLcyE和TrxA-桂花CCD1;crtY和phCCD1;ΔN50-LsLcyE;crtY和blh;以及crtY、blh和ybbO。
46.根据项目45所述的载体,其中所述桂花CCD1包含以下突变中的一种或更多种:N154Y、M152T、L151F。
47.一种系统,所述系统用于生产类胡萝卜素或脱辅基类胡萝卜素,所述系统包括表达模块,所述表达模块包含表达载体,所述表达载体具有编码至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接,其中所述至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶选自:
a.用于生产α-紫罗酮的ΔN50-LsLcyE和TrxA-桂花CCD1;或
b.用于生产β-紫罗酮的crtY和phCCD1;或
c.用于生产ε-胡萝卜素的ΔN50-LsLcyE;或
d.用于生产视黄醛的crtY和blh;或
e.用于生产视黄醇的crtY、blh和ybbO。
48.根据项目47所述的系统,所述系统还包括:
第一表达模块,所述第一表达模块包含具有第一编码区的表达载体,所述第一编码区编码选自atoB、hmgS、thmgR和任选的crtY的一种或更多种优化的第一基因产物,所述第一编码区与启动子可操作地连接;
第二表达模块,所述第二表达模块包含具有第二编码区的表达载体,所述第二编码区编码选自mevK、pmk、pmd或idi的一种或更多种优化的第二基因产物,所述第二编码区与启动子可操作地连接;
第三表达模块,所述第三表达模块包含具有第三编码区的表达载体,所述第三编码区编码选自ispA、crtE、crtB或crtI的一种或更多种优化的第三基因产物,所述第三编码区与启动子可操作地连接。
49.一种试剂盒,所述试剂盒在根据项目1至34中任一项所述方法中使用时用于生产脱辅基类胡萝卜素或类胡萝卜素,所述试剂盒包含以下的一种或更多种:
第一载体,所述第一载体编码选自atoB、hmgS、thmgR和任选的crtY的与启动子可操作地连接的一种或更多种优化的第一基因产物;
第二载体,所述第二载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的第二基因产物;
第三载体,所述第三载体编码选自ispA、crtE、crtB或crtI的与启动子可操作地连接的一种或更多种优化的第三基因产物;和
第四载体,所述第四载体编码选自以下的一种或更多种优化的基因产物:
a.用于生产α-紫罗酮的与启动子可操作地连接的ΔN50-LsLcyE和TrxA-桂花CCD1;或
b.用于生产β-紫罗酮的与启动子可操作地连接的crtY和phCCD1;或
c.用于生产ε-胡萝卜素的与启动子可操作地连接的ΔN50-LsLcyE;或
d.用于生产视黄醛的与启动子可操作地连接的crtY和blh;或
e.用于生产视黄醇的crtY、blh和ybbO。
50.一种用于生产类胡萝卜素或脱辅基类胡萝卜素的方法,所述方法包括以下步骤:
a.在化学成分确定的培养基中使根据项目35至40中任一项所述的宿主细胞与用于类胡萝卜素或脱辅基类胡萝卜素生产的底物接触;
b.在所述化学成分确定的培养基中孵育所述宿主细胞以产生一种或更多种预先选择的类胡萝卜素或脱辅基类胡萝卜素;和
c.使用有机层从所述化学成分确定的培养基中提取所述一种或更多种预先选择的类胡萝卜素或脱辅基类胡萝卜素。
51.根据项目50所述的方法,其中所述有机层是椰子油或大豆油。
52.根据项目50或51所述的方法,其中所述脱辅基类胡萝卜素选自α-紫罗酮、β-紫罗酮、假性紫罗酮(或ψ-紫罗酮)、羟基紫罗酮、β-环柠檬醛、反式香叶基丙酮、6-甲基-5-庚烯-2-酮(MHO)、视黄醛、视黄醇、8’,10-二阿朴胡萝卜素-8’,10-二醛(C17)或10’,6-二阿朴胡萝卜素-10’,6-二醛(C19),并且其中所述类胡萝卜素选自八氢番茄红素、番茄红素、α-胡萝卜素、γ-胡萝卜素、δ-胡萝卜素、ε-胡萝卜素或β-胡萝卜素。
53.一种试剂盒,所述试剂盒在根据项目1至34中任一项所述的方法中使用时用于生产类胡萝卜素,所述试剂盒包含以下的一种或更多种:第一载体,所述第一载体编码选自atoB、hmgS、thmgR的一种或更多种优化的第一基因产物;第二载体,所述第二载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的第二基因产物;第三载体,所述第三载体编码选自ispA、crtE或crtB、任选地crtI的与启动子可操作地连接的一种或更多种优化的第三基因产物,其用于生产八氢番茄红素或番茄红素。
定义
如本文所使用的,术语“编码区”,也称为编码序列或CDS(来自编码DNA序列),是编码蛋白的由外显子组成的DNA或RNA的部分。
如本文所使用的,“操纵子(operon)”是指作为单个转录单位起作用的基因或DNA区段的组。它可以包含操纵基因(operator)、启动子和一个或更多个被转录为一个多顺反子mRNA的结构基因。
附图说明
当结合非限制性实例和附图考虑时,参考详细描述,本发明将被更好地理解,在附图中:
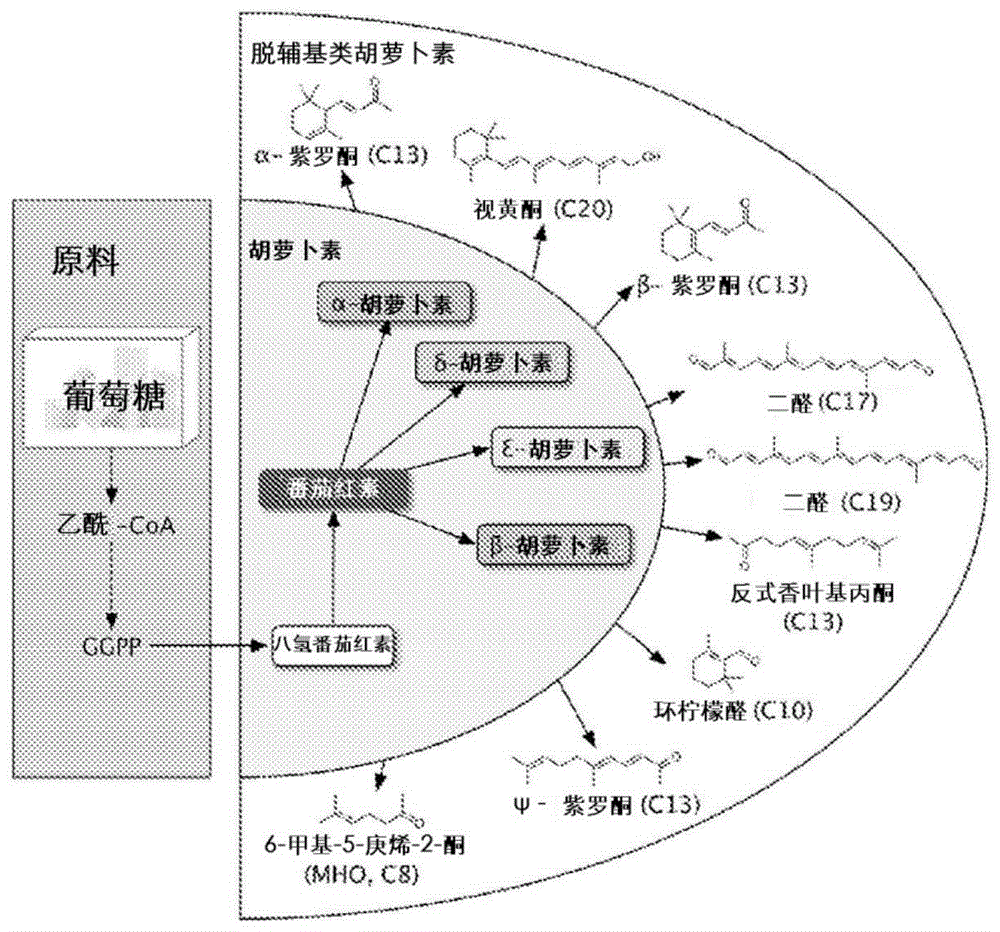
图1是用于胡萝卜素和脱辅基类胡萝卜素的生物合成的“即插即用(plug-n-play)”平台的图。原料是廉价的糖(例如葡萄糖)或甘油。该平台可生产各种胡萝卜素(八氢番茄红素、番茄红素、α-胡萝卜素、β-胡萝卜素、δ-胡萝卜素和ε-胡萝卜素)和脱辅基类胡萝卜素(α-紫罗酮、β-紫罗酮、ψ-紫罗酮、视黄醇、二醛(C17和C19)、香叶基丙酮、β-环柠檬醛和6-甲基-5-庚烯-2-酮(MHO))。
图2是用于胡萝卜素合成的表达模块的示意图。上游MVA途径(表达模块1)、下游MVA途径(模块2)、八氢番茄红素或番茄红素途径(表达模块3)、胡萝卜素途径(表达模块4)。表达的基因编码以下酶:atoB,乙酰乙酰-CoA硫解酶;hmgS,HMG-CoA合成酶;thmgR,截短的HMG-CoA还原酶;mevk,甲羟戊酸激酶;pmk,磷酸甲羟戊酸激酶;pmd,甲羟戊酸焦磷酸脱羧酶;idi,IPP异构酶;ispA,FPP合成酶;crtE,GGPP合成酶;crtB,八氢番茄红素合成酶;crtI,八氢番茄红素去饱和酶;crtY,番茄红素-β-环化酶;LCYe,番茄红素-ε-环化酶。化合物的缩写:G3P,D-3-磷酸甘油醛;DHAP,磷酸二羟丙酮;HMG-CoA,3-羟基-3-甲基-戊二酰辅酶A;MVA,甲羟戊酸;MVAP,磷酸甲羟戊酸;MVAPP,二磷酸甲羟戊酸;IPP,异戊烯焦磷酸;DMAPP,二甲基烯丙基焦磷酸;HMBPP,(E)-4-羟基-3-甲基-丁-2-烯基焦磷酸;GPP,香叶基焦磷酸;FPP,法呢基焦磷酸;GGPP,香叶基香叶基焦磷酸。虚线箭头表示多个酶促步骤。
图3显示了各种类胡萝卜素的UV吸收光谱。示出UV-B和UV-A波长。
图4显示了使用实验设计辅助系统途径优化(an experimental design-aidedsystematic pathway optimization;EDASPO)方法通过用T7启动子变体控制SAR、MPPI和EBIA模块来优化八氢番茄红素生产。数字代表T7启动子变体的不同强度,其中1、2和3分别代表天然T7启动子强度的约92%、37%和16%。表达模块1或SAR模块,hmgS-atoB-hmgR;表达模块2或MPPI模块,mevK、pmk、pmd和idi;表达模块3或EBA模块,八氢番茄红素生物合成途径(crtEB和ispA)。
图5显示了使用EDASPO方法通过用T7启动子变体控制SAR、MPPI和EBIA模块来优化八氢番茄红素生产。数字代表T7启动子变体的不同强度,其中1、2和3分别代表天然T7启动子强度的约92%、37%和16%。表达模块1或SAR模块,hmgS-atoB-hmgR;表达模块2或MPPI模块,mevK、pmk、pmd和idi;表达模块3或EBIA模块,番茄红素生物合成途径(crtEBI和ispA)。
图6显示了积累番茄红素的大肠杆菌(E.coli)菌株中ε-胡萝卜素的生产。表达不同形式的LCYe酶的菌株的类胡萝卜素生产。不同菌株的启动子和调节的基因的图示。测试了来自莴苣(Lactuca sativa)的不同N-末端截短的LCYe。缩写如下。LL,来自莴苣的野生型LCYe酶;L25,去除前25个氨基酸的LCYe酶;L34,去除前34个氨基酸的LCYe酶;L50,去除前50个氨基酸的LCYe酶;L75,去除前75个氨基酸的LCYe酶;L92,去除前92个氨基酸的LCYe酶;L100,去除前100个氨基酸的LCYe酶。参见表3中的菌株描述。所有测量值均为三次重复的平均值,其中标准误差条在图中示出。还示出最终总类胡萝卜素(番茄红素+δ-胡萝卜素+ε-胡萝卜素)中ε-胡萝卜素的百分比。
图7显示了具有N-末端修饰的LsLcyE和OfCCD1的蛋白和mRNA表达分析。(A)具有各种N-末端修饰的LsLcyE和OfCCD1的全细胞蛋白表达的SDS-PAGE凝胶图像。用蓝色箭头指示感兴趣的蛋白。泳道1:具有过表达的LsLCYe的大肠杆菌细胞。泳道2:具有过表达的Δ50-LsLCYe(L50)的大肠杆菌细胞。泳道3:具有过表达的Δ100-LsLCYe(L100)的大肠杆菌细胞。泳道4:具有过表达的OfCCD1的大肠杆菌细胞。泳道5:具有过表达的SUMO-OfCCD1(SUMO-O)的大肠杆菌细胞。泳道6:具有过表达的MBP-OfCCD1(MBP-O)的大肠杆菌细胞。泳道7:具有过表达的TrxA-OfCCD1(TrxA-O)的大肠杆菌细胞。泳道8:没有任何过表达物的大肠杆菌细胞(对照)。过表达的蛋白产量的定量分析基于SDS PAGE凝胶上的条带强度。(B)具有各种N-末端截短的LsLCYe表达。(C)LsLCYe及其截短形式的mRNA表达水平。(D)具有不同融合伴侣(partner)的OfCCD1表达。(E)具有不同融合蛋白的OfCCD1的mRNA表达水平。通过LsLCYe(B和C)和SUMO-OfCCD1(D和E)的表达归一化蛋白表达的相对倍数变化。结果是三次重复的平均值,其中标准误差条被示出。
图8是脱辅基类胡萝卜素(例如α、β-紫罗酮和类视黄醇)的生物合成途径的示意图。生物合成途径被分组为四个主要模块:上游MVA途径(表达模块1)、下游MVA途径(表达模块2)、番茄红素途径(表达模块3)和脱辅基类胡萝卜素途径(表达模块4)。表达的基因编码以下酶:atoB,乙酰乙酰-CoA硫解酶;hmgS,HMG-CoA合成酶;thmgR,截短的HMG-CoA还原酶;mevk,甲羟戊酸激酶;pmk,磷酸甲羟戊酸激酶;pmd,甲羟戊酸焦磷酸脱羧酶;idi,IPP异构酶;ispA,FPP合成酶;crtE,GGPP合成酶;crtB,八氢番茄红素合成酶;crtI,八氢番茄红素去饱和酶;LCYe,番茄红素ε-环化酶;crtY,番茄红素β-环化酶;CCD1,类胡萝卜素裂解双加氧酶;BCDO(或blh),β-胡萝卜素双加氧酶;ybbO,NADP+依赖性醛还原酶。化合物的缩写:G3P,D-3-磷酸甘油醛;DHAP,磷酸二羟丙酮;HMG-CoA,3-羟基-3-甲基-戊二酰辅酶A;MVA,甲羟戊酸;MVAP,磷酸甲羟戊酸;MVAPP,二磷酸甲羟戊酸;IPP,异戊烯焦磷酸;DMAPP,二甲基烯丙基焦磷酸;HMBPP,(E)-4-羟基-3-甲基-丁-2-烯基焦磷酸;GPP,香叶基焦磷酸;FPP,法呢基焦磷酸;GGPP,香叶基香叶基焦磷酸。虚线箭头表示多个酶促步骤。
图9显示了积累ε-胡萝卜素的大肠杆菌菌株中α-紫罗酮的生产。(A)具有N-末端融合伴侣(FP)的CCD1的优化,补充具有不同y轴比例的插入图片以对菌株121-LO和121-L50-O的紫罗酮滴度进行比较。(B)保持未被切割的细胞内类胡萝卜素。(C)不同菌株的启动子和调节的基因的图示。缩写如下。LO、LsLCYe和OfCCD1以多顺反子方式在同一质粒上表达;L50-O(去除前50个氨基酸的LsLCYe酶(L50))和OfCCD1以多顺反子方式表达。L50-SUMO-O、L50和SUMO融合的OfCCD1被共表达。L50-MBP-O、L50和MBP融合的OfCCD1被共表达。L50-TrxA-O、L50和TrxA融合的OfCCD1被共表达。
图10显示了具有N-末端修饰的OfCCD1的蛋白溶解性。感兴趣的蛋白用箭头示出。泳道1:不可溶的OfCCD1。泳道2:可溶的OfCCD1。泳道3:不可溶的SUMO-OfCCD1。泳道4:可溶的SUMO-OfCCD1。泳道5:不可溶的MBP-OfCCD1。泳道6:可溶的MBP-OfCCD1。泳道7:不可溶的TrxA-OfCCD1。泳道6:可溶的TrxA-OfCCD1。
图11显示了基于来自玉米(Zea mays)的viviparous14的晶体结构的OfCCD1的同源建模(PDB:3NPE)。两个膜相互作用螺旋被标记出。膜由阴影区域表示。辅因子Fe
图12显示了OfCCD1的第二膜相互作用螺旋的工程化。(A)野生型ofCCD1和具有突变(L151F、M152T和N154Y)的工程化ofCCD1之间的α-紫罗酮和ψ-紫罗酮的滴度比较。(B)工程化菌株的生物质。(C)TrxA融合的野生型OfCCD1和trxA融合的突变体OfCCD1的溶解性和总表达的倍数变化。(D)TrxA融合的野生型OfCCD1和trxA融合的突变体OfCCD1的SDS PAGE凝胶图像。泳道M,分子标志物。泳道1,表达trxA融合的野生型OfCCD1的大肠杆菌细胞的总蛋白。泳道2,表达trxA融合的野生型OfCCD1的大肠杆菌细胞的可溶的蛋白。泳道3,表达trxA融合的突变体OfCCD1的大肠杆菌细胞的总蛋白。泳道4,表达trxA融合的突变体OfCCD1的大肠杆菌细胞的可溶的蛋白。
图13显示了脱辅基类胡萝卜素的补料分批发酵(fed-batch fermentation)。(A)紫罗酮和生物质的时间进程曲线。(B)用于在补料分批发酵中使用的菌株的启动子和调节的基因的图示。该过程由两个主要阶段(通过诱导分离)组成,仅积累生物质的生物质阶段和同时产生紫罗酮和生物质的生产阶段。肉豆蔻酸异丙酯被用作有机层来提取α-紫罗酮、β-紫罗酮和ψ-紫罗酮。(C)生物反应器中脱辅基类胡萝卜素的原位分离的图示。食品级椰子油(或大豆油等)作为有机层来提取α-紫罗酮、β-紫罗酮和ψ-紫罗酮。使用不含任何氨基酸和维生素的化学成分确定的培养基来降低培养基的成本。
图14显示了α-紫罗酮的手性分析。产物是α-紫罗酮的100% R-对映体,与天然α-紫罗酮相同。相比之下,化学合成的紫罗酮是50% R-对映体和50% S-对映体的混合物。
图15显示了用于生产β-紫罗酮的代谢工程策略。对野生型OfCCD1、N-末端修饰的OfCCD1和补充crtY进行比较。在Of、TOf和crtY菌株中,分别表达了操纵子/基因crtY-OfCCD1、crtY-TrxA-OfCCD1和crtY。在TOf+Y菌株中,在p15A-spec载体中补充另外拷贝的crtY基因。(A)工程化菌株中的紫罗酮生产。菌株crtY是不表达CCD1基因的对照菌株,因此仅产生β-胡萝卜素。(B)工程化菌株中积累的类胡萝卜素。(C)工程化菌株的生物质。尽管硫氧还蛋白融合未能改善β-紫罗酮的生产,但它导致副产物ψ-紫罗酮的产量增加了37倍,该ψ-紫罗酮通过TOfCCD1从番茄红素转化获得。补充另外的crtY有效地将更多的番茄红素转化为β-胡萝卜素,因此β-紫罗酮的生产显著提高并且ψ-紫罗酮显著降低。
图16显示了Of、TOf和TOf+Y菌株中产物的GC-色谱图。
图17显示了α-紫罗酮、β-紫罗酮和ψ-紫罗酮的质谱。
图18显示了本研究中不同CCD1变体的比对。通过Clustal Omega多重序列比对工具进行比对。关于CCD1的信息总结在表4中。
图19显示了具有更高选择性的CCD的筛选。(A)使用不同CCD的紫罗酮生产。(B)具有不同CCD的大肠杆菌细胞中积累的类胡萝卜素。在TOf、At、Vv、Ph、TPh菌株中,分别表达操纵子/基因crtY-TrxA-OfCCD1、crtY-AtCCD1、crtY-VvCCD1、crtY-PhCCD1和crtY-TrxA-PhCCD1。在Ph+Y和TPh+Y菌株中,在p15A-spec载体中补充另外拷贝的crtY基因。发现PhCCD1而不是VvCCD1和OfCCD1对β-胡萝卜素的选择性高于番茄红素,因此产生更高滴度的紫罗酮和更低量的ψ-紫罗酮。(C)用菌株TPh+Y的β-紫罗酮补料分批发酵。(D)不同菌株的启动子和调节的基因的图示。
图20显示了在发酵罐中产生的二醛和二醇的质谱。检测到二醛和二醇的C17和C19,但未检测到C14。
图21显示了具有更高活性和选择性的CCD2和CCD4的筛选。上图显示了使用β-胡萝卜素作为β-紫罗酮生产的底物。下图显示了使用胡萝卜素作为α-紫罗酮生产的底物。
图22显示了模块化系统中类视黄醇的生产。(A)使用不同的blh基因和增加的基因拷贝的crtY的类视黄醇生产。(B)不同大肠杆菌细胞中积累的类胡萝卜素。为了生产其他脱辅基类胡萝卜素,我们可以仅将CCD1酶替换为其他相应的类胡萝卜素裂解加氧酶。此处,我们使用BCDO(blh)来生产类视黄醇。(C)用于生产不同脱辅基类胡萝卜素的模块化系统的概述图示。
具体实施方式
在第一方面,本发明涉及用于生产类胡萝卜素或脱辅基类胡萝卜素的方法。方法包括以下步骤:在宿主细胞中表达表达模块,所述表达模块包含表达载体,所述表达载体具有编码至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接。
类胡萝卜素可以选自八氢番茄红素、番茄红素、α-胡萝卜素、γ-胡萝卜素、δ-胡萝卜素、ε-胡萝卜素或β-胡萝卜素,并且其中脱辅基类胡萝卜素可以选自α-紫罗酮、β-紫罗酮、假性紫罗酮(或ψ-紫罗酮)、羟基紫罗酮、β-环柠檬醛、反式香叶基丙酮、6-甲基-5-庚烯-2-酮(MHO)、视黄醛、视黄醇、8’,10-二阿朴胡萝卜素(diapocarotene)-8’,10-二醛(C17)或10’,6-二阿朴胡萝卜素-10’,6-二醛(C19)。
番茄红素环化酶可以选自lycE或crtY或其截短的形式。
如本文所描述的,至少一种优化的脱辅基类胡萝卜素生成酶可以选自crtY、CCD1、CCD2、CCD4、BCDO、LcyE、blh或ybbO。
CCD2可以选自CaCCD2或CsCCD2。CCD4可以选自由以下组成的组:AtCCD4、BoCCD4b、CmCCD4、CsCCD4a、MaCCD4、MdCCD4、OfCCD4、PpCCD4、RdCCD4和VvCCD4a。
在一个实施方案中,脱辅基类胡萝卜素可以是α-紫罗酮,并且至少一种优化的脱辅基类胡萝卜素生成酶可以选自LcyE和CCD1,并且可以形成具有以下结构的操纵子:LcyE-CCD1。
在一些实施方案中,LcyE可以源自莴苣并且是N-末端截短的(范围为LsLcyE的1至100个氨基酸,特别是ΔN50-LsLcyE)。
CCD1可以被表达为选自TrxA-CCD1、SUMO-CCD1或MBP-CCD1的融合蛋白。
在一些实施方案中,融合蛋白是TrxA-CCD1。融合蛋白可以选自TrxA-桂花CCD1或TrxA-矮牵牛CCD1。
在一些实施方案中,CCD1可以源自桂花或可以是桂花CCD1(OfCCD1)。在一些实施方案中,如本文所描述的OfCCD1可以在氨基酸位置F148至I167之间进行优化。特别地,OfCCD1可以包含一个或更多个以下突变:N154Y、M152T、L151F。
在一些实施方案中,方法可以包括针对在24小时的时间段内从10至1000mg/L、从200到800mg/L、从300到700mg/L、从400至600mg/L的量的α-紫罗酮表达水平进行筛选。在一些实施方案中,α-紫罗酮的量为在24小时的时间段内约500mg/L。
在一些实施方案中,脱辅基类胡萝卜素是β-紫罗酮。至少一种优化的脱辅基类胡萝卜素生成酶可以选自crtY和CCD1,并且可以形成具有结构crtY-CCD1的操纵子。在一些实施方案中,如本文所描述的crtY可以源自菠萝泛菌(Pantoea ananatis)。
在一些实施方案中,如本文所描述的CCD1可以源自矮牵牛(PhCCD1)。
在一些实施方案中,方法还可以包括针对在24小时的时间段内从10至1000mg/L、从200到800mg/L、从300到700mg/L、从400至600mg/L的量的β-紫罗酮表达水平进行筛选。在一些实施方案中,α-紫罗酮的量为在24小时的时间段内约500mg/L。
脱辅基类胡萝卜素可以是视黄醛或视黄醇。在一个实施方案中,脱辅基类胡萝卜素可以是视黄醛。至少一种优化的脱辅基类胡萝卜素生成酶可以选自crtY和blh,并且可以形成具有结构crtY-blh的操纵子。在一些实施方案中,脱辅基类胡萝卜素可以是视黄醇。至少一种优化的脱辅基类胡萝卜素生成酶可以选自crtY、blh或ybbO,并且可以形成具有结构crtY-blh-ybbO的操纵子。在一些实施方案中,如本文所描述的crtY可以源自菠萝泛菌。在一些实施方案中,如本文所描述的blh可以源自未培养海洋细菌(Uncultured marinebacterium)HF10_19P19。在一些实施方案中,方法还可以包括针对在24小时的时间段内从10至1000mg/L、从200到800mg/L、从300到700mg/L、从400至600mg/L的量的视黄醛表达水平进行筛选。在一些实施方案中,α-紫罗酮的量为在24小时的时间段内约500mg/L。
类胡萝卜素可以是ε-胡萝卜素。至少一种优化的类胡萝卜素生成酶可以是LcyE。在一些实施方案中,LcyE可以源自莴苣(LsLcyE)并且可以是N-末端截短的。在一些实施方案中,LsLcyE可以包含1-100个氨基酸、30-70个氨基酸或40-60个氨基酸的N-末端截短。在一些实施方案中,LsLcyE包含50个氨基酸的N-末端截短(ΔN50-LsLcyE)。
在一些实施方案中,方法还可以包括在所述宿主细胞中表达:第一表达模块,所述第一表达模块包含具有第一编码区的表达载体,所述第一编码区编码选自atoB、hmgS、thmgR和任选的crtY的一种或更多种优化的第一基因产物,所述第一编码区与启动子可操作地连接;第二表达模块,所述第二表达模块包含具有第二编码区的表达载体,所述第二编码区编码选自mevK、pmk、pmd或idi的一种或更多种优化的第二基因产物,所述第二编码区与启动子可操作地连接;第三表达模块,所述第三表达模块包含具有第三编码区的表达载体,所述第三编码区编码选自ispA、crtE、crtB或crtI的一种或更多种优化的第三基因产物,所述第三编码区与启动子可操作地连接。
在一些实施方案中,一种或更多种第一基因产物可以形成具有以下结构的操纵子:atoB-hmgS-thmgR。
在一些实施方案中,一种或更多种第一基因产物可以形成具有以下结构的操纵子:crtY-atoB-hmgS-thmgR。
在一些实施方案中,一种或更多种第二基因产物可以形成具有以下结构的操纵子:mevK-pmk-pmd-idi。
在一些实施方案中,一种或更多种第三基因产物可以形成具有以下结构的操纵子:crtE-crtB-ispA。
在一些实施方案中,一种或更多种第三基因产物可以形成具有以下结构的操纵子:crtE-crtB-crtI-ispA。
如本文所描述的宿主细胞可以是选自BL21 DE3或MG1655 DE3的大肠杆菌(Escherichia coli)。
启动子可以选自TM1、TM2或TM3、T7 RNA聚合酶启动子、T5 RNA聚合酶启动子、T3RNA聚合酶启动子、SP6 RNA聚合酶启动子或诱导型启动子中的一种或更多种。
在一些实施方案中,脱辅基类胡萝卜素生成酶的优化和优化的基因产物通过密码子优化或定点诱变来实现。
在另一方面,提供了宿主细胞,所述宿主细胞包含表达模块,所述表达模块包含表达载体,所述表达载体具有编码至少一种优化的脱辅基类胡萝卜素或类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接。
在一些实施方案中,至少一种优化的脱辅基类胡萝卜素生成酶可以选自crtY、CCD1、CCD2、CCD4、BCDO、LcyE、blh或ybbO。
宿主细胞还可以包含第一表达模块,所述第一表达模块包含具有第一编码区的表达载体,所述第一编码区编码选自atoB、hmgS、thmgR和任选的crtY的一种或更多种优化的第一基因产物,所述第一编码区与启动子可操作地连接;第二表达模块,所述第二表达模块包含具有第二编码区的表达载体,所述第二编码区编码选自mevK、pmk、pmd或idi的一种或更多种优化的第二基因产物,所述第二编码区与启动子可操作地连接;第三表达模块,所述第三表达模块包含具有第三编码区的表达载体,所述第三编码区编码选自ispA、crtE、crtB或crtI的一种或更多种优化的第三基因产物,所述第三编码区与启动子可操作地连接。
在另一方面,提供了载体,所述载体编码选自atoB、hmgS、thmgR和任选的crtY的与启动子可操作地连接的一种或更多种优化的基因产物。
在另一方面,提供了载体,所述载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的基因产物。
在另一方面,提供了载体,所述载体编码选自ispA、crtE、crtB或crtI的与启动子可操作地连接的一种或更多种优化的基因产物。
在另一方面,提供了载体,所述载体编码选自crtY、CCD1、BCDO、LcyE、blh或ybbO的与启动子可操作地连接的一种或更多种优化的基因产物。
在一些实施方案中,优化的基因产物可选自由以下组成的组:ΔN50-LsLcyE和TrxA-桂花CCD1;crtY和phCCD1;ΔN50-LsLcyE;crtY和blh;以及crtY、blh和ybbO。
在另一方面,提供了用于生产类胡萝卜素或脱辅基类胡萝卜素的系统,所述系统包含表达模块,所述表达模块包含表达载体,所述表达载体具有编码至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶的编码区,所述编码区与启动子可操作地连接,其中所述至少一种优化的类胡萝卜素或脱辅基类胡萝卜素生成酶选自:a.用于生产α-紫罗酮的ΔN50-LsLcyE和TrxA-桂花CCD1;或b.用于生产β-紫罗酮的crtY和phCCD1;或c.用于生产ε-胡萝卜素的ΔN50-LsLcyE;或d.用于生产视黄醛或视黄醇的crtY和blh;或e.用于生产视黄醇的crtY、blh和ybbO。
在一些实施方案中,系统还可以包含:第一表达模块,所述第一表达模块包含具有第一编码区的表达载体,所述第一编码区编码选自atoB、hmgS、thmgR和任选的crtY的一种或更多种优化的第一基因产物,所述第一编码区与启动子可操作地连接;第二表达模块,所述第二表达模块包含具有第二编码区的表达载体,所述第二编码区编码选自mevK、pmk、pmd或idi的一种或更多种优化的第二基因产物,所述第二编码区与启动子可操作地连接;第三表达模块,所述第三表达模块包含具有第三编码区的表达载体,所述第三编码区编码选自ispA、crtE、crtB或crtI的一种或更多种优化的第三基因产物,所述第三编码区与启动子可操作地连接。
在另一方面,提供了试剂盒,所述试剂盒在如本文所描述的方法中使用时用于生产类胡萝卜素或脱辅基类胡萝卜素,所述试剂盒包含以下的一种或更多种:第一载体,所述第一载体编码选自atoB、hmgS、thmgR的一种或更多种优化的第一基因产物;第二载体,所述第二载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的第二基因产物;第三载体,所述第三载体编码选自ispA、crtE或crtB、任选地crtI的与启动子可操作地连接的一种或更多种优化的第三基因产物,其用于生产八氢番茄红素或番茄红素。
在另一方面,提供了试剂盒,所述试剂盒在如本文所描述的方法中使用时用于生产脱辅基类胡萝卜素或类胡萝卜素,所述试剂盒包含以下的一种或更多种:第一载体,所述第一载体编码选自atoB、hmgS、thmgR和任选地crtY的与启动子可操作地连接的一种或更多种优化的第一基因产物;第二载体,所述第二载体编码选自mevK、pmk、pmd或idi的与启动子可操作地连接的一种或更多种优化的第二基因产物;第三载体,所述第三载体编码选自ispA、crtE、crtB或crtI的与启动子可操作地连接的一种或更多种优化的第三基因产物;和第四载体,所述第四载体编码选自以下的一种或更多种优化的基因产物:a.用于生产α-紫罗酮的与启动子可操作地连接的ΔN50-LsLcyE和TrxA-桂花CCD1;或b.用于生产β-紫罗酮的与启动子可操作地连接的crtY和phCCD1;或c.用于生产ε-胡萝卜素的与启动子可操作地连接的ΔN50-LsLcyE;或d.用于生产视黄醛的与启动子可操作地连接的crtY和blh;或e.用于生产视黄醇的crtY、blh和ybbO。
在另一方面,提供了用于生产脱辅基类胡萝卜素或类胡萝卜素的方法,所述方法包括以下步骤:a.使如本文描述的宿主细胞在化学成分确定的培养基中与用于脱辅基类胡萝卜素或类胡萝卜素生产的底物接触;b.在所述化学成分确定的培养基中孵育宿主细胞以产生一种或更多种预先选择的脱辅基类胡萝卜素或类胡萝卜素;和c.使用有机层从化学成分确定的培养基中提取一种或更多种预先选择的脱辅基类胡萝卜素或类胡萝卜素。
在一些实施方案中,有机层可以是椰子油或大豆油或其他食用油。
在一些实施方案中,脱辅基类胡萝卜素可以选自α-紫罗酮、β-紫罗酮、假性紫罗酮(或ψ-紫罗酮)、羟基紫罗酮、反式香叶基丙酮、6-甲基-5-庚烯-2-酮(MHO)、视黄醛、视黄醇、8’,10-二阿朴胡萝卜素-8’,10-二醛(C17)或10’,6-二阿朴胡萝卜素-10’,6-二醛(C19),并且其中类胡萝卜素可以选自八氢番茄红素、番茄红素、α-胡萝卜素、γ-胡萝卜素、δ-胡萝卜素、ε-胡萝卜素或β-胡萝卜素。
本文示例性地描述的本发明可以在不存在本文未具体公开的任何一个或更多个要素、一个或更多个限制的情况下被适当地实施。因此,例如,术语“包括/包含/含有(comprising)”、“包括/包含/含有(including)”、“包括/包含/含有(containing)”等应被广泛地理解,而非限制性的。另外,本文采用的术语和表述被用作描述性而非限制性的术语,并且在这些术语和表述的使用方面,不预期排除所示出的和所描述的特征的任何等同物或其部分,相反,应认识到在所要求保护的发明的范围内,各种修改形式是可能的。因此,应理解,尽管已经通过优选的实施方案和任选的特征具体公开了本发明,但是本领域技术人员可以采用本文公开的其中体现的本发明的修改形式和变化形式,并且这些修改形式和变化形式被认为是在本发明的范围内。
本文宽泛地和一般性地描述了本发明。落入通用公开内容中的每个较窄种类和亚属群组也构成本发明的一部分。这包括具有从该属中去除任何主题的附带条件或负面限制的本发明的一般描述,无论是否在本文中具体记载了被移除的材料。
其他实施方案在所附权利要求和非限制性实施例中。此外在根据马库什群组描述本发明的特征或方面时,,本领域技术人员将认识到,本发明从而也描述了马库什组的任何个体成员或成员亚组。
实验部分
本发明的非限制性实施例和比较实施例通过参考具体实施例将被更详细地进一步描述,这些实施例不应被解释为以任何方式限制本发明的范围。
材料与方法
在该研究中使用了大肠杆菌Bl21-Gold DE3菌株(Stratagene)。基因hmgS、hmgR、mevK、pmk和pmd(或MVD1)使用酿酒酵母(Saccharomyces cerevisiae)染色体DNA通过PCR来扩增。基因atoB和idi从大肠杆菌基因组DNA扩增。将所有基因克隆到两个质粒中,p15A-spec-hmgS-atoB-hmgR(L2-8)和p15A-cam-mevK-pmk-pmd-idi(L2-5)。将从pAC-LYC质粒扩增的番茄红素生物合成途径中的基因(crtEBI)引入p15A-kan-crtEBI-ispA质粒。来自莴苣的LCYe基因(LsLCYe酶)、来自菠萝泛菌的crtY基因、来自拟南芥(Arabidopsis thaliana)、桂花、葡萄(Vitis vinifera)和矮牵牛的CCD1基因以及来自未培养海洋细菌HF10_19P19的blh基因(blh1)和来自未培养海洋细菌66A03的blh基因(blh2)经密码子优化并由Integrated DNA Technologies合成。将LsLCYe基因和crtY基因首先分别克隆到质粒p15A-amp-LsLCYe(L2-9)和p15A-amp-crtY(L2-9)中。将OfCCD1基因插入p15A-amp-LsLCYe(L2-9)质粒中。随后将不同的CCD1或blh基因插入p15A-amp-crtY(L2-9)菌株中。从由IntegratedDNA Technologies合成的引物引入定点诱变。将另外拷贝的crtY插入p15A-spec-hmgS-atoB-hmgR(L2-8)质粒中。所有p15A质粒均源自pAC-LYC质粒。对p15A质粒起点中的RNA I的茎环结构进行突变以使质粒彼此兼容。T7启动子变体TM1、TM2和TM3总结于表1中。关于质粒和菌株的信息总结在表2和表3中。
表1总结了所使用的启动子序列。
表2总结了所使用的菌株和质粒。
/>
/>
/>
表3描述了本研究中所使用的菌株。
/>
/>
/>
培养基和培养条件
所有细胞均在补充有10g/L甘油、50mM 4-(2-羟乙基)-1-哌嗪乙磺酸酸(HEPES)的2XPY培养基(20g/L蛋白胨、10g/L酵母提取物和10g/LNaCl)中生长。对于延长的孵育(48h),还将5mg/L Tween80添加至培养基中以防止细胞聚集。简而言之,将10μL新鲜细胞培养物接种到14mL BD Falcon
类胡萝卜素和类视黄醇的定量
根据丙酮提取方法从细胞沉淀物(pellet)中提取细胞内类胡萝卜素。简而言之,收集10-50μL细菌培养物(取决于细胞中类胡萝卜素的含量)并离心。用PBS洗涤细胞沉淀物,并将其重悬在20μL水中,然后加入180μL丙酮。HPLC方法采用Agilent 1260Infinity LC系统,其配备有ZORBAX,Eclipse Plus C18,4.6mm X 250mm,5μm柱和二极管阵列检测器(DAD)。以1.5mL/min维持等度条件(50%甲醇、48%乙酸乙酯和2%水)持续5min。在450nm的波长检测类胡萝卜素。使用商业标准品(包含ε-胡萝卜素、β-胡萝卜素、番茄红素、视黄醇和视黄醛)生成标准曲线。通过将20-50μL有机层稀释到1000μL己烷中来制备细胞外类视黄醇样品并通过相同的HPLC系统进行分析。等度条件如下使用。流动相为95%甲醇和5%乙腈,且流速为1.5ml/min。类视黄醇在340nm的波长检测。
α-紫罗酮、β-紫罗酮和ψ-紫罗酮的定量
通过将20-50μL有机层稀释到1000μL己烷中来制备α-紫罗酮或β-紫罗酮样品。在配备有Agilent VF-WAXms柱和Agilent 7200精确质量四极杆飞行时间的Agilent 7980B气相色谱(GC/MS)上分析样品。在240℃以不分流模式进行样品注射。升温程序(ovenprogram)在100℃开始2min,然后温度以30℃/min升高至240℃并在240℃保持另外的2min。通过用商业标准品制备的标准曲线进行内插来计算紫罗酮浓度。质谱仪在EI模式下通过全扫描分析(m/z 30-300,1spetra/s)运行。
手性分析
用配备有Agilent Cyclosil-B GC柱和Agilent 7200精确质量四极杆飞行时间的Agilent 7980B气相色谱(GC/MS)分析来自样品的α-紫罗酮的手性。升温程序在80℃开始2min,然后温度以5℃/min升高至210℃,并以20℃/min升高至250℃,并且最后在250℃保持另外的2min。通过用商业标准品制备的标准曲线进行内插来计算紫罗酮浓度。质谱仪在EI模式下通过全扫描分析(m/z 30-300,2spetra/s)运行。
补料分批发酵
起始培养基是化学成分确定的改良培养基,其含有15g/L葡萄糖、2g/L(NH
实施例
通过“即插即用”生产胡萝卜素
实施例1.八氢番茄红素生产的优化
如本文所描述的“即插即用”平台从廉价的原料生产胡萝卜素和脱辅基类胡萝卜素(图1)。沿着重组途径维持高代谢通量是非常具有挑战性的,该重组途径在大肠杆菌细胞中同时过表达13种酶以生产胡萝卜素(图2)。紫外线-B(UVB,280-310nm)是最急剧的诱导皮肤损伤的阳光。无色胡萝卜素,八氢番茄红素,在280nm具有最大的UV吸光度(图3),使其成为用于局部UV防护剂的理想成分。八氢番茄红素是可以被进一步转化为各种C40类胡萝卜素的首个关键中间体。为了产生八氢番茄红素,将来自乙酰-CoA的生物合成途径分为三个表达模块(图2,模块1,上游甲羟戊酸途径,包括hmgS-atoB-hmgR;模块2,下游甲羟戊酸途径,包括mevK、pmk、pmd和idi;模块3,八氢番茄红素生物合成途径,包括crtEB和ispA),并通过EDASPO方法进行系统优化。简而言之,3个表达模块由具有不同强度的三种不同T7启动子变体控制,并且然后将八氢番茄红素产量与每个模块的启动子强度相关联,以找出每个表达模块的最佳转录范围(三元图(Ternary diagram),图4)。结果,鉴定出每个表达模块的最佳范围,并获得了优化的菌株(221菌株),其在摇瓶中生产~45mg/L或38,000ppm的八氢番茄红素(图4)。
实施例2.番茄红素生产的优化
番茄红素是另一种有价值的类胡萝卜素,其具有有效的抗氧化作用。生物合成途径极其长并且在异源微生物生产菌株中进行优化是具有挑战性的。本文,将途径分为三个不同模块(图2,模块1,上游甲羟戊酸途径,包括hmgS-atoB-hmgR;模块2,下游甲羟戊酸途径,包括mevK、pmk、pmd和idi;模块3,番茄红素生物合成途径,包括crtEBI和ispA),并通过EDASPO方法过量生产番茄红素。简而言之,3个表达模块由具有不同强度的三种不同T7启动子变体控制,并且然后将番茄红素产量与每个表达模块的启动子强度相关联,以找出每个表达模块的最佳转录范围(三元图,图5)。结果,鉴定出每个表达模块的最佳范围,并获得了优化的菌株(121菌株),其在摇瓶中生产~107mg/L或26,000ppm的番茄红素(图5)。将该番茄红素生产菌株用作亲本平台菌株,用于进一步生产下游类胡萝卜素和脱辅基类胡萝卜素。
实施例3.胡萝卜素生产的优化
基于亲本番茄红素过量生产菌株,可以引入第四生物合成表达模块(图2)。取决于crtY和LCYe的表达水平,可以生产α-胡萝卜素、β-胡萝卜素、δ-胡萝卜素、γ-胡萝卜素和ε-胡萝卜素(图2)。然而,已知ε-胡萝卜素在自然界中以非常低的水平积累。迄今为止,已知仅来自莴苣的LCYe(LsLCYe)优先从番茄红素形成双环ε-环。当野生型LsLCYe酶在番茄红素菌株(121菌株)中过表达时,产生δ-胡萝卜素(具有在一端的一个ε-环的胡萝卜素)和ε-胡萝卜素(具有在两端的两个ε-环的胡萝卜素)的混合物,其中超过70%的番茄红素未环化(0.1mM,图6)。ε-胡萝卜素的生产最初通过调节转录水平来优化,并通过中等IPTG诱导(0.03mM)获得最高量的ε-胡萝卜素。然而,最高的ε-胡萝卜素滴度仅为18mg/L(2500ppm),对应于总类胡萝卜素的小于30%(图6),表明LsLCYe酶的活性不足。
通过Phobius的结构预测显示了LsLCYe酶中可能的膜相互作用区(第104-128位氨基酸)和弱信号肽区(第1-30位氨基酸)。先前已经报道了参与膜相互作用和信号肽编码区的N-末端残基的修饰以增加重组蛋白的溶解性和活性。因此,检查了参与锚定至膜的N-末端序列的截短,以确定其是否会增加LsLCYe的催化效率。通过使用截短交叉铺设体外组装方法(the truncate cross-lapping in vitro assembly method)一次系统地去除50个残基来构建一系列N-末端截短的LsLCYe。当前50个氨基酸被去除时,酶表达水平增加~40%(图7A和B),其中伴随ε-胡萝卜素(>40mg/L,5500ppm和最终产物的80%)产生增加超过两倍(图6,121+L50菌株)。显著地,去除前100个残基(图6,121+L100菌株)导致蛋白浓度增加~140%(图7A和B)。然而,环化酶活性完全丢失。为了更好地理解截短如何影响LsLCYe表达,对截短的LsLCYe及其天然形式的转录水平和mRNA二级结构进行比较。结果表明,截短的LsLCYe的表达增加并未表现出是由于mRNA表达的显著增加(图7C)或是由于二级mRNA结构的修饰。
为了证明该模块化方法的更广泛的效用,通过用来自菠萝泛菌的番茄红素β环化酶(或crtY)的表达替换LCYe酶来生产其他脱辅基类胡萝卜素。与LsLCYe不同,天然番茄红素β环化酶活性高,并且将大于70%的番茄红素转化为β-胡萝卜素(65mg/L),具有残余量的番茄红素(24mg/L)(图15中的crtY菌株)。
通过“即插即用”生产类胡萝卜素
实施例4.α-紫罗酮生产的优化
通过模块化方法,可以将类胡萝卜素裂解加氧酶添加至第四表达模块以产生各种脱辅基类胡萝卜素(图8)。N-末端50个氨基酸被截去的LsLCYe(ΔN50-LsLCYe)被进一步研究用于α-紫罗酮生产。先前已经证明,来自桂花的CCD1(OfCCD1)可以在C9-C10位置裂解胡萝卜素以产生α-紫罗酮和β-紫罗酮。因此,将OfCCD1酶在ε-胡萝卜素菌株中过表达(图6中的121-LL和121-L50)。然而,即使菌株121-L50-O中ε-胡萝卜素的可用性增加,检测到的α-紫罗酮的量也小于500μg/L(图9A,插图)。如先前注意到的,番茄红素和ε-胡萝卜素分别是LsLCYe和ΔN50-LsLCYe过表达菌株中积累的主要中间体(图9B)。虽然mRNA被良好地检测到(图7E),SDS-PAGE分析显示,诱导后24小时几乎没有观察到任何OfCCD1蛋白(图7A和D)。结果表明,OfCCD1表达可能受到翻译不足的限制,这与先前针对其他CCD1过表达的研究一致。
文献表明,与谷胱甘肽-S-转移酶(GST)的融合将显著提高CCD1在大肠杆菌中的表达和溶解性。因此,检查融合伴侣对OfCCD1的功能表达的改善。测试了三种常用的N-末端融合伴侣,小泛素样修饰物(SUMO)蛋白、麦芽糖结合蛋白(MBP)和硫氧还蛋白(TrxA)。当与三种融合伴侣融合时,OfCCD1显著增加了α-紫罗酮的滴度(图9A)。其中,具有TrxA融合的OfCCD1(或TOfCCD1)的菌株能够以低诱导(0.03mM IPTG)产生29.7mg/Lα-紫罗酮,这是多于50倍的提高(图9A)。为了研究融合伴侣的潜在机制,通过变性SDS-PAGE凝胶进一步研究蛋白表达。在没有融合伴侣的情况下,OfCCD1几乎不可检测(图7A和D)。相比之下,与SUMO、MBP和TrxA融合的OfCCD1酶良好地表达。SUMO-,MBP-和TrxA-融合的OfCCD1的相对蛋白条带强度与它们在图9A中的对应α-紫罗酮产量良好相关。例如,表达TOfCCD1的菌株具有最佳表达并产生最高量的α-紫罗酮。进一步研究了融合伴侣对OfCCD1溶解性的影响。所有融合的CCD1都具有明显的可溶性级分(图10),然而,α-紫罗酮生产与SUMO-、MBP-和TrxA-融合的OfCCD1的溶解性之间没有明显的相关性。由于转录和mRNA二级结构保持相对相似,OfCCD1的表达增加可能是由于翻译效率的提高或蛋白稳定性的增加。有趣的是,即使使用最高的紫罗酮生产菌株(图9,121-L50-TrxA-O菌株,用0.03mM IPTG),ε-胡萝卜素和番茄红素(~30mg/L总类胡萝卜素)仍然积累到与α-紫罗酮相似的水平(图9B),表明α-紫罗酮产率可以被进一步提高。因此,实现了α-紫罗酮从500μg/L至29mg/L的生产的逐步提高。
为了进一步提高α-紫罗酮产率,使用同源建模来预测OfCCD1的3D结构(图11)。基于OfCCD1模型,存在两个膜相互作用螺旋。第一个螺旋位于蛋白的N-末端,且第二个螺旋被发现位于序列中(F148-I167)。序列比对表明,主要差异发生在亮氨酸-151、甲硫氨酸-152、天冬酰胺-154和异亮氨酸-167(图18)。通过同时将亮氨酸-151突变为苯丙氨酸、将甲硫氨酸-152突变为苏氨酸并将天冬酰胺-154突变为酪氨酸,α-紫罗酮滴度被进一步提高至~35mg/L(图12A)。蛋白表达分析显示,这些突变进一步提高了trxA融合的OfCCD1表达(图12C和D)。结果突出了CCD酶工程对于提高紫罗酮生产至关重要。
接下来,使用最好的α-紫罗酮生产菌株(121-L50-TrxA-O菌株)测试补料分批发酵中的性能。由于α-紫罗酮是挥发性的,在发酵过程中使用肉豆蔻酸异丙酯捕获化合物。如图13中所示,在48h内生产约480mg/L的α-紫罗酮。总之,实现了α-紫罗酮生产从最初的500μg/L至480mg/L的~1000倍增加。因此,在该研究中实现的α-紫罗酮滴度比先前报道的滴度高约1428倍。
此外,使生产的α-紫罗酮经历手性检查,并发现其是α-紫罗酮的100%R-对映体(图14),这与天然α-紫罗酮相同。相比之下,化学合成的紫罗酮是50% R-对映体和50% S-对映体的混合物。更重要的是,紫罗酮的不同对映体具有不同的气味和潜在的不同活性。结果清楚地显示了通过“即插即用”平台进行的生物合成优于化学合成的优势。
实施例5.β-紫罗酮生产的优化
为了证明该模块化方法的更广泛的效用,通过共表达类胡萝卜素裂解双加氧酶与来自菠萝泛菌的番茄红素β环化酶(或crtY)来生产其他脱辅基类胡萝卜素。用表达野生型OfCCD1的菌株(Of菌株)生产的β-紫罗酮为140μg/L,对应仅低于1%的从β-胡萝卜素的转化率(图15)。由于N-末端TrxA融合的OfCCD1(TOfCCD1)提高了α-紫罗酮(图9),测试了它可以类似地提高β-紫罗酮生产的可能性。令人失望的是,TOfCCD1表达没有导致β-紫罗酮生产的显著增加(图15A)。相反,在GC色谱图中检测到另一个在9.46min的主峰(图16和17)。该峰通过美国国家标准与技术研究院(National Institute of Standards and Technology;NIST)质谱库被预测为ψ-紫罗酮,并通过真正的ψ-紫罗酮标准品被进一步证实。TOfCCD1的表达导致ψ-紫罗酮生产从~0.4mg/L至~14.6mg/L的37倍增加。值得注意的是,ψ-紫罗酮也是由α-紫罗酮生产菌株生产的,尽管它是次要产品(图9A和12A)。因此,番茄红素表现出也被TOfCCD1裂解并产生ψ-紫罗酮(图8),这与某些类型的CCD1可以将番茄红素转化为ψ-紫罗酮或6-甲基-5-庚烯-2-酮(MHO)的观察结果一致。此外,观察到在表达TOfCCD1的菌株(TOf菌株,图15B)中没有积累β-胡萝卜素,而是积累大量番茄红素。一个可能的原因可以是在指数期,番茄红素优先被TOfCCD1转化而不是被番茄红素β环化酶环化。
由于在TOf菌株中产生了大量番茄红素和番茄红素衍生的ψ-紫罗酮,因此假设增加crtY的基因剂量(TOf+Y菌株)可具有两个潜在益处。首先,它可以增加从番茄红素到β-胡萝卜素的碳通量,并从而增加β-紫罗酮的生产。其次,通过降低细胞内番茄红素的可用性可以减少ψ-紫罗酮的产生。为了检验该假设,首先将crtY插入到我们系统的第一表达模块atoB-hmgS-hmgR中,产生新的操纵子,crY-atoB-hmgS-hmgR(如图15所示)。由于在该研究中使用的质粒为约10个拷贝/细胞,插入使crtY拷贝数从10个拷贝/细胞增加到20个拷贝/细胞。有趣的是,crtY的基因剂量有效地导致更多的番茄红素转化为β-胡萝卜素,因此,从不可检测量的β-胡萝卜素(TOf菌株,图15)到显著的产量42.4mg/L(TOf+Y菌株,图15)。因此,β-紫罗酮的滴度从0.3mg/L显著增加至20.9mg/L,且ψ-紫罗酮从14.6mg/L降低至4.4mg/L(图15),表明更高的碳通量转向通过β-胡萝卜素的β-紫罗酮生产。
尽管补充crtY显著提高了β-紫罗酮的生产,但仍然产生了4.4mg/L的ψ-紫罗酮。为了使β-紫罗酮的生产最大化并使副产物/中间体的形成最小化,筛选对β-胡萝卜素具有更高选择性的CCD。测试另外三种来自拟南芥(AtCCD1)、葡萄(VvCCD1)和矮牵牛(PhCCD1)的CCD1酶(图18)。本研究中使用的所有CCD1酶在表4中示出。通过野生型AtCCD1、VvCCD1和PhCCD1的表达,β-紫罗酮分别以0.1mg/L、13.0mg/L和27.0mg/L产生,分别伴有0.2mg/L、14.8mg/L和4.8mg/L的ψ-紫罗酮(图19A)。数据表明,野生型VvCCD1和PhCCD1在大肠杆菌中具有比AtCCD1和OfCCD1更高的活性。此外,PhCCD1还具有比VvCCD1和TOfCCD1更高的对β-胡萝卜素的选择性。然而,在表达PhCCD1的菌株中仍然积累13.3mg/L的β-胡萝卜素和13.8mg/L的番茄红素(图19B)。接下来,研究TrxA与PhCCD1的融合以及补充另外拷贝的crtY。通过另外补充crtY(Ph+Y菌株),β-紫罗酮滴度从27mg/L增加至32.4mg/L,并且ψ-紫罗酮滴度从4.8mg/L降低至1.6mg/L。同时,β-胡萝卜素生产从13.3mg/L(Ph菌株)增加至24.3mg/L(Ph+Y菌株),并且番茄红素生产从13.8mg/L降低至1.5mg/L。然而,TrxA的融合(TPh菌株)仅导致β-紫罗酮生产从27mg/L至30.4mg/L的中等增加,并且ψ-紫罗酮生产从4.8mg/L至3.2mg/L的略微降低。此外,crtY补充和TrxA融合的组合(TPh+Y菌株,图19)没有协同益处。总体来说,结果表明,与OfCCD1不同,天然PhCCD1活性足以有效地将β-胡萝卜素转化为β-紫罗酮。总而言之,β-紫罗酮生产从最初的140μg/L提高至32.4mg/L,在24h的时间段内于管和烧瓶中增加~230倍。此外,在补料分批发酵中,用Ph+Y菌株产生~500mg/L的β-紫罗酮(图19C),其与初始菌株相比增加约3700倍。
表4总结了本研究中的CCD1酶。
来自生物反应器的有机相的颜色是黄色。为了鉴定黄色化合物,进行了超高效液相色谱-飞行时间质谱联用分析。鉴定出一些二醛(C17和C19)和醇(图20)。这些是由于PhCCD1的非特异性裂解的副产物。为了避免这个问题,进行了对更特异性的CCD的筛选。由于CCD4在底物和产物特异性方面显示出显著改进,我们筛选了表5中列出的几种CCD4酶,并发现PpCCD4对β-胡萝卜素的活性最高,而CmCCD4对ε-胡萝卜素的活性最高(图21)。
表5总结了本研究中的CCD2和CCD4酶。
实施例6.类视黄醇生产的优化
通过在C15-C15'位置裂解β-胡萝卜素生物合成类视黄醇。为了进一步说明“即插即用”系统生产其他脱辅基类胡萝卜素的效用,用来自未培养海洋细菌HF10_19P19(blh1)和未培养海洋细菌66A03(blh2)的两个blh基因(BCDO酶,图8)替换CCD1基因。在没有任何上游途径优化的情况下,“即插即用”系统在blh1菌株中产生18.5mg/L的视黄醇和5.1mg/L的视黄醛,并在blh2菌株中产生3.0mg/L的视黄醇和1.1mg/L的视黄醛(图22A)。在blh1菌株中,番茄红素积累(28.2mg/L),但未检测到β-胡萝卜素(图22B)。因此,假设blh1菌株中类视黄醇生产受到番茄红素β-环化酶而非BCDO的限制。如预期的,共表达另外的crtY基因(blh1+Y)增加了类视黄醇的产生(从23.6mg/L增加至33.2mg/L)。关于blh2菌株,类视黄醇生产可能受到BCDO而不是番茄红素β-环化酶活性的限制,因为crtY基因剂量的增加尽管将>90%的番茄红素转化为β-胡萝卜素,但未能提高类视黄醇的生产(图22)。值得注意的是,在类视黄醇生产菌株中,预测为大肠杆菌中的氧化还原酶并且通过实验证实具有高视黄醇脱氢酶活性的ybbO基因(Genbank登录ID是ECD_00444,图8)没有过表达,但是大于80%的视黄醛转化为视黄醇。虽然潜在的机制尚不清楚,但这可能是由于ybbO酶或具有视黄醇脱氢酶活性的其他未知内源蛋白的相对高的细胞内表达。类视黄醇和紫罗酮的结果表明,该“即插即用”系统是通用的,并且将可用于生产共有共同上游途径的许多脱辅基类胡萝卜素(图22C)。
讨论
模块化代谢工程已被成功应用以合理改进通过微生物细胞工厂的小分子生产。这是一种减少参数优化空间并允许在与完整途径合并之前对表达模块子集进行顺序优化的强有力方法。通常,随着表达模块数目的增加,通路优化的准确性将提高,但完整组合也将呈指数增加。因此,必须确定平衡的表达模块数目。如本文所描述的,将包含13种基因的多基因途径铸成4个不同的表达模块:上游甲羟戊酸途径(表达模块1)、下游甲羟戊酸途径(表达模块2)、番茄红素生物合成途径(表达模块3)和脱辅基类胡萝卜素生物合成途径(表达模块4)。通过用EDASPO方法优化前三个代谢表达模块,获得了积累高含量番茄红素的稳定亲本菌株(图6中的菌株121)。随后,引入携带番茄红素环化酶和CCD的第四表达模块以产生各种脱辅基类胡萝卜素。使脱辅基类胡萝卜素表达模块独立于剩余表达模块提供了超过非模块化方法的三个主要优点。首先,它使对上游系统(甲羟戊酸途径和番茄红素生物合成途径)的潜在负面影响最小化。其次,它显著简化了菌株工程工作量。随着上游系统被优化并保持有效,工程工作可以集中在下游脱辅基类胡萝卜素生物合成表达模块上。最后,它使该系统成为用于生产有价值的脱辅基类胡萝卜素的“即插即用”底盘(chassis)。因此,“插入”番茄红素环化酶(LCYe或crtY)和CCD1产生了α-紫罗酮或β-紫罗酮,并且“插入”crtY和blh则产生视黄醇。更重要的是,在烧瓶中获得类似的脱辅基类胡萝卜素滴度(图9、15、19和22),表明该模块化系统的稳健性。
总体来说,这些结果证明,调节关键蛋白表达对于脱辅基类胡萝卜素在大肠杆菌中的异源生物合成是必需的。从广义上讲,这突出了将蛋白工程和模块化途径设计相结合以过量生产有价值的化学品的益处。
天然成分标签监管方面的最近变化导致对天然调味剂(flavour)和香料的需求增加。因此,对微生物工程化以从可再生资源中生产成分的兴趣越来越高。然而,脱辅基类胡萝卜素途径的复杂代谢特征阻碍了高效微生物过程的发展。有利地,本公开内容提供了模块化代谢工程和酶工程策略,其被系统地应用以有效地使由13种酶的过表达所施加的代谢负担最小化,以克服来自低活性的关键酶的挑战。该策略使得能够开发出能够生产前所未有的产量的α-紫罗酮和β-紫罗酮的稳健的大肠杆菌菌株,证明了使用微生物生产天然调味剂和香料的巨大潜力。
- 一种从游离态羟基类胡萝卜素制备类胡萝卜素多元酸酯的方法
- 类胡萝卜素和脱辅基类胡萝卜素的生产
- 一种从游离态羟基类胡萝卜素制备类胡萝卜素多元酸酯的方法
