一种可诱导广谱中和活性重组多组分新冠病毒三聚体蛋白疫苗的制备及应用
文献发布时间:2024-05-31 01:29:11
相关申请的交叉引用
本申请要求2022年02月25日提交的中国专利申请202210184528.3的权益,该申请的内容通过引用被合并于本文。
本发明涉及分子疫苗学领域,涉及一种可诱导广谱中和活性重组多组分新冠病毒三聚体蛋白疫苗的制备及应用。
新型冠状病毒(SARS-CoV-2)具有较强的传播能力,安全有效的疫苗是控制疫情最有力的技术手段。根据靶点和技术的不同,疫苗可以被分为以下几类:灭活疫苗、重组蛋白疫苗、病毒载体疫苗、RNA疫苗、减毒活疫苗和病毒样颗粒疫苗等。自SARS-CoV-2大流行以来,各国研制的新冠疫苗已达200多种。截止2022年12月2日,全球已有50种疫苗被批准使用或附条件使用,另外已有242种疫苗进入临床研究(https://covid19.trackvaccines.org/vaccines/)。
血管紧张素转化酶2(ACE2)是SARS-CoV-2和SARS-CoV共同的宿主细胞受体蛋白
SARS-CoV-2为RNA单链病毒,易发生缺失突变,且这种突变多发生在S蛋白的重复缺失区(Recurrent deletion regions,RDRs)。缺失或突变可能改变S蛋白的构象,使得先前疫苗免疫诱导的抗体对突变S蛋白的结合和中和降低,从而导致疫苗免疫效果的下降和病毒的免疫逃逸。早期的D614G突变(B.1)增强了S蛋白同ACE2受体的亲和力,并迅速成为了流行株,但该突变未降低对中和抗体的敏感性
发明内容
基于以上对于新型冠状病毒SARS-CoV-2变异株具有高保护效果的疫苗的需求,本发明第一方面提供一种提高SARS-CoV-2突变毒株ECD抗原免疫原性/抗原三聚体稳定性的方法,该方法通过构建包含SEQ ID No:8所示的氨基酸序列,或其免疫原性片段和/或免疫原性变体的ECD抗原,从而获得稳定的融合前构象的三聚体形式ECD。
在一个实施方案中,突变毒株为含有A67V、H69del、V70del、T95l、G142D、V143del、Y144del、Y145del、N211del、L212l、ins214EPE、G339D、S371L、S373P、S375F、K417N、N440K、G446S、S477N、T478K、E484A、Q493R、G496S、Q498R、N501Y、Y505H、T547K、D614G、H655Y、N679K、P681H、N764K、D796Y、N856K、Q954H、N969K和L981F之中至少任一突变的高风险突变毒株;
优选地,该突变毒株为BA.1。
在一个实施方案中,该ECD抗原和佐剂共同施予受试者,佐剂选自铝佐剂、油乳佐剂、Toll样受体(TLR)激动剂、免疫增强剂的组合、微生物类佐剂、蜂胶佐剂、左旋咪唑佐剂、脂质体佐剂、中药佐剂及小肽类佐剂中的一种或多种;
优选地,油乳佐剂包含角鲨烯成分;
Toll样受体(TLR)激动剂包含吸附在铝盐上的CpG或单磷酰脂质A(MPL);以及
免疫增强剂的组合包含QS-21和/或MPL。
本发明第二方面提供一种提高SARS-CoV-2突变毒株ECD抗原免疫原性/抗原三聚体稳定性的方法,该方法通过构建编码包含SEQ ID No:8所示的氨基酸序列,或其免疫原性片段和/或免疫原性变体的多核苷酸,从而表达稳定的融合前构象的三聚体形式ECD。
在一个实施方案中,突变毒株为含有A67V、H69del、V70del、T95l、G142D、V143del、Y144del、Y145del、N211del、L212l、ins214EPE、G339D、S371L、S373P、S375F、K417N、N440K、G446S、S477N、T478K、E484A、Q493R、G496S、Q498R、N501Y、Y505H、T547K、D614G、H655Y、N679K、P681H、N764K、D796Y、N856K、Q954H、N969K和L981F之中至少任一突变的高风险突变毒株;
优选地,该突变毒株为BA.1。
在一个实施方案中,该方法包括构建包含SEQ ID No:7所示的核苷酸序列或其片段的多核苷酸。
本发明第三方面提供一种免疫原性/抗原三聚体稳定性提高的SARS-CoV-2突变毒株ECD免疫原性蛋白/肽,该免疫原性蛋白/肽包含SEQ ID No:8所示的氨基酸序列,或其免疫原性片段和/或免疫原性变体,该ECD免疫原性蛋白/肽为稳定的融合前构象的三聚体形式。
在一个实施方案中,突变毒株为含有A67V、H69del、V70del、T95l、G142D、V143del、Y144del、Y145del、N211del、L212l、ins214EPE、G339D、S371L、S373P、S375F、K417N、N440K、G446S、S477N、T478K、E484A、 Q493R、G496S、Q498R、N501Y、Y505H、T547K、D614G、H655Y、N679K、P681H、N764K、D796Y、N856K、Q954H、N969K、L981F之中至少任一突变的高风险突变毒株;
优选地,该突变毒株为BA.1。
本发明第四方面提供一种多核苷酸,其编码上述的免疫原性蛋白/肽。
在一个实施方案中,所述多核苷酸包含SEQ ID No:7所示的核苷酸序列。
本发明第五方面提供一种免疫原性组合物,其包含:
上述的免疫原性蛋白/肽,或
上述的多核苷酸,和
药学上可接受的载体、赋形剂或稀释剂中的任意一种或至少两种的组合;
任选地,包含佐剂。
在一个实施方案中,所述免疫原性组合物进一步包含SEQ ID No:16、SEQ ID No:20、SEQ ID No:28所示的氨基酸序列,或其免疫原性片段和/或免疫原性变体。
在一个实施方案中,所述免疫原性组合物进一步包含编码SEQ ID No:16、SEQ ID No:20、SEQ ID No:28所示的氨基酸序列,或其免疫原性片段和/或免疫原性变体的核苷酸序列。
在一个实施方案中,上述编码SEQ ID No:16、SEQ ID No:20、SEQ ID No:28所示的氨基酸序列的核苷酸序列分别为SEQ ID No:15、SEQ ID No:19、SEQ ID No:27所示的核苷酸序列。
在一个实施方案中,佐剂选自:
铝佐剂、油乳佐剂、Toll样受体(TLR)激动剂、免疫增强剂的组合、微生物类佐剂、蜂胶佐剂、左旋咪唑佐剂、脂质体佐剂、中药佐剂及小肽类佐剂中的一种或多种。
优选地,油乳佐剂包含角鲨烯成分;
Toll样受体(TLR)激动剂包含吸附在铝盐上的CpG或单磷酰脂质A(MPL);以及
免疫增强剂的组合包含QS-21和/或MPL。
本发明第六方面提供上述的免疫原性蛋白/肽、多核苷酸和免疫原性组合物用于预防或治疗SARS-CoV-2突变毒株引起的疾病的用途。
在一个实施方案中,突变毒株为高风险突变毒株;
优选地,突变毒株为含有L18F、T19l、T19R、L24del、P25del、P26del、A27S、A67V、H68del、H69del、V70del、D80A、T95l、G142D、V143del、Y144del、Y145del、E156G、F157del、R158del、N211del、L212l、V213G、ins214EPE、D215G、L242del、A243del、L244del、R246l、G339D、R346K、S371F、S371L、S373P、S375F、T376A、D405N、R408S、K417N、N440K、G446S、L452R、S477N、T478K、E484A、E484K、E484Q、F486V、Q493R、G496S、Q498R、N501Y、Y505H、T547K、A570D、D614G、H655Y、N679K、P681H、P681R、A701V、T716l、N764K、D796Y、N856K、D950N、Q954H、N969K、L981F、S982A和D1118H之中至少任一突变的高风险突变毒株;
在一个实施方案中,该毒株选自D614G突变株、Beta毒株、Alpha毒株、Delta毒株、Gamma毒株、Epsilon毒株、BA.1毒株、BA.1.1毒株、BA.2毒株、BA.2.12.1毒株、BA.3毒株和/或BA.4/5毒株的至少一种;
优选地,该毒株包含Alpha毒株、Beta毒株、Delta毒株、BA.1毒株、BA.1.1毒株、BA.2毒株、BA.2.12.1毒株、BA.3毒株和/或BA.4/5毒株的至少一种。
本发明第七方面提供上述的免疫原性蛋白/肽、多核苷酸和免疫原性组合物在制备预防或治疗SARS-CoV-2突变毒株引起的疾病的疫苗或药物中用途。
在一个实施方案中,突变毒株为高风险突变毒株;
优选地,突变毒株为含有L18F、T19l、T19R、L24del、P25del、P26del、A27S、A67V、H68del、H69del、V70del、D80A、T95l、G142D、V143del、Y144del、Y145del、E156G、F157del、R158del、N211del、L212l、V213G、ins214EPE、D215G、L242del、A243del、L244del、R246l、G339D、R346K、S371F、S371L、S373P、S375F、T376A、D405N、R408S、K417N、N440K、G446S、L452R、S477N、T478K、E484A、E484K、E484Q、F486V、Q493R、G496S、Q498R、N501Y、Y505H、T547K、A570D、D614G、H655Y、N679K、P681H、P681R、A701V、T716l、N764K、D796Y、N856K、D950N、Q954H、N969K、L981F、S982A和D1118H之中至少任一突变的高风险突变毒株;
在一个实施方案中,该毒株选自D614G突变株、Alpha毒株、Beta毒株、Delta毒株、Gamma毒株、Epsilon毒株、BA.1毒株、BA.1.1毒株、BA.2毒株、BA.2.12.1毒株、BA.3毒株和/或BA.4/5毒株中的至少一种;
更优选地,该毒株选自Alpha毒株、Beta毒株、Delta毒株、BA.1毒株、BA.1.1毒株、BA.2毒株、BA.2.12.1毒株、BA.3毒株和/或BA.4/5毒株的至少一种。
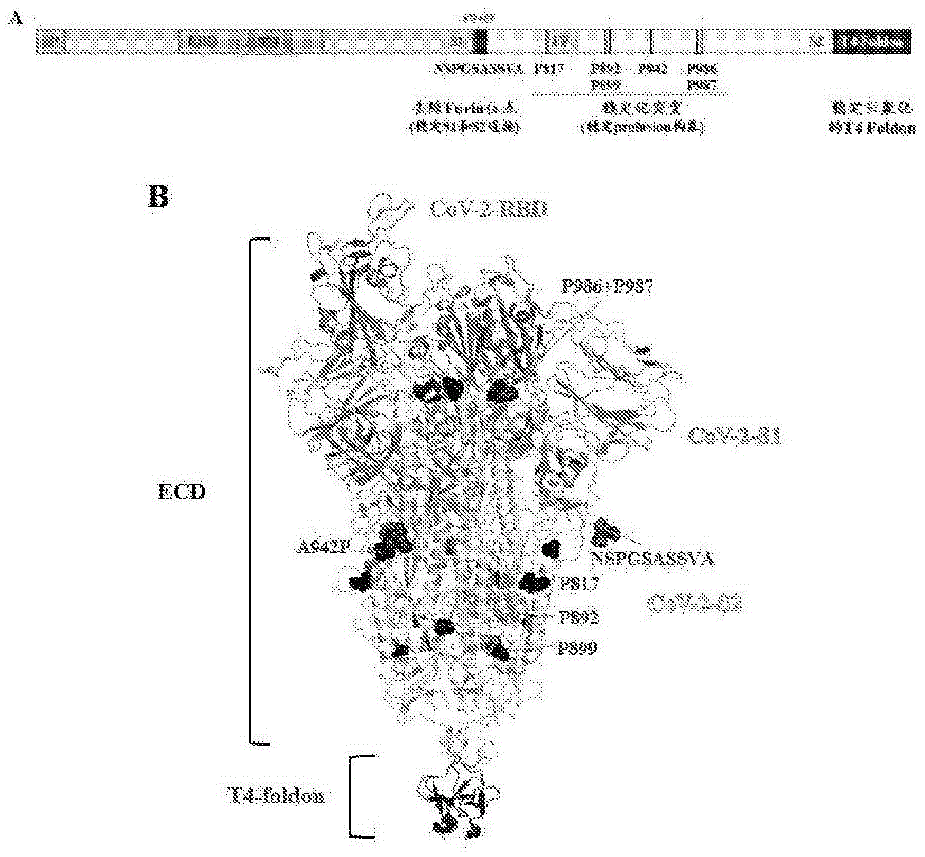
图1为经过改造的S-ECD的一级结构(A)及高级结构(B,参考PDB:6XLR)的示意图。
图2为TM41蛋白纯度分析,其中(A)为非还原SDS-PAGE代表性图谱;(B)为SEC-HPLC代表性图谱。
图3示出了TM41单组分以及多组分疫苗免疫C57BL/6小鼠后血清抗体效价检测结果(GeoMean±SD)。
图4示出了TM41单组分以及多组分疫苗免疫C57BL/6小鼠2免7天后血清中和不同假病毒中和效价检测结果(GeoMean±SD)。
图5示出了不同剂量TM22+TM23+TM28+TM41四组分疫苗免疫C57BL/6小鼠2免7天后血清中和不同变异株假病毒效价检测(GeoMean±SD)。
图6示出了TM22+TM23双组分疫苗和TM22+TM23+TM28+TM41四组分疫苗免疫C57BL/6小鼠2免7天后血清中和不同变异株假病毒效价检测结果(GeoMean±SD)。
图7示出了C57BL/6小鼠2免7天及3免7天血清中和Omicron(BA.1)假病毒效价检测结果(GeoMean±SD);2M7D代表2免后7天;3M7D代表3免后7天。
图8示出TM22+TM23+TM28+TM41四组分疫苗与单组分/双组分疫苗免疫C57BL/6小鼠2免14天后血清中和不同变异株假病毒效价检测结果。
图9示出了不同疫苗抗原诱导的细胞免疫反应检测结果,其中(A)为IFN-)阳性细胞数结果;(B)为IL-4阳性细胞数结果;(C)为CD137+CD134+双阳性CD4T淋巴细胞比例结果;(D)为CD137+CD69+双阳性CD8T淋巴细胞比例结果。
图10(A-D)分别示出了加强免疫1针后血清对Omicron各亚型(BA.1,BA.2,BA.3,BA.4/5)假病毒中和效价比较。[a表示与TM8两针免疫(2免7天)相比倍数变化;b表示与TM8加强免疫相比变化倍数]。
图11(A-C)分别示出了加强免疫1针后血清对Alpha,Beta,Delta假病毒中和效价比较。[a表示与TM8两针免疫(2免7天)相比倍数变化;b表示与TM8加强免疫相比变化倍数]。
图12(A-D)分别示出了加强免疫2针后血清对Omicron各亚型(BA.1,BA.2,BA.3,BA.4/5)假病毒中和效价比较。[a表示与TM8两针免疫(2免7天)相比倍数变化;b表示与TM8加强免疫相比变化倍数]。
附图图标中,Omicron(B.1.1.529)及奥密克戎均指Omicron(BA.1)。
定义
除非另有说明,本文使用的所有技术和科学术语具有本发明所属的技术领域的普通技术人员通常理解的含义。为了本发明的目的,进一步定义以下术语。
当用于本文和所附权利要求书中时,单数形式“一”、“一种”、“另一”和“所述”包括复数指代对象,除非上下文明确地另有指示。
术语“包括”、“包含”是指包括具体成分而不排除任何其他的成分。诸如“基本上由……组成”允许包括不损害本发明的新颖或基本特征的其他成分或步骤,即,它们排除损害本发明的新颖或基本的特征的其他未列举的成分或步骤。术语“由……组成”是指包括具体成分或成分组并且排除所有其他成分。
术语“抗原”是指一种由抗体或T细胞受体所识别(特异性结合)的外源物质,但是其不能确定性地诱导免疫应答。诱导特异性免疫的外源性物质称为“免疫性抗原”或“免疫原”。“半抗原”是指一种本身不能引发免疫应答(尽管几个分子半抗原的结合物,或半抗原与大分子载体的结合物可引发免疫应答)的抗原。
术语“体液免疫应答”是抗体介导的免疫应答并且涉及引入和生成以一定亲和力识别和结合本发明的免疫原性组合物中的抗原的抗体,“细胞介导的免疫应答”是由T细胞和/或其他白细胞介导的免疫应答。“细胞介导的免疫应答”是通过提供与主要组织相容性复合物(MHC)的I类或II类分子、CD1或其他非典型MHC样分子相关的抗原表位而诱发的。
术语“免疫原性组合物”是指含有抗原如微生物或其组分的任何药物组合物,该组合物可用于在个体中诱发免疫应答。
如本文所使用的“免疫原性”意指抗原(或抗原的表位)例如冠状病毒棘突蛋白受体结合区或免疫原性组合物在宿主(例如哺乳动物)中诱发体液或细胞介导的免疫应答或二者的能力。
“保护性”免疫应答是指免疫原性组合物诱发用于保护个体免于感染的体液或细胞介导的免疫应答或两者的能力。所提供的保护不必是绝对的,即,不必完全阻止或根除感染,只要相对于对照个体群体(例如未给药疫苗或免疫原性组合物的受感染动物)存在统计学上显著的改进即可。保护可限于缓和感染症状的严重性或发作快速性。
“免疫原性量”和“免疫有效量”二者在本文可交换使用,是指抗原或免疫原性组合物足以引发免疫应答(细胞(T细胞)或体液(B细胞或抗体)应答或二者,如通过本领域技术人员已知的标准测定所测量的)的量。
抗原作为免疫原的有效性可通过例如增殖测定、通过细胞溶解测定、或通过测量B细胞活性水平来测量。
术语“多肽”和“蛋白质”在本文中可互换使用,指连续氨基酸残基的聚合物。
术语“核酸”、“核苷酸”和“多核苷酸”可互换使用,是指RNA、DNA、cDNA或cRNA及其衍生物,诸如含有经修饰的骨架的那些。应当理解,本发明提供了包含与本文所述序列互补的序列的多核苷酸。本发明中考虑的“多核苷酸”包括正向链(5′至3′)和反向互补链(3′至5′)。根据本发明的多核苷酸可以以不同方式(例如通过化学合成,通过基因克隆等)制备,并且可采取各种形式(例如直链或支链的,单链或双链的,或其杂合体,引物,探针等)。
术语“免疫原性蛋白/肽”包括在一旦向宿主施用,其能够引发针对该蛋白质的体液和/或细胞类型的免疫反应的意义上,具有免疫活性的多肽。因此,根据本发明的蛋白质片段包含至少一个表位或抗原决定簇或基本上由其组成或由其组成。如本文中所用,“免疫原性”蛋白质或多肽包括蛋白质的全长序列、其类似物或其免疫原性片段。“免疫原性片段”是指包含一个或多个表位,从而引发上述免疫反应的蛋白质片段。
术语“免疫原性蛋白/肽”还涵盖了对序列的缺失、添加和取代,只要该多肽起到产生如本文所定义的免疫反应的作用即可,即“免疫原性变体”。
本发明的“免疫原性片段”以及“免疫原性变体”与相应的(前者从后者衍生)“免疫原性蛋白/肽”具有99%、98%、97%、95%、90%的序列同一性。
本发明提供的SCTV01E重组蛋白疫苗,基于SARS-CoV-2刺突蛋白的胞外结构域(ECD,含S1和S2部分)改造而来。SARS-CoV-2的天然刺突蛋白为三聚体结构,在其产生和行使侵染功能的过程中,由于S1和S2间存在的RRAR位点而易被高尔基体中以及细胞表面的蛋白酶切开,随后发生S1的脱落,进一步地S2结构由融合前构象(prefusion conformation)转变为融合后构象(postfusion conformation),从而完成膜融合过程[20]。为了获得稳定的融合前构象的ECD三聚体,本发明在不同毒株变体的S蛋白基础上,进行了如下三部分改造(表1和图1):
1)目前发现,具有较高中和活性的抗体都结合于S1区域(具体来说结合于S1中的NTD和RBD区域)。保持S1部分的完整对于新冠疫苗诱导中和抗体的产生至关重要。本发明在SCTV01E重组蛋白疫苗中改造去除了Furin位点,即将679至688位的氨基酸序列固定为NSPGSASSVA,以降低S1断裂与脱落的可能性。
2)由于S2自身的变构倾向,使得刺突蛋白的融合前构象不稳定,而有效地诱发中和抗体需要保持融合前构象稳定,这在RSV和HIV-1疫苗研究中已经被证实
3)最后,为了进一步稳定S-ECD三聚体结构,本发明在疫苗分子的C端加入了三聚化模块T4foldon。该模块来源于T4噬菌体的纤维蛋白的C端结构域,具有27个氨基酸。T4 foldon曾被用于过RSV候选疫苗中,并在临床I期研究中被证明安全性良好
在使用经上述改造后的重组S-ECD三聚体蛋白抗原重组进表达载体、并对表达出的重组S-ECD三聚体蛋白进行常规纯度和稳定性分析后,制备成相应的三聚体蛋白,即此前发明中(记载于PCT/CN2022/095609及PCT/CN2022/107213)D614G变异株S-Trimer-TM8蛋白(以下简称TM8)、Alpha变异株S-Trimer-TM22蛋白(以下简称TM22)、Beta变异株S-Trimer-TM23蛋白(以下简称TM23)、Delta变异株S-Trimer-TM28蛋白(以下简称TM28)和本发明的BA.1变异株S-Trimer-TM41蛋白(以下简称TM41,表1概述了其分子改造方案)。
此前的发明中,使用制备出的D614G变异株TM8蛋白疫苗免疫小鼠后进行免疫学测定、Beta变异株TM23蛋白疫苗在食蟹猴中的免疫学测定以及Alpha变异株TM22蛋白疫苗在小鼠中的免疫学测定均显示本发明制备的这三种疫苗能够在实验动物体内产生足够效价的抗体免疫反应;并且在使用TM8+TM23双组分疫苗以及TM22+TM23双组分疫苗在小鼠的免疫学评价中也提示,本发明的双组分疫苗对不同毒株均具有较高且相近中和效价,因此相比单组分疫苗具有更优的广谱中和能力,双组分疫苗对不同变异株的中和效价远高于康复者血清对早期流行株(其基因组序列:GenBank Accession No.NC_045512)的中和效价。
本发明的四组分疫苗(TM22+TM23+TM28+TM41)对Alpha、Beta、Delta和Omicron等变异株具有更为广谱的中和活性,但保持了同单组分苗和双组分苗相近的高水平的T细胞免疫反应,有希望对多种变异毒株(表2记载了相关的SARS-CoV-2变异株的S蛋白突变)产生交叉保护能力,提高对变异株感染的保护率。
本发明的ECD三聚体免疫原性蛋白/肽在小鼠和食蟹猴中显示出优异的免疫原性,可维持长时程的体液免疫和细胞免疫反应。
表1 SCTV01E疫苗分子结构设计改造
表2.本发明相关的SARS-CoV-2变异株的S蛋白突变
注:序列来源GISAID(https://gisaid.org/)
实施例
实施例1:新冠病毒重组刺突蛋白胞外区(S-ECD)三聚体蛋白抗原设计、表达载体的构建及蛋白生产
1.1基于BA.1(B.1.1.529.1)序列(EPI_ISL_6640917)的S-ECD三聚体蛋白(S-Trimer-TM41)表达载体的构建
TM41包含3699bp的基因片段,通过overlap PCR从模板pCMV3-CoV2-B.1.1.529和pD2535nt-CoV2-S-ECDTM8-T4F-trimer改造获得TM41基因片段。通过In-fusion方法构建到Xba I+Asc I酶切的pD2535nt-HDP稳定株表达载体中,获得pD2535nt-CoV2-S-ECDTM41-T4F-trimer表达载体。
扩增引物
1.2 S-ECD三聚体蛋白的表达和纯化
将上述构建的目的基因通过化学法转入到HD-BIOP3(GS-)细胞中(Horizon),采用自主研发的无血清培养基培养,经过MSX加压筛选获得稳定表达的细胞株,加料培养14天后,经过离心和过滤获得培养上清液。培养上清液首先采用阳离子交换层析(POROS XS,Thermo)捕获,用高盐缓冲液进行洗脱;然后采用阴离子层析(NanoGel-50Q,NanoMicro)结合模式和混合阴离子层析(DiamondMIX-A,博格隆)流穿模式进行进一步的精纯,去除与产品和工艺相关杂质;其次采用低pH孵育和除病毒过滤(Planova)对病毒进行灭活和去除,最后用超滤膜包(Millipore)进行超滤换液至柠檬酸盐缓冲液。S-ECD三聚体表达水平>500mg/L。
实施例2:新冠病毒重组刺突蛋白胞外区(S-ECD)三聚体蛋白纯度及稳定性分析
2.1重组S-ECD三聚体蛋白纯度分析
将上述纯化后重组S-ECD三聚体蛋白原液置于含1.7mM枸橼酸,8mM枸橼酸钠,300mM氯化钠,0.3g/kg聚山梨酯80,pH7.0±0.2缓冲液中,浓度约0.6mg/mL,应用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE)分析一级结构纯度和分子排阻高效液相色谱(siza-exclusion high performance liquid chromatograph,SEC-HPLC)分析其三聚体含量,应用动态光散射(dynamic light scattering,DLS)检测其形态学特征。
SDS-PAGE具体操作步骤:(1)SDS-PAGE胶配制:3.9%浓缩胶,7.5%分离胶;(2)样品100℃煮沸2min,离心后上样8样-;(3)考马斯亮蓝染色后脱色。SEC-HPLC操作步骤为:(1)仪器:液相色谱系统(Agilent公司,型号:Agilent1260),水溶性体积排阻色谱柱(Sepax公司,型号:SRT-C SEC-500色谱柱);(2)流动相:200mM NaH2P04,100mM Arginine,pH 6.5,0.01%异丙醇(IPA);(3)上样量为80μg;(3)检测波长280nM,分析时间为35min,流速为0.15mL/min。
DLS具体操作步骤:(1)仪器:动态光散射仪(Wyatt Technology公司,型号:DynaPro NanoStar);(2)上样量为50μL;(3)采集数据后,应用Dynamics 7.1.8软件分析数据。
重组TM41蛋白由于其非共价疏水作用为同源三聚体结构。经非还原SDS-PAGE处理后成为分子量大小约148KDa的单体分子(图2),纯度为99.0%;SEC-HPLC显示三聚体纯度为98.8%,其聚集体与片段比例含量均低于5%,其主峰分子量平均为512KDa;动态光散射结果显示TM41三聚体蛋白分子平均半径为8.8nm(表3)。
表3重组S-ECD三聚体纯度分析
2.2重组S-ECD三聚体蛋白稳定性评价
将重组TM41三聚体蛋白分别置于37℃中保存2周(37T2W),-80℃条件保存8h后转移至25℃条件解冻0.5h(F/T),如此进行4次反复冻融,应用SDS-PAGE、SEC-HPLC分析其三聚体含量变化,数据见 表4。
结果如表4所示,重组TM41三聚体蛋白37℃加速2周后和5次反复冻融后,非还原SDS-PAGE纯度与SEC-HPLC三聚体含量均在95.0%以上,加速后纯度变化在2.0%以内,聚集体与片段无显著增加,表现出了良好的热加速稳定性和冻融稳定性。
表4重组S-ECD三聚体蛋白稳定性评价
实施例3:TM41单组分疫苗及多组分疫苗在
3.1疫苗制备及免疫方案
TM22和TM23三聚体蛋白的表达及纯化参见PCT/CN2022/095609《一种提高SARS-CoV-2突变毒株ECD抗原免疫原性/抗原三聚体稳定性的方法》(在此全文引入)。申请人在该专利中详细阐述了TM22+TM23组成的双组分苗相比TM22以及TM23单组分疫苗具有更优秀的广谱中和能力。TM28三聚体蛋白的表达及纯化参见PCT/CN2022/107213《一种可诱导广谱中和活性重组多组分新冠病毒三聚体蛋白疫苗的制备及应用》(在此全文引入)。申请人在该专利申请中详细阐述了TM22+TM23+TM28组成的三价苗相比单组分疫苗具有更优秀的广谱中和能力。为进一步扩宽疫苗的广谱中和效果,特别是针对Omicron变异株的中和效果,申请人在TM22+TM23+TM28三价苗的基础上加入了TM41成分,组成了四组分疫苗。
根据最终免疫剂量(表5)将纯化获得的TM22、TM23、TM28和TM41三聚体蛋白用PBS进行预稀释后与MF59(8×,来源:神州细胞工程有限公司,下文同)等体积混合制备单组分或多组分疫苗样品。
表5免疫分组信息汇总
3.2小鼠免疫
6-8周雌性C57BL/6小鼠(来源:北京维通利华实验动物技术有限公司,体重18-20g),肌肉注射0.1mL含MF59佐剂的疫苗样品。共进行3次免疫,免疫间隔为14天。2次免疫后7天(2免7天)和3次免疫后7天进行眼眶采血,4500rpm离心15分钟取血清,进行后续血清学免疫分析。
3.3小鼠免疫血清抗体效价的测定
单组分苗免疫的小鼠免疫血清包被5μg/mL的TM41蛋白,双组分苗免疫的小鼠免疫血清包被5μg/mL的TM22和TM23蛋白(1∶1),四组分苗免疫的小鼠免疫血清包被5μg/mL的TM22、TM23、TM28和TM41蛋白(1∶1∶1∶1),100μL/孔包被于96孔板,2~8℃过夜包被。酶标板洗净拍干后加入含2%BSA的封闭液320μL/孔,室温封闭1h以上。使用含0.1%BSA的TBST样品稀释剂将单组分或多组分疫苗小鼠免疫血清进行梯度稀释(如8000×、16000×、32000×、64000×、128000×、256000×、512000×等),以相同梯度稀释的未免疫小鼠血清作为阴性对照血清。96孔酶标板加入梯度稀释后的血清100μL/孔,室温孵育1~2h。洗板3遍,加入80ng/mL的兔抗鼠IgG F(ab)2/HRP检测二抗(来源:Jackson ImmunoResearch,下文同)100μL/孔,室温孵育1h。洗板5遍,加入底物显色液进行显色10~15min,2M H
二免7天小鼠血清中总IgG抗体滴度结果如图3所示,与空白对照组和佐剂对照组比较,TM22+TM23双组分疫苗抗原、不同剂量的TM41单组分疫苗抗原和TM22+TM23+TM28+TM41四组分疫苗抗原免疫组均诱导了较高水平的小鼠血清中总IgG抗体滴度。其中,TM22+TM23双组分疫苗抗原诱导的总IgG抗体滴度为960000,而TM22+TM23+TM28+TM41四组分疫苗抗原免疫组(0.5+0.5+0.5+1.5μg)诱导了最高的总IgG抗体滴度(1024000)。不同剂量的TM41单组分疫苗抗原(0.25μg/剂、0.5μg/剂和1μg/剂)诱导的总IgG抗体滴度可见剂量效应关系,抗体滴度分别为256000、512000和576000。不同剂量的TM22+TM23+TM28+TM41四组分疫苗抗原免疫组诱导产生的总IgG抗体滴度均高于TM41单组分疫苗。
3.4小鼠免疫血清对不同变异株中和效价的测定
将不同稀释倍数的2免7天免疫血清或3免7天免疫血清50μL/孔加入96孔板,然后50μL/孔加入100~200TCID
3.4.1 TM41单组分以及多组分疫苗免疫血清对不同变异株中和效价的测定
检测TM41单组分以及四组分疫苗TM22+TM23+TM28+TM41免疫C57BL/6小鼠2免7天后血清中和不同变异株Alpha(B.1.1.7)、Beta(B.1.351)、Delta(B.1.617.2)和BA.1(B.1.1.529.1)假病毒中和 效价。不同剂量下的TM41单组分疫苗均可诱导产生BA.1变异株的特异性中和抗体,其中1μg的单组分疫苗TM41在C57BL/6J小鼠中诱导产生对BA.1变异株的最高中和活性,中和抗体滴度为2730,在本实验中达到了饱和剂量。而TM41单组分疫苗对Alpha、Beta和Delta变异毒株均无中和活性,中和抗体滴度检测值均为60,低于检测限。不同剂量组的TM22+TM23+TM28+TM41四组分疫苗对BA.1变异株产生较强的中和活性,中和抗体滴度检测值为461~1000,而TM41单组分疫苗对BA.1变异株中和抗体滴度检测值为618~2730。TM22+TM23+TM28+TM41四组分疫苗对BA.1变异株中和活性与TM41单组分疫苗中和活性相当,并且同时对Alpha、Beta、Delta等变异株均具有较高中和活性,说明与TM41单组分疫苗相比,TM22+TM23+TM28+TM41四组分疫苗具有更为广谱的针对SARS-CoV-2不同变异株的中和活性(图4)。
3.4.2不同剂量TM22+TM23+TM28+TM41四组分疫苗免疫血清对不同变异株中和效价的测定
检测不同剂量TM22+TM23+TM28+TM41四组分疫苗免疫C57BL/6小鼠2免7天后血清中和不同变异株Alpha(B.1.1.7)、Beta(B.1.351)、Delta(B.1.617.2)和BA.1(B.1.1.529.1)假病毒中和效价。不同剂量的TM22+TM23+TM28+TM41四组分疫苗均可诱导较高水平的针对Alpha、Beta和Delta变异株的中和抗体,与上述三种中和抗体相比,四组分疫苗诱导BA.1中和抗体整体水平偏低。随着TM41剂量的升高,对BA.1变异株的中和活性有升高的趋势,可见剂量效应关系(图5)。
3.4.3 TM22+TM23双组分疫苗和不同剂量的TM22+TM23+TM28+TM41四组分疫苗免疫血清对不同变异株中和效价的测定
检测TM22+TM23双组分疫苗和不同剂量的TM22+TM23+TM28+TM41四组分疫苗免疫C57BL/6小鼠2免7天后血清中和不同变异株Alpha(B.1.1.7)、Beta(B.1.351)、Delta(B.1.617.2)和BA.1(B.1.1.529.1)假病毒效价。TM22+TM23双组分疫苗免疫组对Alpha、Beta、Delta和BA.1变异株特异性中和抗体滴度分别为4598、4972、1384和247。产生了较高针对Alpha、Beta、Delta特异性中和抗体滴度,而对BA.1变异株保护效力相对较弱。不同剂量的TM22+TM23+TM28+TM41四组分疫苗对Alpha和Beta变异株产生的中和抗体滴度与双组分疫苗相当,而对Delta和BA.1变异株产生的中和抗体滴度要高于双组分疫苗。其中四组分疫苗低剂量组诱导针对Delta和BA.1变异株的中和抗体是双组分疫苗的5.4倍和1.9倍,四组分疫苗中剂量诱导针对Delta和BA.1变异株的中和抗体是双组分疫苗的3.8倍和5.1倍,四组分疫苗高剂量诱导针对Delta和BA.1变异株的中和抗体是双组分疫苗的4.2倍和5.9倍(图6)。说明了在保护Delta和BA.1变异株感染时,TM22+TM23+TM28+TM41四组分疫苗的保护效力优于TM22+TM23双组分疫苗。
3.4.4不同免疫方案的疫苗免疫血清对Omicron株中和效价的测定
检测C57BL/6小鼠2免7天及3免7天血清中和BA.1(B.1.1.529.1)假病毒效价。血清学检测结果显示,与2免7天后血清中BA.1中和抗体滴度比较,3免7天后,所有疫苗免疫组的BA.1中和抗体滴度均呈升高趋势,TM22+TM23双组分疫苗升高了0.9倍、TM41(0.25、0.5、1和2μg)分别升高了7.8、3.9、1.2和0.8倍,TM22+TM23+TM28+TM41四组分疫苗(0.25μg/价、0.5μg/价、1μg/价和2μg/价)分别升高了4.9、4.2、1.6和2.6倍。四组分疫苗0.5+0.5+0.5+1μg和0.5+0.5+0.5+1.5μg分别升高了2.6倍和2.4倍(图7)。
3.4.5 TM22+TM23+TM28+TM41四组分疫苗与单组分/双组分疫苗免疫血清对不同变异株中和效价的测定
检测TM22+TM23+TM28+TM41四组分疫苗与单组分/双组分疫苗免疫C57BL/6小鼠2免14天后血清中和不同变异株(D614G毒株、Alpha毒株、Beta毒株、Delta毒株、BA.1毒株、BA.1.1毒株、BA.2毒株、BA.2.12.1毒株、BA.3毒株和BA.4/5毒株)假病毒效价。比较四组分疫苗TM22+TM23+TM28+TM41与TM8、TM41单组分疫苗及双组分疫苗TM22+TM23对不同的新冠变异毒株假病毒中和活性,检测结果如图8A所示,与TM8单组分疫苗相比,四组分疫苗TM22+TM23+TM28+TM41可显著提升对Beta、Delta、Omicron BA.1、BA.1.1、BA.2、BA.3和BA.4/5变异毒株的中和活性。图8B所示,与TM41单组分疫苗比较,四组分疫苗TM22+TM23+TM28+TM41可显著提升对D614G、Alpha、Beta和Delta变异毒株的中和活性。图8C所示,与双组分疫苗TM22+TM23比较,四组分疫苗TM22+TM23+TM28+TM41可显著提升对Delta、Omicron BA.1、BA.1.1、BA.2、和BA.3变异毒株的中和活性。图8D所示,增加疫苗免疫剂量到6微克每剂后,与TM41单组分疫苗比较,四组分疫苗TM22+TM23+TM28+TM41可显著提升对Omicron BA.2.12.1和BA.4/5变异毒株的中和活性。
3.5疫苗诱导的T细胞免疫反应检测
ELISpot法检测T细胞免疫:分离小鼠脾细胞,将小鼠脾细胞100μL/孔接种于提前处理好的ELISpot孔板(来源:Mabtech,下文同),细胞接种密度为2×10
流式细胞术检测活化T细胞亚群:将脾脏研磨成单细胞悬液,用野生型(原始株:基因组序列:GenBank Accession No.NC_045512)多肽库和奥密克戎(BA.1)多肽库分别刺激不同疫苗抗原免疫的脾细胞,在37℃ 5%CO
ELISpot法检测疫苗诱导的T细胞免疫反应结果显示,TM41单组分疫苗抗原诱导的Th1细胞免疫水平(IFN Y阳性细胞数)与TM22+TM23双组分疫苗抗原诱导水平相当,与上述两疫苗相比,TM22+TM23+TM28+TM41四组分疫苗抗原可诱导较高水平的Th1细胞免疫反应,显示其优越性(图9A)。对于疫苗诱导的Th2细胞免疫反应而言,TM41单组分、TM22+TM23双组分和TM22+TM23+TM28+TM41四组分疫苗抗原诱导的IL-4阳性细胞数量相当,疫苗诱导的Th2细胞免疫反应在各组之间无明显差异(图9B)。三组不同疫苗免疫后,小鼠的脾脏细胞分别接受了野生型和BA.1抗原肽刺激后,均诱导出高于空白及佐剂对照组水平的活化的CD4
实施例4:TM22+TM23+TM28+TM41四组分疫苗在Naive小鼠的免疫学评价
4.1免疫方案及小鼠免疫
参照实施例3.1制备TM8单组分疫苗、TM22+TM23双组分疫苗及TM22+TM23+TM28+TM41四组分疫苗。
6周左右C57BL/6J雌性小鼠(来源:北京维通利华实验动物技术有限公司)分别在第0天和第14天通过肌肉注射方式免疫100μL含MF59佐剂的TM8单组分苗抗原(1μg/剂),于2免7天眼眶进行血清学免疫分析。在第70天和第182天,以相同的免疫方式分别加强免疫TM22+TM23+TM28+TM41四组分苗、TM22+TM23双组分苗、TM8单组分苗(抗原剂量:1μg/剂,其中TM22+TM23各组分配比为TM22∶TM23=1∶1,TM22+TM23+TM28+TM41各组分配比为TM22∶TM23∶TM28∶TM41=1∶1∶1∶3;MF59佐剂用量:2mg/剂),每组8只小鼠,共免疫4次。分别在单针和两针加强免疫后7天采血,进行血清学免疫分析。
4.2小鼠免疫血清中和效价的测定
4.2.1小鼠加强免疫一针后免疫血清对变异株中和效价的测定
参照实施例3.4检测小鼠免疫血清对Alpha、Beta、Delta,Omicron各亚型(BA.1,BA.2,BA.3,BA.4/5)假病毒的中和效价。TM22+TM23+TM28+TM41四组分疫苗单针加强免疫后(3免7天)诱导的Omicron BA.1、BA.2、BA.3、BA.4/5假病毒中和滴度几何平均值分别为1293,1178、803和722,分别是TM8单组分疫苗二免7天中和滴度的15.0倍、9.1倍、10.7倍和10.6倍,是TM8单组分疫苗加强免疫组的2.9倍、3.7倍、2.3倍和3.0倍,是TM22+TM23双组分疫苗加强免疫组的2.9倍、3.8倍、4.1倍和3.9倍(图10A-D);对Delta株中和滴度为22298,是TM8单组分疫苗二免7天中和滴度的5.2倍,是单组分疫苗加强免疫组的1.6倍,是双组分疫苗加强免疫组的1.6倍;此外,TM22+TM23+TM28+TM41四组分疫苗加强免疫可诱导高水平的Alpha和Beta变异株中和活性,分别为21257、12898(图11A-C)。提示四组分疫苗对SARS-CoV-2突变株Alpha、Beta、Delta和Omicron(BA.1,BA.2,BA.3,BA.4/5)具有更为广谱的中和活性,优于TM8单组分疫苗加强免疫或TM22+TM23双组分疫苗加强免疫。
4.2.2小鼠加强免疫两针后免疫血清对变异株中和效价的测定
TM22+TM23+TM28+TM41四组分疫苗两针加强免疫后(4免7天)诱导的Omicron BA.1、BA.2、BA.3和BA.4/5中和滴度几何平均值分别为14872,6897,8768和1136,分别是TM8单组分疫苗二免7天中和滴度的172.9倍、53.5倍、116.9和16.7倍,是TM8单组分疫苗加强免疫组的22.6倍、17.4倍、32.5倍和2.8倍,是TM22+TM23双组分疫苗加强免疫组的20.7倍、6.7倍、20.8倍、1.7倍(图12)。提示TM22+TM23+TM28+TM41四组分疫苗两针加强免疫可诱导高水平的0micron突变株(BA.1,BA.2,BA.3,BA.4/5)中和活性,优于TM8单组分疫苗加强免疫或双组分疫苗加强免疫。
综上所述,与单组分疫苗和双组分苗相比,四组分疫苗针对不同变异株具有广谱的中和能力,但保持了同单组分苗和双组分苗相近的高水平的T细胞免疫反应,有希望对多种变异毒株产生交叉保护能力,提高对变异株感染的保护率。
虽然前述已经用说明和实施例的方式对本发明进行了细节描述,但其目的在于理解方便,本领域普通技术人员显然可以对本发明的技术方案作出的各种变形和改进,而不会偏离附加的权利要求的精神或范围。
参考文献
1.Zhou,P.,et al.,Discovery of a novel coronavirus associated with the recent pneumonia outbreak in humans and its potential bat origin.BioRxiv,2020.
2.Hoffmann,M.,et al.,SARS-CoV-2 cell entry depends on ACE2and TMPRSS2and is blocked by a clinically proven protease inhibitor.Cell,2020.
3.Korber,B.,et al.,Spike mutation pipeline reveals the emergence of a more transmissible form of SARS-CoV-2.bioRxiv,2020:p.2020.04.29.069054.
4.Korber,B.,et al.,Tracking Changes in SARS-CoV-2 Spike:Evidence that D614G Increases Infectivity of the COVID-19 Virus.Cell,2020.182(4):p.812-827.e19.
5.https://www.cdc.gov/coronavirus/2019-ncov/cases-updates/variant-surveillance/variant-info.html.
6.Davies,N.G.,et al.,Increased mortality in community-tested cases of SARS-CoV-2 lineage B.1.1.7.Nature,2021.
7.Cele,S.,et al.,Escape of SARS-CoV-2 501Y..V2 from neutralization by convalescent plasma.2021.
8.Zhou,D.,et al.,Evidence of escape of SARS-CoV-2 variant B.1.351 from natural and vaccine-induced sera.Cell,2021.
9.Tada,T.,Neutralization of viruses with European,South African,and United States SARS-CoV-2 variant spike proteins by convalescent sera and BNT162b2 mRNA vaccine-elicited antibodies.2021.
10.Wang,P.,et al.,Increased Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7 to Antibody Neutralization.bioRxiv,2021.
11.Wadman,M.and J.Cohen,Novavax vaccine delivers 89%efficacy against COVID-19in UK-but is less potent in South Africa.Science,2021.
12.Wu,K.,et al.,mRNA-1273 vaccine induces neutralizing antibodies against spike mutants from global SARS-CoV-2 variants.2021.
13.Madhi,S.A.,et al.,Efficacy of the ChAdOx1 nCoV-19 Covid-19 Vaccine against the B.1.351 Variant.2021.
14.Shinde,V.,et al.,Efficacy of NVX-CoV2373 Covid-19 Vaccine against the B.1.351 Variant.New England Journal of Medicine,2021.
15.Abu-Raddad,L.J.,H.Chemaitelly,and A.A.Butt,Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants.2021.
16.Karim,S.S.A.,Vaccines and SARS-CoV-2 variants:the urgent need for a correlate of protection.Lancet,2021.397(10281):p.1263-1264.
17.Garcia-Beltran,W.F.,et al.,mRNA-based COVID-19 vaccine boosters induce neutralizing immunity against SARS-CoV-2 Omicron variant.medRxiv,2021:p.2021.12.14.21267755.
18.Dejnirattisai,W.,et al.,Reduced neutralisation of SARS-CoV-2 omicron B.1.1.529 variant by post-immunisation serum.Lancet,2022.399(10321):p.234-236.
19.Araf,Y.and F.Akter,Omicron variant of SARS-CoV-2:Genomics,transmissibility,and responses to current COVID-19 vaccines.2022.
20.Cai,Y.,J.Zhang,and T.Xiao,Distinct conformational states of SARS-CoV-2 spike protein.2020.369(6511):p.1586-1592.
21.McLellan,J.S.,et al.,Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus.Science,2013.342(6158):p.592-8.
22.Frey,G.,et al.,Distinct conformational states of HIV-1 gp41 are recognized by neutralizing and non-neutralizing antibodies.Nat Struct Mol Biol,2010.17(12):p.1486-91.
23.Tian,J.H.,et al.,SARS-CoV-2 spike glycoprotein vaccine candidate NVX-CoV2373 immunogenicity in baboons and protection in mice.2021.12(1):p.372.
24.Mercado,N.B.,et al.,Single-shot Ad26 vaccine protects against SARS-CoV-2 in rhesus macaques.2020. 586(7830):p.583-588.
25.Corbett,K.S.,et al.,SARS-CoV-2 mRNA Vaccine Development Enabled by Prototype Pathogen Preparedness.bioRxiv,2020.
26.Hsieh,C.L.,et al.,Structure-based Design of Prefusion-stabilized SARS-CoV-2 Spikes.bioRxiv,2020.
27.Crank,M.C.,A proof of concept for structure-based vaccine design targeting RSV in humans.2019.365(6452):p.505-509.
- 一种产生广谱交叉中和活性的重组新型冠状病毒RBD三聚体蛋白疫苗、其制备方法和应用
- 一种产生广谱交叉中和活性的重组新型冠状病毒RBD三聚体蛋白疫苗、其制备方法和应用
