医药组合物用于制备促发炎细胞介素抑制剂的用途
文献发布时间:2023-06-19 11:24:21
技术领域
本发明涉及一种用于降低个体中的促发炎细胞介素量的手段。具 体而言,本发明是涉及一种医药组合物用于制备促发炎细胞介素抑制 剂及制备治疗细胞介素释放症候群的药品的用途。
背景技术
过去,癌症的治疗药物主要为小分子化学药物或大分子抗体。现 在,治疗方法已经达到细胞疗法水平。然而,嵌合抗原受体T细胞免 疫疗法(CAR-T)已得到广泛研究。它具有特异性受体并靶向识别特异 性的细胞诸如肿瘤细胞。目前,世界上有两家制药公司Novartis及 Gilead,它们已被FDA批准进行CAR-T细胞疗法。临床试验表明,所 述疗法具有高缓解率及延长的总体存活期。
尽管CAR-T细胞疗法为临床上有效的,但亦有一些副作用,甚至 死亡。最普遍的不良反应为细胞介素释放症候群(Cytokine Release Syndrome,CRS)。当将CAR-T细胞注射至患者体内时,T细胞杀死癌 细胞,然后引起包括TNF-α、IFN-γ、IL-10及IL-6的细胞介素的释放, 导致患者发烧、低血压、呼吸衰竭。因此,如何控制由CAR-T细胞回 输引起的这些免疫风暴为CAR-T疗法的挑战。
发明内容
在数次药物筛选及测试之后,申请人发现多种化合物或组成物, 诸如吩噻嗪衍生物(Phenothiazine derivatives)、石莲花 (GraptopetalumParaguayense)提取物、红景天(Rhodiolarosea)提取物及 组蛋白去乙酰酶(Histone Deacetylase,HDAC)抑制剂,可以抑制促发炎 细胞介素的产生,因此提供了一种用于治疗患者的免疫反应的新方法, 同时避免了由降低抗肿瘤功效的潜在风险引起的不必要的免疫抑制。
如上文所述,本发明提供了一种新的用于降低个体中的促发炎细 胞介素表现量的方法;该方法包含向有需要的个体给予治疗有效量的 医药组合物,该医药组成物包含选自吩噻嗪衍生物、石莲花提取物、 红景天提取物、及组蛋白去乙酰酶(HDAC)抑制剂中的至少一种。
另外,本发明还提供一种治疗由CAR-T细胞疗法引起的细胞介素 释放症候群或由促发炎细胞介素的产生过量介导的病症的方法;该方 法包含向有需要的个体投予治疗有效量的医药组合物,该医药组成物 包含选自吩噻嗪衍生物、石莲花提取物、红景天提取物、及组蛋白去 乙酰酶(HDAC)抑制剂中的至少一种。
即,本发明可以提供一种医药组合物用于制备个体促发炎细胞介 素抑制剂的用途,所述医药组合物包含选自吩噻嗪衍生物、石莲花提 取物、红景天提取物、及组蛋白去乙酰酶(HDAC)抑制剂中的至少一种。
根据本发明的一个实施例,促发炎细胞介素(Proinflammatory Cytokine)为选自由TNF-α、IFN-γ、IL-10、及IL-6中的至少一种。
根据本发明的一个实施例,吩噻嗪衍生物为三氟拉嗪 (Trifluoperazine)或硫利达嗪(Thioridazine)。
根据本发明的一个实施例,组蛋白去乙酰酶(HDAC)抑制剂为辛二 酰苯胺异羟肟酸(Suberoylanilide Hydroxamic Acid)。
根据本发明的一个实施例,其中在投予含硫利达嗪的医药组合物 后6小时,细胞中的IFN-γ含量降低了至少18.6%;在投予含硫利达 嗪的医药组合物后24小时,细胞中的IFN-γ含量降低了至少28.2%。
根据本发明的一个实施例,其中在投予含石莲花提取物的医药组 合物后6小时,细胞中的IFN-γ含量降低了至少72.5%;在投予含石 莲花提取物的医药组合物后24小时,细胞中的IFN-γ含量降低了至少 77.7%。
根据本发明的一个实施例,其中在投予含红景天提取物的医药组 合物后6小时,细胞中的IFN-γ含量降低了至少36.3%;在投予含红 景天提取物的医药组合物后24小时,细胞中的IFN-γ含量降低了至少 62.9%。
根据本发明的一个实施例,其中在投予含硫利达嗪的医药组合物 后6小时,细胞中的IL-6含量降低了至少20.7%;在投予含硫利达嗪 的医药组合物后24小时,细胞中的IL-6含量降低了至少39.5%。
根据本发明的一个实施例,其中在投予含石莲花提取物的医药组 合物后6小时,细胞中的IL-6含量降低了至少37.5%;在投予含石莲 花提取物的医药组合物后24小时,细胞中的IL-6含量降低了至少 19.4%。
根据本发明的一个实施例,其中在投予含红景天提取物的医药组 合物后6小时,细胞中的IL-6含量降低了至少35.2%;在投予含红景 天提取物的医药组合物后24小时,细胞中的IL-6含量降低了至少 24.3%。
本发明的另一实施方式是关于一种医药组合物用于制备治疗细胞 介素释放症候群的药物的用途,所述医药组合物包含选自吩噻嗪衍生 物、石莲花提取物、红景天提取物、及组蛋白去乙酰酶(HDAC)抑制剂 中的至少一种。
根据本发明的一个实施例,细胞介素释放症候群是由CAR-T细胞 疗法引起的,并且医药组合物是在CAR-T细胞疗法期间或在CAR-T 细胞疗法之后投予。
根据本发明的一个实施例,细胞介素释放症候群是关于一或多种 促发炎细胞介素的产生过量。
本发明的另一实施方式是关于一种医药组合物用于制备治疗由细 胞介素的产生过量介导的病症的药品的用途,所述病症诸如发炎、自 体免疫疾病、糖尿病、动脉粥样硬化及癌症。
另外,本发明还可以提供一种医药组合物,其包含选自吩噻嗪衍 生物、石莲花提取物、红景天提取物、及组蛋白去乙酰酶(HDAC)抑制 剂中的至少一种;该医药组合物是用以降低个体中促发炎细胞介素表 现量,并且能够进一步治疗由CAR-T细胞疗法引起的细胞介素释放症 候群或由促发炎细胞介素的产生过量介导的病症。
以下,详细描述本发明的一或多个实施例。经由以下详细描述及 所附申请专利范围,将使得本发明的前述特征变得更加明显。应当理 解的是,前述一般描述及以下详细描述的意旨是只用于说明性目的而 具有例示性;而且并不用于限制本发明的范畴的意图。
附图说明
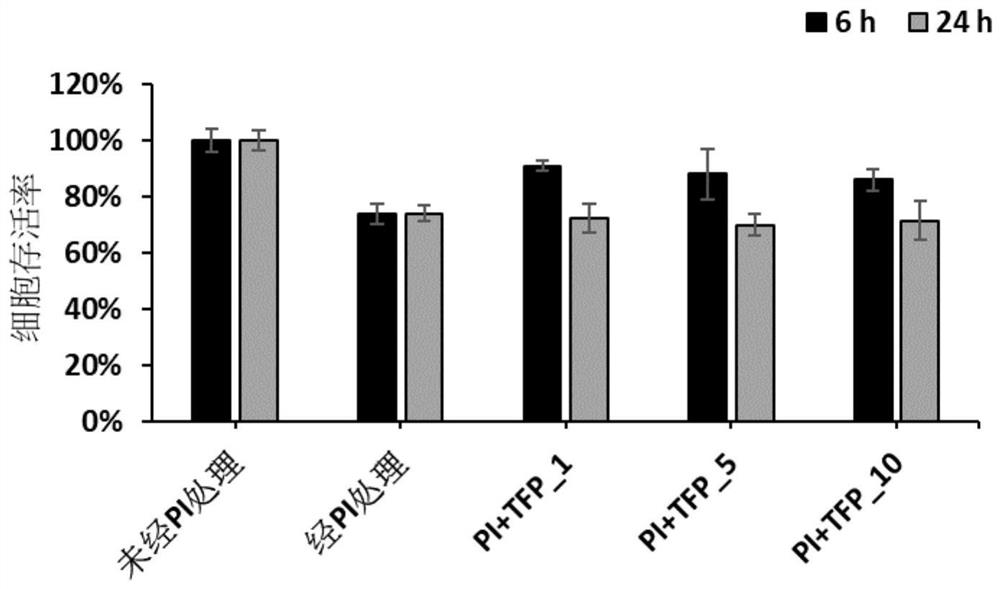
图1A为本发明的实施例1中的三氟拉嗪(TFP)的细胞存活率测试 结果图。
图1B为本发明的实施例1中的三氟拉嗪(TFP)的细胞介素释放测 试结果图。
图2A为本发明的实施例1中的硫利达嗪(THZ)的细胞存活率测试 结果图。
图2B为本发明的实施例1中的硫利达嗪(THZ)的细胞介素释放测 试结果图。
图3A为本发明的实施例1中的石莲花提取物(HH-F3)的细胞存活 率测试结果图。
图3B为本发明的实施例1中的石莲花提取物(HH-F3)的细胞介素 释放测试结果图。
图4A为本发明的实施例1中的红景天提取物(Rr-EtOH)的细胞存 活率测试结果图。
图4B为本发明的实施例1中的红景天(Rhodiolarosea)提取物 (Rr-EtOH)的细胞介素释放测试结果图。
图5A为本发明的实施例1中的辛二酰苯胺异羟肟酸(SAHA)的细 胞存活率测试结果图。
图5B为本发明的实施例1中的辛二酰苯胺异羟肟酸(SAHA)的细 胞介素释放测试结果图。
图6A为本发明的实施例2中的三氟拉嗪(TFP)的细胞存活率测试 结果图。
图6B为本发明的实施例2中的三氟拉嗪(TFP)的细胞介素释放测 试结果图。
图7A为本发明的实施例2中的硫利达嗪(THZ)的细胞存活率测试 结果图。
图7B为本发明的实施例2中的硫利达嗪(THZ)的细胞介素释放测 试结果图。
图8A为本发明的实施例2中的石莲花提取物(HH-F3)的细胞存活 率测试结果图。
图8B为本发明的实施例2中的石莲花提取物(HH-F3)的细胞介素 释放测试结果图。
图9A为本发明的实施例2中的红景天提取物(Rr-EtOH)的细胞存 活率测试结果图。
图9B为本发明的实施例2中的红景天(Rhodiolarosea)提取物 (Rr-EtOH)的细胞介素释放测试结果图。
图10A为本发明的实施例3中的硫利达嗪(THZ)的细胞存活率测 试结果图。
图10B为本发明的实施例3中的硫利达嗪(THZ)的细胞介素释放 测试结果图。
图11A为本发明的实施例4中的石莲花提取物(HH-F3)的细胞存 活率测试结果图。
图11B为本发明的实施例4中的石莲花提取物(HH-F3)的细胞介 素释放测试结果图。
具体实施方式
在本文中,本文所用的所有技术及科学术语均具有与本发明所属 领域中的普通技术人员通常理解的含义相同的含义。另外,除非上下 文有另外指示,否则本文所用的单数术语应包括复数,且复数术语应 包括单数。
除非本文另外定义,否则术语“治疗(treat/treating/treatment)” 意谓向患有特定疾病或病症的患者投予的动作,其中所述动作可以减 轻患者的疾病或病症、或降低一种或多种症状的严重性、或减慢或延 迟疾病或病症的进展。
在本文中,术语“有效量”意谓向患者直接或间接投予 (administered/administration)的医疗药物在适当的给药期后可达成降 低促发炎细胞介素表现量的作用的特定量。
在本文中,术语“个体”或“患者”可以彼此互换使用。术语“个体” 或“患者”是指分别可借由化合物及/或方法治疗的动物,包括但不限于 例如狗、猫、马、绵羊、猪、牛及其类似动物以及人类、非人类灵长 类动物。除非另外指定,否则“个体”或“患者”可包括男性及女性。另 外,其亦包括适合接受本发明的医药组合物及/或方法治疗的个体或患 者,较佳为人类。
尽管阐述本发明的广泛范畴的数值范围及参数为近似值,但在特 定实例中所阐述的数值尽可能精确地加以报告。然而,任何数值本身 均含有由其各自测试量测中存在的标准偏差必然引起的某些误差。在 本文中,术语“约”通常意谓实际值在特定值或范围以上或以下10%、 5%、1%或0.5%之内。替代地,术语“约”指示当由本领域中的普通技 术人员考虑时,实际值落在平均值的可接受的标准误差内。除在实例 中或另外有明确指示的以外,本文所用的所有范围、量、值及百分比(例 如,用于描述材料的量、时间、温度、操作条件、量比率及其类似者) 应理解为借由词“约”进行修饰。因此,除非有相反的明确说明,否则 本说明书及所附权利要求书中所公开的数值参数全部为近似值,并且 如果需要,可以改变。无论如何,各数值参数应至少依照报告的有效 数位的数值且借由应用普通的舍入技术来解释。
在本发明的一个实施方式中,本发明提供一种用于降低个体中的 促发炎细胞介素表现量的方法,其借由向有需要的个体投予治疗有效 量的医药组合物来进行,所述医药组合物包含选自吩噻嗪衍生物、石 莲花提取物、红景天提取物、及组蛋白去乙酰酶(HDAC)抑制剂中的至 少一种。
根据上文,所公开的医药组合物可借由众所所周知的制药制程制 备。在本发明的一个实施方式中,本发明中所公开的医药组合物可借 由任何适当的给药途径投予,例如借由以胶囊、悬液剂或糖衣锭的口 服投予或者借由例如以肌内注射、静脉内注射、皮下注射或腹膜内注 射的肠胃外投予的全身投予模式。此外,在一些实施例中,本发明中 所公开的医药组合物亦可通过透黏膜或透皮手段进行投予,例如局部 皮肤应用、或者支气管、鼻或口服吸入、或者呈滴鼻剂的滴注;且亦 可经直肠投予。
对于口服投予,本发明中所公开的医药组合物可以与赋形剂一起 投予或可以不与赋形剂一起投予。同样,本发明的医药组合物亦可调 配成呈固体剂型的糖衣锭,其中含有各种助剂、崩解剂、颗粒状黏合 剂或润滑剂。另外,在一个实例中,亦可使用乳糖或高分子量聚乙二 醇。此外,视情况,任何药物活性成分的释放速率可用包衣或包层例 如肠溶衣经进一步改善。在其他实例中,本发明的医药组合物亦可调 配成脂质体结构或仿生细胞外基质是统结构,或者可填充至硬质及软 质明胶胶囊中,或者可封装至套组中的可生物降解的颗粒中。
同样,在本发明中,医药上可接受的赋形剂意谓与医药调配物的 其他成分相容并且与有机体相容的赋形剂,例如封装材料或各种添加 剂诸如吸收增强剂、抗氧化剂、黏合剂、缓冲液、包衣剂、着色剂、 稀释剂、崩解剂、乳化剂、补充剂、填充剂、调味剂、保湿剂、润滑 剂、香料、防腐剂、推进剂、脱模剂、杀菌剂、甜味剂、增溶剂、润 湿剂及其混合物。
适用于本发明的助剂的实例可为例如微晶纤维素、碳酸钙、磷酸 氢钙或甘胺酸。适用于本发明的崩解剂的实例可为例如淀粉、藻酸或 某些硅酸盐。适用于本发明的颗粒状黏合剂的实例可为例如聚乙烯吡 咯啶酮、蔗糖、明胶或阿拉伯胶。适用于本发明的颗粒状黏合剂的实 例可为例如硬脂酸镁、月桂基硫酸钠或滑石。适用于本发明的赋形剂 的实例可为例如乳糖、蔗糖、甘露醇、山梨糖醇、玉米淀粉、小麦淀 粉、米淀粉、马铃薯淀粉、明胶或黄蓍胶。
在一些实施例中,本发明的医药组合物经调配成适合口服投予的 液体剂型,例如口服悬液剂、乳剂、微乳剂及/或酏剂。对于此一液体 剂型,本发明的医药组合物的活性成分可进一步与各种甜味剂或调味 剂、着色剂或染料一起调配,如果需要,则添加乳化剂及/或助悬剂、 或稀释剂诸如水、酒精、丙二醇或甘油、或用于维持pH值的缓冲液。
同样,在其他实施例中,将含有本发明的医药组合物的液体调配 物制成无菌可注射溶液或悬液剂;例如,制成适于借由静脉内、肌内、 皮下或腹膜内注射投予的溶液。
在一些实施例中,本发明中所公开的医药组合物可以用作另外的 辅助治疗剂,以改善癌症的主要治疗方法如手术、放射疗法或化学疗 法的治疗效果。本发明中所公开的医药组合物可以单独应用或与已知 医药上可接受的助剂组合应用,并且例如可以口服或与食物一起向个 体投予。
在一些实施例中,本发明的方法进一步包括在向个体投予本发明 的医药组合物之前、期间或之后,另外向个体应用癌症的另一主要治 疗手段诸如手术、放射疗法或化学疗法,以便改善个体中的癌症的治 疗效果。
为了更全面且完整地描述本发明,以下对本发明的实施方式及具 体实例进行说明性的描述。然而,此等并无代表本发明的具体实例中 可实践或可利用的唯一形式的意图。实施例中涵盖了多个具体实例的 特征和构造;以及操作这些具体实例的过程步骤及顺序。然而,在其 他实例中,亦可借由相同或等效的功能及步骤顺序来完成。
首先,描述本发明的实例中的测试的标准操作过程。
<细胞培养及试剂>
本实施例中所选用的人类Jurkat T细胞株(Clone E6-1,ATCC TIB 152)及人类白血病细胞株THP-1,购自中国台湾生物资源保存及研究 中心(Bioresource Collectionand Research Centre;BCRC)。将细胞维持 在具有2mM L-麸酰胺的RPMI 1640培养基(Gibco,Carlsbad,CA,USA) 中,所述培养基经调整成含有1.5g/L碳酸氢钠、4.5g/L葡萄糖、10mM HEPES、1.0mM丙酮酸钠、1%(v/v)青霉素-链霉素(HyClone,Logan,UT) 及10%(v/v)胎牛血清(FBS;HyClone)。将细胞在37℃下保存在具有5% CO
<试剂及药物>
此实施例中所用的离子霉素(ionomycin)、佛波醇12-肉豆蔻酸酯 13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)、脂多醣 (Lipopolysaccharide,LPS)、三氟拉嗪(Trifluoperazine,TFP)、硫利 达嗪(Thioridazine,THZ)及辛二酰苯胺异羟肟酸(Suberoylanilide hydroxamic acid,SAHA)购自Sigma-Aldrich(St.Louis,MO,USA)。
根据制造商的说明,用于细胞毒性检定的3-(4,5-二甲基噻唑-2- 基)-5(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑 (3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)-2-(4-sulfophe nyl)-2H-tetrazolium,MTS)购自CellTilter
可借由美国专利第8686030号中所示的方法制备石莲花提取物及 红景天提取物,所述专利所公开的内容以全文引用的方式并入本文。
即,将石莲花(称为GP)的叶子研磨并在-20℃下冻干成粉末,且在 提取前在25℃下储存于防潮箱(moisture buster)中。首先,将1.5g GP 粉末与10ml 100%甲醇(MeOH)震荡5分钟,然后以1500g离心5分 钟。去除上清液后,将10ml水、100%丙酮、100%甲醇、100%乙醇、70%乙醇、50%乙醇、100%DMSO及30%DMSO添加至各沉淀物中以 使其重新悬浮以得到各提取物。将悬浮液藉由震荡5分钟进行混合, 以1500g离心5分钟两次,再次以9300g离心5分钟并在室温下使用 0.45μm滤器进行层流过滤。
然后,借由Sephadex LH-20管柱将30%DMSO上清液分级成四 个流份(HH-F1、HH-F2、HH-F3、HH-F4),并且借由具有UV侦测器 的高效液相层析法(HPLC)进一步分析各流份。本发明中较佳选择 HH-F3。
类似地,将红景天(称为RS)的植物冻干成粉末,且在提取前在25℃ 下储存于防潮箱中。将1.5公克的RS粉末溶解在10ml H
将Jurkat细胞以每毫升5.0×10
借由离心收集培养上清液,并-20℃下储存以供细胞介素分析。借 由ELISA套组(Invitrogen,Carlsbad,CA,USA)根据制造商的说明测 量IFN-γ及IL-6的浓度。
<细胞存活率检定>
使用MTS试剂(Promega)确定细胞存活率。在37℃、5%CO
此后,将借由参考附图解释本发明的较佳实施例来详细描述本发 明。
《实施例1》
为了诱导IFN-γ产生,将Jurkat T细胞如上文所述进行培养并用 PMA加上离子霉素刺激24小时,之后分别用如表1中所示的候选药 物进行培育。6小时及24小时后,收集上清液以供细胞存活率分析及 细胞介素分析。采用人类IFN-γELISA套组(Invitrogen)根据制造商的 说明量测细胞介素的浓度,并将所测得的IFN-γ浓度与细胞存活率相 除(IFN-γ/细胞存活率),进而获得用细胞存活率正规化的IFN-γ浓度。
表1中列出了细胞存活率结果及用细胞存活率正规化的IFN-γ浓 度。并且结果亦显示在图1A、图1B、图2A、图2B、图3A、图3B、 图4A、图4B、图5A及图5B中。
表1
关于细胞存活率,从以上表1中可以看出,在用PMA加上离子霉 素预培养24小时后,Jurkat T细胞的细胞存活率降低至约80~90%。 并且在药物处理6小时及24小时后,细胞存活率的下降小于30%,表 明上述药物不对细胞造成严重损伤。此外,HH-F3能够恢复由PMA 及离子霉素引起的细胞损伤,从而增加细胞存活率。
此外,关于IFN-γ含量,从以上表1可以看出,在存在PMA加上 离子霉素的情况下,Jurkat T细胞可经刺激以产生IFN-γ。并且在药物 处理6小时及24小时后,Jurkat T细胞中的IFN-γ含量能够降低。在 它们当中,与TFP及SAHA相比,硫利达嗪(THZ)、HH-F3及Rr-EtOH 对细胞的作用更强。随着这三种药物浓度及培养时间的增加,IFN-γ 含量逐渐降低。
更特定而言的,当所述医药组合物仅包含硫利达嗪时,在投予分 别含有1μM、5μM及10μM硫利达嗪的医药组合物6小时后,细胞 中的IFN-γ含量分别降低了18.6%、23.7%及36.2%;在投予分别含有 1μM、5μM及10μM的硫利达嗪的医药组合物24小时后,细胞中的IFN-γ含量分别降低了28.2%、57.7%及52.2%。
当所述医药组合物仅包含石莲花提取物(HH-F3)时,在投予分别含 有10μg/mL、20μg/mL及40μg/mL的石莲花提取物(HH-F3)的医药组 合物6小时后,细胞中的IFN-γ含量分别降低了72.5%、80.8%及90.8%; 在投予分别含有10μg/mL、20μg/mL及40μg/mL的石莲花提取物 (HH-F3)的医药组合物24小时后,细胞中的IFN-γ含量分别降低了 77.7%、87.1%及94.4%。
当所述医药组合物仅包含红景天提取物(Rr-EtOH)时,在投予分别 含有10μg/mL、20μg/mL及40μg/mL的红景天提取物(Rr-EtOH)的医 药组合物6小时后,细胞中的IFN-γ含量分别降低了36.3%、57.2%及 60.9%;在投予分别含有10μg/mL、20μg/mL和40μg/mL的红景天提 取物(Rr-EtOH)的医药组合物24小时后,细胞中的IFN-γ含量分别降 低了62.9%、67.0%及76.6%。
《实施例2》
为了诱导IL-6产生,将THP-1细胞如上文所述进行培养并用LPS 刺激16小时,之后分别用如表2中所示的候选药物进行培育。6小时 及24小时后,收集上清液以供细胞存活率分析及细胞介素分析。借由 IL-6ELISA套组(Invitrogen)根据制造商的说明量测细胞介素的浓度, 并将所测得的IL-6浓度与细胞存活率相除(IFN-γ/细胞存活率),进而 而获得用细胞存活率正规化的IFN-γ浓度。
表2中列出了细胞存活率结果及用细胞存活率正规化的IL-6浓 度。并且结果亦显示在图6A、图6B、图7A、图7B、图8A、图8B、 图9A及图9B中。
表2
关于IL-6含量,从以上表2可以看出,在存在PMA加上离子霉 素的情况下,JurkatT细胞可经刺激以产生IL-6。并且在药物处理6 小时及24小时后,Jurkat T细胞中的IL-6含量能够降低。在它们当中, 与TFP相比,硫利达嗪(THZ)、HH-F3及Rr-EtOH对细胞的作用更强。 随着这三种药物浓度及培养时间的增加,IL-6含量逐渐降低。
更特定言的,当所述医药组合物仅包含硫利达嗪时,在投予分别 含有1μM、5μM及10μM的硫利达嗪的医药组合物6小时后,细胞 中的IL-6含量分别降低了20.7%、37.1%及45.9%;在投予分别含有1 μM、5μM及10μM的硫利达嗪的医药组合物24小时后,细胞中的IL-6 含量分别降低了39.5%、51.8%及65.2%。
当所述医药组合物仅包含石莲花提取物(HH-F3)时,在投予分别含 10μg/mL、20μg/mL及40μg/mL的石莲花提取物(HH-F3)的医药组合 物6小时后,细胞中的IL-6含量分别降低了39.2%、37.5%及38.5%; 在投予分别含有10μg/mL、20μg/mL及40μg/mL的石莲花提取物 (HH-F3)的医药组合物24小时后,细胞中的IL-6含量分别降低了 26.3%、19.4%及22.3%。
当所述医药组合物仅包含红景天提取物(Rr-EtOH)时,在投予分别 含有10μg/mL、20μg/mL及40μg/mL的红景天提取物(Rr-EtOH)的医 药组合物6小时后,细胞中的IL-6含量分别降低了35.2%、47.5%及 44.6%;在投予分别含有10μg/mL、20μg/mL和40μg/mL的红景天提 取物(Rr-EtOH)的医药组合物24小时后,细胞中的IL-6含量分别降低 了24.3%、24.9%及24.5%。
《实施例3》
在所述实施例中,将Jurkat细胞以每毫升5.0×10
24小时及48小时后,收集上清液以供细胞存活率分析及细胞介 素分析。借由人类IFN-γELISA套组(Invitrogen)根据制造商的说明量 测细胞介素的浓度。表3中列出了细胞存活率结果及用细胞存活率正 规化的IFN-γ浓度。并且结果亦显示在图10A及图10B中。
表3
*IFN-γ/细胞存活率:用细胞存活率正规化的IFN-γ浓度
从以上表3中列出的结果中清楚知道,在培育24小时及48小时 后,第3组的IFN-γ数值正规化后分别为34.9pg/mL及32.6pg/mL, 比第2组降低46.5%及18.7%;在培育24小时及48小时后,第4组 的IFN-γ数值正规化后分别为35.7pg/mL及39.7pg/mL,比第2组降低45.3%及1.0%。THZ及PMA加上离子霉素的共处理显著减弱了 Jurkat细胞中的细胞介素诱导。结果表明可在CAR-T细胞疗法期间向 个体投予药物,以阻止细胞介素产生。
此外,第2组、第3组与第4组的间的细胞存活率没有显著差异, 因此可清楚地知道,THZ不影响细胞存活率。
《实施例4》
在所述实施例中,将Jurkat细胞以每毫升5.0×10
24小时、30小时及48小时后,收集上清液以供细胞存活率分析 及细胞介素分析。借由人类IFN-γELISA套组(Invitrogen)根据制造商 的说明量测细胞介素的浓度。表4中列出了细胞存活率结果及用细胞 存活率正规化的IFN-γ浓度。并且结果亦显示于图11A及图11B中。
表4
*用细胞存活率正规化的IFN-γ浓度(pg/ml)
从以上表4中列出的结果中可清楚知道,在培育24小时、30小 时及48小时后,第3组的IFN-γ数值正规化后分别为39.5pg/mL、24.9 pg/mL及23.7pg/mL,比第2组降低39.5%、50.4%及35.4%;在培育 24小时、30小时及48小时后,第4组的IFN-γ数值正规化后分别为 29.0pg/mL、19.1pg/mL及20.5pg/mL,比第2组降低55.6%、62.0% 及44.1%;在培育24小时、30小时及48小时后,第5组的IFN-γ数 值正规化后分别为24.2pg/mL、13.9pg/mL及18.2pg/mL,比第2组 降低62.9%、72.3%、50.4%。HH-F3及PMA加上离子霉素的共处理显 著减弱了Jurkat细胞中的细胞介素诱导。结果表明可在CAR-T细胞疗 法期间向个体投予药物,以阻止细胞介素产生。
此外,关于细胞存活率,第3组至第5组的细胞存活率高于第2 组,这表明HH-F3可恢复由PMA及离子霉素引起的细胞损伤,然后 增加细胞存活率。
本发明显示以下内容:抗精神病药物硫利达嗪(THZ)显著降低了产 生IFN-γ的细胞中的IFN-γ的表现量。经研究中草药HH-F3及Rr-EtOH 的处理对减少IFN-γ分泌量有显著作用,并且亦影响了T细胞中的IL-6 分泌。此外,采取处理后细胞的存活率几乎不受影响。结果表明,候 选药物硫利达嗪(THZ)、HH-F3及Rr-EtOH可能具有免疫抑制作用, 并提供了细胞介素释放症候群的潜在疗法。
此外,借由使用药物共处理方法,HH-F3及硫利达嗪亦能够减少 细胞介素产生。结果表明,HH-F3及硫利达嗪在CAR-T细胞抗癌疗法 中预防细胞介素释放症候群。
上文所述的具体实施例仅用于说明本发明的特征和效果,且不旨 在限制本发明的实施方案范畴。在不脱离本发明的精神及技术范畴的 情况下,基于本发明中所公开的内容进行的任何等效改变及修改仍落 在所描述的专利范畴内。
- 医药组合物用于制备促发炎细胞介素抑制剂的用途
- 化合物及其组合物用于制备缓解肺部细胞发炎活性的医药品的用途
