用于治疗皮下脂肪团的组合物和方法
文献发布时间:2023-06-19 11:32:36
相关申请
本申请要求2018年9月18日递交的美国临时专利申请第 62/733,046号、2019年1月6日递交的美国临时专利申请62/788,916 号、2019年2月28日递交的美国临时专利申请第62/812,036号、 2019年3月25日递交的美国临时专利申请第62/823,596号、2019 年7月11日递交的国际申请PCT/US2019/041494和2019年7月12 日递交的国际申请第PCT/US2019/41718号的优先权,这些专利的全部内容通过引证在此全部并入本文。
技术领域
本申请涉及评估并治疗皮下脂肪团领域。
背景技术
皮下脂肪团(也称为水肿性纤维硬化性泛神经病变(EFP))是一种美学疾病,可以理解为皮下连接处的结构特征和生物力学特性 (即微妙的遏制力和挤出力)之间的不平衡(Rudolph et al,“Structural Gender Dimorphism and the Biomechanics of theGluteal Subcutaneous Tissue:Implications for the Pathophysiology ofCellulite,(“结构性别二型性和臀部皮下组织的生物力学:皮下脂肪团病理生理学的意义)”Plast.Reconstr.Surg.2019;143(4): 1077-1086)。因此,皮下脂肪团治疗的目的是加强皮下界面和/或通过各种类型的皮下注射释放纤维隔膜(Rudolph等人,同上)。通过解剖和图像分析研究,纤维间隔被认为是引起皮下脂肪团的主要原因,也是治疗皮下脂肪团的靶点((Hexsel et al,“Side-by-side comparison of areas with and withoutcellulite depressions using magnetic resonance imaging,”Dermatol Surg.2009;35(10):1471-1477; Hexsel et al.“Magnetic Resonance Imaging of CelluliteDepressed Lesions Successfully Treated by Subcision,”Dermatol Surg.2016;42(5):693-696;Mirrashed F,Sharp JC,Krause V,Morgan J,Tomanek B. “Pilot study ofdermal subcutaneous fat structures by MRI in individuals who differ ingender,BMI,and cellulite grading,”Skin Res Technol.2004;10(3):161-168;Nürnberger and Müller,“So-called cellulite:an invented disease,”J Dermatol SurgOncol.1978;4 (3):221-229;Piérard et al,“Cellulite:from standing fatherniation to hypodermal stretch marks,”Am J Dermatopath.2000;22(1):34-37;Querleux et al,“Anatomy and physiology of subcutaneous adipose tissue by invivo magnetic resonance imaging and spectroscopy: relationships with sex andpresence of cellulite,”Skin Res Technol. 2002;8(2):118-124)。为了有效地治疗皮下皮下脂肪团,需要一种治疗方法来溶解或破坏真皮隔膜,所述真皮隔膜是由胶原蛋白组成的(图1),并导致皮肤凹陷,困扰许多妇女。
有一些疗法已被用于治疗皮下脂肪团;但是,没有被批准的药物治疗。尽管有多种治疗方式,但几乎没有科学证据表明目前的任何非药物治疗都是有益的。事实上,许多证据都是传闻、主观的,或者仅仅基于患者的自我评估。EFP的一些历史治疗包括减肥、外用药物、按摩、吸脂、介体疗法、射频、分切、动力分切和激光疗法。这些治疗方法中的许多都有不良副作用(Avram MM,“Cellulite:a review of its physiology and treatment,”JCosmet Laser Ther.2004;6 (4):181-185;Collis et al,“Cellulite treatment:a mythor reality:a prospective randomized,controlled trial of two therapies,endermologie and aminophylline cream,”Plast Reconstr Surg. 1999;104(4):1110-1114;Khan MH,Victor F,Rao B,Sadick NS. “Treatment of cellulite:PartI.Pathophysiology.”J Am Acad Dermatol. 2010;62(3):361-370;Hexsel DM,MazzucoR.“Subcision:a treatment for cellulite.”Int J Dermatol.2000;39(7):539-544;Boyce et al,“Clinical evaluation of a device for the treatment of cellulite:Triactive.”Am J Cosmet Surg.2005;22:233-237;DiBernardo BE. “Treatment ofcellulite using a 1440-nm pulsed laser with one-year follow-up.”Aesthet SurgJ.2011;31(3):328-341)。因此,许多医生认为,改善审美条件是不容易的。因此,仍然需要安全有效的非手术疗法来改善患有皮下脂肪团的妇女的美容效果。
发明内容
这里公开的内容满足上述需要,并涉及通过皮下注射治疗有效量的胶原酶(如具体实施方式中所定义)来治疗人类患者的皮下脂肪团的方法。这些方法涉及使用各种量表和评估技术对患者的皮下脂肪团严重程度进行治疗前评估,以建立患者的皮下脂肪团严重程度基线。然后皮下注射胶原酶治疗皮下脂肪团。胶原酶的剂量和给药方式可以变化,并且所述胶原酶可以以药物组合物的形式存在,所述药物组合物包括胶原酶和一种或一种以上医药上可接受的赋形剂。此类赋形剂可包括无菌注射用水、pH调节剂和稳定剂。进行治疗后评估,以确认与基线相比的治疗效果。这里公开的治疗方法可显著减少皮下脂肪团的出现。
如具体实施方案所述,共有四个治疗阶段,尽管它们是选择性的并且并不需要严格限制实施顺序。
1.在第一阶段,临床医生选择皮下脂肪团凹坑进行治疗。接下来,在注射之前,进行评估,例如,临床医生和/或患者使用以下一个或多个量表或其他评估方法(如具体实施方式中所定义)独立地评估皮下脂肪团的治疗前严重程度:
οHexsel皮下脂肪团严重程度分级表(Hexsel CSS)
οHexsel凹陷深度评分表
ο里克特量表
ο凹坑分析
ο临床医生报告的相片数字皮下脂肪团严重程度量表 (CR-PCSS)
ο患者报告的相片数字皮下脂肪团严重程度量表(PR-PCSS)
ο研究者全球审美改善量表(I-GAIS)
ο受试者全球审美改善量表(S-GAIS)
ο患者报告的皮下脂肪团影响量表(PR-CIS)
οPR-CIS简化版
ο患者自评表(SSRS)
ο受试者对皮下脂肪团治疗的满意度调查表(SSCT)
ο临床医生对皮下脂肪团严重程度的评估(摄影或其他图像)
οBody-Q
ο菲茨帕特里克量表
ο大腿皮下脂肪团疗效量表(PR-TCES;CR-TCES)
ο大腿皮下脂肪团严重程度量表-患者(TCS-P);大腿皮下脂肪团严重程度量表-临床医生(TCS-C)
ο任何有效的图像数字或者其他临床使用和/患者用于评价皮下脂肪团严重程度、改善和/或病人满意度的量表(例如,Hexsel-Merz 量表(Hexsel et al.,“ValidatedAssessment Scales for Cellulite Dimples on the backbutes and thighs in FemalePatients,”Dermatologic Surgery: August 2019(Volume 45)Issue p S2-S11和2019年美国皮肤病学会会议海报发布)。
此外,临床医生和患者的治疗前评估可以通过分析一系列1到 15张照片、插图、图纸、计算机图像、3-D模型、MRI图像、热像图、超声波图、患者口头反馈等来执行,每一张照片、插图、图纸、计算机图像、3-D模型、MRI图像、热像图、超声波图、患者口头反馈等具有不同的皮下脂肪团严重程度等级或水平。
2.在治疗的第二阶段,临床医生用圆点或其他标记标出待治疗的凹坑(图6)。如果存在最低点,则通常将其放置在凹坑的最低点。可拍摄更多的照片并进行其他评估。
3.在治疗的第三阶段中,在一个或多个治疗区域(如具体实施方式部分的定义)以单剂量或多剂量将治疗有效量的胶原酶皮下注射到凹坑中。剂量和注射技术各不相同。例如,该方法可包括根据以下程序:
·当受试者处于俯卧姿势时,使用带有30号1/2英寸针头的注射器将胶原酶组合物(例如CCH)注射到皮下。如图7(以下简称“治疗I”)所示,每个注射部位接受胶原酶组合物的单次皮肤注射,将胶原酶组合物作为三份0.1毫升的等分物注射到位置A、B和C,总注射量为0.3毫升。注射深度为1/2英寸,对应于治疗针从针尖到针座的长度,没有向下的压力。在每个注射部位,将针头放置在与皮肤表面垂直的90°处并插入,然后注射0.1mL的胶原酶组合物(位置 A)。轻轻抽出针头(但不从皮肤上取下),将针头重新放置在离垂直方向45°且高于酒窝长轴的位置,然后注射0.1毫升的胶原酶成分(位置B,朝向头部方向)。再次轻轻抽出针头,将针头重新定位在离垂直方向约45°的位置,并低于酒窝的长轴,然后注射0.1mL 的胶原酶成分(位置C,朝向脚部方向)。注射后,受试者保持俯卧5分钟。
在一个实施例中,治疗I可用于在三个治疗疗程期间在每个治疗区域皮下注射12次0.84mg胶原酶组合物,每次间隔至少21天(+/-3 天窗口期)。例如,可施用5.04mg的累积剂量(即,3次治疗访视 x0.84mg/治疗区域x2个治疗区域)。在具体实施方式部分详细说明了其它技术。
4.在治疗的第四阶段,使用上述量表和其他评估方法(例如,瘀伤分析)进行注射后评估。特定胶原酶治疗的疗效可基于单个临床医生评级或患者评级,或基于由临床医生评级和患者评级组成的复合终点,其中在同一受试者的两个量表中显示改善,即,临床医生和患者量表都显示了预先规定的改善水平。
胶原酶以约0.01mg至约20mg的量被注射,可以单剂量注射可以被分成几个分剂量注射,并具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量为大约60kDa至大约130kDa,或者大约70至大约130 kDa,或大约80至大约120kDa,或大约90至大约120kDa,或大约100至大约110kDa。
·通过反相HPLC(高压液相色谱法)测定的纯度(按面积计) 至少为80%
·效价(即比活性)约为500至约30000SRC单位/mg
·效价约为5,000至约30,000f-SRC单位/mg
·效价约为100,000至约400,000GPA单位/mg
·效价约为175,000至约500,00f-GPA单位/mg
·效价约为5,000至约25,000ABC单位/mg
·小于或等于1%(按面积计)的杂质,该杂质选自梭菌蛋白酶、明胶酶和亮肽
·小于或等于1cfu/mL的生物负荷
如本文所用,可使用如本文所述的反应杯测定或微孔板测定(例如,SRC反应杯测定、SRC微孔板测定、GPA反应杯测定和GPA 微孔板测定)来测量相关动力学参数。
在一些实施方案中,组合物中存在的胶原酶包含按约1∶1比例存在的胶原酶I和胶原酶II。也可以采用其他比例的胶原酶I和胶原酶II,例如0.1-2∶1,或0.25-2∶1,或0.5-2∶1,或0.75-2∶1,或1∶0.1-2,或1∶0.25-2,或1∶0.5-2,或1∶0.75-2,或1∶0,或0∶ 1。胶原酶I和胶原酶II中的每一种可具有至少80%、85%、90%、 91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的面积纯度,如通过反相HPLC测量的。
在另一实施方案中,胶原酶组合物包含CCH(如具体实施方式中所定义的),CCH中含有的AUX I和AUX II的比率约为1∶1。也可以采用其他比率的AUX I和AUX II,例如0.1-2∶1、或0.25-2∶ 1、或0.5-2∶1、或0.75-2∶1、或1∶0.1-2、或1∶0.25-2、或1∶0.5-2、或1∶0.75-2、或1∶0、或0∶1。AUX I和AUX II中的每一个可具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、 98%、99%或100%的面积纯度,如通过反相HPLC测量的。
在其它实施例中,胶原酶组合物可为液体或由冻干固体形式与稀释剂重组。混合物的剂量通过胶原酶的存在量来测量,而不考虑稀释剂,并且在一次或多次注射中可包含约0.1mg到约20mg的胶原酶。在另一实施方案中,在一次或多次注射中施用的剂量为约0.06mg、0.48mg、0.84mg、1.68mg、2.52mg、3.36mg、4.2mg、5.04mg、 5.88mg、6.72mg、7.56mg或8.4mg。例如,在大约12次分次注射中施用约0.06mg、0.48mg、0.84mg或1.68mg。注射的胶原酶组合物的体积可在每次注射0.01mL到3mL之间,或每次治疗随诊的总量约为0.2mL到150mL(如具体实施方式中所定义的)。在特定实施方案中,上述剂量是针对包含CCH的胶原酶组合物。在另一实施方案中,上述剂量用于具有以下一个或多个特征的胶原酶组合物:
·V
·K
·K
·1/K
·K
·分子量为大约60kDa至大约130kDa,或者大约70至大约130 kDa,或大约80至大约120kDa,或大约90至大约120kDa,或大约100至大约110kDa。
·通过反相HPLC(高压液相色谱法)测定的纯度(按面积计) 至少为80%
·效价(即比活性)约为500至约30000SRC单位/mg
·效价约为5,000至约30,000f-SRC单位/mg
·效价约为100,000至约400,000GPA单位/mg
·效价约为175,000至约500,00f-GPA单位/mg
·效价约为5,000至约25,000ABC单位/mg
·小于或等于1%(按面积计)的杂质,该杂质选自梭菌蛋白酶、明胶酶和亮肽
·小于或等于1cfu/mL的生物负荷
在另一实施方案中,在每个治疗区域约12次等分注射中注射约 0.84mg的CCH(约0.07mg x12次注射=约0.84mg)。在某些情况下,这种0.84毫克的治疗发生在一次治疗访视中,或每10-40天进行2次、3次、4次或5次治疗访视。在其他情况下,多个治疗区域每10-40天注射0.84毫克,进行2次、3次、4次或5次治疗访视。此类注射可在5次以上的治疗访问中进行。
此外,如具体实施方式部分所述,胶原酶注射对治疗皮下脂肪团是有效的。例如,通过Hexsel凹陷深度评分、里克特量表评分和凹坑分析,可以证明皮下脂肪团外观的显著改善。
CCH注射液最常见的副作用是注射部位反应,包括:瘀伤、疼痛、结节、瘙痒、肿胀、硬度、变色和发红。注射部位的瘀伤在治疗过程中通常会减少。
从随后的描述、附图、实施例和权利要求书中,本发明组合物、规模、方法等的其他实施方案变得显而易见。从前面和下面的描述中可以理解,这里描述的每个特征以及两个或更多这样的特征的每个组合都包括在本发明的范围内,前提是包括在这样的组合中的特征不是相互不一致的。此外,可以从任何实施例或方面具体排除任何特征或特征的组合。以下描述和权利要求中阐述了其他方面和实施方案,特别是当结合所附示例和附图考虑时。
附图简要说明
专利或申请文件至少包含一幅彩色图纸。经要求并支付必要费用后,专利局将提供本专利或专利申请出版物的彩色图纸副本。
通过参考以下详细描述并与所附附图相结合,各个实施方案的上述特征将更容易理解,其中:
图1是描述胶原隔膜的皮肤和真皮下组织的横截面图。
图2是AUX-I(Seq.ID NO.5)的氨基酸序列列表。
图3是AUX-II(Seq.NO.ID 6)的氨基酸序列列表。
图4显示了Hexsel皮下脂肪团严重程度量表(CSS)(B)凹陷深度。
图5显示了大腿皮下脂肪团严重程度量表-患者(TCS-P);大腿皮下脂肪团严重程度量表-临床医生(TCS-C)。
图6举例说明了受试者臀部上的凹坑和注射部位标记。
图7描述了治疗I中使用的注射技术。
图8是RELEASE-1和RELEASE-2研究中复合应答者主要终点和关键次要终点的条形图,定义为第71天目标臀部CR-PCSS和 PR-PCSS评分较基线水平严重程度改善大于或等于2级或大于或等于1级的患者。
图9是第71天与基线相比CCH 0.84mg复合反应的一系列照片。图9A展示了CR-PCS和PR-PCS的2个水平的改善。图9B展示了 CR-PCS和PR-PCS的1个水平的改善。
图10是第71天非靶向臀部复合应答者主要终点和关键次要终点的条形图(用于数据分析)。综合反应被定义为在第71天CR-PCSS 和PR-PCSS评分中比基线严重程度改善大于或等于2级或大于或等于1级的患者。
图11是意向治疗(ITT)人群第71天PR-PCSS和S-GAIS应答者频率的条形图。
图12是改良意向治疗(mITT)人群第71天PR-CIS总分较基线平均改善的条形图。基线值用于没有进行第71天PR-CIS评估的妇女。
图13说明了三维网格注册中的预标记图像配准(第1天预标记)。图像以三维空间中的网格为中心。使用网格作为参考,图像分析技术人员(IAT)定位基线图像,以便将图像的近似中心放置在网格的原点。大腿/臀部朝-+-z方向向前,大腿/臀部上部朝+y方向,大腿/臀部下部朝-y方向。
图14是一种彩色距离图,用于图像配准。
图15说明了感兴趣区域(1)的主要凹陷。第1天-标记后图像用作参考,以在第1天-标记前图像上定位目标酒窝。然后,技师在跟踪的预标记图像上跟踪主凹坑的边界。
图16是转置感兴趣区域主要凹陷位置的一系列照片。根据每个后续图像与基线的唯一表面跟踪关系,将跟踪的预标记图像上的酒窝跟踪转置到第22天、第43天和第71天的后续图像上。
图17描述了受试者左臀部注射后第4天、第8天和第15天的正常组织和瘀伤组织的轮廓。
图18(A)描述了左臀部注射后第4天、第8天和第15天正常组织和瘀伤组织的轮廓,并提供了这些组织的L*、a*和b*颜色测量值。
图18(B)描绘了左臀部注射后第4天、第8天和第15天正常组织和瘀伤组织的轮廓。根据L*a*b*颜色值计算正常组织和瘀伤组织的平均颜色和ΔEs。
图19(A)-19(C)描述了凹坑分析。图19(A)说明了观察到的和从第1天开始在凹坑分析参数中标记前图像的变化。图19(B) 说明了凹坑的最大长度和最大宽度。图19(C)说明了凹坑底部和内插表面之间的表面积和体积。
图20是实施例3的目标臀部(mITT群体)随时间平均PR-PCSS 评级的折线图。下部曲线是CCH治疗与安慰剂(上部曲线)的比较,如实施例2和实施例3所述。
图21是实施例3的非目标臀部(mITT群体)随时间平均PR-PCSS评级的折线图。下部曲线是CCH治疗与安慰剂(上部曲线) 的比较,如实施例2和实施例3所述。
图22是实施例2的目标臀部(mITT群体)随时间平均CR-PCSS 评级的折线图。下部曲线是CCH治疗与安慰剂(上部曲线)的比较,如实施例2和实施例3所述。
图23是实施例2的非目标臀部(mITT群体)随时间平均 CR-PCSS评级的折线图。下部曲线是CCH治疗与安慰剂(上部曲线)的比较,如实施例2和实施例3所述。
图24表示第71天目标和非目标臀部的两级复合反应者(ITT 人群)。
图25表示了实施例5的研究设计。
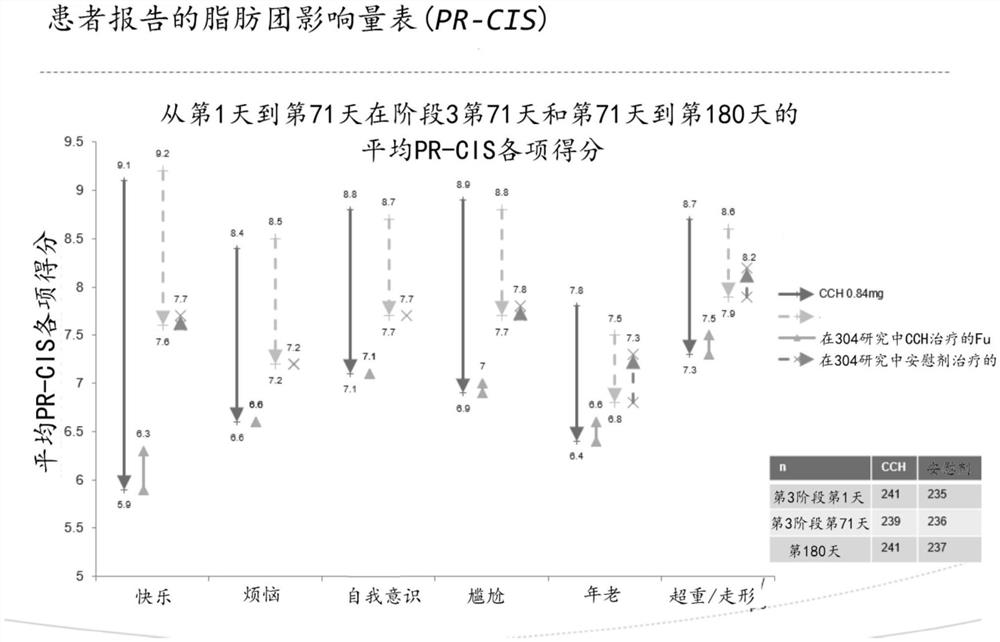
图26表示第3阶段(302/-303)从第1天到第71天以及实施例 5(研究304)中从第71天到第180天的PR-CIS项目平均得分。
图27显示了与第3阶段第71天相比,在第180天接受CCH治疗与安慰剂治疗的SSCTA应答者的百分比。
图28显示了研究202期间的受试者处置。注a:在201研究药物双盲实验被主办方破坏之前,受试者在双盲研究(201)第1天(即完成双盲研究后20天±4天)后90天开始的3个月期间最多只接受 4次观察访问。观察阶段在每个治疗区域内定义,并且定义为从筛查 A到研究202中的第一个治疗日期的时间段,或者如果研究202中没有接受治疗,则定义为研究202结束的时间段。注b:另一类包括筛查失败、受试者拒绝参与治疗阶段、受试者登记研究第272天的研究场地关闭或不符合研究访问的受试者。注c:治疗结束后(治疗阶段第71天),按照观察评估,每隔3个月对受试者进行随访,直至第360天。对于研究201中接受CCH治疗的受试者,对治疗区域进行长期耐久性评估,直至第720天。
图29表示了研究202中CCH治疗区域随时间变化的PR-PCSS 平均得分。
图30表示研究202中再次暴露(臀部和大腿治疗)受试者随着时间推移的平均PR-PCSS得分。
图31表示研究202中第一和第二治疗过程中,重新暴露臀部治疗受试者的PR-PCSS平均得分随时间推移而变化。
图32表示研究202中CCH治疗区随时间变化的CR-PCSS平均得分。
图33表示研究202中再暴露(臀部和大腿治疗)受试者随时间变化的CR-PCSS平均得分。
图34表示研究202中第一和第二治疗过程中,重新暴露臀部治疗受试者的CR-PCSS平均得分随时间推移而变化。
具体实施方式
这里将全面描述各个方面和实施方案。然而,这些方面和实施方案可以以许多不同的形式体现,并且不应被解释为对本发明的限制;相反,这里提供的实施方案使得本公开将是彻底和完整的,并且将向本领域技术人员充分传达本主题的范围。本文引用的所有出版物、专利和专利申请,无论是上文还是下文,均以引用方式全部并入本文。
A.定义
除非另有定义,否则本文中使用的所有术语和短语具有该术语和短语在本领域中获得的含义,除非从术语或短语使用的上下文中清楚地表明或清楚地看到相反的含义。尽管在本发明的实践或测试中可以使用与本文所描述的方法和材料类似或等效的任何方法和材料,但是现在描述了特定的方法和材料。
除非另有说明,使用个别数值是指使用该数值的近似值,如同在该数值前面有“大约”或“近似”一词。同样,除非另有明确说明,否则本申请中规定的各种范围内的数值被称为近似值,如同所述范围内的最小值和最大值前面都有“大约”或“近似”一词。这样,所述范围以上和以下的变化可用于获得与所述范围内的值基本相同的结果。如本文所使用的,当提及数值时的术语“大约”和“近似”对于与所公开的主题最密切相关的本领域的普通技术人员或与所讨论的范围或元素相关的本领域的普通技术人员应具有其简单和普通的含义。严格数值边界的加宽量取决于许多因素。例如,可以考虑的一些因素包括元素的临界性和/或给定量的变化将对所要求保护的主题的性能产生的影响,以及本领域技术人员已知的其他考虑。如本文所使用的,对不同数值使用不同数量的有效数字并不意味着限制使用词语“大约”或“近似”将如何用于拓宽特定数值或范围。因此,一般来说,“大约”或“近似”拓宽了数值。此外,该范围的公开旨在作为一个连续的范围,包括最小值和最大值之间的每一个值加上使用术语“大约”或“大约”所提供的范围的扩大,本文中对值的范围的叙述仅旨在用作单独引用该范围内的每个单独值的简写方法,并且每个单独值被并入说明书中,如同其在本文中被单独叙述一样。
如这里所使用的,“受影响区域”或“治疗区域”,是指将要治疗或已经用胶原酶(定义见下文)治疗的人类患者的皮下脂肪团区域。这可能包括一个象限(即左臀、右臀、左后外侧大腿、右后外侧大腿)。受影响区域或治疗区域不限于臀部或大腿。相反,身体上任何有皮下脂肪团的部位都可以作为治疗部位。
“副作用”或“AE”是指身体结构(体征)、身体功能(症状)、实验室结果(如化学、心电图、X光等)的任何不利或非预期变化,或与研究药物的使用暂时相关的先前存在的病情恶化,无论是否被认为与研究药物有关。
“Body-Q”是根据斯隆凯特林纪念癌症中心的许可证在商业上可买到的患者报告结果仪器。它基于患者对身体轮廓和/或体重减轻的感知。它通过18个独立功能的量表测量3个领域:外观、健康相关生活质量(HRQL)和患者的医疗体验。患者报告的结果工具如下文所述:BODY-Q:使用手册BODY-Q:使用手册,第1.0版,2015 年7月,斯隆凯特林纪念癌症中心,McMaster大学和Stefan Cano. BODY-Q包括测量皮下脂肪团的量表。参见
传统上,瘀伤的临床检查包括对瘀伤和周围区域的目视检查,以及对受试者的医疗、手术和伴随用药史的评估。这种解释的结果是主观的,受几个不相关因素的影响,包括观察几何、环境光照、未暴露周围皮肤的颜色以及观察者的经验和视力。本文所用的“瘀伤分析”是指使用美国专利公开号2019/0035080中公开的客观图像捕获和跟踪方法检测从受试者经过胶原酶治疗区域的图像中评估的皮肤颜色的可见变化,该方法统一应用于所有受试者图像。这种客观分析通过提供量化、区别化的方式评估受试者内部(同一受试者在不同时间点内)和受试者之间(不同受试者之间)的瘀伤程度,可以帮助甚至取代医疗保健提供者对瘀伤的目检和临床检查。这一分析利用了国际照明委员会(CIE)定义的L*a*b*颜色空间,该空间遵循颜色对立理论,即两种颜色不能同时是红色和绿色,也不能同时是黄色和蓝色。如下所示,L*显示明/暗,a*是红/绿坐标,且 b*是黄/蓝坐标。DeltaL*(ΔL*),Delta a*(Δa*)和Delta b*(Δb*) 可以是正偏差(+)或者负偏差(-).但是总偏差Delta E(ΔE*)总是正的。
·ΔL*(L*样品-L*标准)=明暗偏差(+=lighter,-=darker);较低的数值(0-50)表示暗并且较高的数值(51-100)表示明。
·Δa*(a*样品-a*标准)=红绿偏差(+=更红,-=更绿)
·Δb*(b*样品-b*标准)=黄蓝偏差(+=更黄,-=更蓝)
需要使用所有这三个值来完整地描述物体的颜色(在这种情况下是在受试者的治疗区域图像中捕捉到的瘀伤)。胶原酶治疗区域 (治疗前和治疗后指定时间点的图像)图像分析的客观方法,其数据输出为L*a*b*值,允许快速、简单、准确、可重复和无偏地量化肤色及其任何变化。这种方法排除了固有的变异性与传统的主观视觉估计的图像。ΔE按如下方式计算:
ΔE(瘀伤与正常皮肤之间的色差)=SQRT[(L
L
L
A
A
B
B
图18(B)显示了治疗区域的瘀伤分析。
“CCH”指AUX-I(Seq.ID NO.5(图2))和AUX-II(Seq.ID NO.6(图3))胶原酶混合物,比例约为1∶1,由溶组织梭状芽胞杆菌(又称Hathewaya溶组织梭状芽胞杆菌)发酵获得。CCH在市场上作为冻干粉末出售,商标为
“临床医生报告的光数字皮下脂肪团严重程度量表 (CR-PCSS)”是PCT专利申请PCT/US2018/020551(2018年9月 7日公开的WO2018/160905)中描述的光数字量表,由医生/临床医生使用,旨在将皮下脂肪团的严重程度评估为5个级别。
除非本文另有规定,“胶原酶”是指以下任何一种:(a)具有 EC3.4.24.3规定的活性的胶原酶(包括突变体) (https://www.brenda-enzymes.org/enzyme.php?ecno=3.4.24.3(2019 年7月3日获得);(b)溶组织梭菌发酵产生的胶原酶(也称为Hathewayahistolytica);(c)CCH(如上定义);(d)BLAST测定的与AUX-I至少50%序列对齐的胶原酶;(e)BLAST测定的与 AUX-II至少50%序列对齐的胶原酶;(f)其他来源生物(即非溶组织梭菌)发酵产生的胶原酶,例如哺乳动物、甲壳类动物、真菌、细菌或微生物胶原酶;(g)通过重组技术获得的胶原酶;(h)分子量在约65kDa到约130kDa之间的胶原酶;(i)指定为I类或II类的胶原酶(也称为胶原酶I(或1)、胶原酶II(或2)、I型胶原酶、2型胶原酶);(j)胶原酶I和II的混合物;(k)来自菌株JCM 1403(ATCC 19401)的胶原酶或其衍生物;(l)来自ATCC21000 菌株的胶原酶或其衍生物;(m)来自菌株ATCC 69334的胶原酶或其衍生物;(n)来源于产气荚膜梭菌的胶原酶;(o)来自溶藻弧菌的胶原酶;(p)来自链霉菌的胶原酶;(q)来自假单胞菌的胶原酶;(r)来自无色杆菌的胶原酶,(s)沃辛顿生化公司(www. Worthington-biochem.com;“产品亮点”)描述的胶原酶);(t) 西格玛·奥尔德里奇公司的胶原酶(www.sigma-aldrich.com)(u) 具有下列一个或多个特征的胶原酶:
·V
·K
·K
·1/K
·K
(v)nordmark Arzneimittel GmbH&Co.KG.描述的胶原酶;(w) 来自菌株004的胶原酶;或(x)上述任何一种的等效物或混合物。美国专利7811560、9757435、9744138和WO2012/125948中描述了可在本文公开中使用的胶原酶的非限制性实施例。
“凹坑分析”是指对一个或多个选定凹坑的分析,其中测量了凹坑的体积、长度、宽度和表面积等参数。可通过各种已知方法进行测量,例如Eckhouse等人在WO 2018/116304和WO 2018/116305 中描述的方法,以及通过Cherry成像进行测量(www.cherrymaging.com)和坎菲尔德科学公司。还可以参见 Salameh et al.,“NovelStereoscopic Optical System for Objectively Measuring Above-Surface ScarVolume-First-Time Quantification of Responses to Various TreatmentModalities,”Dermatol.Surg.00:1-7 (2017);和美国专利第9,996,923号。体积、长度、宽度和表面积的这种测量可以使用数字3-D灰度图像(具有X和Y轴旋转特征) 和数字3-D纹理和光照图像(具有X和Y旋转特征)以及分析这种图像的计算机程序来计算。例如,对于臀部治疗区域,可以在治疗前后为每个患者拍摄左治疗臀部和/或右治疗臀部的图像。对于大腿治疗区域,可以在治疗前后以0度、45度和90度拍摄每一个大腿治疗区域的图像。对于大腿治疗区域,可以在治疗前后在0度、45度和90度处使用Canfield Scientific方法对每个大腿治疗区域拍摄图像。
“持久性”指治疗效果持续的时间段。这段时间可以是3个月到20年,或者大约1到19年,或者大约2到18年,或者大约3到 17年,或者大约4到16年,或者大约5到15年,或者大约6到14 年,或者大约7到13年,或者大约8到12年,或者大约9到11年。该时间段可以是6个月左右、大约1年左右、大约2年左右、大约3 年左右、大约4年左右、大约5年左右、大约10年左右、大约15 年左右、大约20年左右。
“提前终止访视”是指对于终止研究的任何受试者,其最后一次访视视为提前终止访视,完成研究的受试者通常在第71天进行的评估将在提前终止访视时进行。
“Fitzpatrick量表”指用于评估受试者皮肤类型的量表,如表1 所示。
表1.Fitzpatrick量表
“Hexsel皮下脂肪团严重程度量表”或“Hexsel CSS”或“皮下脂肪团严重程度量表(CSS)”是指如下所示评估皮下脂肪团5个主要形态特征的相片数字量表(表2):
表2.Hexsel皮下脂肪团严重程度量表
得分结果的综合按如下分类
Hexsel et al.,J.Eur.Acad.,Dermatol.Venereol.2009;23(5): 523-528.a.Nürnberger and Müller,J.Dermatol.Surg.Oncol. 1978;4(3):221-229。受试者以站立姿势进行评估,臀肌放松。然而,如果受试者没有明显的凹陷症状,则要求他们收缩臀肌或进行挤压试验(通过捏拇指和食指之间的皮肤),以区分0分或1分/ 等级。
这里使用“Hexsel凹陷深度评分”指的是仅评估(B)Hexsel CSS的凹陷深度(图4):
0=无凹陷
1=浅凹陷
2=中等深度的凹陷
3=深凹陷.
本文中所使用的“图像”或者“图片”表示相片、图解、图示、模型、3D模型、计算机生成的图像、MRI图像等。
“里克特量表评分”是指在每次治疗后访视时,由独立的盲法评估员(或者患者)通过比较第1天治疗前(基线)的皮下脂肪团照片(二维颜色,3-D颜色和3-D灰度)以及治疗后访视时治疗区域(臀部和大腿)的照片识别治疗区域的变化。采用以下5级里克特量表记录分数
本文中使用的术语“非目标大腿”或“非目标臀部”是指未选择用于评估主要疗效终点的大腿或臀部。这些非目标区域仍可能接受治疗,并用于评估次要疗效终点。
“可选的”或“任选的”是指随后描述的元素、成分或条件可能发生或不发生,因此该描述包括所述元素、成分或条件发生的情况和不发生的情况
这里使用的“患者报告的皮下脂肪团影响量表(PR-CIS)”是指使用6个问题的调查对皮下脂肪团的视觉和情感影响(快乐、烦恼、自我意识、尴尬、看起来衰老或看起来超重或身体变形)进行评估,每个问题的评量表的数值范围为0(完全没有)到10(极端明显)。更具体的,PR-CIS是一种6-项静态问卷,评价皮下脂肪团的视觉和情感影响(快乐、烦恼、自我意识、尴尬、看起来衰老或看起来超重或身体变形);当观察其臀部和/或大腿数码照片时,受试者用11级数字评分量表回答每个问题,评分范围从0(一点也不) 到10(极端)。这种评估可能是所有大腿和/或臀部在一起,而不是每个单独的区域。PR-CIS总分可由6个单独问题得出:
问题1-想想你选择的治疗部位,你对皮下脂肪团的外观有多满意?
问题2-想想你选择的治疗部位,你对皮下脂肪团的外观有多困扰?
问题3-想想你选择的治疗部位,你对皮下脂肪团的出现有多在意?
问题4-想想你选择的治疗部位,你对皮下脂肪团的出现有多尴尬?
问题5-想想你选择的治疗部位,由于皮下脂肪团的出现,你看起来老了多少?
问题6-想想你选择的治疗部位,由于皮下脂肪团你看起来有多胖或者身材有多走形?
这里使用的“患者报告的皮下脂肪团影响量表(减缩版) (PR-CIS减缩版)”是指使用5个问题的调查对皮下脂肪团的视觉和情感影响(快乐、烦恼、自我意识、尴尬、看起来衰老或看起来超重或身体变形)进行评估,每个问题的评量表的数值范围为0(完全没有)到10(极端明显)。更具体的,PR-CIS是一种5-项静态问卷,评价皮下脂肪团的视觉和情感影响(快乐、烦恼、自我意识、尴尬、看起来衰老或看起来超重或身体变形);当观察其臀部和/或大腿数码照片时,受试者用11级数字评分量表回答每个问题,评分范围从0(一点也不)到10(极端)。这种评估可能是所有大腿和/ 或臀部在一起,而不是每个单独的区域。在一个非限制性实施例中, PR-CIS减缩版的总分可由6个单独问题得出:
问题1-想想你选择的治疗部位,你对皮下脂肪团的外观有多满意?
问题2-想想你选择的治疗部位,你对皮下脂肪团的外观有多困扰?
问题3-想想你选择的治疗部位,你对皮下脂肪团的出现有多在意?
问题4-想想你选择的治疗部位,你对皮下脂肪团的出现有多尴尬?
问题5-想想你选择的治疗部位,由于皮下脂肪团你看起来有多胖或者身材有多走形?
PR-CIS减缩版的总分可以从完整版PR-CIS的其他五个问题中得到。
如本文中所使用的“患者报告的相片数字皮下脂肪团严重程度量表(PR-PCSS)”是患者的相片数字量表,如PCT国际申请PCT/US2018/020551(2018年9月7日以WO2018/160905公开号公开),其被设计用于将皮下脂肪团的严重程度量化为5个级别。
如本文中所使用的“相片数字”是指使用一系列相片、图解、图示、模型、3D模型、计算机生成的图像、MRI图像、图像等,各自在量表中指定了不同级别的皮下脂肪团严重程度。
这里使用的“连续访视”指两次或两次以上的临床医生访视或通过量表评估皮下脂肪团变化的次数。各个探视之间的间隔时间可以是两周左右、一个月左右、两个月左右、三个月左右、四个月左右、五个月左右、六个月左右、一年左右、两年左右、三年左右,或者五年以上。
这里使用的“严重副作用”是指导致死亡、立即危及生命、导致或延长住院患者住院时间、导致永久性或实质性残疾、先天性异常/出生缺陷或被视为重要医疗事件的副作用。
这里使用的术语“统计显著性”是指“P”值通常小于0.05的统计数据。在本发明的上下文中,临床试验通常被设计来测试干预(例如,在本例中,治疗)相对于对照的优越性。考虑到临床试验涉及的人在生理上各不相同,结果自然会发生变化。因此,统计数据被用来确定观察到的任何差异是偶然造成的还是干预本身造成的。统计显著性度量量化了一项研究的结果是由于偶然性造成的概率。“P”值,常用于测量统计显著性,是指研究结果是由于偶然而不是实际治疗效果的概率。一般来说,被认为具有统计学意义的“P”值的传统截止值为0.05,或5%,尽管它可能会根据研究设计和结果而改变。如果“P”值小于0.05,这意味着研究结果是偶然的可能性小于5%。如果“P”值大于0.05(5%),则治疗组和对照组之间的任何差异均不具有统计学意义,这意味着该差异不可能归因于治疗,而是可能是由于偶然性。
术语“受试者”或者“患者”在这里可互换使用,指的是人类或其他哺乳动物。
这里使用的“受试者整体美感改善量表(S-GAIS)”和“研究者整体美感改善量表(I-GAIS)”是指以下评估皮下脂肪团严重程度和/或改善的量表。向受试者提出以下介绍性问题:“您如何评价治疗后皮下脂肪团的外观?“评分范围从-3(非常差)到+3(非常好),这取决于受试者的反应,如表3所示。
表3.受试者整体审美改善量表(S-GAIS)和研究者整体审美改善量表(I-GAIS)
这里使用的“受试者对皮下脂肪团治疗的满意度”(SSCT)指的是-2到+2的受试者满意度等级。例如,下表4提供了臀部皮下脂肪团治疗的评估。患者被问到:“今天,你对你接受的臀部特定部位的皮下脂肪团治疗结果满意吗?“然后他们选择一个答案/评分,如表4所示。
表4.受试者对皮下脂肪团治疗的满意度评估-臀部
表5提供了大腿皮下脂肪团治疗的评估。患者会被问到:“今天,你对大腿特定部位的皮下脂肪团治疗结果满意吗?“然后他们选择一个答案/评分,如表5所示。
表5.受试者对皮下脂肪团治疗的满意度评估-大腿
“受试者自评量表(SSRS)”是受试者使用的量表,该量表用于评估他/她与皮下脂肪团相关的外观满意度,表示为7个等级的量表,从0(极度不满意)到6(极度满意),如图6所示。
表6.受试者自评量表(SSRS)
本文使用的术语“目标大腿”或“目标臀部”是指选择用于评估主要疗效终点的大腿或臀部。
本文使用的术语“治疗有效量”是指降低患者或具有统计意义的患者群体中皮下脂肪团严重程度所需的胶原酶量。所使用的胶原酶组合物的量将是递送达到期望结果所需的胶原酶量所必需的量。实际上,这取决于注射的胶原酶、注射技术和治疗区域的酶活性。
本文中使用的术语“疗程”包括三个疗程(即,每次疗程均为临床医生就诊接受治疗)。
本文中使用的术语“治疗紧急副作用”或“TEAE”是指在使用研究药物治疗前不存在,但在治疗后出现,或者在治疗开始时出现,但在治疗期间恶化,或在治疗开始时出现,但在患者接受治疗时消失,然后再次出现(无论治疗开始时AE的强度如何)的任何情况。
本文中使用的术语“大腿脂肪团严重程度量表-患者” (“TCS-P”)和“大腿脂肪团严重程度量表-临床医生”(“TCS-C”) 是指患者(TCS-P)或临床医生(TCS-C)用于评估大腿脂肪团严重程度、改善和/或患者满意度的图5所示的相片数字量表(或基本相似的量表),从而用于协助评估胶原酶的疗效。患者报告使用的量表称为TCS-P;临床医生报告使用的量表称为TCS-C。
本文中使用的术语“治疗访视”或“治疗”或者“治疗阶段”是指对受影响区域进行至少一次的注射或治疗,使用治疗有效量的至少一种活性制剂在一次门诊访视中治疗脂肪团。
本文中使用的术语“有效的”、“有效性”或“有效”是指一个过程,通过此过程证明特定量表是准确可靠的,该过程包括视觉评估的可重复性,以确保能够一致地获得相同的结果。验证进一步检查量表的精密度、准确度和灵敏度,以确认其测量值可靠、可重复和稳健。
B.引入
本发明涉及治疗皮下脂肪团的方法,包括通过使用下文所述的某些注射技术向具有皮下脂肪团外观的受试者施用治疗有效量的一种或多种胶原酶。
一般来说,治疗分为四个阶段:(1)临床医生和患者进行治疗前评估,以确定治疗前基线,临床医生选择要治疗的凹坑;(2)如果存在最低点,临床医生在最低点标记要治疗的凹坑;(3)临床医生用胶原酶治疗患者;和(4)临床医生和患者进行治疗后评估。下面对这些阶段进行详细描述。各个阶段和其中的步骤是可选的,并且各个步骤不需要限制实施顺序,因为顺序可能会有所不同,但会获得可比较的结果。
C.阶段1-治疗前评估
在这里描述的治疗皮下脂肪团的第一阶段,临床医生根据以下标准选择需要治疗的皮下脂肪团凹坑:
如照片所示,当患者以放松姿势站立(臀部肌肉放松的站立姿势)时,凹坑应清晰可见并自然清楚
选择的凹坑应是临床医生认为最有可能改善整个臀部、大腿或其他受影响区域美观的凹坑
当患者以放松姿势站立时,在治疗前拍摄受影响区域的照片
注射前,进行评估,即临床医生和/或患者独立评估照片,并使用以下一个或多个量表或评估方法对结果进行评分:
οHexsel皮下脂肪团严重程度分级表(Hexsel CSS)
οHexsel凹陷深度评分表
ο里克特量表
ο凹坑分析
ο临床医生报告的相片数字皮下脂肪团严重程度量表 (CR-PCSS)
ο患者报告的相片数字皮下脂肪团严重程度量表(PR-PCSS)
ο研究者全球审美改善量表(I-GAIS)
ο主体全球审美改善量表(S-GAIS)
ο患者报告的皮下脂肪团影响量表(PR-CIS)
ο患者自评表(SSRS)
ο受试者对皮下脂肪团治疗的满意度调查表(SSCT)
ο大腿皮下脂肪团疗效量表(PR-TCES;CR-TCES)
οBody-Q
ο菲茨帕特里克量表
ο任何有效的图像数字或者其他临床使用和/患者用于评价皮下脂肪团严重程度、改善和/或病人满意度的量表。
D.阶段2-标记需要治疗的凹坑
在这里描述的治疗的第二阶段,临床医生用点标出待治疗的凹坑。可以拍摄更多的照片。参见,例如,图6和图15。
E.阶段3-胶原酶注射
在治疗的第三阶段,临床医生用胶原酶治疗患者。
1.
本发明中有用的胶原酶包括上文定义的任何胶原酶。作为进一步的背景,基质金属蛋白酶(MMPs)可由属于本文定义范围内的胶原酶组成。例如,MMP-1包含胶原酶1;MMP-8包含胶原酶2/中性粒细胞胶原酶;MMP-13包含胶原酶3;以及MMP-18包含胶原酶4。此外,组织蛋白酶可归类为胶原酶。
2.
本发明中有用的胶原酶也可通过其酶动力学来表征。这里,有效治疗皮下脂肪团的一种或多种胶原酶的近似动力学值包括:
·V
·K
·K
·1/K
·K
V
K
K
1/K
这些值可使用下文所述的微孔板分析进行实验测定,但使用不同的底物和时间。还可以采用其他分析和参数。
这些值反映了基于Michaelis-Menten方程的酶行为的定量表达:
其中V
其中k
其中E是酶,S是底物,ES是酶-底物复合物,并且P是产品。
催化K
在某些实施方案中,AUX-I和AUX-II具有以下特征:
·AUX I
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·AUX II
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
假设:
K
催化效率(K
·V
·K
·K
·1/K
·K
*通过SRC微板实验
+通过GPA微板实验
3.
已开发出多种测定方法,用于测定胶原酶的比活性(效价)。这种分析方法在a.到c.小节中描述,并通过胶原酶在给定时间段内以预先确定的酶浓度将底物转化为产物的能力来表征胶原酶。在某些非限制性实施方案中,这些分析用于确定AUX-I和AUX-II中的每一个以及结合的CCH药物产物(AUX-I和AUX-II的1∶1比率) 的效价。SRC分析(如下所述)使用胶原作为反应底物。SRC分析使用可溶性大鼠(尾)胶原(SRC)作为底物,并用于测量I型胶原酶活性,II型胶原酶约占胶原酶混合物观察活性的20%。SRC分析是荧光法,利用荧光胺检测SRC I型消化产生的肽。反应在pH 值为7.2的4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)缓冲液(含15mM 二价钙离子)中于25℃下进行2.5h。
牛腱胶原(BTC)分析实验(如下所述)基于Mandl et al.,Arch.Biochem.Biophys.74:465-475(1958)所述的过程进行,并根据Keller and Mandl,Arch.Biochem.Biophys.101:81-88(1963)的描述进行修饰。还参见Rosen,Arch.Biochem.Biophys.67:10-15 (1957)。BTC分析使用不溶性牛肌腱胶原作为底物,测量I型和 II型活性(如AUX-I和II型胶原酶)。BTC分析方法采用比色法,并利用茚三酮检测BTCI型和II型降解产生的肽。该反应也在pH 7.2 下进行,但在37℃下在含有10mM二价钙离子的三(羟甲基)氨基甲烷(tris)缓冲液中进行22h。
第三种胶原酶类型的分析,GPA实验(如下所述),利用可溶性衍生六肽(羧基-GPGGPA)作为底物。GPA实验主要用于测量II 型活性,I型约占观察活性的10%。II型胶原酶将六肽切割成两个三肽,其中一个(GPA)具有游离氨基末端,与荧光素胺反应提供荧光产物。GPA在pH 7.2下,在含有100mM二价钙离子的HEPES 缓冲液中于25℃下运行10分钟。
SRC和BTC实验均降解天然底物(胶原蛋白),这更接近胶原酶注射的治疗作用。GPA实验的优点是它们利用一个定义明确的小分子量六肽作为底物,并产生两个定义明确的三肽。GPA实验产生荧光信号,非常敏感。最后,GPA实验适合于Michaelis-Menten动力学分析,因为它使用单一底物和反应条件(10分钟培养),其接近初始酶速度。SRC实验非常适合于具有胶原结合域的胶原降解酶,而GPA实验非常适合于不具有胶原结合域的胶原降解酶,通常称为明胶酶。
a.GPA单元实验方法和比活性单元
i.GPA实验(比色皿)测定的胶原酶效价
GPA实验主要用于测量II类胶原酶的效力。实验的第一步涉及酶促反应,所述酶促反应包括通过胶原酶样品将底物羧基-甘氨酰-L- 脯氨酰-甘氨酰-脯氨酰-L-丙氨酸(ZGPGPA)消化成两种肽:羧基- 甘氨酰-L-脯氨酰-甘氨酸(zGPG)和甘氨酰-脯氨酰-L-丙氨酸(GPA)。第二步涉及随后用荧光衍生物荧光素胺测量释放的GPA。实验遵循以下方法,但是本领域的普通技术人员将理解,在实现实验目的的前提下可以进行某些修改(例如稀释浓度和时间)。
总的方法如下。制备亮氨酸标准品。获得胶原酶样品并制备溶液,用于胶原酶对zGPGGPA(以下简称“底物”)的酶裂解过程第一步。在该步骤之后,在室温下用荧光素处理胶原酶处理的样品(含有释放的GPA)和亮氨酸标准品一段时间,以便分别荧光标记产生的GPA和亮氨酸分子中的游离氨基。在392nm激发后,测量每种溶液在480nm处的荧光发射。亮氨酸和胶原酶样品曲线的斜率用于计算效价单位,如下所示:
效价(f-GPA单元/mg)=(M
其中:
M
M
DF=稀释因子
T=反应时间
除此之外,关于GPA实验方法的非限制性细节在下面进行了表述。
缓冲液和试剂
1.f-Appel缓冲液,pH 7.2(55mM HEPES,100mM醋酸钙)
2. 1mM亮氨酸工作储备溶液
3. 200mM硼酸盐,pH 9.0
4. 0.5mM丙酮中的萤光胺溶液
5.f-Appel’s缓冲液中的2mg/mL zGPGGPA底物
溶液制备
按照如下方法制备溶液:
f-Appel缓冲液:将13.0g HEPES和17.6g醋酸钙溶解在约800 mL水中。用氢氧化钠调节pH至7.2,用水调节QS至1L。储存在 2-8摄氏度。
10mM亮氨酸储备溶液:将65.5mg亮氨酸溶解在50mL水中。亮氨酸必须直接称重到100毫升(或同等)玻璃烧杯的规模。称取约65mg(目标重量)亮氨酸放入烧杯中。根据所称亮氨酸的重量,使用下式计算加入烧杯的水量。向烧杯中加入计算体积的水,充分混合,确保亮氨酸完全溶解。分为1mL等份。储存在低于或等于20 摄氏度下。
其中:
C2=称量的亮氨酸重量(mg)
V1=50(毫升水)
C1=65.5(毫克亮氨酸)
V2=产生10mM储备溶液(ml)所需要的水的体积
1mM亮氨酸工作储备溶液:解冻一小瓶10mM亮氨酸储备溶液,并结合150μL和1350μL水稀释至1mM。使用前充分搅拌。
0.5N HCl:用水将HCl稀释至0.5N,并充分混合。室温条件下保存。或者,可以使用市售的0.5N HCl。
200nM硼酸盐,pH 9.0:将2.4克硼酸溶解在大约150毫升水中。使用氢氧化钠将pH值调整到9。用水调节QS至200mL并混合均匀。储存在2-8摄氏度。
0.5mM荧光胺溶液:将15毫克荧光胺与100毫升丙酮混合在一起并搅拌溶解。在在2-8摄氏度下避光保存。
底物溶液(2mg/mL zGPGGPA):用f-Appel缓冲液制备2mg/mL 的底物。在机械振动筛/旋转器存在的条件下溶解,留出足够的时间完全溶解(约15分钟)。
亮氨酸标准曲线
根据表7制备亮氨酸标准曲线
表7.亮氨酸标准曲线的制备
“L1”指的是亮氨酸标准样品1
然后,每100μL亮氨酸标准品被分别转入试管并检测其中的荧光胺。
胶原酶样品制备
在两个步骤中用f-Appel缓冲液将胶原酶样品稀释到0.01 mg/mL然后轻轻搅拌混合。下面描述了示例性的稀释方案:
1. 100μL x1.0mg/mL-→1000μL=0.1mg/mL
2. 100μL x0.1mg/mL-→1000μL=0.01mg/mL
空白制备
通过将45μL稀释制剂与500μL 0.5N盐酸混合以使酶失活来制备空白。添加455μL的zGPGGPA底物溶液并充分搅拌。将100μL 空白样品转移到单独的试管中,以检测可能与萤光胺反应的杂质。
效价曲线
为每个胶原酶样品制备一组效价曲线,如下所示:
在25℃的水浴中加热含有底物和缓冲液的试管至少15分钟。在第二组试管上贴上标签,并向每个试管中添加50μL 0.5N的盐酸。将稀释的胶原酶样品制剂(0.01mg/mL)按表8加入试管中培养10 分钟,混合后返回25℃水浴。将第一种制剂添加到预热的底物中后,开始培养阶段。
表8.样品制剂
在10分钟培养还剩余1-2分钟的时候,将制剂从水浴中取出,轻轻旋涡混合。将第一种制剂添加到底物中10分钟后,从每根试管中转移50微升到含有50μL 0.5N HCl的试管中。这些制剂应直接加入酸中以抑制消化。在淬火所有制剂之后,旋涡各试管使之充分混合。
检测
将400μL 200mM硼酸盐缓冲液和500μL 0.5mM萤光胺溶液添加到含有100μL每种制剂(空白、胶原酶样品效价曲线和亮氨酸标准品)的所有检测试管中。充分搅拌。让试管在室温下培养至少10 分钟。
荧光光度计设置
使用以下仪器参数设置荧光计,并在衍生化1小时后读取每个制剂的荧光。
计算
根据480nm(Y轴)处的荧光反应绘制每个亮氨酸标准品(X 轴)的浓度。确定斜率(m)和确定系数(R
确定胶原酶样品的效价
效价(f-GPA单位/mg)=(M
其中:
M
M
DF=稀释因子(1100μL/50μL=22)
T=反应时间(10分钟)
ii.用于确定胶原酶样品中II类胶原酶活性的GPA微板实验
此方法与上述GPA类似,只是在微孔板中进行。与上述测定一样,微孔板测定法测量胶原酶样品在底物羧苄氧基-甘氨酰-L-脯氨酰 -甘氨酰-甘氨酰-L-丙基-L-丙氨酸(zGPGGPA)(以下简称“底物”) 的酶切中的蛋白水解活性。该实验遵循以下方法,但是本领域的普通技术人员将理解,在实现本实验目的的范围内可以进行某些修改 (例如稀释浓度和时间)。
试剂
1.肽底物(zGPGGPA)(Bachem M1260或者等价物)
2.三肽GPA(Bachem H3615或者等价物)
3.荧光胺(Acros 191675000或者等价物)
4.纯净水(Milli-Q-Plus 18.2MΩ系统或者等价物)
5. 1M HEPES缓冲液(Gibco 15630-080或者等价物)
6.Surfact-Amps 20
7. 1M醋酸钙(Ca(C
8.硼酸(Sigma B7660或者等价物)
9. 2.5N NaOH(J.T Baker 5666-02或者等价物)
10. 0.5N盐酸(VWR 101223-134或者等价物)
11.丙酮(Sigma 270725或者等价物)
溶液的制备
(i)实验缓冲液(50mM HEPES pH 7.1/0.05%吐温20/5mM(Ca (C
(ii)0.1N NaOH的制备:向48mL去离子水中加入2mL 2.5N NaOH。该溶液可在室温下储存3个月。
(iii)4mg/mL三肽GPA储备液的制备:将400mg(±1mg)三肽GPA溶解于10mL 0.1NNaOH中并旋转直至完全溶解。添加足量的实验缓冲液,使体积为100mL,并将溶液分为0.5mL等份,并在 -70℃下储存。4mg/mL三肽GPA储备可在-70℃下储存一年。
(iv)制备4mg/mL(6.8mM)肽底物zGPGGPA:将400mg(+1mg) 肽底物zGPGGPA溶解于10ml 0.1N氢氧化钠中,旋涡旋转直至完全溶解。添加足量的实验缓冲液,使体积达到100mL。该溶液可在4℃下储存3个月。
(v)制备pH值为9.0的120mM硼酸:将7.4g(±0.5g)硼酸溶解在800mL去离子水中。用NaOH滴定溶液至pH 9.0。加入足量的去离子水,将体积调节到1升。该溶液可在室温下储存3个月。
(vi)在丙酮中制备1mM萤光胺:将28±2mg萤光胺溶解于100 mL丙酮中。这种溶液需要新鲜制备,避免光照和潮湿。
三肽GPA标准品的制备和系列稀释
通过将4mg/mL三肽GPA存储溶液在实验缓冲液中稀释50倍(例如,在980μL实验缓冲液中稀释20μL 4mg/mL三肽GPA),制备0.08 mg/mL(329μM)三肽GPA标准品。在实验平板,A行,用移液管将200μL 329μM三肽GPA标准品移到A1和A7中。用移液管将100μ L实验缓冲液移入A2-A6和A8-A12中。
对于三肽GPA标准系列稀释液,将100μL的量从Al转移到A2中,混合,将100μL的量从A2转移到A3中,重复至A5。从A5孔中取出 100μL,使其最终体积为100μL。A6孔仅含有缓冲液。
对于第二个三肽GPA标准系列稀释液,将100μL的量从A7转移到A8,混合,将100μL的量从A8转移到A9,并重复直到A11孔。从 A11孔中取出100μL,使其最终体积为100μL。A12孔仅含有缓冲液。
胶原酶样品的制备
对于胶原酶样品(例如,冻干胶原酶药物产品),在至少十分钟的时间内将样品冷却至室温,并重新配制成500ng/mL储备溶液。可以使用不同的浓度。用实验缓冲液稀释储备溶液制备待检测胶原酶样品(T1A)。重复该程序以制备三份试验样品(T1A、T1B、T1C)。
讨论
在该方法中,在96孔板中将50μL浓度增加的胶原酶待检测样品与50μL过量底物(2.0mg/mL最终浓度)混合。在U型底96孔聚丙烯反应板的C-G行中加入50μL的实验缓冲液。用移液管将150 μL胶原酶样品移到B行。然后,使用多通道移液管进行1/1.5的连续稀释,将100μL胶原酶样品从B行移到C行,混合并重复该过程,直到达到G行。从G行中去除并丢弃100μL的量。表9包含将50μL底物添加到B行到H行后的最终胶原酶浓度。
通过向H行移液50μL实验缓冲液制备H行空白。该行不含酶。示例性浓度如表9所示。
表9.添加底物之后的实验目标浓度
胶原酶反应
zGPGGPA底物在室温下15分钟的培养时间内被II类胶原酶切割成zGPG和GPA。打开培养箱和温度探头(向培养板中添加底物前,温度为22±1℃)。将50μL 4mg/mL(6.8mM)zGPGGPA底物逐列添加到B-H行的1-12柱中,然后混合。反应开始时间从底物加入第一个列后开始。将培养板盖上并置于22±1℃培养箱中,总反应时间为15±1分钟。
培养之后,通过添加盐酸来猝灭反应,并且在肽的游离氨基末端与荧光试剂荧光胺反应后,对释放的GPA肽的量进行定量。为了使反应停止,将100μL 0.5N HCl从A行添加到H行的每个孔中,逐列添加,然后混合。反应时间在HCl加入到第一个色谱柱后结束。
检测
向微孔板Greiner聚丙烯黑色阅读板的每个孔中添加195μL 120 mM硼酸盐(pH9.0)。将30μL的淬火反应混合物从反应板转移到读数板的相应孔中,并充分混合。然后,将75μL 1mM萤光胺添加到阅读板的每个孔中(使用聚丙烯托盘分配萤光胺/丙酮),并在每次添加后立即混合。使用分子器件M2荧光板读取器在荧光胺添加后15分钟内读取板,使用以下设置:激发380nm,发射473nm,截止455nm,6次读取/孔,PMT培养基。
绘制了GPA浓度(μM)与473nm发射的关系曲线,胶原酶浓度(ng/mL)与473nm发射的关系曲线。对于每个图,线性回归拟合没有固定参数。对于胶原酶测试样本,从线性拟合中排除零点数据,并使用每个样本的整个三份数据集生成绘图。测定三肽GPA标准品和胶原酶样品的斜率.
效价确定
按照如下方式计算胶原酶样品的比活性:
GPA微板实验单元=((胶原酶样品斜率)/(三肽GPA斜率x培养时间))x10
胶原酶待检测样品的比活性由三肽GPA标准品的斜率确定,并通过曲线拟合程序计算。根据Michaelis-Menton方程,采用微孔板法,可以用不同底物浓度和不同时间计算酶动力学。
iii.GPA实验测定的胶原酶效价
在这里公开的内容中有效的胶原酶可能具有约100,000至约 300,000GPA单位/mg或约175,000至约300,000f-GPA单位/mg的效价。在其它实施方案中,效价可为约70,000至约400,000GPA单位/mg,或约100,000至约375,000GPA单位/mg,或约125,000至约 350,000GPA单位/mg,或约150,000至约325,000GPA单位/mg,或约175,000至约300,000GPA单位/mg,或约200,000至约275,000 GPA单位/mg。或者,效价可为约70,000至约400,000f-GPA单位/mg,或约100,000至约375,000f-GPA单位/mg,或约125,000至约350,000 f-GPA单位/mg,或约150,000至约325,000f-GPA单位/mg,或约 175,000至约300,000f-GPA单位/mg,或约230,000至约430,000 f-GPA单位/mg,或约200,000至约275,000f-GPA单位/mg。胶原酶也可具有约30,100至87,100或约43,000至67,000GPA微孔板分析单位的效力。上述GPA可用于分析任何胶原酶的比活性。
b.SRC单位分析方法和比活性单位
i.通过SRC测定(比色杯)的胶原酶效价
SRC实验主要用于测量I类胶原酶的效价。一般方法如下。制备亮氨酸标准品和胶原酶样品溶液。实验的第一步涉及胶原酶消化可溶性鼠尾腱胶原(SRC)的酶促反应。第二步涉及随后用荧光衍生物荧光胺测量释放的肽片段/氨基酸。实验遵循以下方法,但是本领域的普通技术人员将理解,在实现实验目的的情况下可以进行某些修改(例如稀释浓度和时间)。
用试剂处理这种胶原酶和亮氨酸标准样品,以便用荧光素标记生成的GPA。亮氨酸标准品和胶原酶样品在室温下培养10分钟,然后分别在392和480nm激发和发射波长下测定每种溶液的荧光。亮氨酸和胶原酶样品曲线的斜率用于计算效价单位,如下所示:
效价(f-GPA单元/mg)=(M
其中:
M
M
DF=稀释因子(1500μL/100mL=15)
T=反应时间(2.5hr x60min/1hr=150min)
CF=转化因子(1000μg/1mg=1000)
此外,关于SRC实验方法的非限制性细节在下面进行了描述。
缓冲液和试剂
1.F-TC实验缓冲液,pH 7.2(22g HEPES[4-(2-羟乙基)-1-哌嗪乙磺酸],4.4克,醋酸钙)
2.F-酶缓冲液,pH 7.2
3. 200mM硼酸盐,pH 9.0
4. 10mM亮氨酸存储溶液
5. 1mM亮氨酸工作存储溶液
6. 1mM丙酮中的荧光胺溶液
7.在0.02N醋酸中浓度为2mg/mL的鼠尾部胶原
溶液制备
按照如下步骤制备溶液
F-TC实验缓冲液:将22g HEPES和4.4g醋酸钙溶解在约900 mL水中。用氢氧化钠调节pH至7.2,用水调节QS至1L。储存于 2-8℃。
F-酶-缓冲液:将4ml F-TC实验缓冲液与16mL水结合来稀释 F-TC实验缓冲液。储存于2-8℃
10mM亮氨酸储备溶液:将65.5mg亮氨酸溶解于50mL水中。亮氨酸必须直接称重到100毫升(或同等规模)玻璃烧杯的规模。称取约65mg(目标重量)亮氨酸放入烧杯中。根据所称亮氨酸的重量,使用下式计算加入烧杯的水量。向烧杯中加入计算体积的水,充分混合,确保亮氨酸完全溶解。分为1毫升等份。在低于或等于 -20℃的温度下储存。
其中
C2=称重的亮氨酸质量(mg)
V1=50(mL的水)
C1=65.5(mg的亮氨酸)
V2=产生10mM存储溶液所需要的水的体积(mL)
1mM亮氨酸工作储备溶液:解冻一小瓶10mM亮氨酸储备溶液,并将150μL与1350μL水混合稀释至1mM。使用前充分搅拌。
0.5N HCl:用水将HCl稀释至0.5N,并充分混合。室温条件下保存。或者,可以使用市售的0.5N HCl。
0.02N醋酸:将1mL 1N醋酸与49mL水混合,充分混合。室温条件下保存。
200mM硼酸盐,pH 9.0:在大约150毫升水中溶解2.4克硼酸。使用氢氧化钠将pH值调节至9.0。加水将QS添加至200ml,混合均匀。储存于2-8℃。
1mM荧光胺溶液:将15毫克荧光胺溶解在50微升的丙酮中并搅拌溶解。于2-8℃条件下避光保存。
底物溶液(2mg/mL鼠尾部胶原):用0.02N醋酸将鼠尾部胶原稀释至2mg/mL。储存于2-8℃。
亮氨酸标准曲线
根据表10制备亮氨酸标准曲线。
表10.亮氨酸标准曲线的制备
然后将100μL每种亮氨酸标准品转移到单独的离心管中以检测荧光素。
胶原酶样品和空白制备
在两个步骤中用F-酶缓冲液将胶原酶样品稀释到0.01mg/mL 然后轻轻漩涡搅拌混合。下面描述了示例性的稀释方案:
1. 100μL x1.0mg/mL→1000μL=0.1mg/mL
2. 100μL x0.1mg/mL→1000μL=0.01mg/mL
在室温条件下维持稀释的样品直到被使用。
根据表11,通过首先将样品和0.5N盐酸结合使酶失活来制备空白,随后加入缓冲液和底物。
根据表11标记各个胶原酶样品试管。试管1,2,4和6从一个制剂中制备并且试管3,5和7从重复的制剂中制备。
表11.空白和胶原酶样品制剂
盖上试管的盖子并轻轻旋转以混合。效价曲线制剂在25℃±3℃水浴中培养2.5小时。培养结束后,从水浴中取出效价曲线试管。向每个制剂中添加750μL 0.5N HCl,并彻底旋转以混合。在检测前,制剂可在2-8℃下储存22小时。
检测/荧光光度计设置
按照上面的描述制备亮氨酸标准品。
使用以下仪器参数设置荧光计,并在衍生化1小时后读取每个制剂的荧光。
计算
根据480nm(Y轴)处的荧光反应绘制每个亮氨酸标准品(X 轴)的浓度。确定斜率(m)和确定系数(R2)。测定每个效价曲线制剂的平均荧光。不要强制归零。确定每个重复制剂的平均荧光度。计算每个胶原酶样品制剂的净荧光度
F(净)=平均胶原酶样品(EM
绘制胶原酶样品在每个制剂中的浓度(X-轴)相对于净荧光度 (Y轴)的曲线。确定斜率(m)和确定因子(R
确定胶原酶样品的效价
效价(f-SRC单位/mg)=(M
其中:
M
M
DF=稀释因子(1500μL/100mL=15)
T=反应时间(2.5hr x60分钟/1hr=150min)
CF=转化因子(1000μg/1mg=1000))
上述SRC实验可以备用分析任何胶原酶的比活性。
ii.用于确定胶原酶样品中I类胶原酶活性的SRC微板实验
此方法与上述SRC类似,只是在微孔板中进行。与上述SRC 实验一样,微孔板测定法测量针对可溶性鼠-尾部胶原(SRC)底物 (以下简称“底物”)的酶切中的胶原酶活性。该实验遵循以下方法,但是本领域的普通技术人员将理解,在实现本实验目的的范围内可以进行某些修改(例如稀释浓度和时间)。
试剂
1.可溶性鼠-尾部胶原底物(BD Biosciences 354236)
2.三肽GPA(Bachem H3615或者等价物)
3.荧光胺(Acros 191675000或者等价物)
4.纯净水(Milli-Q-Plus 18.2MΩ系统或者等价物)
5. 1M HEPES缓冲液(Gibco 15630-080或者等价物)
6. 1M醋酸钙(Ca(C
7.Surfact-Amps 20
8. 1.0N醋酸(Sigma 318590或等价物)
9. 0.5N盐酸(VWR 101223-134或者等价物)
10.硼酸(Sigma B7660或等价物)
11. 2.5N氢氧化钠(J.T Baker 5666-02或等价物)
12.丙酮(Sigma 270725或者等价物)
溶液的制备
(i)实验缓冲液(50mM HEPES pH 7.1/0.05%吐温20/5mM(Ca (C
(ii)0.1N NaOH的制备:向48mL去离子水中加入2mL 2.5N NaOH。该溶液可在室温下储存3个月。
(iii)4mg/mL三肽GPA储备液的制备:将400mg(±1mg) 三肽GPA溶解于10mL 0.1NNaOH中并旋转直至完全溶解。添加足量的实验缓冲液,使体积为100mL,并将溶液分为0.5mL等份,并在-70℃下储存。4mg/mL三肽GPA储备可在-70℃下储存一年。
(iv)0.02N醋酸的制备:将1毫升1.0N醋酸加入40mL纯净水中。加入足量的纯净水将体积调整到50毫升。该溶液可以在室温下存储一年。
(v)2mg/mL SRC底物储备溶液的制备:将23.3mL 0.02N的乙酸直接添加到供应底物的试管中(在一个非限制性实施例中以 3.75mg/mL的浓度供应100mgSRC)。可以使用其他浓度的SRC底物。计算如下:
100mg÷3.75mg/mL=26.7mL;
总vol(mL)=(3.75mg/mL x26.7mL)/2mg/mL;
总vol(50.0mL)-26.7mL=23.3mL
通过倒置将溶液充分混合,并可在2-8℃下储存3个月。
(vi)0.6mg/mL SRC底物工作液的制备:在15mL锥形管中加入4.2mL实验缓冲液。然后,添加1.8mL 2mg/mL SRC底物储备溶液,并通过倒置混合该溶液。该溶液应在加入平板前立即制备。
(vii)制备pH值为9.0的120mM硼酸:将7.4g(±0.5g)硼酸溶解在800mL去离子水中。用NaOH滴定溶液至pH 9.0,并加入足够的去离子水将体积调节至1L。该溶液可在室温下储存3个月。
(viii)制备在丙酮中浓度为1mM的萤光胺:将28±2mg萤光胺溶解于100mL丙酮中。这种溶液需要新鲜制备,避免光照和潮湿。
三肽GPA标准品的制备和系列稀释
通过将4mg/mL三肽GPA存储溶液在实验缓冲液中稀释50倍 (例如,在980μL实验缓冲液中稀释20μL 4mg/mL三肽GPA),制备0.08mg/mL(329μM)三肽GPA标准品。在实验平板,A行,用移液管将200μL 329μM三肽GPA标准品移到A1和A7中。用移液管将100μL实验缓冲液移入A2-A6和A8-A12中。
对于三肽GPA标准系列稀释液,将100μL的量从A1转移到A2中,混合,将100μL的量从A2转移到A3中,重复至A5。从 A5孔中取出100μL,使其最终体积为100μL。A6孔仅含有缓冲液。
对于第二个三肽GPA标准系列稀释液,将100μL的量从A7 转移到A8,混合,将100μL的量从A8转移到A9,并重复直到A11 孔。从A11孔中取出100μL,使其最终体积为100μL。A12孔仅含有缓冲液。
胶原酶待检测样品的制备
对于胶原酶样品(例如,冻干胶原酶药物产品),在至少十分钟的时间内将样品冷却至室温,并重新配制成3.0μg/mL储备溶液。可以使用不同的浓度。用实验缓冲液稀释储备溶液制备待检测胶原酶样品(T1A)。重复该程序以制备三份试验样品(T1A、T1B、T1C)。
讨论
在该方法中,在96孔板中将50μL浓度增加的胶原酶待检测样品与50μL过量底物(2.0mg/mL最终浓度)混合。在U型底96孔聚丙烯反应板的C-G行中加入50μL的实验缓冲液。用移液管将150 μL胶原酶样品移到B行。然后,使用多通道移液管进行1/1.5的连续稀释,将100μL胶原酶样品从B行移到C行,混合并重复该过程,直到达到G行。从G行中去除并丢弃100μL的量。通过向H 行移液50μL实验缓冲液制备H行空白。该行不含酶。表12包含将50μL底物添加到B行到H行后的最终胶原酶浓度。
表12.添加底物之后的实验目标浓度
胶原酶反应
打开培养箱和温度探头(向培养板中添加底物前,温度为22± 1℃)。将50μL0.6mg/mL SRC底物添加到B-H行的每个孔中,逐列添加然后混合。反应开始时间从底物加入第一个列后开始。将培养板盖上并置于22±1℃培养箱中,总反应时间为45±5分钟。培养之后,通过向稀释板的每个小孔添加100微升0.5N的盐酸来猝灭反应,逐列添加,然后混合。反应时间在HCl加入到第一个列中后结束。
检测
向微孔板Greiner聚丙烯黑色阅读板的每个孔中添加195μL 120mM硼酸盐(pH9.0)。将30μL的淬火反应混合物从反应板转移到读数板的相应孔中,并充分混合。从反应平板中向阅读平板相应的孔中转移30微升的退火反应混合物并充分混合,然后,将75 μL 1mM萤光胺添加到阅读板的每个孔中(使用聚丙烯托盘分配萤光胺/丙酮),并在每次添加后立即混合。使用分子器件M2荧光板读取器在荧光胺添加后15分钟内读取板,使用以下设置:激发380 nm,发射473nm,截止455nm,6次读取/孔,PMT培养基。
绘制了GPA浓度(μM)与473nm发射的关系曲线,胶原酶浓度(ng/mL)与473nm发射的关系曲线。对于每个图,线性回归拟合没有固定参数。对于胶原酶测试样本,从线性拟合中排除零点数据,并使用每个样本的整个三份数据集生成绘图。测定三肽GPA标准品和胶原酶样品的斜率。
比活性和相关效价的确定
按照如下方式计算胶原酶样品的比活性:
SRC微板实验单元=((胶原酶样品斜率)/(三肽GPA斜率x 培养时间))x10
胶原酶待检测样品的比活性由三肽GPA标准品的斜率确定,并通过曲线拟合程序计算。根据Michaelis-Menton方程,采用微孔板法,可以用不同底物浓度和不同时间计算酶动力学。
iii.SRC实验测定的胶原酶效价
在这里公开的内容中有效的胶原酶的效价约为500至15,000 SRC单位/mg。在某些实施方案中,效价为约500至约12,500SRC 单位/mg,或约700至约10,000SRC单位/mg,或约1,000至约7,500 SRC单位/mg,或1,500至约6,000SRC单位/mg,或约2,500至约 5,000SRC单位/mg。或者,效价可为约5,000至约35,000f-SRC单位/mg,或约10,000至约30,000f-SRC单位/mg,或约13,000至约 23,000f-SRC单位/mg,或约15,000至约25,000f-SRC单位/mg。胶原酶也可具有约980至3,510或约1,400至2,700SRC微孔板实验单位的效力。
c.BTC单元实验中的胶原酶效价
牛肌腱胶原蛋白胶原酶测定基于Mandl et al.(1958)公开的方法,经Keller和Mandl(1963年)修改。由于牛腱胶原是一种不溶性底物,因此对其进行精细的分离是很重要的。运行胰蛋白酶作为对照,以说明变性胶原蛋白或其他蛋白质杂质的存在。该实验是在胶原酶活性所需的钙离子存在的条件下进行的。可溶解的肽的数量通过肽的N-末端氨基与茚三酮反应并通过比色法测量形成的辅助物的量来确定(Rosen 1957)。
本方法的目的是使用胶原底物检测胶原酶的比活性。
试剂和溶液
1.胶原底物(胶原)
2.去离子水(水)
3.Tris实验缓冲液
4.胰蛋白酶储备溶液
5. 0.5M HCl
6.亮氨酸标准实验溶液(1mM亮氨酸)
7.Rosen缓冲液
8. 3%茚三酮
9. 50%异丙醇
培养
按如下方式设置和标记反应管:三管用于胰蛋白酶对照,六管用于参照溶液,六管用于每个待检测样品。给每根管子贴上标签并打开盖子。按表13的顺序称取10±1mg胶原,将称取的胶原放入各反应管中。
表13.称重顺序和反应试管编号
对于受试样品,每个反应管(ACT)中酶的活性应在1.6至5.7 nmol leu eq/min之间。未溶解的样品应首先溶解在Tris实验缓冲液中,然后再用于实验分析。浓度(加入反应管前)应不低于 0.0065mg/mL。
根据表14设置反应管,使其具有矩阵模式。下表假设有2个待测样品。如果运行更多或更少的样品,调整反应管的数量,但保留模式。表14列出了体积保持不变的情况。
表14.矩阵模式
*建议的最大样品数量是3
盖住反应管。轻轻但彻底地混合内容物。将反应管置于37℃的水浴中。孵育22±0.5小时。记录培养开始的实际时间a,37℃,所用水浴的数量,胶原蛋白脂质的批号,所用批号的胶原蛋白校正系数和所用所有溶液的批号。
淬火并过滤
标记滤液管,使其对应于培养的每个反应管。将装有折叠滤纸的漏斗放在每个标记的滤液管上。在培养阶段结束时,从水浴中取出反应管。记录培养结束的实际时间。
打开反应管并丢弃盖子。通过向每个反应管中分配2mL 0.5M HCl来猝灭反应。把试管里的东西充分混合。将每个反应管中的内容物过滤到适当的过滤管中。
前两步需要尽快完成,因为未消化的胶原蛋白可以在短时间内被盐酸溶解。在显色前,滤液可在有盖滤液管中冷藏达95.5小时。记录冷藏和储存时间。
显色
设置煮沸的试管并贴上标签,如下所示:6个试管用于水和亮氨酸对照品(步骤1),2个试管用于每个滤液桶(步骤1)。将以下量的水和亮氨酸标准分析溶液放入六个亮氨酸对照试管中。
用移液管将0.8mL水移到每个煮沸的试管中(步骤2)。用移液管从每个样品中吸取0.2毫升滤液,放入适当标记的煮沸的试管中。向每个煮沸的试管中加入0.5毫升罗森缓冲液。在密封罩下,向每个煮沸的试管中分配0.5mL 3%茚三酮。在涡流混合器上彻底混合各管中的内容物。将煮沸的试管放入通风柜中的沸水浴中。煮沸 15±1分钟。在沸腾期结束时,从水浴中取出煮沸的试管。在密封罩下,将5.0mL 50%异丙醇分配到每个煮沸的试管中,并彻底混合内容物。在读取吸光度之前,让煮沸的试管达到环境温度(至少10分钟)。
吸光度读数
在密封罩下工作时,读取各个试管的吸光度。打开分光光度计并使其预热。将分光光度计的波长设置为570nm。用50%异丙醇调零分光光度计。读取水、亮氨酸、胰蛋白酶对照品和受试样品的吸光度(A
计算原则
以分钟为单位计算总读取时间和总培养时间。总读数时间应少于60分钟,总培养时间应在1290-1350分钟之间。使用线性最小二乘法,计算亮氨酸标准品的斜率“b”和相关系数“r”(x=nmol亮氨酸vs y=A
按照如下方式计算每个试管的活性(ACT),以nmol leu eq/min 为单位:
式中,20是所形成反应混合物量的稀释系数,“b”是亮氨酸标准曲线的斜率。把这个数字记到小数点后一位。受试样品每个试管的活度应为1.6-5.7nmol leu eq/min。
按照如下方式计算以BTC单元为单位的活性:
BTC单元=以nmol leu eq/min为单位的活性x胶原相关系数。
按照如下方式计算样品以BTC单元/mL为单位的活性:
按照如下方式计算样品以BTC单元/mm为单位的比活性:
BTC单元向ABC单元的转化:
ABC单元=BTC单元x1.09
i.BTC单元和ABC单元
可使用各种胶原酶组合物,其中胶原酶具有约5,000BTC单位 /mg至约25,000BTC单位/mg,或约10,000BTC单位/mg至约25,000 BTC单位/mg,或约15,000BTC单位/mg,或约17,500BTC单位/mg,或约20,000BTC单位/mg,或约22,500BTC单位/mg,或约9,175BTC 单位/0.58mg,或15,817BTC单位/mg的比活性,其中“mg”指存在于组合物中的胶原酶的量(不同于赋形剂和其它成分)。
此外,可使用各种胶原酶组合物,其中胶原酶具有约5,000ABC 单位/mg至约25,000ABC单位/mg,或约10,000ABC单位/mg至约 25,000ABC单位/mg,或约15,000ABC单位/mg或约17,500ABC 单位/mg,或约20,000ABC单位/mg,或约22,500ABC单位/mg,或约10,000ABC单位/0.58mg,或17,241ABC单位/mg的比活性,其中“mg”指存在于组合物中的胶原酶的量(不同于赋形剂和其他成分)。
d.其他实验
用来标记胶原的实验方法记载在Gisslow et al.,Anal. Biochem.,68:70-78(1975);Robertson et al.,Clinica Chimica Acta,42:43-45(1972);Sakamoto et al.,ANew Method for the Assay of Tissue Collagenase(36297)(1972).中。其他方法还包括Worthington生物化学公司的实验方法(http: //www.worthington-biochem.com/CLS/assay.html)(2019年7月3日登录的)。
4.
至于本文所采用的胶原酶剂量,本发明提供了治疗有效量的胶原酶,其足以在皮下注射时结合并溶解隔膜,从而与预治疗基线相比减少皮下脂肪团的出现。
在一个实施方案中,胶原酶可单次或分次注射约0.01mg至约 20mg的量。在另一实施方案中,胶原酶可单次或分次注射约0.05mg 至约15mg的量。在另一实施方案中,胶原酶可单次或分次注射约 0.10mg至约10mg的量。在另一实施方案中,胶原酶可单次或分次注射约0.15mg至约5mg的量。在另一实施方案中,胶原酶可单次或分次注射约0.20mg至约3mg的量。在另一实施方案中,胶原酶可单次或分次注射约0.25mg至约2mg的量。在依旧另一个实施方案中,所述胶原酶可以注射大约0.05mg,大约0.10mg,大约0.15mg,大约0.20mg,大约0.25mg,大约0.30mg,大约0.35mg,大约0.40 mg,大约0.45mg,大约0.50mg,大约0.55mg,大约0.60mg,大约0.65mg,大约0.70mg,大约0.75mg,大约0.80mg,大约0.85mg,大约0.90mg,大约0.95mg,大约1.00mg,1.05mg,大约1.10mg,大约1.15mg,大约1.20mg,大约1.25mg,大约1.30mg,大约1.35 mg,大约1.40mg,大约1.45mg,大约1.50mg,大约1.55mg,大约1.60mg,大约1.65mg,大约1.70mg,大约1.75mg,大约1.80mg,大约1.85mg,大约1.90mg,大约1.95mg,大约2.00mg,2.05mg,大约2.10mg,大约2.15mg,大约2.20mg,大约2.25mg,大约2.30 mg,大约2.35mg,大约2.40mg,大约2.45mg,大约2.50mg,大约2.55mg,大约2.60mg,大约2.65mg,大约2.70mg,大约2.75mg,大约2.80mg,大约2.85mg,大约2.90mg,大约2.95mg,大约3.00 mg,3.05mg,大约3.10mg,大约3.15mg,大约3.20mg,大约3.25 mg,大约3.30mg,大约3.35mg,大约3.40mg,大约3.45mg,大约3.50mg,大约3.55mg,大约3.60mg,大约3.65mg,大约3.70mg,大约3.75mg,大约3.80mg,大约3.85mg,大约3.90mg,大约3.95 mg,大约4.00mg,4.05mg,大约4.10mg,大约4.15mg,大约4.20 mg,大约4.25mg,大约4.30mg,大约4.35mg,大约4.40mg,大约4.45mg,大约4.50mg,大约4.55mg,大约4.60mg,大约4.65mg,大约4.70mg,大约4.75mg,大约4.80mg,大约4.85mg,大约4.90 mg,大约4.95mg,大约5.00mg,5.05mg,大约5.10mg,大约5.15 mg,大约5.20mg,大约5.25mg,大约5.30mg,大约5.35mg,大约5.40mg,大约5.45mg,大约5.50mg,大约5.55mg,大约5.60mg,大约5.65mg,大约5.70mg,大约5.75mg,大约5.80mg,大约5.85 mg,大约5.90mg,大约5.95mg,或者大约6.00mg。
在一个实施方案中,根据SRC实验的测定结果,所述胶原酶具有大约2.6min
在一个实施方案中,根据GPA实验的测定结果,所述胶原酶具有大约135min
在一个实施方案中,根据SRC实验的测定结果,所述胶原酶的 K
在一个实施方案中,根据GPA实验的测定结果,所述胶原酶的 K
在一个实施方案中,根据SRC实验的测定结果,所述胶原酶的 K
在一个实施方案中,根据GPA实验的测定结果,所述胶原酶的 K
在一个实施方案中,根据SRC实验的测定结果,所述胶原酶的 1/K
在一个实施方案中,根据GPA实验的测定结果,所述胶原酶的 1/K
在一个实施方案中,根据SRC实验的测定结果,所述胶原酶的 K
在一个实施方案中,根据GPA实验的测定结果,所述胶原酶的 K
在一个实施方案中,所述胶原酶的分子量在大约60kDa到大约 130kDa之间。在其他实施方案中,所述胶原酶的分子量在大约70 kDa到大约130kDa之间。在其他实施方案中,所述胶原酶的分子量在大约80kDa到大约120kDa之间。在依旧另一个实施方案中,所述胶原酶的分子量在大约90kDa到大约120kDa之间。在其他实施方案中,所述胶原酶的分子量在大约100kDa到大约110kDa之间。在依旧另一个实施方案中,所述胶原酶的分子量是大约55kDa,大约57kDa,大约60kDa,大约62kDa,大约65kDa,大约67kDa,大约70kDa,大约72kDa,大约75kDa,大约77kDa,大约80kDa,大约82kDa,大约85kDa,大约87kDa,大约90kDa,大约92kDa,大约95kDa,大约97kDa,大约100kDa,大约102kDa,大约105 kDa,大约107kDa,大约110kDa,大约112kDa,大约115kDa,大约117kDa,大约120kDa,大约122kDa,大约125kDa,大约127kDa,大约130kDa,大约132kDa,大约135kDa,或者大约137 kDa。
在一个实施方案中,通过反向HPLC测定的所述胶原酶的纯度为至少80%。在其他实施方案中,通过反向HPLC测定的所述胶原酶的纯度为至少大约80%,大约81%,大约82%,大约83%,大约 84%,大约85%,大约86%,大约87%,大约88%,大约89%,大约90%,大约91%,大约92%,大约93%,大约94%,大约95%,大约96%,大约97%,大约98%,或者大约99%。在依旧另一个实施方案中,所述胶原酶可以包括按面积计少于或者等于1%的梭菌蛋白酶。在其他实施方案中,所述胶原酶还包括按面积计少于或者等于1%的白明胶酶。在其他实施方案中,所述胶原酶还可以包括按面积即小于或者等于1%的亮抑蛋白酶肽。在依旧另一个实施方案中,所述胶原酶包括少于或者等于1cfu/mL生物污染物。
在一个实施方案中,所述胶原酶的效价(即,比活性)在大约 500到大约30,000SRC单位/mg。在其他实施方案中,所述胶原酶的效价在大约2,500到大约25,000SRC单位/mg之间。在其他实施方案中,所述胶原酶的效价在大约5,000到大约20,000SRC单位/mg 之间。在依旧另一个实施方案中,所述胶原酶的效价是大约500,大约1,000,大约1,500,大约2,000,大约2,500,大约3,000,大约3,500,大约4,000,大约4,500,大约5,000,大约5,500,大约6,000,大约 6,500,大约7,000,大约7,500,大约8,000,大约8,500,大约9,000,大约9,500,大约10,000,大约10,500,大约11,000,大约11,500,大约12,000,大约12,500,大约13,000,大约13,500,大约14,000,大约14,500,大约15,000,大约15,500,大约16,000,大约16,500,大约17,000,大约17,500,大约18,000,大约18,500,大约19,000,大约19,500,大约20,000,大约20,500,大约21,000,大约21,500,大约22,000,大约22,500,大约23,000,大约23,500,大约24,000,大约24,500,大约25,000,大约25,500,大约26,000,大约26,500,大约27,000,大约27,500,大约28,000,大约28,500,大约29,000,大约29,500或者大约30,000SRC单位/mg。
在一个实施方案中,所述胶原酶的效价(即,比活性)在大约 5,000到大约30,000f-SRC单位/mg之间。在其他实施方案中,所述胶原酶的效价在大约7,500到大约25,000f-SRC单位/mg之间。在其他实施方案中,所述胶原酶的效价在大约10,000到大约20,000f-SRC 单位/mg之间.在依旧另一个实施方案中,胶原酶的效价是大约 2,500,大约3,000,大约3,500,大约4,000,大约4,500,大约5,000,大约5,500,大约6,000,大约6,500,大约7,000,大约7,500,大约 8,000,大约8,500,大约9,000,大约9,500,大约10,000,大约10,500,大约11,000,大约11,500,大约12,000,大约12,500,大约13,000,大约13,500,大约14,000,大约14,500,大约15,000,大约15,500,大约16,000,大约16,500,大约17,000,大约17,500,大约18,000,大约18,500,大约19,000,大约19,500,大约20,000,大约20,500,大约21,000,大约21,500,大约22,000,大约22,500,大约23,000,大约23,500,大约24,000,大约24,500,大约25,000,大约25,500,大约26,000,大约26,500,大约27,000,大约27,500,大约28,000,大约28,500,大约29,000,大约29,500,或者大约30,000f-SRC单位/mg。
在一个实施方案中,所述胶原酶的效价(即,比活性)在大约 100,000到大约400,000GPA单位/mg之间。在其他实施方案中,所述胶原酶的效价在大约150,000到大约350,000GPA单位/mg之间。在其他实施方案中,所述胶原酶的效价在大约200,000到大约300,000GPA单位/mg之间。在依旧另一个实施方案中,所述胶原酶的效价是大约100,000,大约110,000,大约120,000,大约130,000,大约140,000,大约150,000,大约160,000,大约170,000,大约 180,000,大约190,000,大约200,000,大约210,000,大约220,000,大约230,000,大约240,000,大约250,000,大约260,000,大约 270,000,大约280,000,大约290,000,大约300,000,大约310,000,大约320,000,大约330,000,大约340,000,大约350,000,大约 360,000,大约370,000,大约380,000,大约390,000或者大约400,000 GPA单位/mg。
在一个实施方案中,所述胶原酶的效价在大约175,000到大约 500,000f-GPA单位/mg之间.在其他实施方案中,所述胶原酶的效价在大约250,000到大约450,000f-GPA单位/mg之间.在其他实施方案中,所述胶原酶的效价在大约300,000到大约400,000GPA 单位/mg之间。在依旧另一个实施方案中,所述胶原酶的效价是大约175,000,大约185,000,大约195,000,大约205,000,大约215,000,大约225,000,大约235,000,大约245,000,大约255,000,大约 265,000,大约275,000,大约285,000,大约295,000,大约305,000,大约315,000,大约325,000,大约335,000,大约345,000,大约 355,000,大约365,000,大约375,000,大约385,000,大约395,000,大约405,000,大约415,000,大约425,000,大约435,000,大约445,000,大约455,000,大约465,000,大约475,000,大约485,000,或者大约495,000f-GPA单位/mg。
在一个实施方案中,所述胶原酶的效价在大约5,000到大约 25,000ABC单位/mg之间。在一个实施方案中,所述胶原酶的效价在大约7,500到大约20,000ABC单位/mg之间。在一个实施方案中,所述胶原酶的效价在大约10,000到大约17,500ABC单位/mg之间。在其他实施方案中,所述胶原酶的效价是大约5,000,大约5,500,大约6,000,大约6,500,大约7,000,大约7,500,大约8,000,大约 8,500,大约9,000,大约9,500,大约10,000,大约10,500,大约11,000,大约11,500,大约12,000,大约12,500,大约13,000,大约13,500,大约14,000,大约14,500,大约15,000,大约15,500,大约16,000,大约16,500,大约17,000,大约17,500,大约18,000,大约18,500,大约19,000,大约19,500,大约20,000,大约20,500,大约21,000,大约21,500,大约22,000,大约22,500,大约23,000,大约23,500,大约24,000,大约24,500,或者大约25,000ABC单位/mg。
在一些实施方案中,在组合物中存在的胶原酶包括胶原酶I和胶原酶II,胶原酶I和胶原酶II的比例是大约1∶1。还可以使用其他比例的胶原酶I和胶原酶II,例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1。胶原酶I和胶原酶 II的每种的纯度是按面积计至少80%、或者85%、或者90%、或者 91%、或者92%、或者93%、或者94%、或者95%、或者96%、或者97%、或者98%、或者99%、或者100%,如通过反向HPLC测量的。
在其他实施方案中,所述胶原酶组合物包括CCH,所述CCH包括比例大约为1∶1的AUX I和AUX II。还可以使用其他比例的 AUX I和AUX II,例如0.1-2∶1、或者0.25-2∶1、或者0.5-2∶1、或者0.75-2∶1、或者1∶0.1-2、或者1∶0.25-2、或者1∶0.5-2、或者1∶0.75-2、或者1∶0、或者0∶1。每个AUX I和AUX II的纯度按面积计至少是80%、或者85%、或者90%、或者91%、或者 92%、或者93%、或者94%、或者95%、或者96%、或者97%、或者98%、或者99%、或者100%,如使用反向HPLC所测量的。
在其他实施例中,所述胶原酶组合物可以是液体,或者可以从冷冻干燥形式用稀释剂重新配制。所述混合物的剂量仅以存在的胶原酶的量来测定,不涉及稀释剂,并且,在一个或者一个以上注射剂中可以包括大约0.1mg到大约20mg。在其他实施方案中,施用的剂量是在单一注射剂或者多个注射剂中含大约0.06mg,0.48 mg,0.84mg,1.68mg,2.52mg,3.36mg,4.2mg,5.04mg,5.88mg, 6.72mg,7.56mg,或者8.4mg。
例如,大约0.06mg,0.48mg,0.84mg,或者1.68mg被分配在大约12个注射剂中被施用。被注射的胶原酶组合物的体积可以在每注射剂0.01mL到3mL范围内,或者总治疗访问大约0.2mL到 150mL。在具体的实施方案中,上述剂量是包括CCH的胶原酶组合物的剂量。在其他实施方案中,上述剂量是含有一种或者一种以上下述特征的胶原酶组合物的剂量:
·V
·K
·K
·1/K
·K
·分子量为大约60kDa到大约130kDa、或者大约70到大约 130kDa、或者大约80到大约120kDa、或者大约90到大约120kDa、或者大约100到大约110kDa。
·通过反向HPLC(高压液相色谱)测量,纯度为按面积计为至少80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约50,000f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计,杂质的含量小于或者等于1%,并且杂质选自由梭菌蛋白酶、白明胶酶和亮肽素
·小于或者等于1cfu/mL的生物负担。
在其他实施方案中,在每个治疗区域,大约0.84mg的CCH被分在大约12个等分额注射剂中被注射(大约0.07mg x12次注射=大约0.84mg)。在一些情况下,每10-40天进行0.84mg的上述治疗,可以分2、3、4或者5次面诊进行。在其他情况下,在一次面诊时或者每10-40天在2、3、4、或者5次面诊时,对一个以上治疗区域注射0.84mg。在其他实施方案中,共有超过五次治疗访问(面诊)。
在另一方面中,在一次或多次注射中,每次治疗访问时,可注射到治疗区域的胶原酶的量约为0.001mg到20mg,可在一个注射剂中也可在多个注射剂中,例如,这些剂量被平均分成3到大约100 次注射剂中。这些胶原酶是液态的,或用稀释剂从冻干固体中重组。胶原酶的剂量通过胶原酶的量来测量,而不考虑稀释剂,并且可以包括约0.1mg到1mg,或者0.25mg到0.75mg、或者0.1mg到2mg、或者0.25mg到1.75mg、或者0.5mg到1mg,0.1mg到3mg、或者0.25mg到2.75mg、或者0.5mg到2.5mg、或者0.75mg到2.25 mg、或者1mg到2mg、或者0.1mg到4mg、或者0.25mg到3.75 mg、或者0.5mg到3.5mg、或者0.75mg到3mg、或者1mg到3mg。在其他实施方案中,所述剂量是每个注射剂或者多个注射剂大约 0.001mg,0.01mg,0.04mg,0.05mg,0.07mg,0.1mg,0.2mg, 0.3mg,0.4mg,0.5mg,0.6mg,0.7mg,0.8mg,0.9mg,1mg,1.1mg,1.2mg,1.3mg,1.4mg,1.5mg,1.6mg,1.7mg,1.8mg, 1.9mg,2mg,2.25mg,2.5mg,2.75mg,3mg,3.25mg,3.5mg, 3.75mg,4.0mg,4.25mg,4.5mg,4.75mg,5.0mg,5.25mg,5.5mg,5.75mg,6mg,6.25mg,6.5mg,6.75mg,7mg,7.25mg, 7.5mg,7.75mg,8mg,8.25mg,8.5mg,8.75mg,9mg,9.25mg, 9.5mg,9.75mg,10mg,11mg,12,mg,13mg,14mg,15mg, 16mg,17mg,18mg,19mg、或者20mg。
在其他实施方案中在一次或多次注射中施用的剂量约为0.06 mg、0.48mg、0.84mg、1.68mg、2.52mg、3.36mg、4.2mg或5.04 mg。在另一实施例中,将0.06mg、0.48mg、0.84mg、1.68mg、2.52 mg、3.36mg、4.2mg或5.04mg分12次注射剂注射给治疗区域。在其他实施例中,胶原酶的剂量分为3次或更多次注射。每次注射胶原酶组合物的体积可在0.01mL到3mL之间,或每次治疗访视的总体积约为1mL到150mL。
在一个方面中,上述AUX I和II混合物(“CCH”)可在一次或多次注射中以每次治疗访视约0.01mg至10mg胶原酶的量注射,例如,所述剂量被平均分配在大约3到大约50个注射剂中。胶原酶可以是液体,或者可以用稀释剂从冻干形式中重组。所述混合物的剂量通过胶原酶的量来测量,而不考虑稀释剂,并且在一次或者一次以上的注射中可以包括约0.1mg到1mg,或者0.25mg到0.75mg,或者0.1mg到2mg,或者0.25mg到1.75mg,或者0.5mg到1mg,0.1mg到3mg,或者0.25mg到2.75mg,或者0.5mg到2.5mg,或者0.75mg到2.25mg,或者1mg到2mg,或者0.1mg到4mg,或者0.25mg到3.75mg,或者0.5mg到3.5mg,或者0.75mg到3mg,或者1mg到3mg,或者大约0.05mg,0.1mg,0.2mg,0.3mg,0.4 mg,0.5mg,0.6mg,0.7mg,0.8mg,0.9mg,1mg,1.1mg,1.2 mg,1.3mg,1.4mg,1.5mg,1.6mg,1.7mg,1.8mg,1.9mg,2 mg,2.25mg,2.5mg,2.75mg,3mg,3.25mg,3.5mg,3.75mg, 4.0mg,4.25mg,4.5mg,4.75mg,5.0mg,5.25mg,5.5mg,5.75 mg,6mg,6.25mg,6.5mg,6.75mg,7mg,7.25mg,7.5mg, 7.75mg,8mg,8.25mg,8.5mg,8.75mg,9mg,9.25mg,9.5mg, 9.75mg或者10mg。在其他实施方案中,施用的CCH的剂量是每个注射剂或者多个注射剂中含有大约0.06mg,0.48mg,0.84mg,或者1.68mg 2.52mg,3.36mg,4.2mg,或者5.04mg。例如,大约 0.06mg,0.48mg,0.84mg,或者1.68mg 2.52mg,3.36mg,4.2mg,或者5.04mg被分配到12个注射剂中被施用。被注射的胶原酶组合物的体积可以在每注射剂0.01ml到3ml范围内,或者每次医疗访视总共施用大约1ml到80ml。
胶原酶的剂量也可以以每次注射mg表示(同样不考虑稀释剂),例如从每次注射约0.001mg到0.5mg、每次注射约0.01mg到大约 5mg、或每次注射约0.005mg到大约0.1mg、或每次注射约0.005 mg、0.04mg或0.07mg。
在某些方面,本发明预计每次治疗访视注射约500个ABC单位到大约50,000个ABC单位,或每次治疗访视注射约10,000个ABC 单位到大约25,000个ABC单位。在其他实施方案中,每次注射胶原酶的剂量约为50ABC单位到大约2,500ABC单位,或约为85 ABC单位到大约2,000ABC单位,或约为1,500ABC单位到大约 1,750ABC单位,或约为200ABC单位到大约1,500ABC单位,或约为300ABC单位到1,500ABC单位,或大约300ABC单位到大约 1,250ABC单位,或者约为500ABC单位到大约1,000ABC单位。
在某些实施方案中,所述剂量是以以下各种比活性为基础的:
*用SRC单位和SRC单位/mg的比活度乘以SRC单位与SRC单位/mg的比活度的倒数,计算毫克。例如,当剂量为500SRC单位且比活度为500SRC单位/mg时,相当于500SRC单位剂量的毫克量为(500SRC单位)*(1/(500SRC单位/mg))=1.00mg
在某些方面,本发明预计注射胶原酶的量为约5000BTC单位到大约25000BTC单位,或大约10000BTC单位到大约25000BTC单位,或大约15000BTC单位,或约17500BTC单位,或约20000BTC 单位,或约22500BTC单位,或约9175BTC单位,大约15817个 BTC单位。
5.
所述CCH或者其他胶原酶可以以药物组合物的形式存在,所述药物组合物包括CCH或者胶原酶和药学上可接受的赋形剂。这些赋形剂可以包括用于注射的无菌水或者氯化钠或者氯化钙、pH调节剂和稳定剂。
一个非限制性实施例是
在其他实施方案中,CCH以无菌冷冻干燥粉末的形式存在,包括0.92mg CCH、蔗糖、Tris,甘露糖和盐酸,处于5ml试管中。用于重组的无菌稀释液可以包括用于注射的水、正常盐水或者0.6%氯化钠和在水中浓度为0.03%的二水合氯化钙,用于注射,填充进单独的5ml试管中。
所述胶原酶或者CCH还可以充入其他尺寸的试管,例如,10ml、 15ml、20ml或者30ml。其他pH调节剂、糖、多醇和稳定剂可以在 Rowe et al.,
6.
上述胶原酶组合物可有效用于治疗或降低人体皮下脂肪团严重程度的方法中。本发明涉及一种降低人类患者中皮下脂肪团严重程度的方法,该方法包括:提供包含至少一种胶原酶的组合物;以及将治疗有效量的组合物注射到一个或多个凹坑中,其中,与治疗前的基线严重程度相比,患者表现出皮下脂肪团严重程度的降低。如下文进一步详述,该组合物可通过各种注射技术施用并且通过若干量表及其它测量工具来测量功效。
申请人先前已经描述了相关的治疗方法,并在此通过引用将其专利申请全部在此并入本文,所述专利申请例如PCT专利申请 PCT/US2018/020551(于2018年9月7日公开,公开号为 WO2018/160905);于2018年7月12日提交的,标题为“治疗水肿性纤维硬化性泛神经病变的注射技术”的美国临时申请第 62/697376号申请;于2018年9月18日提交的,标题为“四象限单剂量胶原酶治疗水肿性纤维硬化性泛神经病变的组成和方法”的美国临时申请第62/733046号申请;和于2018年3月28日提交的,标题为“胶原酶的生产方法”的美国专利申请公开号 US20180327731。
本文所述胶原酶组合物的施用可以是在治疗访视期间对单个受试者的双侧(两个大腿或两个臀部)或全部4个象限(两个臀部和两个大腿)的施用。此类治疗访视可能每10-40天进行一次,为期一年的2次、3次、4次或5次治疗访视。
表15概述了胶原酶的各种注射参数和用于治疗患者的相关技术。
表15.胶原酶的各种注射参数和用于治疗患者的相关技术综述
在某些实施方案中,将约0.84mg CCH以约12次等分注射的方式注射到受影响区域,例如象限(即,右或左臀部或右或左大腿) (约0.07mg x12次注射=约0.84mg CCH)。在某些情况下,每10-40 天进行一次0.84毫克的治疗,共进行2次、3次、4次、5次或6次。在其他情况下,每10-40天向一个以上的受影响区域或象限注射0.84 毫克,进行2、3、4、5或6次治疗。
在一个实施方案中,手术标记用于圈出选择用于治疗的每个凹坑。在另一实施方案中,所选治疗区域中的圆圈不重叠。在又一实施方案中,所选治疗区域中的圆圈重叠。
在某些实施方案中,使用治疗I的方法(图7),如表16所示对患者给药胶原酶。
表16.胶原酶剂量和体积
在本实施例中,临床医生可以在每个臀部内选择凹坑,这些凹坑在受试者站立时明显且清晰,适合治疗。临床医生对治疗的选择不受限制。每次治疗包括每个臀部注射12次(2个臀部共注射24 次)。因为治疗的目标是改善整个臀部的美观,临床医生被指示选择他或她认为最能改善整个臀部美观的凹坑。每次治疗访视时可治疗臀部内相同的凹陷或与先前在臀部内治疗的凹陷不同的凹陷,但对于3次访视中的每次访视,注射优选在臀部内(每个臀部12次注射)。每个臀部接受所有3种治疗,除非臀部没有可治疗的EFP凹坑,临床医生在CR-PCSS上给臀部评分为0。如果在第2次治疗访视时未对特定臀部(右侧或左侧)进行注射,则在第2次治疗访视和第3次治疗访视时仍对受试者的对侧臀部进行治疗评估,并由受试者(PR PCSS)和研究者(CR-PCSS)再次对每个臀部进行评估。如果研究者在CR PCSS上对其中一个或两个臀部的评分大于0,则在第3次就诊时进行注射。此外,胶原酶治疗可包括以下一种或多种:
·治疗1或者更多的象限;
·治疗凹坑,不考虑尺寸;
·治疗年长于45岁的女性;
·治疗没有皮肤松弛、松弛或下垂的凹坑;
·在不同的治疗访视中治疗不同的凹坑;
·使用1/2英寸或更长的针;
·不限制注射的凹坑之间的距离;
·不要依靠垫片、直尺、纸张或其他装置来限制注射位置;
·确保至少有一次注射发生在凹坑的最低点;
·处理长度小于约1cm或大于约2cm的凹坑;
·使用彼此相距约2厘米的注射剂;
·相互之间的注射距离小于2cm;和/或
·使用本文所述的一个或多个量表和方法测量疗效。
在某些实施方案中,当按照上面各个方面进行治疗时,患者对治疗反应迅速。参见图20-23。
进一步的,在某些具体的实施方案中,表17和表18中提供了治疗患者的参数。
表17.CCH冷冻干燥制剂参数
表18.CCH稀释参数
在一个实施方案中,重组产品的渗透压是大约50到大约1,000,大约100到大约900,大约200到大约800,大约300到大约700,大约400到大约600,大约50,大约100,大约150,大约200,大约250,大约300,大约350,大约400,大约450,大约500,大约 550,大约600,大约650,大约700,大约750,大约800,大约850,大约900,大约950,或者大约1,000mOsm/kg。在依旧另一个实施方案中,重组产品的渗透压是大约512mOsm/kg,大约275mOsm/kg,大约281mOsm/kg,或者大约227mOsm/kg。
除上述方法外,本发明还提供了一种治疗或减少需要的受试者中EFP的方法,其中该方法与EFP的常规程序和治疗相比具有以下至少一个优点:
a.医生容易施用;
b.治疗时间较短;
c.意料之外的疗效,考虑到医生普遍认为审美条件的改善是很难获得的;
d.不需要施用透明质酸酶;
e.不需要加热;
f.不需要施用激光;
g.无分割;
h.不需要麻醉(尽管有瘀伤);
i.不需要穿紧身衣;以及
j.不使用真空。
在其他实施方案中,治疗或者降低皮下脂肪团的方法对待治疗的皮下脂肪团的严重性没有要求,即,例如,胶原酶治疗是安全和有效的,无论脂肪团的流行程度或严重程度如何。
F.阶段4-治疗结束和疗效测定
本文所述的治疗方法通过下文所述的多种措施有效地治疗皮下脂肪团。如本文所用,“天”是指研究日;从在一个治疗疗程第一次对特定治疗区域使用胶原酶治疗的第一天开始连续一天天的计算,除非如下面实施例5中另外规定,在实施例5中,从开始研究前第71天开始顺序测量天数。例如,如实施例5所示,“第180天”指的是从实施例2和3所述的第71天开始算起的第180天。因此,在实施例5所述内容之外,第1天是指治疗的第一天;第71天时指从第1天开始计算70天之后;第180天时指从第一天开始计算179天后(除非是实施例5中使用的“第180天”,在实施例5中,“第180天”指的是从第71天开始算起的第180天,也就是从治疗第一天开始算起的第 251天。)
在某些实施方案中,在全部具有中度或重度CR-PCSS和/或 PR-PCSS评级的患者群体中:
·由目标治疗区域的临床医生现场评估,至少有50%的患者在第 22天、43天或71天的CR-PCSS的严重程度与基线检查时的严重程度相比至少有1级改善。
·根据受试者在查看目标治疗区域的数字图像做出的评估,至少有50%的患者在第22天、43天或71天的PR-PCSS的严重程度与基线检查时的严重程度相比至少有1级改善。
·由目标治疗区域的临床医生现场评估,至少有5%的患者在第 22天、43天或71天的CR-PCSS的严重程度与基线检查时的严重程度相比至少有2级改善。
·根据受试者在查看目标治疗区域的数字图像做出的评估,至少有5%的患者在第22天、43天或71天的PR-PCSS的严重程度与基线检查时的严重程度相比至少有2级改善。
·至少有5%的患者经历了凹坑大小(体积、长度、宽度、深度) 的显著减少,例如,在第22天、第43天或第71天,与基线相比至少减少了5%,或至少减少了10%,或至少减少了20%。
下面详细描述了这些及其他疗效参数和基准。此外,如下面的实施例所示,胶原酶注射显著改善了脂肪团的外观,表现出耐受性,并且通常耐受性良好。
1.
各个患者在任何就诊时的改善是指与基线或任何先前得分或评级相比至少提高1个水平或1级。一组患者在任何一次就诊时的平均得分或评分比基线检查或任何先前的平均得分或评分提高约0.1。应答者是指从基线检查结果看,最大总分或评分至少提高25%的患者。在某些实施方案中,通过CR-PCSS和/或PR-PCSS测量确定,以上详细描述的治疗方法产生以下一个或多个疗效终点:
1.与基线相比,在CR-PCSS和/或PR-PCSS评分中分数至少提高0.1。
2.由目标区域的临床医生现场评估,从基线(治疗前“第一天”) 开始第22天、43天、71天、90天、180天、251天、360天、431 天、720天、3年、4年或者5年,CR-PCSS的严重程度至少有2级改善。
3.由受试者观察目标区域的数字图像评估,从基线(第一天) 开始第22天、43天、71天、90天、180天、251天、360天、431 天、720天、3年、4年或者5年,PR-PCSS的严重程度至少由2级改善。
4.在第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第720天、第3年、第4年或者第5年通过2级复合反应证明的改善,被定义为受试者在CR-PCSS中比基线时的严重程度至少改善2级,在PR-PCSS中比基线时的严重程度至少改善2级。
5.在第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第720天、第3年、第4年、或第5年,由目标区域的临床医生现场评估CR-PCSS中皮下脂肪团的严重程度与基线相比至少有1级改善。
6.在第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第720天、第3年、第4年或者第5年,由受试者观察目标区域的数字图像评估PR-PCSS中皮下脂肪团的严重程度与基线相比至少有1级改善。
7.在第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第730天、第3年、第4年或者第5年,通过1级综合反应所证明的改善,定义为受试者在CR-PCSS中与基线相比严重程度至少改善1级,PR-PCSS中与基线相比严重程度至少改善1级。
8.在所有CR-PCSS评分均为中度或重度的患者群体中,与安慰剂相比,至少一个治疗区域的改善在统计学上具有显著性,其中,所述改善为上述1到7中的一个或多个。
9.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药或者三次给药后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
10.第180天在CR-PCSS中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
11.在所有CR-PCSS评分均为中度或重度的患者群体中,至少一个治疗区域最早出现2级CR-PCSS和/或PR-PCSS改善的中位时间约为50天,或60天,或70天,或80天,或90天。
12.在所有CR-PCSS评分为中度或重度的患者群体中,至少一个治疗区域中最早出现1级CR-PCSS和/或PR-PCSS改善的中位时间约为15天,或20天,或30天,或40天,或50天,或60天,或70天,或80天,或90天。
13.在所有CR-PCSS评分均为中度或重度的患者群体中,受试者CR-PCSS和/或PR-PCSS的平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
14.在所有CR-PCSS评分均为中度或重度的患者群体中,在第 71天至少一个治疗区域通过CR-PCSS和/或PR-PCSS测量具有2级复合反应的受试者百分比约为1%至10%、10%至20%、20%至30%、 30%至40%、40%至50%或大于50%。
15.在所有CR-PCSS评分均为中度或重度的患者群体中,在第 71天至少在一个治疗区域通过CR-PCSS和/或PR-PCSS测量的实现 1级复合反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%。
16.在所有CR-PCSS评分为中度或重度的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,至少有一个治疗区域的CR-PCSS和/或PR-PCSS反应至少为1级,其中CR-PCSS结果与年龄,BMI或肤色无关。
17.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
18.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,首次观察到CR-PCSS和/或PR-PCSS评分较基线检查(筛查检查)下降的最大值出现在第90天。
19.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在180天就诊前的给定时间点上,皮下脂肪团严重性 (即,负变化)的改善在第180天就诊时维持不变。
20.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第90天,左侧臀部和左侧大腿的CR-PCSS和/或 PR-PCSS评分与基线评分相比的平均(SD)变化分别约为-0.8(0.58) 和-0.6(0.62),右侧臀部和右侧大腿的变化分别约为-0.7(0.73)和 -0.5(0.70)。
21.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第180天,CR-PCSS和/或PR-PCSS评分从基线检查 (筛查访视)开始的下降在左右两侧是一致的。
22.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第90天至少有10%的受试者和第180天至少有15%的受试者的CR-PCSS和/或PR-PCSS评分在至少1个方面有2级改善。
22.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第90天,至少有10%的受试者以及在第180天,至少有15%的受试者的CR-PCSS和/或PR-PCSS评分在至少1个方面有2级改善,臀部和大腿区域以及左右两侧的反应相似。
23.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第90天,至少有60%的受试者以及在第180天,至少有65%的受试者的CR-PCSS和/或PR-PCSS评分在至少1个方面有 1级改善。
24.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第90天,至少有60%的受试者以及在第180天,至少有65%的受试者的CR-PCSS和/或PR-PCSS评分在至少1个方面有 1级改善,臀部和大腿区域以及左右两侧的反应相似。
25.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在至少一个治疗区域中,最早出现2级CR-PCSS和/或 PR-PCSS反应的中位时间约为80天。
26.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在至少一个治疗区域中,最早出现1级CR-PCSS和/或 PR-PCSS反应的中位时间约为40天。
27.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,至少50%的患者是目标臀部的1级PR-PCSS 和/或PR-PCSS应答者。
28.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,至少20%的患者是目标臀部的2级PR-PCSS 和/或PR-PCSS应答者。
29.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,至少35%的患者是目标臀部的1级CR-PCSS 和/或PR-PCSS复合应答者。
30.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,至少5%的患者是非目标臀部的2级CR-PCSS 和/或PR-PCSS复合应答者。
31.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,在受试者的目标臀部和非目标臀部,用胶原酶治疗的受试者的PR-PCSS和/或PR-PCSS与基线相比的平均变化大于用安慰剂治疗的受试者的平均变化,目标臀部分别约为0.9对 0.5;和非目标臀部分别约为0.9对0.5。
32.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,在受试者的目标臀部和非目标臀部,用胶原酶治疗的受试者中1级PR-PCSS和/或PR-PCSS响应者的所占的比例大于用安慰剂治疗的受试者中的相应比例,在目标臀部分别为大约62%对大约40%,在非目标臀部分别为大约65%对40%。
33.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,在受试者的目标臀部和非目标臀部,用胶原酶治疗的受试者的CR-PCSS和/或PR-PCSS与基线相比的平均变化大于用安慰剂治疗的受试者的平均变化,目标臀部分别约为0.7对 0.4[0.72];和非目标臀部分别约为0.8对0.3。
34.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,在受试者的目标臀部和非目标臀部,用胶原酶治疗的受试者中1级CR-PCSS和/或PR-PCSS响应者的所占的比例大于用安慰剂治疗的受试者中的相应比例,在目标臀部分别为大约58%对大约32%,在非目标臀部分别为大约60%对27%。
35.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,在受试者的目标臀部和非目标臀部,用胶原酶治疗的受试者中1级CR-PCSS和/或PR-PCSS复合应答者的所占的比例大于用安慰剂治疗的受试者中的相应比例,在目标臀部分别为大约42%对大约20%,在非目标臀部分别为大约44%对13%。
36.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,如本文所述的胶原酶治疗使患者群体中产生大于或等于 2个水平的复合应答者的数量比安慰剂至少高5%、或比安慰剂至少高7.5%、或比安慰剂至少高10%、或比安慰剂至少高12.5%、或比安慰剂至少高15%、或比安慰剂至少高20%。
37.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,如本文所述的胶原酶治疗使患者群体中产生大于或等于1 个水平的复合应答者的数量比安慰剂至少高5%、或比安慰剂至少高 7.5%、或比安慰剂至少高10%、或比安慰剂至少高12.5%、或比安慰剂至少高15%、或比安慰剂至少高20%、或比安慰剂至少高25%、或比安慰剂至少高30%、或比安慰剂至少高35%、或比安慰剂至少高40%。
38.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中CR-PCSS和/或PR-PCSS评分较基线检查(筛查检查)下降的最大值首次出现在第22天、第71天或更早。
39.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在基线检查(预处理)时,CR-PCSS和/或PR-PCSS评分与基线检查(筛查访视)的下降在左右两侧是一致的。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至39号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到39中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到39中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到39中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的胶原酶I和胶原酶II被注射到至少一个治疗区域并得到上述结果1到39中的一个或者一个以上,其中所述胶原酶I和胶原酶II具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的胶原酶I和胶原酶II被注射到至少一个治疗区域并得到上述结果1到39中的一个或者一个以上,其中所述胶原酶I和胶原酶II具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
在其他实施方案中,响应于上述治疗,受试者是2级CR-PCSS 应答者,是指其在评估时间点显示CR-PCSS评级比基线至少提高2 级(改变-2、-3或-4)。1级CR-PCSS应答者是指受试者在评估时间点CR-PCSS评分较基线至少提高1级(变化为-1、-2、-3或-4)。受试者是2级PR-PCSS应答者,是指受试者在评估时间点PR-PCSS 评分比基线至少提高2级(变化为-2、-3或-4)。1级PR-PCSS应答者是指在评估时间点,受试者PR-PCSS评分比基线至少提高1级(变化为-1、-2、-3或-4)。在其它方面,2级复合应答者是指所述受试者在评估时间点既是2级PR-PCSS应答者又是2级CR-PCSS 应答者。1级复合应答者是指在评估时间点所述受试者既是1级 PR-PCSS应答者又是1级CR-PCSS应答者。
2.
在Hexsel CSS中,个体患者在任何就诊时的改善是指相对于基线或任何先前得分至少提高1个水平或1级。一组患者在任何就诊时的改善都是从基线或任何先前的HexselCSS平均得分或评级改善约 0.1。应答者是指从基线检查结果看,最大总分或评分至少提高25%的患者。在某些实施方案中,以上详述的治疗方法产生通过Hexsel CSS测量的一个或多个以下疗效终点:
1.在所有具有基线第1天Hexsel CSS评分的患者群体中,在至少一次治疗访视期间向至少一个治疗区域注射胶原酶导致在统计学上显著数量的此类患者满足以下一个或多个疗效终点:
·从严重转为中度(评分从11-15变为6-10)
·从严重转为轻度(评分从11-15变为1-5)
·从严重转为零(评分从11-15变为0)
·从中度转为轻度(评分从6-10变为1-5)
·从中度转为零(评分从6-10变为0)
·从轻度转为零(评分从1-5变为0)
2.由目标区域的临床医生现场评估,从基线(治疗前“第一天”) 开始第22天、43天、71天、90天、180天、251天、360天、431 天、720天、3年、4年或者5年,Hexsel CSS的严重程度至少有2 级改善。
3.由临床医生观察目标区域的数字图像评估,从基线(第一天) 开始第22天、43天、71天、90天、180天、251天、360天、431 天、720天、3年、4年或者5年,Hexsel CSS的严重程度至少有2 级改善。
4.在第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第720天、第3年、第4年或者第5年通过2级复合反应证明的改善,被定义为由临床医生评估受试者在 Hexsel CSS中比基线时的严重程度至少改善2级,由受试者评估比基线时的严重程度至少改善2级。
5.从基线(第一天)开始第22天、第43天、第71天、第90 天、第180天、第251天、第360天、第431天、第720天、第3 年、第4年或者第5年,由目标区域的临床医生现场评估Hexsel CSS 中皮下脂肪团的严重程度与基线相比至少有1级改善。
6.从基线(第一天)开始第22天、第43天、第71天、第90 天、第180天、第251天、第360天、第431天、第720天、第3 年、第4年或者第5年,由临床医生观察目标区域的数字图像评估 Hexsel CSS中皮下脂肪团的严重程度与基线相比至少有1级改善。
7.在第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第720天、第3年、第4年或者第5年通过1级复合反应证明的改善,被定义为由临床医生评估受试者在 Hexsel CSS中比基线时的严重程度至少改善1级,由受试者评估比基线时的严重程度至少改善1级。
8.在所有Hexsel CSS评分均为中度或重度的患者群体中,与安慰剂相比,至少一个治疗区域的改善在统计学上具有显著性,其中,所述改善为上述2到7中的一个或多个。
9.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药或者三次给药后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
10.第180天在Hexsel CSS中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
11.在所有Hexsel CSS评分均为中度或重度的患者群体中,至少一个治疗区域最早出现2级Hexsel CSS改善的中位时间约为50 天,或60天,或70天,或80天,或90天。
12.在所有Hexsel CSS评分为中度或重度的患者群体中,至少一个治疗区域中最早出现1级Hexsel CSS改善的中位时间约为15 天,或20天,或30天,或40天,或50天,或60天,或70天,或80天,或90天。
13.在所有Hexsel CSS评分均为中度或重度的患者群体中,受试者Hexsel CSS的平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
14.在所有Hexsel CSS评分均为中度或重度的患者群体中,在第71天至少一个治疗区域通过Hexsel CSS测量具有2级复合反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%。
15.在所有Hexsel CSS评分均为中度或重度的患者群体中,在第71天至少在一个治疗区域通过Hexsel CSS测量的实现1级复合反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、 30%至40%、40%至50%或大于50%。
16.在所有Hexsel CSS评分为中度或重度的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,至少有一个治疗区域的Hexsel CSS反应至少为1级,其中Hexsel CSS结果与年龄,BMI或肤色无关。
17.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至17号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到17中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到17中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到17中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶按照治疗I的方式被注射到至少一个治疗区域并得到上述结果1到17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οVmax,min
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和II 型胶原酶可以分别被表示为AUX-I和AUX-II。
3.
在Hexsel凹陷深度评分中,个体患者在任何就诊时的改善是相对于基线或任何先前评分至少提高1个水平或1级。一组患者在任何一次就诊时的改善是,平均Hexsel凹陷深度得分或评分比基线或任何先前的平均Hexsel凹陷深度得分或评分提高约0.1。应答者是指从基线检查结果看,最大总分或评分至少提高25%的患者。在某些实施方案中,以上详述的治疗方法产生通过Hexsel凹陷深度评分测量的以下一个或多个疗效终点:
1.在所有具有基线检查第1天Hexsel凹陷深度评分的患者群体中,在至少一次治疗访视期间向至少一个治疗区域注射胶原酶导致统计显著患者数目需符合以下一个或多个疗效终点:
·从深度凹陷(3)改为中度凹陷(2)
·从深度凹陷(3)改为浅凹陷(1)
·从深度凹陷(3)改为不凹陷(0)
·从中度凹陷(2)改为浅凹陷(1)
·从中度凹陷(2)改为不凹陷(0)
·从浅凹陷(1)改为不凹陷(0)
2.由治疗区域的临床医生现场评估,从基线(治疗前“第一天”) 开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年,Hexsel 凹陷深度评分的严重程度至少有2级改善。
3.由临床医生现场评估,所观察到的改善说明从基线开始第22 天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年,Hexsel凹陷深度评分的严重程度至少有2级改善。
4.由治疗区域的临床医生现场评估,从基线开始第22天、第43 天、第71天、第90天、第180天、第251天、第360天、第431 天、第720天、第3年、第4年或者第5年,Hexsel凹陷深度评分的严重程度至少有1级改善。
5.由临床医生现场评估,所观察到的改善说明从基线(治疗前“第一天”)开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5 年,Hexsel凹陷深度评分的严重程度至少有1级改善。
6.在所有Hexsel CSS评分均为中度或重度的患者群体中,与安慰剂相比,至少一个治疗区域的改善在统计学上具有显著性,其中,所述改善为上述2到5中的一个或多个。
7.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药或者三次给药后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
8.第180天在Hexsel凹陷深度评分中观察到的相对于基线的改善在左侧和右侧治疗区域上是一致的。
9.在所有Hexsel凹陷深度评分均为中度或重度的患者群体中,至少一个治疗区域最早出现2级Hexsel凹陷深度评分改善的中位时间约为50天,或60天,或70天,或80天,或90天。
10.在所有Hexsel凹陷深度评分为中度或重度的患者群体中,至少一个治疗区域中最早出现1级Hexsel凹陷深度评分改善的中位时间约为15天,或20天,或30天,或40天,或50天,或60天,或70天,或80天,或90天。
11.在所有Hexsel凹陷深度评分均为中度或重度的患者群体中,受试者Hexsel凹陷深度评分的平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
12.在所有Hexsel凹陷深度评分均为中度或重度的患者群体中,在第71天至少一个治疗区域通过Hexsel凹陷深度评分测量具有2级复合反应的受试者所占百分比约为1%至10%、10%至20%、 20%至30%、30%至40%、40%至50%或大于50%。
13.在所有Hexsel凹陷深度评分均为中度或重度的患者群体中,在第71天至少一个治疗区域通过Hexsel凹陷深度评分测量具有1级复合反应的受试者所占百分比约为1%至10%、10%至20%、 20%至30%、30%至40%、40%至50%或大于50%。
14.在所有Hexsel凹陷深度评分为中度或重度的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第 71天,至少有一个治疗区域的Hexsel凹陷深度评分反应至少为1级,其中Hexsel凹陷深度评分结果与年龄,BMI或肤色无关。
15.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
16.在一个或者一个以上治疗区域,从基线到第71天评分的变化在大约-0.1到大约-2.0范围内。
17.在具有统计学显著性的患者群体内,一个或多个治疗区域的最小二乘(LS)平均值约为-0.1到大约-1.5(95%置信区间(CI))。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1到17号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果第1到17中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果第1至17中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果第1至17中的一个或者一个以上。
在某些实施方案中,使用治疗I中任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果第1至17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果第1至17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
4.
在里克特量表中,各个患者在任何就诊时的改善是指与基线或任何先前得分或评级相比至少提高1个水平或1级。一组患者在任何一次就诊时的平均得分或评分比基线检查或任何先前的平均得分或评分提高约0.1。在某些实施方案中,通过里克特量表评分测量确定,以上详细描述的治疗方法产生以下一个或多个疗效终点:
1.在皮下脂肪团患者群体中,在至少一次治疗访视期间向至少一个治疗区域注射胶原酶导致符合以下一个或多个疗效终点的此类患者的统计显著性数量:
里克特量表评分为“改善的”(1)
里克特量表评分为“显著改善”(2)
里克特量表评分为“非常显著的改善”(3)
2.由治疗区域的临床医生现场评估,从治疗前开始第22天、第 43天、第71天、第90天、第180天、第251天、第360天、第431 天、第720天、3年、4年或者5年,里克特量表评分显示的治疗区域外观与治疗前相比至少有2级改善。
3.由受试者观察治疗区域的数字图像评估,第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、3年、4年或者5年,里克特量表评分显示的治疗区域外观与治疗前相比至少有2级改善。
4.由治疗区域的临床医生现场评估,第22天、第43天、第71 天、第90天、第180天、第251天、第360天、第431天、第720 天、第3年、第4年或者第5年,里克特量表评分显示的治疗区域外观与治疗前相比至少有1级改善。
5.由受试者观察治疗区域的数字图像评估,第22天、第43 天、第71天、第90天、第180天、第251天、第360天、第431 天、第720天、第3年、第4年或者第5年,里克特量表评分显示的治疗区域外观与治疗前相比至少有1级改善。
6.在患有皮下脂肪团的患者中,在至少一个治疗区域里克特量表评分的改善是具有统计学显著性的,其中所述改善为上述2到5 中的一个或多个
7.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次治疗后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次治疗、二次治疗或者三次治疗后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
8.第180天在里克特量表评分分级中观察到的相对于基线的改善在左侧和右侧治疗区域上是一致的。
9.在所有患有皮下脂肪团的患者群体中,至少一个治疗区域最早出现2级里克特量表评分改善的中位时间约为50天,或60天,或70天,或80天,或90天。
10.在所有患有皮下脂肪团的患者群体中,至少一个治疗区域最早出现2级里克特量表评分改善的中位时间约为15天,或20天,或30天,或40天,或50天,或60天,或70天,或80天,或90 天。
11.在所有患有皮下脂肪团的患者群体中,受试者里克特量表的平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
12.在所有患有皮下脂肪团的患者群体中,在第71天至少一个治疗区域通过里克特量表的测量具有2级反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%。
13.在所有患有皮下脂肪团的患者群体中,在第71天至少一个治疗区域通过里克特量表的测量具有1级反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%。
14.在所有患有皮下脂肪团的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,至少有一个治疗区域的里克特量表评分反应至少为1级,其中里克特量表评分结果与年龄,BMI或肤色无关.
15.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
在其他实施方案中,在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至15号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到15中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到15中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到15中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到15中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和II 型胶原酶可以分别被表示为AUX-I和AUX-II。
5.
在某些实施方案中,用胶原酶治疗皮下脂肪团能够减少凹坑尺寸参数,如下所述:
·
·
·
·
·
在某些实施方案中,该治疗使至少5%的患者在初始剂量后71 天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有 10%、或20%、或30%、或40%、或50%的患者在初次给药后至少 6个月、或者9个月、或者12个月、或18个月、或2年或3年、或 4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药、三次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶,能够使至少一个凹坑的尺寸参数减少至少5%、或者至少10%或者至少20%,其中,所述胶原酶具有一个或者一个以上以下特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶,能够使至少一个凹坑的尺寸参数减少至少5%、或者至少10%或者至少20%。
在其他实施方案中,根据治疗I向至少一个治疗区域注射约1mg 到大约20mg胶原酶,能够使至少一个凹坑的尺寸参数减少至少5%、或者至少10%或者至少20%,其中,所述胶原酶具有一个或者一个以上以下特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的CCH,能够使至少一个凹坑的尺寸参数减少至少5%、或者至少10%或者至少20%。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域,能够使至少一个凹坑的尺寸参数减少至少5%、或者至少10%或者至少20%,其中,所述胶原酶具有一个或者一个以上以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的至少一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域,能够使至少一个凹坑的尺寸参数减少至少5%、或者至少10%或者至少20%,其中,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
6.
根据S-GAIS和I-GAIS的测量,上述治疗方法可获得改善的治疗效果。2级S-GAIS应答者是指在评估时间点S-GAIS评分至少为 2(+2或+3)的受试者。1级S-GAIS应答者是指在评估时间点S-GAIS 评分至少为1(+1、+2或+3)的受试者。2级I-GAIS应答者是指在评估时间点I-GAIS评分至少为2(+2或+3)的受试者。1级I-GAIS 应答者是指在评估时间点I-GAIS评分至少为1(+1、+2或+3)的受试者。个别患者在任何就诊时的改善是指与基线或任何先前得分相比至少提高1级或1级。一组患者在任何一次就诊时的平均得分或评分比基线检查或任何先前的平均得分或评分提高约0.1。
在某些实施方案中,通过S-GAIS和/或I-GAIS测量,上面详细描述的治疗方法产生了的一个或多个以下疗效终点:
1.在患有皮下脂肪团的患者群体中,在至少一次治疗访视期间将胶原酶注射到至少一个治疗区域会产生统计学显著数量的符合以下一个或多个疗效终点的此类患者:
S-GAIS和/或I-GAIS评分为“改善的”(+1)
S-GAIS和/或I-GAIS评分为“显著改善的”(+2)
S-GAIS和/或I-GAIS评分为“非常显著改善的”(+3)
2.由目标区域的临床医生现场评估,在第22天、第43天、第 71天、第90天、第180天、第365天或第730天可以在I-GAIS中观察到至少2级改善。
3.由受试者观察目标区域的数字图像评估,在第22天、第43 天、第71天、第90天、第180天、第365天或第730天可以在S-GAIS 中观察到至少2级改善。
4.在第22天、第43天、第71天、第90天、第180天、第365 天或第730天通过2级复合反应证明的改善,被定义为由临床医生评估受试者在I-GAIS中比基线时的严重程度至少改善2级,由受试者评估受试者在S-GAIS中比基线时的严重程度至少改善2级。
5.由目标区域的临床医生现场评估,在第22天、第43天、第 71天、第90天、第180天、第365天或第730天可以在I-GAIS中观察到至少1级改善。
6.由受试者观察目标区域的数字图像评估,在第22天、第43 天、第71天、第90天、第180天、第365天或第730天可以在S-GAIS 中观察到至少1级改善。
7.在第22天、第43天、第71天、第90天、第180天、第365 天或第730天通过1级复合反应证明的改善,被定义为由临床医生评估受试者在I-GAIS中比基线时的严重程度至少改善1级,由受试者评估受试者在S-GAIS中比基线时的严重程度至少改善1级。
8.在患有皮下脂肪团的患者群体中,在所有评分均为中度或重度的患者群体中,与安慰剂相比,至少一个治疗区域的I-GAIS和/或 S-GAIS改善在统计学上具有显著性,其中,所述改善为上述2到7 中的一个或多个。
9.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或30%、或40%、或50%的患者在初次给药后至少6个月、或者9 个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或 18个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药或者三次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
10.第180天在I-GAIS和/或S-GAIS中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
11.在所有患有皮下脂肪团的患者群体中,至少一个治疗区域最早出现2级I-GAIS和/或S-GAIS评分改善的中位时间约为50天,或60天,或70天,或80天,或90天。
12.在所有患有皮下脂肪团的患者群体中,至少一个治疗区域中最早出现1级I-GAIS和/或S-GAIS评分改善的中位时间约为15 天,或20天,或30天,或40天,或50天,或60天,或70天,或80天,或90天。
13.在所有患有皮下脂肪团的患者群体中,受试者I-GAIS和/ 或S-GAIS的平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
14.在所有患有皮下脂肪团的患者群体中,在第71天至少一个治疗区域通过I-GAIS和/或S-GAIS的测量具有2级反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、 40%至50%或大于50%。
15.在所有患有皮下脂肪团的患者群体中,在第71天至少一个治疗区域通过I-GAIS和/或S-GAIS的测量具有1级反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、 40%至50%或大于50%。
16.在所有患有皮下脂肪团的患者群体中,在所有Hexsel CSS 评分为中度或重度的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,至少有一个治疗区域的I-GAIS和/或S-GAIS的测量评分反应至少为1级,其中I-GAIS和 /或S-GAIS的测量评分结果与年龄,BMI或肤色无关.
17.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
18.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在目标臀部,在第71天,至少60%的患者是1级S-GAIS 应答者。
19.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在目标臀部,在第71天,至少20%的患者是2级S-GAIS 应答者。
20.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,使用胶原酶治疗患者目标臀部之后的平均 S-GAIS大于用安慰剂治疗患者之后的结果(分别是大约1.0vs.大约0.5)。对非目标臀部可以得到相似的结果(胶原酶治疗的患者为大约1.0,而安慰剂治疗的患者为大约0.5)。
21.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天使用胶原酶治疗患者目标臀部之后的1级 S-GAIS应答者的比率大于用安慰剂治疗患者之后的比率(分别是大约70%vs.大约40%)。对非目标臀部可以得到相似的结果(分别为大约70%vs大约40%)。
22.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,使用胶原酶治疗患者目标臀部之后的平均 I-GAIS大于用安慰剂治疗患者之后的结果(分别是大约1.0vs.大约0.3)。对非目标臀部可以得到相似的结果(胶原酶治疗的患者为大约0.6,而安慰剂治疗的患者为大约0.1)。
23.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天使用胶原酶治疗患者目标臀部之后的1级 I-GAIS应答者的比率大于用安慰剂治疗患者之后的比率(分别是大约70%vs.大约25%)。对非目标臀部可以得到相似的结果(分别为大约70%vs大约25%)。
24.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,一系列交叉表显示了PR-PCSS和S-GAIS之间的一致性。 PR-PCSS的1级变化与S-GAIS的类似变化相关。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至17号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到17中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到17中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内,
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到17中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1),进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
如实施例2和3中进一步描述的,与基线相比,使用S-GAIS对目标和非目标臀部进行治疗后,对患者进行了改善评级。如图11所示,通过S-GAIS测量的≥2水平和≥1水平反应,CCH治疗明显优于安慰剂。
7.
根据PR-CIS测定,上面详细描述的治疗方法可实现改善的治疗效果。PR-CIS总分是量表上六个项目的总和。PR-CIS中的第1项询问受试者对脂肪团外观的满意程度,通过从10中减去受试者报告的评估值来逆转。PR-CIS总分可以在0到60之间,数值越大,说明脂肪团的负面影响越大。对于PR-CIS总分,应答者是指在评估时间点PR-CIS总分比基线至少降低12分的受试者。对于个人PR-CIS 影响分数,反应是在每个时间点从基线至少2个分数间隔的改善。此外,应答者是任何显示出比基线检查时的最大总分至少提高20%的患者。个别患者在任何就诊时的改善是指与基线或任何先前得分相比至少提高1个水平或1级。一组患者在任何一次就诊时的平均得分或评分比基线检查或任何先前的平均得分或评分提高约0.1。此外,改善是指相对于基线60分中至少有1个水平的变化。
在某些实施方案中,根据PR-CIS的测定结果,上面详细描述的治疗方法可以实现一个或多个以下疗效终点:
1.在患有皮下脂肪团的患者群体中,在至少一次治疗访视期间将胶原酶注射到至少一个治疗区域会产生具有统计学显著性数量的符合以下一个或多个疗效终点的患者:
·PR-CIS显示至少有一个领域的改善,这些领域选自快乐、烦恼、自我意识、尴尬、看起来老了、看起来超重/不健康的组中选择的
·在一个或多个评估时间点,PR-CIS总分比基线至少降低12分
·PR-CIS影响分数显示在一个或多个评估时间点从基线至少2 个分数间隔的改善
·改善是指相对于基线60分中至少有1个水平的变化
2.对于目标区域,从基线(治疗前“第一天”)开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第 431天、第720天、第3年、第4年或者第5年,PR-CIS测定的严重程度至少改善12分。
3.在患有皮下脂肪团的患者群体中,从基线(治疗前“第一天”) 开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年PR-CIS 测定的严重程度与安慰剂相比,严重程度具有统计学显著性改善是指改善至少为12分。
4.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药或者三次给药后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
5.第180天在PR-CIS评分中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
6.在所有患有皮下脂肪团的患者群体中,在至少一个治疗区域,在一个或者一个以上评估时间点测定的与基线相比PR-CIS总分减少至少12的中位时间约为15天,或20天,或30天,或40天,或 50天,或60天,或70天,或80天,或90天。
7.在所有患有皮下脂肪团的患者群体中,受试者PR-CIS平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
8.在所有患有皮下脂肪团的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,在一个或者一个以上评估时间点与基线相比PR-CIS总分减少至少12,其中PR-CIS 的评分结果与年龄,BMI或肤色无关。
9.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
10.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,PR-CIS总分与基线相比的平均变化对于使用胶原酶治疗的患者是大约-10,而对于用安慰剂治疗的患者是大约 -5。
11.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,与基线检查时相比,胶原酶治疗组受试者的 PR-CIS平均变化与安慰剂治疗组受试者相比显著的,在总分(分别约为-12分与-6分)和简略分(分别约为-10分与-5分)以及个体影响分数(脂肪团出现时的幸福感、烦人感、,自我意识、尴尬、老样子和体形问题)各个方面都是显著的。
12.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天胶原酶治疗组受试者中PR-CIS应答者的比例大于安慰剂治疗组受试者的比例,无论从总分来看(分别为45%对 20%)还是从缩略分来看(分别为大约50%对25%)。另外,胶原酶治疗组受试者中对于每个个体影响分数的应答者比例也大于安慰剂治疗组的比例。这些区别也是显著的。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至9号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到9中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到19中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到9中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到9中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到9中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
如实施例2和3中进一步描述的,与基线相比,使用 PR-CIS对CCH治疗后和安慰剂治疗后的患者进行了改善评级。如图11所示,CCH治疗明显优于安慰剂。
8.
通过PR-CIS减缩版测量证明,上面详细描述的治疗方法可以实现改善的治疗效果。PR-CIS减缩版总分是量表上五个项目的总和。 PR-CIS中的第1项询问受试者对脂肪团外观的满意程度,将通过从 10中减去受试者报告的评估来逆转。PR-CIS减缩版的总分可以在0 到50之间,数字越高,说明脂肪团的负面影响越大。对于PR-CIS 减缩版的总分,应答者是指在评估时间点PR-CIS总分比基线至少降低10分的受试者。对于个人PR-CIS减缩版影响分数,反应是在每个时间点从基线至少2个分数间隔的改善。此外,应答者是任何显示出比基线检查时的最大总分至少提高20%的患者。个别患者在任何就诊时的改善是指与基线或任何先前得分相比至少提高1个水平或1级。一组患者在任何一次就诊时的平均得分或评分比基线检查或任何先前的平均得分或评分提高约0.1。此外,改善是从基线的 50分中至少改变了1分的水平。
在某些实施方案中,通过PR-CIS减缩版测定,上面描述的治疗方法能够实现以下一个或者一个以上的下述功效终点:
1.在患有皮下脂肪团的患者群体中,在至少一次治疗访视期间将胶原酶注射到至少一个治疗区域可以产生统计学显著数量的符合以下一个或多个疗效终点的患者:
·PR-CIS减缩版显示至少有一个领域的改善,这些领域选自由快乐、烦恼、自我意识、尴尬、看起来老了、看起来超重/不健康所组成的组中
·在一个或多个评估时间点,PR-CIS减缩版总分比基线至少降低10分
·PR-CIS减缩版影响分数显示在一个或多个评估时间点从基线至少2个分数间隔的改善
·进一步的,改善是指相对于基线50分中至少有1个水平的变化
2.对于目标区域,从基线(治疗前“第一天”)开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第 431天、第720天、第3年、第4年或者第5年,PR-CIS减缩版测定的严重程度至少改善12分。
3.在患有皮下脂肪团的患者群体中,从基线(治疗前“第一天”) 开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年PR-CIS 减缩版测定的严重程度与安慰剂相比,严重程度具有统计学显著性改善是指改善至少为10分。
4.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药或者三次给药后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
5.第180天在PR-CIS减缩版评分中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
6.在所有患有皮下脂肪团的患者群体中,在至少一个治疗区域,在一个或者一个以上评估时间点测定的与基线相比PR-CIS减缩版测定的总分减少至少10的中位时间约为15天,或20天,或30天,或40天,或50天,或60天,或70天,或80天,或90天.
7.在所有患有皮下脂肪团的患者群体中,受试者PR-CIS减缩版平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
8.在所有患有皮下脂肪团的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,在一个或者一个以上评估时间点与基线相比PR-CIS减缩版总分减少至少10,其中PR-CIS的评分结果与年龄,BMI或肤色无关.
9.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
10.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,PR-CIS减缩版总分与基线相比的平均变化对于使用胶原酶治疗的患者是大约-10,而对于用安慰剂治疗的患者是大约-5。
11.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,与基线检查时相比,胶原酶治疗组受试者的 PR-CIS减缩版平均变化与安慰剂治疗组受试者相比显著的,在总分 (分别约为-12分与-6分)和简略分(分别约为-10分与-5分)以及个体影响分数(脂肪团出现时的幸福感、烦人感、,自我意识、尴尬、老样子和体形问题)各个方面都是显著的。
12.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天胶原酶治疗组受试者中PR-CIS应答者的比例大于安慰剂治疗组受试者的比例,无论从总分来看(分别为45%对 20%)还是从缩略分来看(分别为大约50%对25%)。另外,胶原酶治疗组受试者中对于每个个体影响分数的应答者比例也大于安慰剂治疗组的比例。这些区别也是显著的。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至12号结果中的一个或多个,其中胶原酶具有以下一个或多个特征。
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到12中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到12中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到12中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到12中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到12中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
9.
根据SSRS的测量,上面详细描述的治疗方法产生改善的治疗效果。SSRS应答者是对第71天大腿上脂肪团的外观至少稍微满意(稍微满意[4]、非常满意[5]或非常满意[6])的受试者。此外,应答者是指与基线相比最大总分改善至少17%的任何患者。个别患者在任何就诊时的改善是指与基线或任何先前得分相比至少提高1个水平或 1级。一组患者在任何一次就诊时的平均得分或评分比基线检查或任何先前的平均得分或评分提高约0.1。在某些实施方案中,通过SSRS 评级测量,治疗方法产生的以下一个或多个疗效终点:
1.在患有皮下脂肪团的患者群体中,在至少一次治疗访视期间向至少一个治疗区域注射胶原酶导致在统计学上显著数量的此类患者满足以下一个或多个疗效终点:
·SSRS评分为“比较满意”
·SSRS评分为“满意”
·SSRS评分为“非常满意”
2.对于治疗区域,从基线(治疗前“第一天”)开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年,SSRS评分测定的严重程度至少改善2级。
3.对于治疗区域,从基线(第一天)开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年,SSRS评分测定的严重程度至少改善1级。
4.在患有皮下脂肪团的患者群体中,在至少一个治疗区域内 SSRS评分测定的改善与安慰剂相比是具有统计学显著性的,其中,所述改善是以上2到3中的一个或者多个。
5.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次治疗或者三次治疗后1个月,或3个月,或6个月,或9个月,或 12个月,或18个月,或24个月表现出改善,并伴有更多的改善
6.第180天在SSRS评分中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
7.在所有患有皮下脂肪团的患者群体中,至少一个治疗区域最早出现2级SSRS评分改善的中位时间约为50天,或60天,或70 天,或80天,或90天
8.在所有患有皮下脂肪团的患者群体中,至少一个治疗区域中最早出现1级SSRS评分改善的中位时间约为15天,或20天,或 30天,或40天,或50天,或60天,或70天,或80天,或90天。
9.在所有患有皮下脂肪团的患者群体中,受试者SSRS平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
10.在所有患有皮下脂肪团的患者群体中,在第71天至少一个治疗区域通过SSRS评分的测量具有2级反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%。
11.在所有患有皮下脂肪团的患者群体中,在第71天至少一个治疗区域通过SSRS评分的测量具有1级反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%
12.在所有患有皮下脂肪团的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,至少有一个治疗区域的SSRS测量评分反应至少为1级,其中SSRS的测量评分结果与年龄,BMI或肤色无关.
13.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
14.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,至少40%的患者是1级SSRS应答者。
15.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第71天,胶原酶治疗组的受试者SSRS的平均得分显著高于安慰剂治疗组的受试者。
16.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,至少50%的患者是1级SSRS应答者。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至16号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到16中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到16中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到16中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到16中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到16中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
10.
根据SSCT的测量,上面详细描述的治疗方法产生改善的治疗效果。SSCT评估中,在第71天对大腿上脂肪团的反应为:“满意”或者“非常满意”的受试者被认为是显示疗效的响应者。个体患者在任何就诊时的改善是指与基线或任何先前得分相比至少提高1个水平或1级。一组患者在任何一次就诊时的平均得分或评分比基线检查或任何先前的平均得分或评分提高约0.1。进一步的,对于 SSCT,改善是与安慰剂相比至少提高0.1。在某些实施方案中,通过SSCT评级测量,治疗方法产生的以下一个或多个疗效终点:
1.在患有皮下脂肪团的患者群体中,在至少一次治疗访视期间向至少一个治疗区域注射胶原酶导致在统计学上显著数量的此类患者满足以下一个或多个疗效终点:
·SSCT评分为“满意”
·SSCT评分为“非常满意”
2.对于目标区域,第22天、第43天、第71天、第90天、第 180天、第251天、第360天、第431天、第720天、第3年、第4 年或者第5年,SSCT评分增加(例如,1到2,等等)。
3.在患有皮下脂肪团的患者群体中,在第22天、第43天、第 71天、第90天、第180天、第251天、第360天、第431天、第 720天、第3年、第4年或者第5年,在至少一个治疗区域SSCT评分的增加与安慰剂相比具有统计学上的显著性。
4.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善结果。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18 个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药或三次给药后1个月,或3个月,或6个月,或9个月,或12 个月,或18个月,或24个月表现出改善,并伴有更多的改善。
5.第180天在SSCT评分中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
6.在所有患有皮下脂肪团的患者群体中,至少一个治疗区域中最早出现SSCT评分改善的中位时间约为15天,或20天,或30天,或40天,或50天,或60天,或70天,或80天,或90天。
7.在所有患有皮下脂肪团的患者群体中,受试者SSRS平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
8.在所有患有皮下脂肪团的患者群体中,在第71天在至少一个治疗区域具有改善的SSCT评分的受试者所占百分比约为1%至 10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%。
9.在所有患有皮下脂肪团的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,至少有一个治疗区域具有改善的SSCT评分,其中SSRS的测量评分结果与年龄, BMI或肤色无关。
10.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
11.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在180天,超过半数的患者对治疗表示满意或者非常满意。
12.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在第180天,CR-PCSS和/或PR-PCSS评分持续下降,再加上受试者满意度调查的得分表明,对每个治疗区域进行12次皮下注射0.84mg CCH的三个疗程(x2治疗区域),在双侧臀部或双侧大腿处均可有效减少皮下脂肪团。
13.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,至少50%的接受脂肪酶治疗的患者对皮下脂肪团治疗表示满意或者非常满意.
14.在所有CR-PCSS和/或PR-PCSS评分均为中度或重度的患者群体中,在71天,使用脂肪酶治疗组的患者和安慰剂治疗组的患者之间关于受试者满意度的平均分出现显著区别。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至14号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到14中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到14中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到14中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到14中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到14中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
11.大腿皮下脂肪团严重程度-患者(TCS-P);大腿皮下脂肪团严重程度-临床医生(TCS-C)量表测定的功效
个体患者在任何就诊时的改善是指相对于基线或任何先前得分至少提高1个水平或1级。一组患者在任何就诊时的改善都是与基线或任何先前的平均得分相比改善约0.1。应答者是指从基线检查结果看,最大总分或评分至少提高20%的患者。在某些实施方案中,以上详述的治疗方法产生通过TCS-C和/或TCS-P测量的一个或多个以下疗效终点:
1.TCS-C和/或TCS-P评分与基线相比改善至少0.1。
2.对于目标区域,由临床医生现场进行评价,从基线(治疗前“第一天”)开始第22天、第43天、第71天、第90天、第180 天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年,TCS-C评分测定的严重程度至少改善2级。
3.对于目标区域,由患者根据数字图像观察评估,从基线(第一天)开始第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第720天、第3年、第4年或者第5年, TCS-P评分测定的严重程度至少改善2级。
4.改善显示在从基线开始第22天、第43天、第71天、第90 天、第180天、第251天、第360天、第431天、第720天、第3 年、第4年或者第5年均出现2-级复合应答者,所述2级复合应答者的定义为使用TCS-P评分测定的严重程度与基线相比至少改善2 级并且使用TCS-C评分测定的严重程度与基线相比也至少改善2级的患者。
5.对于目标区域,由临床医生现场进行评价,从基线(“第一天”) 开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第431天、第720天、第3年、第4年或者第5年,TCS-C 评分测定的严重程度至少改善1级。
6.对于目标区域,由患者根据数字图像观察评估,从基线(第一天)开始第22天、第43天、第71天、第90天、第180天、第251 天、第360天、第431天、第720天、第3年、第4年或者第5年, TCS-P评分测定的严重程度至少改善1级。
7.改善显示在从基线开始第22天、第43天、第71天、第90 天、第180天、第251天、第360天、第431天、第720天、第3 年、第4年或者第5年均出现1-级复合应答者,所述1级复合应答者的定义为使用TCS-P评分测定的严重程度与基线相比至少改善1 级并且使用TCS-C评分测定的严重程度与基线相比也至少改善1级的患者。
8.在所有TCS-C评分均为中度或重度的患者群体中,与安慰剂相比,至少一个治疗区域的改善在统计学上具有显著性,其中,所述改善为上述1到7中的一个或多个。
9.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或 18个月,或24个月表现出改善,并伴有更多的改善。ter the initial dose. 一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、二次给药、或者三次给药后1个月,或3个月,或6个月,或9个月,或12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
10.第180天在TCS-C和/或TCS-P评分中观察到的相对于基线的改善在左侧和右侧大腿上是一致的。
11.在所有TCS-C评分均为中度或重度的患者群体中,至少一个治疗区域最早出现2级TCS-C和/或TCS-P评分改善的中位时间约为50天,或60天,或70天,或80天,或90天。
12.在所有TCS-C评分均为中度或重度的患者群体中,至少一个治疗区域最早出现1级TCS-C和/或TCS-P评分改善的中位时间约为15天,或20天,或30天,或40天,或50天,或60天,或 70天,或80天,或90天。
13.在所有TCS-C评分均为中度或重度的患者群体中,受试者 TCS-C和/或TCS-P平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
14.在所有TCS-C评分均为中度或重度的患者群体中,在第71 天至少在一个治疗区域通过TCS-C和/或TCS-P测量的实现2级复合反应的受试者所占百分比约为1%至10%、10%至20%、20%至30%、30%至40%、40%至50%或大于50%。
15.在所有TCS-C评分均为中度或重度的患者群体中,在第71 天至少在一个治疗区域通过TCS-C和/或TCS-P测量的实现1级复合反应的受试者所占百分比约为1%至10%、10%至20%、20%至 30%、30%至40%、40%至50%或大于50%。
16.在所有TCS-C评分均为中度或重度的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天在至少一个治疗区域具有至少1级TCS-C和/或至少1级TCS-P应答,其中,TCS-C和/或TCS-P的测量评分结果与年龄,BMI或肤色无关。
17.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21 天、30天、35天、40天、45天或50天内迅速减轻。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至17号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到17中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到17中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的胶原酶会产生上述结果1到17中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到10中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到17中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者 1∶0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I 型和II型胶原酶可以分别被表示为AUX-I和AUX-II。
12.
根据Body-Q的测量,上面详细描述的治疗方法产生改善的治疗效果。对于皮下脂肪团,共有16个量表项目测量过去一周时间段内的患者反应,选项从“完全没有”到“非常困扰”,并综合成 Flesch-Kincaid等级读数水平。分数在16(非常困扰)到64(完全没有)范围内变化。对于Body-Q总分,响应者是指在评估时间点与基线相比Body-Q总分增加至少16分的患者。对于各个Body-Q影响分数,反应是指在每个时间点与基线相比至少增加一个分数间隔的改善。在作为选择的实施方案中,评分的项目可以大于或者小于 16,并且,所述响应者是指与基线相比最大总分的改善至少为25%的患者。
在某些实施方案中,以上详述的治疗方法产生通过Body-Q测量的一个或多个以下疗效终点:
1.在患有皮下脂肪团的患者群体中,在至少一次治疗访视期间向至少一个治疗区域注射胶原酶导致在统计学上显著数量的此类患者满足以下一个或多个疗效终点:
Body-Q显示在选自以下所组成的组中的至少一个方面具有改善:
在一个或者一个以上评估时间点,与基线相比Body-Q测量的总分至少增加16;
对于各个Body-Q影响分数,在每个时间点与基线相比至少改善 1分;并且
从基线开始至少改善最大总分的25%。
在一个或者一个以上评估时间点,与基线相比Body-Q总分至少增加16。
Body-Q影响分数在每个时间点与基线相比至少改善1分
Body-Q鉴定皮下脂肪团时与基线相比的平均改变发生在第90 天和/或第180天
2.对于目标区域,从基线(治疗前“第一天”)开始第22天、第43天、第71天、第90天、第180天、第251天、第360天、第 431天、第720天、第3年、第4年或第5年后严重程度的改善为Body-Q评分至少增加16分。
3.在患有皮下脂肪团的患者群体中,对于,目标区域,从基线(治疗前第一天)开始第22天、第43天、第71天、第90天、第180 天、第251天、第360天、第431天、第720天、第3年、第4年或第5年后Body-Q测定结果显示与安慰剂相比,严重程度的改善具有统计学显著性,即,至少增加16分。
4.该治疗使至少5%的患者在初始剂量后71天内保持了与治疗前基线相比的改善水平。在某些情况下,至少有10%、或20%、或 30%、或40%、或50%的患者在初次给药后至少6个月、或者9个月、或者12个月、或18个月、或2年或3年、或4年、或5年内保持这种水平。在其他情况下,治疗至少有5%的患者表现出与治疗前基线相比的改善,并且随着时间的推移表现出更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药后1个月,或3个月,或6个月,或9个月,或12个月,或 18个月,或24个月表现出改善,并伴有更多的改善。一些治疗导致至少10%,或20%,或30%,或40%或50%的患者在首次给药、或者二次给药后或者三次给药后1个月,或3个月,或6个月,或9 个月,或12个月,或18个月,或24个月表现出改善,并伴有更多的改善。
5.在第一次注射后第180天,与基线相比,Body-Q评分后观察到的改善在左侧和右侧大腿上是一致的。
6.在所有患有皮下脂肪团的患者群体中,Body-Q评分总分与基线相比至少增加16的中位时间约为15天,或20天,或30天,或 40天,或50天,或60天,或70天,或80天,或90天。
7.在所有患有皮下脂肪团的患者群体中,受试者Body-Q平均得分在第一次治疗21天后与安慰剂分离,并在随后的治疗后显示出持续和显著的改善。
8.在所有患有皮下脂肪团的患者群体中,超过三分之一、二分之一、三分之二或四分之三的患者在治疗后第71天,至少有一个治疗区域的在一个或者一个以上评价时间点Body-Q评分总分与基线相比至少增加16,其中Body-Q的测量评分结果与年龄,BMI或肤色无关。
9.皮下脂肪团的严重程度在首次治疗访视后7天、14天、21天、 30天、35天、40天、45天或50天内迅速减轻。
在其他实施方案中,在至少一次治疗访视期间向至少一个治疗区域注射约1mg到大约20mg胶原酶产生上述第1至9号结果中的一个或多个,其中胶原酶具有以下一个或多个特征:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000到大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到9中的一个或者一个以上。
在其他情况下,根据治疗I中的任意一个注射大约1mg到大约 20mg的胶原酶会产生上述结果1到9中的一个或者一个以上,其中,所述胶原酶具有以下特征中的一个或者一个以上:
·V
·K
·K
·1/K
·K
·分子量在大约60kDa到大约130kDa,或者大约70到大约 130kDa,或者大约80到大约120kDa,或者大约90到大约120kDa,或者大约100到大约110kDa范围内。
·通过反向HPLC(高压液相色谱)测定的纯度按面积计为至少 80%
·效价(即,比活性)为大约500到大约30,000SRC单位/mg
·效价为大约5,000到大约30,000f-SRC单位/mg
·效价为大约100,000到大约400,000GPA单位/mg
·效价为大约175,000到大约500,00f-GPA单位/mg
·效价为大约5,000至大约25,000ABC单位/mg
·按面积计杂质的纯度小于或者等于1%,所述杂质选自由梭菌蛋白酶、白明胶酶和亮肽素所组成的组中
·小于或者等于1cfu/mL的生物负担
在另一个实施例中,根据治疗I中的任意一个注射大约1mg到大约20mg的CCH会产生上述结果1到9中的一个或者一个以上。
在某些实施方案中,在至少一次治疗访视中,大约1mg到大约 20mg的比例为大约1∶1的I型胶原酶和II型胶原酶被注射到至少一个治疗区域并得到上述结果1到9中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
在某些实施方案中,使用治疗I中的任意一个将大约1mg到大约20mg的比例为大约1∶1的I型胶原酶和II型胶原酶注射到至少一个治疗区域并得到上述结果1到9中的一个或者一个以上,其中所述I型胶原酶和II型胶原酶具有以下特征:
·I型
ο实验:SRC微孔板
οV
οK
οK
ο1/K
οK
·II型
ο实验:GPA微孔板
οV
οK
οK
ο1/K
οK
还可以使用其他比例,(例如,0.1-2∶1,或者0.25-2∶1,或者 0.5-2∶1,或者0.75-2∶1,或者1∶0.1-2,或者1∶0.25-2,或者1∶ 0.5-2,或者1∶0.75-2,或者1∶0,或者0∶1)。进一步的,I型和 II型胶原酶可以分别被表示为AUX-I和AUX-II。
13.
介绍.如以下实施例中的描述,三维摄影或其他图像可用于治疗效果的评估,尤其是凹坑分析和瘀伤分析。使用三维图像进行的凹坑分析(如上所述)可包括计算凹坑体积、长度、宽度和面积。可通过各种已知方法来执行计算,例如Eckhouse et al.WO 2018/116304和WO 2018/116305,Cherry Imaging中描述的方法以及可从Canfield Scientific,Inc.获得的方法。可使用数字3-D灰度图像 (具有X和Y轴旋转特征)来计算体积、长度、宽度和面积的此类测量值,以及数字3-D纹理和照明图像(具有X和Y旋转功能)以及分析此类图像的计算机程序。在一个实施方案中,在臀部治疗区,可在治疗前后为每位患者拍摄左侧治疗臀部和/或右侧治疗臀部的图像。在其他实施方案中,大腿治疗区域,可在治疗前后拍摄患者前位、后位、侧位的图像,例如以0度、45度和90度的角度拍摄大腿治疗区域中的每一个的图像。
临床医生和患者可以使用照片和成像工具来评估脂肪团的严重程度,无论是否使用本文所述的量表和其他工具。在一个实施方案中,临床医生/研究人员或合格指定人员使用提供的标准化三维摄像机以标准化方式拍摄每个治疗区域(每个臀部或每个大腿)。拍摄对象代表每一个摄影环节,穿着标准化的摄影服装。临床医生/研究人员或合格指定人员在受试者以一致的标准放松姿势站立时,对2 个治疗部位(2个臀部或2个大腿)中的每个部位进行拍照。这些照片和上述图像可用于下述疗效分析。下面描述了该方法其他的非限制性和可选的细节。
3D照片的图像分析.采用三维摄影图像评价治疗效果。研究人员或合格的指定人员在注射前用标准化的数码相机对每个治疗部位 (臀部或大腿)进行拍照,在治疗第1天、第22天和第43天标记凹坑和注射部位前后进行拍照。在筛选和所有其他非给药访视时,对每个治疗区域拍摄一组照片。在第4天、第8天、第15天、第22 天、第43天和第71天(研究结束/ET)拍摄的照片由一名对治疗组和研究访视日不知情的中央评估员进行审查。
下面讨论用于评估瘀伤、体积、表面积和最大长度/宽度的标准图像分析(IA)程序。本研究使用的相机系统是购自Canfield Scientific公司的IntelliStudio,配备有定制照明、Vectra M1相机和 Canfield Capture软件(3.5版)。图像类型、属性、视图和访问窗口被定义并将其直接输入研究方案内的数字监控系统(DMS)。DMS 中的研究设置包括以下内容:
图像被捕获并分阶段放入DMS中,供审查。摄影访问包括:筛选、第1天/预评分、第1天/后评分、第4天、第8天、第15天、第22天/预评分、第22天/后评分、第43天/预评分、第43天后评分和第71天/ET。
1.拍照并用PowerPoint打开图像;
2.联系现场并要求该现场的调查员在PowerPoint内将主凹坑标记为X。
3.保存信件并于图像分析(IA)小组共享
在第1天(预标记)、22天、43天和71天进行凹坑分析。在第22天、第43天和第71天,总结了从第一天预标记图像观察到的凹坑分析参数、凹坑底部和内插表面之间的最大长度、最大宽度、表面积和体积的变化,使用描述性统计(图19(A)-19(C)中描述了示例性凹坑分析)按治疗区域和注射类型分类。此外,还利用线性模型对体积进行了分析。
IAT(图像分析小组)使用第1天标记后图像作为参考,以确定第1天标记前图像上目标凹陷的位置。在第1天-预标记时,在凹坑凹陷边缘周围进行追踪。将凹坑追踪转移到第22天预标记、第43 天预标记和第71天/ET图像。该追踪用于测量(i)最大长度(即,穿过凹坑的最长直线距离);(ii)最大宽度(即,垂直于最大长度测量的最长直线距离);(iii)凹坑的表面积;以及(iv)凹坑底部和内插表面之间的体积。
在VAM中生成了一张彩色距离图,IAT使用该图来审查登记。基于+5到-5毫米(mm)(图14)的色阶,颜色-距离映射表示两(2) 个图像模型之间的距离。IAT确保了大部分图像都是绿色的,这表明两个图像之间的距离可以忽略不计,并且它们是正确对齐的。
质量检查IAT审查了跟踪的随访图像和QC图像的质量,以验证跟踪是否成功。对于接受凹坑分析的访视,IAT还将QC图像覆盖在跟踪的随访图像上,以确保在主要凹坑区域的QC图像上没有大的孔。QC图像的网格上有一个洞,表明丢失区域的跟踪信息。如果由于分析区域内的信息丢失,IAT认为跟踪不可接受,则调整跟踪种子地标并再次运行跟踪脚本。IAT指出,由于眩光、深阴影、衣服在皮肤上留下的印记、受试者体位的大变化或皮肤色素沉着的大变化,不可避免地会出现表面跟踪质量差的情况。QC图像的网格中的孔预计位于强瘀伤区域。
IAT使用第1天-标记后图像作为参考,在第1天-标记前图像上定位目标凹坑。然后,IAT在跟踪的预标记图像上跟踪主凹坑的边界。根据需要调整跟踪,直到刚好超出凹坑变凹的脊线,并描绘出用于凹坑分析的主凹坑AOI。(图15).根据每个随访图像与基线 (图16)的唯一表面跟踪关系,将跟踪预标记图像上的凹坑跟踪转置到第22天、第43天和第71天的随访图像上。IAT注意到任何影响转置AOI的图像质量差的情况。
此外,IAT还创建了第二个跟踪,“正常组织”AOI。正常组织 AOI是在不受衣服压线、异常发红或痤疮或疤痕组织等皮肤特征造成的皮肤纹理扭曲影响的皮肤区域创建的。在可能和适用的情况下,正常组织AOI试图匹配第一天预标记瘀组织AOI曲率上出现的任何阴影、光泽或眩光。正常组织AOI的大小和形状因受试者不同而不同,这取决于可用的自然外观皮肤的数量。追踪后,IAT根据第4 天图像的表面追踪关系,将第4天图像中的瘀组织织和正常组织AOI 转换为第1天-预标记、第8天和第15天图像。如果某一特定受试者或受试者一侧的其他瘀伤分析访视的边缘之外有一个或多个 AOI,则应对AOI进行调整,直到所有访视的AOI一致。
IAT在第1天-预标记、第4天、第8天和第15天的图像上手动追踪白色参考标签,并将追踪标记为“白色”。如果白色参考标签放置在瘀伤区域内,IAT追踪标签的边界,并在每次受影响的就诊时从瘀伤AOI中减去。在图像上不存在白色参考标签的情况下,该图像不符合擦伤分析的目的。
在第1天-标记后图像的情况下,表面积测量为主要凹陷AOI或现场跟踪AOI的总表面积。最大凹坑长度测量为穿过主凹坑AOI的最大点对点轴。最大凹坑宽度测量为垂直于最大凹坑长度轴的最大点到点距离。
瘀伤分析由两个L*a*b*颜色测量所组成。L*a*b*在瘀组织和正常组织AOI(图18(A))内测量颜色值。下表总结了所进行的分析(表19)。
表19.瘀伤分析总结
瘀伤分析.在第1、4、8和15天使用两个L*A*B*颜色测量在 3维照片上进行瘀伤组织和正常组织分析(图18(B)).L*A*B*颜色强度测量值越大,瘀伤越严重。这里确定了每个治疗区域和注射类型的两种颜色的瘀伤组织和正常组织之间的视觉感知变化。
G.效果的持久性
本文所述的胶原酶治疗具有通过本文所公开的任何量表或评估方法测量的持久有效性。这种持久性可能从3个月到5年或更长。单次注射或一系列注射可维持脂肪团的改善,或持续改善脂肪团的外观,或长时间降低脂肪团外观的严重程度,例如6个月、1年、2年、3年、4年或5年或更长时间。
在特定的实施方案中,接受胶原酶注射的患者在治疗后约6个月时,CR-PCSS和PR-PCSS评分中的一个或两个评分与基线相比持续改善≥1分,或在治疗后约12个月时,CR-PCSS和PR-PCSS评分中的一个或两个评分与基线相比持续改善≥1分。此外,这些患者在治疗后约22天、43天、90天或180天的CR-PCSS和PR-PCSS评分与基线相比有≥1分的改善。例如,至少约有10%、15%、20%、25%、30%、 35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、 90%、95%、100%的患者表现出这种持久性。
在另一个方面,该治疗方法评估了2级复合反应者(PR-PCSS 和CR-PCSS中至少有2级脂肪团严重程度改善的患者)的疗效持久性,从而得出在6个月和12个月时显示疗效持久性的统计显著数。在某些实施例中,至少约10%、15%、20%、25%、30%、35%、40%、 45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、 100%的患者证明了这种持久性。
持久性非限制性实施例包括:
a.CR-PCSS评分的下降一直维持到第180天,再加上受试者对脂肪团治疗满意度量表的评分,证明像两侧臀部或者两侧大腿上每治疗区域(x2个治疗区域)12次皮下注射CCH0.84mg 3个疗程的有效性。
b.在第180天,CR-PCSS评分从基线检查(筛查访视)开始的下降在左右两侧是一致的。
c.在第180天,观察到至少一个治疗区域的CR-PCSS评分有2 级改善。臀部和大腿左右两侧的反应相似。
d.在第180天,观察到至少一个治疗区域的CR-PCSS评分有1 级改善。臀部和大腿左右两侧的反应相似。
e.在至少一个区域可以最早观察到2-级CR-PCSS评分响应的中位时间是83天。
f.最早观察到1-级CR-PCSS评分响应的中位时间是41天。
g.在第180天,超过一半以上的患者对治疗效果是满意的或者非常满意的。
h.与其基线分类为重度(11-15)相比较,患者在一段时间内在 Hexsel-CSS上的得分首先被分为中度(6-10)或轻度(1-5),然后继续被分为中度(6-10)或轻度(1-5)。
i.使用CR-PCSS、PR-PCSS、Hexsel CSS、Hexsel凹陷深度评分、里克特量表、凹坑分析、I-GAIS、S-GAIS、PR-CIS、PR-CIS减缩版、 SSRS、SSCT、CR-TCES,PR-TCES,Body-Q中的一个或多个,通过摄影或其他图像进行的评估,或临床医生和/或患者用于评估脂肪团严重程度、改善和/或患者满意度的任何其他经验证的相片数字或其他量表测量患者恢复到基线或比基线更差的时间段。
j.使用CR-PCSS、PR-PCSS、Hexsel CSS、Hexsel凹陷深度评分、里克特量表、凹坑分析、I-GAIS、S-GAIS、PR-CIS、PR-CIS减缩版、 SSRS、SSCT、CR-TCES,PR-TCES,Body-Q中的一个或多个,通过摄影或其他图像进行的评估或临床医生和/或患者用于评估脂肪团严重程度、改善和/或患者满意度的任何其他经验证的相片数字或其他量表测量从改善之日起到受试者不在对治疗有明显反应之日止的时间段。
k.测量从治疗反应的参考时间点到受试者的反应发生变化(包括对治疗最初反应的改善)的时间段。可通过CR-PCSS、PR-PCSS、Hexsel CSS、Hexsel凹陷深度评分、里克特量表、凹坑分析、I-GAIS、 S-GAIS、PR-CIS、PR-CIS减缩版、SSRS、SSCT、CR-TCES、PR-TCES、Body-Q中的一种或者一种以上方法,通过摄影或其他图像进行的评估或使用的任何其他经验证的摄影数字或其他量表由临床医生和/ 或患者评估脂肪团的严重程度、改善和/或患者满意度,从而测量反应和/或改善的变化。在一些实施方案中,参考时间点是基线(给药前,第1天)或治疗后第71天。
l.从受试者根据CR-PCSS和PR-PCSS测定成为2级复合响应者的访视日期开始测量的一段时间,直到两次连续访视评估评分恢复并维持到基线评分的第一天。
m.从受试者根据CR-PCSS和PR-PCSS测定成为1级复合响应者的访视日期开始测量的一段时间,直到两次连续访视评估评分恢复并维持到基线评分的第一天。
H.胶原酶注射的安全性
到目前为止所做的研究(其中一些在下面的实施例中进行了详细说明)确定了本文所述治疗的安全性。例如,这些研究证实,在四个治疗区域同时皮下注射3.36毫克CCH后,胶原酶缺乏全身暴露。事实上,在四个治疗区域同时给药时没有观察到胶原酶在安全性方面的新问题。通常报告的事件与目前已知的胶原酶不良事件相一致。
大多数接受CCH治疗的受试者至少出现一次轻度到中度的 TEAE。受试者在大腿或臀部治疗部位发生TEAE没有显著差异。 TEAE最常见的类型是注射部位反应,特别是注射部位瘀伤,治疗部位(臀部或大腿)之间没有差异。大多数TEAE在21天内解决。临床和血液学实验室参数、尿液分析结果、生命体征或联合用药均无临床意义的变化。在临床上没有发现与抗药物抗体或中和抗体相关的受试者。
如这里所述和图16-18中的定义所述,可以进行瘀伤分析以测量瘀伤的程度。在某些实施方案中,由胶原酶治疗引起的任何瘀伤可在治疗访视后约3天、或4天、或5天、或6天、或7天、或8天、或9天、或10天、或11天、或12天、或13天、或14天、或15 天或20天时消退或颜色强度显著降低。
I.实施例
下面包括的实施例用以演示本发明的某些实施方案。然而,根据本发明的公开,本领域技术人员应当理解,在不脱离本发明的精神和范围的情况下,可以在所公开的特定实施例中进行修改,并且仍然获得类似的结果。因此,所有提出的问题都应解释为说明性的,而不是限制性的。例如,在使用CCH的研究中,其他胶原酶的使用量(治疗有效量)足以产生与CCH相当的活性和反应。在下文所述的临床试验结果中,应理解,所报告的每个数值并不打算严格限制。本发明公开的范围包括围绕与本文所述发明的事实和原理一致的每个值的范围。因此,每个值可以上下变化约1%、5%、10%、15%、 20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、 75%、80%、85%、90%、95%或100%。在某些情况下,根据特定值的上下文和环境,它可以上下变化约125%、150%、175%、200%、 225%、250%、275%或300%。
实施例1-CCH用于治疗EFP的临床研究(研究205)
对至少在2个双侧治疗区域(即双侧臀部或双侧后外侧大腿) 有轻度、中度或重度脂肪团的受试者进行了一项开放标签的第2阶段研究,其中在第1天、第22天和第43天在指定的治疗区域使用 CCH。在90天和180天对所有受试者进行随访,并在每个疗程后1 天、3天、6天和13天对受试者子集进行随访。在第90天和180天进行随访(即第1天之后分别为89天和179天)以评估治疗效果(摄影子研究)。除非本例中另有规定,否则205研究中使用的“天”与205研究中的初始剂量(第1天)相关。
这里使用的CCH是无菌冻干粉末,在冻干饼中含有0.9mg溶组织梭菌胶原酶、0.5mg盐酸、18.5mg蔗糖和1.1mg氨丁三醇。用于重组的CCH无菌稀释液为0.03%二水氯化钙0.6%氯化钠溶液,2.0 mL/瓶。
受试者为18岁或以上的健康未怀孕女性,在筛查访视时有两个双侧治疗区(即两个臀部或两个腿),根据临床医生报告的光数字脂肪团严重程度(CR-PCSS)量表中得分在2(轻度)或以上,以及 Hexsel脂肪团严重程度量表(CSS)得分不大于13。如果受试者表现出以下任何一种情况,则被排除在外:凝血障碍;恶性肿瘤(基底细胞癌除外)的证据或病史,除非至少5年内没有复发;瘢痕疙瘩疤痕或异常伤口愈合史;或可能干扰研究进行、混淆研究结果解释或危及受试者健康的并发疾病或状况。
受试者每疗程服用最大剂量为1.68mg CCH。每个治疗区域(即,每个臀部或每个腿)皮下注射12次剂量为0.84mg的CCH。每个受试者在三个疗程中服用CCH,每个疗程间隔至少21天。CCH的累积剂量为5.04mg(即,三次治疗访问x0.84mg/治疗区域x2个治疗区域)。
对于选择用于治疗的每个凹坑,选择注射部位。每一个注射部位都用一个手术标记物标记一个点。对于圆形凹坑,圆点放在凹坑的中心。对于细长的凹坑,圆点沿凹坑的长轴间隔约2厘米。如果凹坑需要1次以上的注射,则凹坑内的注射部位间隔约2cm,至少有一个注射部位位于凹坑的最低点(如果存在)。然后用手术标记圈出每一个选择治疗的凹坑。选定治疗区域的圆圈没有重叠。如图6 所示。
当受试者俯卧时,使用1mL注射器(梯度为0.1mL)皮下注射CCH。针头是30号和1/2英寸长。如图7所示,每次注射包括单次皮肤注射CCH,分三等分每份0.1毫升,注射到位置A、位置B和位置C(总注射量为0.3毫升)。注射深度为1/2英寸,对应于治疗针头的长度,从针头的顶端到针头的底部,不需要向下的压力。在每个注射位点,将针放置在与皮肤表面垂直的90°处并插入,然后注射0.1mL等分的CCH(位置A)。将针头稍微抽出(但不从皮肤上取下),并将其重新定位,使其与头部和凹坑长轴上方的垂直方向偏离45°,然后注射0.1mL等分的CCH(位置B)。再次轻轻抽出针头,并将针头重新放置在于皮肤表面呈约45°的角度并朝向受试者的脚部的位置,并在凹坑长轴下方,注射0.1mL等分CCH(位置C)。注射后,受试者保持俯卧5分钟。
疗效.临床医生采用CR-PCSS评分法分析CCH治疗脂肪团的疗效。从最初问诊(筛选问诊)开始第90天可以第一次观察到 CR-PCSS评分从基线开始的最大降低。脂肪团严重程度的改善(即,负变化)在第180天访视时保持不变。大多数受试者在研究开始时有轻度到中度CR-PCSS评分。在第90天,左侧臀部和左侧大腿的 CR-PCSS评分平均值从基线开始的变化分别为-0.8(0.58)和-0.6 (0.62),右侧臀部和右侧大腿的CR-PCSS评分平均值从基线的变化分别为-0.7(0.73)和-0.5(0.70)。按地区和就诊的CR-PCSS得分见表20。
表20.治疗访视时CR-PCSS得分从基线起的变化.
SD=标准偏差
69名受试者接受了双侧臀治疗,89名受试者接受了双侧腿部治疗。在第90天时有17名(13.4%)可评估受试者、在180天时观察到20名(15.3%)可评估受试者(62名接受臀部治疗的受试者,82 名接受腿部治疗的受试者)至少有一项治疗在观察到CR-PCSS评分的脂肪团严重程度从基线开始出现2级改善。在至少一个治疗区域达到最早2级反应的时间中位数为83天。对于接受左侧和右侧治疗的患者以及接受大腿治疗和臀部治疗区域的患者,在2级CR-PCSS 应答者的比例和出现2级CR-PCSS应答反应的时间中位数方面是相似的。这些结果提供在表21中。
表21.CR-CPSS评分中的2级-应答者
在第90天大约四分之三的受试者在至少一个治疗区域经历了的至少1级反应。96名(75.6%)可评估受试者在第90天时和90名 (68.7%)可评估受试者在第180天时,CR-PCSS量表评估的脂肪团严重程度与基线相比至少有一级改善。在至少1个治疗区域最早观察到1级反应的时间中位数是41天。接受左侧和右侧治疗的受试者的1级CR-PCSS应答者比例相似,并且接受臀部和腿部治疗的受试者的1级CR-PCSS应答者比例相似。左侧和右侧最早出现1级 CR-PCSS反应的时间中位数是相同,均在第43天。这些结果汇总在表22中。
表22.CR-CPSS评分中的1级应答者
受试者还使用受试者满意度得分(受试者对脂肪团治疗的满意度量表)分析CCH治疗脂肪团的疗效。在第180天,在130名可评价的应答者中,半数以上(56.1%)对治疗满意或非常满意。接受臀部治疗的受试者对治疗满意或非常满意的比例为71.5%。接受大腿治疗的受试者对治疗满意或非常满意的比例为44.6%。表23总结了这些结果。
表23.研究结束时评估受试者对CCH治疗的满意度
关于疗效的其他结论包括:
1.第180天,CR-PCSS评分从基线(筛选访视)处的下降在左侧和右侧是一致的。CR-PCSS评分平均值从基线开始的变化在左侧臀部和左侧大腿(分别为-0.8(0.58)和-0.6(0.62))以及右侧臀部和右侧大腿(分别为-0.7(0.73)和-0.5(0.70))是相似的。
2.在第90天时有17名(13.4%)可评估受试者、在180天时观察到20名(15.3%)可评估受试者至少在一个治疗区域观察到 CR-PCSS评分的脂肪团严重程度从基线开始出现2级改善。在臀部和大腿区域以及在左侧和右侧,这些反应是相似的。
3.在第90天时有96名(75.6%)可评估受试者、在180天时观察到90名(68.7%)可评估受试者至少在一个治疗区域观察到 CR-PCSS评分的脂肪团严重程度从基线开始出现1级改善。在臀部和大腿区域以及在左侧和右侧,这些反应是相似的。
4.最早在至少一个治疗区域观察到2级CR-PCSS反应的中位数时间是83天(范围:21,191)。最早在至少一个治疗区域观察到 1级CR-PCSS反应的中位数时间是41天(范围:20,205)。
5.在第180天(研究结束/治疗结束)时,超过一半的可评价应答者(56.1%)对治疗满意或非常满意(满意:48[36.9%])或非常满意:(25[19.2%])。
6.CR-PCSS评分的下降可维持至第180天,再加上受试者满意度调查的得分表明,在双侧臀部或者双侧大腿每次治疗进行12次皮下注射共计0.84mg的CCH,进行三个疗程是有效的。
安全性.大多数接受CCH治疗的受试者至少经历过一次轻度到中度的治疗紧急不良事件。受试者在接受治疗的区域出现治疗引起的不良事件没有显著差异。最常见的不良反应类型是注射部位反应,特别是注射部位瘀伤,不同治疗区域之间没有差异。
该研究还包括一项摄影子研究,在该研究期间,受试者在每个疗程后1、3、6和13天返回诊所进行摄影,以配合随访。在2个研究地点参与摄影子研究的37名受试者的大腿和臀部区域的摄影图像按地点、受试者、研究访问时间顺序排列,并累积为各自治疗区域 (左臀、右臀、左腿和右腿)的拼贴。研究人员完成了一份问卷调查,目的是在审查了图像和照片拼贴后,对注射部位瘀伤的外观进行总体观察。研究人员观察到,注射部位的瘀伤在治疗后3天和6 天是严重的,在下一次治疗之前就已经解决了,而且通常在每次治疗后都变得不那么严重。持续的变色归因于含铁血黄素染色。
按疗程对治疗相关注射部位反应的分析显示,随着后续疗程的进行,注射部位反应的发生率和持续时间呈下降趋势,大多数在21 天内消退。在第1、第2和第3疗程期间,受试者出现在21天或更短时间内解决的治疗紧急不良事件的比例分别为76.7%、85.2%和71%。
实施例2-CCH治疗EFP的3期临床研究(研究302)
进行了一项第3阶段、随机、双盲、安慰剂对照研究,其中,在第1天、第22天和第43天,在指定的治疗区域对每个臀部中或重度脂肪团的受试者施用CCH。除非本实施例中另有规定,否则本研究302中使用的“天”与研究302中的初始剂量(第1天)相关。用于脂肪团组合物的CCH是无菌冻干粉末,其包含0.92mg溶组织梭菌胶原酶、蔗糖、Tris、甘露醇和pH为8.5的盐酸qs、CCH无菌稀释液,以及0.6%氯化钠和0.03%氯化钙在水中脱水。在第1、22、43和71天对受试者进行评估。受试者为18岁或以上的健康未怀孕女性,在筛选访视时和治疗前的第一次治疗中,使用患者报告的光数字脂肪团严重程度评分(PC-PCSS)和临床医生报告的光数字脂肪团严重程度评分(CR-PCSS),得分为3或4(中度或重度)。
受试者每疗程服用最大剂量为1.68mg CCH或安慰剂。每个臀部每次皮下注射0.84毫克CCH共注射12次。每个受试者在三个疗程中服用CCH,每个疗程间隔约21天。CCH的累积剂量为5.04mg (即,三次治疗访问x0.84mg/治疗区域x2个治疗区域)。以实施例1所述和图7所示的相同方式注入CCH。受试者的两个臀部都接受CCH治疗或安慰剂治疗,这取决于他们被随机分配到哪个治疗组。
下述治疗群体处于被分析的群体中:
意向治疗(ITT)人群包括至少注射过一次研究药物的所有随机受试者。所有人口统计和特征总结均以该人群为基础。主要和关键次要疗效参数是基于这一人群。
改良意向治疗(mITT)人群包括所有具有基线及至少一次注射后受试者双侧目标臀部或者非目标臀部的CR-PCSS和PR-PCSS评估的ITT受试者。所有次要和支持性疗效评估均基于mITT人群。
临床医师在每个患者的每侧臀部选择凹坑,所述凹坑在受试者站立时明显且适合治疗。因为治疗的目的是改善整个凹坑的美学外观,临床医师被指示选择可能会改善每个整体的美学外观的凹坑。在每个治疗阶段,可以治疗臀部同一个凹坑或不同的凹坑,但注射必须在臀部之内。除非没有可治疗的皮下脂肪团凹坑且临床医师在CR-PCSS上评分为0,否则每个人都接受了所有三种治疗。如果在第二次治疗阶段没有给特定的注射,受试者仍在对侧臀部进行治疗评估,并返回第三个治疗疗程,并且每个受试者和临床医师再次评估每一个臀部。如果临床医师在CR-PCSS上的评分大于0,则在第三次治疗期间给予注射。
所有受试者在第1疗程期间每个臀部接受了所有12次注射。在第2疗程中,CCH治疗组88.1%的受试者和安慰剂治疗组94.8%的受试者每个臀部各接受了12次注射。在第3疗程中,89.0%的CCH 治疗受试者和90.6%的安慰剂治疗受试者每个臀部接受了12次注射。在两个治疗组之间和整个治疗过程中,治疗凹坑的数量和每个凹坑注射的数量相似。使用以下脂肪团严重程度评级系统分析疗效: (i)PR-PCSS;(ii)CR-PCSS;(iii)S-GAIS;(iv)i-GAIS;(v) PR-CIS;(vi)SSRS;和(vii)受试者对脂肪团治疗的总体满意度 (SSCT)。受试者、研究人员和工作人员对目标药物和治疗均不知情。评估是由受试者和研究者独立完成的,他们不知道对方的分数。主要疗效变量是在第71天定义为受试者的2级复合应答者的比例:(1)从第1天开始,由目标研究者现场评估目标臀部,在CR-PCSS 中与基线相比脂肪团的严重程度至少有2级改善;以及(2)从第1 天起,在观看目标臀部的数字图像时,受试者评估PR-PCS中脂肪团严重程度与基线(第1天)相比至少2级改善。如果受试者的随机化目标臀部符合这些标准,则该受试者被视为应答者。
在本研究中使用的应答者的定义如下:
主要终点是意向治疗(ITT)人群第71天目标臀部中2级 CR-PCSS/PR-PCSS复合应答者的比例。两级复合应答者被定义为 CR-PCSS中与基线相比严重程度至少有2级改善以及PR-PCSS中与基线相比严重程度至少2级改善的受试者。
在此研究中,与安慰剂治疗组(4[1.9%])相比,在CCH治疗组受试者(16[7.6%])中可以观察到的2级CR-PCSS/PR-PCSS复合应答者的比例存在统计学显著性偏差(p=0.006)详见表24和图24。
表24:在71天目标臀部2级复合应答者(ITT群体)
本研究共有3个终点家族,包括8个关键的次要终点。CCH和安慰剂治疗受试者之间的差异在所有8个终点都有利于CCH,并且所有差异都具有统计学意义。下文表25概述了这些情况。
每次访视时获得PR-PCSS评分,并检查从基线发生的变化。从基线的负变化表示脂肪团严重程度有所改善。在基线处,所有受试者的PR-PCSS评分为中度或重度。早在第22天,使用CCH治疗的受试者目标臀部的PR-PCSS与基线相比的平均变化(-0.4[0.67])就比使用安慰剂治疗的受试者高(0.1[0.45])。差异有统计学显著性 (p<0.001)。对于非目标臀部也获得了类似的结果。与安慰剂组相比,CCH组受试者在所有研究访视(包括第71天)中观察到的改善在目标臀部和非目标臀部方面仍具有统计学意义。这些结果汇总在表26中。
对目标和非目标臀部的PR-PCSS 1级和2级应答者的分析表明,与安慰剂相比,CCH治疗的受试者在改善方面存在统计学显著差异。目标臀部和非目标臀部,接受CCH治疗的受试者中的1级PR-PCSS 应答者比例高于安慰剂受试者,目标臀部分别为(34.8%vs.16.8%),非目标臀部为(34.8%vs.18.8%)。这些差异具有统计学意义 (p<0.001),并且在整个研究过程中持续存在,并且在每次评估时仍然具有统计学意义。这些结果总结在表27和图22-23中。
还分析了就诊时CR-PCSS评分及从基线起发生的变化。与 PR-PCSS评分一致,他们显示CCH治疗组与安慰剂组相比,脂肪团严重程度具有统计学显著性的改善。在第71天,使用CCH的受试者与服用安慰剂的受试者相比,CR-PCSS与基线相比的平均值更大。早在22日就有明显的治疗反应。在目标臀部和非目标臀部,第22 天,使用CCH的受试者中1级CR-PCSS应答者的比例大于使用安慰剂的受试者中的比例,其中,在目标臀部的比例分别为33.2%和 16.8%,在非目标臀部的比例分别为36.4%和16.8%。这些差异具有统计学意义,p<0.001。在第71天,使用CCH的受试者与服用安慰剂的受试者相比,1级CR-PCSS应答者的比例更高。结果汇总在表 28-29和图22-23中。
对S-GAIS评分进行了分析。早在第22日,使用CCH治疗的受试者与使用安慰剂治疗的受试者相比,S-GAIS的平均得分更高。这种改善有统计学意义(p<0.001)。在第71天仍观察到改善。对目标臀部和非目标臀部的S-GAIS 1级和2级应答者的分析表明,在研究过程中,CCH与安慰剂治疗的受试者在改善方面存在统计学显著差异。这些结果总结在表30-31中。使用I-GAIS评分也观察到类似的结果,总结在表32-33中。
如表34所示,在第71天,CCH治疗组受试者与安慰剂治疗组受试者的PR-CIS平均值与基线相比的变化具有统计学显著性,无论在总分(-10.9比-5.7)和缩略分(-10.9比-5.7)方便,以及个体影响分数均在统计学上显著有利。
表34.PR-CIS从基线起的变化(mITT群体).
在第5天两个治疗组的SSRS平均值与基线相比没有统计学上的显著性差异。在第71天,与安慰剂组相比,CCH组的评分更高。差异有统计学意义(p<0.001)。结果显示在35中。
表35.受试者访视自评得分(SSRS)(mITT人群)
关于SSCT评分,与安慰剂组相比,CCH组受试者中对脂肪团治疗满意或非常满意的受试者比例更高,与安慰剂组受试者相比(分别为54.3%和25.8%,p<0.001)。CCH(0.4[1.12])和安慰剂(-0.4[1.17]) 治疗组在第71天的受试者满意度得分存在统计学显著差异 (p<0.001)。如下表36所示。
表36:第71天受试者对脂肪团治疗的满意度(mITT群体)
功效总结
主要终点是ITT人群中第71天目标臀部2级CR-PCSS/PR-PCSS 复合应答者的比例。2级CR-PCSS/PR-PCSS复合应答者定义为一个受试者,其皮下脂肪团严重程度至少有2级CR-PCSS改善,并且至少有2级PR-PCSS改善。
在本研究中,CCH治疗的受试者中2级PR-PCSS/CR-PCSS复合应答者的比例(16[7.6%])与安慰剂治疗组受试者中的比例 (4[1.9%])存在统计学显著差异(p=0.006)。
为验证正交标度的药物效果,对一系列次要终点进行了评价。在所有8个主要次要终点中,接受CCH治疗的受试者与安慰剂组相比,其反应有统计学意义差异:
第71天,在目标臀部1级PR-PCSS应答者的比例(CCH治疗组114例(54.3%),安慰剂治疗组77例(36.2%),p<0.001)。
第71天,在目标臀部2级PR-PCSS应答者的比例(CCH治疗组51例(24.3%),安慰剂治疗组26例(12.2%),p=0.001)。
在第71天,在目标臀部1级CR-PCSS/PR-PCSS复合应答者在患者中的比例(CCH治疗组78例(37.1%),安慰剂治疗组38例 (17.8%),p=<0.001)。
在第71天,在目标臀部2级CR-PCSS/PR-PCSS复合应答者在患者中的比例(CCH治疗组16例(7.6%),安慰剂治疗组2例(0.9%), p=<0.001)。
第71天1级SSRS应答者的比例(CCH治疗组102例(48.6%),安慰剂治疗组28例(22.5%),p=<0.001)。
第71天PR-CIS总分与基线相比的平均变化(CCH治疗组为 -10.9[12.51],安慰剂治疗组为-5.9[11.62],p=<0.001)。
在第71天,目标臀部1级S-GAIS应答者在受试者中的比例 (CCH治疗组135例(64.3%),安慰剂治疗组82例(38.5%), p=<0.001)。
在第71天,目标臀部中2级S-GAIS应答者的比例(CCH治疗组49例(23.3%),安慰剂治疗组13例(6.1%),p=<0.001)。
所有敏感性分析都支持主要和关键次要终点的结果。在研究的第71天,CCH治疗组和安慰剂治疗组在所有支持性终点上也存在统计显著性差异(在许多情况下,统计显著性差异早在CCH单次治疗后就出现)。在严重程度评估中,与基线相比的负变化表示脂肪团改善。目标和非目标臀部的结果概述如下:
在第71天,使用CCH治疗的受试者的PR-PCSS与基线相比的平均变化大于使用安慰剂的受试者的平均变化,在目标臀部分别为 0.9[0.93]对0.5[0.88;p<0.001,在非目标臀部分别为0.9[0.90]对 0.5[0.83;p<0.001。
在第71天,使用CCH治疗的受试者中1级PR-PCSS应答者的比例高于使用安慰剂治疗的受试者中比例,在目标臀部分别为62.0%和40.7%,p<0.001在非目标臀部分别为65.2%和41.6%,p<0.001。
在第71天,使用CCH的受试者CR-PCSS中从基线起的平均变化大于使用安慰剂的受试者,在目标臀部分别为0.7[0.87]对 0.4[0.72;p<0.001,在非目标臀部分别为0.8[0.83]对0.3[0.67; p<0.001)。
在第71天,使用CCH的受试者中1级CR-PCSS应答者的比例高于使用安慰剂的受试者中的比例,在目标臀部该比例分别为58.5%和32.5%;p<0.001,在非目标臀部,该比例分别为60.7%和27.7%; p<0.001。
在第71天,使用CCH的受试者中1级CR-PCSS/PR-PCSS复合应答者的比例高于使用安慰剂的受试者中的比例,在目标臀部该比例分别为42.9%和20.1%;p<0.001,在非目标臀部,该比例分别为 44.5%和13.7%;p<0.001。
在第71天,与安慰剂治疗组相比,CCH治疗组在目标臀部的 S-GAIS平均值(SD)更大(分别为1.0[0.99]对0.5[0.79],p<0.001)。非目标臀部的结果相似(CCH治疗组的S-GAIS为1.0[0.94],安慰剂治疗组的S-GAIS为0.5[0.76],p<0.001)。
在第71天,使用CCH的受试者中,1级S-GAIS应答者的比例高于服用安慰剂的受试者中的比例,在目标臀部该比例分别为73.4%和43.2%;p<0.001,在非目标臀部,该比例分别为73.9%和42.6%; p<0.001。
第71天,与安慰剂治疗组相比,CCH治疗组在目标臀部的 I-GAIS平均值在统计学上显著(p<0.001)更高(分别为1.0[0.81] 和0.3[0.66])。非目标臀部的结果相似(CCH治疗组为0.6[0.63]和安慰剂治疗组为0.1[0.48])。
在第71天,使用CCH的受试者中,1级I-GAIS应答者的比例高于服用安慰剂的受试者中的比例,在目标臀部该比例分别为69.9%和28.3%;p<0.001在非目标臀部,该比例分别为74.9%和27.2%; p<0.001。
第71天,CCH治疗组受试者从基线开始的PR-CIS变化平均值统计学上显著的好于安慰剂治疗组的受试者,其中总分分别为12.5 分[2.63]对-6.7[12.11],p<0.001,和缩略分分别为10.9[10.72]对5.7[10.23],p<0.001,以及个人影响得分(出现脂肪团的快乐 [p<0.001]、烦人[p=0.009]、自我感觉[p<0.001]、尴尬[p=0.004]、衰老外观[p=0.024]、体形问题[p=0.005])。
在第71天,CCH治疗组的PR-CIS应答者比例高于安慰剂治疗组的总分(分别为48.4%和24.2%,p<0.001)和减缩版得分(分别为52.7%和29.5%,p<0.001)。此外,CCH治疗组受试者对每个个体影响得分的反应比例高于安慰剂治疗组受试者。这些差异也具有统计学意义。
其他支持性结果包括:
第71天,CCH治疗组(3.3[1.80])的平均值(SD)SSRS评分高于安慰剂组(2.1[1.75])。差异有统计学意义(p<0.001)。接受 CCH治疗的受试者中,1级SSRS应答者所占的比例高于安慰剂治疗组:分别为54.9%和25.1%。这种差异也具有统计学意义(p<0.001)。
接受CCH治疗的受试者对脂肪团治疗满意或非常满意的比例高于接受安慰剂治疗的受试者(分别为54.3%和25.8%,p<0.001)。 CCH(0.4[1.12])治疗组和安慰剂(0.4[1.17])治疗组在第71天的受试者满意度得分存在统计学显著性差异(p<0.001)。
一系列交叉表显示PR-PCS和S-GAIS之间的一致性。PR-PCSS 的1级变化与S-GAIS的类似变化相关。
对主要和次要终点的现场分析表明,在多个现场观察到反应,并且没有单个现场显著影响任何疗效分析的结果。
结论
这些临床结果表明,服用CCH可有效治疗受试人群的臀部脂肪团。本研究达到了主要终点,CCH治疗受试者与安慰剂治疗受试者的2级CR-PCSS/PR-PCSS复合应答者的比例在统计学上有显著差异,当给予CCH治疗受试者0.84毫克,每次间隔21天(总共1.68 毫克)时,患双侧EFP的成年妇女臀部在所有8个关键次要终点和所有支持终点中,偏向CCH治疗的受试者与安慰剂治疗的受试者的反应存在统计学显著差异。服用CCH后,没有出现重大或意外的安全问题。大多数不良事件发生在注射部位,并在14天内解决。在血液学或化学实验室参数或生命体征方面,未观察到任何临床或相关趋势。免疫原性结果没有显示出任何潜在的差异,从其他临床研究中看到这种药物。根据这项研究的结果,CCH是一种安全有效的治疗成年女性EFP的方法,剂量为0.84毫克/支(总剂量1.68毫克),间隔至少21天3个疗程。
实施例3-CCH治疗EFP的第三阶段临床研究(研究303)
进行第二项临床研究,其设计、随机性、双盲、安慰剂对照与实施例2中所述的临床研究相同。疗效得到了众多分析的证实和支持,包括在目标臀部,使用CCH治疗的受试者中观察到2级 CR-PCSS/PR-PCSS复合应答者的比例(12[5.6%])与安慰剂治疗的受试者中的比例(1[0.5%])存在统计学显著性差异(p=0.002),该差异与CCH治疗的患者脂肪团严重程度的改善相一致。
下述受试者群体处于被分析的群体:
意向治疗(ITT)群体包括至少注射过一次研究药物的所有随机受试者。所有人口统计和特征总结均以该群体为基础。主要和关键次要疗效参数也是基于这一群体。
改良意向治疗(mITT)人群包括所有ITT群体受试者,该ITT 群体有基线数据,还有至少一个在注射后对受试者的目标臀部和非目标臀部进行调查者CR PCSS和受试者PRPCSS评估的数据。所有次要和支持性疗效评估均基于mITT人群。
为了使用正交量表确定药物疗效,对一系列次要临床终点进行了评估。在反应方面,CCH治疗的受试者比给予慰剂治疗的受试者有统计学上的显著差异,包括(i)第71天目标臀部中1级PR-PCSS 应答者的比例;(ii)第71天目标臀部中2级PR-PCSS应答者的比例;(iii)第71天,在目标臀部中1级CR-PCSS/PR-PCSS复合应答者的比例;(iv)第71天,1级SSRS应答者的比例;(v)第71 天,PR-CIS总分与基线相比的变化;(vi)第71天,目标臀部1 级S-GAIS应答者比例;和(vii)第71天,目标臀部2级S-GAIS 应答者的比例。除非本实施例中另有规定,否则本研究303中使用的“天”与研究303中的初始剂量(第1天)相关。
与实施例2一样,本研究中有3个家族,包括8个关键次要终点。CCH治疗受试者和安慰剂治疗受试者之间的差异在8个终点中的7个有统计学显著性差异。对于非目标臀部中的2级 CR-PCSS/PR-PCSS复合应答者,CCH治疗组应答者的比例高于安慰剂的比例,但通过多重性检验,差异未达到统计学意义,家族I型错误率为5%。然而,非目标臀部次要终点的分析结果强烈支持一个在非目标臀部反应的差异趋势,即CCH治疗的受试者优于安慰剂治疗的受试者。这些结果汇总在下表37中。
表47.PR-CIS从基线起的变化(mITT群体).
表48.访视时受试者自己评分分值(SSRS)(mITT群体).
关于受试者对脂肪团治疗的满意程度,与使用安慰剂治疗的受试者相比,使用CCH治疗的受试者中对治疗效果满意或者非常满意的比例更大,分别为46.8%对13.6%;p<0.001。在第71天,使用 CCH治疗组和安慰剂治疗组中患者满意程度平均值(SD)出现统计学显著性差异(p<0.001),其中CCH治疗组平均值为(0.3[1.05]) 而安慰剂治疗组平均值为-0.6[1.04]。该结果总结在下表49中。
表49:第71天受试者对脂肪团治疗的满意度(mITT群体)
功效总结
主要终点是ITT人群中第71天目标臀部2级CR-PCSS/PR-PCSS 复合应答者的比例。2级CR-PCSS/PR-PCSS复合应答者定义为一个受试者,其皮下脂肪团严重程度至少有2级CR-PCSS改善,并且至少有2级PR-PCSS改善。
在本研究中,CCH治疗的受试者中2级PR-PCSS/CR-PCSS复合应答者的比例(12[5.6%])与安慰剂治疗组受试者中的比例 (1[0.5%])存在统计学显著差异(p=0.002)。
为验证正交标度的药物效果,对一系列次要终点进行了评价。在ITT群体中,接受CCH治疗的受试者与安慰剂组相比,在所有8 个主要次要终点中有7个反映出有统计学意义差异。在严重性评价中,从基线开始的负变化表明脂肪团的改善。目标臀部和非目标臀部的结果如下所述:
第71天,在目标臀部1级PR-PCSS应答者的比例(CCH治疗组124例[57.9%],安慰剂治疗组61例[29.6%],p<0.001)。
第71天,在目标臀部2级PR-PCSS应答者的比例(CCH治疗组45例[21.0%],安慰剂治疗组12例[5.8%],p=0.001)。
在第71天,在目标臀部1级CR-PCSS/PR-PCSS复合应答者在患者中的比例(CCH治疗组89例(41.6%),安慰剂治疗组23例 (11.2%),p<0.001)。
第71天1级SSRS应答者的比例(CCH治疗组30例(42.1%),安慰剂治疗组31例(15.0%),p<0.001)。
第71天PR-CIS总分与基线相比的平均变化(CCH治疗组为 -11.5[12.74],安慰剂治疗组为-6.5[11.74],p<0.001)。
在第71天,目标臀部1级S-GAIS应答者在受试者中的比例(CCH治疗组126例(58.9%),安慰剂治疗组46例(22.3%), p<0.001)。
在第71天,目标臀部中2级S-GAIS应答者的比例(CCH治疗组38例(17.8%),安慰剂治疗组9例(4.4%),p<0.001)。
对于非目标臀部的2-级CR-PCSS/PR-PCSS复合应答者,CCH 治疗组受试者中复合应答者的比例高于安慰剂治疗组的受试者比例 (分别为13[6.1%]对4[1.9%],p=0.033),但通过多重性检验,该区别并没有实现统计学显著性,家族I型错误率为5%。然而,非目标臀部次要终点的分析结果强烈支持一个在非目标臀部反应的差异趋势,即CCH治疗的受试者优于安慰剂治疗的受试者。所有敏感性分析都支持主要和关键次要终点的结果。
所有敏感性分析都支持主要和关键次要终点的结果。在研究的第71天,CCH治疗组和安慰剂治疗组在所有支持性终点上也存在统计显著性差异(在许多情况下,统计显著性差异早在CCH单次治疗后就出现)。在严重程度评估中,与基线相比的负变化表示脂肪团改善。目标和非目标臀部的结果概述如下:
在第71天,使用CCH治疗的受试者的PR-PCSS与基线相比的平均变化大于使用安慰剂的受试者的平均变化,在目标臀部分别为 0.9[0.89]对0.4[0.64];p<0.001,在非目标臀部分别为0.9[0.84]对 0.4[0.67];p<0.001)。
在第71天,使用CCH治疗的受试者中1级PR-PCSS应答者的比例高于使用安慰剂治疗的受试者中比例,在目标臀部分别为66.7%和31.9%,p<0.001在非目标臀部分别为64.5%和35.6%,p<0.001。
在第71天,使用CCH的受试者CR-PCSS中从基线起的平均变化大于使用安慰剂的受试者,在目标臀部分别为0.8[0.72]对0.2[0.55];p<0.001,在非目标臀部分别为0.8[0.89]对0.2[0.61]; p<0.001)。
在第71天,使用CCH的受试者中1级CR-PCSS应答者的比例高于使用安慰剂的受试者中的比例,在目标臀部该比例分别为65.4%和27.4%,;p<0.001,在非目标臀部,该比例分别为67.6%和28.4%; p<0.001。
在第71天,使用CCH的受试者中1级CR-PCSS/PR-PCSS复合应答者的比例高于使用安慰剂的受试者中的比例,在目标臀部该比例分别为48.1%和12.1%;p<0.001,在非目标臀部,该比例分别为 49.7%和15.3%;p<0.001。
在第71天,与安慰剂治疗组相比,CCH治疗组在目标臀部的 S-GAIS平均值(SD)更大(分别为0.9[0.92]对0.2[0.68],p<0.001)。非目标臀部的结果相似(CCH治疗组的S-GAIS为0.9[0.94],安慰剂治疗组的S-GAIS为0.2[0.67],p<0.001)。
在第71天,使用CCH的受试者中,1级I-GAIS应答者的比例高于服用安慰剂的受试者中的比例,在目标臀部该比例分别为67.7%和24.1%;p<0.001在非目标臀部,该比例分别为66.7%和26.2%; p<0.001。
第71天,与安慰剂治疗组相比,CCH治疗组在目标臀部的 I-GAIS平均值在统计学上显著(p<0.001)更高(分别为0.9[0.81] 和0.3[0.52])。非目标臀部的结果相似(CCH治疗组为0.9[0.79]和安慰剂治疗组为0.3[0.52];p<0.001)。
在第71天,使用CCH的受试者中,1级I-GAIS应答者的比例高于服用安慰剂的受试者中的比例,在目标臀部该比例分别为70.8%和24.2%;p<0.001在非目标臀部,该比例分别为70.3%和21.6%; p<0.001)。
第71天,CCH治疗组受试者从基线开始的PR-CIS变化平均值统计学上显著的好于安慰剂治疗组的受试者,其中总分分别为13.2 [12.80]对-7.0[12.05],p<0.001,和缩略分分别为12.8[12.62]对6.1 [110.25],p<0.001,所有个人影响得分在第71天也具有统计选显著性差异,(出现脂肪团的快乐[p<0.001]、自我意识[p=0.0012]、尴尬 [p<0.001]、衰老外观[p=0.009]、体形问题[p<0.001],只有在厌烦感觉上,CCH治疗的优势没有达到统计学显著性(p=0.052))。
在第71天,CCH治疗组的PR-CIS应答者比例高于安慰剂治疗组的总分(分别为50.0%和26.2%,p<0.001)和减缩版得分(分别为52.2%和29.3%,p<0.001)。此外,CCH治疗组受试者对每个个体影响得分的反应比例高于安慰剂治疗组受试者。这些差异也具有统计学意义。
其他支持性结果包括:
第71天,CCH治疗组(3.1[1.68])的平均值(SD)SSRS评分高于安慰剂组(1.9[1.55])。差异有统计学意义(p<0.001)。接受 CCH治疗的受试者中,1级SSRS应答者所占的比例高于安慰剂治疗组:分别为48.4%和16.2%。这种差异也具有统计学意义(p<0.001)。
接受CCH治疗的受试者对脂肪团治疗满意或非常满意的比例高于接受安慰剂治疗的受试者(分别为46.8%和13.6%,p<0.001)。CCH(0.3[1.05])治疗组和安慰剂(0.6[1.04])治疗组在第71天的受试者满意度得分存在统计学显著性差异(p<0.001)。
一系列交叉表显示PR-PCS和S-GAIS之间的一致性。PR-PCSS 的1级变化与S-GAIS的类似变化相关。
对主要和次要终点的现场分析表明,在多个现场观察到反应,并且没有单个现场显著影响任何疗效分析的结果。
结论
本研究达到了主要终点,当在间隔21天的时间内,对成年女性 EFP患者每个臀部给予0.84毫克(总共1.68毫克)给与3个疗程后,在CCH治疗受试者与安慰剂治疗受试者中,2级CR-PCSS/PR-PCSS 复合应答者的比例在统计学上有显著性差异。在8个关键次要终点和所有支持终点中的7个终点中,CCH治疗的受试者比接受安慰剂治疗的受试者的反应更加且该差异存在统计学显著性。
服用CCH后,没有出现重大或意外的安全问题。大多数不良事件发生在注射部位,并在14天内解决。在血液学或化学实验室参数或生命体征方面,未观察到任何临床或相关趋势。免疫原性结果没有显示出任何潜在的差异,从其他临床研究中看到这种药物。
根据这项研究的结果,CCH是一种安全有效的治疗成年女性 EFP的方法,剂量为0.84毫克/支(总剂量1.68毫克),间隔至少 21天3个疗程。
实施例4-版本-1/版本-2
上述实施例2和3报告了两种设计相同的多中心双盲、随机的,安慰剂-对照的三期研究,该研究针对患有中度到重度皮下脂肪团 (PR-PCSS和CR-PCSS评级为3-4)成年女性,在其双侧臀部,每个治疗区域接受最多3次皮下CCH 0.84mg或安慰剂治疗。
第3阶段研究对BMI或者Hexsel严重程度没有设限(入选标准)。缺乏Hexsel的入选标准与第2阶段研究设计不同。尽管存在这种差异,该研究还是达到了严格的主要终点,并通过了16个次要终点中的15个。去除脂肪团严重程度的Hexsel限制可能有助于纳入BMI较高的受试者,这增加了3期试验中的平均BMI。在第3阶段,423名患者中有210名肥胖,而在第2b阶段,94名患者中有32 名肥胖。在所有BMI组中都观察到药物的作用,并且没有以患者为中心的结果指标受到BMI或其他因素的影响。因此,胶原酶是治疗脂肪团安全有效的方法。
已完成的2b期试验的应答者目前正在进行累积延期研究,该研究着眼于5年的安全性和耐久性。此外,版本1和版本2的受试者目前正在进行累积的延期研究。对数据的其他分析显示了以下结果。
843名妇女接受了≥1次注射(CCH vs安慰剂:版本-1,n=210 vs n=213;版本-2,n=214 vs n=206)。CCH治疗的妇女中大于或者等于2级复合应答者的比例统计学显著性的高于安慰剂治疗组中的比例,在版本-1(约7.6%对约1.9%;p=0.006)和版本-2(约5.6%对约0.5%;p=0.002),并且其中大于或等于1级复合应答者的比例在统计学上显著高于安慰剂治疗组中的比例,在版本-1(约37.1%对约 17.8%;p=<0.001)和版本-2(分别为41.6%和11.2%;p<0.001)中。图8和图9显示了通过PR-PCSS和CR-PCSS测量的疗效。
下述治疗群体处于被分析的群体中:
意向治疗(ITT)人群包括至少注射过一次研究药物的所有随机受试者。所有人口统计和特征总结均以该人群为基础。主要和关键次要疗效参数是基于这一人群。
改良意向治疗(mITT)人群包括所有具有基线及至少一次注射后受试者双侧目标臀部或者非目标臀部的CR-PCSS和PR-PCSS评估的ITT受试者。所有次要和支持性疗效评估均基于mITT人群。
对于每一个设计相同的试验,样本量的估计是基于这样一个假设:在目标臀部,CCH组中≥2个水平的复合应答者的百分比≥12%,安慰剂组中≤3%(优势比≥4.4),参与者中止率约为10%。根据这些假设,每项试验需要420名妇女的样本量,按1∶1的比例随机分配到两个治疗组。这种女性分布旨在提供≥90%的力量,1型误差为 0.05,以检测主要和关键次要终点的统计显著变化。所有随机分配接受1次以上研究药物注射治疗的妇女都被纳入ITT和安全人群。使用Cochran-Mantel-Haenszel检验分析主要和主要次要疗效终点的数据,并对研究中心进行调整。以治疗组和分析中心为因素,在调整了基线值后,通过协方差分析评估PR-CIS总分中的变化至第71 天。缺乏疗效数据的妇女被认为是无应答者。采用描述性统计方法总结人口统计学、安全性和免疫原性数据。使用SAS统计软件包9.3 版或更高版本(SAS Institute Inc.,Cary,NC)进行统计分析。
根据美国食品和药物管理局(美国卫生和公众服务部,食品和药物管理局。行业指南:患者报告结果测量:用于医疗产品开发以支持标签声明。2009年12月出版。可从以下网址获得: https://www.fda.gov/downloads/drugs/guidances/ucm193282.pdf。访问日期:2019年4月23日)的指导,使用基于锚定的方法估计临床意义的变化。S-GAIS是PR-PCSS的锚。使用两项研究的汇总数据进行分析PR-PCSS检测脂肪团严重程度变化的能力。结果采用PR-PCSS(因变量)和S-GAIS(自变量)数据确定,并采用 Kruskal-Wallis单因素方差分析模型分析,以确定具有临床意义的变化阈值。
与CCH治疗脂肪团的早期研究一致,CCH在所有剂量组的第3阶段研究中耐受性良好,大多数不良事件(AE)为轻度至中度,主要局限于局部注射区域。试验中最常见的不良反应是注射部位瘀伤、注射部位疼痛、注射部位变色、注射部位结节和注射部位瘙痒。此外,版本-1和版本-2的CCH治疗组的停药率非常低,分别为4.3%和 3.7%。
在版本-1/版本-2中,平均每10名受试者中就有7人在第一次治疗后PR-PCSS得分提高1级。这些受试者的PR-CIS幸福感得分(即脂肪团外观的幸福感)也显著增加(与安慰剂相比,有统计学意义的改善,p<0.01)。在临床试验的其他方面,超过50%的受试者的PR-PCSS 评分提高了1级,超过65%的受试者使用受试者整体美学改善量表 (S-GAIS)评分“改善”或“非常改善”或“非常改善”。CR-PCSS、 PR-PCSS、I-GAIS、S-GAIS和/或PR-CIS结果与年龄、BMI或肤色无关。而且,值得注意的是,在体重/体重指数正常的女性亚群中,她们脂肪团外观的改善程度高于整个研究人群。例如,约11%的正常体重患者、约8%的超重患者和约2.5%的肥胖患者是PR-和CR-PCSS 的2级复合反应者。
图10是非目标臀部复合应答者主要终点和关键次要终点的条形图(用于数据分析),定义为在第71天的CR-PCSS和PR-PCSS测定的与基线相比严重程度改善大于等于2级或大于等于1级的患者。
第71天,与两项研究中接受安慰剂治疗的受试者相比,接受 CCH治疗的妇女在目标臀部具有统计学上显著高的≥2级CR-PCSS 和PR-PCSS复合应答者百分比(主要功效终点)(版本-1,p=0.006;版本-2,p=0.002;图8)。此外,在第71天,与安慰剂治疗组相比,接受CCH治疗的妇女在目标臀部具有统计学上显著高的≥1级复合应答者百分比(版本-1和-2均为p<.001;图8)。在两个研究中,在非目标臀部中,第71天的≥2水平和≥1水平复合应答者的百分比(图10)与两项研究中目标臀部的百分比相似。2级(图9A)和 1级(图9B)复合反应的摄影图像显示,CCH治疗后,与基线相比,治疗后患者的皮肤地形有所改善。此外,两项研究均显示,与接受安慰剂治疗的女性相比,接受CCH治疗的女性在PR-PCSS(≥1级改善)和S-GAIS评分(≥1级和≥2级改善;图11)以及PR-CIS 总分(图12)方面均有显著改善(全部p<0.001)。检测PR-PCSS 变化的能力表明,1级改善变化阈值能够代表所述改善是对女性而言有临床意义的改善,因为这种变化水平与S-GAIS作为外部锚定变量的改善评级相关。除非本实施例中另有规定,否则研究302和303 中使用的“天”与研究302和303中的初始剂量(第1天)相关。
两项研究均显示,与接受安慰剂治疗的女性相比,接受CCH治疗的女性在PR-PCSS(≥1级改善)和S-GAIS评分(≥1级和≥2 级改善;图11)以及PR-CIS总分(图12)方面有显著改善(p<0.001)。检测PR-PCSS变化的能力表明,1级改善变化阈值能够代表所述改善是对女性而言有临床意义的改善,因为这种变化水平与S-GAIS 作为外部锚定变量的改善评级相关。
胶原酶注射见效快。在第一次治疗后21天,胶原酶注射的受试者PR-PCSS平均得分就可以与安慰剂相区别,并在随后的治疗后显示出持续和显著的改善。同样,在第一次治疗后21天,胶原酶治疗的受试者CR-PCSS平均得分就与安慰剂相区别,并在随后的治疗后显示出持续和显著的改善。
通过CR-PCSS和PR-PCSS量表测量,超过11%的第三阶段被研究的患者在至少一个目标臀部具有2级复合反应。
患者和医生在光数字量表中均显示出如下反应:
第一次治疗后71天,超过三分之二的患者在任一臀部观察到至少一级PR-PCSS反应。
第一次治疗后71天,超过三分之二的患者在任一臀部观察到至少一级CR-PCSS反应。
第一次治疗后71天,超过四分之三的患者在任一臀部观察到一级CR-PCSS反应和/或一级PR-PCSS反应。
患者和医生均见证了如下全面改善:
超过四分之三的患者从第一次治疗开始71天后使用S-GAIS测定在任一臀部都有改善
超过四分之三的患者从第一次治疗开始71天后使用I-GAIS测定在任一臀部都有改善
患者对光数字及其他以患者为中心的量表的反应如下:
第一次治疗后71天,超过三分之二的患者在任一臀部是1级 PR-PCSS应答者和/或1级SSRS应答者
第一次治疗后71天,超过三分之二的患者在任一臀部是1级 PR-PCSS应答者和/或1级SSCT应答者
第一次治疗后71天,超过四分之三的患者在任一臀部是1级 PR-PCSS应答者和/或1级S-GAIS应答者
第一次治疗后71天,超过四分之三的患者在任一臀部是1级 PR-PCSS应答者和/或1级PR-CIS快乐应答者
第一次治疗后71天,超过四分之三的患者在任一臀部是1级 PR-PCSS应答者和/或1级PR-CIS焦虑应答者
第一次治疗后71天,超过四分之三的患者在任一臀部是1级 PR-PCSS应答者和/或1级PR-CIS自我意识应答者
患者报告的皮下脂肪团影响量表(PR-CIS)在如下方面显示出统计学上的改善:
对脂肪团外观的不满
厌烦
自我意识
尴尬
看起来年老
看起来超重/身材走形
CR-PCSS,PR-PCSS,I-GAIS,S-GAIS和/或PR-CIS结果与年龄、身高体重比和肤色无关。并且,显著的是,在体重正常/BMI正常的女性亚群体,其脂肪团外观的改善比整个研究群体的改善更高。
观察到1级PR-PCSS1改善的受试者(CCH)在PR-CIS快乐评分时也观察到连续的增加(与安慰剂相比,具有统计学意义)。此外,研究中的受访者发现,在第一次注射后,与安慰剂所实现的效果有明显的区别。
接受CCH治疗的受试者在治疗后脂肪团的外观与接受慰剂治疗的受试者相比在统计学上显著改善,通过试验的主要终点(版本-1, p=0.006和版本-2,p=0.002)测量显示,目标臀部在第71天的脂肪团严重程度至少有2级复合改善(图8)。此外,版本-1通过了8 个关键次要端点中的8个,版本-2通过了8个关键次要端点中的7 个。CCH在积极治疗的受试者中耐受性良好,大多数不良事件(AE) 的严重程度为轻度至中度,主要局限于局部注射区域。
在目标或非目标臀部或两者中至少为1级PR-PCSS应答者的受试者的PR-CIS快乐得分见表50。如图所示,CCH治疗能迅速改善受试者对脂肪团外观的幸福感。
表50:目标臀部或者非目标臀部或两者中至少为1级PR-PCSS 应答者的受试者的PR-CIS快乐得分
PR-CIS快乐得分0=全不,10=非常
在第71天,在目标臀部,7.6%接受CCH治疗的受试者在“研究者和患者”对脂肪团外观的综合评估中表现出非常显著的改善 (p=0.006),根据临床医生报告的-光数字脂肪团严重程度量表(CR-PCSS)和患者报告的-光数字脂肪团严重程度量表(PR-PCSS) 得分的两级反应来衡量,而在安慰剂受试者中只有1.9%。
在第71天,在目标臀部,5.6%接受CCH治疗的受试者在“研究者和患者”对脂肪团外观的综合评估中表现出非常显著的改善 (p=0.002),根据临床医生报告的-光数字脂肪团严重程度量表 (CR-PCSS)和患者报告的-光数字脂肪团严重程度量表(PR-PCSS) 得分的两级反应来衡量,而在安慰剂受试者中只有0.5%。
版本-1和版本-2的次要终点:
·在第71天,在目标臀部,根据CR-PCSS和PR-PCSS评分测定结果,在版本-1中37.1%接受CCH治疗的受试者,以及在版本-2 中41.6%接受CCH治疗的受试者在“研究者和患者”对脂肪团外观的综合评估中表现出非常显著性的1-级反应,相比而言,安慰剂受试者该百分比分别只有17.8%和11.2%。
·在第71天,在目标臀部,根据PR-PCSS评分测定结果,在版本-1中24.3%接受CCH治疗的受试者,以及在版本-2中21.0%接受 CCH治疗的受试者在患者对脂肪团外观的综合评估中表现出非常显著性的2-级反应,相比而言,安慰剂受试者该百分比分别只有12.2%和5.8%。
·在第71天,在目标臀部,根据PR-PCSS评分测定结果,在版本-1中54.3%接受CCH治疗的受试者,以及在版本-2中57.9%接受 CCH治疗的受试者在患者对目标臀部脂肪团外观评价中表现出非常具有统计学显著性的1-级改善,相比而言,安慰剂受试者该百分比分别只有36.2%和29.6%。
·在第71天,在目标臀部,根据SSRS(受试者自测量表)评分测定结果,在版本-1中48.6%接受CCH治疗的受试者,以及在版本 -2中42.1%接受CCH治疗的受试者在患者对目标臀部脂肪团外观评价中表现出非常具有统计学显著性的1-级改善,相比而言,安慰剂受试者该百分比分别只有22.5%和15.0%。
·在第71天,在目标臀部,根据受试者对脂肪团治疗满意程度评估表评估,在版本-1中54.3%接受CCH治疗的受试者,以及在版本 -2中46.8%接受CCH治疗的受试者对其脂肪团治疗表示“满意”或者“非常满意”,相比而言,安慰剂受试者该百分比分别只有25.8%和13.6%。
·在第71天,在目标臀部,根据受试者对整体外观改善量表的评估,在版本-1中73.3%接受CCH治疗的受试者,以及在版本-2中 67.8%接受CCH治疗的受试者认为其脂肪团整体外观被“改善”或者“显著改善”或者“非常显著的改善”,相比而言,安慰剂受试者该百分比分别只有43.2%和24.1%。
·在第71天,在非目标臀部,根据CR-PCSS和PR-PCSS评分 2-级改善的测定结果,在版本-1中接受CCH治疗的受试者在“研究者和患者”对脂肪团外观的综合评估中表现出统计学显著性的改善,但是在版本-2研究中没有显示出这种统计学显著性。
接受胶原酶治疗的患者在治疗后71天左右CR-PCSS和PR-PCSS 评分均比基线改善≥2分,或在治疗后71天左右CR-PCSS和PR-PCSS 评分均比基线改善≥1分。在治疗后6个月左右,这些患者的CR-PCSS 和PR-PCSS评分比基线改善≥2分,或在治疗后6个月左右,CR-PCSS 和PR-PCSS评分比基线改善≥1分,或在治疗后12个月左右CR-PCSS 和PR-PCSS评分比基线改善≥2分,或在治疗后12个月左右CR-PCSS 和PR-PCSS评分比基线改善≥1分。此外,这些患者在治疗后约22天、 43天、90天或180天的CR-PCSS和PR-PCSS评分均比治疗前提高≥2 分或≥1分。
患者在治疗后6个月左右的CR-PCSS和PR-PCSS评分均比基线改善≥3分,或在治疗后12个月左右的CR-PCSS和PR-PCSS评分均比基线改善≥3分,或在治疗后12个月左右的CR-PCSS和PR-PCSS评分均比基线改善≥3分治疗后12个月。此外,这些患者在治疗后约22天、43天、90天或180天的CR-PCSS和PR-PCSS评分均比治疗前提高≥3 分。在另一方面,胶原酶处理表现出耐久性(如本文所定义)。
患者报告的脂肪团影响量表(PR-CIS)显示,至少有一个领域具有统计学改善,这些领域选自对脂肪团外观的不满意、烦恼、自我意识、尴尬、看起来变老和看起来超重/变形。在治疗人群的目标人群中,在治疗后的两级综合改善中,应答者(非应答组)应答“应答”的百分比约为15.4%。
其他总结包括:
1.在任一臀部,超过三分之一的患者至少出现1级PR-PCSS 反应。在任一臀部,超过三分之二的患者至少出现1级PR-PCSS反应。在任一臀部,所有患者均至少出现1级PR-PCSS反应。
2.在任一臀部,超过三分之一的患者在第22天至少出现1级 PR-PCSS反应。在任一臀部,超过三分之二的患者在第22天至少出现1级PR-PCSS反应。在任一臀部,所有患者在第22天均至少出现1级PR-PCSS反应。
3.在任一臀部,超过三分之一的患者在第43天至少出现1级 PR-PCSS反应。在任一臀部,超过三分之二的患者在第43天至少出现1级PR-PCSS反应。在任一臀部,所有患者在第43天均至少出现1级PR-PCSS反应。
4.在任一臀部,超过三分之一的患者在第71天至少出现1级 PR-PCSS反应。在任一臀部,超过三分之二的患者在第71天至少出现1级PR-PCSS反应。在任一臀部,所有患者在第71天均至少出现1级PR-PCSS反应。
5.在任一臀部,超过三分之一的医生观察到至少1级CR-PCSS 反应。在任一臀部,超过三分之二的医生观察到至少1级CR-PCSS 反应。在任一臀部,所有医生均观察到至少出现1级CR-PCSS反应。
6.在任一臀部,超过三分之一的医生在第22天观察到至少1 级CR-PCSS反应。在任一臀部,超过三分之二的医生在第22天观察到至少1级CR-PCSS反应。在任一臀部,所有医生在第22天均观察到至少出现1级CR-PCSS反应。
7.在任一臀部,超过三分之一的医生在第43天观察到至少1 级CR-PCSS反应。在任一臀部,超过三分之二的医生在第43天观察到至少1级CR-PCSS反应。在任一臀部,所有医生在第43天均观察到至少出现1级CR-PCSS反应。
8.在任一臀部,超过三分之一的医生在第71天观察到至少1 级CR-PCSS反应。在任一臀部,超过三分之二的医生在第71天观察到至少1级CR-PCSS反应。在任一臀部,所有医生在第71天均观察到至少出现1级CR-PCSS反应。
9.在第71天,在任一臀部,超过四分之三的患者具有1级 CR-PCSS和/或1-级PR-PCSS反应。
10.在第71天,在任一臀部,超过四分之三的医生使用I-GAIS 观察到改善。
11.超过三分之一的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSRS应答者。超过三分之二的患者在任一臀部是1级 PR-PCSS应答者和/或1-级SSRS应答者。所有患者在任一臀部均是 1级PR-PCSS应答者和/或1-级SSRS应答者。
12.在第22天,超过三分之一的患者在任一臀部是1级 PR-PCSS应答者和/或1-级SSRS应答者。在第22天,超过三分之二的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSRS应答者。在第22天,所有患者在任一臀部均是1级PR-PCSS应答者和/ 或1-级SSRS应答者。
13.在第43天,超过三分之一的患者在任一臀部是1级 PR-PCSS应答者和/或1-级SSRS应答者。在第43天,超过三分之二的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSRS应答者。在第43天,所有患者在任一臀部均是1级PR-PCSS应答者和/ 或1-级SSRS应答者。
14.在第71天,超过三分之一的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSRS应答者。在第71天,超过三分之二的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSRS应答者。在第71天,所有患者在任一臀部均是1级PR-PCSS应答者和/ 或1-级SSRS应答者。
15.超过三分之一的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSCT应答者。超过三分之二的患者在任一臀部是1级 PR-PCSS应答者和/或1-级SSCT应答者。所有患者在任一臀部均是 1级PR-PCSS应答者和/或1-级SSCT应答者。
16.在第22天,超过三分之一的患者在任一臀部是1级 PR-PCSS应答者和/或1-级SSCT应答者。在第22天,超过三分之二的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSCT应答者。在第22天,所有患者在任一臀部均是1级PR-PCSS应答者和/ 或1-级SSCT应答者。
17.在第43天,超过三分之一的患者在任一臀部是1级 PR-PCSS应答者和/或1-级SSCT应答者。在第43天,超过三分之二的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSCT应答者。在第43天,所有患者在任一臀部均是1级PR-PCSS应答者和/ 或1-级SSCT应答者。
18.在第71天,超过三分之一的患者在任一臀部是1级 PR-PCSS应答者和/或1-级SSCT应答者。在第71天,超过三分之二的患者在任一臀部是1级PR-PCSS应答者和/或1-级SSCT应答者。在第71天,所有患者在任一臀部均是1级PR-PCSS应答者和/ 或1-级SSCT应答者。
19.超过四分之一的患者在任何一个臀部是1级PR-PCSS应答者和/或1级S-GAIS应答者。超过一半的患者在任何一个臀部是1 级PR-PCSS应答者和/或1级S-GAIS应答者。超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级S-GAIS应答者。所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级 S-GAIS应答者。
20.在第22天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级S-GAIS应答者。在第22天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级S-GAIS应答者。在第22天,超过四分之三的患者在任何一个臀部都是1级 PR-PCSS应答者和/或1级S-GAIS应答者。在第22天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级S-GAIS应答者。
21.在第43天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级S-GAIS应答者。在第43天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级S-GAIS应答者。在第43天,超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级S-GAIS应答者。在第43天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级S-GAIS应答者。
22.在第71天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级S-GAIS应答者。在第71天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级S-GAIS应答者。在第71天,超过四分之三的患者在任何一个臀部都是1级 PR-PCSS应答者和/或1级S-GAIS应答者。在第71天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级S-GAIS应答者。
23.超过四分之一的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。所有患者在任何一个臀部都是1级PR-PCSS应答者和 /或1级PR-CIS:快乐应答者。
24.在第22天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第22天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第22天,超过四分之三的患者在任何一个臀部都是 1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第22天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。
25.在第43天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第43天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第43天,超过四分之三的患者在任何一个臀部都是 1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第43天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。
26.在第71天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第71天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第71天,超过四分之三的患者在任何一个臀部都是 1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。在第71天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:快乐应答者。
27.超过四分之一的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。所有患者在任何一个臀部都是1级PR-PCSS应答者和 /或1级PR-CIS:烦躁应答者。
28.在第22天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。在第22天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级 PR-CIS:烦躁应答者。在第22天,超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。在第22天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或 1级PR-CIS:烦躁应答者。
29.在第43天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。在第43天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级 PR-CIS:烦躁应答者。在第43天,超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。在第43天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或 1级PR-CIS:烦躁应答者。
30.在第71天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。在第71天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级 PR-CIS:烦躁应答者。在第71天,超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:烦躁应答者。在第71天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或 1级PR-CIS:烦躁应答者。
31.超过四分之一的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/ 或1级PR-CIS:自我意识应答者。所有患者在任何一个臀部都是1 级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。
32.在第22天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。在第22天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级 PR-CIS:自我意识应答者。在第22天,超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。在第22天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。
33.在第43天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。在第43天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级 PR-CIS:自我意识应答者。在第43天,超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。在第43天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。
34.在第71天,超过四分之一的患者在任何一个臀部是1级 PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。在第71天,超过一半的患者在任何一个臀部是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。在第71天,超过四分之三的患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。在第71天,所有患者在任何一个臀部都是1级PR-PCSS应答者和/或1级PR-CIS:自我意识应答者。
35.当前研究中基于锚定的分析表明PR-PCSS评分变化≥1在临床上是有意义的。在两项研究中,半数以上接受CCH治疗的女性 PR-PCSS评分变化≥1(54.3%和57.9%)。超过35%的女性在PR-PCSS 和CR-PCSS中观察到复合≥1级反应,超过55%的女性观察到≥1级S-GAIS反应。
36.根据PR-CIS总分与基线相比的变化,与接受安慰剂治疗的女性相比,接受CCH治疗的妇女报道脂肪团治疗后的总体视觉和情感影响较低,即生活质量和自尊得到改善。
37.可以快速解决的不良因素是强度为轻度至中度不良事件,是研究中断的罕见原因(两项研究中女性均<5%)。
38.目前的研究包括迄今为止脂肪组织研究中最大的合并患者群体(N=843)和多中心、随机、双盲、慰剂对照研究设计。
39.广泛的研究准入标准,包括严重脂肪组织的妇女。在开始患有严重脂肪组织的妇女中,分别有>15%和>35%的CCH治疗妇女通过CR-PCSS和PR-PCSS评估,在目标臀部上有改善。如前所述,主要终点,从基线开始≥2级复合改善被认为是一个严格的标准;这是一个限制,因为这一结果在临床实践中很难实现。然而,尽管有这一严格的标准,接受CCH治疗的妇女达到主要终点的比例明显高于接受安慰剂治疗的妇女。
40.根据2个3阶段随机安慰剂-参照研究,CCH是安全的并且可以有效的治疗在臀部患有中度或者重度脂肪团的妇女。
实施例2和3的并列结果(研究302和303):
由于实施例2和实施例3中进行的分析是相同的,表51中列出了实施例2和3中主要和关键次要终点的并列结果表。
关键阶段3研究(研究-302和-303;“池1”)和随机双盲安慰剂对照研究(研究-201、-301和-302;“池2”)的汇总分析结果比较了各研究的结果。研究-202、-205和-304的结果支持疗效的持久性,研究-202的结果支持在再次暴露于CCH时缺乏耐受性(随着时间的推移对治疗剂量的反应能力的丧失)。个体研究(研究-201、 302和-303)的主要疗效分析结果显示,第1组和第2组的综合结果表明,根据临床医生(研究者)和患者(受试者)的综合评分,CCH 治疗组比安慰剂治疗组更容易观察到脂肪团严重程度的减轻。
主要和关键次要疗效终点(池1-ITT人群)的比较结果见表52。
表52:主要和关键次要疗效终点(池1-ITT人群)的多重比较结果
注:每一栏百分比是以N的数字为基础的。
下表53-61提供了相关临床数据。
表53:第71天目标臀部患者/调查者复合应答者(池1-ITT群体)
表54:第71天目标臀部患者PR-PCSS应答者(池1-ITT群体)
表55:访视时目标臀部PR-PCSS评分及从基线起的变化(池-ITT 群体)
注:任何时间点缺失的PR-PCSS评级均不属于估算范围,因此不包括在该总结中。
表56:第71天1级SSRS应答者(池1-ITT群体)
表57:PR-CIS总分从基线起的变化
表58:第71天目标臀部S-GAIS应答者(池1-ITT群体)
表59:第71天目标臀部CR-PCSS应答者(池1-ITT群体)
表60:访问时目标臀部CR-PCSS评分从基线起的变化(池1-ITT 群体)
表61:第71天的SSCTA(池1-ITT群体)
注意:在任一时间点没有检测到受试者对脂肪团治疗满意程度分值的均被删除,因此没有被包括在该总结中。
两项多中心、随机、双盲、安慰剂对照关键研究的结果表明,与安慰剂相比,CCH显著降低皮下脂肪团的严重性,根据第71天上2级复合反应者的比例来评价。在关键的第3阶段研究中,早在第一次治疗后21天,就在CR-PCSS和PR-PCSS评分中观察到CCH 治疗与安慰剂治疗的区别。
亚组分析表明,年龄、民族、种族、BMI、Fitzpatrick皮肤类型、脂肪团家族史、脂肪团严重程度基线或免疫原性状态对疗效无明显影响。为了进一步评估CCH对≥65岁年龄组和≥30kg/m2体重指数组的影响,进行了补充性事后分析。所选的事后分析是关键研究中的关键次要终点,包括目标研究中的1级复合反应、非目标研究中的2级复合反应以及2级和1级PR PCSS反应者分析。基于这一分析,所有的证据都支持在所有亚组中,与安慰剂治疗相比,CCH的疗效更为有效。
CCH和安慰剂治疗组在所有关键次要终点的两个汇总分析中均观察到统计学上的显著差异。包括:目标臀部1级PR-PCSS应答者比例、目标臀部2级PR-PCSS应答者比例、目标臀部1级复合应答者比例、非目标臀部2级复合应答者比例、1级SSRS应答者比例, PR-CIS总分从基线(第1天)起变化,目标臀部的1级S-GAIS应答者,目标臀部的2级S-GAIS应答者。
这些关键的次要终点包括评估患者报告的对受试者相关且具有临床意义的治疗益处的影响措施的量表。PR-CIS评估脂肪团对视觉和情绪的影响,SSRS评估对脂肪团外观的满意度,S-GAIS评估视觉外观。总的来说,与安慰剂治疗组相比,CCH治疗组患者报告的满意度和情绪影响指标有更大的改善,且具有统计学意义。脂肪团的严重程度早在每个治疗区域服用0.84毫克CCH的第一个疗程后 21天就明显减轻,并在71天的双盲研究期间持续。研究304的结果显示,在完成主要研究后,PR-PCSS和CR-PCSS的耐久性(持续效应)长达6个月。
实施例5-3B期,开放标签,长期研究,评估CCH治疗脂肪团的安全性和反应时间模式(研究304)
这是一项多中心、开放性、长期随访研究,如上述实施例2和实施例3所述。本研究在71天双盲、安慰剂对照研究(实施例2(研究302)或实施例3(研究303),以下简称“家长研究”或“主要研究”)中,对先前接受每个臀部CCH 0.84毫克/次(总剂量高达 1.68毫克×3个疗程)治疗的成年女性双侧EFP患者进行了评估研究。在完成上述一项研究后,受试者从主要研究的第71天(即首次治疗后70天)开始(并将被跟踪)长达5年,这大约是在这些研究中最后一次接触CCH后28天。
除非本实施例中另有规定,否则研究304中使用的“天”与研究302或303中初始剂量(第1天)的第71天相对。在本研究的第 180天进行脂肪团评估,即在实施例2和3中报告的第71天之后大约180天,以及受试者首次用CCH治疗后大约251天。因此,就本实施例而言,“第180天”是在实施例2和3的第71天之后大约180 天。本实施例5的第180天评估是以盲法进行的,因为受试者、研究人员和现场人员对第3阶段研究中接受的治疗是盲法的,直到评估完成。
本研究的主要目的是评估(a)CCH用于治疗成年女性EFP的脂肪团的长期安全性;(b)CCH用于治疗成年女性EFP的再治疗时的安全性;以及(c)CCH在治疗成年女性EFP后的长期免疫原性概况。本研究的第二个目的是评估用CCH治疗的EFP成年妇女的反应减少时间(TRR),例如治疗的持久性。这项研究目前正在进行中。此实施例表示截至2019年4月1日(含)收集的数据。其中包括479名受试者,他们在该日期之前至少完成了180天的评估访问。
在完成实施例2和3研究的755名受试者(CCH治疗和安慰剂治疗)中,617名受试者(CCH治疗和安慰剂治疗)进入本开放标签的扩展研究。一旦这些受试者在本研究的第180天被揭盲,之后只有接受积极CCH的受试者留在本研究中。
研究设计如图25所示。完成第180天评估后(即实施例2和3 的第71天后180天),在主要研究中对每个接受研究治疗的受试者揭盲(在主要研究的第71天后大约6个月,以及在主要研究中第一次服用CCH后大约251天),在这些研究中接受安慰剂治疗的受试者被撤回,不再继续研究。随后,接受CCH的受试者被分为以下3 类中的1类:
·第I类(1-级复合应答者)包括在主要研究中接受CCH治疗的受试者,其中在主要研究中的任一(或两者)最大复合反应是经 PR-PCSS和CR PCSS评估的脂肪团严重程度的至少有1级复合改善的受试者。如果两个臀部都有改善,则1级的复合改善必须发生在同一个臀部才有资格(即PR-PCSS和CR-PCSS改善必须发生在同一个臀部)。在一个量表中表现出2级改善但在另一个量表中仅表现出1级改善的受试者也被视为第I类受试者,前提是复合改善在相同的臀部范围内。在本开放标签研究中,第I类受试者最多可接受在最多2侧臀部2个疗程的1个额外再治疗疗程(即间隔约21天的3个疗程)。在完成第180天的评估后,以及在对主要研究期间的受试者揭盲之后开始再治疗。如果对主要研究中使用的研究药物已经揭盲,则可能已在第180天访视时开始筛选复治。只有复合1 级或更低级别改善的臀部将在第I类受试者中被在此治疗。在本公开标签研究的治疗访问4(第71天+5天)之前,将确定开始复治疗后开放标签疗效的评估(治疗访问1,治疗第1天),然后观察受试者,具体时间取决于接受复治疗的受试者在5年内的时间,在主要研究302和303的第71天之后,每6个月进行2年,然后每年进行一次直至第5年(第1800天)。符合I类资格的受试者选择不接受额外的复治治疗,将进行观察访问(第2至7次访视,即12、18、 24、36、48和60个月)。
·第II类(2级复合应答者)包括在主要研究中接受CCH治疗的受试者并且该受试者在主要研究的第71天即在至少一个臀部实现脂肪团严重程度的PR-PCSS和CR-PCSS至少2级复合改善(即2 级复合应答者)。然后从主要研究的第71天开始,大约每6个月对这些受试者进行一次TRR(定义见下文)和安全性观察,持续2年,然后每年进行观察持续直到第5年(第1800天)。第II类受试者必须比主要研究中的第71天至少减少1级复合反应,并且与主要研究中的第1天相比,在其中一个或两个臀部上不再保持2级复合反应,才有资格再治疗,之后他们将参与观察访问。
·第III类(非复合应答者)包括在主要研究中接受活性CCH治疗但不符合第I类或第II类标准的所有其他受试者。这些受试者每 6个月观察一次安全性,持续2年,每年观察一次,持续5年(第 1800天),在研究期间不符合再治疗的条件。
符合再治疗条件的I类受试者和II类受试者将在3次再治疗访视中接受研究药物,除非该患者没有可治疗的EFP凹坑,研究者在治疗访视1、治疗访视2和/或治疗访视3期间,调查者对臀部 CR-PCSS评分为0。每次再治疗访视期间,受试者以持续的、标准放松的姿态站立(与本文其他部分的描述一致)时标记凹坑和注射部位,在此之前和之后拍摄待治疗臀部的照片。
治疗区域定义为合格臀部。受试者在180天之后才有资格在任一臀部或者两侧臀部接受治疗。所有脂肪团评估将在每个单独的治疗区域进行。治疗区域将单独评估。每个臀部内选择的凹坑应清晰,当受试者以一致的放松姿势站立时明显,适合治疗。在指定的治疗访视中,可以对臀部内的相同凹坑或臀部内的不同凹坑进行再治疗,但在所有治疗访视中,注射必须全部在臀部内(例如,每个臀部12 次注射)。
如果在治疗访视时(例如,治疗访视,例如,治疗访视2)没有注射特定的臀部(右/左),那么如果在治疗访视1期间治疗了臀部,受试者仍将在该访视时(治疗访视2)接受对侧臀部的再治疗评估。当受试者返回第3次治疗访视时,受试者(使用PR-PCSS)和研究者(使用CR-PCSS)将再次对每个臀部进行评估。如果研究者使用CR-PCSS对符合条件的臀部(s)中的脂肪团严重程度评分大于0,则将给予注射。
参与本研究观察阶段的I类和II类受试者将在第12、18、24、 36、48和60个月的观察访视期间完成脂肪团评估。在这些观察访视中,如果评级表明受试者有资格再治疗,并且受试者之前在本研究 304(实施例5)中没有接受CCH治疗,则受试者将为合格的受试者提供1个再治疗疗程。
符合条件的I类和II类受试者的再治疗疗程包括3个间隔21天的再治疗疗程,除非臀部没有可治疗的EFP凹坑,即研究者在治疗访视1、2和/或治疗访视3时对CR-PCSS评分为0。每次再治疗包括12次CCH注射(每次0.07mg/0.3mL),剂量为0.84mg,体积为3.6mL(与双盲研究中的治疗过程相同),在每个合格的臀部直至双侧臀部。在这项为期5年的研究中,为符合条件的I类和II类受试者同时提供最多2个符合条件的再治疗疗程。开始再治疗后(治疗访视1;治疗第1天),受试者在再治疗期间的每一天进行注射安全性评估,并在治疗访视2(第22天)、治疗访视3(第43天)和治疗访视4(第71天)进行安全性和脂肪团严重性评估。再治疗后,将观察这些受试者,这取决于受试者在5年期间接受再治疗的时间,连续2年每6个月观察一次,然后在主要研究(实施例2和实施例3) 后每年观察持续5年(1800天)。
出于研究目的,反应减少(即反应减少或失去反应)被定义为在主要研究中,PR-PCSS和CR-PCSS观察到的脂肪团严重程度改善的1级复合恶化。TRR被定义为从评估疗效(主要研究中的第71 天)到在本研究中观察到PR-PCSS和CR-PCSS复合1级反应丧失的研究访视之间的时间。在首次检测到复合反应降低后大约2周的随访研究中,确定反应降低和/或完全丧失反应。
数码照片不是直接的疗效测量法;但是,数码照片用于某些疗效测量的评估。如上所述,使用数码相机在两个臀部的每个在如下时间点按照之前描述标准的访视对每个臀部拍照:
·在第180天,对每个受试者进行筛选以及确认访视(无凹陷或注射部位标记)。
·在I类和/或合格II类受试者治疗访视(第1天、第22天和第43天)期间标记凹坑和注射部位(注射前)前后。
·在第71天访视(治疗结束/提前终止)、观察评估访视(第 360、540、720、1080、1440和1800天/研究结束(“EOS”))和确认访视(无凹坑或注射部位标记);
在第180天访视之后并对双盲主要实验揭盲之后,仅对第I类和II类受试者拍照。
多达843名在主要研究中接受研究药物的受试者可以参与本研究。共有617名受试者完成了主要研究并同意参与本研究。其中130 人未达到入选标准,撤回同意或在第180天访问之前失去后续行动。此外,4名受试者参加了180天的访问,但在揭盲前退出研究,4名受试者在中期数据截止时(2019年4月1日)未被揭盲。因此,共有479名受试者完成了第180天的访问,并在数据截至时进行了揭盲。
在这479名受试者中,238名受试者在主要研究中接受了安慰剂治疗,完成了第180天的访视,然后退出进一步参与本研究。因此, 241名在主要研究中接受CCH治疗的受试者和完成本研究中的第 180天访视的受试者有资格继续。在241名符合条件的受试者中,有198人在数据截止日期(2019年4月1日)同意参与研究的开放标签阶段。其中,30名受试者符合条件,并选择在数据截止前接受CCH 再治疗,见表62和63。
表62:参与本研究的受试者总结.
表63:“反应减少时间(TRR)人群”参与本研究的总结.
用于脂肪团的CCH是无菌冻干粉末,包含0.92mg溶组织梭菌胶原酶,如上所述。有资格参加本研究的受试者每疗程给予0.84毫克CCH或每疗程给予1.68毫克CCH(每疗程总剂量为1.68毫克),每疗程间隔21天进行3次皮下注射12次(表64)。
表64:再治疗研究(仅限符合条件的I类和II类受试者)
当受试者处于俯卧位时,使用带有30号1/2英寸针头的注射器将研究药物注射到皮下。如图7所示,每个注射部位将接受单次皮肤注射研究药物,将其分为三份0.1-mL的等分注射到A、B和C位置 (总注射体积为0.3mL)。注射深度相当于治疗针的长度(0.5英寸),从针尖到针头的中心或底部,不施加向下的压力。
在每次再治疗访视期间,每个臀部准备4支注射器进行给药。每支注射器含有0.9毫升研究药物(即每支注射器注射3次)。在每次治疗访视期间接受再治疗的每个合格患者体内,注射12次,每次0.3毫升。在本研究中,符合再治疗条件的受试者每次治疗访视每个臀部给予最大剂量为0.84毫克的CCH,在间隔21天的3次治疗访视中,每个臀部给予12次皮下注射。
使用CR-PCSS和PR-PCSS、患者报告的脂肪团影响量表 (PR-CIS)、受试者整体美学改善量表(S-GAIS)、受试者自我评定量表(SSRS)和受试者对脂肪团治疗评估的满意度来评估疗效。
安全终点包括副作用(AEs)、生命体征、体检、实验室检查和免疫原性。
使用以下分析群体:
·第180天观察人群包括所有来自主要研究的受试者
·开放标签观察人群包括进入开放标签研究并在主要研究中接受CCH的所有受试者。该人群包括所有I、II和III类受试者
·再治疗前TRR群体包括所有在主要研究中第71天任一或者两侧被治疗的臀部CR-PCSS和PR-PCSS评分至少改善1级或2级的受试者。该群体包括I类和II类受试者。对于在主要研究期间在每个被治疗的臀部CR-PCSS和PR-PCSS评分至少有1级和2级改善的受试者,在每个治疗组中分别评估反应降低的程度。使用该人群分析再治疗前反应的减少。
·开放标记的再治疗(OLR)群体包括所有TRR群体中再次开放标记研究中被治疗的受试者。
·再治疗后TRR人群包括OLR人群中的所有受试者,这些受试者在第71天/开放标签治疗阶段的治疗访视门诊就诊结束时, CR-PCSS和PR-PCSS评分至少有1级或2级复合改善。对于在每个治疗组的每个被治疗的臀部开放标签治疗阶段CR-PCSS和PR-PCSS 评分至少有1级和2级复合改善的受试者,分别评估反应减少程度。使用该人群分析再治疗后反应的减少。
本研究中使用的反应定义如下所示:
再治疗前和再治疗后分别评估反应减少程度。表65概述了本研究中减少反应的定义。
表65:反应的减少
表66:减少反应的时间
·
·
·
·
·
·
·
·对于PR-CIS总分,PR-CIS应答者被定义为在评估时间点, PR-CIS总分与基线相比减少至少12分(即每个项目至少平均2分) 的受试者。
·对于PR-CIS缩略分,PR-CIS应答者被定义为在评估时间点, PR-CIS总分与基线相比减少至少10分(即每个项目至少平均2分) 的受试者。
·每个项目的PR-CIS应答者被定义为在评估时间点,PR-CIS项目得分从开放标签阶段的第71天得分至少减少2的受试者。
·PR-CIS提问中的第1项——“受试者对脂肪团的出现有多高兴”通过从10中减去受试者报告的评估来计算(即,为了综合的目的,“高兴”问题的得分被逆转(反映),使其与其他问题在方向上一致)。这样,6个PR-CIS问题的数量越多,反映的负面影响就越大。
功效结果
A.功效分析-第180天观察群体
1.脂肪团严重性
a.PR-PCSS和CR-PCSS
表67概述了在第180天观察人群中,从主要研究的第1天到主要研究的第71天到本研究的第180天(主要研究的第71天之后的180天,或主要研究中第一剂研究药物之后的大约251天)PR-PCSS 和CR-PCSS的变化。
表67:脂肪团严重程度评分从主要研究第1天的到第180天就诊时的变化(第180天观察人群,定义见本研究304)
在主要研究中接受CCH治疗并完成本研究中脂肪团严重程度的第180天评估的241名受试者中,在主要研究中从第1天到第71 天的PR-PCSS平均值的变化为左臀-0.8(0.85),右臀为-0.9(0.92)。在这些相同的受试者中,从主要研究的第1天到本研究的第180天, PR-PCSS的平均变化为左臀-0.7(0.87),右臀-0.7(0.92)。
在主要研究中,从第1天到第71天,左臀部(SD)CR-PCSS 的平均变化为-0.8(0.79),右臀部为-0.7(0.76)。从主要研究的第 1天到本研究的第180天,CR-PCSS的变化(SD)为左臀-0.6(0.83),右臀-0.6(0.83)。
在主要研究中,238名接受安慰剂治疗的受试者从第1天到第 71天的PR-PCSS的变化平均值(SD)在左侧臀部和右侧臀部分别为-0.5(0.75)和-0.5(0.79)。从主要研究的第1天到本研究的第 180天,在PR-PCSS中,左侧臀部PR-PCSS为-0.3(0.71)和右侧臀部PR-PCSS-0.4(0.80)。
在安慰剂治疗的受试者中,从第1天到第71天,CR-PCSS的平均(SD)变化在左侧臀部和右侧臀部分别为-0.3(0.64)和-0.3(0.70)。从主要研究的第1天到本研究的第180天,CR-PCSS的平均变化为左臀为-0.4(0.72)在右臀为-0.4(0.72)。
从第一天到第71天(在主要研究中)以及从第1天到第180天 (在本研究中),CR-PCSS和PR-PCSS的平均值变化表明,观察人群中的受试者是主要研究人群的代表。CCH治疗受试者和安慰剂治疗受试者在第180天的差异与主要研究中的结果一致。
b.PR-CIS
表68概述了从主要研究的第1天到主要研究的第71天和本研究第180天观察人群的PR-CIS变化。
表68:从父母研究第一天起到第180天/提前终止访视,PR-CIS 总分、简略分和项目得分变化(第180天观察人群,定义见本研究 304)
在主要研究中接受CCH治疗并完成本研究中PR-CIS评估的受试者中,PR-CIS总分从主要研究第1天到第71天的变化为-11.8 (11.77)。在这些受试者中,从主要研究的第1天到本研究的第180 天,PR-CIS总分的变化(SD)为-10.5(11.76)。
在主要研究中接受安慰剂的受试者中,PR-CIS总分从主要研究第1天到第71天的变化为-6.5(12.12)。在这些受试者中,从主要研究的第1天到本研究的第180天,PR-CIS总分的变化平均值(SD) 为-5.4(11.30)。
对于PR-CIS减缩版分数,对于接受CCH治疗的患者在主要研究中从第1天到第71天的PR-CIS减缩版分数变化为-10.3(9.95),而在主要研究中从第1天到第180天的变化为-9.3(9.88)。在接受安慰剂治疗的受试者中,在主要研究中从第1天到第71天PR-CIS减缩版分数变化为-5.7(10.30),从主要研究中的第1天到本研究中的第180天的PR-CIS减缩版分数变化为-5.2(9.90)。
当检查PR-CIS中每个单独项目的反应变化时,也看到了类似的结果。
从第1天到第71天(在主要研究中)以及从第1天到第180天(在本研究中),PR-CIS总分、缩写和项目分数的变化也表明观察人群中的受试者是主要研究人群的代表。CCH治疗受试者和安慰剂治疗受试者在第180天的差异与主要研究中的结果一致。
2.治疗效果的持久性
a.PR-PCSS和CR-PCSS在第180天观察群体
表69概述了在第180天观察群体中,从主要研究的第71天到本研究的第180天PR-PCSS和CR-PCSS的变化。
表69:从主要研究第71天/EOS到第180天/早期终止访视(第 180天观察群体,如研究304中的定义)PR-PCSS和CR-PCSS的变化
对于PR-PCSS,从主要研究第71天到本研究180天接受CCH 治疗受试者的变化平均值(SD)为左臀0.2(0.81),右臀0.2(0.86)。在接受安慰剂治疗的受试者中,PR-PCSS的变化平均值在左侧臀部和右侧臀部分别为0.1(0.76)和0.0(0.84)。
对于CR-PCSS,从主要研究的第71天到本研究第180天,接受 CCH治疗的受试者的变化平均值在左侧臀部为0.2(0.78),右侧臀部为0.1(0.76)。在接受安慰剂治疗的受试者中,CR-PCSS上的变化平均值在左侧和右侧臀部分别为-0.1(0.74)和-0.1(0.76)。
第71天和第180天之间PR-PCSS和CR-PCSS的微小差异表明,在主要研究中接受CCH治疗的受试者中,治疗效果持续到第71天之后6个月。这些结果还表明,左、右臀治疗效果基本相同。
b.PR-CIS第180天观察群体
表70概括了从主要研究第71天起到本研究第180天,第180 天观察群体中PR-CIS总分、简略分和项目得分变化。
表70:从主要研究第一天起到第180天/提前终止访视,PR-CIS 总分、简略分和项目得分变化(第180天观察人群,定义见本研究 304)
在第180天观察人群中,从主要研究第71天到本研究第180天的CCH治疗组的PR-CIS总分变化平均值为1.2(11.32)并且安慰剂治疗组的PR-CIS总分变化平均值为1.0(10.14)。对于PR-CIS 简略评分,CCH和安慰剂治疗受试者从主要研究的第71天到本研究的第180天的变化平均值分别为1.0(9.45)和0.4(8.98)。在单项得分中也出现了类似的小变化(脂肪团的出现的幸福感: CCH0.5[2.68]、安慰剂0.1[2.88];烦恼:CCH0.0[3.55]、安慰剂 0.0[3.78];自我意识:CCH0.1[2.63]、安慰剂-0.1[2.92];尴尬:CCH0.1[2.62]、安慰剂0.1[2.27];衰老外观:CCH 0.3[2.92],安慰剂 0.6[2.42];体型关注:CCH 0.3[2.59],安慰剂0.4[2.56])。
第71天和第180天之间PR-CIS总分、缩略分和各项得分的微小差异表明,在主要研究中接受CCH治疗的受试者中,治疗效果持续到第71天之后6个月。另外,PR-CIS应答者的比例从第71天到第180天维持不变。
c.受试者自评价量表第180天观察群体
在主要研究的第71天中,24.7%在主要研究中接受CCH治疗的受试者为2级SSRS应答者,而在观察人群中接受安慰剂治疗的受试者为11.4%。在第180天,在主要研究中接受CCH治疗的受试者中,14.9%的受试者为2级SSRS应答者,而接受安慰剂治疗的受试者为8.9%。
在主要研究的第71天中,51.5%在主要研究中接受CCH治疗的受试者为1级SSRS应答者,而在180天观察人群中接受安慰剂治疗的受试者为21.2%。在第180天,在主要研究中接受CCH治疗的受试者中,36.9%的受试者为1级SSRS应答者,而接受安慰剂治疗的受试者为17.3%(表71)。
这些结果表明,随着时间的推移,CCH治疗组和安慰剂治疗组的SSRS应答者的比例均降低。然而,CCH治疗受试者和安慰剂治疗受试者之间SSRS应答者的差异在第180天与在主要研究的第71 天观察到的差异相似。
表71:受试者自评量表应答者和个体评分达到180天/提前终止访视的受试者人数(研究304中定义的180天观察人群)
B.功效分析-再治疗前TRR群体
再治疗前TRR人群由103名接受CCH治疗的受试者组成,这些受试者在主要研究中CR-PCSS和PR-PCSS的综合反应为1级或2 级,并且同意继续当前研究的开放标签阶段。其中19名受试者被归类为II类,84名被归类为I类。
1. 2级-反应减少-CR-PCSS和PR-PCSS
在这项研究中,有19名受试者的脂肪团严重程度至少有2级的复合改善,在主要研究中至少有1级(II类)。没有一个受试者的脂肪团严重程度在第180天时有2级复合降低。当单独考虑II类受试者的CR-PCSS和PR-PCSS时,1名(5.3%)受试者的CR-PCSS 应答至少降低2级,4名(21.1%)受试者的PR-PCSS应答至少降低 2级,如本研究304所定义(表72)。
表72:再治疗前(再治疗前群体TRR),脂肪团严重性评分反应降低至少2个水平的受试者数量
当单独考虑各个臀部时可以观察到类似的结果。在上述19名II 类受试者中,有26名受试者在主要研究中的脂肪团复合改善至少为2级。在第180天有1位(3.8%)患者中至少有2水平复合降低(3.8%)。此外,在第180天在4例(15.4%)患者中,臀部CR-PCSS至少降低2个水平,在5例(19.2%)患者中,臀部PR-PCSS至少降低2 个水平。
2. 1级反应降低-CR-PCSS和PR-PCSS
再治疗前TRR人群中有19名II类受试者。其中,3例(15.8%) 在再治疗前有1级复合降低反应。再治疗前TRR人群中84名I类受试者中,10名(11.9%)在再治疗前有1级综合反应降低。总的来说(I类和II类共103名受试者),13名(12.6%)受试者在180 天时的综合反应降低了1级(表73)。
表74表示再治疗前脂肪团严重程度分级反应降低1级的臀部数(再治疗前TRR人群)。
当单独考虑臀部时,观察到类似的结果。在上述19名II类受试者中,有26名受试者在主要研究中至少有2级复合反应。其中,6 名受试者(23.1%)出现1级复合反应降低。在I类受试者中,132 名受试者中有19名(14.4%)出现1级复合反应降低。总体而言(I 类和II类,158名受试者臀部),15.8%的受试者臀部在180天出现 1级复合反应降低。
3.反应减少时间-CR-PCSS和PR-PCSS
TRR被定义为从主要研究中的第71天/EOS到当前试验中首次观察到CR-PCSS和PR-PCSS反应复合恶化的研究访视的天数。没有受试者的反应降低2级,因此无法计算反应降低2级的时间。I 类受试者1级反应减少的标准差(SD)时间为187.5(10.87)天, II类受试者为182.7(17.47)天。
4.完全无反应-CR-PCSS和PR-PCSS
完全无反应被定义为在CR-PCSS和PR-PCSS评分中恢复到基线程度(主要研究)。第二类受试者(在主要研究中至少有2级复合反应的受试者)在第180天时没有完全失去反应。在84名I类受试者中,有4名(4.8%)完全失去反应(表75)。
表75:再治疗前完全失去反应的受试者人数(再治疗前TRR人群)
5.在再治疗前完全无反应的时间-CR-PCSS和PR PCSS
完全丧失反应的时间定义为从主要研究中的第71天/EOS到当前试验的研究访视中首次观察到完全丧失反应的天数。第II类受试者没有完全失去反应。第I类反应完全丧失反应的时间为183.0 (2.83)天。
6.皮下脂肪团严重性-再治疗群体TRR
a.PR-PCSS和CR-PCSS
总体而言(在第I类和第II类受试者的合并中),主要研究中从第1天到第71天/EOS的平均值(SD)PR-PCSS变化在左侧臀部为-1.3(0.64),在右侧臀部为1.4(0.83)。在TRR再治疗前人群中,从主要研究的第1天到第180天,PR-PCSS的总体变化(SD) 为左侧1.0(0.80),右侧1.1(0.93)。
对于I类受试者,主要研究中的平均值(SD)PR-PCSS从第1 天到第71天的变化在左侧臀部和右侧臀部分别为-1.2(0.60)和-1.2 (0.80)。从主要研究的第1天到本研究的第180天,左、右侧臀部的平均值(SD)PR-PCSS变化分别为-1.0(0.77)和1.1(0.96)。
对于II类受试者,主要研究中的平均值(SD)PR-PCSS从第1 天到第71天的变化在左侧和右侧分别为-1.7(0.65)和-2.1(0.62)。从父母研究的第1天到本研究的第180天,左、右臀的平均值(SD) PR-PCSS变化分别为-1.1(0.94)和1.2(0.79)。
在主要研究中,从第1天到第71天/EOS的CR-PCSS总体变化 (I类和II类受试者合并)为左侧臀部1.2(0.57),右侧臀部为1.1 (0.63)。从主要研究的第1天到第180天,CR-PCSS的总体变化 (SD)为在左侧臀部-0.8(0.78),右侧臀部为0.9(0.78)。
对于I类受试者,主要研究中从第1天到第71天的CR-PCSS 变化在左侧臀部和右侧臀部分别为-1.1(0.46)和-0.9(0.54)。从主要研究的第1天到本研究的第180天,左侧和右侧臀部的CR-PCSS 变化分别为-0.7(0.74)和0.9(0.78)。
对于II类受试者,主要研究中PR-PCSS评分的平均值(SD)从第1天到第71天的变化在左臀和右臀分别为-1.8(0.63)和-1.8(0.37)。从主要研究的第1天到本研究的第180天,左、右臀的PR-PCSS评分的变化平均值(SD)分别为-1.2(0.85)和1.2(0.76)。
这些结果说明在这些群体中体现持续的反应。
b.PR-CIS
PR-CIS总分、缩略分和项目得分也有类似的结果,并支持该人群中反应的持续性。
7.治疗效果的持续性
a.治疗效果的持续性-CR-PCSS和PR-PCSS-再治疗前的群体 TRR
表76显示了从主要研究(研究302/303)中的第71天到本研究中的第180天TRR再治疗前人群CR-PCSS和PR-PCSS的变化。
在第I类受试者中,从主要研究中的第71天到本研究中的第 180天PR-PCSS评分变化平均值(SD)在左侧臀部为0.2(0.68),在右侧臀部为0.2(0.84)。对于CR-PCSS,从父母研究中的第 71天到本研究中的第180天,评分变化的平均值分别为左侧臀部 0.4(0.72)和右侧臀部0.1(0.77)。
在第II类受试者中,从主要研究中的第71天到本研究中的第180天PR-PCSS评分变化平均值(SD)在左侧臀部为0.6(0.83),在右侧臀部为0.8(0.76)。对于CR-PCSS,从父母研究中的第 71天到本研究中的第180天,评分变化的平均值分别为左侧臀部 0.6(1.02)和右侧臀部0.7(0.75)。
在全体TRR人群中,主要研究中的平均值(SD)PR-PCSS 从第71天变为本研究中的第180天,分别为0.3(0.72)和0.3 (0.87)。对于CR-PCSS,父母研究中的平均值(SD)从第71天变化到本研究中的第180天,在左侧臀部中为0.4(0.79),在右侧臀部中为0.2(0.80)。
在接受CCH治疗的受试者的主要研究中,第71天和第180 天之间的总体TRR人群PR-PCSS和CR-PCSS分数的微小差异表明治疗效果持续到第71天的至少6个月后。这些结果还表明,左侧和右侧的平均值治疗效果几乎相同。
b.再治疗前PR-CIS-TRR治疗效果的持续性
表77显示了TRR再治疗前人群从研究302/303研究的第71 天/EOS到本研究的第180天/提前终止的PR-CIS总分、缩略分和项目得分的变化
表77:TRR再治疗前人群从研究302/303研究的第71天 /EOS到本研究的第180天/提前终止的PR-CIS总分、缩略分和项目得分的变化
在再治疗前TRR全部群体(将第I类和第II类相结合)中,从主要研究第71天到本研究第180天的总PR-CIS总分变化平均值为0.0(12.21)。对于第I类受试者,从第71天到第180天的变化平均值为-0.6(11.20),并且对于第II类受试者,从第71 天到第180天的变化平均值为2.5(16.04)。
对于PR-CIS简略评分,从主要研究的第71天到本研究的第 180天的变化平均值为0.1(9.80)。对于第I类受试者,从第71 天到第180天的变化平均值为-0.5(9.12),并且对于第II类受试者,从第71天到第180天的变化平均值为2.8(12.32)。
在总体单项得分中也出现了类似的小变化(脂肪团的出现的幸福感:0.7;烦恼:-0.2;自我意识:-0.2;尴尬:-0.1;衰老外观:-0.1;体型关注:-0.1)。
第71天和第180天之间PR-CIS总分、缩略分和各项得分的微小差异支持了PR-PCSS和CR-PCSS的评分结果,并且显示在主要研究中接受CCH治疗的受试者中,治疗效果持续到第71天之后6个月。
PR-CIS,S-GAIS,受试者对脂肪团治疗的满意程度以及 SSRS应答者-再治疗前TRR群体。
在第180天,第I类和第II类再治疗前TRR受试者群体显示为PR-CIS(总分、缩略分和个体分数),S-GAIS,受试者对脂肪团治疗的满意程度和SSRS应答者。大比例的II类受试者比I类受试者更具反应性。
A.第180天观察群体
第180天观察人群由479名受试者组成,他们完成了第180 天访视(包括脂肪团评估),并在数据截止日期(2019年4月1 日)揭盲。第180天访视发生在主要研究完成后约180天和主要研究中第一次给药后约251天。
从第1天到第71天(在主要研究中)以及从第1天到第180 天(在本研究中),CR-PCSS、PR-PCSS和PR-CIS的平均变化表明,在第180天观察人群中的受试者是主要研究人群的代表。 CCH治疗受试者和安慰剂治疗受试者在第180天的差异与主要研究中的结果一致。
·在主要研究中接受CCH治疗的241名受试者中,在主要研究第1天到第71天PR-PCSS评分的平均变化在左侧臀部和右侧臀部分别为-0.8(0.85)和0.9(0.92),从主要研究第1天到本研究第180天的PR-PCSS评分的平均变化在左侧臀部和右侧臀部分别为-0.7(0.87)和-0.7(0.92)。在主要研究中使用安慰剂治疗的受试者中,从第1天到第71天,PR-PCSS的平均变化在左侧臀部和右侧臀部分别为0.5(0.75)和-0.5(0.79)。从主要研究的第1天到本研究的第180天,PR-PCSS评分的平均变化在左侧臀部和右侧臀部分别为0.3(0.71)和-0.4(0.80)。
·在主要研究中接受CCH治疗的受试者中,在主要研究第 1天到第71天CR-PCSS评分的平均变化在左侧臀部和右侧臀部分别为-0.8(0.79)和-0.7(0.76),从主要研究第1天到本研究第180天的PR-PCSS评分的平均变化在左侧臀部和右侧臀部分别为-0.6(0.82)和-0.6(0.83)。在主要研究中使用安慰剂治疗的受试者中,从第1天到第71天,CR-PCSS的平均变化在左侧臀部和右侧臀部分别为-0.3(0.64)和-0.3(0.70)。从主要研究的第1天到本研究的第180天,CR-PCSS评分的平均变化在左侧臀部和右侧臀部分别为-0.4(0.72)和-0.4(0.72)。
·在主要研究中接受CCH治疗并完成本研究中第180天 PR-CIS评估的受试者中,从主要研究第1天到第71天的PR-CIS 总分平均变化为-11.8(11.77)。在这些受试者中,从主要研究的第1天到本研究的第180天,PR-CIS总分的平均变化(SD) 为10.5(11.76)。在主要研究中接受安慰剂治疗的受试者中,从主要研究第1天到第71天PR-CIS总分的平均变化为-6.5(12.12)。在这些受试者中,从主要研究的第1天到本研究的第180天, PR-CIS总分的平均变化(SD)为5.4(11.30)。PR-CIS缩略版和个体项目得分也有类似的变化。
从主要研究的第71天到本研究中的第180天,PR-PCSS、 CR-PCSS和PR-CIS方面的微小差异表明,在接受CCH治疗的受试者中,治疗效果可以持续到主要研究的第71天之后6个月。此外,PR-CIS应答者的比例在第71天到第180天之间保持一致。 PR-PCSS和CR-PCSS的结果也表明,左侧臀部和右侧臀部的治疗效果几乎相同。
·对于PR-PCSS,从主要研究中的第71天到本研究的第180 天,接受CCH治疗受试者的平均变化在左侧臀部和右侧臀部分别为0.2(0.81)和0.2(0.86)。在接受安慰剂治疗的受试者中, PR-PCSS的平均变化在左侧臀部和右侧臀部分别为0.1(0.76) 和0.0(0.84)。
·对于CR-PCSS,从主要研究中的第71天到本研究的第 180天,接受CCH治疗受试者的平均变化在左侧臀部和右侧臀部分别为0.2(0.78)和0.1(0.76)。在接受安慰剂治疗的受试者中,CR-PCSS的平均变化在左侧臀部和右侧臀部分别为-0.1 (0.74)和0.1(0.76)。
·在第180天观察人群中,从主要研究的第71天到本研究的第180天,CCH治疗组和安慰剂治疗组的PR-CIS总分变化平均值分别为CCH治疗组1.2(11.32)和安慰剂治疗组1.0(10.14)。对于PR-CIS简略评分,从主要研究的第71天到本研究的第180 天,CCH治疗组和安慰剂治疗组受试者的平均变化分别为1.0 (9.45)和0.4(8.98)。个别项目得分也有类似的小变化。
在主要研究中,CCH治疗组和安慰剂治疗组受试者的 S-GAIS、受试者对脂肪团治疗的满意度以及SSRS应答者比例在第180天均下降。然而,在本研究第180天,CCH治疗受试者的应答率仍然高于安慰剂治疗受试者的应答率。
·在主要研究第71天,接受CCH治疗的受试者在左侧臀部有19.1%的受试者为S-GAIS 2级应答者,21.6%的接受CCH 治疗的受试者在右侧臀部为S-GAIS 2级应答者,而接受安慰剂治疗的受试者分别为6.3%(左侧臀部)和7.1%(右侧臀部)。在本研究304的第180天,在左侧臀部和右侧臀部分别有12.4%和11.6%的接受CCH治疗受试者为2级S GAIS应答者。在接受安慰剂治疗的受试者中,180天时在右侧臀部和左侧臀部2级 S-GAIS应答者的比例均为3.8%。
·在主要研究第71天,接受CCH治疗的受试者在左侧臀部和右侧臀部有70.5%的受试者为S-GAIS 1级应答者,而接受安慰剂治疗的受试者分别为37.4%(左侧臀部)和37.0%(右侧臀部)。在本研究304的第180天,在左侧臀部和右侧臀部分别有 53.5%和51.0%的接受CCH治疗受试者为1级S GAIS应答者。在接受安慰剂治疗的受试者中,180天时在左侧臀部和右侧臀部 1级S-GAIS应答者的比例分别为27.8%和28.3%。
·在第71天,在主要研究中接受CCH治疗的受试者中有 50.6%的受试者对脂肪团治疗表示满意或非常满意,而在第180 天观察人群中,接受安慰剂治疗的受试者中该数据仅为22.5%。在第180天,在主要研究中,34.4%的接受CCH治疗的受试者对脂肪团治疗感到满意或非常满意,而在接受安慰剂治疗的受试者中,这一比例为16.5%(图27)。
·在主要研究第71天,在180天观察群体中,24.7%的接受CCH治疗的受试者为2级SSRS应答者,而接受安慰剂治疗的受试者中该比例为11.4%。在第180天,接受CCH治疗的受试者中,14.9%的受试者为2级SSRS应答者,而接受安慰剂治疗的受试者中该比例为8.9%。
·在主要研究第71天,在180天观察群体中,51.5%的接受CCH治疗的受试者为1级SSRS应答者,而接受安慰剂治疗的受试者中该比例为21.2%。在第180天,接受CCH治疗的受试者中,36.9%的受试者为1级SSRS应答者,而接受安慰剂治疗的受试者中该比例为17.3%。
B.在治疗前TRR群体
再治疗前TRR群体由103名接受CCH治疗的受试者组成,他们在主要研究中CR-PCSS和PR-PCSS有1级或2级复合反应,并且同意继续进行当前研究的开放标签阶段。其中19名受试者被归类为II类,84名被归类为I类。
根据PR-PCSS和CR-PCSS的测量结果,II类中没有受试者并且I类中少部分受试者的复合反应减少或完全丧失反应。反应减少的时间和反应完全丧失的时间反映了数据截止时研究的持续时间。下文提供了减少反应的时间和完全减少反应的时间,但需要额外的长期数据才能从这些数据中得出关于反应持续时间的结论。
·本研究中存在19个受试者,这些受试者在主要研究中至少一个臀部的脂肪团严重程度至少有2级复合改善(II类)。在本研究中,没有一个受试者的脂肪团严重程度在第180天有2级的复合降低。当单独考虑II类受试者的CR-PCSS和PR-PCSS时,在第180天,1名受试者(5.3%)的CR-PCSS反应至少降低2 级,4名受试者(21.1%)的PR-PCSS反应至少降低2级。当单独考虑臀部时观察到类似的结果。
·再治疗前TRR中有19名II类受试者。其中,3名(15.8%) 在再治疗前有1级复合降低反应。再治疗前TRR人群中84名I 类受试者中,10名(11.9%)在再治疗前有1级复合反应降低。总体而言(I类和II类共103名受试者),13名(12.6%)受试者在180天时的复合反应降低了1级。
·完全丧失反应被定义为在CR-PCSS和PR-PCSS评分中恢复到基线(在主要研究中)。第II类受试者(在主要研究中至少有2级复合反应的受试者)在第180天时没有完全丧失反应。在 84名I类受试者中,有4名(4.8%)完全失去反应。
·TRR被定义为从主要研究中的第71天/EOS到当前试验中首次观察到CR-PCSS和PR-PCSS反应复合恶化的研究访视的天数。没有受试者的反应降低2级,因此无法计算反应降低2级的时间。I类受试者1级反应减少的平均时间为187.5(10.87)天, II类受试者为182.7(17.47)天。
·完全丧失反应的时间定义为从主要研究中的第71天/EOS 到当前试验中首次观察到完全丧失反应的研究访视的天数。第II 类受试者没有完全失去反应。I类反应完全丧失的时间为183.0 (2.83)天。
第71天和第180天之间再治疗前TRR人群中PR-PCSS、 CR-PCSS和PR-CIS的总体差异很小,表明在接受CCH治疗的受试者的父母研究中,治疗效果持续到第71天后6个月。这些结果还表明,左侧和右侧臀部的治疗效果几乎相同。
·在I类受试者中,从主要研究的第71天到本研究中的第 180天,PR-PCSS评分的平均变化分别为在左侧臀部为0.2(0.68) 和右侧臀部为0.2(0.84)。从主要研究的第71天到本研究中的第180天,CR-PCSS评分的平均变化分别为在左侧臀部为0.4 (0.72)和右侧臀部为0.1(0.77)。
·对于II类受试者,从主要研究的第71天到本研究中的第 180天,PR-PCSS评分的平均变化分别为在左侧臀部为0.6(0.83) 和右侧臀部为0.8(0.76)。对于接受CCH治疗的受试者从主要研究的第71天到本研究中的第180天,CR-PCSS评分的平均变化分别为在左侧臀部0.6(1.02)和在右侧臀部0.7(0.75)。
·从主要研究的第71天到本研究中的第180天,PR-CIS 总分的平均变化为0.0(12.21)。对于I类受试者,从第71天到第180天的平均变化为-0.6(11.20),而对于II类受试者,从第 71天到第180天的平均变化为2.5(16.04)。
·从主要研究的第71天到本研究中的第180天,PR-CIS 缩略分的平均变化为0.1(9.80)。对于I类受试者,从第71天到第180天的平均变化为-0.5(9.12),而对于II类受试者,从第71天到第180天的平均变化为2.8(12.32)。
·在整体单项得分中也出现了类似的小的平均值(SD)变化(脂肪团外观的幸福感:0.7;令人烦恼的:-0.2;自我意识: -0.2;尴尬:-0.1;年龄较大的外观:-0.1;体形问题:-0.1)。
在第180天,再治疗前TRR人群中PR-CIS(总分、缩写分和项目分)、S-GAIS、受试者对脂肪团治疗的满意度和SSRS应答者中的I类和II类受试者比例与在第180天观察人群和父母研究中看到的相似。
C.OLR群体
在数据截止时完成再治疗的受试者人数不足,无法评估开放标签再治疗人群的疗效。
CCH的安全性曲线与先前研究的安全性结果一致。CCH治疗受试者(在主要研究中)在第180天观察期内的AE曲线与在主要研究中使用安慰剂治疗的受试者非常相似,这表明截至数据截止日期,CCH没有长期安全问题。不同受试者类别(I、II或 III)之间的不良事件频率或类型几乎没有差异。在免疫原性方面没有发现明显的变化,这与以前的研究一致。
本研究截至数据截止日期(2019年4月1日)的结果表明,当通过PR-PCSS、CR-PCSS和PR-CIS进行测量时,CCH治疗的受试者臀部EFP在第3阶段双盲主要研究的第71天后至少180 天(6个月)的持续治疗效果(图26)。在本研究中,没有受试者的复合反应降低了2级,也没有在主要研究中是2级复合反应者的受试者在本研究180天其反应完全丧失。在主要研究中,没有迹象表明服用CCH的受试者存在长期安全问题。在本研究中,截至数据截止日期(2019年4月1日),30名接受CCH治疗的受试者的AE特征与其他脂肪组织CCH临床试验相似。
实施例6-CCH治疗脂肪团的2期开放标签扩展研究(研究202)
目前的实施例(研究202)是先前研究(研究201)的第2 阶段开放标签延伸研究,该研究评估了CCH对成年女性的安全性和有效性。在本实施例中,对201研究中治疗的合格受试者进行长期安全性评估。此外,在登记并接受第二个疗程的受试者中,评估再次暴露于每个治疗区域0.84mg CCH的安全性、有效性和免疫原性。在这项研究中,评估了先前接受CCH治疗的受试者在先前接受过治疗的治疗区域(称为再治疗)或未接受过治疗的治疗区域(称为再治疗)再次暴露的安全性。最后,对先前研究 (研究201,双盲/开放标签评估)和当前研究(研究202,开放标签)中CCH治疗的受试者进行疗效持久性评估。对于先前研究(研究201)中接受CCH治疗的受试者,对治疗区域进行了长达2年的长期疗效持久性评估。对于再次暴露(再治疗或再给药) 的受试者,对治疗区域进行长达约1年的评估。除非在本实施例中另有规定,否则本研究202中使用的“天”是指研究201中的初始剂量(第1天)。在研究201中,每名患者在一个治疗区域 (1侧臀部或1条腿)使用0.84mg CCH或安慰剂。
更具体地说,目前的研究评估了所有选择参加本研究的脂肪团受试者(无论他们是否决定接受本研究中的治疗(再治疗或再给药))在1年(最长2年)内按计划间隔服用CCH的长期安全性。在先前研究(研究201)中接受的治疗受试者揭盲后,符合条件的受试者可以选择接受CCH治疗。如果受试者在研究201 中接受CCH治疗,并且治疗区域的脂肪团严重程度分级已恢复到或高于研究201的分级(表明脂肪团严重程度更严重),则受试者可以选择在一个治疗疗程中使用CCH对先前治疗区域进行再治疗(称为再治疗)。如果受试者在研究201中接受CCH治疗,受试者可以选择治疗合格区域,而不是在研究201中接受 CCH治疗的区域(称为重做)。在本研究中,在201研究中接受安慰剂治疗的受试者可选择接受2个CCH治疗疗程(一个疗程包括相隔21天的3个疗程)。每个疗程包括CCH 0.84mg,每个治疗区域皮下注射12次,在臀部或大腿的相同或不同合格治疗区域进行3个疗程。疗程2包括重新治疗或恢复治疗的受试者。
201研究中选择不接受治疗的受试者(仅观察受试者,观察阶段)从第1天起每隔3个月进行一次安全性和脂肪团严重程度评估,随访时间长达2年。在201项研究中,对接受CCH治疗的受试者进行为期2年的反应持续性评估,结果显示,脂肪团严重程度至少有1级复合PR-PCSS/CR-PCSS改善(双盲治疗受试者的长期持久性阶段)。反应的持久性被定义为在CCH治疗区域中CR-PCSS和PR-PCSS反应者并保持这种反应(即,不存在完全丧失反应,没有恢复到基线或更差的情况)的受试者。在本研究中接受治疗的受试者在本研究中首次接触CCH后的第71天继续观察,然后在本研究中每个治疗区域首次接触CCH后的3 个月间隔观察1年。
在再治疗或重给药之前,受试者和研究人员使用PR-PCSS、 CR-PCSS和Hexsel CSS对受试者的4个治疗区域(即左侧臀部、右侧臀、左后外侧腿和右后外侧腿)进行独立评估,以评估筛查时脂肪团的严重程度。
A.总体研究设计和计划
在研究201第71天完成安全性和脂肪团评估后,询问受试者是否希望继续进行双盲研究(筛查A)的开放标签扩展实验。在进入当前研究时,受试者和研究人员对受试者在201研究中接受的研究药物的身份一无所知。在201研究药物盲法被打破之前,受试者每隔3个月±7天(相对于201研究中的初始剂量)只接受一次观察访问,其中治疗区域的安全性和脂肪团严重性评估均以双盲方式进行(图28)。
在研究201中对他们接受的治疗揭盲后,符合条件的受试者可以选择接受CCH治疗。如果受试者选择不接受治疗,则将其放入观察人群中观察2年。在开放标签治疗访视第1天开始CCH 治疗前14天,进行筛查评估(筛查B),以确定是否符合规定的纳入和排除标准,并确定有资格通过再治疗、再次给药或首次治疗进行治疗的治疗区域(如果存在的话)。在研究201中接受 CCH治疗的受试者可以选择在相同或不同的合格治疗区域接受疗程。在本研究中,在201研究中接受CCH治疗的受试者可选择接受2个疗程的CCH治疗。每个疗程最多包括3个疗程,每个疗程在相同或不同的合格治疗区域进行。在第一个治疗疗程结束后至少28天(例如,第二个治疗过程的筛查B访视可在第一个治疗区域治疗后的第71天进行),选择的治疗区域可被重新治疗或重新给药。
选择不接受进一步CCH治疗的受试者(仅观察受试者)继续进行安全性和脂肪团严重程度评估,从3个月到12个月或更长时间。治疗耐久性评估长达2年。
在筛选B期间,对受试者的4个治疗区域(象限)中的每一个进行了拍照(即:左侧臀部、右侧臀部、左后外侧腿和右后外侧腿)。受试者收到了PR-PCSS的使用说明,随后通过将标准化计算机显示器上显示的每个治疗区域(象限)的数字图像与 PR-PCSS仪器进行比较,使用该量表对4个治疗区域(象限)中每个区域的脂肪团严重程度进行评分。这种独立的自我评估是在私人场合进行的,目的是尽量减少现场人员的任何潜在偏见。然后,研究人员使用CR-PCS实时评估受试者的4个治疗区域(象限)。研究者使用Hexsel脂肪团严重程度量表(CSS)对4个治疗区域(象限)进行评分。受试者必须至少有1个象限符合以下标准才能纳入研究的治疗阶段:
·受试者报告(PR-PCSS)的3分或4分(中度或重度),以及
·调查者报告(CR-PCSS)的3分或4分(中度或重度),以及
·Hexsel CSS评分不高于13。
将受试者分为以下群体进行分析:
·观察人群包括201号研究的所有受试者。揭盲后,那些选择不再暴露的人仍留在观察人群中。
·安全性群体包括所有在本研究中接受1剂量CCH的患者。
·有效性群体包括所有安全受试者,这些受试者在当前研究中选择的治疗区域对CR-PCSS和PR-PCSS具有基线评分和至少1次基线后评估.
·总耐久性群体被定义为所有在治疗过程的第1天和第71 天以及第1天之后180天或之后进行CR-PCSS和PR-PCSS评估的积极应答者。所述积极应答者是接受CCH治疗的受试者,在治疗过程中,每个量表(CR-PCSS和PR-PCSS)的水平至少提高了1个水平。
-双盲治疗受试者的耐久性群体定义为在总体耐久性人群中,所有在双盲研究中,在每个量表(CR-PCSS和PR-PCSS) 中,与基线相比在第71天显示改善的受试者。
-开放标签受试者的耐久性群体定义为总体耐久性人群中,在当前开放标签研究中,CR-PCSS和PR-PCSS的耐久性在第71天与基线相比改善至少1水平(研究202)的所有受试者。
在本发明的统计学分析中总结了下述2个阶段:
·观察阶段:定义为从筛选A到当前研究(研究202)中同一治疗区域的第一个治疗日期的时间段,或者如果研究202中同一治疗区域没有接受治疗,则为到研究202结束的时间段。观察阶段在每个治疗区域内进行定义,除非总结仅针对受试者水平,不能根据治疗区域进行区分(即处置、不良事件)。对于受试者水平总结,观察阶段被定义为从筛选A到研究202中的第一个治疗日期的时间段,或者如果研究202中没有接受治疗,则为到研究202结束的时间段。
·治疗阶段:定义为从研究202中选定治疗区域的第一个治疗日期到研究202结束的时间段。治疗阶段在每个治疗区域内定义,除非总结仅针对受试者水平,不能根据治疗区域(即处置、不良事件)加以区分。对于受试者水平总结,治疗阶段被定义为从研究202的第一个治疗日期到研究202结束的时间段。纳入研究202中第一次CCH治疗后第1天的所有数据。因此,观察阶段的数据包括在治疗阶段。
如果受试者在下文确定的时间内使用以下任何一种方法治疗腿部或者臀部EFP,或在研究过程中的任何时候打算使用以下任何一种方法,则被排除在本研究的治疗之外(但不排除在观察评估之外):(A)在身体一侧抽脂选择在注射CCH前12个月内进行治疗,(b)注射(如介观疗法);射频设备治疗;激光治疗;或在注射CCH前12个月内选择的治疗区域内进行手术(包括分切和/或电动分切),(c)注射CCH前6个月在选定治疗区域内进行
研究者回顾了他/她的评估和受试者的评估,以确定哪些治疗区域(象限)是合格的。在开放标签研究202中选择接受治疗的合格象限由受试者自行决定。如果受试者在研究201中接受CCH 治疗,并且治疗部位的脂肪团严重程度得分已恢复或高于研究 201的评分,则受试者可以选择使用CCH对先前治疗的象限进行再治疗(称为再治疗)。如果受试者在研究201中接受CCH治疗,受试者可以选择治疗合格象限,而不是在研究201中接受 CCH治疗的象限(称为重给药)。
对于在双盲研究中指定的治疗区域接受活性药物治疗的受试者,治疗区域的脂肪团严重程度得分必须高于PR-PCSS和 CR-PCSS的201基线(或更高),才有资格再治疗。
治疗结束后(治疗阶段第71天),按照研究计划,每隔3 个月对受试者进行随访,直至第360天。如果受试者在201项研究中服用了安慰剂,那么在202项研究中,如果符合条件,最多可以在2个治疗区域(臀部或后外侧腿)分别服用2个CCH疗程。对于研究201中接受CCH治疗的受试者,对治疗区域进行长期耐久性评估,直至第720天。
设计开发标签的延展实验从而允许下述:
·在超过12个月的时间里收集安全性数据从而协助进一步定义CCH在这些群体中的安全性曲线。
·在重复暴露(再治疗/再给药)的12个月内评价安全性数据和免疫原性,并监控之前接受CCH治疗的患者12个月
·之前使用安慰剂治疗的受试者接受CCH治疗。
·评价CCH反应的持续性(皮下脂肪团严重性评价)。
本研究的主要目的是评估所有选择参加本开放标签试验的 EFP受试者以预定间隔在1年(12个月)或更长时间内服用0.84 毫克CCH的长期安全性,无论他们是否决定接受开放标签CCH 治疗(再治疗或再治疗)或选择不接受治疗。
本研究的二级目标是:
·评估先前接受过CCH治疗的受试者再治疗或再给药的安全性和免疫原性。
·使用PR-PCSS和CR-PCSS评估先前在CCH-201研究中接受积极治疗的受试者首次服用CCH后12个月内EFP严重程度对CCH反应的持久性。
·使用PR-PCSS和CR-PCSS评估先前在201研究中接受积极治疗的受试者首次服用CCH后12个月后EFP严重程度对CCH 反应的持久性。
·评估EFP评估中对CCH的长期反应,包括受试者满意度、研究者整体美学改善量表(I-GAIS)和受试者整体美学改善量表 (S-GAIS)。
·评价本研究中使用CCH治疗的象限中的皮下脂肪团严重程度。
·评价暴露于CCH之后的免疫原性。
对每个治疗区域0.84mg CCH的持续作用进行了长达2年的评估。这包括在202研究中治疗的受试者的持续有效性(最长1 年)和在201研究中使用CCH治疗的受试者的长期持续有效性,这些受试者被转入202研究并观察了2年。
在162名受试者中评估了再暴露2个治疗过程(每个治疗过程包括3个疗程)的影响。在201号研究或本研究中接受治疗的受试者,如果符合条件,可以在本研究中接受第二个治疗疗程(称为再治疗或再给药,分别取决于该区域以前是否接受过CCH治疗或是未被治疗过的)。对于在研究201中指定的治疗区域接受CCH治疗的受试者,治疗区域的脂肪团严重程度得分必须等于 (或大于)研究201中要重新治疗的受试者。
表78代表了本研究的描述.
表78:研究的描述
符合条件并选择接受治疗的受试者在每个治疗区域皮下注射0.84mg CCH,最多12次(见表79)。一名受试者总共只能接受2个疗程的CCH治疗。如果受试者在研究201中接受了第一个CCH疗程,则在当前研究中接受了第二个CCH疗程。如果受试者在201项研究中服用了安慰剂,那么在本研究中,如果符合条件,最多可以在2个治疗区域(均为臀部或后外侧腿)分别接受2个CCH治疗过程。
表79:每次治疗过程的CCH剂量和体积
注射前,研究人员或合格的指定人员在选定的治疗区域内选择了清晰的凹坑,所述凹坑当受试者站立时明显,适合治疗。因为治疗的目的是改善整个治疗区域的美观,研究者被指示选择他或她认为最能改善整个治疗区域美观的凹坑。治疗区域内的相同凹坑或治疗区域内的不同凹坑可能已在每次治疗期间进行了治疗,但注射必须在所有3次治疗期间都在选定的治疗区域内。
如果一个凹坑需要一次以上的注射,则凹坑内的注射部位相距约2cm。每个注射部位都用手术标记用“点”标记。对于圆形凹坑,“点”位于凹坑的中心;对于细长凹坑,“点”沿凹坑的长轴间隔约2cm。然后,研究者或合格的指定人员用手术标记圈出选择治疗的每个凹坑。选定治疗区域的圆圈不能重叠。
每个注射部位接受上述CCH单次皮肤注射用于治疗皮下脂肪团,并将其作为三份0.1毫升的等分物注射在位置A、B和C (总注射量为0.3毫升),如图7所示。注射深度与治疗针的长度(0.5英寸)相对应,从针尖到针座或底部,没有向下的压力。在每次治疗过程中,研究者都会得到4支注射器。每支注射器含有0.9毫升CCH(即每支注射器最多注射3次)。在每次治疗期间,在选定的治疗区域内最多进行12次皮肤注射,每次注射0.3 毫升。
B.剂量和给药时间
本研究选择的剂量与主要研究201中使用的剂量相同。符合条件并选择接受治疗的受试者间隔21天服用CCH 3次(研究第 1、22和43天)。在研究201中接受安慰剂治疗的受试者可以选择在本研究中接受2个疗程的治疗,以进入合格的治疗区域。本研究(研究202)中的治疗疗程I和II在本研究第一个疗程的CCH 最终剂量后不少于28天后分开。
目前的研究是一项开放标签的研究。在进入本研究时,受试者和研究人员对201研究中使用的研究药物的身份仍然一无所知。在201研究药物被主办方揭盲之前,受试者每隔3个月±7 天(相对于201中的初始剂量)只接受一次观察访问,其中治疗区域的安全性和脂肪团严重性评估均以双盲方式进行。
C.功效方法学
利用数码摄影来评估特定时间点的某些脂肪团严重程度参数,仅观察组的受试者以及选择再次接受CCH治疗或再次接受 CCH治疗的受试者。在为选择接受重做或再治疗的受试者进行筛查B访问时,研究人员或合格的指定人员使用赞助商提供的标准数码相机对每个治疗区域进行拍照。受试者每次拍照都站着,穿着标准化的服装拍照。
研究者进行的脂肪团评估独立于受试者进行的评估。因此,所有受试者的脂肪团评估都是在研究者进行脂肪团评估之前完成的。在筛选B时,在受试者和研究者的评估完成后,将受试者的评估与临床医生的评估进行比较,以确定治疗区域的合格性。如果超过1个治疗区域符合条件,受试者选择1个治疗区域进行治疗。
在双盲研究中,最初使用CCH治疗的治疗区域的受试者,在第360天之后进行治疗持久性评估,在特定时间点完成PR-PCSS。在研究201中研究药物被揭盲后选择再治疗或重新给药的受试者,在给药第1天之前的14天内被重新筛选(筛选B 访视)。
所有4个治疗区域(象限)的数码照片都是在筛查B时拍摄的,以便进行鉴定。然后受试者在第22天、第43天和第22天开始就诊时,对臀部和大腿进行PR-PCSS评估,并对选定的治疗区域拍摄了71张数码照片,完成了选定治疗区域的PR-PCSS。
仅观察组的受试者使用双盲研究中指定治疗区域的预处理第1天图像(基线)在特定时间点完成S-GAIS,以进行比较。对于选择接受CCH治疗的受试者,在特定时间点进行S-GAIS 评估,并将其与所选治疗区域的给药前筛查B图像(治疗受试者的图像)进行比较。选择通过再治疗或再给药接受CCH的受试者完成了脂肪团治疗量表评估的受试者满意度。仅观察组的受试者在特定时间点完成CR-PCSS。
对于选择接受CCH作为再治疗或再给药的受试者,研究者通过使用CR-PCSS进行现场评估,在受试者在筛查B就诊时使用PR-PCSS完成自我评估后,通过现场评估确定4个治疗区域 (象限)的皮下脂肪团的严重性。选定的合格治疗区域由受试者自行决定。在治疗前第1、22和43天以及在就诊时,研究人员使用CR PCSS进行现场评估,评估选定的治疗区域。对于最初在双盲研究中使用CCH治疗的受试者,在第360天之后评估治疗耐久性,CR-PCSS在特定时间点完成。
在最后一次研究访视(第12个月或提前终止)时,仅观察组的受试者完成I-GAIS,使用双盲研究指定治疗区域的预处理第 1天图像。对于选择在疗程的第71天和12个月或EOS就诊时接受CCH治疗的受试者,完成I-GAIS。为了进行这项评估,研究人员通过比较受试者所选治疗区域的筛查B预处理(基线)图像在第12个月或EOS就诊时的实时评估中的脂肪团,确定了所选治疗区域的筛查B数字图像的改善程度。
对于仅在观察组的受试者,在特定的时间点进行Hexsel CSS 评估。对于选择进行再治疗的受试者,在特定的时间点进行 Hexsel CSS评估。
脂肪团严重程度的复合终点是复合反应者的比例。复合应答者被定义为治疗区域在CR-PCSS中严重程度与基线相比至少改善2(或1)个水平,在PR-PCSS中严重程度与基线相比至少改善2(或1)个水平的受试者。使用适当的描述性统计方法,按治疗区域和总体(臀部和大腿)以及研究日总结这些终点。
接受治疗的治疗区域(象限)的其他终点包括:
PR-PCSS从基线起的变化
·在PR-PCSS中任一水平改善的比例:
-应答者的比例,定义为PR-PCSS(受试者评级)中严重程度与基线相比具有2级以上改善的受试者。
-应答者的比例,定义为PR-PCSS(受试者评级)中严重程度与基线相比具有1级以上改善的受试者。
·CR-PCSS从基线起的变化
·在CR-PCSS中任一水平改善的比例
-调查者应答者的比例,定义为CR-PCSS(调查者评级) 中严重程度与基线相比具有2级以上改善的受试者。
-调查者应答者的比例,定义为CR-PCSS(调查者评级) 中严重程度与基线相比具有1级以上改善的受试者
·达到任一水平I-GAIS应答者的比例:
-在第71天和第360天达到任一水平I-GAIS应答者的比例。
·达到任一水平S-GAIS应答者的比例:
-在第71天和第360天达到任一水平S-GAIS应答者的比例。
·受试者对脂肪团治疗量表各级别满意度的反应者比例。
·筛查访视中Hexsel CSS总分的变化。
每个接受治疗的治疗区域的观察终点包括:
·复合应答者的比例定义为CR-PCSS和PR-PCSS中严重程度与基线相比具有2(或1)级改善的受试者。
·PR-PCSS从基线起的变化.
·在PR-PCSS中任一水平改善的比例.
-应答者的比例,定义为PR-PCSS中严重程度与基线相比具有2级以上改善的受试者。
-应答者的比例,定义为PR-PCSS中严重程度与基线相比具有1级以上改善的受试者。
·CR-PCSS从基线起的变化
·在CR-PCSS中任一水平改善的比例
-调查者应答者的比例,定义为CR-PCSS(调查者评级) 中严重程度与基线相比具有2级以上改善的受试者。
-调查者应答者的比例,定义为CR-PCSS(调查者评级) 中严重程度与基线相比具有1级以上改善的受试者.
·在第360天处于任一受试者对脂肪团治疗满意程度的受试者比例。
·从研究201第71天和第360天或者第360天之后的长期耐受性访视过程中HexselCSS总分变化
D.耐受性方法学
治疗持久性评估包括对在201研究中接受积极治疗的受试者长达2年的观察,这些受试者在CR-PCSS和PR-PCSS方面得分至少提高1级。对于在研究201中接受CCH并且在当前研究中也接受CCH的受试者,除了在开放标签研究期间治疗的任何治疗区域(象限)外,在当前研究的第720天之前,对在研究201 中治疗的原始治疗区域进行评估。耐久性人群还包括在研究201 中接受CCH但在本研究中选择不接受额外治疗的受试者,以及在研究201中接受慰剂并在本研究中接受CCH的受试者。
对于在第360天之后进行耐久性评估的受试者,受试者必须: (a)参与并完成了双盲研究201,(b)在双盲研究201中接受了积极CCH,(c)在双盲研究201中的第71天当天或之前的同一次就诊中,CR-PCS和PR-PCS的改善程度至少达到1级,并且(d)在参与研究期间,愿意在每次暴露于阳光下之前(即通过EOS进行筛选)在CCH-201治疗区域涂抹防晒霜。
治疗效果的持久性基于CR-PCSS和PR-PCSS脂肪团评估的纵向反应。按研究日总结与治疗区域(象限)相关的CR-PCSS、 PR-PCSS及其组合(即综合评分、两个评分的1级或2级改善) 各级别(即1级或2级改善)应答者的数量和百分比。
治疗失败被定义为积极应答者,其中CR-PCSS和PR-PCSS 在CCH治疗区的某个随访期内恢复基线到或更差。按研究日(即 180天、360天、540天和720天)总结人数和百分比。
受试者来源于以下两个群体:
·双盲治疗受试者的耐受性群体:耐久性人群中的所有受试者,在双盲研究(研究201)中使用CCH治疗的治疗区域在每个量表(CR-PCSS和PR-PCSS)上显示出与基线相比至少1个水平的改善(研究201),并随访2年。
·开发标签受试者的耐受性群体:耐久性群体中的所有受试者,在研究202中使用CCH治疗的治疗区域中,在研究202 的第71天显示CR-PCSS和PR-PCSS评分与基线相比的改善程度至少为1级,然后随访至1年。
E.安全性评估
安全性变量包括:不良事件、注射部位反应/局部耐受性、生命体征、临床实验室参数(包括血液学、血液化学和尿液分析) 和免疫原性。
F.研究受试者
259名受试者从研究201转过来,参与了当前研究,并被纳入观察人群(表80)。观察群体中包括121名在先前研究201 中接受过CCH治疗的受试者和138名在先前研究201中接受过安慰剂治疗的受试者。观察群体中有53名(20.5%)受试者被纳入双盲治疗受试者的持久性群体。这些受试者在研究201中第71 天就诊当天或之前的同一次就诊中,CR-PCSS和PR-PCSS的改善程度至少为1级。
表80:观察阶段的分析群体
在治疗阶段,200名受试者在本研究中接受了至少1剂CCH,并被纳入安全群体(表81)。在被纳入安全群体的受试者中,193 名在治疗区域具有CR-PCSS和PR-PCSS基线评估以及至少一次基线后评估的受试者被选择进行本研究的治疗,并纳入有效群体。在研究202的治疗过程中,3名受试者将治疗区域的选择从臀部切换到大腿,并在研究202疗程中先在臀部接受治疗,然后在大腿接受治疗,8名受试者将治疗区域从大腿切换到臀部。这些受试者在两个治疗区域都被计算在内。
在治疗阶段,受试者最多接受2个疗程。在201号研究中接受安慰剂治疗的受试者在本研究中最多可接受2个疗程。在201 研究中接受CCH治疗的受试者在本研究中接受1个疗程。
在研究期间,163名受试者在本研究中接受了第二个疗程,并被纳入安全人群。该再治疗/再给药治疗组包括88名在本研究中接受CCH第二疗程治疗的受试者(在201研究中接受了第1 疗程治疗)和75名在本研究中同时接受第一疗程和第二疗程治疗的受试者。
有效群体中包括在本研究中接受第二疗程治疗的162名受试者。该再治疗/再给药治疗组包括87名在本研究中接受CCH第二疗程治疗的受试者(在研究201中接受了第二疗程治疗),以及75名在本研究中同时接受第一疗程和第二疗程治疗的受试者。
在耐受性群体中有42位受试者在本研究中进入治疗阶段,并被包括在进行双盲治疗的受试者耐受性群体中(表81)。
开放标签治疗受试者的耐久性人群包括124名受试者。在开放标签研究(研究202)中,耐久性人群中的所有受试者在治疗区域的CR-PCSS和PR-PCSS与基线相比表现出至少1个水平的改善(研究202)。这些人口包括以下群体:
1.在研究201中接受CCH治疗并在研究CCH-201的治疗疗程1中出现反应的受试者接受再给药或者重新治疗。
·在研究201中接受CCH治疗的受试者退出治疗,并且治疗区域的脂肪团严重程度得分已恢复到或低于研究201的评分。这些受试者可以选择使用CCH对先前治疗区域进行再治疗。
·再给药的受试者在研究201中接受CCH。
2.在研究201中接受安慰剂治疗的受试者在研究202中最初被治疗并且在治疗第一疗程就成为应答者。
3.在研究201中接受安慰剂治疗的受试者在研究202中接受 2个疗程的治疗并在第二疗程后成为应答者。
表81:治疗阶段的分析群体
G.受试者处置:
图28总结了如何对受试者进行处置
(i)受试者处置(观察阶段):在观察阶段,对259名受试者进行了评估,222名(85.7%)受试者完成了这一阶段(表82)。总的来说,37名受试者因以下原因停药:未接触CCH的嗜酸性粒细胞轻度增加的不良事件(1名受试者;0.4%),失去随访(13 名受试者;5%),受试者退出(13名受试者,5%),以及其他 (10名受试者,3.9%)。另一类包括筛查失败、受试者拒绝参与治疗阶段、受试者登记研究第272天的研究场地关闭或受试者不符合研究访问要求。
表82:观察阶段的受试者处置(所有受试者)
(ii)受试者处置(治疗阶段):216名受试者被筛选进入治疗阶段,200名受试者被纳入研究,156名(78%)受试者完成了治疗阶段(表83)。总体而言,臀部治疗区多于大腿治疗区。 104名受试者在臀部接受治疗,96名受试者在腿地区接受治疗
在治疗阶段,163名受试者再次暴露于CCH。163名再暴露受试者组包括88名在治疗过程I中再次暴露于CCH的受试者,他们在研究201中接受了治疗,75名受试者在治疗过程2中再次暴露于CCH。
在治疗阶段,112名受试者在第1疗程开始接受治疗,88名受试者在第1疗程重新暴露(82名受试者接受再给药,只有6 名受试者重新接受治疗)。在研究201中,82名再给药受试者接受CCH治疗,并选择在合格的治疗区域接受治疗,而不是在研究201中接受治疗的区域。在研究201中,6名受试者接受CCH 再治疗,其治疗区域的脂肪团严重程度评分已恢复到研究201的评分或高于研究201的评分。这些受试者选择之前接受过CCH 治疗的区域进行再治疗。
75名受试者在研究202中接受第一和第二治疗过程。所有受试者,如定义所述,在治疗过程2中被重新暴露于CCH。大部分受试者(73/75受试者;97.3%)被再给药并且只有2名受试者被再治疗。
156名受试者完成了该研究。未继续CCH治疗受试者分布再臀部和大腿组中是相似的(22[21.2%]对22[22.9%]受试者)。
表83:治疗阶段的受试者处置(所有受试者)
H.功效结果
1.
在治疗阶段和观察阶段对201号研究中的积极应答者的 CR-PCSS/PR-PCSS复合终点反应进行了评估。脂肪团严重程度的复合终点定义为复合反应者的比例。应答者被定义为CR-PCSS 中比基线(研究201中)严重程度至少改善1级的受试者, PR-PCSS中比基线(研究201中)严重程度至少改善1级的受试者。在研究201中,积极应答者接受CCH治疗,其CR-PCSS和 PR-PCSS在研究201治疗区域的改善程度与基线相比至少为1 级。
在研究202的观察阶段,对从研究201转过来的受试者进行为期2年的观察,这些受试者是治疗区域的积极反应者。在研究 202的治疗阶段接受治疗的受试者为2级复合应答者,观察时间长达1年。治疗失败被定义为接受CCH治疗的积极应答者,其 CR-PCSS和PR-PCSS返回CCH治疗区的基线水平。治疗效果的持久性按治疗失败的倒数计算。对2级复合反应者和至少1级复合反应者进行分析。
脂肪团严重程度的复合终点定义为复合反应者的比例。这被定义为受试者在CR-PCSS中比研究201中基线的严重程度至少提高2(或1)级,在PR-PCSS中比研究201中基线的严重程度至少提高2(或1)级。这项分析是针对进入观察和治疗阶段的受试者进行的。研究者在观察阶段对1级和2级复合反应者的反应持久性进行了双盲评估。
按治疗区域和受试者进行评估。因此,对于可能在不同治疗过程中在不同治疗区域接受CCH治疗的受试者,按治疗区域分别评估反应。在一个治疗区域有反应的受试者视为1级或2级复合反应者(如适用),因为他们在另一个治疗区域可能没有同样或根本没有反应(如果治疗的话)。在研究201中,对至少有1 级或2级复合反应的受试者的反应持久性进行了评估。
共有26名受试者(包括19个臀部和7个大腿治疗区域)在第180天或以上为2级复合应答者。在研究202期间,这些受试者接受了1个或2个疗程。在研究202、第180天(26名受试者; 100%)和第360天(21名受试者;100%)观察到的所有可评价受试者保持2级反应。新治疗区域的CR-PCSS和PR-PCSS评分为2级复合应答者的受试者没有恢复到(研究202)的评分或更差。在本研究中接受治疗的受试者,在第180天和第360天持续出现2级复合反应,在臀部和腿治疗区域相似。
在研究202期间,共有124名受试者(包括72名臀部受试者和54名大腿受试者)在第180天出现1级复合反应,114名受试者在第360天保持1级复合反应。没有被评估为治疗失败的受试者,也就是说没有受试者的CR-PCSS和PR-PCSS评分恢复到基线(在研究202中)或更差。1级复合反应持续存在,在第180 天和第360天相似,在臀部和大腿治疗区域相似。
2.
本研究评估了所有选择登记的脂肪团受试者在2年(24个月) 内按计划间隔服用CCH的长期安全性。符合条件的受试者接受1 个臀部或1条大腿治疗,根据资格,可接受1侧臀部或1条大腿的第二疗程治疗。在研究201中接受CCH治疗的受试者中,对反应的持续性进行了长达2年的评估;在研究202中接受CCH 初始治疗的受试者中,对反应的持续性进行了长达12个月的评估。在研究202第720天评估的受试者(在研究201中接受治疗) 的可用数据支持CR-PCSS和PR-PCSS反应持续2年。
这项研究的结果为CCH的长期安全性和持久性提供了长达2 年的支持性数据,CCH0.84mg/治疗区域×3个疗程间隔21天。这包括在202研究中治疗的受试者的疗效持久性(最长1年),以及在201研究中使用CCH治疗的受试者的长期疗效持久性,并在202研究的扩展研究中登记,观察时间长达2年。
参与当前开放标签研究(研究202)的受试者,CR-PCSS和 PR-PCSS上的脂肪团严重程度与基线相比减少了约1级(即改善)。这种减少的幅度与双盲研究中受试者所经历的CR-PCSS 和PR-PCSS的减少相似。
(a)长达一年的PR-PCSS应答者的持续性:在研究201中接受CCH治疗、研究202中接受CCH治疗和研究202中再次暴露的受试者组之间,PR-PCSS与基线相比的变化在持久性方面是一致的。从研究201中登记到研究202中的259名受试者中,CCH 治疗组(n=121)在研究201第71天从基线开始的平均变化为-1.2 (0.89);而在安慰剂治疗组(n=138)该平均变化为0.6(0.74)。经过长达1年的观察,CCH治疗的受试者在PR-PCSS评分方面继续表现出改善。CCH治疗组在第180天(n=119)、270天(n=105) 和360天(n=96)与基线相比的平均变化分别为-0.7(0.88)、-0.7 (0.96)和-1.0(0.91)。
在研究202中登记和治疗的受试者中,193名受试者(103 名臀部-和90名大腿治疗区域)在疗程1期间进行了疗效评估。接受第1疗程治疗的受试者包括最初接受CCH治疗的受试者和退出或恢复治疗的受试者。在长达1年的观察后,CCH治疗的受试者在PR-PCSS评分方面与基线相比继续表现出改善。在第180 天、第270天和第360天,与基线相比的平均改善分别为-1.1 (0.85)、-1.1(0.87)和-1.0(0.83)。臀部(n=103)和大腿治疗区域(n=90)的反应相似(图29)。
在这项研究中,162名受试者再次暴露,并在观察1年后进行疗效评估,CCH治疗的受试者在第180天(-1.0[0.83])和第 360天(-1.0[0.83])的PR-PCSS与基线相比继续显示出改善。臀部和大腿治疗区域在第1疗程治疗后的反应与第二个治疗疗程后相似(图30和图31)。
(b)长达一年的CR-PCSS应答者的持续性:在研究201中接受CCH治疗、研究202中接受CCH治疗和研究202中再次暴露的受试者组之间,CR-PCSS与基线相比的变化在持久性方面是一致的。
从研究201中登记到研究202中的121名受试者中,CCH治疗组在研究201第71天从基线开始的平均变化为-0.8(0.88);而在安慰剂治疗组该平均变化为-0.3(0.6)。经过长达1年的观察,CCH治疗的受试者在CR-PCSS评分方面继续表现出改善。 CCH治疗组在第180天、270天和360天与基线相比的平均变化分别为-0.6(0.80)、-0.6(0.76)和-0.9(0.86)。
在研究202中登记和治疗的受试者中,193名受试者(103 名臀部-和90名大腿治疗区域)在疗程1期间进行了疗效评估。接受第1疗程治疗的受试者包括最初接受CCH治疗的受试者和再给药或者再治疗的受试者。在长达1年的观察后,CCH治疗的受试者在CR-PCSS评分方面与基线相比继续表现出改善。在第 180天、第270天和第360天,与基线相比的平均改善分别为-1.0 (0.80),-1.1(0.83),和-1.1(0.82)。臀部(n=103)和腿治疗区域(n=90)的反应相似。
在研究202中,162名受试者再次暴露,并在观察1年后进行疗效评估,CCH治疗的受试者在第180天和第360天的 CR-PCSS与基线相比继续显示出改善。与基线相比平均变化为第 180天-1.0(0.80)并且第360天-0.9(0.77)。臀部和大腿治疗区域在第1疗程治疗后的反应与第二个治疗疗程后相似(图33 和图34)。
(c)2级复合反应的持续性超过2年:对7位2级复合应答者受试者(5个臀部和2位大腿CCH-治疗区域)在长达720 天的时间内进行评估。在第720天,7位受试者中没有任何一位CR-PCSS和PR-PCSS评分回归基线分数(在研究201中)或变得更差。
(d)1级复合反应的持续性超过1年:对23位≥1级复合应答者受试者(13个臀部和10位大腿CCH-治疗区域)在长达 720天的时间内进行评估。在第720天,21位受试者(91.3%) 的CR-PCSS和PR-PCSS评分没有回归基线分数(在研究201中) 或变得更差。
3.
本研究评估了第二个疗程的耐受性(再次暴露于CCH后,随着时间的推移对治疗剂量的反应能力丧失)。当前研究的数据支持再次暴露于CCH后缺乏耐受性(随着时间的推移对治疗剂量的反应能力丧失)。163名受试者再次接受治疗。这一组包括88名在治疗过程1中再次暴露的受试者,他们在研究201中接受了治疗,75名受试者在治疗过程2中再次暴露。
在研究202中,75名受试者同时接受了第一和第二个疗程。根据定义,治疗过程2中的所有受试者再次暴露于CCH。大多数受试者(73/75;97.3%)重新给药,只有2名受试者重新接受治疗。在再次暴露于CCH治疗的受试者中(重新给药和/或重新接受CCH治疗)没有任何提示安全问题的信号。
(a)PR-PCSS评分与基线相比的变化(再治疗/再给药):在本研究中,162名受试者(包括91个臀部和71个大腿-治疗区域)在其第一疗程和第二疗程CCH治疗后接受PR-PCSS的有效性评估(1名受试者因评估缺失而未纳入有效性人群)(表84)。
当在初次治疗后第71天和第360天进行评估时,在第二个疗程后观察到的PR-PCSS变化与在第一个疗程后相同时间点观察到的变化相似且重叠。在第360天,PR-PCSS评分在第二个疗程后的总体变化平均值为-1.0(0.82)(表84)和-1.0(0.83)(表 85)。在臀部和大腿治疗区也观察到类似的下降。臀部治疗区(图 31)的变化与大腿-和臀部治疗区(图30)联合分析的变化相似。在研究202中再次暴露的受试者,其PR-PCSS上的脂肪团严重程度降低,其程度类似于双盲研究(研究201、302和303)中受试者在第一个也是唯一一个疗程后观察到的反应。
表84:第一疗程后访视时接受第一和第二CCH治疗过程的受试者PR-PCSS评分从基线起的变化(有效群体)
表85:在第二疗程之后访视时,第一和第二疗程均接受 CCH治疗的患者(有效群体)PR-PCSS评分及其从基线起的变化
(b)CR-PCSS评分从基线起的变化(再治疗/再给药):在本研究中,162名受试者(包括91臀部和71腿部治疗区域)接受了CCH的第一个和第二个治疗过程,并对CR-PCSS的有效性进行了评估(1名受试者由于缺少评估而未纳入有效性人群)(表 86)。
当在初次治疗后第71天和第360天进行评估时,在第二个疗程后观察到的CR-PCSS变化与在第一个疗程后相同时间点观察到的变化相似且重叠。在第360天,CR-PCSS评分在第二个疗程后的总体变化为-1.1(0.88)(表86)和-0.9(0.77)(表 87)。在臀部和腿治疗区也观察到类似的下降。臀部治疗区的变化(图34)与腿和臀部治疗区的联合分析的变化相似,图33。在研究202中再次暴露的受试者,其CR-PCSS上的脂肪团严重程度降低,其程度类似于双盲研究(研究201、302和303)中受试者在第一个也是唯一一个疗程后观察到的反应。
表86:在第一疗程后,第一和第二疗程均接受CCH治疗的患者(有效群体)CR-PCSS评分从基线起的变化
表87:在第二疗程后,第一和第二疗程均接受CCH治疗的患者(有效群体)CR-PCSS评分从基线起的变化
(c)再治疗/再给药的受试者Hexsel CSS总分、I-GAIS, S-GAIS,受试者对EFP治疗满意程度量表的变化:在再暴露的受试者中,使用Hexsel CSS评价CCH再减少脂肪团严重程度方面的有效性,使用调查员(I-GAIS)和受试者(S-GAIS)评价美感外观方面的改善,并且,使用受试者对EFP治疗的满意度量表评价。通过这些量表评价治疗后的有效性与未经治疗的患者以及再暴露患者治疗后效果相似,这一结论支持了对受试者进行再给药或者再暴露缺乏对CCH的耐受或快速反应。
I.安全性评价
CCH的安全性曲线与先前研究的安全性结果一致。在研究期间,联合用药没有临床意义的变化。在研究期间,血清化学参数、血液学参数、尿液分析结果或生命体征的平均变化与基线相比没有观察到有临床意义的变化趋势。在具有抗-AUX-I和抗-AUX-II 抗体的受试者或具有中和抗体的受试者中没有临床相关的发现。
J.结果和结论总结
在研究201的可评估2级复合应答者中观察到应答的持久性 (缺乏完全丧失)。CCH治疗区域没有受试者恢复到基线 CR-PCSS和PR-PCSS水平或更差。在以下过程中观察到持久的反应:
·分别在第180天和第360天对19名(100%)和16名 (100%)可评估双盲受试者进行观察。
·在第540天和第720天,7名(100%)可评估的双盲受试者进入长期耐用性阶段。
·在180天和360天分别对26名(100%)和21名(100%) 可评估的开放标签治疗受试者进行治疗。
研究-201中可评估的1级复合反应者证明了反应的持久性 (缺乏完全损失)。在以下过程中观察到持久的反应:
·分别在180天和360天对50名(94.3%)和43名(95.6%) 可评估双盲受试者进行观察。
·在540天和720天分别有22名(95.6%)和21名(91.3%) 可评估双盲治疗受试者的长期耐久性阶段。
·分别在第180天和第360天对124名(100%)和114名 (100%)可评价的开放标签治疗受试者进行治疗。
在所有来自研究201的2-级CR-PCSS积极应答者中,以下期间维持2-级反应:
·在第360天对10名(47.6%)可评价的双盲受试者进行观察阶段。
·在第540天和第720天,分别有3名(30%)和4名(40%) 可评估的双盲受试者进入长期耐用性阶段。
·在第180天和第360天,32名(62.7%)和26名(56.5%) 可评价的开放标签治疗受试者处于治疗阶段。
在1-级CR-PCSS积极应答者中,以下期间维持1-级反应:
·第360天有38(84.4)位双盲治疗的受试者处于观察阶段。
·在第540天,19名(82.6%)双盲受试者处于长期耐用性阶段,在第720天,16名(69.6%)双盲受试者处于长期耐用性阶段。
·在第180天和第360天,109名(87.9%)可评价的开放标签治疗受试者和96名(84.2%)开放标签治疗受试者处于治疗阶段。
在所有来自研究201的2-级PR-PCSS积极应答者中,以下期间维持2-级反应:
·在第180天和360天分别对10名(31.3%)和14名(48.3%) 可评价的双盲受试者进行观察阶段。
·在540天和720天,7名(53.8%)可评价的双盲受试者进入长期耐用性阶段。
·在第180天和第360天,分别有33名(66.7%)和24名 (54.5%)可评价的开放标签治疗受试者处于治疗阶段。
在201研究的1级PR-PCSS积极应答者中,1级应答在以下期间维持:
·在180天和360天分别对40名(75.5%)和35名(77.8%) 可评价双盲受试者进行观察。
·在第180天和第360天,分别有19名(82.6%)和20名 (87.0%)可评价的双盲受试者进入长期耐用性阶段。
·分别在第180天和第360天对103名(83.1%)和92名 (80.7%)可评价的开放标签治疗受试者进行治疗阶段。
在观察阶段、长期持久性阶段和治疗阶段,还观察了2级和 1级CR-PCSS和2级和1级PR-PCSS应答者以及201研究应答者的应答持久性。
在观察阶段观察到第360天的CR-PCSS评分下降约1级,在接受疗程1和疗程2的治疗阶段,双盲和开放标签治疗受试者的CR-PCSS评分下降约1级。在再治疗和再给药的受试者中观察到类似的效果;在第二次CCH治疗后的治疗观察第360天(受试者再暴露与治疗初期),CR-PCSS评分的变化为-0.9(0.77)。
在观察阶段观察到第360天的PR-PCSS评分下降约1级,在接受疗程1和疗程2的治疗阶段,双盲和开放标签治疗受试者的 PR-PCSS评分下降约1级。在观察第360天再给药和再治疗的受试者中观察到类似的效果,在第二次CCH治疗后,CCH(受试者再暴露与治疗初期)PR-PCSS评分中的平均值(SD)变化为-1.0 (0.83)。
在观察阶段、长期耐受性阶段和治疗阶段(第一治疗过程和第二治疗过程)中,使用Hexsel CSS、I-GAIS、S-GAIS和受试者对EFP治疗的满意度量表来观察CCH在降低脂肪团严重程度的效果。CCH治疗后这些量表上的变化幅度在再治疗和再给药受试者与治疗初期受试者之间具有可比性。
·在以下期间进行Hexsel CSS总分评价:
-观察阶段,在CCH治疗的受试者中,在观察访视第360 天时,Hexsel CSS总分相比第71天基线水平的变化为-2.2(2.34),相比之下,在安慰剂治疗的受试者中,Hexsel CSS总分的变化为 -1.2(1.47)。
-长期耐久性阶段,第540天与基线相比的变化(研究 201)为-1.0(0.83),第720天为-2.9(1.74)。
-治疗阶段,在再治疗或者再给药的受试者中,在第360 天与基线起的变化(研究202)。
·在以下期间通过观察员进行I-GAIS评价:
-观察阶段,半数以上(64.9%)的CCH治疗受试者的皮下脂肪团使用I-GAIS被被调查者评价为非常显著改善 (4.1%),显著的改善(23.7%),或改善(37.1%)。
-治疗阶段,在疗程1的第360天,约四分之三(73.2%) 的受试者的脂肪团被评估为改善(81名受试者;49.4%),显著改善(32名受试者;19.5%),或非常显著的改善(7名受试者; 4.3%)。
-治疗阶段,在第2个疗程的第360天,超过一半(64.2%) 的受试者总体上被评估为改善(24名受试者;35.8%),显著改善(16名受试者;23.9%),或非常显著的改善(3名受试者; 4.5%)。
-治疗阶段,在第360天,接受第二次CCH治疗的受试者中,超过三分之二(71.8%)的再治疗和再给药的受试者的脂肪团被评估为改善64(45.1%),显著的改善33(23.2%),或非常显著的改善5(3.5%)。
·在以下期间通过受试者进行S-GAIS评价:
-观察阶段,超过三分之二(69.1%)的CCH治疗受试者的脂肪团评估为改善(46名受试者;47.4%)、显著改善(18 名受试者;18.6%)或非常显著d额改善(3名受试者;3.1%)。
-在治疗阶段,在疗程1的第360天,超过三分之二 (66.2%)的受试者评估其脂肪团改善(73名受试者;44.8%)、显著改善(18名受试者;11%)或非常显著的改善(17名受试者,10.4%)。
-在治疗阶段的第360天,在第2个疗程中,约有一半 (51.5%)的受试者评估其脂肪团改善(24名受试者;35.3%)、显著改善(6名受试者;8.8%)或非常显著的改善(5名受试者; 7.4%)。
-在第360天接受第二次CCH治疗的受试者的治疗阶段,超过一半(64.4%)的受试者评估其脂肪团改善(64名受试者;44.8%),显著改善(14名受试者;9.8%),或非常显著的改善16名(11.2%)。
·在以下期间受试者对EFP治疗的满意度量表:
-观察阶段,在第360天,41名(42.3%)和14名(14.4%) 接受CCH治疗的受试者对治疗表示满意或非常满意。
-在治疗阶段,治疗过程1第360天、观察第360天, 55名(33.7%)受试者对治疗效果满意,26名(16.0%)受试者对治疗非常满意。
-在治疗阶段,第2疗程第360天,观察第360天,21 名(30.9%)受试者对治疗满意,10名(14.7%)受试者对治疗非常满意。
-在治疗阶段,接受第二次CCH治疗的受试者中,50 (35%)受试者对治疗满意,25(17.5%)受试者对治疗非常满意。
这项研究的数据表明,在193名受试者中,CCH 0.84mg/治疗区域×3个疗程的持续作用长达1年。在CCH治疗后的2年评估中取样的受试者中,效果的持续性也得到了证实。研究结果还表明,向臀部或者大腿的每个治疗区域皮下注射0.84mg CCH,每次治疗×间隔21天的3个治疗疗程对未成年受试者和重新治疗的受试者都是有效的。研究人员和受试者评定量表等多种工具均显示脂肪团严重程度降低。臀部和大腿治疗区域的疗效评估结果相似。
162名受试者再次接受CCH第二疗程,每个治疗区域0.84mg ×3次治疗疗程,并评估其疗效,未观察到对治疗的耐受性(即治疗效果无损失)。研究202的结果支持了这一点,在第二个治疗过程后162名受试者的反应和关键阶段3研究中观察到的反应,CR-PCSS和PR-PCSS上观察到的减少情况相似。
本研究的结果表明,持续性的效果可以维持一年,如 PR-PCSS和CR-PCSS评级从基线起的变化,以及PR-PCSS和 CR-PCSS的持续性反应证明效果的持续性长达1年。研究结果也支持1级和2级复合反应持续2年。
在研究202中,再次暴露于CCH的受试者(即,再次治疗或再次给药)在其第二个疗程后,CR-PCSS和PR-PCSS上的脂肪团严重程度降低,其降低幅度类似于这些受试者在接受治疗后第一疗程和双盲研究(研究201,302和303)中观察到的反应。
在研究的观察、长期持久性和治疗阶段,可评估受试者对CCH反应的持久性得到了证实。在研究201中的2级复合反应者中,所有可评价的受试者都保持了反应的持久性,即在第180天和第360天,没有人恢复到基线CR-PCSS和PR-PCSS水平。在研究201中的1级复合反应者中,几乎所有受试者在第180天和第360天都保持了持久的治疗反应。在本研究治疗的受试者中也观察到了类似的结果;所有可评价的受试者在第180天和第360 天都保持了持久的反应。
在可评估的2级和1级复合应答者、CR-PCSS应答者和 PR-PCSS应答者中显示了研究201中从基线分数开始的长达2年的长期耐用性。根据Hexsel CSS总分、I-GAIS、S-GAIS和受试者对EFP治疗分数的满意度评分可以确定从基线开始,CCH对 201研究中的脂肪团严重程度的影响维持到至少1年。
在本研究中,每个治疗区域0.84mg CCH的有效性在未接受治疗的受试者和再次暴露(再次治疗/再次给药)的受试者中进行了评估。通过CR-PCSS、PR-PCSS、Hexsel CSS总分、I-GAIS、S-GAIS和受试者对EFP治疗分数的满意度评估的有效性测量结果与观察人群的结果一致,并证明无论是由研究者还是受试者评估,脂肪团严重程度均有改善。同样的结果也出现在再治疗和再给药的受试者中。值得注意的是,在选择接受第二次剂量的受试者中,很少有受试者退出治疗,大多数受试者重新接受了治疗。
在对CCH进行2阶段长期、开放标签、多中心研究的总体结果进一步证明CCH在治疗EFP过程中的安全性、耐受性、功效和长期持续性。
这里公开的实施方法只起到示例性作用,本领域普通技术人员应该理解在不脱离本发明所附权利要求所保护范围的情况下,可以进行多种变化和修饰。
- 用于治疗皮下脂肪团的组合物和方法
- 用于治疗肝硬化的配体结合的金团簇,组合物和方法
