一种脱色及污水COD去除的肺形侧耳菌株及其应用
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及生物技术领域,特别是涉及一种脱色及污水COD去除的肺形侧耳菌株及其应用。
背景技术
从20世纪起真菌的降解能力被发现,首次报道了黄孢原毛平革菌(Phanerochaetechrysosporium)能够分泌木质素降解酶。1983年Ming Tie等人证实了其能够依靠木质素降解酶或是木质素修饰酶来降解木质素,研究发现这些酶属于胞外酶,能够分泌到细胞体外或吸附在细胞壁上,黄孢原毛平革菌通过这些胞外酶的作用,对木质素、纤维素以及半纤维素进行降解。1985年Bumpus等首次发现黄孢原毛平革菌能通过木质素降解酶将几种难降解有机污染物无机化。黄孢原毛平革菌首先被美国农业部林产品实验室和美国北卡罗莱纳州立大学的真菌脱色研究组采用。1982年开发了一种特殊的处理技术,实验结果表明:废水的颜色大于1万倍时,脱色是一级反应,大于1万倍时,废水色度是零级反应。
Chang等人将在1987年使用黄孢原毛平革菌为处理纸浆和制浆造纸废水申请专利。1992年Sublett等将黄孢原毛平革菌固定在RBC上,对军火工业废水(红水)的降解能力进行了研究,实验结果表明,在间歇连续式运行条件下,模拟红水和真实红水均能得到有效的处理。
Lewandowsk等人在1990年利用了黄孢原毛平革菌处理2-氯酚废水,介绍了不同类型反应器的设计和工作状况,重点开发了PBB和完全混合的反应堆。首次发表黄孢原毛平革菌处理有害废水反应器的反应器设计的具体参数。Kapdan等在2002年建立了云芝(Trametes versicolor)的RBC反应器,研究了不同运行参数对含酞菁染料废水生物脱色的生物脱色效果。
国内研究对于黄孢原毛平革菌处理工业废水的研究起步较晚,2003年李慧蓉等建立了黄孢原毛平革菌对3种工业有机废水的降解反应体系。但目前仍亟需获得一种处理废水效果更好的菌株。
发明内容
本发明的目的是提供一种脱色及污水COD去除的肺形侧耳菌株及其应用,以解决上述现有技术存在的问题,本发明提供肺形侧耳RG-171可以实现对湿地污水的高效脱色和COD降解。
为实现上述目的,本发明提供了如下方案:
本发明提供一种肺形侧耳(Pleurotuspulmonarius)RG-171,所述肺形侧耳RG-171于2022年12月08日保藏在中国微生物菌种保藏管理委员会普通微生物中心;保藏单位地址:北京市朝阳区北辰西路1号院3号;保藏编号:CGMCC No.40366。
本发明还提供一种微生物菌剂,包含所述的肺形侧耳RG-171。
本发明还提供一种在处理湿地污水中的应用。
进一步的,所述应用为脱色和COD降解。
本发明还提供一种处理湿地污水的方法,包括将肺形侧耳RG-171或微生物菌剂接种于所述湿地污水中,进行脱色和COD降解的步骤。
进一步的,所述脱色和COD降解的时间为14d。
本发明还提供一种湿地污水处理剂,包含肺形侧耳RG-171或微生物菌剂。
本发明公开了以下技术效果:
(1)本发明中利用愈创木酚和苯胺蓝固体培养基进行了初步筛选后,以黄孢原毛平革菌作为对照,测定肺形侧耳RG-171对污水的脱色率和COD去除率,对肺形侧耳RG-171进行复筛,获得具有较强脱色及COD去除能力的肺形侧耳RG-171。将肺形侧耳RG-171接种于愈创木酚-PDA和苯胺蓝-PDA固体培养基上,测量显色圈/褪色圈直径,通过试验测定在愈创木酚-PDA测量显色圈直径59.37±0.74mm;而在苯胺蓝-PDA固体培养基测量褪色圈直径57.43±1.75mm。
(2)在14d内肺形侧耳RG-171脱色率和COD去除率较对照黄孢原毛平革菌分别高3.37%和116.46%。
(3)肺形侧耳RG-171在添加20%湿地污水的第10天达到酶峰,酶活峰值为64.32U/L,脱色率第14天达到74.43%,COD去除率第14天达到79.85%。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为基于ITS序列构建CGMCC40366及其相关种的系统发育树;
图2为吸附实验脱色率变化;
图3为吸附实验COD去除率变化;
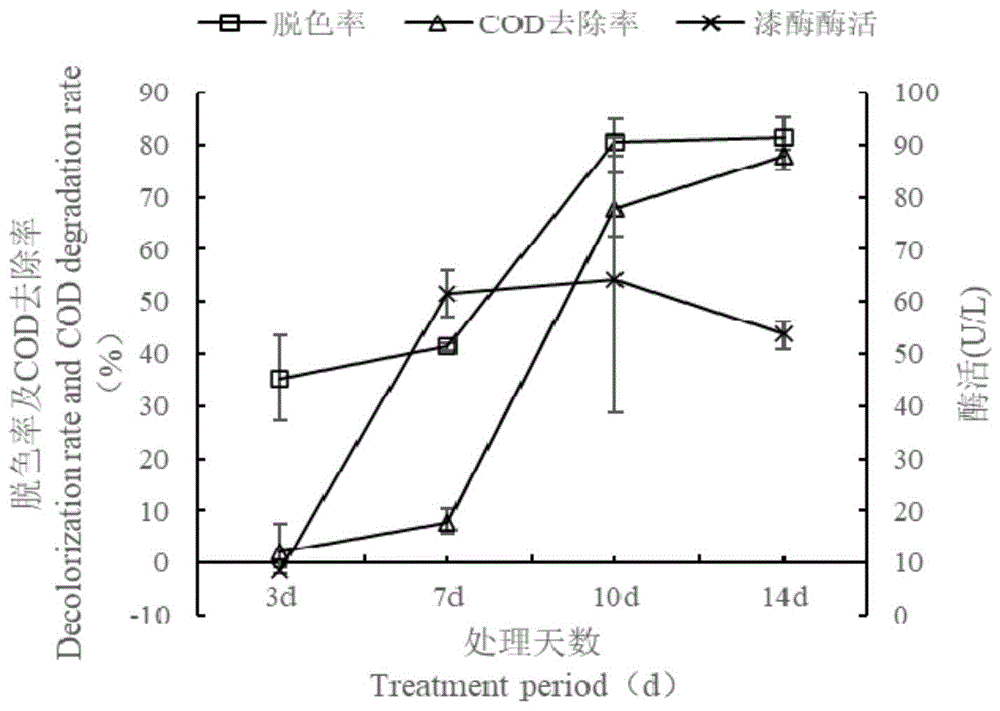
图4为肺形侧耳RG-171降解过程中漆酶活力及脱色率、COD去除率的变化。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
以下实施例中所用的污水样品为湿地污水,采集自兴凯湖国家级自然保护区湿地公园,指标:水样颜色为橙,深色,浑浊,pH为8.3,色度200倍,COD为2375.65±73.15mg/L。
以下实施例中所用各个培养基的组分:
愈创木酚-PDA固体培养基:200g马铃薯提取液,琼脂20g,葡萄糖20g,愈创木酚0.4mL,加水定容到1L,121℃灭菌3min。
苯胺蓝-PDA固体培养基:200g马铃薯提取液,琼脂20g,葡萄糖20g,苯胺蓝0.1g,加水定容到1L,121℃灭菌30min。
菌株活化培养基:葡萄糖20g,琼脂20g,酵母浸粉5.0g,KH
含湿地污水的液体培养基:污水样品100mL,葡萄糖20.0g,酵母浸粉5.0g,KH
实施例1利用愈创木酚和苯胺蓝固体培养基进行初步筛选
将24株采自东北地区的真菌(其中包括部分食用菌)菌株分别接种于愈创木酚-PDA固体培养基、苯胺蓝-PDA固体培养基中,25℃培养7d,通过十字划线法,测量培养皿中的菌丝直径、显色圈直径和褪色圈直径,计算菌丝直径与显色圈、褪色圈直径的比值,每个菌株设置3个重复。选择漆酶或过氧化物酶活性较高的菌株用于后续试验。所有数据处理均使用SPSS 24.0及Microsoft Excel软件进行处理、分析,数据通过单因素方差分析(ANOVA)、LSD检验,总体方差(P<0.05)存在显著差异。最终结果如表1、表2所示。通过试验发现菌株RG-171的愈创木酚-PDA固体培养基中显色圈直径为59.37±0.74mm,苯胺蓝-PDA固体培养基中显色圈直径为57.43±1.75mm。
表1愈创木酚平板显色结果
表2苯胺蓝平板褪色结果
实施例2测定菌株对污水的脱色率和COD去除率进行复筛
将20mL的液体培养基加入到100mL离心管中,移出2mL液体后,补加2mL的湿地污水,湿地污水占混合液总体积的10%,灭菌,将活化后的菌株使用无菌打孔器从平板上取2片直径为1cm的菌片,接种于含湿地污水的液体培养基中,25℃,150r/min振荡培养15d,每个处理设3个平行样。投加湿地污水当天为第0天,测定COD,取3个平行样的平均值和标准差作为最终结果。
以黄孢原毛平革菌(Phanerochaete chrysosporium)CGMCC 5.0776为对照,利用上述筛选出的20株菌株再次活化后,接种于含湿地污水的液体培养基,观察记录14d内菌株的生长情况,测定在14d时其COD值及污水色度变化情况,计算污水COD去除率及脱色率。结果见表3,结果表明,菌株RG-171的COD去除率达到79.85%,较对照高3.37%;脱色率达到65.89%,较对照高116.46%,具有较强脱色能力。
表3复筛菌株COD去除率、脱色率
注:同列数值后不同小写字母表示在P<0.05水平上差异显著。
形态学鉴定:
子实体形态为菌盖宽4.5~6.5cm,菌盖为扇形,成熟子实体盖缘开裂成瓣状,灰白色或黄褐色,表面平滑;菌肉肉质,白色至乳白色;菌褶延生,中等密度,不等长;菌柄长1.5~2.2cm,直径0.7~0.9cm,侧生,实心,基部被绒毛。观察菌株RG-171在培养基上的生长情况,在接种第5d时,可长满培养基表面,长速较快,菌丝较浓密。
分子生物学鉴定:
基于ITS序列利用最大似然法、贝叶斯法构建系统发育树,如图1所示。系统发育树结果表明,菌株RG-171与来自日本和瑞典的2株肺形侧耳Pleurotuspulmonarius菌株聚在了一个分支,支持率ML/BI为80/0.859。结合传统形态学和分子生物学对菌株RG-171进行鉴定为肺形侧耳Pleurotuspulmonarius。
保藏证明:
菌株RG-171已于2022年12月08日保藏在中国微生物菌种保藏管理委员会普通微生物中心;保藏单位地址:北京市朝阳区北辰西路1号院3号;保藏编号:CGMCCNo.40366。
实施例3子实体对污水的吸附实验
将4℃保存的RG-171子实体于121℃下灭菌30min,得到灭菌子实体。用未灭菌的子实体作为对照,用装有含湿地污水的液体培养基中分别加入同等生物量的子实体。25℃,150r/min振荡培养14d,每个处理设3个平行样.投加污水当天为第0天,分别在第3d、7d、10d和14d时取样进行检测。测定COD值及色度,取3个平行样的平均值和标准差作为最终结果。观察记录14d内菌株的生长情况及污水培养基的脱色情况,计算污水培养基脱色率和COD去除率,取3个平行样的平均值和标准差作为最终结果,结果如图1、图2所示。
经过14d的吸附实验,菌株RG-171灭活子实体脱色率在第14d达到最大值45.83%,COD去除率是在第10d达到最大值29.79%,14d内灭活子实体的脱色率和COD去除率分别在20%~40%和10%~30%之间波动,都维持在较低水平,而对于未灭活的子实体脱色率在第10d达到最大值63.78%,COD去除率是在第14d达到最大值75.04%,7d之后均显著高于灭活子实体。
实施例4不同污水投加量的降解实验
RG-171菌株的液体培养液的制备步骤:
将RG-171菌株活化,待菌丝长满平板后,用打孔器取直径为0.5cm大小的菌块,接种至液体培养基中,25℃、150r/min振荡培养7d,形成大小一致的菌球备用。
以RG-171菌株的液体培养液为基础,于液体培养液中的锥形瓶中分别移出1、2、3、4和5mL液体后,补加相对应体积的湿地污水,混合液总体积为20mL,废水占混合液总体积的5%、10%、15%、20%和25%,25℃,150r/min振荡培养14d,每个处理设3个平行样。投加湿地污水当天为第0天,分别在第3d、7d、10d和14d时取样进行检测。测定COD值及色度,取3个平行样的平均值和标准差作为最终结果。菌株RG-171在添加4mL污水第14d时脱色率最高,达到74.43%;在添加4mL污水第14d时,COD去除率最高,达到74.00%。
实施例5降解过程中漆酶活力变化实验
液体培养基培养的RG-171菌株为基础(制备方法同实施例4),投加湿地污水当天为第0天,振荡培养14d,分别在第2d、4d、6d、8d、10d和14d时取样并制备粗酶液进行检测。测定漆酶活性、COD值及色度,最终的菌丝体及发酵液4℃、12000rpm条件下离心30min过滤后所得上清液用于后续降解产物分析,所剩菌丝体测定其生物量,取3个平行样的平均值和标准差作为最终结果。
降解过程中漆酶活力及脱色率、COD去除率的变化见图2。如图所示,在菌株生长过程中随着时间的进行,酶活逐渐升高。采用试剂盒(苏州科铭生物技术有限公司)对提取出的漆酶活性进行测定。漆酶活力单位的定义(U):在波长420nm下,每分钟将1μmolABTS底物氧化所需的酶量。
菌株RG-171在第10天达到酶峰,酶活峰值为64.32U/L,之后酶活趋于稳定或略有下降。脱色率、COD去除率在第7天或第10d达到较高水平,之后趋于稳定或略有上升。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
