一种CRISPR/Cas9纳米系统
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及生物领域,具体地,本发明涉及一种CRISPR/Cas9纳米系统。
背景技术
CRISPR(聚簇成规则间隔短回文重复序列)/Cas9作为一种新兴的基因组编辑技术,具有设计简单、特异性强、效率高等优点,为基因组定向改造调控和应用带来了突破性的进展,在生物医学中展现出广阔的应用前景。但是如何解决生物安全性问题,及在体内中实现蛋白/核酸复合体的高效递送,降低脱靶率,是当前CRISPR/Cas9递送系统亟待解决的重要科学问题。
CRISPR/Cas9系统的特点是体积大、易降解。在没有相应递送工具的帮助下,无论是以DNA、 mRNA还是蛋白质的形式几乎都无法进入哺乳动物细胞。尽管病毒载体具有较高的递送效率,但存在生物安全问题,这阻碍了其广泛应用。近年来,已经报道了多种非病毒递送方法,但是它们不适用于体内应用及全身系统性使用,或不具备细胞核靶向。这些载体可以将Cas9蛋白和sgRNA传递到目标区域,但是也可以将基因编辑材料。
目前CRISPR/Cas9递送系统设计中,sgRNA的设计和载体材料的选择、设计以及刺激响应开关的设计都存在诸多问题。因此需要设计出高效的sgRNA、并且靶向运输到肿瘤细胞。就递送载体而言CRISPR/Cas9递送系统载体目前主要以病毒载体为主,但是病毒载体存在着一定的安全性问题。同时,在刺激响应开关设计中,在CRISPR/Cas9系统有效进入细胞后,如何避免胞质的降解、如何进行溶酶体逃逸、如何高效释放相应的Cas9/sgRNA复合物并高效入核是决定最后能否高效敲除目标基因的关键。
因此,本领域需要开发一种高效递送的CRISPR/Cas9纳米系统。
发明内容
本发明的目的在于提供一种安全性高和高效递送的CRISPR/Cas9纳米系统。
为实现上述目的,本申请采取的技术方案是:
本发明第一方面提供一种CRISPR/Cas9纳米系统,所述的CRISPR/Cas9纳米系统包括载体、声敏剂和CRISPR/Cas9系统;
所述的载体负载声敏剂和CRISPR/Cas9系统。
优选地,所述的声敏剂包括血卟啉单甲醚。
本发明第二方面提供一种制备如本发明第一方面所述的CRISPR/Cas9纳米系统的方法,所述的方法包括:
(1)将声敏剂、2-甲基咪唑和硝酸锌混合搅拌,离心,洗涤,得到MH;
(2)将MH和CRISPR/Cas9系统孵化,得到CRISPR/Cas9纳米系统。
优选地,MH与CRISPR/Cas9系统的质量比为3-5:1,较佳地3.5-4.5:1。
优选地,所述的方法包括步骤:
(1)2-甲基咪唑1.8-2.0g和硝酸锌1.2-1.4g分别溶于18-22ml甲醇中,得到2-甲基咪唑溶液和硝酸锌溶液。
(2)在室温机械搅拌下,将血卟啉单甲醚(190-210μL,1.8-2.2mg/mL)加入2-甲基咪唑溶液中,然后滴加硝酸锌溶液,在室温下搅拌,离心,洗涤,得到了MH。
(3)将MH和CRISPR/Cas9系统孵化,得到CRISPR/Cas9纳米系统。
本发明第三方面提供一种益生菌CRISPR/Cas9纳米系统,所述的益生菌CRISPR/Cas9纳米系统包括乳酸菌和如本发明第一方面所述的CRISPR/Cas9纳米系统。
优选地,所述的益生菌CRISPR/Cas9纳米系统包括自驱动益生菌CRISPR/Cas9纳米系统。
优选地,所述的乳酸菌负载CRISPR/Cas9纳米系统。
优选地,所述的乳酸菌包括鼠李糖乳杆菌。
本发明第四方面提供一种制备如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统的方法,所述的方法包括:
(a)将CRISPR/Cas9纳米系统与乳酸菌混合搅拌,得到益生菌CRISPR/Cas9纳米系统。
优选地,所述的乳酸菌的数量为0.5×107CFU至1.5×107CFU,较佳地0.8×107CFU至1.2×107 CFU。
优选地,所述的CRISPR/Cas9纳米系统的质量为0.8-1.2mg。
优选地,所述的搅拌温度为室温。
本发明第五方面提供一种如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统的用途,用于制备组合物,所述的组合物用于基因编辑。
优选地,所述的组合物为药物组合物或试剂组合物
优选地,所述的组合物还包括药学上、试剂上可接受的载体。
优选地,所述的组合物的剂型为固体制剂、液体制剂或半固体制剂。
优选地,所述的组合物的剂型为口服制剂、外用制剂或注射制剂
优选地,所述的组合物的剂型为片剂、注射剂、输液剂、膏剂、凝胶剂、溶液剂、微球或膜剂。
优选地,所述的注射制剂为静脉注射制剂。
优选地,在施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统后,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
本发明第六方面提供一种组合物,所述的组合物包括如本发明第一方面所述的CRISPR/Cas9 纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统。
优选地,所述的组合物为药物组合物或试剂组合物
优选地,所述的组合物还包括药学上、试剂上可接受的载体。
优选地,所述的组合物的剂型为固体制剂、液体制剂或半固体制剂。
优选地,所述的组合物的剂型为口服制剂、外用制剂或注射制剂
优选地,所述的组合物的剂型为片剂、注射剂、输液剂、膏剂、凝胶剂、溶液剂、微球或膜剂。
优选地,所述的注射制剂为静脉注射制剂。
本发明第七方面提供一种对细胞进行基因编辑的方法,将如本发明第一方面所述的 CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统与细胞接触,从而对细胞进行基因编辑。
优选地,所述的方法为体外方法。
优选地,所述的方法为非诊断性和非治疗性方法。
优选地,所述的接触为体外接触。
优选地,所述的接触包括在超声辐照下接触。
优选地,在施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统后,对细胞进行超声辐照处理。
本发明第八方面提供一种基因编辑的方法,所述的方法包括:给所需对象施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统,从而进行基因编辑。
优选地,所述的对象包括人或非人哺乳动物。
优选地,所述的非人哺乳动物包括牛、马、羊、狗、猫或鼠。
优选地,所述的施用为口服施用或注射施用。
优选地,所述的注射施用为静脉注射施用。
优选地,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
优选地,在施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统后,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
本发明第九方面提供一种超声仪的用途,用于制备设备,所述的设备用于选自下组的一种或多种用途:
(i)通过超声辐照改善如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统被细胞溶酶体的滞留和/或降解;和/或
(ii)通过超声辐照提高如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统的基因编辑效率。
优选地,所述的改善包括降低、克服或避免。
优选地,施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统后,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
本发明第十方面提供一种用于基因编辑的装置,所述的种装置包括如本发明第一方面所述的 CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统;和超声装置。
优选地,所述的系统或装置还包括说明书或标签,所述的说明书或标签记载:
给所需对象施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统后,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
在本发明范围内中,本发明的上述各技术特征和在下文中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。
附图说明
图1为自驱动益生菌CRISPR/Cas9纳米系统的制备,TEM检测。
图2为活体成像验证自驱动益生菌CRISPR/Cas9纳米系统的靶向能力。
图3为CLSM观察MHS纳米系统进行或不进行超声辐照孵育1或3小时后的亚细胞分布,其中,US为超声辐照处理。
图4为NGS测序检测目的基因IDO1突变率,超声可以明显提高MHS纳米系统的基因编辑效率,其中,US为超声辐照处理。
图5为CLSM检测目的蛋白IDO的表达,超声可以明显提高MHS纳米系统的基因编辑效率,降低蛋白IDO的表达量。其中,US为超声辐照处理。
图6为Western blot和CLSM检测该系统在超声作用下触发肿瘤免疫原性细胞死亡效果,(a)Western blot分析DAMPs(HMGB1,CRT和HSP70)后的特异性蛋白表达。(b-d)免疫荧光分析DAMPs后的特异性蛋白表达,包括HMGB1、CRT和HSP70,其中,US为超声辐照处理。
图7为流式及ELSA分析该体外免疫激活效果。(a)DC细胞体外成熟探索实验示意图。在上室, 4T1细胞不加任何处理,只加US,与MH、MH+US、MHS和MHS+US共孵育,在下室里培养 BMDCs。共培养24h后,收集BMDCs进行分析。(b)BMDCs上清分泌IL-12p70和IL-2。(c,d)各组处理后成熟BMDCs(CD80+CD86+CD11c+)的代表性流式细胞仪图和统计数据。其中,US为超声辐照处理。
图8为转录组测序显示LGG可以激活多条免疫相关的信号通路。(a、b)LGG处理前后基因变化的火山图和热图(P<0.05,|foldchange|≥2)。(c)LGG处理后差异基因表达谱的KEGG分析。
图9为LGG-MHS+US在体内对4T1肿瘤的作用。(a)体内原发性肿瘤治疗过程示意图。(b) PBS、LGG、MHS、LGG-MHS、MHS+US、LGG-MH+US、LGG-MHI+US、LGG-MHS+US 处理后4T1肿瘤生长曲线(n=5),其中,为了比较传统IDO小分子抑制剂与IDO1基因敲除疗效的优劣,在动物实验中添加了IDO抑制剂NLG919作为CRISPR的对照I指的是IDO抑制剂。(c)各组肿瘤平均生长曲线(n=5)。其中,US为超声辐照处理。
图10为效应记忆T细胞的流式细胞,其中,US为超声辐照处理。
具体实施方式
本发明开发了一种CRISPR/Cas9纳米系统,所述的CRISPR/Cas9纳米系统包括载体、声敏剂和CRISPR/Cas9系统,所述的载体负载声敏剂和CRISPR/Cas9系统,所述的CRISPR/Cas9纳米系统在超声辐照条件下具有优异的溶酶体逃逸能力,从而避免被溶酶体降解,增强基因编辑效率。本发明还开发了一种非病毒载体乳酸菌负载CRISPR/Cas9纳米系统用于基因编辑,具有安全性高,且可发挥优异的肿瘤靶向性和抗肿瘤效果。
术语
如本文所用,术语“包括”、“包含”与“含有”可互换使用,不仅包括开放式定义,还包括半封闭式、和封闭式定义。换言之,所述术语包括了“由……构成”、“基本上由……构成”。
CRISPR/Cas9纳米系统及其制备方法
本发明开发一种CRISPR/Cas9纳米系统,所述的CRISPR/Cas9纳米系统包括载体、声敏剂和 CRISPR/Cas9系统;
所述的载体负载声敏剂和CRISPR/Cas9系统。
在本发明的一个优选例中,所述的声敏剂包括(但不限于)血卟啉单甲醚。
本发明还提供一种制备本发明所述的CRISPR/Cas9纳米系统的方法,所述的方法包括:
(1)将声敏剂、2-甲基咪唑和硝酸锌混合搅拌,离心,洗涤,得到MH;
(2)将MH和CRISPR/Cas9系统孵化,得到CRISPR/Cas9纳米系统。
在本发明的一个优选例中,MH与CRISPR/Cas9系统的质量比为3-5:1,较佳地3.5-4.5:1。
代表性地,所述的方法包括步骤:
(1)2-甲基咪唑1.8-2.0g和硝酸锌1.2-1.4g分别溶于18-22ml甲醇中,得到2-甲基咪唑溶液和硝酸锌溶液。
(2)在室温机械搅拌下,将血卟啉单甲醚(190-210μL,1.8-2.2mg/mL)加入2-甲基咪唑溶液中,然后滴加硝酸锌溶液,在室温下搅拌,离心,洗涤,得到了MH。
(3)将MH和CRISPR/Cas9系统孵化,得到CRISPR/Cas9纳米系统。
益生菌CRISPR/Cas9纳米系统
本发明提供一种益生菌CRISPR/Cas9纳米系统,所述的益生菌CRISPR/Cas9纳米系统包括乳酸菌和本发明所述的CRISPR/Cas9纳米系统。
在本发明的一个优选例中,所述的益生菌CRISPR/Cas9纳米系统包括自驱动益生菌 CRISPR/Cas9纳米系统。
在本发明的一个优选例中,所述的乳酸菌负载CRISPR/Cas9纳米系统。
优选地,所述的乳酸菌包括鼠李糖乳杆菌。
本发明还提供一种制备本发明所述的益生菌CRISPR/Cas9纳米系统的方法,所述的方法包括:
(a)将CRISPR/Cas9纳米系统与乳酸菌混合搅拌,得到益生菌CRISPR/Cas9纳米系统。
优选地,所述的乳酸菌的数量为0.5×107CFU至1.5×107CFU,较佳地0.8×107CFU至1.2 ×107CFU。
优选地,所述的CRISPR/Cas9纳米系统的质量为0.8-1.2mg。
优选地,所述的搅拌温度为室温。
用途
本发明提供一种本发明所述的CRISPR/Cas9纳米系统或本发明所述的益生菌CRISPR/Cas9纳米系统的用途,用于制备组合物,所述的组合物用于基因编辑。
优选地,在施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统后,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
本发明提供一种超声仪的用途,用于制备设备,所述的设备用于选自下组的一种或多种用途:
(i)通过超声辐照改善本发明所述的CRISPR/Cas9纳米系统或本发明所述的益生菌 CRISPR/Cas9纳米系统被细胞溶酶体的滞留和/或降解;和/或
(ii)通过超声辐照提高本发明所述的CRISPR/Cas9纳米系统或本发明所述的益生菌 CRISPR/Cas9纳米系统的基因编辑效率。
优选地,所述的改善包括降低、克服或避免。
优选地,施用本发明所述的CRISPR/Cas9纳米系统或本发明所述的益生菌CRISPR/Cas9纳米系统后,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
方法
本发明提供一种对细胞进行基因编辑的方法,所述的方法包括:将本发明所述的CRISPR/Cas9 纳米系统或本发明所述的益生菌CRISPR/Cas9纳米系统与细胞接触,从而对细胞进行基因编辑。
在本发明的一个优选例中,所述的方法为体外方法。
在本发明的一个优选例中,所述的方法为非诊断性和非治疗性方法。
在本发明的一个优选例中,所述的接触为体外接触。
在本发明的一个优选例中,所述的接触包括在超声辐照下接触。
优选地,在施用如本发明第一方面所述的CRISPR/Cas9纳米系统或如本发明第三方面所述的益生菌CRISPR/Cas9纳米系统后,对细胞进行超声辐照处理。
本发明还提供一种基因编辑的方法,所述的方法包括:给所需对象施用本发明所述的 CRISPR/Cas9纳米系统或本发明所述的益生菌CRISPR/Cas9纳米系统,从而进行基因编辑。
在本发明的一个优选例中,所述的对象包括人或非人哺乳动物。
优选地,所述的非人哺乳动物包括牛、马、羊、狗、猫或鼠。
在本发明的一个优选例中,所述的施用为口服施用或注射施用。
优选地,所述的注射施用为静脉注射施用。
在本发明的一个优选例中,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
在本发明的一个优选例中,在施用如权利要求1所述的CRISPR/Cas9纳米系统或如权利要求3所述的益生菌CRISPR/Cas9纳米系统后,基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
装置
本发明提供一种用于基因编辑的装置,所述的种装置包括本发明所述的CRISPR/Cas9纳米系统或本发明所述的益生菌CRISPR/Cas9纳米系统;和超声装置。
优选地,所述的系统或装置还包括说明书或标签,所述的说明书或标签记载:
给所需对象施用本发明所述的CRISPR/Cas9纳米系统或本发明所述的益生菌CRISPR/Cas9纳米系统,对基因编辑的靶部位(如靶细胞、靶器官)进行超声辐照处理。
组合物
本发明所述的组合物优选为药物组合物或试剂组合物,本发明所述的组合物可以包括药学上或试剂上可接受的载体。
如本文所用“药学上可接受的载体”是指一种或多种相容性固体、半固体、液体或凝胶填料,它们适合于人体或动物使用,而且必须有足够的纯度和足够低的毒性。“相容性”是指药物组合物中的各组分和活性成分以及它们之间相互掺和,而不明显降低药效。
应理解,在本发明中,所述的药学上可接受的载体没有特别的限制,可选用本领域常用材料,或用常规方法制得,或从市场购买得到。药学上可接受的载体部分例子有纤维素及其衍生物(如甲基纤维素、乙基纤维素、羟丙甲基纤维素、羧甲基纤维素钠等)、明胶、滑石粉、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油、等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如吐温)、润湿剂(如十二烷基硫酸钠)、缓冲剂、螯合剂、增稠剂、pH调节剂、透皮促进剂、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、抑菌剂、无热原水等。
在本发明的一个优选例中,所述的组合物的剂型为固体制剂、液体制剂或半固体制剂。
在本发明的一个优选例中,所述的组合物的剂型为口服制剂、外用制剂或注射制剂
优选地,所述的组合物的剂型为片剂、注射剂、输液剂、膏剂、凝胶剂、溶液剂、微球或膜剂。
优选地,所述的注射制剂为静脉注射制剂。
药物制剂应与给药方式相匹配。本发明药物还可与其他协同治疗剂一起使用(包括之前、之中或之后使用)。使用药物组合物或制剂时,是将安全有效量的药物施用于所需对象(如人或非人哺乳动物),所述安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约8毫克/千克体重,较佳地该剂量是约10微克/千克体重-约1毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明的主要优异技术效果包括:
1.本发明开发了一种CRISPR/Cas9纳米系统,所述的CRISPR/Cas9纳米系统在超声辐照条件下具有优异的溶酶体逃逸能力,从而避免被溶酶体降解,增强基因编辑效率。
2.本发明开发了一种非病毒载体乳酸菌负载CRISPR/Cas9纳米系统用于基因编辑,具有安全性高,且可发挥优异的肿瘤靶向性和抗肿瘤效果。
下面结合具体实施例,进一步阐述本发明。应理解,以下具体实施例以本技术方案为前提,给出了详细的实施方式和具体操作过程,但本发明的保护范围并不限于本实施例。
实施例1
1.自驱动益生菌CRISPR/Cas9纳米系统(LGG-MHS)的制备
(1)2-甲基咪唑(1.910克)和硝酸锌(1.314克)分别溶于甲醇(20毫升)中,得到2-甲基咪唑溶液和硝酸锌溶液。
(2)在室温机械搅拌下,将血卟啉单甲醚(HMME,200μL,2mg/mL)缓慢加入2-甲基咪唑溶液中,10分钟后,滴加硝酸锌溶液,在室温下搅拌24小时后,ddH2O洗涤三次后离心得到了 MH。
(3)将MH和CRISPR/Cas9系统(MH与CRISPR/Cas9系统的质量比为4:1)在37℃孵化,离心,用ddH2O洗涤三次以去除残留物,得到MHS纳米系统。
(4)将MHS与鼠李糖乳杆菌(LGG,乳杆菌属)(PBS=1mL,LGG=1×107CFU,MHS=1mg) 在PBS中进一步搅拌24小时,得到自驱动益生菌CRISPR/Cas9纳米系统(LGG-MHS),LGG-MHS 的透射电子显微镜(TEM)图如图1所示。
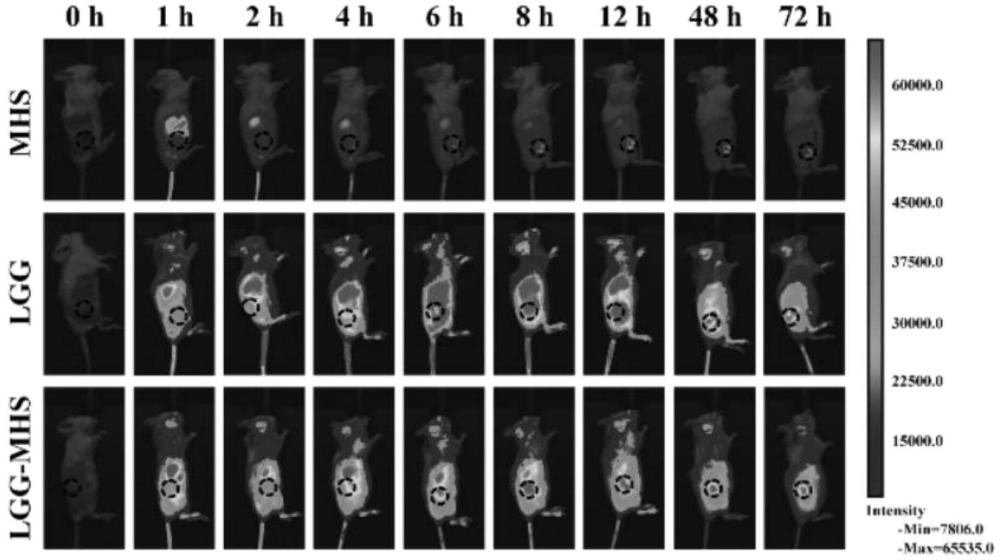
2.自驱动益生菌CRISPR/Cas9纳米系统(LGG-MHS)的靶向能力
建立9只4T1荷瘤小鼠模型,随机分为MHS组,LGG组和LGG-MHS组,在肿瘤体积达到200mm3左右时静脉注射Cy5.5标记的MHS(200μL,Cy5.5-MHS=10mg/kg,Cy5.5=10μ g/mL)、Cy5.5标记的LGG(200μL,Cy5.5-LGG=1×107CFU,Cy5.5=10mg/kg,Cy5.5=10μ g/mL)和Cy5.5标记的LGG-MHS(200μL,LGG=1×107CFU,Cy5.5-MHS=10mg/kg,Cy5.5= 10μg/mL)。在不同时间点(0、2、4、6、8、12、48、72h)麻醉小鼠,用VISQUE成像系统成像。
自驱动益生菌CRISPR/Cas9纳米系统(LGG-MHS)的靶向能力图2所示,从图2中可以看出, LGG-MHS具有优异的肿瘤靶向能力。
3.考察超声对CRISPR/Cas9纳米系统的控制能力
使用CLSM(ZEISSLSM900)观察对Cy5.5标记的MHS的溶酶体逃逸用于记录Cas9/sgRNA的细胞内分布。
将4T1细胞以1×105的密度预接种到CLSM特异性培养皿中,并孵育24小时以粘附在培养板上。然后,将4T1细胞与MHS纳米系统(100μg/mL)与超声辐照(1.0MHz,1.0W/cm2,50%占空比, 5分钟)或不进行超声辐照孵育1或3小时。DAPI(10μg/mL)和LysoTracker(0.5μg/mL)分别将细胞核染成蓝色和溶酶体绿色。
CLSM观察MHS纳米系统进行或不进行超声辐照孵育1或3小时后的亚细胞分布(如图3所示),从图3中可以看出,在超声刺激处理下,MHS纳米系统具有优异的溶酶体逃逸能力。
同时,进一步检测目的基因的编辑能力,4T1细胞在6孔板中培养24小时(每孔1×105个细胞),用不含血清的新培养基更换培养基,1小时后,将MH/MHS(100g/mL)添加到MH、MHS、 MH+US和MHS+US组的孔中。共孵育12h后,仅US组、MH+US组和MHS+US组接受US(超声辐照)照射(1.0MHz,1.0W/cm2,50%占空比,5分钟)。用2mL含有10%FBS的新鲜培养基替换培养基。然后对不同处理后的IDO1突变基因组进行分析。提取处理过的4T1细胞基因组DNA 用于PCR分析(n=3)。在纯化和收集PCR产物后进行深度测序.
NGS测序检测目的基因IDO1突变率图4所示,从图4中可以看出,超声能够显著提高MHS 纳米系统的基因编辑效率。
4.考察CRISPR/Cas9纳米系统敲除IDO1后免疫激活能力
CLSM检测IDO表达情况。将4T1癌细胞以1×105个细胞/培养皿的密度接种到CLSM特异性培养皿中,并培养过夜以进行细胞附着。用IFN-γ(1ng/mL)刺激细胞12小时,并对这些细胞进行不同的处理,包括对照、仅US、MH、MHS、MH+US和MHS+US(MH/MHS=100μg/mL,1.0MHz, 1.0W/cm2,50%占空比,5分钟)。用PBS洗涤3次后,将细胞与抗IDO抗体(CellSignalingTechnology86630)一起孵育1小时,并用AlexaFluor555-山羊抗兔IgG染色1小时。将细胞用DAPI染色20 分钟,并使用CLSM捕获细胞的荧光图像。从图5中可以看出,MHS纳米系统在超声照射下能够有效降低蛋白IDO的表达。
5.验证超声的免疫激活能力
体外免疫原性细胞死亡(ICD)的检测。为了确定CRISPR/Cas9纳米系统诱导的肿瘤细胞ICD,通过体外免疫荧光检测CRT的表面表达、HMGB1和HSP70的细胞外释放。通常,将4T1细胞(每孔1×105个细胞)接种在CLSM特异性培养皿中。然后,将细胞与PBS、仅US、MH、MHS、MH+US和MHS+US孵育6小时,然后在有或没有US辐照的情况下进行辐照(1.0MHz,1.0W/cm,50%占空比,5分钟)。进一步孵育12小时后,用PBS洗涤细胞3次,与HMGB1、HSP70和CRT 兔单克隆抗体孵育1小时,并用AlexaFluor488或555山羊抗兔IgG染色1小时。将细胞用DAPI 染色20分钟并使用CLSM观察。从6周大的Balb/c小鼠的骨髓中提取BMDC,以研究体外DC成熟。4T1细胞用PBS、仅US、MH、MHS、MH+US和MHS+US预处理12小时(MH/MHS=100 μg/mL1.0,US=MHz,1.0W/cm2,50%占空比,5分钟)。然后,将1×106个未成熟DC细胞与 1×105个预处理的4T1细胞在transwell系统中共培养24小时。收集细胞培养上清液。并用ELISA 试剂盒测定DC分泌的促炎细胞因子IL-2和IL-12p70。FCM用于检查用抗CD80-APC、抗CD86-PE 和抗CD11c-FITC抗体染色后DC细胞的成熟。
CLSM检测该系统在超声作用下触发肿瘤免疫原性细胞死亡效果如图6所示,从图6中可以看出,在超声刺激下,MHS纳米系统能够显著促进肿瘤免疫原性细胞死亡。
流式及ELSA分析该体外免疫激活效果如图7所示,从图7中可以看出,在超声刺激下,MHS 纳米系统能够显著促进免疫激活。
6.验证LGG的免疫激活能力
建立6只4T1荷瘤小鼠模型,随机分为LGG组和对照组,当肿瘤体积达到200mm3时,对肿瘤进行RNA测序(如图8所示),探讨LGG促进疗效的潜在生物学机制,从图8中可以看出,转录组测序显示LGG可以激活多条免疫相关的信号通路。
7.鸡尾酒疗法的联合治疗效果评估:
将4T1肿瘤细胞(1×106)注射到雌性Balb/c小鼠(~20g)的腋窝,建立异种移植肿瘤模型。将这些小鼠随机分为8组(n=5):对照(200μL,PBS)、LGG(200μL,LGG=1×107CFU)、MHS(200μL,MHS=10mg/kg)、LGG-MHS(200μL,LGG=1×107CFU,MHS= 10mg/kg),MHS+US(200μL,MHS=10mg/kg,US=1.0MHz,1.0W/cm2,50%占空比,5分钟),LGG-MH+US(200μL,LGG=1×107CFU,MH=10mg/kg,US=1.0MHz,1.0W/cm2, 50%占空比,5分钟),LGG-MHI+US(200μL,LGG=1×107CFU,MHI=10mg/kg,US=1.0MHz,1.0W/cm2,50%占空比,5min),LGG-MHS+US(200μL,LGG=1×107CFU,MHS=10 mg/kg,US=1.0MHz,1.0W/cm2,50%占空比,5分钟)。上述药物分别于第7、9、11、13天注射,应用超声治疗组分别于第8、10、12、14天进行超声照射。在第7-21天期间,每2天测量一次小鼠的肿瘤体积和体重。根据公式(肿瘤长度)×(肿瘤宽度)2/2计算肿瘤体积。免疫记忆效果:为了研究记忆T细胞,收集来自不同组小鼠的脾组织并用抗CD8-APC、抗CD3-FITC、抗CD44-PE和抗62LAPC-Cy7抗体染色。流式细胞仪用于分离和分析效应记忆T细胞(CD3+CD8+CD44+CD62L-,Tem和CD3+CD8+CD44+CD62L+,Tcm)。
不同治疗组的肿瘤生长曲线如图9所示,从图9中可以看出,超声刺激能够显著增强LGG-MHS的抗肿瘤效果。
效应记忆T细胞的流式细胞分析如图10所示,从图10中可以看出,LGG-MHS系统可以提高记忆性T细胞的比例,防止肿瘤的复发。
以上所述是本发明针对一种案例设计的实施方案,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下还可以作出若干改进,这些改进也应视为本发明的保护范围。
- 一种Cas9蛋白、CRISPR/Cas9系统、蘑菇基因编辑的方法及应用
- 一种使用CRISPR/Cas9治疗HPV阳性的宫颈上皮内瘤变的方法
- 一种磁性纳米材料介导的CRISPR/Cas9 T细胞内递送系统及其制备方法和应用
- 一种磁性纳米材料介导的CRISPR/Cas9 T细胞内递送系统及其制备方法和应用
