一种含巯基环糊精与螺旋藻的复合物及其制备方法与应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物技术领域,涉及一种含巯基环糊精与螺旋藻的复合物及其制备方法与应用。
背景技术
多酚的抗氧化功能对于慢性疾病(如阿尔兹海默症等)可起到预防作用,但因其被摄入后到达胃部易被胃酸、酶降解后失效难以靶向作用于肠道,且肠道中大量存在的活性氧(ROS)会将多酚氧化成醌失效,因而出现生物利用度低等情况。为解决上述问题,产生了基于胃肠道pH差异构建的递送载体以期实现多酚的肠靶向递送的研究。然而,该类载体在靶向释放前须经过较为缓慢的pH响应过程,易导致释放滞后。此外,也可通过体系与肠液中的电解质、离子发生非共价作用(氢键、静电作用等)实现肠靶向,但响应程度常因pH、温度、离子浓度等不同而变化,体系稳定性不可靠,甚至有些体系因带有正电荷易产生细胞毒性。因而构建一种体系稳定,可靠,高效的递送载体对于肠靶向药物与食品的吸收具有巨大意义。
螺旋藻是一种外径为3~5μm、表面含有14~16nm微孔的螺旋状蓝藻,其主要成分为叶绿素,具有绿色荧光,因其独特的结构、性能特征在活性因子递送领域表现出广阔的应用前景,例如[D.Zhong,D.Zhang,W.Chen,J.He,C.Ren,X.Zhang,N.Kong,W.Tao,M.Zhou.Orally deliverable strategy based on microalgal biomass for intestinaldisease treatment.Sci.Adv.,2021,7:eabi9265.]中将姜黄素装载至螺旋藻空腔内,制备了一种基于螺旋藻的多用途制剂,用于治疗结肠炎和结肠癌两种肠道疾病。
现有技术中仅有将营养素装载至螺旋藻空腔内的报道,并没有关于巯基环糊精与螺旋藻复配的复合物负载活性因子的相关研究,将活性因子负载于巯基环糊精与螺旋藻复配的复合物上,是否对肠靶向药物可以达到更好的递送效果,对于实现肠靶向药物与食物的高效递送具有重要的现实意义。
发明内容
为解决上述问题,本发明旨在构建一种耐胃酸、高效、稳定的活性因子肠靶向递送载体。
基于上述目的,本发明提供了一种含巯基环糊精与螺旋藻的复合物,基于静电相互作用,构建了一种可通过与肠绒毛缠绕的主动靶向和与肠黏液形成共价二硫键的被动靶向协同作用的巯基环糊精功能化螺旋藻复合物,制备原料包括巯基环糊精、螺旋藻和活性因子。
优选地,本发明所述制备原料中的活性因子为脂溶性多酚、药物或益生菌中的任一种。
更优选地,本发明所述制备原料中的活性因子为白藜芦醇,本发明所提供的含巯基环糊精与螺旋藻的复合物对白藜芦醇的总载药量为63.4%~78.3%。
基于上述制备原料,本发明提供的含巯基环糊精与螺旋藻的复合物中包含巯基环糊精-活性因子包合物(即巯基环糊精@活性因子包合物)与螺旋藻-活性因子复合物(即螺旋藻@活性因子复合物),以质量计,所述螺旋藻@活性因子复合物与巯基环糊精@活性因子包合物的配比为1:0.8~100。
优选地,以质量比计,所述螺旋藻@活性因子复合物与巯基环糊精@活性因子包合物的配比为1:10。
进一步地,以摩尔比计,所述巯基环糊精@活性因子包合物中巯基环糊精和活性因子的配比为1:0.5~5;以质量比计,所述螺旋藻@活性因子复合物中螺旋藻和活性因子的配比为1:0.005~0.02。
优选地,以摩尔比计,所述巯基环糊精@活性因子包合物中巯基环糊精和活性因子的配比为1:1;以质量比计,所述螺旋藻@活性因子复合物中螺旋藻和活性因子的配比为1:0.01。
更进一步地,本发明还提供了制备所述含巯基环糊精与螺旋藻的复合物的方法,包括:将活性因子分别负载于巯基环糊精与螺旋藻上得到巯基环糊精@活性因子包合物与螺旋藻@活性因子复合物;将所述螺旋藻@活性因子复合物分散至水中形成浓度为0.5mgmL
此外,本发明还提供了所述含巯基环糊精与螺旋藻的复合物在肠靶向型功能食品或肠靶向药物中的应用。
通过上述技术方案,结合实施例,本发明所提供含巯基环糊精与螺旋藻的复合物至少具有下述有益效果或优点:
1.本发明所提供的含巯基环糊精与螺旋藻的复合物对白藜芦醇的载药量63.4%~78.3%,显著高于巯基环糊精对白藜芦醇的载药量或螺旋藻对白藜芦醇的载药量。
2.本发明所提供的含巯基环糊精与螺旋藻的复合物对黏蛋白的表现出显著的吸附能力,黏附量达0.616±0.013mg。
3.本发明通过模拟所述含巯基环糊精与螺旋藻的复合物在胃、肠液中的释放行为,结果显示白藜芦醇在2h内释放量仅为9.51%±1.19%,伴随着环糊精和螺旋藻在肠道中逐渐被消化,复合物结构也被破坏,白藜芦醇快速释放,在第8h释放量达到91.12±2.98%,说明本发明所构建的巯基环糊精与螺旋藻的复合体系能保护营养素免于被胃酸破坏,实现活性因子稳定的肠靶向释放。
4.本发明将白藜芦醇负载至含巯基环糊精与螺旋藻的复合物后,由于复合物具有耐胃酸、协同肠靶向和肠道ROS清除的效果,在将白藜芦醇靶向递送至肠道后白藜芦醇生物利用度达到84.98%±2.45%,是游离白藜芦醇的2.12倍,表明本发明所述含巯基环糊精与螺旋藻的复合物能够显著提升白藜芦醇的生物利用度。
5.本发明通过对比消化前后所述含巯基环糊精与螺旋藻的复合物与游离白藜芦醇对·OH、·O
附图说明
图1为巯基环糊精、白藜芦醇的红外光谱图。
图2为螺旋藻、螺旋藻@白藜芦醇、巯基环糊精@白藜芦醇和含巯基环糊精与螺旋藻的复合物的红外光谱图。
图3为螺旋藻、白藜芦醇、巯基环糊精和含巯基环糊精与螺旋藻的复合物的Zeta电位图。
图4为螺旋藻、含巯基环糊精与螺旋藻的复合物的扫描电子显微镜图片,其中(a)为螺旋藻的扫描电子显微镜图片,(b)为含巯基环糊精与螺旋藻的复合物的扫描电子显微镜图片。
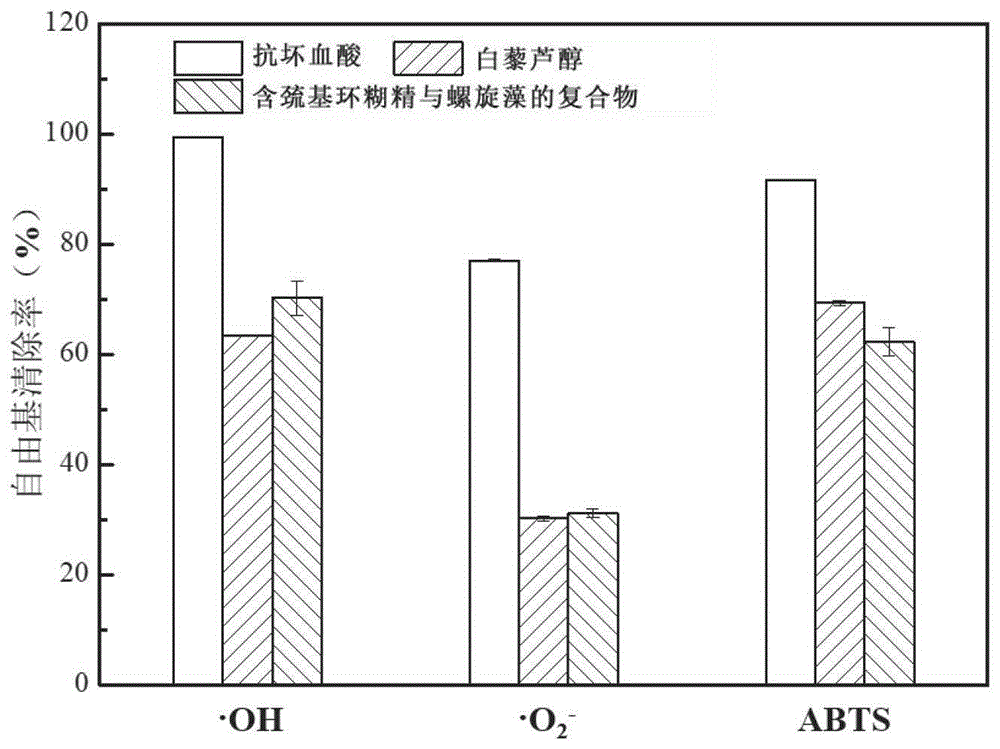
图5为消化前白藜芦醇和含巯基环糊精与螺旋藻的复合物对·OH、·O
图6为螺旋藻、巯基环糊精、含巯基环糊精与螺旋藻的复合物对黏蛋白的黏附效果图。
图7为含巯基环糊精与螺旋藻的复合物在模拟胃、肠液中的释放曲线。
图8为白藜芦醇、含巯基环糊精与螺旋藻的复合物的生物利用度。
图9为消化后白藜芦醇和含巯基环糊精与螺旋藻的复合物对·OH、·O
具体实施方式
下面,结合实施例对本发明的技术方案进行说明,但是,本发明并不限于下述的实施例。
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场获得的常规产品。
实施例1
本实施例提供了巯基化环糊精@白藜芦醇包合物、螺旋藻@白藜芦醇复合物及含巯基环糊精与螺旋藻的复合物的制备方法。
1.螺旋藻@白藜芦醇复合物的制备
本实施例中螺旋藻的培养及螺旋藻@白藜芦醇复合物的制备方法参照Orallydeliverable strategy based on microalgal biomass for intestinal diseasetreatment.ScienceAdvances,2021,7,eabi9265。
2.巯基环糊精@白藜芦醇包合物的制备
1)巯基环糊精的制备
将95mg巯基化半胱氨酸溶于10mL去离子水中,然后加入168mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和101mgN-羟基琥珀酰亚胺,室温下搅拌反应2h得到活化的N-乙酰半胱氨酸,之后加入5mL浓度为60mg mL
2)巯基环糊精@白藜芦醇包合物的制备
以摩尔比1:1称取白藜芦醇和巯基环糊精,将38mg白藜芦醇避光溶于10mL乙醇中,将333mg巯基环糊精溶于10mL去离子水中持续在45℃中搅拌,然后将白藜芦醇的乙醇溶液加入巯基环糊精的水溶液中,在45℃下持续搅拌4h,紧接着在4℃中保存12h,12h之后,将混合液在4500rpm下离心5min,所得沉淀物用50%乙醇洗涤三次以除去吸附在巯基环糊精表面的白藜芦醇,紧接着旋转蒸发除去沉淀物上的乙醇,冷冻干燥获得巯基环糊精@白藜芦醇包合物。
3.含巯基环糊精与螺旋藻的复合物的制备
将螺旋藻@白藜芦醇复合物分散在水中,得到螺旋藻@白藜芦醇复合物分散液,将巯基环糊精@白藜芦醇包合物溶于水中,得到巯基环糊精@白藜芦醇包合物水溶液,将上述螺旋藻@白藜芦醇复合物分散液与巯基环糊精@白藜芦醇包合物水溶液按体积比1:0.5~100混合,在20~37℃下,以转速100~500rpm搅拌1~48h得到含巯基环糊精与螺旋藻的复合物。
实施例2
本实施例分别对白藜芦醇以及实施例1所制备的螺旋藻、螺旋藻@白藜芦醇、巯基环糊精、巯基环糊精@白藜芦醇包合物与含巯基环糊精与螺旋藻的复合物进行了红外光谱分析。
经分析,白藜芦醇与巯基环糊精的红外光谱图如附图1所示,根据附图1,1597、1517和1433cm
螺旋藻、螺旋藻@白藜芦醇、巯基环糊精@白藜芦醇包合物与含巯基环糊精与螺旋藻的复合物的红外光谱图如附图2所示,根据附图2,螺旋藻的主要成分是叶绿素,其结构中羧酸羰基的特征振动峰出现在1725-1700cm
实施例3
本实施将白藜芦醇与实施例1所制备的螺旋藻、巯基环糊精及含巯基环糊精与螺旋藻的复合物以一定浓度分散至50%乙醇水溶液中,测定Zeta电位。
测定结果如附图3所示,经过Zeta电位仪检测发现,螺旋藻的Zeta电位为-28.6±0.81mV,白藜芦醇几乎不带电(2.25±0.03mV),巯基环糊精因含有氨基带正电荷(26.71±1.24mV),表现出与带负电的肠黏液和螺旋藻基于静电吸引结合的潜力;因此使荷正电的巯基环糊精@白藜芦醇和荷负电的螺旋藻结合后制得的巯基环糊精功能化螺旋藻几乎将两者所带的相反电荷抵消(4.14±1.42mV),可有效消除带正电荷的巯基环糊精的细胞毒性,也证明巯基环糊精@白藜芦醇和螺旋藻@白藜芦醇的成功结合。
实施例4
本实施例测定了实施例1所制备的巯基环糊精@白藜芦醇包合物、螺旋藻@白藜芦醇复合物及含巯基环糊精与螺旋藻的复合物的负载量和包封率。
首先配制白藜芦醇的标准溶液,测定白藜芦醇标准溶液在308nm处的紫外吸光度,拟合得到白藜芦醇的标准曲线:
C(mg mL
式中,C、A分别代表白藜芦醇标准溶液浓度及其对应的紫外吸光度。
将一定量的巯基环糊精@白藜芦醇包合物在乙醇中超声5min后持续搅拌2h,对于螺旋藻@白藜芦醇复合物与含巯基环糊精与螺旋藻的复合物,需先研碎然后分散至乙醇中伴随超声以萃取其中的白藜芦醇,取上清液4500rpm离心后再测上清液在308nm处的吸光度。根据式(1)、(2)计算巯基环糊精@白藜芦醇包合物、螺旋藻@白藜芦醇复合物和含巯基环糊精与螺旋藻的复合物的负载量和包封率。
据此计算,巯基环糊精对白藜芦醇的载药量和包封率分别为18.3%~24.1%和60.3%~88.4%,螺旋藻对白藜芦醇的载药量和包封率分别为36.1%~40.7%和80.7%~93.4%,含巯基环糊精与螺旋藻的复合物对白藜芦醇的总载药量为63.4%~78.3%。
实施例5
本实施例描述了实施例1所制备的螺旋藻与含巯基环糊精与螺旋藻的复合物的微观形貌表征。
在扫描电子显微镜下,螺旋藻呈外径为3~5μm的螺旋状结构,如附图4(a)所示,巯基环糊精可产生分子内、分子间氢键,且白藜芦醇为晶体,因此含巯基环糊精与螺旋藻的复合物会通过分子内氢键相互吸引从而呈现出排状刚性结构,如附图4(b)所示,其表面覆盖的巯基环糊精具有柔性结构,如附图4(b)所示,该结构中镶嵌的颗粒是由疏水的白藜芦醇团聚形成的。
实施例6
本实施例对比测试了游离白藜芦醇与实施例1所制备的含巯基环糊精与螺旋藻的复合物对·OH、·O
1.对·OH清除效率的评价
采用Fenton试剂法检测含巯基环糊精与螺旋藻的复合物对·OH的清除效果。将含巯基环糊精与螺旋藻的复合物配制成浓度为3mg mL-1的样品溶液。将9mM硫酸亚铁溶液(50μL)、9mM水杨酸-乙醇溶液(50μL)和样品溶液(50μL)置于96孔板中混合均匀后,加入50μL8.8mM过氧化氢溶液启动反应,在37℃下反应0.5h后测定其在510nm波长处的吸光度。该实验阳性对照组为抗坏血酸,空白对照组为蒸馏水,按式(3)计算样品对·OH的清除率。
式中,A
2.对·O
将含巯基环糊精与螺旋藻的复合物配制成浓度为2mg/mL的样品溶液。采用邻苯三酚法测定含巯基环糊精与螺旋藻的复合物对·O
其中,A
3.对ABTS的清除能力
将7mMABTS·水溶液与2.45mM过硫酸钾溶液等体积混合,避光时间保存12h以上,后将ABTS-过硫酸钾混合液用超纯水稀释,使其在734nm处的吸光度在0.2左右。另将含巯基环糊精与螺旋藻的复合物配制成浓度为2mg mL
其中,A
以游离白藜芦醇为对照样,分别进行上述的自由基清除实验,实验结果如附图5所示,白藜芦醇对于·OH、·O
实施例7
本实施例对比测试了实施例1所制备的螺旋藻、巯基环糊精以及含巯基环糊精与螺旋藻的复合物对黏蛋白的吸附性能。
将黏液蛋白溶于浓度为
0.5mg mL
测试结果如附图6所示,螺旋藻中几乎不含巯基化合物,仅凭借其中的多糖与黏蛋白之间微弱的氢键作用吸附黏蛋白,吸附量仅为0.05±0.001mg;巯基环糊精、含巯基环糊精与螺旋藻的复合物表现出显著的黏液粘附性能,黏附量分别为0.412±0.023mg、0.616±0.013mg,这归因于以下原因导致:(1)所含的游离羟基与黏液蛋白的官能团形成氢键。(2)复合物中的白藜芦醇与黏蛋白产生物理作用。(3)巯基环糊精和复合物中的巯基与黏蛋白中的巯基形成二硫键。(4)链纠缠、非共价相互作用如范德华力和离子相互作用。其中,含巯基环糊精与螺旋藻的复合物与黏蛋白的结合力之所以最强,除上述四个因素协同作用外,还有螺旋藻表面的多糖与黏蛋白之间的氢键作用对黏附作用的贡献。事实上,螺旋藻因其结构的特殊性可与肠绒毛的缠绕作用,因此,复合物实际的肠靶向效果要要更为优异。据此推断,复合物可以延长白藜芦醇在肠黏膜膜上的滞留时间,从而提高白藜芦醇的生物利用度。
实施例8
本实施例模拟了实施例1所制备的含巯基环糊精与螺旋藻的复合物在胃、肠液中的释放行为,对其释放性能进行评价。
本实施例以40mL的模拟胃液、肠液作为体外释放介质,将6mg含巯基环糊精与螺旋藻的复合物溶于0.5mL去离子水中,再将其移入透析袋、密封。首先将透析袋浸入pH 2.0PBS(人工胃液)中释放2h;然后将透析袋取出后再浸入pH 6.8PBS(人工肠液)中释放3h;最后在pH 7.4PBS(人工结肠液)中释放3h,测试过程中定期取样,每次取1mL样,并向释放体系中补充等体积的新鲜介质。释放结束后,向取出的样品中分别加入等体积乙醇,用紫外分光光度法测定308nm处的吸光度,按照式(6)计算各时间点对应的白藜芦醇累积释放量,并绘制释放曲线。
式中,m
释放曲线如附图7所示,羟丙基-β-环糊精在胃肠道中不被消化,但可以被肠道菌群发酵,并支持大肠中双歧杆菌等益生菌发酵,且被肠道微生物发酵利用后会产生有利于维护肠道屏障健康的短链脂肪酸(如乙酸、丁酸等);螺旋藻在胃部几乎不被消化,因此含巯基环糊精与螺旋藻的复合物在模拟胃液中稳定性良好,其中的白藜芦醇在2h内释放量仅为9.51%±1.19%;伴随着环糊精和螺旋藻在肠道中逐渐被消化,复合物结构也被破坏,其中的白藜芦醇快速释放,在第8h释放量达到91.12±2.98%,说明所构建的体系能保护营养素免于被胃酸破坏,实现活性因子稳定的肠靶向释放。
实施例9
本实施例对实施例1所制备的含巯基环糊精与螺旋藻的复合物对白藜芦醇生物利用度的提升作用作出了评价。
本实施例采用体外消化法研究含巯基环糊精与螺旋藻的复合物的体外生物利用度。
首先对含巯基环糊精与螺旋藻的复合物进行体外模拟胃、肠液消化:将3mg·mL
以游离白藜芦醇为对照,给予同样处理后评估其体外生物利用度,评估结果如附图8所示,游离白藜芦醇由于没有载体的保护,经过模拟胃、肠液消化后其体外生物利用度仅为40.08%±1.12%。将白藜芦醇负载至复合物后,由于复合物具有耐胃酸、协同肠靶向和肠道ROS清除的效果,在将白藜芦醇靶向递送至肠道后白藜芦醇生物利用度高达84.98%±2.45%,是游离白藜芦醇的2.12倍,说明借助复合物实现高效肠靶向递送是提升白藜芦醇的生物利用度的有效途径。
实施例10
本实施例对比测试了消化后的白藜芦醇和含巯基环糊精与螺旋藻的复合物对·OH、·O
对白藜芦醇、含巯基环糊精与螺旋藻的复合物进行模拟胃、肠液消化后分别获得消化物。将其用于·OH、·O
评价结果如附图9所示,消化后的白藜芦醇对·OH、·O
如上所述,即可较好地实现本发明,上述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种改变和改进,均应落入本发明确定的保护范围内。
