单链环状DNA病毒GyH1重组多表位腺病毒载体疫苗及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及疫苗技术领域,具体涉及一种单链环状DNA病毒GyH1重组多表位腺病毒载体疫苗及其应用。
背景技术
鸡传染性病毒性病毒性腺胃炎(Transmissible viral proventriculitis,TVP)是一种以腺胃肿大、发育不良和饲料转化率低的传染病,给我国的养禽业带来了巨大的危害,但是关于其致病病原仍未确定。基于此背景,李根等人通过Pacbio三代测序从患有鸡传染性病毒性腺胃炎的病鸡中分离鉴定出一种新病毒GyV3,并使用纯培养的GyV3复制出TVP。进一步研究确证GyV3是引起鸡传染性腺胃炎的病原之一,同时还会造成雏鸡贫血和免疫抑制等症状(“鸡传染性腺胃炎相关病毒-圆圈病毒3型的分离鉴定及致病机制研究”,山东农业大学博士学位论文)。此外,GyV3还可跨种传播感染小鼠,造成小鼠贫血和肠炎等症状,是一种潜在的人畜共患病病毒,危害公共卫生安全。通过遗传进化分析,2021年Kraberger等人根据基因结构的相似性和发现的物种,将圆圈病毒3型(Gyrovirus 3,GyV3)的名称改为圆圈病毒人源1型(Gyrovirus homsal,GyH 1)。
由于GyH 1是首次在腺胃炎鸡中鉴定的新型单链环状DNA病毒(GenBank登录号MG366592,病毒原名称“Gyrovirus GyV3”),目前针对GyH 1还缺少有效的防控措施。
疫苗是防控病毒感染的有效手段,但针对GyH 1病毒疫苗的研究很少见有报道,为获得免疫原性强及效果好的疫苗,贾梅玉制备了亚单位疫苗和DNA疫苗,选取VP1的第90位至第463位氨基酸进行表达用于制备亚单位疫苗,以及将VP1的第90位至第463位氨基酸与VP2通过柔性氨基酸linker串联进行表达制备亚单位疫苗;构建pEGFP-VP1真核表达质粒用于鸡群DNA疫苗的接种。结果表明:亚单位疫苗的免疫原性和免疫保护性要优于DNA疫苗;VP1
发明内容
针对上述现有技术,本发明的目的是提供一种单链环状DNA病毒GyH1重组多表位腺病毒载体疫苗及其应用。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面,提供一种单链环状DNA病毒GyH1的抗原表位多肽,包括:
(1)GyH1病毒VP1蛋白、VP2蛋白和VP3蛋白的CD8
(2)GyH1病毒VP1蛋白、VP2蛋白和VP3蛋白的CD4
(3)GyH1病毒VP1蛋白、VP2蛋白和VP3蛋白的B细胞表位区域;
(4)连接臂Linker;
所述CD8
所述CD4
所述B细胞表位区域选自SEQ ID NO.25-SEQ ID NO.36所示的氨基酸序列中的一段或多段。
优选的,所述连接臂Linker的序列为AAY、GPGPG和/或KK。
优选的,所述抗原表位多肽的氨基酸序列如SEQ ID NO.4所示,具体如下:
注:序列中阴影的区域为连接臂Linker。
本发明的第二方面,提供上述抗原表位多肽的编码基因。
优选的,所述编码基因的核苷酸序列如SEQ ID NO.8所示。
本发明的第三方面,提供含有上述抗原表位多肽的编码基因的生物材料,所述生物材料为重组表达载体、表达盒、重组菌或宿主细胞。
本发明的第四方面,提供上述抗原表位多肽或抗原表位多肽的编码基因在制备预防GyH1病毒感染的疫苗中的应用。
优选的,所述疫苗的形式为腺病毒载体疫苗、亚单位疫苗或DNA疫苗;更优选的,所述疫苗的形式为腺病毒载体疫苗。
本发明的第五方面,提供一种单链环状DNA病毒GyH1重组多表位腺病毒载体疫苗,由如下方法构建而成:
将上述抗原表位多肽的编码基因插入到腺病毒载体中,构建重组质粒;再进行包装、加工,获得具有免疫原性的重组多表位腺病毒载体疫苗。
优选的,所述腺病毒载体为人5型复制缺陷腺病毒。
本发明的第六方面,提供上述单链环状DNA病毒GyH1重组多表位腺病毒载体疫苗在制备预防或治疗GyH1感染的药物中的应用。
本发明的有益效果:
(1)本发明首次基于腺病毒载体开发了重组多表位腺病毒载体疫苗rAd5-GyMEV,由于人5型腺病毒在鸡群中不流行,因此本发明的疫苗不会受鸡体中预存腺病毒抗体的影响;
(2)本发明中,腺病毒载体疫苗安全性好,无需添加佐剂,可采用肌肉免疫或口服免疫等免疫途径,将具有良好的市场竞争性。
(3)本发明的新型GyH1预防性疫苗不仅具有原创性,而且具有较好的免疫原性和可行性,单次肌肉注射即可在鸡体内诱导产生高水平的特异性抗体反应以及细胞反应。
(4)本发明以人复制缺陷型5腺病毒载体为基础制备了GyH1预防性疫苗,有望获得制备简单、成本低廉、安全性好、无需添加佐剂、具有广泛的应用前景的疫苗产品。
附图说明
图1为本发明构建的抗原多肽A、B、C和多表位疫苗GyMEV的二级结构图;
图2为本发明构建的抗原多肽多表位疫苗GyMEV的三级结构图;
图3为本发明构建的抗原多肽多表位疫苗GyMEV的分子动力学图;
图4为重组多表位腺病毒质粒感染HEK 293细胞后七天荧光显微镜观察结果图;
图5为快速滴定法检测定量重组多表位腺病毒载体疫苗候选株病毒滴度图;
图6为临床实验中各组鸡群抗体消长规律图;
图7为临床实验中各组鸡群免疫原性检测图;
图8为临床实验中各组鸡群体重检测图;
图9为临床实验中各组鸡群病理组织切片图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
如前所述,针对GyH 1病毒疫苗的研究很少见有报道,现有研究仅涉及GyH 1病毒VP1和VP2蛋白的抗原表位区域,因此对GyH 1病毒的疫苗还需要更加深入的研究。
基于此,本发明提供了一种单链环状DNA病毒GyH1的重组多表位腺病毒载体疫苗rAd5-GyMEV及其应用,能更有效的刺激机体对GyH1的免疫保护反应。这种重组腺病毒疫苗具有亚单位疫苗的安全性和能够采取多种免疫方式,段时间内刺激机体全方位的免疫应答,从而具有广泛的开发和应用前景。
本发明中,通过改造人5型腺病毒可构建复制缺陷型腺病毒载体疫苗,具有以下优势:1)由于腺病毒感染细胞后,其基因组可进入细胞核,因此腺病毒载体携带的外源抗原可通过内源蛋白加工途径刺激机体产生较强的T细胞和抗体应答;2)改造后的复制缺陷型腺病毒具有很好的安全性;3)腺病毒基因组不整合到宿主基因组中,无遗传致癌性;4)腺病毒对多种类型的细胞具有侵染性,有利于抗原蛋白的表达和递呈;5)腺病毒载体可装载最大8kb的外源基因;6)腺病毒载体在体内表达外源基因的时效性更长;7)腺病毒的扩增纯化工艺成熟,可以获得较高滴度的病毒颗粒;8)人5型腺病毒在鸡群中无针对载体的预存免疫的影响,有利于疫苗免疫效果的最大化。
在一个优选例中,还包括Linker,Linker的序列为AAY、GPGPG和/或KK。
在一个优选例中,所述腺病毒载体为人5型复制缺陷腺病毒。
本发明提供了一种重组多表位腺病毒载体疫苗rAd5-GyMEV的制备方法,包括以下步骤:
1)通过在线生物信息分析服务器筛选GyH1 VP1、VP2和VP3蛋白的抗原表位,通过Linker连接抗原表位构建GyMEV;
2)通过在线蛋白分析服务器进一步验证GyMEV的合理性和稳定性,随后通过反向翻译和密码子优化得到GyMEV的核苷酸序列;
3)将GyMEV的核苷酸序列插入到腺病毒载体质粒上构建重组腺病毒质粒;
4)将重组质粒酶切线性化后,转染至腺病毒包装细胞中,然后培养至80%的细胞有明显的细胞病变;
5)收集细胞,采用反复冻融的方式破碎细胞,离心收集上清液;
6)将上清液感染腺病毒包装细胞,培养至细胞由贴壁变成悬浮状态;
7)依照步骤5)和6)反复扩大培养,收集细胞,破碎后离心上清液;
8)取上清液进行重组腺病毒的纯化,获得纯化的病毒液,该病毒液即为重组多表位腺病毒载体疫苗rAd5-GyMEV。
在一个优选例中,所述包装细胞是可支持复制缺陷型腺病毒增殖的贴壁细胞系或悬浮细胞系。
在一个优选例中,所述腺病毒包装细胞为贴壁HEK293细胞系。
在一个优选例中,所述腺病毒纯化方式选择氯化铯密度梯度离心法。
本发明实施例中,所述疫苗以人5型复制缺陷腺病毒为载体,携带经密码子优化的GyMEV,所述疫苗在鸡体内具有良好的免疫原性,能在短时间内诱导机体产生强烈的细胞及体液免疫反应,因此可用于制备疫苗。
本发明对所述圆圈病毒人源1型疫苗的剂型并没有特殊限定,优选包括注射剂、滴鼻剂或喷雾剂,实施例中以注射剂为例进行说明,但是不能仅将其认定为本发明的全部保护范围。
综上所述,本发明的发明人在首次发现GyH1与传染性腺胃炎之间的致病机理基础上,以GyH1为研究对象,获得了具有较好预防效果的重组多表位腺病毒载体疫苗rAd5-GyMEV,该疫苗无副作用可以引起较高的抗体滴度及对GyH1有良好免疫效果,可以广泛的应用于GyH1的免疫预防工作中。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例和对比例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。未注明详细条件的实验方法是按照常规试验方法或按照供应商所建议的操作说明书进行的。
其中:人5型复制缺陷腺病毒购自Takara-宝日医生物技术有限公司。
实施例1抗原多肽A、B、C和多表位疫苗GyMEV的构建
1.GyH1抗原表位的筛选
根据GenBank登录号MG366592公开的GyH1序列,获得GyH1病毒的VP1、VP2和VP3氨基酸序列。使用NetCTL v1.2服务器预测VP1和、VP2和VP3蛋白的保守序列的九聚体,生成阈值高于0.5的九聚体用于IEDB服务器预测CD8
表1:CD8
表2:CD4
表3:B细胞表位
2.构建抗原表位多肽A、B和C以及多表位疫苗GyMEV
采用Linker1连接8个CD8
采用Linker2连接8个CD4
采用Linker3连接12个B细胞表位,得到抗原表位多肽C,其氨基酸序列为SEQIDNO.3。
将抗原表位多肽A、B和C连接,得到多表位疫苗GyMEV,其氨基酸序列为SEQIDNO.4。
具体地,本实施例优选Linker 1的序列为AAY,Linker 2的序列为GPGPG,Linker 3序列为KK。
3.抗原性、过敏原性及理化性质检测
使用Vaxijen服务器验证抗原性,使用Allertop v2.0服务器验证过敏原性。使用Protparam服务器预测理化性质,其中抗原多肽A可能为过敏原,抗原多肽B的抗原性相对较低,抗原多肽C半衰期太短,而多表位疫苗GyMEV各项指标优秀,结果如表4
表4:抗原表位多肽A、B、C和多表位疫苗GyMEV的过敏原性及理化性质检测
注:抗原性大于0.5即符合要求,不稳定指数低于40为稳定蛋白,反之则为不稳定蛋白。平均水性小于0表明具有亲水性,大于0表明具有疏水性。
4.二、三级结构预测
使用PSIPRED服务器预测二级结构,使用trRosetta服务器预测预测三级结构,结果如图1所示。
图1A为抗原多肽A二级结构,以无规卷曲(41/93,44.08%)为主,其次是α-螺旋(38/93,40.86%)和β-折叠(14/93,15.06%)。
图1B为抗原多肽B二级结构,以无规卷曲(93/155,60%)为主,其次是β-折叠(50/155,32.25%)和α-螺旋(12/155,7.75%)。
图1C为抗原多肽C二级结构,以无规卷曲(134/214,62.62%)为主,其次是β-折叠(72/214,33.64%)和α-螺旋(8/214,3.74%)。
图1D为多表位疫苗GyMEV二级结构,以无规卷曲(288/469,61.41%)为主,其次是β-折叠(119/469,25.38%)和α-螺旋(62/469,13.21%),
三级结构预测结果如图2所示,抗原多肽A、B、C和GyMEV的二、三级结构能够相互吻合,模型合理度较高。
5.分子动力学检测
使用iMODS服务器分析抗原多肽GyMEV的分子动力学,变形分析表明,在复合结构中有最小的变形,如图3A所示;b因子与均方根(RMS)成正比,显示了抗原多肽复合体的稳定性,如图3B所示;图3C显示了残基对之间的协方差矩阵,其中红色、白色和蓝色分别表示相关运动、不相关运动和反相关运动;图3D显示了抗原多肽的弹性网络模型,深灰色表示某些区域的蛋白质硬度较高。综上表明我们构建的抗原多肽GyMEV具有较好的稳定性。
6.反向翻译及密码子优化
使用JCAT服务器进行反向翻译并优化密码子,抗原多肽A得到一个长度为279bp的核苷酸序列,为SEQ ID NO.5。抗原多肽B得到一个长度为465bp的核苷酸序列,为SEQ IDNO.6。抗原多肽C得到一个长度为642bp的核苷酸序列,为SEQ ID NO.7。多表位疫苗GyMEV得到一个长度为1407bp的核苷酸序列,为SEQ ID NO.8。
实施例2重组腺病毒载体疫苗rAd5-A、rAd5-B、rAd5-C和rAd5-GyMEV的制备
1.人工合成目的片段
根据实施例1中获得的抗原多肽A、B、C和GyMEV核苷酸序列,分别人工合成至质粒pMD19-T中,构建质粒pMD19-A、pMD19-B、pMD19-C和pMD19-GyMEV。
2.重组腺病毒质粒的构建
利用In-Fusion技术,将含有抗原多肽A、B、C和GyMEV核苷酸序列的克隆质粒,定向插入腺病毒载体中(如表5),共转化感受态大肠杆菌细胞,筛选阳性菌落,挑菌,摇菌,质粒大提,获得重组腺病毒质粒rAd5-A、rAd5-B、rAd5-C和rAd5-GyMEV。
表5:In-Fusion体系
3.重组多表位腺病毒载体疫苗的制备
重组腺病毒质粒rAd5-A、rAd5-B、rAd5-C和rAd5-GyMEV消化
在重组腺病毒被包装之前,重组质粒必须被PacI消化(如表6),暴露位于腺病毒基因组两端的反向末端重复序列(ITRs),并从质粒骨架释放腺病毒基因组。
表6:50μL PacI消化体系
1).在无菌的1.5毫升微量离心管中,混合以下试剂;
2).吹打混匀内容物并在微型离心机中短暂离心;
3).37℃孵育10min。通过对1%琼脂糖凝胶的分析,确认PacI消化完成。重组pAdeno5载体的质粒部分将在~3kb处迁移,而腺病毒基因组不会进入凝胶,但会保持在通道的顶端;
4).加入60ul 1X TE Buffer和100ul的苯酚:氯仿:异戊醇(25:24:1)混合液,轻轻地旋转;
5).在高速离心机中以-4℃,14000rmp,离心5min;
6).小心地将顶部水层转移到干净的无菌1.5毫升微量离心管中;
7).加入400μl 95%乙醇,25μl醋酸铵和1μl蔗糖(20mg/ml)轻轻地转;
8).在高速离心机中以-4℃,14000rmp,离心5min;
9).去除并丢弃上清液,加入300μl 70%乙醇洗涤;
10).在高速离心机中以-4℃,14000rmp,离心2min,小心地吸出上清液;
11).在室温下风干颗粒约15min,加入10μl TE Buffer溶解DNA,于-20℃保存。
线性化的重组腺病毒质粒转染至HEK 293细胞
在转染前12-24小时,以每60mm培养板(约100个细胞/平方毫米)12X10
用15μl经Pca1消化的rAd5-X DNA转染每个60mm培养板。使用钙磷哺乳动物转染试剂盒(Cat)将大质粒转染到HEK 293细胞中的磷酸钙转染方法(如表7)。
表7:600μL磷酸钙转染体系
1).将以上混合物室温孵育5-15min;
2).将600μl混合液缓慢滴入培养基中;
3).来回移动细胞瓶,使转染混合液均匀分布;
4).在37℃,5%CO
5).除去含有磷酸钙的培养基混合液,用培养基清洗细胞;
6).加入5ml新鲜培养基,37℃,5%CO
7).观察转染后24h-72h荧光信号强度(如图4),一周后待出现细胞病变(CPE),吹打细胞,将悬浮液转移到无菌的15ml锥形离心管;
8).3000rmp,5min离心收集细胞,弃掉上清,加入2mlPBS重悬细胞;
9).将细胞放置-80℃冻40min后,取出细胞放置37°水浴5min,反复冻融3次;
10).12000rmp,2min离心收集上清,保存与-80℃。
实施例3:重重组腺病毒载体疫苗rAd5-A、rAd5-B、rAd5-C和rAd5-GyMEV的鉴定及滴度测定
1.重组表位腺病毒载体疫苗的鉴定及病毒滴度测定
1).生长密度80%以上的细胞铺至12孔板
2).使用PBS作为稀释剂,倍比稀释P2代病毒10
3).每孔加入100μl病毒稀释液。
4).37℃,5%CO
5).加入1ml冰镇100%甲醇,-20℃放置10min。
6).弃掉甲醇,加入PBS+1%BSA 1ml,3min,洗三次。
7).用PBS 1:1000稀释一抗(Mouse Anti-Hexon)。
8).每孔加入500μl一抗,37℃孵育1h。
9).弃掉一抗,加入PBS+1%BSA 1ml,3min,洗三次。
10).用PBS 1:1500稀释二抗(Rat Anti-Mouse)。
11).弃掉二抗,加入PBS+1%BSA 1ml,3min,洗三次。
12).加入500ulDAB工作液(10XDAB:1Xstable Perosidase=1:10),室温孵育10min。
13).在显微镜下,观察每孔阳性细胞数(黑色/棕色),结果如图5示,图5A为重组腺病毒载体疫苗rAd5-A,图5B为重组腺病毒载体疫苗rAd5-B,图5C为重组腺病毒载体疫苗rAd5-C,图5D为重组腺病毒载体疫苗rAd5-GyMEV。
14).计算病毒滴度
公式:ifu=(阳性细胞数×细胞培养板底面积(cm
根据公式计算出rAd5-A、rAd5-B、rAd5-C和rAd5-GyMEV的病毒滴度分别为1.08×10
实施例4重组腺病毒载体疫苗rAd5-A、rAd5-B、rAd5-C和rAd5-GyMEV的临床应用
1.GyH1的攻毒保护
SPF1日龄雏鸡从济南赛斯家禽科技有限公司购买,将其按类别分为5组。SPF鸡7日龄进行第一次免疫,14日龄进行第二次免疫,疫苗组30只进行腿部肌肉接种疫苗,15日龄腹腔接毒。详细情况如表8。
表8:重组腺病毒载体疫苗动物实验设计
2.免疫原性检测
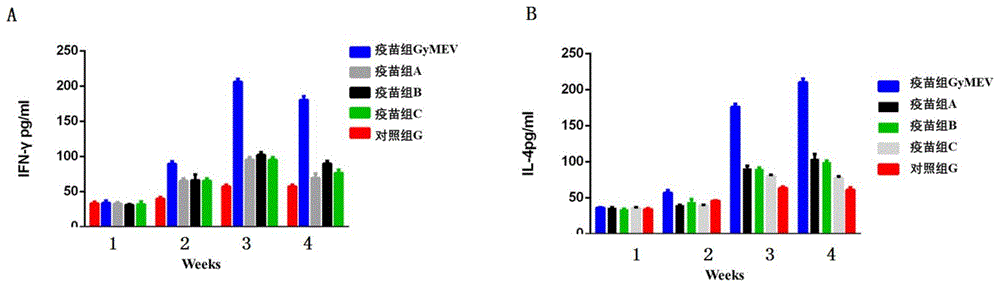
免疫因子检测:SPF鸡7日龄第一次免疫后,于免疫后1周龄,2周龄,3周龄,4周龄,5周龄,6周龄采血并分离血清。使用本实验室建立的GyH1 ELISA抗体检测方法(“圆圈病毒人源1型抗体/抗原ELISA检测方法的建立及应用”,山东农业大学硕士学位论文)检测抗体消长规律,检测结果显示所有疫苗抗体水平均在一免后两周开始上升,疫苗C于第四周开始下降,其他疫苗于第五周开始下降,接种多表位疫苗GyMEV鸡群的抗体水平最高(图6)。使用鸡IL-4和IFN-γELISA检测试剂盒进行IL-4和IFN-γ检测,检测结果表明接种多表位疫苗GyMEV接种鸡群的IL-4和IFN-γ表达量最高,说明多表位疫苗GyMEV免疫原性最好(图7A和7B;图中横坐标时间表示的是7日龄第一次免疫后的第1-4周)。以7日龄第一次免疫后的第4周为例,疫苗组GyMEV的IFN-γ表达量为180.4pg/ml,IL-4的表达量为210.07pg/ml;疫苗组A的IFN-γ表达量为69.19pg/ml,IL-4的表达量为103.33pg/ml;疫苗组B的IFN-γ表达量为89.86pg/ml,IL-4的表达量为99.0pg/ml;疫苗组C的IFN-γ表达量为76.53pg/ml,IL-4的表达量为77.33pg/ml;对照组G的IFN-γ表达量为57.45pg/ml,IL-4的表达量为60.86pg/ml。与疫苗组A-疫苗组C相比,疫苗组GyMEV将筛选出8个CD8
3.保护性检测
体重检测:于15日龄接毒后,每日观察鸡群的采食状况及饮水状况,称量体重并记录,监测鸡群的生长状况制备折线图,结果显示:各个疫苗组与对照组G进行相比,疫苗组GyMEV更能有效减缓病毒早期的生长抑制症状,说明多表位疫苗GyMEV保护性最好(图8,表中的横坐标是以15日龄接毒作为0天)。
GyH1抗原检测:于15日龄接毒后,每周进行采血,提取血液DNA,用GyH1鉴定引物(F:GACACAGACTGCGACGAAGA;R:ATGCTCCTGGCTGTCTAGAT)进行GyH1的PCR鉴定。计算每组GyH1感染率,死亡率和保护率(表9)。
表9:动物实验各组GyH1的感染率,死亡率和保护率
注:感染率=(GyH1抗原检测为阳性的鸡只数/30)×100%;
死亡率=(死亡的鸡只数/30)×100%;
保护率=1-感染率。
表9中的结果是统计到15日龄接毒后的第5周。
病理学观察:每组试验动物在15日龄接毒后第5周(体重检测和GyH1抗原检测结束后)进行剖杀观察动物的大体病变,采取脾脏、肾脏、腺胃、法氏囊、骨髓、胸腺等组织,将各组动物组织脏器于4%的福尔马林中固定,制备石蜡组织切片,在显微镜下观察病理组织学病变(图9),结果显示各个疫苗组能一定程度的保护组织损伤,而疫苗组GyMEV效果最好(表10)。
表10:病理组织学病变评估
注:“+”表示病变程度,“+++”严重病变,“++”中度病变,“+”轻度病变,“-”无明显病变
综上,本发明的重组多表位腺病毒载体疫苗rAd5-GyMEV是将筛选出8个CD8
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
