一种检测人源间充质干细胞在小鼠体内分布的方法及应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及一种检测人源间充质干细胞在小鼠体内分布的方法及应用,涉及A61K,具体涉及医用的配置品领域。
背景技术
间充质干细胞对癌症肿瘤类疾病具有良好的治疗效果,但是需要使间充质干细胞具有肿瘤靶向性,为了监测癌症,肿瘤细胞的生长情况,可以采用示踪法,监测间充质干细胞对癌症细胞的治疗和代谢情况。目前传统的示踪法包括细胞外源基因标记法,可以通过活体成像仪实时监测细胞在动物体内的分布情况,但是部分组织会产生自发荧光造成假阳性;荧光染料标记法通过荧光染料在体外进行标记细胞,然后注射动物体内,并结合免疫荧光或流式细胞手段,检测细胞在体内组织的分布情况,但是目的细胞并不能完全被标记,随着细胞增殖分裂,荧光信号逐渐减弱,结果评判受到主观性影响较大;PCR检测方法通过高丰度人源Alu DNA序列,设计特定的引物,从而检测细胞在动物体内不同组织的相对分布情况,该方法灵敏度高,操作简单,但是Alu序列在不同个体间的变异度较大,且由于高度保守性造成动物组织的非特异性扩增,从而造成检测结果不稳定。
中国发明专利CN201310695256.4公开了一种具有体内示踪和肿瘤治疗作用的转基因细胞及其制备方法,由人脐带来源的间充质干细胞、经携带有海肾荧光素酶、红色荧光蛋白和胸苷激酶的三融合基因的慢病毒表达载体转染后构建而成,能够对同一只动物在不同时间点进行实时监测,但是目的细胞并不能完全被标记,随着细胞增殖分裂,荧光信号逐渐减弱。中国发明专利CN201911173634.6公开了一种可在生物体内示踪的细胞、其制备方法及其在细胞药代动力学研究中的用途,细胞标记有荧光染料,所述荧光染料通过化学键偶联且以不可逆的方式结合于所述细胞的表面,通过对该细胞的荧光检测结果,可以准确反映该细胞的变化过程或分布情况,但是随着细胞增殖分裂,荧光信号逐渐减弱,结果受主观影响较大。
发明内容
为了达到快速、准确,客观地检测目的细胞在不同时间点多种组织中体内分布的目的,本发明的第一个方面提供了一种检测人源间充质干细胞在小鼠体内分布的方法,包括以下步骤:
(1)将人源脐带间充质干细胞通过尾静脉输注入小鼠体内,分别在0.5h,2h,24h,48h,7d时间点收集组织细胞,血液样品,分别提取总RNA;
(2)将提取的总RNA分别发生反转录反应制备cDNA检测样品;
(3)采用引物和探针组合,对获得的cDNA检测样品进行PCR扩增,然后实时荧光定量PCR,获得CT值;
(4)将CT值代入标准曲线中,换算得到人源脐带间充质干细胞不同时间点在小鼠组织细胞和血液中的分布情况。
作为一种优选的实施方式,所述步骤1中人源脐带间充质干细胞在小鼠体内的注射量为1-1.5×10
作为一种优选的实施方式,所述提取组织细胞中总RNA的具体操作步骤如下:
M1:从-80℃冰箱及液氮罐中分别取出小鼠组织及UCMSC细胞(脐带间充质干细胞),将组织放入事先灭菌好的研钵中,加入液氮研磨,将研磨好的组织粉末分装至EP管中,每管加入1ml TRIzol涡旋15s使两者充分接触;
M2:室温下静置5min使其充分反应。在12000g/min下离心5分钟,吸取澄清液,按每毫升TRIzol加入200μL的氯仿,盖紧离心管,用手上下振荡混匀15s,25℃室温放置10min;
M3:4℃,12000rpm离心15min,吸取上层水相,移至另一新的离心管中;
M4:加入与上清液同体积在-20度冰箱预冷过的异丙醇,上下颠倒混匀,25℃室温放置10min;4℃,12000rpm离心10min,弃上清液,RNA沉管底;
M5:加入1ml的75%乙醇,上下颠倒数次使沉淀脱离管壁;4℃,12000rpm离心5min,倒去上清;
M6:重复M5操作一次,并用移液枪头吸干液体;
M7:EP管置于室温下晾干,加入100μLDEPC(超纯)水,溶解RNA;
M8:用核酸浓度测量仪测RNA浓度,根据浓度调整体积,贴上标签,至-80℃冷冻保存。
作为一种优选的实施方式,所述提取血液中总RNA的具体操作步骤如下:
H1:从-80℃冰箱取出小鼠血液样本,待血液样本融解后转移至15mL离心管中,每管加入6mL TRIzol,涡旋混匀使两者充分接触;
H2:室温下静置10min使其充分反应,每管加入1.2mL的氯仿,盖紧离心管,用手上下振荡混匀15s,室温放置10min;
H3:4℃,5400rpm离心15min,每个离心管中吸取上层水相分装至4-5个EP中,每管500μL,做好标记;
H4:每管加入500μL-20℃冰箱预冷过的异丙醇,上下颠倒混匀,室温放置10min;4℃,12000rpm离心10min,弃上清液,RNA沉管底;
H5:将同一样本的RNA沉淀吸取混合至同一EP管中,加入1mL的75wt%乙醇,上下颠倒数次使沉淀脱离管壁;4℃,12000rpm离心5min,倒去上清液;
H6:重复H5操作一次,并用移液枪头吸干液体;
H7:EP管置于室温下晾干,加入100μLDEPC水,溶解RNA;
H8:用核酸定量分析仪测RNA浓度(ng/μl),根据浓度调整体积,贴上标签,至-80℃冷冻保存。
申请人在实验过程中发现,采用TRIzol法提取组织细胞和血液中总RNA,并且提取过程中引入预冷的异丙醇,可以将提取的RNA尽可能的沉淀出来,并且提取效率较高,猜测可能的原因是:研磨过程中冷却的细胞组织在与TRIzol试剂接触后,RNA进入TRIzol试剂中温度较低,引入预冷的异丙醇,可以减少体系内部的热量交换,尽快使体系达到内部均匀状态,当预冷的异丙醇加入后,仅通过极性的差异,使RNA尽快沉淀。申请人进一步发现,在体系中引入乙醇,可以减少RNA对管壁的吸附,原因可能是,形成的体系极性与EP管差异较大,表面张力大,从而减少了RNA在管壁的残留,提高了RNA的回收率。
作为一种优选的实施方式,所述步骤2中反转录反应的具体步骤如下:
S1:取总RNA,Buffer,脱氧核糖核酸酶溶液,灭菌水冰上解冻,使用前分别将上述物质涡旋振荡混匀,瞬离收集残留在管壁的液体;
S2:按体积配制混合液;
S3:配制完成后,涡旋混匀,离心后置于35-37℃,孵育20-40min;加入1-2μL 50-53mM EDTA,60-65℃孵育10-12min,孵育后放置于冰上待用;
S4:在S3配制后的混合液中加入1-2μL随机引物,在60-65℃下孵育5-6min;
S5:然后加入反转录体系,设置反转录程序,结束后即可。
作为一种优选的实施方式,所述混合液包括混合液Ⅰ和混合液Ⅱ,混合液的制备原料及加入量包括,混合液Ⅰ:总RNA1-2μg,Buffer1-2μL,1U/μL的脱氧核糖核酸酶溶液1-2μL,灭菌水补充至10μL;混合液Ⅱ:总RNA4-6μg,Buffer1-2μL,1U/μL的脱氧核糖核酸酶溶液1-2μL,灭菌水补充至10μL。
作为一种优选的实施方式,所述混合液Ⅰ中总RNA为人源总RNA,混合液Ⅱ中总RNA为鼠源干燥组织总RNA。
作为一种优选的实施方式,所述反转录体系的制备原料及加入量包括,Buffer4-6μL,20U/μL的核糖核酸酶抑制剂1-2μL,200U/μL的逆转录酶1-2μL,10mM的dNTP Mix(脱氧核苷三磷酸底物)2-5μL。
作为一种优选的实施方式,所述反转录程序为:设置25-30℃,反应5-8min,升温至42-45℃,反应60-80min,升温至70-75℃,反应5-10min,降温至4℃终止反应。
作为一种优选的实施方式,所述反转录程序为:设置25℃,反应5min,升温至42℃,反应60min,升温至70℃,反应5min,降温至4℃终止反应。
作为一种优选的实施方式,所述步骤3中引物包括正向引物和反向引物,正向引物的序列为:GAPDH-F 5’-TGGGTGTGAACCATGAGAAG-3’;反向引物的序列为:GAPDH-R 5’-GTCCTTCCACGATACCAAAGT-3’;所述探针的序列为:HEX 5’-CCTCAAGATCATCAGCAATGCCTCCT-3’BHQ1。
注:所述HEX为荧光探针标记基团,BHQ1为荧光淬灭基团。
申请人发现采用GAPDH为目的基因,并且优选正向引物和反向引物的序列,同时优化荧光探针的序列,对人源间充质干细胞的分布进行检测,猜测可能的原因是:采用高丰度表达磷酸甘油醛脱氢酶为目标基因,使得检测有了更强的特异性和灵敏度,可达到快速、准确和客观地检测目的细胞在不同时间点多种组织中体内分布的目的,可以实现在短时间内处理大量的样品,可为干细胞药物在体内的药代动力学的研究及产品的临床应用提供重要数据支持。
作为一种优选的实施方式,所述步骤3中进行PCR扩增的PCR体系的制备原料及加入量包括:10μM的正向引物0.5-1μL,10μM的反向引物0.5-1μL,10μM的探针1-3μL,PCR混合液12-15μL,灭菌水5-10μL,cDNA2-5μL。
申请人在实验过程中发现通过引入脱氧核糖核酸酶,去除gDNA,发生RNA逆转录反应,可以通过RNA逆转录,去除gDNA的影响,提高干细胞示踪的准确度。以组织细胞或血液为目标物,提取的核苷酸中不可避免含有Gdna,含有全部的遗传信息,在进行扩增转录的时候,对片段序列的结合会产生干扰,本发明通过脱氧核糖核酸酶,去除gDNA,避免了gDNA对引物探针序列的结合影响,避免了gDNA的影响,并且通过RNA的逆转录得到的cDNA可以作为对照例,对引物进行特异性验证,进一步提高了检测的准确度。
作为一种优选的实施方式,所述步骤4前还包括特异性验证,孔间重复性评估,板间重复性评估,标准曲线绘制,灵敏度验证。
作为一种优选的实施方式,所述特异性验证的方法具体包括以下步骤:
A1:1μg人源总RNA反转录后的cDNA分别用灭菌水稀释25及250倍作为高、低浓度阳性样品,小鼠5μg肺脏组织总RNA反转录的cDNA原液和稀释10倍作为高、低浓度阴性样品进行引物特异性验证,同时设立纯化H
A2:加样后,设置程序为:95℃预变性30s;95℃变性5s,60℃30s(荧光信号采集阶段),40个循环;荧光通道为HEX。
作为一种优选的实施方式,所述标准曲线绘制和灵敏度验证的方法具体包括以下步骤:
B1:由人源和小鼠组织分别提取得到人源RNA和鼠源RNA,将人源RNA按照不同比例(50pg/ng、20pg/ng、2pg/ng、0.2pg/ng、0.02pg/ng、0.002pg/ng、0.0002pg/ng、0.0001pg/ng、0.00002pg/ng)与鼠源RNA反转录后混合作为标准品,进行qPCR反应,以标准品浓度Log10值为横坐标,CT值为纵坐标,绘制标准曲线;
B2:确定标准曲线的线性范围和定量下限,同时设置阴性对照(以纯化水代替cRNA,NTC组),每组3个复孔,建立标准曲线,并确定线性范围和检测下限。实验体系同PCR体系。
所述标准品的配置原料和加入量见表1。
表1
作为一种优选的实施方式,所述孔间重复性评估和板间重复性评估的方法具体包括以下步骤:
C1:选择标准曲线的7个浓度即STD1-STD7分别在同一块96孔板内重复测定6次,计算各含量的板内重复性的变异系数(CV%),CV%=Ct值标准偏差/Ct平均值×100%。加样体系同PCR体系。
C2:选择标准曲线的6个浓度即STD2-STD7分别在不同96孔板间重复测定6块板,每板3个复孔,计算各浓度的板间重复性,重复性的变异系数(CV%),CV%=Ct值标准偏差/Ct平均值×100%。加样体系同PCR体系。
作为一种优选的实施方式,所述步骤4的具体操作为:
D1:以GAPDH为引物,以待测cDNA样品进行qPCR,待测样品使用的cDNA为625pg;以待测样本的CT值代入标准曲线方程后经对数换算,背景上样量为500ng,样本上样量为625ng,换算后的结果除以1.25得到每ng鼠RNA中干细胞的RNA含量;
D2:标准曲线方程为y=-3.1134x+24.083,R
本申请中对反转录的cDNA分别稀释低倍数和高倍数,作为高低浓度的阴性对照,可以进行引物特异性验证,从而证明检测方法的特异性。本申请中以GAPDH为引物,以待测cDNA样品进行qPCR,然后带入标准曲线进行计算,同时扣除背景信号,计算得到组织中的间充质干细胞的RNA量,从而获得RNA在组织中的分布情况。克服了背景噪音影响,具有特异性高、检测限低的特征,可实现定量分析人间充质干细胞在小鼠体内各个组织中的代谢分布情况。
本发明的第二个方面提供了一种检测人源间充质干细胞在小鼠体内分布的方法的应用,应用于定量检测人源间充质干细胞在小鼠体内不同器官的分布情况。
与现有技术相比,本发明具有以下有益效果:
(1)本发明所述检测人源间充质干细胞在小鼠体内分布的方法,采用TRIzol法提取总RNA,分离过程中引入预冷的异丙醇,得到的RNA沉淀中加入乙醇,可以使组织和血液中的RNA提取出来,分离蛋白质和RNA,增加RNA的提取率和纯度。
(2)本发明所述检测人源间充质干细胞在小鼠体内分布的方法,通过引入脱氧核糖核酸酶,去除gDNA,发生RNA逆转录反应,去除gDNA的影响,提高干细胞示踪的准确度。
(3)本发明所述检测人源间充质干细胞在小鼠体内分布的方法,选取高丰度表达磷酸甘油醛脱氢酶(GAPDH)为目标基因,结合TaqMan探针qPCR方法,灵敏度高,特异性强,操作简单,可定量检测细胞在不同组织的含量;可检测细胞在动物体内不同组织的相对分布情况。
(4)本发明所述检测人源间充质干细胞在小鼠体内分布的方法,通过特异性验证,并且进行重复性和稳定性验证,绘制标准曲线,扣除背景信号,进一步提高检测的准确度和检测稳定性。
(5)本发明所述检测人源间充质干细胞在小鼠体内分布的方法,细胞不需要复杂的体外操作,直接注射体内用于后续的分析,解决了操作复杂,细胞活性受到影响的问题;解决了需要配备复杂昂贵仪器的问题;并且该分析方法客观准确,避免了结果评判受到个人主观性影响。
(6)本发明所述检测人源间充质干细胞在小鼠体内分布的方法,可达到快速、准确和客观地检测目的细胞在不同时间点多种组织中体内分布的目的,可以实现在短时间内处理大量的样品,结果可为干细胞药物在体内的药代动力学的研究及产品的临床应用提供重要数据支持。
附图说明
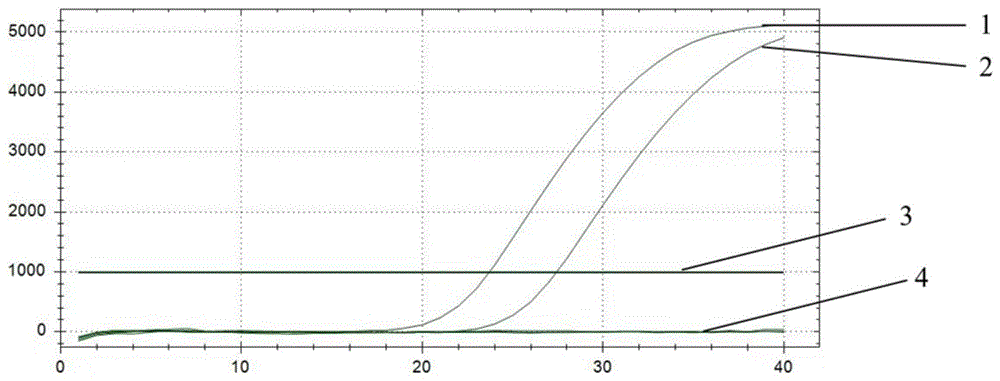
图1为特异性扩增曲线图;
图2为标准曲线扩增图;
图3为标准曲线图。
图4为灵敏度扩增曲线图;
图5为干细胞不同时间点在小鼠肺脏组织内的扩增曲线图;
图6为干细胞不同时间点在小鼠肺脏内的RNA含量统计图;
图7为干细胞不同时间点在小鼠血液内的扩增曲线图;
图8为干细胞不同时间点在小鼠血液内的RNA含量统计图。
图中1.人源高浓度样本;2.人源低浓度样本;3.荧光阈值线;4.小鼠高,低浓度样本,纯化水曲线(小鼠高,低浓度样本,纯化水的曲线接近,不做区分)。
具体实施方式
Premix Ex Taq
实施例1
一种检测人源间充质干细胞在小鼠体内分布的方法,包括以下步骤:
(1)将人源脐带间充质干细胞通过尾静脉输注入C57BL/6N小鼠体内,分别在0.5h,2h,24h,48h,7d时间点收集肺脏组织细胞,血液样品,分别提取总RNA;
(2)将提取的总RNA分别发生反转录反应制备cDNA检测样品;
(3)采用引物和探针组合,对获得的cDNA检测样品进行PCR扩增,然后实时荧光定量PCR,获得CT值;
(4)将CT值代入标准曲线中,换算得到人源脐带间充质干细胞不同时间点在小鼠组织细胞和血液中的分布情况。
所述步骤1中人源脐带间充质干细胞在小鼠体内的注射量为1.5×106细胞/鼠,提取总RNA的方法为TRIzol法提取总RNA。
所述提取组织细胞中总RNA的具体操作步骤如下:
M1:从-80℃冰箱及液氮罐中分别取出小鼠肺脏组织及UCMSC细胞(脐带间充质干细胞),将组织放入事先灭菌好的研钵中,加入液氮研磨,将研磨好的组织粉末分装至EP管中,每管加入1ml TRIzol涡旋15s使两者充分接触;
M2:室温下静置5min使其充分反应。在12000g/min下离心5分钟,吸取澄清液,按每毫升TRIzol加入200μL的氯仿,盖紧离心管,用手上下振荡混匀15s,25℃室温放置10min;
M3:4℃,12000rpm离心15min,吸取上层水相,移至另一新的离心管中;
M4:加入与上清液同体积在-20度冰箱预冷过的异丙醇,上下颠倒混匀,25℃室温放置10min;4℃,12000rpm离心10min,弃上清液,RNA沉管底;
M5:加入1ml的75%乙醇,上下颠倒数次使沉淀脱离管壁;4℃,12000rpm离心5min,倒去上清;
M6:重复M5操作一次,并用移液枪头吸干液体;
M7:EP管置于室温下晾干,加入100μLDEPC(超纯)水,溶解RNA;
M8:用核酸浓度测量仪测RNA浓度,根据浓度调整体积,贴上标签,至-80℃冷冻保存。
所述提取血液中总RNA的具体操作步骤如下:
H1:从-80℃冰箱取出小鼠血液样本,待血液样本融解后转移至15mL离心管中,每管加入6mL TRIzol,涡旋混匀使两者充分接触;
H2:室温下静置10min使其充分反应,每管加入1.2mL的氯仿,盖紧离心管,用手上下振荡混匀15s,室温放置10min;
H3:4℃,5400rpm离心15min,每个离心管中吸取上层水相分装至4-5个EP中,每管500μL,做好标记;
H4:每管加入500μL-20℃冰箱预冷过的异丙醇,上下颠倒混匀,室温放置10min;4℃,12000rpm离心10min,弃上清液,RNA沉管底;
H5:将同一样本的RNA沉淀吸取混合至同一EP管中,加入1mL的75wt%乙醇,上下颠倒数次使沉淀脱离管壁;4℃,12000rpm离心5min,倒去上清液;
H6:重复H5操作一次,并用移液枪头吸干液体;
H7:EP管置于室温下晾干,加入100μLDEPC水,溶解RNA;
H8:用核酸定量分析仪测RNA浓度(ng/μl),根据浓度调整体积,贴上标签,至-80℃冷冻保存。
所述步骤2中反转录反应的具体步骤如下:
S1:取总RNA,Buffer,脱氧核糖核酸酶,灭菌水冰上解冻,使用前分别将上述物质涡旋振荡混匀,瞬离收集残留在管壁的液体;(Buffer为MgCl
S2:按体积配制混合液;
S3:配制完成后,涡旋混匀,离心后置于35-37℃,孵育20-40min;加入1-2μL 50-53mM EDTA,60-65℃孵育10-12min,孵育后放置于冰上待用;
S4:在S3配制后的混合液中加入1-2μL随机引物(Random Hexamer primer),在60-65℃下孵育5-6min;
S5:然后加入反转录体系,设置反转录程序,结束后即可。
所述混合液包括混合液Ⅰ和混合液Ⅱ,混合液的制备原料及加入量包括,混合液Ⅰ:总RNA1μg,Buffer1μL,1U/μL的脱氧核糖核酸酶1μL,灭菌水补充至10μL;混合液Ⅱ:总RNA5μg,Buffer1μL,1U/μL的脱氧核糖核酸酶1μL,灭菌水补充至10μL。
所述混合液Ⅰ中总RNA为人源总RNA,混合液Ⅱ中总RNA为鼠源干燥组织总RNA。
所述反转录体系的制备原料及加入量包括,Buffer 4μL,20U/μL的核糖核酸酶抑制剂1μL,200U/μL的逆转录酶1μL,10mM的dNTP Mix 2μL。
所述反转录程序为:设置25℃,反应5min,升温至42℃,反应60min,升温至70℃,反应5min,降温至4℃终止反应。
所述步骤3中引物包括正向引物和反向引物,正向引物的序列为:GAPDH-F5’-TGGGTGTGAACCATGAGAAG-3’;反向引物的序列为:GAPDH-R5’-GTCCTTCCACGATACCAAAGT-3’;所述探针的序列为:HEX 5’-CCTCAAGATCATCAGCAATGCCTCCT-3’BHQ1。
所述步骤3中进行PCR扩增的PCR体系的制备原料及加入量包括:10μM的正向引物0.5μL,10μM的反向引物0.5μL,10μM的探针1μL,PCR混合液12.5μL,灭菌水8μL,cDNA2.5μL。
所述步骤4前还包括特异性验证,孔间重复性评估,板间重复性评估,标准曲线绘制,灵敏度验证。
所述特异性验证的方法具体包括以下步骤:
A1:1μg人源总RNA反转录后的cDNA用灭菌水分别稀释25及250倍作为高、低浓度阳性样品,小鼠5μg肺脏组织总RNA反转录的cDNA原液和稀释10倍作为高、低浓度阴性样品进行引物特异性验证,同时设立纯化水作为空白对照(NTC组)进行TaqMan RT-qPCR扩增,每个样设3个复孔,检验该方法的特异性,加样体系同PCR体系;
A2:加样后,设置程序为:95℃预变性30s;95℃变性5s,60℃30s(荧光信号采集阶段),40个循环;荧光通道为HEX。
特异性验证结果见表2,特异性扩增曲线图见图1。
表2
如表2和图1所示:在小鼠不同浓度的肺脏组织样品和空白对照组中均无扩增曲线或CT值大于39,表明该引物对和探针组合可以实现人源间充质干细胞的特异性表达检测。
所述标准曲线绘制和灵敏度验证的方法具体包括以下步骤:
B1:由人源和小鼠组织分别提取得到人源RNA和鼠源RNA,将人源RNA按照不同比例(50pg/ng、20pg/ng、2pg/ng、0.2pg/ng、0.02pg/ng、0.002pg/ng、0.0002pg/ng、0.0001pg/ng、0.00002pg/ng)与鼠源RNA反转录后混合作为标准品,进行qPCR反应,以标准品浓度Log10值为横坐标,CT值为纵坐标,绘制标准曲线;
B2:确定标准曲线的线性范围和定量下限,同时设置阴性对照(以纯化水代替cRNA,NTC组),每组3个复孔,建立标准曲线,并确定线性范围和检测下限。实验体系同PCR体系。标准曲线方程为y=-3.1134x+24.083,R
所述标准品的配置原料和加入量见表1。标准品的定量结果见表3。灵敏度验证的结果见表4。标准曲线扩增图见图2,标准曲线见图3,灵敏度扩增曲线图见图4。
表3
表4
本专利线性定量范围较宽,在50-2×10
所述孔间重复性评估和板间重复性评估的方法具体包括以下步骤:
C1:孔间重复性评估:选择标准曲线的7个浓度即STD1-STD7分别在同一块96孔板内重复测定6次,计算各含量的板内重复性的变异系数(CV%),CV%=Ct值标准偏差/Ct平均值×100%。加样体系同PCR体系。
C2:板间重复性评估:选择标准曲线的6个浓度即STD2-STD7分别在不同96孔板间重复测定6块板,每板3个复孔,计算各浓度的板间重复性,重复性的变异系数(CV%),CV%=Ct值标准偏差/Ct平均值×100%。加样体系同PCR体系。
孔间重复性评估结果见表5,板间重复性评估结果见表6。
表5
表6
本发明的CV%值不超过5%符合标准,重复性及稳定性良好。
所述步骤4的具体操作为:
D1:以GAPDH为引物,以待测cDNA样品进行qPCR,待测样品使用的cDNA为625pg;以待测样本的CT值代入标准曲线方程后经对数换算,背景上样量为500ng,样本上样量为625ng,换算后的结果除以1.25得到每ng鼠RNA中干细胞的RNA含量;
D2:标准曲线方程为y=-3.1134x+24.083,R
干细胞不同时间点在小鼠肺脏组织内的扩增曲线图见图5,干细胞不同时间点在小鼠血液内的扩增曲线图见图7,将换算后的量通过Graphpad Prism绘制统计图,得到图6和图8。注:图中“—”代表均值。
结果表明经尾静脉注射的人源间充斥干细胞在小鼠肺脏中的含量在0.5h时达到峰值为13.12±4.12pg人源RNA/ng鼠源RNA,随后逐渐下降,48h时肺脏中的hUCMSC(人源间充斥干细胞)含量为0.34±0.27pg人源RNA/ng鼠源RNA,至7d时所有小鼠肺脏中均未检测到hUCMSC的存在(图6)。小鼠血液中hUCMSC含量在0.5h时达到峰值结果为0.15±0.09pg人源RNA/ng鼠源RNA,随后逐渐下降,2h时的hUCMSC含量为0.08±0.11pg人源RNA/ng鼠源RNA,24h时仅检测了2只小鼠血液样本,均可检测到hUCMSC的存在,分别为0.03和0.01pg人源RNA/ng鼠源RNA,至48h仅可检测到1只小鼠中hUCMSC结果为0.01pg人源RNA/ng鼠源RNA,但低于检测下限,7d时所有小鼠血液中均未检测到hUCMSC的存在(图8)。
- 人源间充质干细胞在小鼠体内分布的RT-qPCR检测方法及应用
- 人源间充质干细胞在动物体内定向分布的检测方法
