通过异丁司特治疗眼科疾病/病症或损伤的方法
文献发布时间:2023-06-19 10:58:46
相关申请的交叉引用
本申请要求于2018年10月19日提交的美国临时专利申请62/748,148号的优先权的利益,其全部内容通过引用合并于此。
政府支持声明
本发明是在与美国国立卫生研究院(卫生与人类服务部机构)的合作研究与开发协议的执行中创造的。美国政府对本发明享有某些权利。
背景技术
小分子异丁司特(ibudilast)(3-异丁酰基-2-异丙基吡唑并[1,5-a]吡啶)是巨噬细胞抑制因子(MIF)的抑制剂(Cho et al., PNAS-USA, 2010年6月107: 11313-8),是环状核苷酸磷酸二酯酶(PDE)3A、4、10A1和11A1的选择性抑制剂(Gibson et al., Eur. J.Pharmacol., 538: 39-42, 2006),并且具有toll样受体-4(TLR4)拮抗活性(Yang et al.,Cell Death and Disease (2016) 7, e2234; doi: l0. l038/cddis.20l6.l40)。异丁司特在CNS中广泛分布(Sanftner et al., Xenobiotica, 2009 39: 964-977),在临床相关血浆或CNS浓度下,异丁司特选择性抑制巨噬细胞迁移抑制因子(MIF),其次是PDE 3、4、10和11。异丁司特还作为白三烯D4拮抗剂、抗炎药、PAF拮抗剂和血管舒张剂(ThompsonCurrent Drug Reports)。据认为,异丁司特可能通过抑制神经胶质细胞的活化在哺乳动物的中枢神经系统中发挥神经保护作用(Mizuno et al., Neuropharmacology 46: 404-411, 2004)。
在日本异丁司特已广泛用于缓解与缺血性中风或支气管哮喘有关的症状。在最近的临床试验中,已经探索了其在多发性硬化症(MS)(一种中枢神经系统的炎性疾病)的治疗中的用途(News.Medical.Net; Pharmaceutical News,2005年8月2日)。如在该出版物中所公开的,该临床试验有望治疗“复发-缓解型MS”,但是并未提及进行性多发性硬化症。在美国专利号6,395,747中,异丁司特被公开为用于多发性硬化症的治疗,该多发性硬化症通常被理解为复发缓解型多发性硬化症,而非进行性多发性硬化症。美国专利申请公开号20060160843公开了异丁司特用于治疗间歇性和短期疼痛,但是,这不是与进行性神经退行性疾病有关的疼痛。但是,美国专利号9,314,452公开了异丁司特作为肌萎缩性侧索硬化症(一种进行性神经退行性疾病)的治疗方法。类似地,美国专利号8,138,201公开了异丁司特作为原发性进行性多发性硬化和/或继发性进行性多发性硬化的治疗方法。
迄今为止,异丁司特用于治疗与进行性多发性硬化症相关的黄斑损伤的用途尚未得到广泛探索。
概述
在一方面,本文提供了一种在有需要的人类患者中治疗与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤的方法,该方法包括向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。在一些实施方案中,所述眼科疾病/病症或损伤是黄斑损伤。在一些实施方案中,所述神经退行性疾病/病症是进行性多发性硬化症。
在另一方面,本文提供了一种在有需要的人类患者中减少与进行性多发性硬化症相关的黄斑体积损失的方法,该方法包括向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。在一些实施方案中,与不施用异丁司特或其药学上可接受的盐相比,所述异丁司特或其药学上可接受的盐的施用减少了人类患者的黄斑体积损失。
在一些实施方案中,所述进行性多发性硬化症已经进展到超过复发缓解型多发性硬化症。在一些实施方案中,所述进行性多发性硬化症是原发性进行性多发性硬化症。在一些实施方案中,所述原发性进行性多发性硬化症的特征在于从发病开始的疾病进展,允许偶然的平台期(plateaus)和暂时的轻微改善,但没有明显的复发。
在一些实施方案中,所述进行性多发性硬化症是继发性进行性多发性硬化症。在一些实施方案中,所述继发性进行性多发性硬化症的特征在于初始的复发-缓解过程,继之以进展,伴有或不伴有偶然复发、轻微缓解和平台期。
在一些实施方案中,所述异丁司特或其药学上可接受的盐施用至少约12、24、36、48、60、72、84或96周。在一些实施方案中,所述异丁司特或其药学上可接受的盐施用约12、24、36、48、60、72、84或96周。在一些实施方案中,所述异丁司特或其药学上可接受的盐施用至少约1年、2年、3年、4年或5年。在一些实施方案中,所述异丁司特或其药学上可接受的盐施用1年、2年、3年、4年或5年。
在一些实施方案中,所述异丁司特或其药学上可接受的盐被口服施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以片剂、胶囊剂、颗粒剂或微珠剂型施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以液体剂型施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐被配制为缓释制剂。
在一些实施方案中,所述异丁司特或其药学上可接受的盐以约0.1 mg/天至约4,000 mg/天的量施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以约0.1mg/天至约720 mg /天的量施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以至少约30 mg/天的量施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以约30 mg/天至约200 mg/天的量施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以约60 mg/天至约600 mg/天的量施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以约60 mg/天至约100 mg/天的量施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以约100 mg/天至约480 mg/天的量施用。
在一些实施方案中,所述异丁司特或其药学上可接受的盐以约30 mg/天、约60mg/天、约80 mg/天、约90 mg/天、约100 mg/天、约120 mg/天、约150 mg/天、约180 mg/天、约210 mg/天、约240 mg/天、约270 mg/天、约300 mg/天、约360 mg/天、约400 mg/天、约440mg/天、约480 mg/天、约520 mg/天、约580 mg/天、约600 mg/天、约620 mg/天、约640 mg/天、约680 mg/天、或约720 mg/天的量施用。在一些实施方案中,所述异丁司特或其药学上可接受的盐以约60 mg/天、约80 mg/天、或约100 mg/天的量施用。在一些实施方案中,每天施用的异丁司特或药学上可接受的盐的量分为一、二或三个部分。
附图说明
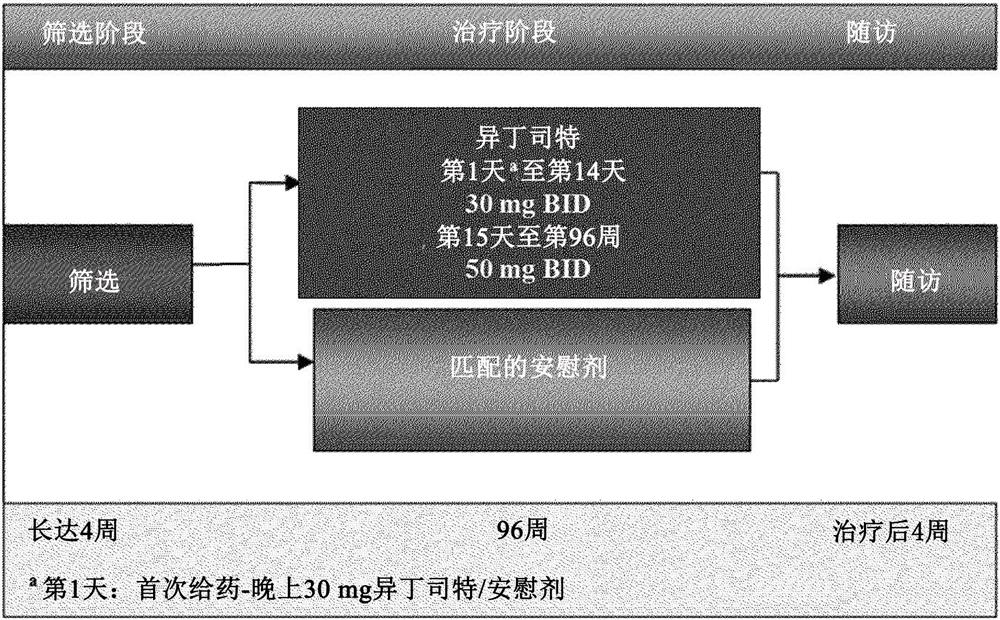
图1示出了研究设计。
详细说明
本发明涉及与神经退行性疾病/病症(例如但不限于进行性形式的多发性硬化症)或神经眼科病症相关的眼科疾病/病症或损伤的治疗或缓解。在一些实施方案中,多发性硬化的进行性形式不包括复发/缓解型多发性硬化。所公开的技术涉及异丁司特或其药学上可接受的盐用于患有与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤的人类患者的用途。
在一些实施方案中,本文提供了在有需要的人类患者中治疗与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤的方法,该方法包括以下步骤,或基本上由其组成,或由其组成:向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。在一些实施方案中,所述眼科疾病/病症或损伤是黄斑损伤。在一些实施方案中,所述神经退行性疾病/病症是进行性多发性硬化症。
在一些实施方案中,本文提供了在有需要的人类患者中治疗与神经退行性疾病/病症相关的眼科疾病/病症或损伤的方法,该方法包括以下步骤,或基本上由其组成,或由其组成:向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。
在一些实施方案中,本文提供了在有需要的人类患者中治疗与神经退行性疾病/病症或神经眼科病症相关的视网膜损伤的方法,该方法包括以下步骤,或基本上由其组成,或由其组成:向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。
在一些实施方案中,本文提供了在有需要的人类患者中治疗与进行性多发性硬化症相关的眼科疾病/病症或损伤的方法,该方法包括以下步骤,或基本上由其组成,或由其组成:向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。
在一些实施方案中,本文提供了在有需要的人类患者中治疗与进行性多发性硬化症相关的视网膜损伤的方法,该方法包括以下步骤,或基本上由其组成,或由其组成:向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。
在一些实施方案中,本文提供了在有需要的人类患者中治疗与进行性多发性硬化症相关的黄斑损伤的方法,该方法包括以下步骤,或基本上由其组成,或由其组成:向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。
在一些实施方案中,本文提供了在有需要的人类患者中减少与进行性多发性硬化症相关的黄斑体积损失的方法,该方法包括以下步骤,或基本上由其组成,或由其组成:向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。在一些实施方案中,与不施用异丁司特或其药学上可接受的盐相比,所述异丁司特或其药学上可接受的盐的施用减少了人类患者的黄斑体积损失。
除非另有说明,否则本公开的实践将采用本领域技术范围内的化学、生物化学和药理学的常规方法。文献中对这些技术进行了充分的解释。参见,例如,A. L. Lehninger,Biochemistry (Worth Publishers, Inc., current addition);Morrison and Boyd,Organic Chemistry (Allyn and Bacon, Inc., current addition);J. March,Advanced Organic Chemistry (McGraw Hill, current addition);Remington: TheScience and Practice of Pharmacy, A. Gennaro, Ed., 20th Ed.;FDA’s OrangeBook, Goodman & Gilman The Pharmacological Basis of Therapeutics, J. GriffithHardman, L. L. Limbird, A. Gilman, l lth Ed., 2005, The Merck Manual, 18thedition, 2007,以及The Merck Manual of Medical Information 2003。
本文(无论是上文还是下文)引用的所有出版物,包括互联网文章、FDA橘皮书(可从FDA网站上获得)、书籍、手册、期刊文章、专利和专利申请,均通过引用整体并入本文。
定义
在详细描述本公开之前,应理解,本公开不限于特定的施用模式、患者人群等,因为它们可以变化,如在所附的描述和附图中显而易见的。
必须注意的是,如在本说明书和预期的权利要求书中所使用的,单数形式的“一个”、“一种”和“该”包括复数对象,除非上下文另外明确指出。因此,例如,提及“一种药物”包括单一药物以及两种或更多种相同或不同的药物,提及“任选的赋形剂”是指单一任选的赋形剂以及两种或更多种相同或不同的任选的赋形剂,等等。
在描述和要求保护本公开时,将根据以下描述的定义使用以下术语。
如本文使用的,术语“包含”旨在意为组合物和方法包括所述的元素但不排除其他元素。“基本上由……组成”当被用来定义组合物和方法时,应该意为排除对于陈述的目的的组合来说具有任何实质性作用的其他元素。因此,如本文定义的基本上由该元素组成的组合物,将不排除不会实质上影响所要求保护的发明的基本的和新颖性特征的其他材料或步骤。“由……组成”应当意为排除多于微量元素的其他成分和实质性方法步骤。由这些过渡术语中的每一个限定的实施方案在本发明的范围内。当实施方案由这些术语之一(例如,“包含”)定义时,应当理解,本公开还包括替代的实施方案,例如,对于所述实施方案,还包括“基本上由……组成”和“由……组成”的实施方案。
“任选的”或“任选地”是指随后描述的情况可以发生或可以不发生,因此该描述包括发生情况的例子和未发生情况的例子。
“药学上可接受的赋形剂或载体”是指可以任选地被包含在本公开的组合物中并且不会对患者引起明显的有害毒理作用的赋形剂。
“药学上可接受的盐”包括但不限于:氨基酸盐;用无机酸制备的盐,例如氯化物、硫酸盐、磷酸盐、二磷酸盐、溴化物和硝酸盐,或由前述任何一种的相应的无机酸形式制备的盐,例如盐酸盐等;或用有机酸制备的盐,例如苹果酸盐、马来酸盐、延胡索酸盐、酒石酸盐、琥珀酸盐、乙基琥珀酸盐、柠檬酸盐、乙酸盐、乳酸盐、甲磺酸盐、苯甲酸盐、抗坏血酸盐、对甲苯磺酸盐、棕榈酸盐、水杨酸盐和硬脂酸盐;以及依托酸盐、葡庚糖酸盐和乳糖醛酸盐。类似地,含有药学上可接受的阳离子的盐包括但不限于钠、钾、钙、铝、锂和铵(包括取代的铵)。
如本文所述,“活性分子”或“活性剂”包括在体内或体外可以被证明提供某些药理作用(通常是有益的作用)的任何试剂、药物、化合物、物质或混合物的组合物。其包括食品、食品补充剂、营养素、营养食品、药物、疫苗、抗体、维生素和其他有益物质。如本文所用,术语还包括在患者中产生局部或全身作用的任何生理或药理活性物质。在具体的实施方案中,活性分子或活性剂包括异丁司特或其药学上可接受的盐。
“大体上”或“基本上”是指几乎全部的或完全的,例如,给定数量的95%或更高。在一些实施方案中,“大体上”或“基本上”是指95%、96%、97%、98%、99%、99.5%或99.9%。
术语“对象”、“个体”或“患者”在本文可互换使用,并且是指脊椎动物,优选哺乳动物。哺乳动物包括但不限于小鼠、啮齿动物、大鼠、猿猴、人、农场动物、狗、猫、运动动物和宠物。在本发明中,对象、个体或患者是指人。
如本文所提供的,组合物或药剂的“药学有效量”或“治疗有效量”指无毒但足以提供所需反应(例如减少或逆转进行性多发性硬化)的组合物或药剂。所需的确切量因对象而改变,这取决于对象的种类、年龄和一般状况、所治疗疾病的严重程度、所使用的一种或多种特定药物、给药方式等。基于本文提供的信息,本领域普通技术人员可以使用常规实验来确定在任何个别情况下的适当“有效”量。
术语“约”将被本领域普通技术人员理解,并且将在一定程度上根据其使用的上下文而变化。如果该术语的使用在给定使用它的上下文中对本领域普通技术人员存在不清楚,则“约”表示特定术语的最多正负10%。例如,在一些实施方案中,它将表示特定术语的正负5%。本文提供了一些范围,数值之前带有术语“约”。本文使用的术语“约”用于为其后的确切数字以及与该术语后的接近或近似数字的数字提供文字支持。在确定数字是否接近或近似于具体列举的数字时,接近或近似的未列举数字可以是一个数字,在给出该数字的上下文中,该数字提供了具体列举的数字的基本等同形式。
如本文所用,术语“治疗”是指对患者的疾病或病症或相关病症的任何治疗,包括抑制疾病或病症,即抑制或压制临床症状的发展。“治疗”还包括阻止疾病的一种或多种症状的发展或将其逆转。为了本发明的各个方面和实施方案的目的,有益的或期望的临床结果包括但不限于:减少、减轻或改善进行性多发性硬化的一种或多种表现形式或负面影响,一种或多种临床结果的改善,硬化程度的降低,硬化进展的延迟或减慢,硬化状态的改善、减轻或稳定,以及本文所述的其他有益结果。
在某些方面,术语治疗是指临床结果的改善。术语“临床结果”是指与患者对疗法的反应有关的任何临床观察或测量。
根据以下详细描述,本发明的其他目的、特征和优点将变得显而易见。然而,应该理解,尽管详细描述和具体实施例示出了本发明的具体实施方案,但是仅以示例性的方式给出,因为根据该详细描述,在本发明的精神和范围内的各种改变和修改对于本领域技术人员将变得显而易见。
神经退行性疾病/病症
示例性的神经退行性疾病/病症包括但不限于:阿尔茨海默氏病,阿尔茨海默氏型老年性痴呆,或皮克氏病(大叶萎缩),多发性硬化症,包括将进行性痴呆与其他突出的神经系统异常相结合的综合征的神经退行性疾病,主要困扰成年人并且包括亨廷顿病的进行性神经退行性形式的进行性神经退行性疾病,痴呆合并共济失调和/或帕金森氏病表现的多系统萎缩症,进行性核上性麻痹(Steele-Richardson-Olszewski),弥漫性路易体病,或皮质齿状腺退变。其他对象可能患有主要困扰年轻人和儿童的进行性神经退行性疾病,包括:Hallervorden-Spatz病和进行性家族性肌阵挛性癫痫,包括逐渐形成姿势和运动异常的综合征的进行性神经退行性疾病,或包括麻痹性震颤(帕金森氏病)的疾病,纹状体黑质变性,进行性核上性麻痹,扭转性肌张力障碍(扭转性痉挛;变形肌张力障碍(dystoniamusculorum deformans)),痉挛性斜颈和其他限制性运动障碍,家族性震颤,或Gilles dela Tourette综合征,进行性共济失调综合征,小脑变性或脊髓小脑变性,小脑皮质变性或少脑桥小脑萎缩(OPCA),脊髓小脑变性(包括脊髓小脑变性)(弗里德里希共济失调和相关疾病)。神经退行性疾病/病症包括但不限于:中枢植物神经系统衰竭(Shy-Drager综合征),肌肉无力和虚弱无感觉改变的综合征(运动神经元疾病),肌萎缩性侧索硬化症(ALS),脊髓性肌萎缩,婴儿性脊髓性肌萎缩症(Werdnig-Hoffmann),少年性脊髓性肌萎缩症(Wohlfart-Kugelberg-Welander),或其他形式的家族性脊髓性肌萎缩症,原发性侧索硬化症或遗传性痉挛性截瘫,合并肌无力和消瘦伴感觉改变的综合症(进行性神经性神经萎缩;慢性家族性多发性神经病),腓骨肌萎缩(Charcot-Marie-Tooth),肥厚性间质性多发性神经病(Deferine-Sottas),或其他形式的慢性进行性神经病,包括进行性视力丧失综合征的进行性神经退行性疾病。神经退行性疾病/病症包括但不限于:视网膜色素变性(色素性视网膜炎),或遗传性视神经萎缩(莱伯氏(Leber’s)病),运动神经元疾病和进行性共济失调;青光眼;偶发性进行性神经退行性疾病,多传导性运动神经病伴传导阻滞,运动性神经病伴副蛋白血症,运动为主的周围神经病,少突性小脑脑萎缩,亚速尔 (Machado-Joseph)病,家族性进行性神经退行性疾病,例如家族性肌萎缩性侧索硬化,脊髓性肌萎缩症,家族性痉挛性下肢轻瘫,遗传性生化失调,多发性先天性关节炎,或进行性少年延髓性麻痹(Fazio-Londe)。遗传性生化疾病的例子是超氧化物歧化酶缺乏症、己糖胺酶A和B缺乏症、或雄激素受体突变(肯尼迪综合症)。进行性神经退行性疾病可以包括病毒性和病毒性疾病,例如HTLV-1相关性脊髓病、进行性多灶性白质脑病、Creutzfeldt-Jakob病、Gerstmann-Straussler-Scheinker病、kuru、致命性家族性失眠、或Alper病。
“进行性神经退行性疾病”是指处于进行性状态(即,与基线水平相比变得更差)或具有这种进行性特征的任何神经退行性疾病。 因此,进行性状态随着时间的流逝使症状恶化,并且可能是突发性或渐进性的。进行性神经退行性疾病的例子包括帕金森氏病、肌萎缩性侧索硬化、阿尔茨海默氏病和进行性形式的多发性硬化症,不包括复发/缓解型多发性硬化症。
神经眼科疾病
示例性的神经眼科疾病包括但不限于:乳头水肿和特发性颅内高压(IIH);前部缺血性视神经病变(AION);视神经炎;眼运动性颅神经病;以及荷马(Homer)综合症。
进行性多发性硬化症
多发性硬化症(multiple sclerosis,MS)是一种复杂的自身免疫性疾病,其病因主要未知,目前影响全世界约250万人。多种病理过程,例如炎症、脱髓鞘、轴突损伤和修复机制,都构成了MS的复杂疾病表现。MS通常是一种散发性疾病,其特征是神经系统的各种进行性疾病,其中大脑和脊髓内部会出现片状的退行性变和炎性变化。退行性变和炎性变化与硬化斑块的形成有关,其部分归因于神经元髓鞘的异常硬化和纤维化。症状多种多样,包括震颤、眼球震颤、瘫痪以及言语和视觉障碍。该病的症状通常在成年早期出现,并伴有特征性病情加重和缓解。
复发性缓解型多发性硬化症(relapsing remitting multiple sclerosis,RRMS)是该疾病的最常见类型,占患者的65%-85%。大多数RRMS患者最终会进展为该疾病的继发性进行性(SPMS)形式。尽管最近对于复发性缓解型多发性硬化症(RRMS)的药物治疗有所改进,但在没有复发的情况下,尚无普遍认为对进行性MS有效的疗法。少数研究显示抗炎疗法在进行性MS中的功效可能是由该疗法的抗炎作用驱动的。目前,米托蒽醌(mitoxantrone)是FDA批准的唯一用于继发性进行性MS的疗法,但由于其具有心脏损伤和血癌(例如白血病)的风险,因此并不常用。对于没有明显炎症的进行性MS患者,非常需要一种安全、有效和方便给药的治疗方法。
有四种公认的多发性硬化症类型:(1)复发/缓解型多发性硬化症(RR多发性硬化症),(2)继发性进行性多发性硬化症(SP多发性硬化症),(3)进行性复发性多发性硬化症(PR多发性硬化症),以及(4)原发性进行性多发性硬化症(PP多发性硬化症)。RR多发性硬化症不被认为落入权利要求的范围内,但是其他形式的多发性硬化症,即SP多发性硬化症、PR多发性硬化症和PP多发性硬化症被认为是本发明的一个方面。在所有类型的进行性MS中,无论复发与否,功能都会随着时间的流逝而丧失。
“复发/缓解型多发性硬化症”(RR多发性硬化症)的特征在于复发(也称为恶化),在此期间可能出现新症状而旧症状重新出现或恶化。复发之后是缓解期,在此期间,该人完全或部分地从复发期间获得的缺陷中恢复。复发可能持续数天、数周或数月,并且恢复可能是缓慢的和渐进的或几乎是瞬时的。患有多发性硬化症的绝大多数人首先被诊断为复发/缓解型。这通常是在他们二十多岁或三十多岁的时候,尽管已知的诊断要早得多或晚得多。出现这种类型的女性大约是男性的两倍。
在“继发性多发性硬化症”(SP多发性硬化症)中,最初患有复发-缓解型多发性硬化症的人开始发展为神经功能逐渐恶化,有或没有复发。多年后,许多患有复发/缓解型多发性硬化症的人将进入该疾病的继发性进展期。其特征是疾病在复发之间逐渐恶化。在继发性进展期MS的早期阶段,该人可能仍会经历几次复发,但过一会儿这些疾病合并为一般疾病。复发后人们通常不恢复原来的功能。继发性MS患者可能会经历好和坏的数天或数周,但除了复发发作后的某些缓解外,没有真正的恢复。10年后,患有复发/缓解型多发性硬化症的人中有50%会发展为继发性进行性疾病。到25至30年时,该数字将上升到90%。
“进行性复发性多发性硬化症”(PR多发性硬化症)显示出从症状最开始时的残疾水平的明显进展,但是明显复发的发作可能与急性发作后的某些恢复相关或不相关。这种形式的多发性硬化症从发病开始就随着病程的进展,被复发打断。复发后立即有明显的恢复,但是在复发之间症状逐渐恶化。
“原发性进行性多发性硬化症”(PP多发性硬化症)的特征在于该疾病从发病开始逐渐进展,完全没有缓解或复发。可能会有一段时间疾病活动趋于平稳,并且与继发性进行性疾病一样,可能有好和坏的数天或数周。PP多发性硬化症与复发/缓解型MS和继发性进行性MS的不同之处在于,其发作通常在30岁末或40岁初,男性和女性很可能会患上这种疾病,最初的疾病活动是在脊髓而不是大脑中。原发性进行性多发性硬化症通常会迁移到大脑中,但与复发/缓解型或继发性进行性进展相比,损害大脑区域的可能性较小——例如,原发性进行性MS患者不太可能出现认知问题。
在一些实施方案中,所述进行性多发性硬化症已经进展到超过复发缓解型多发性硬化症。在一些实施方案中,所述进行性多发性硬化症是原发性进行性多发性硬化症。在一些实施方案中,所述原发性进行性多发性硬化症的特征在于从发病开始的疾病进展,允许偶然的平台期和暂时的轻微改善,但没有明显的复发。在一些实施方案中,所述进行性多发性硬化症是继发性进行性多发性硬化症。在一些实施方案中,所述继发性进行性多发性硬化症的特征在于初始复发-缓解过程,继之以进展,伴有或不伴有偶然复发、轻微缓解和平台期。
与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤
在一些实施方案中,与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤是视网膜损伤。在一些实施例中,视网膜损伤并非由于偶然原因而发生。在一些实施方案中,视网膜损伤是由于疾病或病症而发生的。在一些实施方案中,视网膜损伤是黄斑损伤。
在一些实施方案中,与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤是黄斑损伤。在一些实施例中,黄斑损伤并非由于偶然原因而发生。在一些实施方案中,黄斑损伤是由于疾病或病症而发生的。在一些实施方案中,通过测量黄斑体积损失和/或颗粒细胞/内部丛状层(GCIP)的变薄来评估黄斑损伤。
在一些实施方案中,与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤是单侧核间性眼肌麻痹、凝视诱发性眼球震颤、眼跳过度(saccadichypermetria)、前庭眼反射抑制缺乏、或摆动性眼球震颤。
在一些实施方案中,与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤是黄斑变性、视网膜变性、或糖尿病性视网膜病。在一些实施方案中,与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤是黄斑变性。在一些实施方案中,与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤是视网膜变性。在一些实施方案中,与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤是糖尿病性视网膜病。
异丁司特
本发明的方法基于分子异丁司特的施用。异丁司特是具有以下结构的小分子药物(分子量为230.3)。
异丁司特也可以在ChemBank ID 3227、CAS#50847-11-5和Beilstein手册参考号5-24-03-00396中找到。它的分子式对应于C
异丁司特是巨噬细胞抑制因子(MIF)的抑制剂。异丁司特还是环状核苷酸磷酸二酯酶(PDE)3A、4、10A1和11A1的选择性抑制剂(Gibson et ah, Eur. J. Pharmacol. 538:39-42, 2006),并且据报道其还具有白三烯D4和PAF拮抗活性。与其他PDE抑制剂和抗炎症性的药剂相比,它的特性看来具有有效的抗炎症性作用,并且具有独特性。PDE催化结合在3’-碳上的磷酸酯键的水解,以生成相应的5’-核苷酸单磷酸。因此,它们调节环核苷酸的细胞浓度。由于许多激素和神经递质的细胞外受体利用环状核苷酸作为第二信使,因此PDE还调节细胞对这些细胞外信号的反应。至少有八类PDE:Ca
如前所述,对本文所述药物中的任何一种或多种的提及,特别是异丁司特,是指在适用时涵盖任何和所有对映异构体、对映异构体的混合物(包括外消旋混合物)、前药、药学上可接受的盐形式、水合物(例如一水合物、二水合物等)、溶剂化物、不同的物理形式(例如结晶固体、无定形固体)、代谢产物等。
施用方法
可以通过各种递送方式来完成异丁司特的给药。异丁司特的优选递送方法包括全身性和局部性递送。这样的施用途径包括但不限于口服、动脉内、鞘内、脊柱内、肌内、腹膜内、鼻内和吸入途径。
更具体地,可以通过任何合适的途径来施用本发明的异丁司特以进行治疗,包括但不限于口服的、直肠的、鼻腔的、局部的(包括经皮的、喷雾的、面颊的和舌下的)、阴道的、肠胃外的(包括皮下的、静脉内的、肌内的和皮内的)、鞘内的和肺的。在一些实施方案中,异丁司特经口服施用。在一些实施方案中,异丁司特通过注射施用。优选的途径将根据接受者的状况和年龄、所治疗的特定综合症以及所用药物的具体组合而变化。
在一些实施方案中,异丁司特或其药学上可接受的盐经口服施用。
剂量
治疗量可以根据经验确定,并且将随所治疗的特定病症、对象以及组合物中包含的每种活性剂的功效和毒性而变化。实际施用的剂量将取决于对象的年龄、体重和一般状况以及所治疗状况的严重性、医疗保健专业人员的判断以及所施用的特定组合。
治疗有效量可以由本领域技术人员确定,并将根据每种具体情况的要求进行调整。通常,异丁司特或其药学上可接受的盐的治疗有效量的总日剂量为约0.1 mg/天至4,000 mg/天、约0.1 mg/天至720 mg/天、约60-600 mg/天、或约100-480 mg/天、或更优选地,其量在约1-240 mg/天之间、约30-240 mg/天、约30-200 mg/天、约30-120 mg /天、约1-120mg/天、约50-150 mg/天、约60-150 mg/天、约60-120 mg/天、或约 60-100 mg/天,以单剂量或多剂量施用。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为约30-200 mg/天,以单剂量或多剂量施用。在一些实施方案中,多次剂量包括每天两次、三次或四次剂量。在一些实施方案中,多次剂量包括每天两次或三次。
在一些实施方案中,异丁司特或其药学上可接受的盐的剂量包括大于约20 mgBID或TID的剂量。在一些实施方案中,异丁司特或其药学上可接受的盐的剂量大于约30mg/天、60 mg/天、80 mg/天、90 mg/天、120 mg/天、150 mg/天、180 mg/天、210 mg/天、240mg/天、270 mg/天、300 mg/天、360 mg/天、400 mg/天、440 mg/天、480 mg/天、520 mg/天、580 mg/天、600 mg/天、620 mg/天、640 mg/天、680 mg/天和720 mg/天或更多。
在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少30 mg/天、至少40 mg/天、至少50 mg/天、至少60 mg/天、至少70 mg/天、至少80 mg/天、至少90mg/天、至少100 mg/天、至少110 mg/天、至少120 mg/天、至少130 mg/天、至少140 mg/天、至少150 mg/天、至少160 mg/天、至少170 mg/天、至少180 mg/天、至少190 mg/天、至少200mg/天、至少225 mg/天、至少250 mg/天、至少275 mg/天、至少300 mg/天、至少325 mg/天、至少350 mg/天、至少375 mg/天、至少400 mg/天、至少425 mg/天、至少450 mg/天、至少475mg/天、至少500 mg/天、至少525 mg/天、至少550 mg/天、至少575 mg/天、至少600 mg/天、至少625 mg/天、至少650 mg/天、至少675 mg/天、至少700 mg/天、或至少720 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少60 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少30 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少60 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少80 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少100 mg/天。
在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少30 mg/天、至少40 mg/天、至少50 mg/天、至少60 mg/天、至少70 mg/天、至少80 mg/天、至少90mg/天、至少100 mg/天、至少110 mg/天、至少120 mg/天、至少130 mg/天、至少140 mg/天、至少150 mg/天、至少160 mg/天、至少170 mg/天、至少180 mg/天、至少190 mg/天、至少200mg/天、至少225 mg/天、至少250 mg/天、至少275 mg/天、至少300 mg/天、至少325 mg/天、至少350 mg/天、至少375 mg/天、至少400 mg/天、至少425 mg/天、至少450 mg/天、至少475mg/天、至少500 mg/天、至少525 mg/天、至少550 mg/天、至少575 mg/天、至少600 mg/天、至少625 mg/天、至少650 mg/天、至少675 mg/天、至少700 mg/天、或至少720 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少30 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少60 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少60 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少80 mg/天。在一些实施方案中,异丁司特或其药学上可接受的盐的治疗有效量为至少100 mg/天。
根据剂量和要治疗的确切病症,给药可以每天一次、两次、三次或四次,持续时间为一天到几天、几周、几个月、甚至几年、甚至可能持续病人的一生。示例性的给药方案将持续至少约一周、从约1-4周、从约1-8周、从1-12周、从1-16周、从1-20周、从1-24周、从1-36周、从1-48周、从1-52周、从1-60周、从1-72周、从1-84周、从1-96周、从1周到1年、从1周至2年、从1周至3年、从1周至4年、从1周至5年、或更长时间。在一些实施方案中,给药方案为至少约12、24、36、48、60、72、84或96周的时间。在一些实施方案中,给药方案为约12、24、36、48、60、72、84或96周的时间。在一些实施方案中,给药方案为至少约1年、2年、3年、4年、或5年的时间。在一些实施方案中,给药方案为约1年、2年、3年、4年、或5年的时间。
实际上,根据临床医生的判断、患者的需求等,可以以各种给药方案来施用本发明或活性剂的任何给定组合物的单位剂量。特定的给药方案是本领域普通技术人员已知的,或者可以使用常规方法通过实验确定。示例性的给药方案包括但不限于每天给药五次、每天四次、每天三次、每天两次、每天一次、隔天一次、每周三次、每周两次、每周一次、每月两次、每月一次等等。
制剂
本文所述的活性剂,如异丁司特或其药学上可接受的盐,可以以可任选地包含一种或多种如下所述的其他成分的制剂的形式给药。
在一方面,本文提供了一种组合物,其包含:(a)治疗有效量的异丁司特或其药学上可接受的盐,以及(b)至少一种药学上可接受的赋形剂和/或载体,或基本上由其组成,或由其组成。
赋形剂/载体
本发明的组合物还可以包含一种或多种药学上可接受的赋形剂或载体。示例性的赋形剂包括但不限于聚乙二醇(PEG)、PEG 400、(2-羟丙基)-P-环糊精、氢化蓖麻油(HCO)、克列莫佛(cremophors)、碳水化合物、淀粉(例如玉米淀粉)、无机盐、抗菌剂、抗氧化剂、粘结剂/填充剂、表面活性剂、润滑剂(例如硬脂酸钙或硬脂酸镁)、助流剂(例如滑石粉)、崩解剂、稀释剂、缓冲剂、酸、碱、涂膜、它们的组合等。
本发明的组合物可以包括一种或多种碳水化合物,例如糖,衍生化的糖,例如糖醇、醛糖酸、酯化糖、和/或糖聚合物。具体的碳水化合物赋形剂包括例如:单糖,例如果糖、麦芽糖、半乳糖、葡萄糖、D-甘露糖、山梨糖等;二糖,例如乳糖、蔗糖、海藻糖、纤维二糖等;多糖,例如棉子糖、松三糖、麦芽糖糊精、右旋糖酐、淀粉等;以及糖醇,例如甘露醇、木糖醇、麦芽糖醇、乳糖醇、木糖醇、山梨糖醇(葡萄糖醇)、吡喃糖基山梨糖醇、肌醇等。
还适合于用于本发明的组合物的是马铃薯和玉米基淀粉,例如羟基乙酸淀粉钠和直接可压缩的变性淀粉。
其他代表性的赋形剂包括无机盐或缓冲剂,例如柠檬酸、氯化钠、氯化钾、硫酸钠、硝酸钾、磷酸二氢钠、磷酸氢二钠及其组合。
本发明的组合物还可以含有一种或多种抗氧化剂。抗氧化剂用于防止氧化,从而防止制剂中药物或其他成分的变质。用于本发明的合适的抗氧化剂包括例如:抗坏血酸棕榈酸酯、丁基羟基茴香醚、二叔丁基对甲酚、次磷酸、硫代甘油、没食子酸丙酯、亚硫酸氢钠、甲醛次硫酸氢钠、偏亚硫酸氢钠、及其组合。
另外的示例性赋形剂包括:表面活性剂,例如聚山梨酯(例如“Tween 20”和“Tween80”);以及普郎尼克类(pluronics),例如F68和F88(两者均可以从BASF, Mount Olive,N.J.获得);失水山梨醇酯;脂类(例如,磷脂质例如卵磷脂和其他磷脂酰胆碱,以及磷脂酰乙醇胺);脂肪酸和脂肪酯;类固醇,例如胆固醇;以及螯合剂,例如EDTA、锌和其他合适的阳离子。
此外,本发明的组合物可以任选地包括一种或多种酸或碱。可以使用的酸的非限制性实施例包括选自以下的酸:盐酸、乙酸、磷酸、柠檬酸、苹果酸、乳酸、甲酸、三氯乙酸、硝酸、高氯酸、磷酸、硫酸、富马酸及其组合。适合的碱的非限制性实施例包括但不限于选自以下的碱:氢氧化钠、乙酸钠、氢氧化铵、氢氧化钾、乙酸铵、乙酸钾、磷酸钠、磷酸钾、柠檬酸钠、甲酸钠、硫酸钠、硫酸钾、富马酸钾及其组合。
组合物中任何单独的赋形剂的量将根据赋形剂的作用、活性剂组分的剂量需求以及组合物的特殊需要而变化。通常,通过常规实验确定任何单独的赋形剂的最佳量,即,通过制备包含变化量(从低到高)的赋形剂的组合物,检查稳定性和其他参数,然后确定达到最佳性能而没有明显不良反应的范围。
然而,通常,赋形剂以以下量存在于组合物中:按重量计约1%至约99%、优选地按重量计约5%至约98%、更优选地按赋形剂的重量计约15%至约95%。通常,本发明的异丁司特组合物中存在的赋形剂的量选自以下:按重量计至少约2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、或甚至95%。
这些前述药物赋形剂与其他赋形剂一起描述于"Remington: The Science &Practice of Pharmacy", l9th ed., Williams & Williams, (1995), the "Physician's Desk Reference", 52.sup.nd ed., Medical Economics, Montvale, N.J. (1998),和Kibbe, A. EL, Handbook of Pharmaceutical Excipients, 3.sup.rd Edition,American Pharmaceutical Association, Washington, D.C., 2000中。
其他活性物
除了异丁司特或其药学上可接受的盐外,根据本发明的制剂(或试剂盒)还可包含一种或多种其他治疗活性剂。在一些实施方案中,一种或多种其他治疗剂是一种具有不同于异丁司特的作用机理的治疗剂。这些活性成分可以在以下列出的中找到:FDA的橙皮书、Goodman & Gilman The Pharmacological Basis of Therapeutics、J. GriffithHardman, L. L. Limbird, A. Gilman, 1 lth Ed., 2005、The Merck Manual, 18thedition, 2007、以及The Merck Manual of Medical Information 2003。
持续递送制剂
在一些实施方案中,配制组合物以改善异丁司特或其药学上可接受的盐的稳定性并延长其半衰期。例如,异丁司特或其药学上可接受的盐可以以控释或缓释制剂的形式被递送。通过将异丁司特或其药学上可接受的盐并入载体或媒介物中来制备控释或缓释制剂,载体或媒介物例如是脂质体、不可吸收的不可渗透的聚合物(例如,乙烯乙酸乙烯酯共聚物和Hytrel®共聚物)、可溶胀的聚合物(例如,水凝胶)、或可吸收的聚合物(例如,胶原蛋白和某些多元酸或聚酯,例如用于制造可吸收缝合线的那些)。另外,异丁司特或其药学上可接受的盐可以被密封、吸附至颗粒载体或与颗粒载体结合。颗粒载体的实施例包括衍生自聚甲基丙烯酸甲酯聚合物的那些、以及衍生自聚(丙交酯)和聚(丙交酯-共-乙交酯)(称为PLG)的微粒。参见,例如Jeffery et ak, Pharm. Res. (1993) 10:362-368;以及McGee et ak, J. Microencap. (1996)。
适合于此目的的缓释聚合物是本领域已知的,包括疏水性聚合物,例如纤维素醚。适合的纤维素醚的非限制性实施例包括:乙基纤维素,乙酸纤维素等;聚乙烯醇酯,例如聚乙酸乙烯酯、聚丙烯酸酯、甲基丙烯酸和丙烯酸脂聚合物(与PH无关的类型);高分子量聚乙烯醇和蜡,例如脂肪酸和甘油酯、甲基丙烯酸酯中性聚合物、聚乙烯醇-马来酸酐共聚物等;丙烯酸乙酯-甲基丙烯酸甲酯共聚物;氨烷基甲基丙烯酸酯共聚物;及其混合物。
递送形式
本文所述的组合物包含所有类型的制剂,尤其是适合于全身或鞘内施用的那些。口服剂型包括片剂、锭剂、胶囊、糖浆、口服悬浮液、乳剂、颗粒剂和丸剂。在一些实施方案中,口服剂型是片剂、胶囊剂、颗粒剂或微珠剂型。在一些实施方案中,口服剂型是片剂。在一些实施方案中,片剂是缓释片剂。在一些实施方案中,口服剂型是胶囊。在一些实施方案中,胶囊是缓释胶囊。在一些实施方案中,口服剂型是液体剂型。在一些实施方案中,口服剂型是缓释制剂。
替代的制剂包括可以被重构的气溶胶、经皮贴剂、凝胶、霜剂、软膏、栓剂、粉末或冻干剂,以及液体。用于例如在注射之前重构固体组合物的合适的稀释剂的实施例包括用于注射的抑菌水、含5%葡萄糖的水、磷酸盐缓冲盐水、林格氏(Ringer's)溶液、盐水、无菌水、去离子水及其组合。关于液体药物组合物、溶液和悬浮液是预期的。优选地,本发明的异丁司特或其药学上可接受的盐组合物是适合于口服施用的一种。
现在转向口服递送制剂,片剂可以任选地与一种或多种辅助成分或添加剂一起来通过压制或模制制备。例如,通过在合适的压片机中压缩自由流动形式的活性成分(例如粉末或颗粒),其任选地与粘合剂(例如,聚维酮、明胶、羟丙基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如,羧基乙酸淀粉钠、交联聚维酮、交联羧甲基纤维素钠)和/或表面活性剂或分散剂混合,以制备压缩片剂。
例如,通过在合适的压片机中模制用惰性液体稀释剂润湿的粉末状化合物的混合物来制备模制的片剂。所述片剂可以任选地被涂覆或刻痕,并且可以被配制为使用例如不同比例的羟丙基甲基纤维素以提供活性成分的缓慢或控释以提供所需的释放曲线。片剂可以任选地具有包衣,例如薄膜、糖衣或肠溶衣,以在肠中除胃以外的部分中释放。用于制备片剂和胶囊的过程、设备和服务制造商在本领域中是众所周知的。
用于在口腔中局部施用的制剂包括:通常在调味基质(例如蔗糖、阿拉伯胶或黄芪胶)中含有活性成分的锭剂;以及在惰性基质(例如明胶和甘油或蔗糖和阿拉伯胶)中含有活性成分的糖果锭剂。
还可以将用于局部施用的药物组合物配制成软膏、霜剂、悬浮液、洗涤剂、粉末、溶液、糊剂、凝胶、喷雾、气溶胶或油剂。
替代地,制剂可以是用活性成分和任选地一种或多种赋形剂或稀释剂浸渍的贴剂(例如经皮贴剂)或敷料(如绷带)或胶布的形式。局部制剂可以另外地包括增强成分通过皮肤或其他受影响区域的吸收或渗透的化合物,仅举几例,例如二甲基亚砜没药醇、油酸、肉豆蔻酸异丙酯和D-柠檬烯。
对于乳剂,油相由已知成分以已知方式构成。尽管该相可以仅包含乳化剂(也称为粘合剂),但是期望其包含至少一种乳化剂与脂肪和/或油的混合物。优选地,包括亲水乳化剂和用作稳定剂的亲油性乳化剂。具有或不具有稳定剂的乳化剂共同组成了所谓的乳化蜡,蜡与油和/或脂肪一起组成了所谓的乳化软膏基质,形成乳膏制剂的油性分散相。示例性的乳化剂和乳化稳定剂包括Tween 60、Span 80、十八十六醇、肉豆蔻醇、单硬脂酸甘油酯和十二烷基硫酸钠。
用于直肠施用的制剂通常为栓剂形式,其具有包含例如可可脂或水杨酸盐的合适基质。
适合于阴道施用的制剂通常采用栓剂、棉塞、乳膏、凝胶、糊剂、泡沫或喷雾的形式。
其中载体是固体的适合于鼻内施用的制剂包括具有例如在约20至约500 μm范围内的颗粒尺寸的粗粉。这种制剂通常是通过鼻道快速吸入被施用,例如从保持在鼻子附近的粉末容器中吸入。替代地,用于鼻腔递送的制剂可以是液体的形式,例如鼻腔喷雾剂或滴鼻剂。
用于吸入的可雾化制剂可以是干粉形式(例如,适合通过干粉吸入器施用),或者替代地可以是液体形式,例如喷雾器中使用。用于递送雾化溶液的雾化器包括AERx®(Aradigm)、Ultravent® (Mallinkrodt)和Acorn II® (Marquest Medical Products)。本公开的组合物也可以使用加压的定量吸入器(MDI)(例如Ventolin®定量吸入器)递送,所述吸入器含有如本文所述的药物组合在药物惰性液体推进剂(例如氯氟烃或碳氟化合物)中的溶液或悬浮液。
适合于肠胃外施用的制剂包括适合于注射的水相和非水相等渗无菌溶液,以及水相和非水相无菌悬浮液。
本发明的肠胃外制剂任选地包含在单位剂量或多剂量密封的容器(例如安瓿瓶和小瓶)中,并且可以以仅需在使用前立即添加无菌液体载体(例如注射用水)的冷冻干燥(冻干)条件保存。临时注射溶液和悬浮液可以由前述类型的无菌粉末、颗粒和片剂制备。
本发明的制剂还可以是缓释制剂,使得与非持续释放制剂相比,每种药物组分随时间缓慢被释放或吸收。缓释制剂可以采用活性剂的前药形式,延迟释放的药物递送系统,例如脂质体或聚合物基质、水凝胶、或聚合物(如聚乙二醇)与活性剂的共价结合。
除了上面具体提到的成分外,本发明的制剂可以任选地包括药学领域中常规的其他试剂和所使用的制剂的具体类型,例如用于口服施用形式,用于口服施用的组合物还可以包括另外的试剂,如甜味剂、增稠剂或调味剂。
试剂盒
本文还提供了一种试剂盒,其包含至少一种本发明的组合物,以及使用说明。
例如,在每种药物本身以单独或分开的剂型形式施用的情况下,该试剂盒包含异丁司特或其药学上可接受的盐,以及使用说明。可以以适合于施用的任何方式包装异丁司特或其药学上可接受的盐,只要在与施用说明一起考虑包装时清楚地指出每种药物成分的施用方式即可。
例如,对于包含异丁司特或其药学上可接受的盐的说明性试剂盒,该试剂盒可以按任何合适的时间段(例如按天)进行组织。例如,对于第1天,代表性试剂盒可以包含异丁司特或其药学上可接受的盐的每一个的单位剂量。如果每种药物每天要施用两次,则该试剂盒可以包含与第1天相对应的异丁司特或其药学上可接受的盐的每一个的两行单位剂型,以及施用时间的说明。根据上述内容,各种实施方案可以被容易地预想,并且当然取决于除了异丁司特或其药学上可接受的盐外用于治疗的药物的具体组合、其相应的剂型、推荐的剂量、预期的患者人群等。该包装可以是通常用于药物包装的任何形式,并且可以利用许多特征中的任何一种,例如不同的颜色、包装、防篡改包装、罩板包装、干燥剂等。
应当理解,尽管已经结合优选的具体实方案描述了本发明,但是前述描述以及随后的实施例旨在说明而非限制本发明的范围。对于本发明所属领域的技术人员而言,本发明范围内的其他方面、优点和修改将是显而易见的。
本申请中提及的所有参考文献,包括任何专利、公开的专利申请、书籍、手册、期刊出版物或FDA橘皮书,其内容均通过引用整体并入本文。
给出以下实施例是为了说明本发明的各种实施方案,并不意味着以任何方式限制本公开。本领域的技术人员将容易理解,本发明非常适合于执行目的并获得所提及的结果和优点以及本文固有的目的、结果和优点。本实施例以及本文描述的方法目前是实施例的代表,并且是示例性的,并不意在限制本发明的范围。本领域技术人员将想到包含在由权利要求的范围所限定的本发明的精神内的其中的改变和其他用途。
实施例
实施例1
这是一项多中心、随机、双盲、安慰剂对照、平行组研究,设计来评估在患有原发性或继发性进行性多发性硬化症的对象中,在96周内每天两次给予异丁司特的安全性、耐受性和活性。
该研究的主要目标是:
•通过使用脑实质部分(BPF)通过定量磁共振成像(MRI)分析测量来评估在96周时异丁司特(100 mg/d)相对于安慰剂在全脑萎缩中的活性;
•评估在患有原发性和继发性进行性多发性硬化症的对象中,与口服安慰剂相比,异丁司特(100 mg/d)的安全性和耐受性;以及
•从异丁司特在进展期MS的SPRINT-MS II期临床试验中研究异丁司特对黄斑测量的影响。
主要的次要目标是通过以下方法测量来评估异丁司特在96周时相对于安慰剂的活性:
•下降的锥体白质区的弥散张量成像(DTI);
•正常出现的脑组织中的磁化传递比(MTR)成像;
•通过光学相干断层扫描(OCT)测量的视网膜神经纤维层;以及
•通过皮质纵向萎缩检测算法(CLADA)测量的皮质萎缩。
额外的次要结果是测量在96周时异丁司特相对于安慰剂的活性:
•炎性疾病活性,以T1病变量、T2病变量和年复发率衡量;
•残疾,以扩展残疾状态量表(EDSS)和多发性硬化症功能综合体(MSFC)衡量;
•认知障碍,以符号数字模态测试和选择性提醒测试衡量;
•生活质量,以多发性硬化症影响量表(MSIS-29)、EuroQol 5尺寸(EQ-5D)和简短的36型健康调查(SF-36)衡量;以及
•神经痛,以简短疼痛清单(BPI)衡量。
第三目标中的第一组是通过主要和次要成像结果测量来评估异丁司特在一年时与安慰剂相比的活性:使用脑实质部分(BPF)的全脑萎缩、下降的锥体白质区的弥散张量成像(DTI)、正常出现的脑组织中的磁化传递比(MTR)成像、通过光学相干断层扫描(OCT)测量的视网膜神经纤维层(RNFL)、以及通过皮质纵向萎缩检测算法(CLADA)测量的皮质萎缩。
第三目标中的第二组是通过全脑灰质分数、灰质中的磁化传递比(MTR)、自基线以来的新T1病变和自基线以来的新T2病变,测定与安慰剂相比异丁司特(MN-166)在96周时的活性。
探索性目标包括使用群体PK方法、脑脊液(CSF)和血清生物标志物与进行性残疾的影像学和临床测量的相关性、独特的2期终点的确定、以及复合MRI标尺(结合BPF、MTR和DTI),以评估异丁司特的药代动力学(PK)。
在第8、48和96周的计划访视期间,收集了用于分析异丁司特及其代谢物6,7-二氢二醇(DHD)的血样。病例报告表中记录了确切的采样时间和相对于先前剂量的时间。使用NONMEM程序(Icon Development Solution)进行的PK人口建模用于表征异丁司特在健康对象和MS对象中的药代动力学特性。群体分析评估了选定的协变量,以确定它们是否促成个体之间PK参数估计值的差异。协变量包括人口统计学变量(年龄、性别、体重和种族)、肌酐清除率(作为肾功能的标志)、肝酶水平(作为肝功能的标志)、血液化学变量和基线时相关疾病的协变量等等。此外,还评估了伴随药物对异丁司特的药代动力学的影响。
总共255名21岁至65岁的男性和女性对象被纳入两个治疗组之一(异丁司特100mg/d或匹配的安慰剂)。SPRINT-MS的研究人群是原发性(53%)和继发性进行性(47%)MS的混合人群,平均年龄56岁和基线时的中位扩展残疾状态量表(EDSS)= 6.0。通过疾病状态(PPMS或SPMS)以及通过免疫调节治疗状态(“未经治疗”、GA或干扰素-β)对对象进行随机分组。在参加这项研究的同时,允许对象继续使用干扰素-β(IFN-b)或醋酸格拉替雷。在研究期间,允许对象将药物从一种注射剂改变为另一种。也允许聚乙二醇化干扰素β-1(如果获得FDA批准)。允许吸入和局部使用类固醇。如果发生复发发作,则按照主治神经科医师的处方,允许单疗程的全身性皮质类固醇激素治疗。对象在第4、8、12、24、36、48、60、72、84和96周定期返回诊所进行随访。
在参加研究之前和研究期间禁止使用以下药物:
•筛查前3个月内进行全身性皮质类固醇治疗(允许吸入或局部使用类固醇);
o允许单疗程的全身性皮质类固醇激素治疗用于治疗临床复发
•目前使用间歇性全身性皮质类固醇(即每月一次或每两个月一次的静脉注射甲基强的松龙);
•筛选后6个月内口服免疫抑制剂(例如硫唑嘌呤、甲氨蝶呤、环孢菌素、特立氟胺[Aubagio®]);
•筛选后6个月使用内米托蒽醌或那他珠单抗;
•筛选后3个月内使用内芬戈莫德或富马酸二甲酯[Tecfidera®];
•筛选后12个月内使用利妥昔单抗或其他B细胞疗法;
•目前正在使用除了醋酸格拉替雷和干扰素-β(任何制剂)以外的其他MS疾病缓解疗法(DMT)。
在研究参与期间,禁止以下药物:西咪替丁(cimetidine),环孢素(cyclosporine),决奈达隆(dronedarone),洛匹那韦(lopinavir),丙磺舒(probenecid),奎尼丁(quinidine)(包括Neudexta),雷诺嗪(ranolazine),利福平(rifampin),利托那韦(ritonavir)和替普那韦(tipranavir)。
要参加该研究,对象必须根据2010年国际专家组标准对继发性进行性MS(SPMS)或原发性进行性MS(PPMS)进行确诊、根据Swanton的MRI标准对脑部MRI上典型的MS病变进行确诊、以及在过去2年中残疾发展的临床证据,如通过以下任何一种方法测量的:
•总体EDSS恶化至少0.5分(可以进行回顾性评估,但不能在临床复发期间),或
•25英尺步行(25-FW)时恶化20%,或
•任一只手的9孔钉测试(9-hole peg test,9-HPT)恶化了20%。
双盲治疗阶段包括基线访视,然后是预定的10次诊所访视。基准访视必须在筛选访视之后的45天内进行。在基线访问(第1天)时,将完成所有筛选评估并继续符合入选标准的对象以1:1的比例随机分配到两个治疗组(异丁司特100 mg/d或安慰剂)之一。
图1显示了研究设计。在基线访视(第1天)晚上,对象服用第一剂研究药物(30 mg异丁司特或安慰剂)。在第2天的早晨,所有对象开始3胶囊BID给药方案直至第14天。随机分配给异丁司特的对象在第2天以60 mg/d(30 mg BID)开始,并保持60 mg/d直至第14天。在第15天,所有对象的剂量增加至5胶囊BID方案;随机分配给异丁司特治疗组的患者服用100mg/d。
在第15天后,允许具有不可忍受的副作用(例如恶心、腹泻、眩晕)的对象将其剂量减至每天两次4粒胶囊(对于服用异丁司特的患者为80 mg/d)或每天两次3粒胶囊(对于服用异丁司特的患者为60 mg/d)。在研究人员的判断下,在第14天结束时,将出现无法忍受的副作用(例如恶心、腹泻、眩晕)的对象继续每天两次服用3粒胶囊。根据研究者的判断,在治疗的前8周内,异丁司特的每日剂量可能在每天两次3粒胶囊、每天两次4粒胶囊和每天两次5粒胶囊之间进行调整。根据研究者的判断,如果需要提高耐受性,可以将异丁司特的每日剂量进行划分,并每天服用三次。在治疗的前8周结束时,对象必须维持其当时的每日研究药物剂量(每天6粒胶囊、每天8粒胶囊、或每天10粒胶囊)。根据研究者的判断,剂量间隔为每天两次或每天3次。在整个研究过程中,根据研究者的判断,剂量间隔也可以设置为每天两次至三次。
对象在第4、8、12、24、36、48、60、72、84和96周定期返回诊所进行随访。出现症状提示可能复发的对象在通知研究者三天之内返回诊所,并进行适当的评估。要求提前中止研究药物的对象每半年继续服用后续研究药物,直到研究结束(第96周)。
选择数据在Fox
患者在基线时和每24周使用Cirrus(n=183)或Spectralis(n=6l)光谱域设备进行光学相干断层扫描(OCT)。由两个独立的认证阅读器在中央阅读中心进行黄斑体积(macular volume)和颗粒细胞/内部丛状层(GCIP)厚度(仅Cirrus),并将测量结果取平均值以得出最终结果。使用线性混合模型评估影像学终点的试验组之间随时间的变化率差异。根据修改后的治疗意向(ITT)进行分析,并在统计分析中包括所有可用值。
表2给出了基线时的黄斑测量。主要OCT结果(所有患者中pRNFL随时间变化的治疗组之间的差异)显示,异丁司特引起每年估计减少0.305 μM(95%Cl:-0.1786至0.7893)pRNFL损失。安慰剂组的每年pRNFL损失率估计为-0.2630 μM(95%Cl:-0.5973至0.0714),相比之下异丁司特组为0.0424 μM(95%Cl:-0.3091至0.3939)。在使用Spectralis OCT的患者中,异丁司特的黄斑体积变化率估计为每年-0.00503 mm
与安慰剂相比,使用异丁司特在96周内使用Spectralis OCT得到的年黄斑体积损失较慢。Cirrus OCT表现出有利的变化,可减少黄斑体积损失和GCIP层变薄。
表1. 患者群体
表2. 基线的黄斑测量
等效物
应当理解,尽管通过某些实施方案和任选的特征已经具体公开了本发明,但是本领域技术人员可以采用本文所公开的实施方案的修改、改进和变化,并且这种修改、改进和变化被认为在本发明的范围内。在此提供的材料、方法和实施例是一些实施方案的代表,是示例性的,并且不旨在作为对本公开的范围的限制。
本文广泛地和一般地描述了本发明。落入一般性描述之内的较窄的种类和亚属分组中的每一个也都形成本发明的一部分。这包括了具有从该属中移除任何主题的附带条件或负面限制的本发明的一般性描述,无论被删除的材料是否在本文中被具体描述。
此外,在以马库什组描述本发明的特征或方面的情况中,本领域技术人员将认识到,还借此以该马库什组中的任何单独成员或成员的亚组描述了本发明。
除非明确指出涉及仅替代方案或替代方案是互相排斥的,否则在权利要求中使用术语“或”来表示“和/或”,尽管本发明支持涉及仅替代方案和“和/或”的定义。
段落A. 一种在有需要的人类患者中治疗与神经退行性疾病/病症或神经眼科病症相关的眼科疾病/病症或损伤的方法,该方法包括向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。
段落B. 根据段落A所述的方法,其中所述眼科疾病/病症或损伤是黄斑损伤。
段落C. 根据段落A或段落B所述的方法,其中所述神经退行性疾病/病症是进行性多发性硬化症。
段落D. 一种在有需要的人类患者中减少与进行性多发性硬化症相关的黄斑体积损失的方法,该方法包括向所述人类患者施用治疗有效量的异丁司特或其药学上可接受的盐。
段落E. 根据段落D所述的方法,其中与不施用异丁司特或其药学上可接受的盐相比,所述异丁司特或其药学上可接受的盐的施用减少了人类患者的黄斑体积损失。
段落F. 根据段落C-E中任一项所述的方法,其中所述进行性多发性硬化症已经进展到超过复发缓解型多发性硬化症。
段落G. 根据段落C-E中任一项所述的方法,其中所述进行性多发性硬化症是原发性进行性多发性硬化症。
段落H. 根据段落G所述的方法,其中所述原发性进行性多发性硬化症的特征在于从发病开始的疾病进展,允许偶然的平台期和暂时的轻微改善,但没有明显的复发。
段落I. 根据段落C-E中任一项所述的方法,其中所述进行性多发性硬化症是继发性进行性多发性硬化症。
段落J. 根据段落I所述的方法,其中所述继发性进行性多发性硬化症的特征在于初始的复发-缓解过程,继之以进展,伴有或不伴有偶然复发、轻微缓解和平台期。
段落K. 根据段落A-J中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐施用至少约12、24、36、48、60、72、84或96周。
段落L. 根据段落A-J中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐施用至少约1年、2年、3年、4年或5年。
段落M. 根据段落A-J中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐施用1年、2年、3年、4年或5年。
段落N. 根据段落A-M中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐被口服施用。
段落O. 根据段落N所述的方法,其中所述异丁司特或其药学上可接受的盐以片剂、胶囊剂、颗粒剂或微珠剂型施用。
段落P. 根据段落N所述的方法,其中所述异丁司特或其药学上可接受的盐以液体剂型施用。
段落Q. 根据段落A-P中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐被配制为缓释制剂。
段落R. 根据段落A-Q中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以约0.1 mg/天至约4,000 mg/天的量施用。
段落S. 根据段落A-R中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以约0.1 mg/天至约720 mg /天的量施用。
段落T. 根据段落A-Q中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以至少约30 mg/天的量施用。
段落U. 根据段落A-Q中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以约30 mg/天至约200 mg/天的量施用。
段落V. 根据段落A-Q中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以约60 mg/天至约600 mg/天的量施用。
段落W. 根据段落A-Q中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以约60 mg/天至约100 mg/天的量施用。
段落X. 根据段落A-Q中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以约100 mg/天至约480 mg/天的量施用。
段落Y. 根据段落A-Q中任一项所述的方法,其中所述异丁司特或其药学上可接受的盐以约30 mg/天、约60 mg/天、约80 mg/天、约90 mg/天、约100 mg/天、约120 mg/天、约150 mg/天、约180 mg/天、约210 mg/天、约240 mg/天、约270 mg/天、约300 mg/天、约360mg/天、约400 mg/天、约440 mg/天、约480 mg/天、约520 mg/天、约580 mg/天、约600 mg/天、约620 mg/天、约640 mg/天、约680 mg/天、或约720 mg/天的量施用。
段落Z. 根据段落Y所述的方法,其中所述异丁司特或其药学上可接受的盐以约60mg/天、约80 mg/天、或约100 mg/天的量施用。
段落AA. 根据段落R-Z所述的方法,其中每天施用的异丁司特或药学上可接受的盐的量分为一、二或三个部分。
