一种评估致病力强度的报告体系
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于微生物技术领域,具体涉及一种评估致病力强度的报告体系。
背景技术
我国集约化农业发展迅速,随之而来的土传病害问题日益凸显,土壤环境和农作物安全受到巨大威胁
发明内容
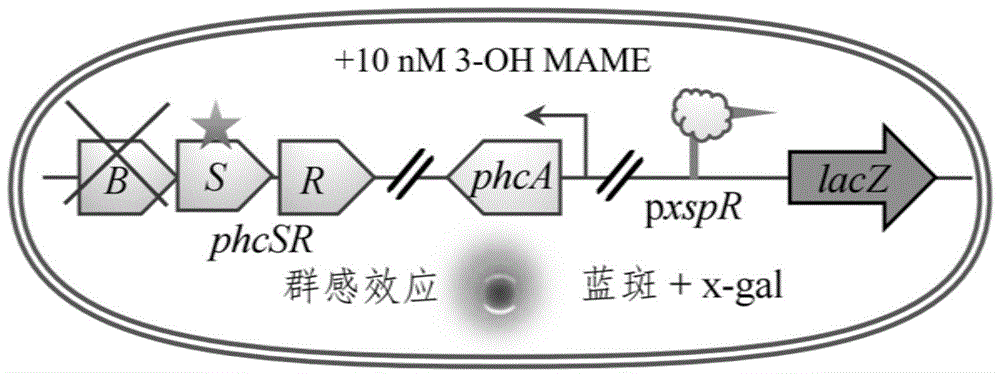
针对现有技术的不足,本发明目的在于提供一种评估致病力强度的报告体系,直观的评估青枯菌群体感应系统表达情况以及青枯菌的致病力强弱。申请人研究发现,PhcBSR群体感应系统可对青枯菌毒力行为进行全局性调控,通过观察3-OH PAME/MAME对群体感应系统表达的影响可直观的了解青枯菌致病力强弱。
一种评估致病力强度的报告体系,通过如下步骤构建:首先利用青枯菌自身修复能力构建青枯菌OE1-1的ΔphcB突变体(OE1-1-dphcB),将phcA的直接转录靶点xpsR(同时也是胞外多糖基因表达的启动子)的启动子区域与编码β-半乳糖苷酶的大肠杆菌报告基因lacZ分别连接到pUC18-mini-Tn7T-Gm质粒上,通过电激转入OE1-1-dphcB后,利用PCR反应筛选构建成功的菌株,即为报告菌株。
将报告菌株与待测菌株共培养进行β-半乳糖苷酶活实验,检测xpsR表达情况;xpsR表达情况与lacZ表达呈正相关关系,待测青枯菌株致病力越强,则β-半乳糖苷酶活性越强,生化实验反应液显色越明显。
在具体的实施方案中,所述评估致病力强度的报告体系通过如下步骤构建:
步骤1,青枯菌OE1-1的ΔphcB突变体构建:PCR反应扩增出phcB左右各500bp的序列并融合,连接至PBLUESCRIPT II KS+质粒载体上,通过HindIII和BamHI双酶切获得所需片段后连接至pK18-Km质粒载体,得到连接正确的载体后转入E.coliS17-1菌株中,通过接合转移的方式将连接正确的pK18-Km质粒转入青枯菌中,筛选出ΔphcB突变株;
步骤2,pUC18-Tn7-xpsR-lacZ-Gm质粒的构建:PCR反应扩增出phcA的直接转录靶点xpsR的启动子区域并连接至PBLUESCRIPT II KS+质粒载体上,通过HindIII和BamHI双酶切获得所需片段后连接至pUC18-mini-Tn7T-Gm质粒载体,随后对该载体和含有编码β-半乳糖苷酶的报告基因lacZ的质粒lacZYA分别进行KpnI单酶切,将lacZYA酶切产物与KpnI单酶切的pUC18-mini-Tn7T-Gm质粒载体相连,构建pUC18-Tn7-xpsR-lacZ-Gm质粒;
步骤3,xpsR-lacZ报告体系的构建:利用构建成功pUC18-Tn7-xpsR-lacZ-Gm质粒,通过含有转座酶pTNS2辅助质粒,利用电激法,将目的片段xpsR-lacZ定点插入在步骤1的ΔphcB突变株的glmS基因下游的attTn7位点,利用含有25μg/mL庆大霉素的BG培养基筛选OE1-1-dphcB-xpsR-lacZ菌株。
通过将报告菌株与待测青枯菌共培养,进行β-半乳糖苷酶活实验来直观的了解待测青枯菌群体感应表达情况以及病原菌致病力强弱。
在具体的实施方案中,报告体系所用土传植物致病菌株为OE1-1,分类命名为茄科雷尔氏菌(Ralstonia solanacearum)。
在具体的实施方案中,所述步骤1中,phcB基因的左侧臂引物如下:phcB-A-F:CGATGACCATGACGTCAGAG;
phcB-A-R:CGATCATGGTGCGTGCGCTCGGTGCGAATTTGCCGGAGAC。
在具体的实施方案中,所述步骤1中,phcB基因的右侧臂引物如下:phcB-B-F:GTCTCCGGCAAATTCGCACCGAGCGCACGCACCATGATCG;
phcB-B-R:TGAACAGCGAGTGCACGATG。
在具体的实施方案中,所述步骤2中,xpsR基因引物如下:
xpsR-F:CGCGAGGTACCGGGCCCAAG;
xpsR-R:TTCGGTAATTTCCCTCCGGA。
在具体的实施方案中,BG固体培养基为:B液体培养基加2~3%(w/w)琼脂和5g/L葡萄糖,115℃高压灭菌30min。
在具体的实施方案中,B液体培养基为:酪蛋白氨基酸1g、蛋白胨10g、酵母粉1g、去离子水1000mL,调节pH 7.2~7.4,121℃高压灭菌20min。
本发明还保护前文所述的报告体系在青枯菌株致病力强弱测定中的应用。
在具体的实施方案中,将报告菌株与待测菌株共培养进行β-半乳糖苷酶活实验,检测xpsR表达情况;xpsR表达情况与lacZ表达呈正相关关系,待测青枯菌株致病力越强,则β-半乳糖苷酶活性越强,生化实验反应液显色越明显。
有益效果
本发明提供了一种评估致病力强度的报告体系,可通过xpsR-lacZ报告体系直观的评估青枯菌群体感应系统的表达情况;本发明可通过xpsR-lacZ报告体系评估青枯菌致病力强弱。
附图说明
图1OE1-1-dphcB-xpsR-lacZ示意图;
图2培养皿显色反应;
图3β-半乳糖苷酶活性实验反应液示意图;
图4为β-半乳糖苷酶活与菌株OD值的对应关系。
具体实施方式
下面结合具体实施方式对本发明的技术方案作进一步的说明。所用试剂或者仪器设备未注明生产厂商的,均视为可以通过市场购买的常规产品。
一种评估致病力强度的报告体系,通过如下步骤构建:首先利用青枯菌自身修复能力构建青枯菌OE1-1的ΔphcB突变体(OE1-1-dphcB),将phcA的直接转录靶点xpsR(同时也是胞外多糖基因表达的启动子)的启动子区域与编码β-半乳糖苷酶的大肠杆菌报告基因lacZ分别连接到pUC18-mini-Tn7T-Gm质粒上,通过电激转入OE1-1-dphcB后,利用PCR反应筛选构建成功的菌株OE1-1-dphcB-xpsR-lacZ,即为报告菌株。将报告菌株与待测菌株共培养进行β-半乳糖苷酶活实验,检测xpsR表达情况;xpsR表达情况与lacZ表达呈正相关关系,待测青枯菌株致病力越强,则β-半乳糖苷酶活性越强,生化实验反应液显色越明显。
材料与方法
1.青枯菌β-半乳糖苷酶活性测定
B液体培养基:酪蛋白氨基酸1g、蛋白胨10g、酵母粉1g、去离子水1000mL,调节pH7.2~7.4,121℃高压灭菌20min。
BG固体培养基为B液体培养基加2~3%(w/w)琼脂和5g/L葡萄糖,115℃高压灭菌30min。
菌株:OE1-1dphcB-xpsR-lacZ,其他待测青枯菌,分类命名为茄科雷尔氏菌(Ralstonia solanacearum)。其中,OE1-1-dphcB-xpsR-lacZ需在25μg/mL庆大霉素的BG培养基中生长,其余青枯菌在正常BG培养基上培养。
试剂及配方:
Z-buffer、A-medium、β-巯基乙醇、氯仿、0.1%SDS、1mol/L碳酸钠。
表1Z-buffer及A medium配方
β-半乳糖苷酶活性测定方法参照Yoshimochi等
(1)β-巯基乙醇、Z-buffer按1/200(v/v)配制后吸取800μL加入到玻璃小试管中:
(2)再吸取200μL待测菌液,每处理6个重复;
(3)分别加入20μL氯仿和10μL 0.1%SDS,涡旋振荡仪充分混匀,放入28℃恒温水浴锅中:(4)各玻璃小试管中加入200μL A-medium(4mg/mL的ONPG),计时t
(5)当试管中溶液呈微黄色时,加入500μL 1mol/L碳酸钠终止反应,计时t
(6)在波长600nm下测定原始菌液OD
(7)根据公式计算体外β-半乳糖苷酶活性
式中T为变黄所需时间,即T=t
2.胞外多糖含量测定
试验材料
MM培养基:3.38g L-谷氨酸钠,0.5g(NH
菌株:实验室前期保存的青枯菌。
胞外多糖含量测定方法具体如下:
(1)活化菌株后挑取单菌落于液体培养基中过夜摇培,吸取5μL菌液滴加至MM固体培养基上,于30℃培养基培养2d。
(2)将菌落转移至含有1mL无菌水的2mL离心管中,充分混匀后吸取200μL菌液于96孔板中,测定菌液OD
(3)将含有剩余菌液的离心管置于40℃摇床中,170转30min,充分溶解胞外多糖。
(4)将含菌离心管12,000g离心10min。
(5)吸取500μL上清液加入至含1mL冰乙醇的新的2mL离心管中,于4℃过夜保存,充分析出胞外多糖。
(6)将上步骤中的离心管12,000g离心10min,弃上清,沉淀物即为胞外多糖。
(7)向离心管中加入2mL无菌水,重悬胞外多糖。
(8)将1mL胞外多糖悬液,1mL的5%苯酚溶液,5mL纯硫酸加入到10mL离心管中混匀,等待20-30min之后测定溶液OD
实施例1评估致病力强度的报告体系的构建
步骤1,青枯菌OE1-1的ΔphcB突变体构建:PCR反应扩增出phcB左右各500bp的序列并融合,连接至PBLUESCRIPT II KS+质粒载体上,通过HindIII和BamHI双酶切获得所需片段后连接至pK18-Km质粒载体,得到连接正确的载体后转入E.coliS17-1菌株中,通过接合转移的方式将连接正确的pK18-Km质粒转入青枯菌OE1-1中,筛选出ΔphcB突变株;
步骤2,pUC18-Tn7-xpsR-lacZ-Gm质粒的构建:PCR反应扩增出phcA的直接转录靶点xpsR的启动子区域并连接至PBLUESCRIPT II KS+质粒载体上,通过HindIII和BamHI双酶切获得所需片段后连接至pUC18-mini-Tn7T-Gm质粒载体,随后对该载体和含有编码β-半乳糖苷酶的报告基因lacZ的质粒lacZYA分别进行KpnI单酶切,将lacZYA酶切产物与KpnI单酶切的pUC18-mini-Tn7T-Gm质粒载体相连,构建pUC18-Tn7-xpsR-lacZ-Gm质粒;
步骤3,xpsR-lacZ报告体系的构建:利用步骤2构建成功pUC18-Tn7-xpsR-lacZ-Gm质粒,通过含有转座酶pTNS2辅助质粒,利用电激法,将目的片段xpsR-lacZ定点插入在步骤1的ΔphcB突变株的glmS基因下游的attTn7位点,利用含有25μg/mL庆大霉素的BG培养基筛选OE1-1-dphcB-xpsR-lacZ菌株,其中报告体系构建所用引物如表2所示。
表2报告体系构建所用引物
A:phcB基因左侧臂;B:phcB基因右侧臂;phcB-A-F左侧臂正向引物;phcB-A-R:左侧臂反向引物;phcB-B-F:右侧臂正向引物;phcB-B-R:右侧臂反向引物。
实施例2培养皿显色反应
材料:青枯菌OE1-1-dphcB-xpsR-lacZ,BG固体培养基,B液体培养液;信号分子3-OH MAME;
试剂:40mg/mL的x-gal、25mg/mL的庆大霉素。
将甘油保存的OE1-1-dphcB-xpsR-lacZ在含有25μg/mL庆大霉素的BG固体培养基上划线,30℃培养2d;用接种环挑取单菌落于2mL B培养液中,30℃、170rpm过夜培养,将菌液稀释10倍,保存备用。准备BG固体培养基与9cm直径的圆形二分隔培养皿,其中一个隔室内倒入含有x-gal(终浓度40μg/mL)与庆大霉素(终浓度25μg/mL)的BG固体培养基,另一半倒入纯BG固体培养基。按照菌株的抗性分别向培养皿的两个隔室中添加10μL稀释过的菌液,用10μLddH
由图2可知,构建完成的报告体系OE1-1-dphcB-xpsR-lacZ接触到3-OH MAME(10nM)后,可产生颜色反应,报告体系构建完成。
实施例3报告体系在评估青枯菌致病力强弱中的应用
申请人接种培养了百株致病性青枯菌,对致病性青枯菌的胞外多糖含量及β-半乳糖苷酶活性测定进行了测定,结果如图3所示,β-半乳糖苷酶活性与胞外多糖含量呈现正相关的关系。
将本发明实施例1构建的报告体系OE1-1-dphcB-xpsR-lacZ与OE1-1共培养后进行测定,发现OE1-1-dphcB-xpsR-lacZ、OE1-1共培养的体系显色明显,如图4所示。
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
参考文献
[1]韦中,沈宗专,杨天杰,王孝芳,李荣,徐阳春,沈其荣.从抑病土壤到根际免疫:概念提出与发展思考[J].土壤学报,2021,58(04):814-824.
[2]S.Mukherjee,B.L.Bassler.Bacterial quorum sensing in complex anddynamically changing environments.[J].Nature Review Microbiology,17(2019),pp.371-382,
[3]Genin S,Denny TP.Pathogenomics of the Ralstonia solanacearumspecies complex[J].Annual Review of Phytopathology.2012;50:67–89.
[4]Schell,M.A.To be or not to be:how Pseudomonas solanacearum decideswhether or not to express virulence genes.[J].European Journal of PlantPathology,(1996)102:459–469.
[5]Yoshimochi,T.,Zhang,Y.,Kiba,A.,Hikichi,Y.&Ohnishi,K.Expression ofhrpG and activation of response regulator HrpG are controlled by distinctsignal cascades in Ralstonia solanacearum[J].Journal of General PlantPathology,(2009b)75,196–204.
